Quiz: TOP 150 câu trắc nghiệm Este Lipit có lời giải chi tiết (Cơ bản - phần 4)
Câu hỏi trắc nghiệm
nX = 0,2 mol; nNaOH = 1.0,3 = 0,3 mol → nNaOH dư = 0,3 – 0,2 = 0,1 mol.
→ mchất rắn sau phản ứng = mmuối + mNaOH dư → mmuối = 23,2 – 0,1.40 = 19,2 gam
→ Mmuối = 96 → Muối là C2H5COONa → X: C2H5COOCH=CH2
→ Đáp án C
nglixerol = 0,5 mol → nX = 0,5 mol → MX = 888
X: C3H5(OCOR)3 → MR = 238,33
→ Hai loại axit béo đó là: C17H33COOH và C17H35COOH
→ Đáp án C
nkhí = 0,2 mol → MX = 136
Xà phòng hóa X bằng dung dịch NaOH (vừa đủ) thu được hỗn hợp hai muối của natri
→ X có dạng RCOOC6H5
Mà MX = 136 → MR + 121 = 136 → MR = 15 → R là CH3
→ Công thức cấu tạo thu gọn của este X là CH3COOC6H5
→ Đáp án A
Etyl axetat: CH3COOC2H5, metyl propionat: CH3CH2COOCH3
→ Etyl axetat và metyl propionat có cùng công thức phân tử là C4H8O2
→ neste = 0,2 mol
Gọi công thức chung của hỗn hợp este là RCOOR’
RCOOR’ + NaOH -to→ RCOONa + R’OH
→ nNaOH = neste = 0,2 mol → 0,5.V.10-3 = 0,2 → V = 400ml.
→ Đáp án A
![]() = 0,1 mol;
= 0,1 mol;
nNaOH = 0,2. 0,2 = 0,04 mol
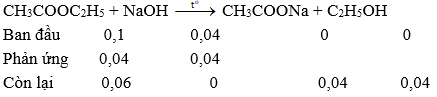
→ Chất rắn thu được sau khi cô cạn là CH3COONa
→ ![]() = 0,04.82 = 3,28 gam
= 0,04.82 = 3,28 gam
→ Đáp án A
nNaOH = 2.0,15 = 0,3 mol → neste = 0,3 mol
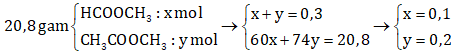
→ Khối lượng metyl fomat trong hỗn hợp là: ![]() = 0,1.60 = 6 g.
= 0,1.60 = 6 g.
→ Đáp án C
mdung dịch NaOH = D.V = 1,08. 25,93 = 28 gam
→ nNaOH = 28. 10% = 2,8 gam → nNaOH = 0,07 → neste = nNaOH = 0,07 mol
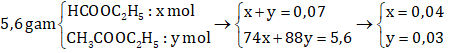
→ Thành phần % khối lượng của etyl axetat trong hỗn hợp là:
%![]() = 47,14%
= 47,14%
→ Đáp án A
![]() = 13,6/136 = 0,1 mol
= 13,6/136 = 0,1 mol
nNaOH = 1,5. 0,2 = 0,3 mol
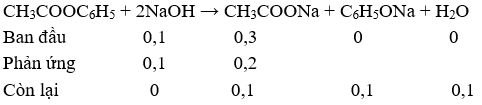
→ Chất rắn khan sau khi cô cạn dung dịch X là: NaOH dư (0,1 mol); CH3COONa (0,1 mol); C6H5ONa (0,1 mol)
→ a = mNaOH(dư) + ![]() +
+ ![]() = 0,1.40 + 0,1.82 + 0,1.116 = 23,8 gam
= 0,1.40 + 0,1.82 + 0,1.116 = 23,8 gam
→ Đáp án D
X là este của axit cacboxylic no, đơn chức, mạch hở và ancol no, đơn chức, mạch hở
→ X là este, no đơn chức, mạch hở có công thức phân tử là CnH2nO2
→ neste = nNaOH = 1.0,1 = 0,1 mol → Meste = 6/0,1 = 60 → 14n + 32 = 60 → n = 2
→ Công thức phân tử của X là C2H4O2 → este X là HCOOCH3: metyl fomat
→ Đáp án D
Gọi công thức chung của este là RCOOR’ (R’ là gốc hiđrocacbon)
Ta có: RCOOR’ + NaOH → RCOONa + R’OH
Khi thủy phân este mà mmuối > meste, vậy gốc R’ là CH3 → loại đáp án C và D
Theo phương pháp tăng giảm khối lượng:
1 mol este phản ứng → khối lượng muối tăng so với khối lượng este: 23 - 15 = 8 gam
Khối lượng tăng thực tế là: 4,76 – 4,2 = 0,56 gam
→ ![]() = nRCOONa = 0,07 mol → MRCOONa = 68 gam
= nRCOONa = 0,07 mol → MRCOONa = 68 gam
→ RCOONa là HCOONa
→ Công thức cấu tạo của E là HCOOCH3
→ Đáp án B
Ta có: RCOOR’ + NaOH → RCOONa + R’OH
Meste = 5,5.16 = 88 → neste = 2,2/88 = 0,025 mol
→ neste = nmuối = 0,025 mol → Mmuối = 82 gam
→ R là CH3 → X là CH3COOR’ → → MR’ = 29 → R’ là C2H5
→ Công thức cấu tạo thu gọn của X là CH3COOC2H5
→ Đáp án C
Ta có: RCOOR’ + NaOH → RCOONa + R’OH
Meste = 5,5.16 = 88 → neste = 0,025 mol
→ neste = nmuối = 0,025 mol → Mmuối = MRCOONa = 82 gam
→ R là CH3 → X là CH3COOR’ → ![]() → MR’ = 29 → R’ là C2H5
→ MR’ = 29 → R’ là C2H5
→ Công thức cấu tạo thu gọn của X là CH3COOC2H5
→ Đáp án B
Ta có: ![]() = 0, 2 (mol);
= 0, 2 (mol); ![]() = 0,2 (mol)
= 0,2 (mol)
0,1 mol este khi cháy tạo ra 0,2 mol CO2 và 0,2mol H2O nên este là C2H4O2.
→ Đáp án D
Gọi công thức tổng quát của este no đơn chức có dạng CnH2nO2.
Mà ![]() = 5,5 → MX = 5,5.16 = 88
= 5,5 → MX = 5,5.16 = 88
→ 14n + 32 = 88 → n = 4 → Công thức phân tử của X là C4H8O2.
nX = 2,2/88 = 0,025 mol
Phản ứng: RCOOR’ (0,025 mol) + NaOH → RCOONa (0,025 mol) + R’OH
Theo đề bài, ta có: 0,025(R + 67) = 2,05 → R = 15 : CH3–
Vậy công thức cấu tạo là CH3COOCH2CH3
→ Đáp án C
Gọi công thức phân tử của este no, đơn chức, mạch hở CnH2nO2 (n ≥ 2)
Phản ứng đốt cháy:
![]()
→ Sản phẩm cháy thu được có: ![]() =
= ![]()
→ Đáp án A
X là este của glixerol với các axit béo: axit oleic (C17H33COOH), axit panmitic (C15H31COOH) và axit stearic (C17H35COOH)
→ Công thức phân tử của X là: C55H104O6
PTHH: C55H104O6 + 78O2 → 55CO2 + 52H2O
![]() = 0,01. 78 = 0,78
= 0,01. 78 = 0,78
→ ![]() = 0,78.22,4 = 17,4721
= 0,78.22,4 = 17,4721
→ Đáp án C
Số mol C có trong 1 mol este A: nC(1 mol A) = ![]() = 2 mol
= 2 mol
→ este A là HCOOCH3 (metyl fomat) là este no, đơn chức, mạch hở → Loại đáp án B, C, D
→ Đáp án A
E là este no, đơn chức, mạch hở khi đốt cháy cho: = = 0,3 mol
Bảo toàn nguyên tố oxi ta có: nO(E) = ![]() = 2 +
= 2 +
→ nO(E) + 2. 0,35 = 2.0,3 + 0,3 → nO(E) = 0,2
→ nC : nH : nO = 0,3 : (2.0,3) : 0,2 = 3:6:2
→ E có dạng (C3H6O2)n
Vì E là este đơn chức → n = 1 → Công thức phân tử của este E là C3H6O2
→ Đáp án C
= 0,12 mol; = 0,09 mol
Theo định luật bảo toàn khối lượng ta có:
mO(este) = 2,58 – mC – mH = 2,58 – 0,12.12 – 0,09.2 = 0,96 g
→ nO(este) = 0,96/16 = 0,06 mol → nC : nH : nO = 0,12 : (0,09.2) : 0,06 = 2:3:1
→ este có dạng (C2H3O)n
Vì este đơn chức → n = 2 → Công thức phân tử của este đó là C4H6O2
→ Đáp án B
Y no, đơn chức, mạch hở nên ta có sơ đồ phản ứng:
CnH2nO2 →
14n+32 18n
6 3,6
![]()
→ Công thức phân tử của Y là C2H4O2
→ Công thức cấu tạo của Y là HCOOCH3
→ Đáp án B
Tỉ lệ về thể tích (cùng điều kiện nhiệt độ, áp suất) chính là tỉ lệ về số mol
→ Đốt cháy este X thu được số mol khí CO2 bằng số mol khí O2 cần dùng cho phản ứng
Este X no, đơn chức mạch hở (CnH2nO2) có phản ứng đốt cháy:
![]()
→ ![]() =
= ![]() → n = (3n-2)/2 → n = 2 → Công thức phân tử của X là C2H4O2
→ n = (3n-2)/2 → n = 2 → Công thức phân tử của X là C2H4O2
→ Công thức cấu tạo của este X là HCOOCH3
→ Đáp án A
Este no, đơn chức, mạch hở có công thức phân tử là CnH2nO2 khi đốt cháy hoàn toàn cho:
Khối lượng bình tăng là tổng khối lượng của H2O và CO2
→![]() +
+ ![]() = 6,2 → 44x + 18x = 6,2 → x = 0,1 mol
= 6,2 → 44x + 18x = 6,2 → x = 0,1 mol
CO2 + Ca(OH)2 → CaCO3↓ + H2O
→ ![]() =
= ![]() = 0,1 mol →
= 0,1 mol → ![]() = 0,1.100 = 10 gam
= 0,1.100 = 10 gam
→ Có 0,1 mol H2O sinh ra và 10 gam kết tủa tạo thành
→ Đáp án B
E no, đơn chức, mạch hở nên ta có sơ đồ phản ứng:
CnH2nO2 → ![]()
14n+32 18n
7,4 5,4
![]()
→ Công thức phân tử của E là C3H6O2
E có phản ứng tráng gương với dung dịch AgNO3/NH3 → E là este của axit fomic
→ Công thức cấu tạo của E là HCOOC2H5
→ Đáp án C
![]() = 0,22/44 = 0,005 mol;
= 0,22/44 = 0,005 mol;
![]() = 0,09/18 = 0,005 mol;
= 0,09/18 = 0,005 mol;
→ ![]() =
= ![]() → este X no, đơn chức, mạch hở
→ este X no, đơn chức, mạch hở
Gọi công thức phân tử X là CnH2nO2 ta có sơ đồ:
CnH2nO2 → ![]()
14n+32 18n
0,11 0,09
→ Công thức phân tử của E là C4H8O2
→ Các đồng phân este của X là
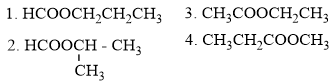
→ Có 4 đồng phân
→ Đáp án D
![]() = 1,8/18 = 0,1 mol;
= 1,8/18 = 0,1 mol;
![]() = 4,4/44 = 0,1 mol;
= 4,4/44 = 0,1 mol;
Bảo toàn khối lượng ta có:
3 = mC + mH + mO → 3 = 0,1.12 + 0,1.2 + mO → mO = 1,6g
→ nO = 1,6/16 = 0,1 mol
→ nC : nH : nO = 0,1: (0,1.2) : 0,1 = 1: 2: 1
→ Công thức đơn giản nhất của A là CH2O
→ Đáp án A
Nếu A là este đơn chức → Công thức phân tử của A là C2H4O2
→ Đồng phân este duy nhất của A là HCOOCH3
→ Đáp án A
![]() = 22,4/22,4 = 1 mol;
= 22,4/22,4 = 1 mol;
![]() = 9/18 = 0,5 mol;
= 9/18 = 0,5 mol;
Este X tạo bởi ancol no, đơn chức, mạch hở và axit cacboxylic không no (có 1 liên kết đôi C = C) đơn chức, mạch hở → Gọi công thức tổng quát của X là CnH2n-2O2
Ta có: ![]()
→ ![]() =
= ![]() -
- ![]() = 1 - 0,5 = 0,5 mol
= 1 - 0,5 = 0,5 mol
→ Đáp án D
Đốt hoàn toàn m gam este đơn chức, no, mạch hở X → ![]() =
= ![]()
![]() →
→ ![]() =
= ![]() = 0,5 mol
= 0,5 mol
BTKL: mO(X) = mX – mC - mH = 15 – 0,5.12 – 0,5.2 = 8 → nO(X) = 0,5 mol
→ nC : nH : nO = 0,5 : 1 : 0,5 = 1: 2:1
X là este đơn chức → X có CTPT là C2H4O2
→ Đáp án A
Gọi CTPT của este là Y CnH2nO2
Ta có: ![]()
![]() =
= ![]() → n = 3
→ n = 3
→ Y là metyl axetat
→ Đáp án B
Tỉ lệ về thể tích (đo ở cùng điều kiện) cũng chính là tỉ lệ về số mol
→ Vậy đốt cháy hoàn toàn 1 mol este đơn chức E phải dùng 2 mol O2
Gọi công thức phân tử của E là CxHyO2 (x ≥ 2) (1)
Ta có: ![]()
→ Bảo toàn nguyên tố O: ![]() +
+ ![]() =
= ![]() +
+ ![]()
→ 2.1 + 2.2 = 2x + y/2 → 4x + y = 12 → 4x ≤ 12 → x ≤ 3 (2)
Từ (1) và (2) ![]()
→ Công thức phân tử của E là C2H4O2
→ E là HCOOCH3 (metyl fomat) là este no, đơn chức, mạch hở → Loại đáp án A, B, D
→ Đáp án C