Quiz: TOP 80 câu trắc nghiệm Đại cương về kim loại có lời giải chi tiết (Cơ bản - phần 1)
Câu hỏi trắc nghiệm
Kim loại nhóm IIA có hóa trị II → Công thức chung của oxit kim loại thuộc nhóm IIA là RO.
→ Đáp án D
Nguyên tử Fe có Z = 26 → Cấu hình e của Fe là 1s22s22p63s23p63d64s2 hay [Ar]3d64s2.
→ Đáp án A
Nguyên tử Cr có Z = 24 (Có cấu hình bán bão hòa) → Cấu hình e của Cr là 1s22s22p63s23p63d54s1 hay [Ar]3d54s1.
→ Đáp án C
Kim loại hoạt động có thể khử được ion kim loại kém hoạt động hơn trong dung dịch muối thành kim loại tự do.
Ni đứng trước Ag, Cu, Pb trong dãy điện hóa → Ni có thể khử được các ion kim loại trên.
Ni + 2AgNO3 → Ni(NO3)2 + 2Ag
Ni + CuSO4 → NiSO4 + Cu
Ni + Pb(NO3)2 → Ni(NO3)2 + Pb.
→ Đáp án D
Không kim loại nào vì cả 3 kim loại đều đứng sau Mg trong dãy điện hóa → Cả 3 kim loại đều không khử được ion Mg2+ trong muối.
→ Đáp án D
CO khử được các oxit kim loại của kim loại đứng sau Al trong dãy điện hóa thành kim loại và khí CO2.
→ CO chỉ khử được CuO thành Cu; Al2O3 và MgO không bị khử.
→ Đáp án D
Nguyên tử kim loại khi tham gia phản ứng hóa học đóng vai trò chất khử → Nhường electron và tạo thành ion dương.
→ Đáp án B
Ag đứng sau Cu trong dãy điện hóa → Ag không thể khử ion Cu2+.
→ Đáp án D
Các kim loại phản ứng với nước ở điều kiện thường tạo ra dung dịch có môi trường bazơ là: Li, Na, K, Ca, Ba. → Chỉ đáp án A thỏa mãn.
→ Đáp án A
Ta ngâm vào lượng dư dung dịch AgNO3 vì Cu phản ứng với AgNO3 tạo thành dung dịch muối và đẩy kim loại Ag ra khỏi muối.
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag.
→ Đáp án A
Những tính chất vật lí chung của kim loại (dẫn điện, dẫn nhiệt, dẻo, ánh kim) gây nên chủ yếu bởi các e tự do trong tinh thể kim loại.
→ Đáp án D
So với nguyên tử phi kim cùng chu kì, nguyên tử kim loại thường có năng lượng ion hóa nhỏ hơn.
→ Đáp án B
Kim loại dẫn điện tốt nhất là bạc (Ag).
→ Đáp án B
Kim loại dẻo nhất trong tất cả các kim loại là vàng (Au).
→ Đáp án A
Kim loại có độ cứng lớn nhất trong tất cả các kim loại là crom (Cr).
→ Đáp án B
Kim loại mềm nhất trong tất cả các kim loại là Xesi (Xe).
→ Đáp án B
Kim loại có nhiệt độ nóng chảy cao nhất trong tất cả các kim loại Vonfam.
→ Đáp án A
Kim loại nhẹ nhất (khối lượng riêng nhỏ nhất) trong tất cả các kim loại là Li (D = 0,5g/cm3).
→ Đáp án A
2Al + 3Cl2 → 2AlCl3
Theo bài ta có: nAlCl3 = 26,7/133,5 = 0,2 mol
Theo phương trình ta có: nCl2 = 3nAlCl3/2 = 0,3 mol
Khối lượng clo cần là: mCl2 = 0,3.71 = 21,3 g
→ Đáp án A
M + Cu2+ → M2+ + Cu
Số mol Cu2+ phản ứng là: 1(0,5 – 0,3) = 0,2 mol
Độ tăng khối lượng của thanh kim loaị M:
M = mCu – mM tan = 0,2(64 – M) = 1,6
Suy ra: M = 56 là Fe
→ Đáp án A
Ta có: nAgNO3 = 0,01 mol.
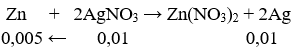
mAg = 0,01. 108 = 1,08g.
Đặt mZn = a ⇒ a = 1,08 – (0,005.65) = 0,755g.
→ Đáp án D
Ta có: nFe = 0,15 mol, nAgNO3 = 0,4mol.
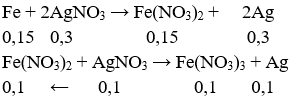
Suy ra: mAg = (0,1+ 0,3).108 = 43,2g.
→ Đáp án C
Tính oxi hoá tăng dần từ trái sang phải: Fe2+,Cu2+, Fe3+.
→ Đáp án D
2Fe3+ + Cu → Cu2+ + 2Fe2+
→ Đáp án A
Kim loại đứng trước H trong dãy điện hoá tác dụng được với dung dịch axit H2SO4 loãng: Fe, Al, Mg, Zn.
→ Đáp án D
Ngâm Cu dư vào dd AgNO3, Ag bị đẩy hết ra khỏi muối, muối mới là Cu(NO3)2 (dd X).
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Ngâm Fe dư vào dung dịch X, Cu bị đẩy hết ra khỏi muối tạo muối mới là Fe(NO3)2.
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
→ Đáp án A
Gọi số mol Fe phản ứng là x mol.
![]()
→ mtăng = 64x – 56x = 8 → x = 1 mol
→ nCuSO4 = x = 1 mol → CM(CuSO4) = 1/0,2 = 5M
→ Đáp án C
2NaCl + 2H2O -Dp→ 2NaOH + Cl2 + H2
CuSO4 + H2O -Dp→ Cu + H2SO4 + 0,5O2
Điện phân dung dịch KNO3 và K2SO4 thực chất là quá trình điện phân nước
2H2O -Dp→ 2H2 + O2.
→ Đáp án A
Điện phân dung dịch dùng để điều chế những kim loại trung bình hoặc yếu như Cu, Ag.
→ Đáp án C
Phương pháp điện phân nóng chảy dùng để điều chế các kim loại từ nhôm trở về trước.
VD: K, Na, Mg…
→ Đáp án C
Ion âm bị hút về cực dương (hay di chuyển về cực dương) và bị khử: 2X- + 2e → X2
→ Đáp án C
Ion của kim loại mạnh như: K, Na, Li, Ca… và ion của các gốc muối có oxi như: SO42-, NO3- không bị điện phân. → Chọn D.
→ Đáp án D
Phản ứng: MgCl2 + 2H2O -đpdd Mg(OH)2 + H2 + Cl2
- Ta có: ne trao đổi = It/F = 0,2 mol
→ nMgCl2 = nCl2 = nH2 = ne/2 = 0,1 mol
→ mdd giảm = 58nMg(OH)2 + 2nH2 + 71nCl2 = 13,1 gam
→ Đáp án D
Gọi muối cần tìm là MCln.
Bảo toàn khối lượng ta có:
mCl2 = mMCln - mM = 1,9 - 0,48 = 1,42 gam → nCl2 = 1,42/71 = 0,02 mol
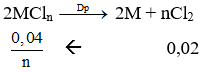
Theo bài ta có: ![]()
Vậy M là Mg.
→ Đáp án C
nM = 16/M mol; nCl2 = 5,6/22,4 = 0,25 mol
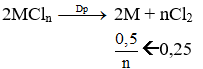
![]() ⇔ M = 32n ⇒ n = 2; M = 64
⇔ M = 32n ⇒ n = 2; M = 64
Kim loại M là Cu.
→ Đáp án C
nCuSO4 = 0,5. 0,4 = 0,2 mol
ne trao đổi = 2.0,2 = 0,4 mol
![]()
→ Đáp án C
Ta có: ![]()
Với F = 96500 C/mol ta có: ![]()
→ Đáp án A
nCl2 = 0,02 mol
Tại catot: Mn+ + ne → M
Theo định luật bảo toàn khối lượng mM = m(muối) – mCl2 = 2,22 – 0,02.71 = 0,8 gam
Tại anot: 2Cl- → Cl2 + 2e
Theo định luật bảo toàn mol electron ta có: nM = 0,04/n → M = 20.n → n = 2 và M là Ca
→ Đáp án B
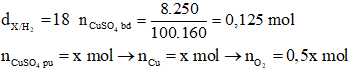
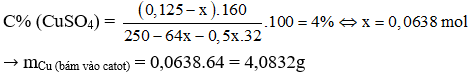
→ Đáp án A
Phương trình điện phân:
CuCl2 -đpdd→ Cu + Cl2↑
Áp dụng công thức Faraday:
![]()
→ Đáp án A