










































































Preview text:
TÓM TẮT BÀI GIẢNG HÓA HỌC ĐẠI CƯƠNG 1 CẤU TẠO CHẤT LÊ THỊ SỞ NHƯ Khoa HÓA HỌC
Đại Học Khoa Học Tự Nhiên - Đại Học Quốc Gia tp HCM Tháng 9/2020 Aa 1 Chương 1 GIỚI THIỆU
1.1. Đối tượng nghiên cứu của hóa học
Thế giới vật chất quanh ta luôn luôn chuyển động và biến đổi. Hóa học là môn khoa học
nghiên cứu các quy luật biến đổi của vật chất đi kèm với sự thay đổi về tính chất, thành phần, và
cấu tạo của chúng. Bên cạnh việc tìm ra các quy luật, một trong các vấn đề mà các nhà Hóa học
quan tâm là giải thích mối liên quan giữa tính chất, thành phần, và cấu tạo của vật chất. Ví dụ, kim
cương và than chì đều có thành phần hóa học là carbon, nhưng điều gì làm cho chúng có tính chất
rất khác nhau: kim cương cứng, còn than chì thì mềm? Tại sao nước hòa tan được đường hay
muối ăn, nhưng không hòa tan được dầu ăn? Tại sao khi ta đốt cháy than thì khí CO2 được tạo
thành kèm theo sự phát nhiệt? Câu trả lời cho các câu hỏi trên sẽ được trình bày trong môn học
Hóa học Đại cương qua các định luật và lý thuyết về cấu tạo của vật chất. Ngoài ra, ta cần nhớ
rằng tất cả vật chất chung quanh chúng ta, từ các vật vô tri vô giác như kim cương, than chì, nước,
đường, muối, dầu ăn... đến các chất sống – từ các dạng đơn bào đến động vật bậc cao – đều được
tạo thành từ các hóa chất. Do đó, đối tượng nghiên cứu của các nhà Hóa học không chỉ gói gọn
trong thế giới vô tri như các ví dụ vừa nêu trên, mà các nhà Hóa học còn nghiên cứu cả những vấn
đề liên quan đến các chất “sống” chung quanh ta.
Không chỉ vậy, việc quan trọng của các nhà Hóa học còn là tìm ra các phương pháp và điều
kiện để điều chế được các chất mới, hoặc cải tiến những phương pháp điều chế các chất đã biết.
Trong lĩnh vực này, hóa học rất gần gũi với đời sống của chúng ta. Nhờ công nghệ hóa học mà
chúng ta có vô số loại sản phẩm khác nhau để đáp ứng các nhu cầu trong cuộc sống như vải sợi,
thuốc men, thực phẩm chế biến, phân bón, thuốc trừ sâu, v.v… Ngày nay, hóa học hiện đại còn
nghiên cứu để tổng hợp những chất mới có cấu trúc chưa từng được biết đến trong tự nhiên. Ví dụ,
bằng cách lắp ráp những phân tử nhỏ với nhau, người ta đã tạo ra các hợp chất có lỗ xốp hoặc hệ
thống rãnh xốp với kích thước và thành phần nhất định để dùng trong nhiều ngành công nghiệp
khác nhau. Hóa học hiện đại cũng nghiên cứu để tìm ra những phương pháp điều chế mới sao cho
thân thiện với môi trường hơn, hướng nghiên cứu này mở ra một lĩnh vực mới với tên gọi là Hóa học xanh (Green Chemistry).
Trong quá trình nghiên cứu để tìm ra những chất mới, có không ít chất được tạo thành mà
không có giá trị thực tế nào trong đời sống. Tuy nhiên, những nghiên cứu như vậy không phải là
hoàn toàn vô ích. Chính việc nghiên cứu những chất “không có giá trị thực tế” đó đã giúp các nhà
Hóa học hiểu rõ hơn các quy luật biến đổi của vật chất, góp phần làm hoàn thiện hơn các kiến thức
hóa học của chúng ta. Ngoài ra, những kiến thức đó không chỉ cho phép các nhà Hóa học cải tiến
và điều khiển các phản ứng hóa học để hy vọng tạo ra được những chất mới khác đáp ứng ngày
càng tốt hơn các nhu cầu của chúng ta, mà còn giúp các nhà khoa học nghiên cứu thế giới theo
cách ngày càng hiệu quả hơn.
Trong lịch sử, nhiều kiến thức hóa học trước thế kỷ thứ XVII được khám phá từ các thí nghiệm theo
kiểu “thử và sai”. Tuy nhiên, nếu tiến hành nghiên cứu theo cách “thử và sai” một cách thiếu định
hướng thì vừa tốn kém thời gian và công sức, vừa phung phí tiền bạc. Ngày nay, kiến thức hóa học
dựa trên các nguyên lý và các lý thuyết được suy ra từ sự khám phá thế giới chung quanh ta một
cách có phương pháp và có hệ thống, được gọi là phương pháp nghiên cứu khoa học. Phương
pháp nghiên cứu khoa học sẽ được giới thiệu trong phần tiếp theo sau đây. 2
1.2. Phương pháp nghiên cứu khoa học
Galileo Galilei (1564–1642), Francis Bacon (1561–1626), Robert Boyle (1627–1691), và
Isaac Newton (1642–1726) là những người đầu tiên khai sinh ra phương pháp nghiên cứu khoa học
vào thế kỷ thứ XVII. Nghiên cứu theo phương pháp khoa học luôn luôn được bắt đầu từ sự quan
sát một cách khách quan các hiện tượng xảy ra. Quan sát khách quan là các quan sát không dựa
trên bất cứ thiên kiến nào. Khi kết quả quan sát đủ nhiều, ta có thể tìm được quy luật tổng quát để
mô tả các hiện tượng quan sát được – các quy luật đó được gọi là các định luật (natural law). Nhiều
định luật có thể được phát biểu dưới dạng phương trình toán học. Ví dụ, mối liên quan giữa nhiệt độ
(T), thể tích (V), và áp suất (P) của khí lý tưởng được phát biểu thành định luật khí lý tưởng theo
phương trình sau: PV = n RT, trong đó n là số mole khí và R là hằng số khí lý tưởng. Trong không ít
trường hợp, định luật mới tìm thấy có nội dung trái với những điều mà con người đã tin tưởng trước
đó. Ví dụ, đầu thế kỷ thứ XVI, Nicolaus Copernicus (1473–1543) đã quan sát cẩn thận sự di chuyển
của các hành tinh và nhận thấy trái đất cùng nhiều hành tinh khác xoay quanh mặt trời theo những
quỹ đạo hình tròn. Ông đã tìm được phương trình toán học để mô tả sự chuyển động của các hành
tinh. Phát hiện của Copernicus hoàn toàn trái ngược với những điều được con người tin tưởng lúc
bấy giờ, rằng trái đất là trung tâm của vũ trụ, mặt trời và các hành tinh khác xoay quanh trái đất.
Cũng nên biết rằng các định luật chỉ có giá trị khi chúng giúp ta dự đoán được những điều sắp xảy
ra. Ví dụ, các phương trình của Copernicus cho phép ta tính toán và dự đoán được vị trí của trái đất
trong tương lai một cách chính xác hơn các quan điểm trước đó; vì vậy, có thể coi định luật
Copernicus là một thành công vào lúc đó. Tuy nhiên, không phải tất cả các định luật đã biết đều
đúng một cách vĩnh viễn. Đôi khi, kết quả từ các nghiên cứu mới buộc chúng ta phải điều chỉnh lại
một số định luật đã có. Ví dụ, sau này, các định luật của Copernicus đã được điều chỉnh bởi
Johannes Kepler (1571–1630), người cho rằng các hành tinh chuyển động quanh mặt trời theo
những quỹ đạo hình ellipse. Để xác nhận hoặc điều chỉnh định luật – tức là xác nhận hoặc điều
chỉnh kiến thức – các nhà khoa học phải tiếp tục quan sát và thiết kế các thí nghiệm để kiểm tra
xem các kết quả thí nghiệm có luôn luôn phù hợp với các kết luận trước đây hay không. Nếu kết
quả thí nghiệm không luôn luôn theo đúng định luật, ta cần điều chỉnh lại định luật. Để ý rằng chúng
ta có thể lặp lại quan sát hay lặp lại thí nghiệm nhiều lần để kiểm tra kết quả, ngay cả chúng ta có
thể điều chỉnh định luật, nhưng không thể điều chỉnh kết quả thí nghiệm.
Bên cạnh những quy luật chung được đưa ra ở dạng định luật, các nhà khoa học cũng muốn giải
thích tại sao các hiện tượng lại xảy ra theo quy luật như vậy. Để giải thích một quy luật nào đó, đầu
tiên, các nhà khoa học đưa ra lời giải thích sơ khởi, được gọi là “giả thuyết” (hypothesis). Khi đã có
giả thuyết, các nhà khoa học phải thiết kế các thí nghiệm để kiểm tra giả thuyết. Nếu kết quả thí
nghiệm thu được phù hợp với giả thuyết, tức là giả thuyết đúng, giả thuyết sẽ được phát triển
thành thuyết, hay lý thuyết (theory). Đôi khi thuyết có thể được trình bày dưới dạng mô hình
(model). Ví dụ trong tài liệu này ta sẽ thấy mô hình nguyên tử chính là thuyết cấu tạo nguyên tử.
Trong những trường hợp như vậy, thuật ngữ “mô hình” và “thuyết” được dùng tương đương nhau.
Vậy, thuyết, mô hình, hay lý thuyết là lời giải thích tại sao các hiện tượng tự nhiên xảy ra theo cách
nào đó. Nếu kết quả thí nghiệm mâu thuẫn với giả thuyết, ta phải điều chỉnh giả thuyết, và kiểm tra
lại giả thuyết mới. Đôi khi, ta không tìm được quy luật và lời giải thích đúng cho tất cả các hiện
tượng, khi đó ta dùng thuyết phù hợp nhất. Theo thời gian, các dữ liệu thí nghiệm mới được tích
lũy, một số lý thuyết và định luật trở thành chắc chắn hơn và được dùng rộng rãi, một số khác có
thể được điều chỉnh hoặc bị loại bỏ. Nói cách khác, 3
lý thuyết và định luật không phải là các kiến thức bất di bất dịch, chúng có thể thay đổi khi ta thu
thập được những thông tin mới hơn.
Trong khoa học, kiến thức được tích lũy và phát triển qua quá trình nghiên cứu khoa học.
Đó là chuỗi các quá trình quan sát – đưa ra định luật, giả thuyết – tiến hành thực nghiệm để kiểm
tra giả thuyết và định luật – đưa ra lý thuyết – tiến hành thực nghiệm để kiểm tra lý thuyết. Chu trình
đó được tóm tắt trong Hình 1.1.
Hình 1.1. Tóm tắt quy trình nghiên cứu khoa học.
Trong nghiên cứu khoa học, các dữ kiện thu được từ quan sát thực nghiệm là bước mở đầu
và cũng là tiêu chuẩn để đánh giá giá trị của các định luật và thuyết. Do đó, chúng ta sẽ bàn chi tiết
hơn về quan sát: quan sát được tiến hành nhờ các giác quan của con người và các dụng cụ hoặc
máy móc mà con người tạo ra để nối dài giác quan của mình. Một số dụng cụ đơn giản nhất để
quan sát mà chúng ta đều biết là thước để đo độ dài, ống đong để đo thể tích chất lỏng, cân để đo
khối lượng, nhiệt kế để đo nhiệt độ, kính viễn vọng để quan sát các ngôi sao ở xa, kính hiển vi để
quan sát những vật có kích thước rất nhỏ, v.v… Trong nghiên cứu hóa học, có hai kiểu quan sát
chính là định tính và định lượng. Ví dụ, những quan sát để nhận ra nước là chất lỏng ở điều kiện
thường, hay khi trộn dung dịch AgNO3 với dung dịch NaCl ta thấy xuất hiện kết tủa màu trắng, v.v…
là những quan sát định tính. Một số quan sát khác có tính định lượng như: nước nguyên chất đông
đặc ở 0 oC và sôi ở 100 oC; khi trộn dung dịch AgNO3 với dung dịch NaCl, chất kết tủa màu trắng tạo
thành có chứa 75.27% bạc và 24.73% chlorine theo khối lượng. Càng ngày con người tạo ra càng
nhiều máy móc mới để quan sát tốt hơn thế giới tự nhiên, các định luật và lý thuyết theo đó cũng có
thể được điều chỉnh.
Cũng cần lưu ý rằng định luật và thuyết là hai sản phẩm của nghiên cứu khoa học, cả hai
đều được dùng để dự đoán thế giới tự nhiên, nhưng định luật khác với thuyết. Một cách ngắn gọn,
ta có thể nói rằng định luật tổng kết những điều xảy ra, lý thuyết là lời giải thích tại sao điều đó lại
xảy ra như vậy. Điều ta cần nhớ là lý thuyết là sản phẩm từ trí tuệ của con người. Bằng kinh nghiệm
của mình, con người cố gắng giải thích thế giới tự nhiên qua các thuyết. Nói cách khác, lý thuyết là
phỏng đoán khoa học của con người. Muốn giải thích thế giới tự nhiên ngày càng đúng hơn, con
người phải không ngừng tiến hành những thí nghiệm mới và điều chỉnh lý thuyết đang có sao cho
phù hợp với những hiểu biết mới.
Những điều ta vừa nói về phương pháp nghiên cứu khoa học có thể được xem là con
đường lý tưởng nhất của quá trình nghiên cứu khoa học. Trong thực tế, con đường đi tới kiến 4
thức khoa học không phải bao giờ cũng bằng phẳng và hiệu quả. Không có điều gì bảo đảm cho sự
thành công của nghiên cứu khoa học. Như ta đã nói ở phần trên, giả thuyết chịu ảnh hưởng của
quan sát, không những vậy, giả thuyết còn luôn luôn dựa trên các lý thuyết đã có, và trên hết, cả giả
thuyết và quan sát đều do con người tiến hành nên không tránh khỏi hoàn toàn tính chủ quan của
người quan sát. Các kết quả nghiên cứu tâm lý con người chỉ ra rằng chúng ta thường dễ quan sát
thấy những điều ta mong đợi hơn là nhận ra những điều chúng ta không mong đợi. Nói cách khác,
khi kiểm tra giả thuyết hay lý thuyết, ta thường tập trung vào vấn đề đang xét, điều này là rất cần
thiết, nhưng sự tập trung đó có thể làm ta không nhìn thấy các cách khác để giải thích vấn đề. Điều
này có thể hạn chế óc sáng tạo của chúng ta, và cũng có thể ngăn cản chúng ta nhận biết vấn đề
một cách toàn diện và sát với thực tế hơn.
1.3. Nội dung và yêu cầu của môn Hóa học đại cương
Như vừa nói ở trên, nghiên cứu khoa học được thực hiện theo trình tự quan sát – đưa ra
định luật và lý thuyết – áp dụng. Trong môn học Hóa học đại cương, chúng ta sẽ quan tâm tới các
định luật và các lý thuyết căn bản đã được các nhà hóa học kiểm tra và công nhận rộng rãi; phần
quan sát thực nghiệm và các kỹ năng thu thập, xử lý dữ liệu thực nghiệm sẽ được nhấn mạnh
trong phần thực hành hóa học đại cương. Như vậy, trong môn học Hóa học đại cương, sinh viên sẽ
học những nguyên lý căn bản nhất của hóa học thông qua các thuyết và định luật. Các nguyên lý
đó là cơ sở để dự đoán tính chất của các chất và khả năng phản ứng của chúng để chuyển hóa thành những chất khác.
Học xong môn Hóa học đại cương, chúng ta cần hiểu rõ nội dung của các thuyết và các
định luật cơ sở trong hóa học, áp dụng được chúng để giải thích và dự đoán một số quá trình
trong thực tế. Điều cần lưu ý là có thể có nhiều thuyết cùng giải thích một vấn đề, một ví dụ là
thuyết Lewis, thuyết liên kết cộng hóa trị (thuyết VB), và thuyết orbital phân tử (thuyết MO) đều có
thể giải thích sự tạo thành liên kết hóa học trong các chất, nhưng mỗi thuyết đều có những mặt
mạnh và yếu khác nhau, ta cần hiểu rõ các mặt mạnh hay yếu, cũng như giới hạn của mỗi thuyết
và định luật để áp dụng chúng một cách hợp lý và hiệu quả. Thông thường, ta sẽ dùng những
thuyết đơn giản để giải thích vấn đề. Nếu không thể giải quyết vấn đề bằng các thuyết đơn giản
thì ta sẽ dùng đến các thuyết mạnh hơn, phức tạp hơn. 5 Chương 2
NGUYÊN TỬ – NGUYÊN TỐ HÓA HỌC – ĐỒNG VỊ
2.1. Sơ lược lịch sử hóa học đến thế kỷ thứ XIX – khái niệm về nguyên tử, nguyên tố hóa học,
đơn chất, và hợp chất
Vật chất chung quanh ta có nguồn gốc từ đâu, chúng có cấu tạo thế nào, biến đổi gì đã xảy
ra khi ta nướng quặng để thu được kim loại làm đồ trang sức, vũ khí, v.v… Con người đã đặt ra
những câu hỏi tương tự như vậy từ thuở sơ khai của xã hội loài người. Từ đó đến nay, người ta đã
đưa ra nhiều cách giải thích khác nhau về nguồn gốc và cấu tạo của thế giới vật chất. Trong phần
này, ta chỉ kể đến vài cách giải thích nổi bật trước thế kỷ thứ XIX. Vào khoảng 400 năm trước công
nguyên, người Hy Lạp tin rằng tất cả vật chất được tạo thành từ sự kết hợp của bốn nguyên tố: lửa,
đất, nước, và không khí. Bên cạnh đó, họ cũng cho rằng các sự biến đổi của vật chất đều xuất phát
từ sự kết hợp khác nhau của bốn yếu tố trên. Họ cũng quan tâm tới vấn đề liệu vật chất có tính liên
tục hay gián đoạn, liệu có những “hạt không thể phân chia được nữa” tạo nên vật chất hay không.
Một nhà triết học Hy Lạp thời bấy giờ là Democritus đã ủng hộ ý tưởng vật chất có tính gián đoạn.
Theo Democritus, vật chất được tạo thành từ những hạt rất nhỏ, không thể nhìn thấy, không thể
phân chia được, và ông gọi các hạt đó là nguyên tử (chính xác hơn, Democritus gọi các hạt đó là
atomos, ngày nay ta gọi là atom). Có thể xem Democritus là người đầu tiên giải thích cấu tạo của
vật chất dựa vào khái niệm nguyên tử. Tuy nhiên, giải thích của ông chỉ xuất phát từ trực giác,
không phải là kết quả của quá trình nghiên cứu khoa học.
Hai ngàn năm tiếp theo trong lịch sử hóa học là giai đoạn giả kim thuật. Các nhà giả kim
luôn luôn tìm cách chuyển các kim loại rẻ tiền thành vàng. Mặc dù không thực hiện được điều đó,
họ đã khám phá ra nhiều nguyên tố hóa học như thủy ngân (Hg), lưu huỳnh (S), antimony (Sb), và
biết cách điều chế một số acid và muối vô cơ, ví dụ như acid sulfuric (H2SO4), acid nitric (HNO3),
muối natrium sulfate (Na2SO4), v.v…
Nền móng của hóa học hiện đại được bắt đầu xây dựng từ thế kỷ thứ XVI với các nghiên
cứu một cách có hệ thống trong lĩnh vực luyện kim của Georgius Agricola (còn có tên là Georg
Bauer, 1494–1555), và việc dùng các khoáng chất vào y học bởi Paracelsus (còn có tên là
Theophrastus von Hohenheim, 1493–1541). Tuy vậy, Robert Boyle (1627–1691) mới được xem là
nhà hóa học hiện đại đầu tiên tiến hành các thí nghiệm mang tính định lượng theo phương pháp
nghiên cứu khoa học khi ông khảo sát mối tương quan giữa thể tích và áp suất của chất khí. Các
nghiên cứu định lượng trong vật lý và hóa học phát triển mạnh sau khi Boyle xuất bản cuốn “The
Steptical Chemist” vào năm 1661.
Bên cạnh định luật về chất khí, một đóng góp quan trọng khác của Boyle trong hóa học là đưa ra
khái niệm nguyên tố hóa học. Qua quan sát, Boyle thấy có một số chất có thể bị phân chia thành
những chất đơn giản hơn, ví dụ, khi nung nóng thủy ngân oxide, ông thu được thủy ngân và
oxygen. Tuy nhiên, không thể phân chia thủy ngân và oxygen thành những chất đơn giản hơn nữa.
Từ đó, Boyle định nghĩa: mỗi chất là một nguyên tố hóa học (element) nếu ta không thể phân chia
nó thành hai hay nhiều chất đơn giản hơn. Dù vậy, ông không nói rõ là có bao nhiêu nguyên tố hóa
học. Hiện nay, từ “element” trong thuật ngữ hóa học tiếng Anh (ngôn ngữ của Boyle) được dùng với
cả hai nghĩa, “đơn chất” và “nguyên tố hóa học”. Thuật ngữ hóa học hiện đại của nhiều ngôn ngữ
khác với tiếng Anh, trong đó có tiếng Việt, phân biệt “đơn chất” và “nguyên tố hóa học”. “Đơn chất”
là những chất được tạo thành từ các nguyên tử của cùng một nguyên tố, ví dụ, oxygen là đơn chất
vì phân tử oxygen gồm hai nguyên tử O giống nhau, ký 6
hiệu là O2. Đối nghịch với đơn chất là “hợp chất” là những chất được tạo thành từ hai hay nhiều
loại nguyên tử khác nhau, ví dụ, thủy ngân oxide, HgO, là hợp chất vì chất này được tạo thành từ
hai loại nguyên tử, O và Hg. Trong khi đó, thuật ngữ “nguyên tố hóa học” để chỉ tập hợp các
nguyên tử có cùng điện tích hạt nhân nguyên tử (xem chi tiết ở mục 2.3). Ngoài ra, thuật ngữ “chất”
có thể dùng chung cho đơn chất và hợp chất khi không cần phân định rõ ràng hai loại này. Trong
phần còn lại của tài liệu này, các thuật ngữ chất, đơn chất, hợp chất, và nguyên tố hóa học sẽ được
dùng theo các định nghĩa vừa nêu trên.
Từ khái niệm nguyên tố hóa học của Boyle và các kết quả nghiên cứu tiếp theo, các khí
oxygen, nitrogen, hydrogen, carbonic dần dần được phát hiện, và số nguyên tố hóa học biết được
tăng lên nhanh chóng. Khái niệm nguyên tử và nguyên tố hóa học dần dần được chấp nhận rộng
rãi và thay thế hẳn thuyết “bốn yếu tố” của người Hy Lạp. Điều đáng cho ta suy ngẫm là mặc dù
Boyle là nhà nghiên cứu khoa học xuất sắc, ông vẫn mắc sai lầm. Boyle vẫn trung thành với quan
điểm của các nhà giả kim nên cho rằng kim loại không thực sự là nguyên tố hóa học, và ta có thể
tìm được cách chuyển kim loại này thành kim loại khác.
Chính các nghiên cứu định lượng đã mở đường cho sự ra đời của các định luật cơ sở của
hóa học. Antoine Lavoisier (1743 – 1794) đã nghiên cứu cẩn thận tổng khối lượng của các tác chất
và sản phẩm trong nhiều phản ứng hóa học khác nhau, ông nhận thấy khối lượng của các chất
trong phản ứng không tăng lên hoặc giảm xuống sau khi phản ứng hóa học xảy ra. Các kết quả này
được tổng kết thành định luật bảo toàn khối lượng. Đây là định luật đầu tiên, đặt nền móng cho sự
phát triển của hóa học trong thế kỷ thứ XIX.
Thế kỷ thứ XVIII – XIX là giai đoạn tìm ra các định luật khoa học tự nhiên làm tiền đề cho sự
phát triển hóa học sau đó. Joseph Proust (1754 – 1826) đã tìm ra định luật thành phần không đổi
sau khi quan sát thấy các chất dù được điều chế bằng những cách khác nhau vẫn chứa các
nguyên tố hóa học như nhau với tỷ lệ khối lượng của các nguyên tố là bằng nhau. Ví dụ, khí
carbonic (CO2) có thể được điều chế bằng cách đốt cháy than hoặc cho acid phản ứng với đá vôi,
nhưng dù điều chế bằng cách nào thì tỷ lệ khối lượng giữa oxygen (O) và carbon (C) trong khí
carbonic luôn luôn bằng nhau: mO/mC = 2.66. Jonh Dalton (1766 – 1844) nghiên cứu thành phần
của các nguyên tố hóa học trong các hợp chất và tìm ra định luật tỷ lệ bội: khi hai nguyên tố có thể
kết hợp với nhau để tạo ra nhiều hơn một hợp chất thì tỷ lệ khối lượng của nguyên tố thứ nhất kết
hợp với 1 gram nguyên tố thứ hai trong các hợp chất luôn luôn là các số nguyên nhỏ. Ví dụ, khối
lượng oxygen kết hợp với 1 gram carbon trong hai hợp chất khí của O và C là 1.33 g (hợp chất I)
và 2.66 g (hợp chất II). Ta thấy hợp chất II giàu oxygen hơn hợp chất I; tỷ lệ khối lượng oxygen kết
hợp với 1 gram carbon trong hai hợp chất trên là 2.66/1.33 = 2, là một số nguyên nhỏ. Từ kết quả
đó, Dalton đề nghị nếu hợp chất I có công thức là CO thì hợp chất II phải có công thức là CO2.
Trong giai đoạn này, các nhà khoa học không chỉ tìm ra các định luật mà còn bắt đầu đưa
ra các thuyết để giải thích cấu tạo của vật chất. Một trong các thuyết vẫn còn giá trị cho đến ngày
nay là thuyết nguyên tử do Dalton đề nghị năm 1808. Nội dung của thuyết gồm các điểm sau:
Vật chất được tạo thành từ những hạt rất nhỏ không thể phân chia thành những phần nhỏ
hơn, cũng không phá hủy được chúng, các hạt rất nhỏ đó là nguyên tử. Các nguyên tử của
cùng một nguyên tố thì giống nhau; các nguyên tố khác nhau có nguyên tử khác nhau. 7
Nguyên tử của các nguyên tố khác nhau kết hợp với nhau theo những tỷ lệ xác định để tạo thành các hợp chất.
Có sự sắp xếp lại của các nguyên tử trong các chất khi phản ứng hóa học xảy ra. Nói cách
khác, khi phản ứng hóa học xảy ra, các nguyên tử kết hợp với nhau theo cách khác để tạo
thành các chất mới, nhưng bản thân nguyên tử không thay đổi trong phản ứng hóa học.
Có thể xem đây là thuyết nguyên tử đầu tiên xuất phát từ kết quả thực nghiệm. Từ đó, các
khái niệm về nguyên tử và nguyên tố hóa học dần dần trở nên quen thuộc và rõ ràng hơn. Cũng từ
các kết quả nghiên cứu định lượng, các kiến thức hóa học tăng lên một cách nhanh chóng. Dựa
vào kết quả định lượng tỷ lệ khối lượng giữa các nguyên tố trong hợp chất (ví dụ, cứ 1 khối lượng
hydrogen thì có 8 khối lượng oxygen trong nước), Dalton là người đầu tiên lập ra bảng khối lượng
tương đối của các nguyên tử. Các kết quả định lượng cho thấy H luôn có khối lượng nhỏ nhất trong
các chất, vì vậy khối lượng tương đối của nguyên tử H được quy ước là 1, từ đó người ta tính
được khối lượng tương đối của nguyên tử của các nguyên tố khác. Vì lúc đó công thức phân tử
của nhiều chất chưa được biết rõ nên có nhiều sai sót trong bảng khối lượng tương đối này. Ví dụ,
kết quả thí nghiệm cho thấy cứ 1 khối lượng hydrogen (H) thì có 8 khối lượng oxygen (O) trong
nước, vì lúc bấy giờ công thức phân tử của nước được cho là OH, nên Dalton cho rằng nếu khối
lượng nguyên tử của H là 1 thì khối lượng nguyên tử của O là 8 (ngày nay ta biết công thức phân
tử của nước là H2O và khối lượng tương đối của nguyên tử O là 16). Tuy vậy, việc Dalton lập bảng
khối lượng tương đối của các nguyên tử là một bước quan trọng cho các nghiên cứu tiếp theo.
Cũng vào năm 1808, nhà hóa học Joseph Gay–Lussac (1778–1850) đã đo thể tích phản
ứng giữa các chất khí và thu được nhiều kết quả có độ tin cậy cao, nhưng ông chưa thể giải thích
tại sao chúng lại xảy ra như vậy. Ví dụ, ông thấy cứ hai đơn vị thể tích khí hydrogen phản ứng với
một đơn vị thể tích khí oxygen thì tạo thành hai đơn vị thể tích hơi nước. Ba năm sau, năm 1811,
Amedeo Avogadro (1776–1856) ủng hộ giả thuyết cho rằng ở cùng nhiệt độ và áp suất, các thể
tích bằng nhau của các chất khí chứa cùng một số lượng “hạt” như nhau. Ông cho rằng giả thuyết
này chỉ hợp lý nếu ta chấp nhận rằng khoảng cách giữa các “hạt” ở thể khí rất lớn so với kích
thước của từng hạt. Các “hạt” ở thể khí được Avogadro gọi là “phân tử”. Từ đó, ông đã biểu diễn
và giải thích kết quả thí nghiệm của Gay-Lussac như sau:
2 thể tích hydrogen + 1 thể tích oxygen → 2 thể tích nước tương ứng với:
2 phân tử hydrogen + 1 phân tử oxygen → 2 phân tử nước
Avogadro lập luận rằng chỉ có thể giải thích tốt nhất các dữ kiện trên nếu ta chấp nhận
các khí hydrogen và oxygen có phân tử ở dạng nhị nguyên tử: H2, O2, còn nước có công thức
phân tử là H2O. Tuy nhiên, con đường khám phá kiến thức mới không phải lúc nào cũng bằng
phẳng và thuận lợi. Đáng tiếc là lúc bấy giờ chưa có nhiều kết quả thí nghiệm và giải thích của
Avogadro không đủ sức thuyết phục các nhà hóa học.
Gần nửa thế kỷ sau đó, Stanislao Cannizzaro (1826–1910) thực hiện hàng loạt các thí
nghiệm đo tỷ lệ khối lượng của các chất khí so với khí hydrogen trong cùng điều kiện nhiệt độ và áp
suất. Ví dụ, ông đo được tỷ lệ khối lượng của 1 L oxygen và 1 L hydrogen là 16 và biểu diễn như sau: 8 16 32 �� ố ℎ �� � ư � ợ���
� 1 �� ℎ�������������� = 1= 2 ố
��ℎ �� ��ượ���� 1 �� ������������
Tin tưởng vào thuyết nguyên tử của Dalton và giả thuyết của Avogadro cho rằng phân tử oxygen và
hydrogen là O2 và H2, Cannizzaro lập luận: nếu khối lượng của nguyên tử hydrogen (H) là 1 thì khối
lượng của phân tử hydrogen (H2) bằng 2, khối lượng của phân tử oxygen (O2) là 32, và khối lượng
nguyên tử của oxygen (O) là 16.
Bên cạnh đó, Cannizzaro đo được khối lượng phân tử của khí carbonic là 44. Các thí
nghiệm phân tích thành phần của hợp chất này cho thấy carbon chiếm 27% khối lượng. Từ đó ông
tính được trong 44 gram carbon dioxide có (0.27) x (44 gram) = 12 gram carbon, vậy oxygen chiếm
32 gram, nghĩa là có 2 nguyên tử O trong phân tử khí carbonic. Cannizzaro cũng đo khối lượng
phân tử và khối lượng của các nguyên tố tạo thành các chất khí chứa carbon khác như methane,
ethane, propane, butane… Khối lượng của carbon trong các phân tử trên luôn luôn là bội số của 12
(xem cột phải trong Bảng 2.1). Các dữ liệu này đã thuyết phục mạnh mẽ cho việc đề nghị khối
lượng tương đối của nguyên tử carbon là 12, và công thức phân tử của khí carbonic là CO2.
Bảng 2.1. Khối lượng của carbon trong các phân tử khác nhau
Hợp chất Khối lượng phân tử
% khối lượng C trong hợp chất
Khối lượng của C trong phân tử Methane Propane Khí carbonic 75 80 82 83 27 16 30 44 58 44 Ethane Butane 12 24 36 48 12
Năm 1860, tại Hội nghị Hóa học thế giới lần thứ nhất ở Đức, cả trong các thảo luận trên diễn đàn
lẫn ở các cuộc đàm đạo ngoài hành lang, Cannizzaro đã dùng thuyết nguyên tử của Dalton và giả
thuyết của Avogadro để giải thích các kết quả thí nghiệm của mình. Với số lượng kết quả thí
nghiệm đủ lớn, giải thích của Cannizzaro đã thuyết phục hội nghị, và từ đó hóa học có bảng quy
ước mới về khối lượng tương đối của nguyên tử. Cũng nói thêm rằng Cannizzaro không phải là
người xác định khối lượng chính xác của nguyên tử, ông chỉ xác định các giá trị gần đúng của
khối lượng tương đối của các nguyên tử. Berzelius (1779–1848) chính là người tiến hành các thí
nghiệm định lượng chính xác khối lượng tương đối của các nguyên tử.
Vào đầu năm 1800, các nhà hóa học biết được khoảng 30 nguyên tố hóa học. Nhờ những
khám phá của hóa học trong thời gian này, đến năm 1860, số nguyên tố được xác định khối lượng
nguyên tử và tính chất hóa học đã lên tới 60. Cùng lúc đó, các nhà hóa học đã nhận thấy nhiều
nguyên tố có tính chất hóa học tương tự nhau. Đến năm 1872, Mendeleev sắp xếp các nguyên tố
hóa học theo sự biến thiên tuần hoàn các tính chất của chúng thành bảng phân loại tuần hoàn, từ
đó mở đường cho việc nghiên cứu tính chất của các nguyên tố hóa học một cách có hệ thống hơn.
Ta sẽ xem chi tiết về bảng phân loại tuần hoàn của các nguyên tố hóa học trong Chương 4. Trong
phần tiếp theo của chương này, ta sẽ xem sự khám phá cấu tạo của nguyên tử từ các kết quả nghiên cứu hiện đại. 9
2.2. Hóa học hiện đại – các thí nghiệm khám phá cấu tạo của nguyên tử
Từ các kết quả nghiên cứu của Dalton, Gay-Lussac, Cannizzaro, v.v… các khái niệm về
nguyên tử, nguyên tố hóa học, đơn chất, và hợp chất ngày càng trở nên có ý nghĩa rõ ràng hơn và
được chấp nhận rộng rãi. Tuy nhiên, mãi đến cuối thế kỷ thứ XIX – đầu thế kỷ thứ XX, thành phần
và cấu tạo của nguyên tử mới dần dần được khám phá từ thực nghiệm. Như đã nói, các
kiến thức mới trong khoa học luôn luôn được phát triển từ những kiến thức đã biết. Trước khi
khám phá ra cấu tạo của nguyên tử, các nhà khoa học đã biết đến các hiện tượng và tính chất
của điện và từ. Họ đã biết hầu hết vật chất quanh ta trung hòa điện, nhưng chúng có thể trở
thành tích điện trong điều kiện thích hợp. Ví dụ, khi ta chà mạnh trái banh cao su vào tấm vải, trái
banh và tấm vải trở thành tích điện khác nhau, thường gọi là điện dương và điện âm. Các nhà
khoa học cũng biết các vật mang điện giống nhau thì đẩy nhau, các vật mang điện khác nhau thì
hút nhau. Các kiến thức đó là cơ sở để giải thích cấu tạo nguyên tử từ các kết quả thí nghiệm sẽ
được giới thiệu trong phần tiếp theo sau đây.
2.2.1. Thí nghiệm khám phá electron – Thuyết nguyên tử của Thomson
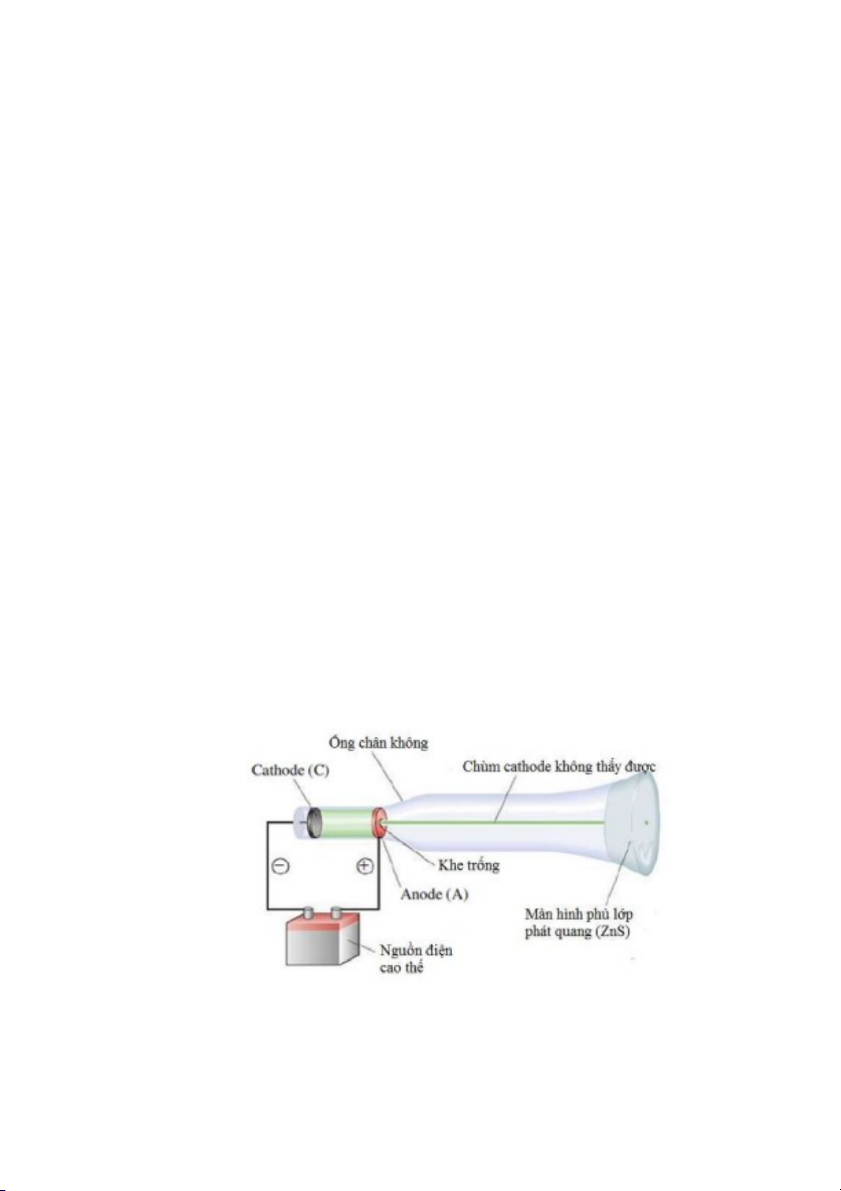
Hình 2.1. Cấu tạo của ống phát tia âm cực.
Dụng cụ góp phần khám phá cấu tạo của nguyên tử là ống phát tia âm cực, còn được gọi là ống
phát tia cathode (Cathode-ray tube, viết tắt là CRT). CRT không xa lạ với chúng ta, chúng được
dùng làm đèn hình cho màn ảnh ti vi và máy vi tính cho đến khoảng năm 2000, trước khi các màn
hình này được thay thế bằng màn hình tinh thể lỏng (liquid crystal display, LCD). Gần giữa thế kỷ
thứ XIX, một số nhà vật lý đã cải tiến thí nghiệm phóng điện trong áp suất thấp và quan sát thấy khi
áp điện thế cao vào hai điện cực kim loại đặt trong một ống chân không thì từ cực âm (cathode) của
ống xuất hiện một chùm tia hướng về phía cực dương (anode). Chùm tia đó sau này được gọi là tia
âm cực, nên ống được đặt tên là ống phát tia âm cực. Cấu tạo của CRT được vẽ trong Hình 2.1,
trong đó anode có một lỗ trống ở giữa để chùm tia âm cực có thể đi xuyên qua và đập vào màn hình
ở cuối ống. Thực ra, ta không thấy được tia âm cực tạo thành trong CRT bằng mắt thường. Nhưng
tia âm cực phát sáng khi chạm vào các vật liệu phát quang (fluorescence); vì vậy, bằng cách sơn
vật liệu phát quang vào màn hình của CRT, người ta “thấy” được tia âm cực. Ví dụ, màn hình của
ống CRT trong Hình 2.1 được phủ bằng lớp phát quang kẽm sulfide (ZnS), chấm xanh ở giữa biểu
diễn cho vị trí tia âm cực đập vào màn hình. 10
Hình 2.2. Chùm tia âm cực bị lệch khi đi qua điện trường hoặc từ trường.
Các nhà khoa học cũng quan sát thấy rằng, bình thường chùm tia âm cực đi thẳng (Hình
2.1), nhưng nếu ta đặt thêm tụ điện (điện trường) hoặc nam châm (từ trường) trên đường đi của
chùm tia âm cực, tia âm cực sẽ bị lệch khỏi vị trí ban đầu (Hình 2.2). Kết quả thí nghiệm cho thấy
chùm tia âm cực luôn luôn lệch về phía cực dương của tụ điện, và hiện tượng này xảy ra khi ta thay
cực âm của CRT bằng nhiều kim loại khác nhau. Năm 1897, Joseph John Thomson (1856–1940)
giải thích rằng chùm tia âm cực lệch về phía cực dương của điện trường nên đó phải là chùm của
các hạt mang điện tích âm. Sau đó, các hạt mang điện tích âm này được gọi là các electron, hay
điện tử. Bằng các phép đo cường độ điện trường áp vào CRT và độ lệch của chùm tia âm cực khi
đi qua điện trường, Thomson xác định được tỷ số giữa khối lượng (m) và điện tích (e) của electron là:
m/e = – 5.6857 x 10–9 g/C (2.1)
Dấu âm trong biểu thức (2.1) xuất phát từ quy ước electron mang điện tích âm. Vì sự phát
ra tia âm cực và tỷ lệ m/e đo được không phụ thuộc vào bản chất kim loại làm cực âm của CRT,
Thomson cho rằng tất cả các nguyên tử đều có electron. Hơn nữa, bản thân kim loại không tích
điện, tức là nguyên tử trung hòa điện, nên phần còn lại của nguyên tử phải có điện tích dương. Từ
lập luận đó, Thomson đưa ra mô hình cấu tạo nguyên tử như sau: nguyên tử như một đám mây
hình cầu mang điện dương với các electron mang điện âm nằm rải rác trong đám mây như biểu
diễn trong Hình 2.3. Khi nguyên tử mất một vài electron, nó trở thành ion dương. Đây là lý thuyết
đầu tiên về cấu tạo nguyên tử được đưa ra từ kết quả thực nghiệm. Cấu tạo nguyên tử do
Thomson đề nghị trông tương tự như một loại bánh bông lan có nhân rải rác bên trong của người
Anh, gọi là bánh plum pudding, do đó thuyết nguyên tử của Thomson còn có tên là “Plum Pudding model”.
Hình 2.3. Mô hình nguyên tử của Thomson: nguyên tử như một đám mây hình cầu
mang điện dương, các electron mang điện âm nằm rải rác trong đám mây.
Từ câu chuyện về kết quả nghiên cứu khoa học vừa kể trên, ta thấy rằng nhà khoa học đưa
ra lời giải thích cho một vấn đề nào đó không phải luôn luôn là người đầu tiên quan sát được hiện
tượng hay thu thập dữ liệu thí nghiệm. Hơn nữa, đôi khi phải mất một thời gian không 11
ngắn để tìm ra lời giải thích hợp lý cho các hiện tượng quan sát được. Trong trường hợp này,
Michael Faraday (1791–1867), Julius Plücker (1801–1868), William Crookes (1832–1919) là những
người đầu tiên nghiên cứu tia âm cực từ giữa thế kỷ thứ XIX, nhưng mãi đến cuối thế kỷ XIX thì
Thomson mới đề nghị cách giải thích cho hiện tượng phát ra tia âm cực. Khi đã có lời giải thích,
thuyết mới có thể ra đời.
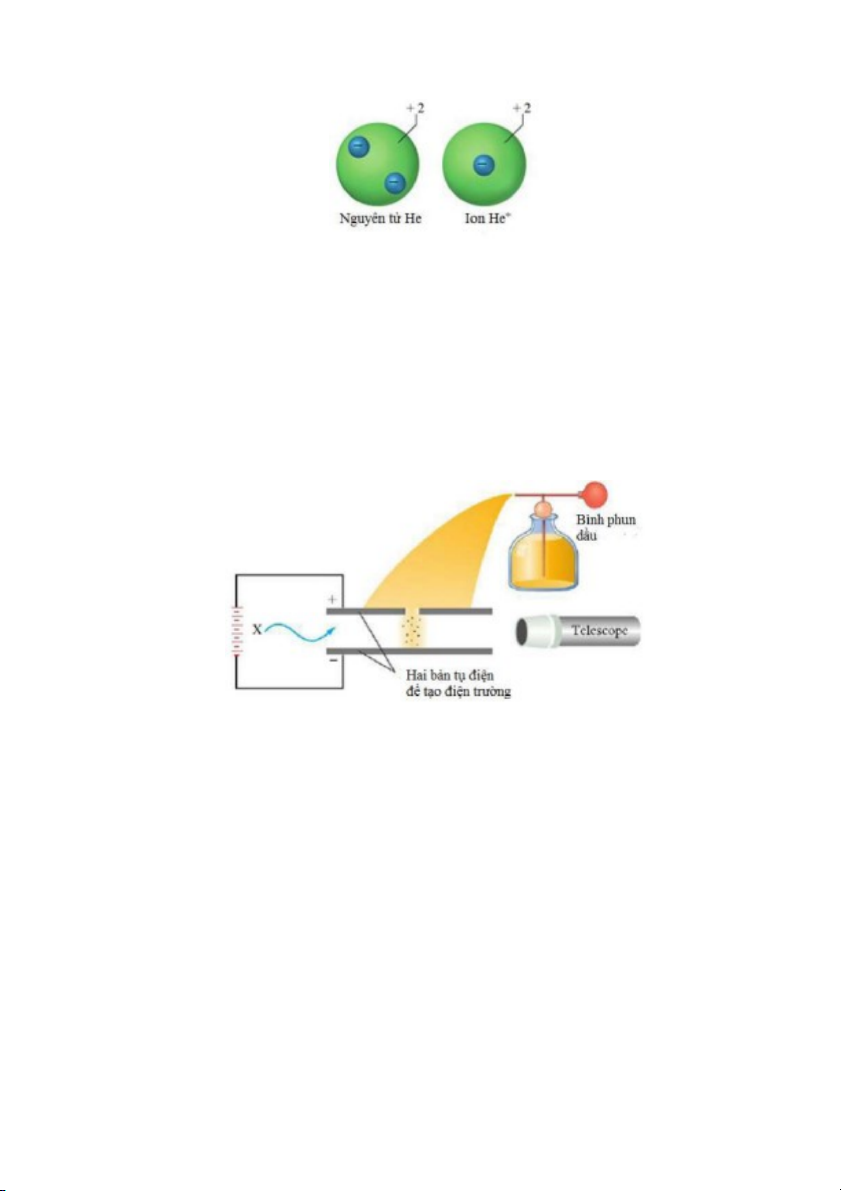
Hình 2.4. Sơ đồ thí nghiệm giọt dầu rơi của Millikan.
Năm 1909, Robert Millikan (1868–1953) làm hàng loạt thí nghiệm để quan sát các giọt dầu
tích điện rơi trong điện trường. Hình 2.4 là sơ đồ thí nghiệm của Millikan. Khi các hạt dầu không
tích điện, chúng chỉ rơi dưới tác dụng của trọng trường. Khi bắn chùm electron được tạo ra từ
nguồn phát tia X vào các hạt dầu đang rơi, các hạt dầu trở thành tích điện âm và sẽ chịu ảnh
hưởng cùng lúc của trọng trường và điện trường bên ngoài. Millikan đã thay đổi cường độ của
điện trường bên ngoài tạo bởi hai bản tụ điện để điều khiển tốc độ rơi của các hạt dầu tích điện,
đồng thời ông đo cẩn thận khối lượng và tốc độ rơi của các hạt dầu. Ông phát hiện điện tích của
các hạt dầu tích điện luôn luôn là bội số của –1.6 x 10–19 C. Sau đó, điện tích này được quy ước là
đơn vị điện tích, và cũng là điện tích của electron. Kết hợp với kết quả thực nghiệm của Thomson,
khối lượng của electron tính được là 9.11 x 10–31 kg. Như vậy, sự có mặt của electron trong nguyên
tử với khối lượng và điện tích nhất định đã được xác nhận.
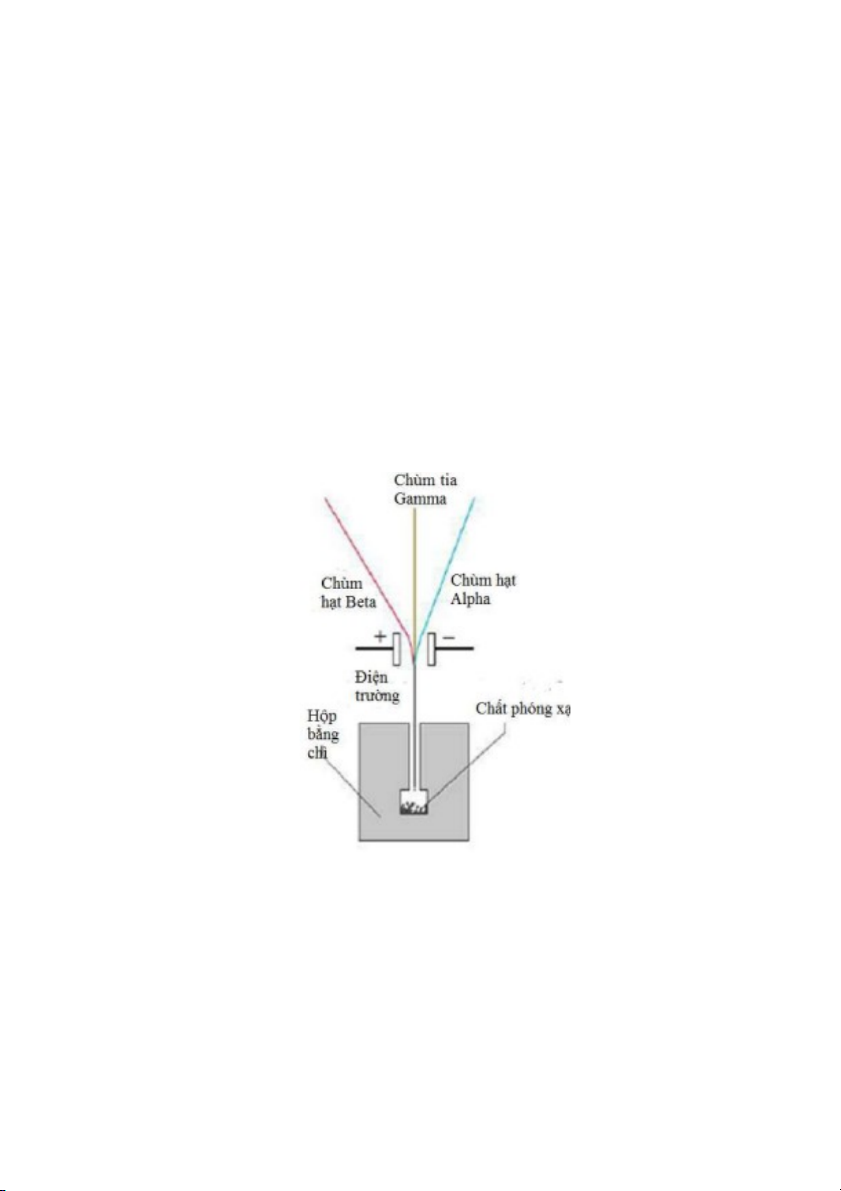
2.2.2. Hiện tượng phóng xạ tự nhiên
Cuối thế kỷ thứ XIX, Antoine Henri Becquerel (1852–1908) quan sát thấy một số chất chứa
uranium (U) có thể làm đen giấy ảnh. Sau đó, người ta biết giấy ảnh bị đen là do các chất uranium
có thể tự phát xạ ra các tia mà mắt ta không nhìn thấy. Ernest Rutherford (1871–1937) và Paul
Villard (1860–1934) đã xác định thành phần các tia đó là:
Tia alpha, ký hiệu là , là chùm của các hạt mang điện tích +2 (điện tích ngư ợc dấu và có độ
lớn gấp đôi điện tích của electron); sau này người ta biết tia alpha là chùm các hạt nhân
của nguyên tử Helium (tức là ion He2+);
Tia beta, ký hiệu là ,
là các electron có tốc độ cao;
Tia gamma, ký hiệu là ,
là sóng điện từ có năng lượng cao.
Đầu thế kỷ thứ XX, các nhà khoa học tìm thấy nhiều loại nguyên tử khác có thể tự phát xạ tương
tự như uranium. Hiện tượng các chất tự phát ra các tia , , và
được gọi là hiện tượng
phóng xạ tự nhiên; các tia , , và
được gọi là các tia phóng xạ. N goài ra, Ernest Rutherford
và Frederick Soddy (1877–1956) quan sát thấy khi nguyên tử phóng xạ, chúng chuyển thành
nguyên tử của nguyên tố khác, điều này hoàn toàn không xảy ra trong các phản 12
ứng hóa học thông thường. Nói cách khác, hiện tượng phóng xạ tự nhiên đi kèm với sự thay đổi vật
chất ở cấp độ nhỏ hơn nguyên tử; tức là nguyên tử được tạo thành từ các hạt nhỏ hơn. Đến lúc
này, sự tồn tại của các electron mang điện tích âm và các hạt mang điện tích dương đã được xác nhận.
Hình 2.5. Thành phần và tính chất của các tia phóng xạ tự nhiên khi đi qua điện trường.
2.2.3. Thuyết cấu tạo nguyên tử theo Rutherford
Hình 2.6. Sơ đồ thí nghiệm bắn chùm tia vào tấm kim loại của Rutherford.
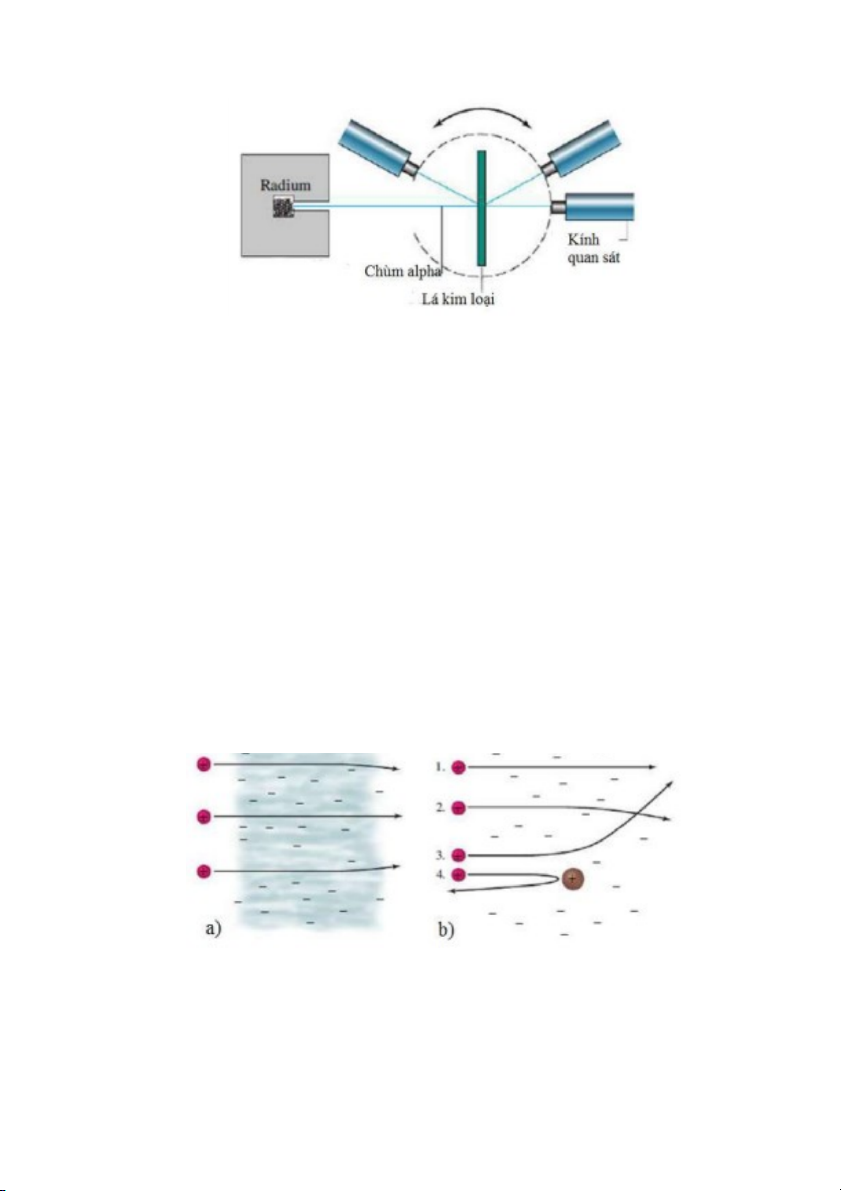
Năm 1909, Emest Rutherford và phụ tá của ông, Hans Geiger (1882–1945), thiết kế thí nghiệm để
nghiên cứu sự phân bố của electron trong nguyên tử bằng cách dùng chùm hạt bắn vào các lá
kim loại mỏng. Mô hình dụng cụ nghiên cứu được biểu diễn ở Hình 2.6, trong đó radium là nguồn phát tia . T
a có thể theo dõi chùm tia sau khi đi qua lá kim loại bằng các ống kính có màn hình
được sơn chất phát quang ZnS. Theo mô hình nguyên tử của Thomson, nhóm nghiên cứu của
Rutherford dự đoán hầu hết chùm sẽ đi xuyên thẳng qua đám mây mang điệ n 13
tích dương của nguyên tử, chỉ một phần nhỏ chùm bị lệch hướng nhẹ do v a chạm với các electron.
Tuy nhiên, Hans Geiger và Ernst Marsden, một sinh viên khác của Rutherford, đã quan sát thấy (xem Hình 2.7):
1. Hầu hết chùm tia xuyên thẳng qua lá kim loại mà không bị lệch hướ ng (Hình 2.7a và 1 trong Hình 2.7b);
2. Một phần nhỏ chùm tia bị lệch hướng nhẹ (2 trong Hình 2.7b);
3. Một phần rất ít chùm tia (khoảng 1/20000) lệch hướng đáng kể sa u khi đi qua lá
kim loại (3 trong Hình 2.7b);
4. Khoảng 1/20000 chùm tia không xuyên qua tấm kim loại, mà dội ngược tr ở lại
hướng ban đầu (4 trong Hình 2.7b).
Hình 2.7. Kết quả thí nghiệm của Rutherford và cộng sự (xem chi tiết trong bài)
Kết quả 3 và 4 trong Hình 2.7b hoàn toàn nằm ngoài dự đoán của nhóm nghiên cứu.
Rutherford cho rằng, các hạt bị phản xạ ngược theo nhiều hướn g khác nhau (3 và 4 trong
Hình 2.7b) do va chạm với các “hạt mang điện tích dương” trong lá kim loại, hay trong nguyên tử.
Vì tỷ lệ của các hạt phản xạ ngược rất thấp nên các hạt mang điện tíc h dương trong nguyên
tử phải tập trung ở vùng rất nhỏ, như vậy mô hình nguyên tử theo kiểu đám mây hình cầu tích
điện dương của Thomson là không hợp lý, hay nói cách khác, nguyên tử phải “rỗng”. Dựa vào
kết quả thí nghiệm này, năm 1911 Rutherford đề nghị mô hình nguyên tử mới (thuyết mới) như sau:
- Nguyên tử gồm hạt nhân mang điện tích dương, có kích thước rất nhỏ và nằm ở tâm
nguyên tử, phần không gian còn lại của nguyên tử là rỗng;
- Các electron mang điện tích âm chuyển động quanh nhân và ở khoảng cách khá xa so
với hạt nhân nguyên tử;
- Các nguyên tử khác nhau có điện tích hạt nhân nguyên tử khác nhau; điện tích hạt nhân
của nguyên tử bằng tổng điện tích của các electron trong nguyên tử, nhưng trái dấu, do
đó nguyên tử trung hòa điện.
Mẫu nguyên tử của Rutherford đã giải thích hợp lý các dữ kiện thực nghiệm cho đến lúc
đó về cấu trúc chung của nguyên tử. Đến nay, mô hình của Rutherford vẫn được dùng cho cấu
trúc nguyên tử theo các lý thuyết hiện đại (xem Hình 2.8 và mục 2.2.5). Tuy nhiên, một câu hỏi 14
khác mà các nhà khoa học lúc bấy giờ vẫn chưa thể trả lời thỏa đáng là: tại sao các electron
mang điện tích âm lại không rơi vào hạt nhân nguyên tử mang điện tích dương?
2.2.4. Sự khám phá proton và neutron trong nhân nguyên tử
Đầu thế kỷ thứ XX, những khám phá mới về sự phân rã phóng xạ hạt nhân nguyên tử khiến
các nhà khoa học dự đoán rằng hạt nhân nguyên tử phải được tạo thành từ những hạt nhỏ hơn.
Khi nghiên cứu tia X phát ra từ các nguyên tử khác nhau, Henry Moseley (1887–1915) đã đo được
điện tích hạt nhân nguyên tử. Kết quả thú vị là điện tích hạt nhân của các nguyên tử khác nhau
cách nhau từng đơn vị một, đơn vị đó chính bằng điện tích electron, nhưng mang điện tích dương.
Kết quả này hướng các nhà khoa học đến giả thuyết rằng hạt nhân của nguyên tử được tạo thành
từ các hạt giống nhau và mang điện tích dương +1; từ đó họ tìm cách thiết kế thí nghiệm để chứng minh giả thuyết này.
Năm 1918, Rutherford cho bắn chùm tia xuyên qua hơi của các nguyên tử nitro gen (N),
ଵଵ , và các hạt giống với hạt nhân của
ông thấy có sự tạo thành một đồng vị của oxygen, ଵ �� ଵଵ ଵ + ଵ���� ଵ �� ଵଵ + ଵ ��
nguyên tử H, phản ứng hạt nhân này được biểu diễn như sau: đó, sự tồn tại của hạt proton (ଵ �� ଵ
�� ଵ) với điện tích dương +1 được xác nhận. ଵ. Đến lúc
Khi so sánh tổng khối lượng của proton và electron với khối lượng của nguyên tử,
Rutherford và James Chadwick (1891–1974) đã nghi ngờ sự tồn tại của các hạt neutron không
mang điện trong nhân nguyên tử, nhưng việc chứng minh nghi vấn trên bằng thực nghiệm gặp khó
khăn do tính trung hòa điện của hạt neutron. Năm 1932, khi các nhà khoa học dùng hạt bắn vào
các nguyên tử beryllium (Be), họ thấy phát ra bức xạ lạ chưa từng biết tới, cho bức xạ lạ này bắn
vào parafin thì thấy tạo ra các hạt proton. Chadwick dự đoán bức xạ lạ đó là các hạt neutron không
mang điện, có khối lượng hơi lớn hơn proton. Sau đó ông thiết kế các thí nghiệm để chứng minh
đó là neutron. Như vậy đến thập niên 1930, các nhà khoa học đã biết nhân nguyên tử có hai loại
hạt chính, đó là proton và neutron.
2.2.5. Cấu tạo và các đặc trưng căn bản của nguyên tử
Bảng 2.2. Khối lượng và điện tích của các hạt proton, neutron, và electron Khối lượng Điện tích Loại hạt Ký hiệu nguyên tử Vị trí trong
Tuyệt đối (kg) Quy ước (amu)* T uyệt đối (C) Quy ước Electron e, e– –31 –19 9.1094 x 10 0.000549 –1.602 x 10 –1 Vỏ Proton p, p+ –27 –19 1.6726 x 10 1.0073 +1.602 x 10 +1 Nhân Neutron n, no 1.6749 x 10–27 1.0087 0 0 Nhân
Ghi chú: * Đơn vị khối lượng quy ước là amu, hay u (atomic mass unit); 1 amu = 1/12 khối
lượng của nguyên tử 12C = 1.660539 x10–27 kg.
Các kết quả thực nghiệm đến cuối thế kỷ thứ XIX và đầu thế kỷ thứ XX đã chứng tỏ nguyên tử
được tạo thành từ ba loại hạt chính mà các nhà hóa học quan tâm: proton, neutron, và electron.
Hiện nay, nghiên cứu các vi hạt ở mức độ sâu hơn cho thấy còn có một số loại hạt 15
khác tạo nên nguyên tử. Trong ba loại hạt đã kể trên, electron được xem là một loại hạt cơ bản
(electron là một trong sáu loại hạt lepton) – tức là không thể phân chia electron thành các hạt nhỏ
hơn. Tuy nhiên, vật lý hiện đại không xem proton và neutron là các hạt cơ bản vì chúng được tạo
thành từ các hạt nhỏ hơn, đó là quark. Quark là các hạt cơ bản. Có sáu loại quark khác nhau
được đặt tên là up, down, strange, charm, bottom, và top. Proton được tạo thành từ hai hạt quark
up và một hạt quark down, neutron được tạo thành từ một hạt quark up và hai hạt quark down.
Đến nay, bằng các máy móc đo lường hiện đại, khối lượng và điện tích của các hạt
proton, neutron, và electron đã được xác định chính xác và được dẫn trong Bảng 2.2.
Hình 2.8. Mô hình cấu tạo nguyên tử (ví dụ: nguyên tử He).
Về cấu tạo nguyên tử, hiện nay các nhà khoa học đồng ý rằng nguyên tử gồm hai phần
chính (xem Hình 2.8): phần thứ nhất là hạt nhân nguyên tử có kích thước khoảng 10–4 kích thước
nguyên tử, gồm các hạt proton mang điện dương và các hạt neutron trung hòa điện; phần thứ hai là
vỏ nguyên tử gồm các hạt electron mang điện tích âm.
Các kết quả thí nghiệm cho thấy số hạt proton trong nhân nguyên tử đúng bằng số hạt
electron ở vỏ, vì vậy nguyên tử trung hòa điện. Mỗi nguyên tử đều có khối lượng nhất định. Một
cách gần đúng, khối lượng của nguyên tử xấp xỉ bằng tổng khối lượng của các hạt tạo thành nó;
khối lượng đúng của nguyên tử sẽ được thảo luận ở mục 2.3.3. Vì khối lượng của electron chỉ
bằng khoảng 1/2000 lần khối lượng của proton và neutron, nên ta có thể bỏ qua khối lượng các
electron khi tính gần đúng khối lượng của nguyên tử. Nói cách khác, có thể coi khối lượng của
nguyên tử gần bằng tổng khối lượng của các hạt proton và neutron trong nhân nguyên tử. Do đó,
người ta dùng số khối A, bằng tổng số hạt proton và neutron trong nguyên tử, để đặc trưng cho
khối lượng tương đối của nguyên tử:
Số khối của nguyên tử (A) = số hạt proton (Z) + số hạt neutron (N)
Mỗi nguyên tử được đặc trưng bằng điện tích hạt nhân Z (chính là số hạt proton trong nhân
nguyên tử) và số khối A của nó. A và Z là các số nguyên tự nhiên vì chúng đều là số hạt. ଵ, trong
đó X là ký hiệu nguyên tố hóa học. Ví dụ, nguyên tử ଵ ��
Nguyên tử được ký hiệu là: ଵ �� ଵଵ là
nguyên tử oxygen, có ký hiệu hóa học là O, nguyên tử này có 8 proton trong nhân và số khối của nó
là 17. Từ đó, ta tính được số neutron trong nguyên tử này là 9. 16
2.3. Nguyên tố hóa học – đồng vị – nguyên tử lượng
2.3.1. Nguyên tố hóa học
Ngày nay, ta biết tất cả các nguyên tử có cùng điện tích hạt nhân, tức là cùng số proton
trong nhân và số electron ở lớp vỏ, đều có tính chất hóa học giống nhau. Các nguyên tử như vậy
thuộc cùng một nguyên tố hóa học (thường gọi vắn tắt là nguyên tố). Mỗi nguyên tố được đặc
trưng bởi số hiệu nguyên tử của nguyên tố đó, chính là điện tích hạt nhân Z của các nguyên tử tạo
nên nguyên tố hóa học. Mỗi nguyên tố được đặt tên và ký hiệu riêng. Ví dụ, oxygen gồm các
nguyên tử có điện tích hạt nhân Z = 8, và được ký hiệu là O. Đến nay, các nhà khoa học đã xác
nhận được 118 nguyên tố hóa học. Các nguyên tố có số hiệu nguyên tử cao hơn của uranium (Z =
92) không có trong tự nhiên. Chúng là các nguyên tố nhân tạo, được các nhà khoa học tạo thành
từ các phản ứng tổng hợp hạt nhân. 2.3.2. Đồng vị
Các kết quả nghiên cứu cho thấy các nguyên tử của cùng một nguyên tố hóa học có thể có khối
lượng nguyên tử không bằng nhau do số neutron trong nguyên tử khác nhau. Tập hợp của các
nguyên tử có cùng khối lượng của một nguyên tố, nghĩa là có cùng số proton và neutron, được gọi
là một đồng vị của nguyên tố đó. Thuật ngữ “đồng vị” ngụ ý tất cả các đồng vị khác nhau của một
nguyên tố đều có “cùng một vị trí” trong bảng phân loại tuần hoàn. Hầu hết các nguyên tố hóa học
đều có nhiều đồng vị có trong tự nhiên, thường được gọi vắn tắt là đồng vị tự nhiên. Ví dụ, nguyên
tố neon có ba đồng vị tự nhiên (hay ba loại nguyên tử): ଵଵ ଵଵ
���� ଵଵ, ଵଵ���� , và ଵଵ ଵଵ����
. Trong tất cả các nguyên tử neon có trong tự nhiên, có 90.51% số nguyên tử là ଵଵ ଵଵ
ଵଵ���� , 0.27% là ଵଵ�
��� ଵଵ , và 9.22% là ଵଵ���� . Lưu ý rằng phần trăm của các
đồng vị luôn được tính trên số nguyên tử, không tính trên khối lượng. Một số nguyên tố chỉ có một
đồng vị trong tự nhiên, khi đó phần trăm của đồng vị là 100%. Ví dụ, người ta biết hai loại nguyên
tử nhôm trong tự nhiên, ���� ଵଵ ଵଵ ଵଵ ଵଵ và ���� ଵଵ
. Tuy nhiên, các nguyên tử ���� ଵଵ là
sản phẩm từ sự bắn phá của proton từ vũ trụ vào các nguyên tử argon (Ar), bản thân nguyên tử ���� ଵଵ ଵଵ ଵଵ
lại phóng xạ tự nhiên nên
���� ଵଵ chỉ có mặt trong tự nhiên ở lượng vô cùng
nhỏ, còn được gọi là lượng vết, vì vậy đồng vị � ��� ଵଵ
ଵଵ thường không được kể đến. Người ta
xem tất cả các nguyên tử nhôm trong tự nhiên đều là ���� ଵଵ ଵଵ .
Các đồng vị tự nhiên của một nguyên tố hóa học có thể bền, hoặc phóng xạ tự nhiên (hay
không bền). Hạt nhân nguyên tử của các đồng vị phóng xạ tự nhiên tự phân hủy dần và chuyển
thành hạt nhân của các nguyên tố hóa học khác, đồng thời phát ra các tia phóng xạ. Đến nay, người
ta biết các hạt nhân nguyên tử có điện tích hạt nhân cao hơn của chì (Pb, Z = 82) đều phóng xạ tự
nhiên và chuyển thành các hạt nhân khác. Tương quan giữa số neutron và proton trong các đồng vị
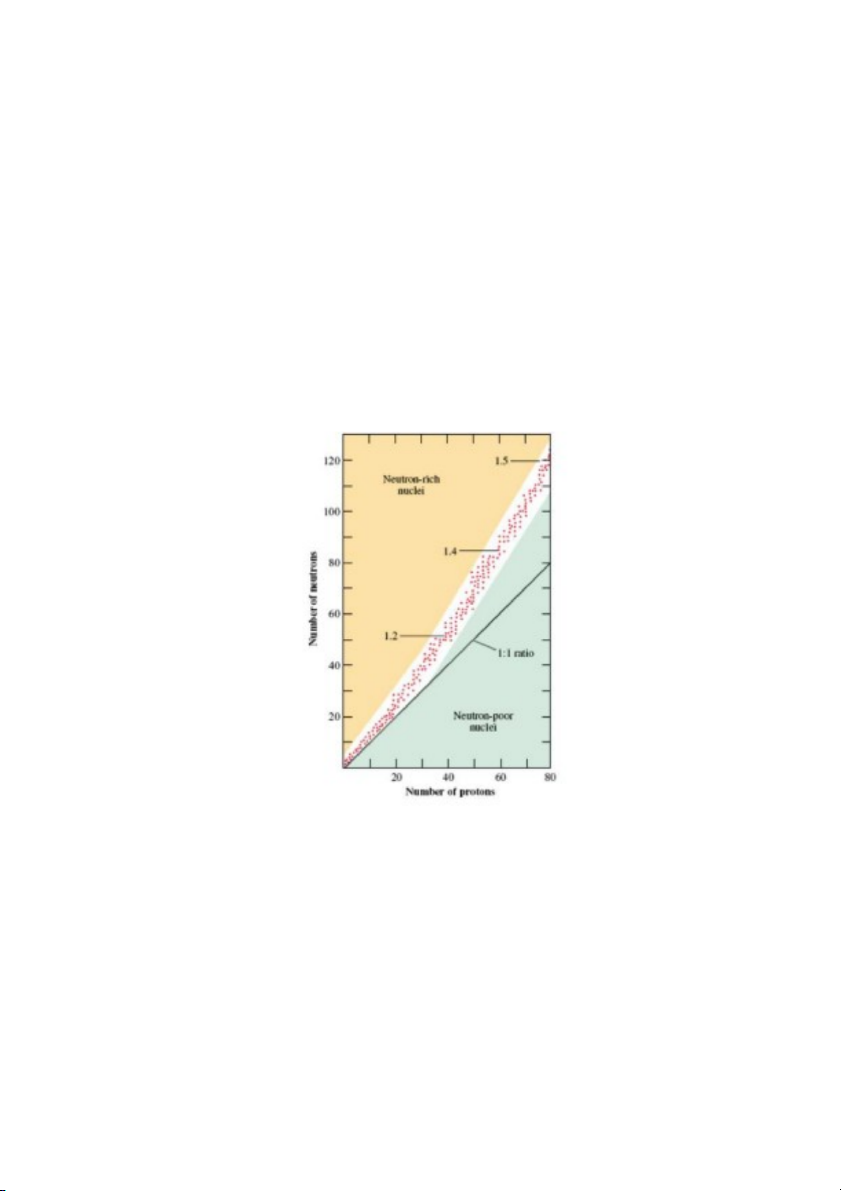
tự nhiên bền được thống kê và biểu diễn trong Hình 2.9: vùng màu trắng với các chấm đỏ là vùng
của các đồng vị bền, phía trên đó là vùng các hạt nhân giàu neutron (neutron-rich nuclei), phía dưới
là vùng các hạt nhân nghèo neutron (neutron-poor nuclei). Như vậy, các nguyên tử có hạt nhân giàu
hoặc nghèo neutron đều không bền, các nguyên tử này phân rã phóng xạ tự nhiên. Để ý, các đồng
vị bền luôn có tỷ số N/Z ≥ 1. Các đồng vị bền có N/Z = 1 chỉ gặp ở những nguyên tố tương đối nhẹ.
Khi điện tích hạt nhân nguyên tử tăng, tỷ số N/Z của các đồng vị bền tăng dần, và đạt đến khoảng
1.5 ở các nguyên tử có điện tích hạt nhân nguyên tử xấp xỉ 80. 17
Hình 2.9. Tương quan giữa số neutron và proton
của các đồng vị nguyên tử bền trong tự nhiên (xem chi tiết trong bài).
2.3.3. Xác định khối lượng nguyên tử - phổ khối lượng
Hình 2.10. Sơ đồ máy khối phổ dùng để xác định khối lượng các đồng vị nguyên tử.
Các dữ liệu thực nghiệm cho thấy khối lượng chính xác của nguyên tử hơi nhỏ hơn tổng khối
lượng của tất cả các proton, neutron, và electron tạo thành nguyên tử. Sự khác biệt giữa tổng khối
lượng của các hạt tạo thành nguyên tử và khối lượng thật của nguyên tử được gọi là độ hụt khối
lượng hay vắn tắt là độ hụt khối. Các nhà khoa học cho rằng khi các proton và neutron kết hợp với
nhau để tạo thành hạt nhân nguyên tử, một phần khối lượng của các hạt này đã chuyển thành
năng lượng liên kết hạt nhân. Năng lượng liên kết hạt nhân lớn hơn rất 18
nhiều so với lực vạn vật hấp dẫn hay lực tĩnh điện, nó đủ mạnh để giữ các proton đều có điện tích
dương và các neutron trung hòa điện với nhau để tạo thành hạt nhân nguyên tử. Chính vì sự
chuyển hóa khối lượng thành năng lượng như vậy, nguyên tử có khối lượng nhỏ hơn tổng khối
lượng các hạt tạo thành. Tuy nhiên, ta không thể dự đoán chính xác phần giảm khối lượng
cho từng loại nguyên tử. Vì vậy, khối lượng đúng của nguyên tử phải được xác định từ thực nghiệm.
Những thí nghiệm trước đây của Dalton, Gay-Lussac, và Cannizzaro chỉ xác định được khối
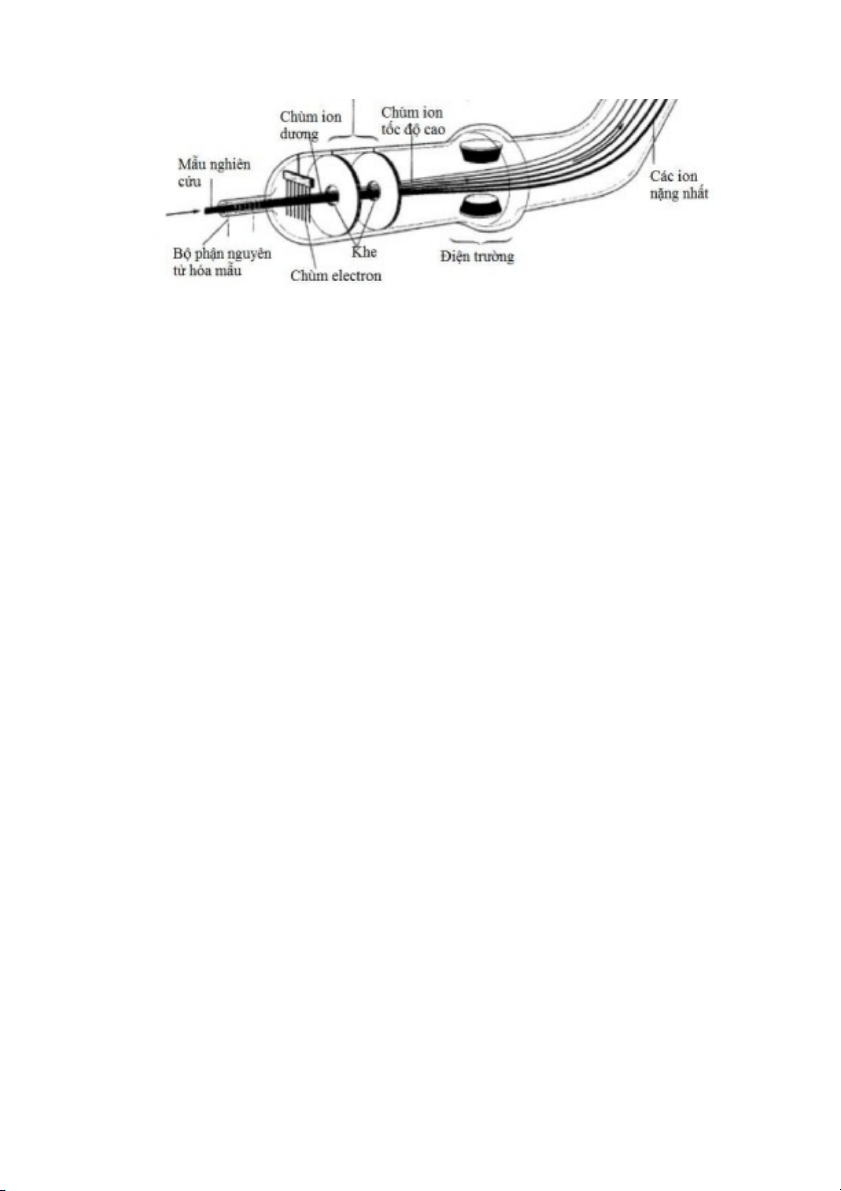
lượng tương đối của nguyên tử. Hiện nay, dụng cụ chính xác nhất để đo khối lượng nguyên tử là
máy khối phổ, sơ đồ của máy được trình bày trong Hình 2.10. Để đo khối lượng của nguyên tử,
mẫu nghiên cứu được làm bay hơi (hay còn gọi là nguyên tử hóa) và bắn phá bởi chùm electron có
năng lượng cao. Kết quả là một số electron bị bắn ra khỏi nguyên tử, phần còn lại là các ion dương.
Các ion dương tạo thành được cho đi qua điện trường thứ nhất để tăng tốc độ. Sau đó, các ion
dương với tốc độ nhất định tiếp tục đi qua điện trường thứ nhì đặt vuông góc với đường đi của
chúng để tách thành các chùm ion có khối lượng và điện tích khác nhau. Mỗi chùm ion dương với tỷ
lệ khối lượng và điện tích riêng biệt sẽ tới đầu dò ion ở các vị trí khác nhau (xem Hình 2.11a), càng
nhiều ion tới một vị trí nào đó của đầu dò thì cường độ mũi phổ ở đó càng cao. Vì khối lượng
electron rất nhỏ so với khối lượng của proton và neutron (xem mục 2.2.5) nên khối lượng của ion và
của nguyên tử tương ứng là xấp xỉ bằng nhau. Do đó, vị trí của các ion trong khối phổ cũng là vị trí
của các đồng vị nguyên tử tương ứng. Dữ liệu phổ thu được gồm phần trăm số nguyên tử (hoặc số
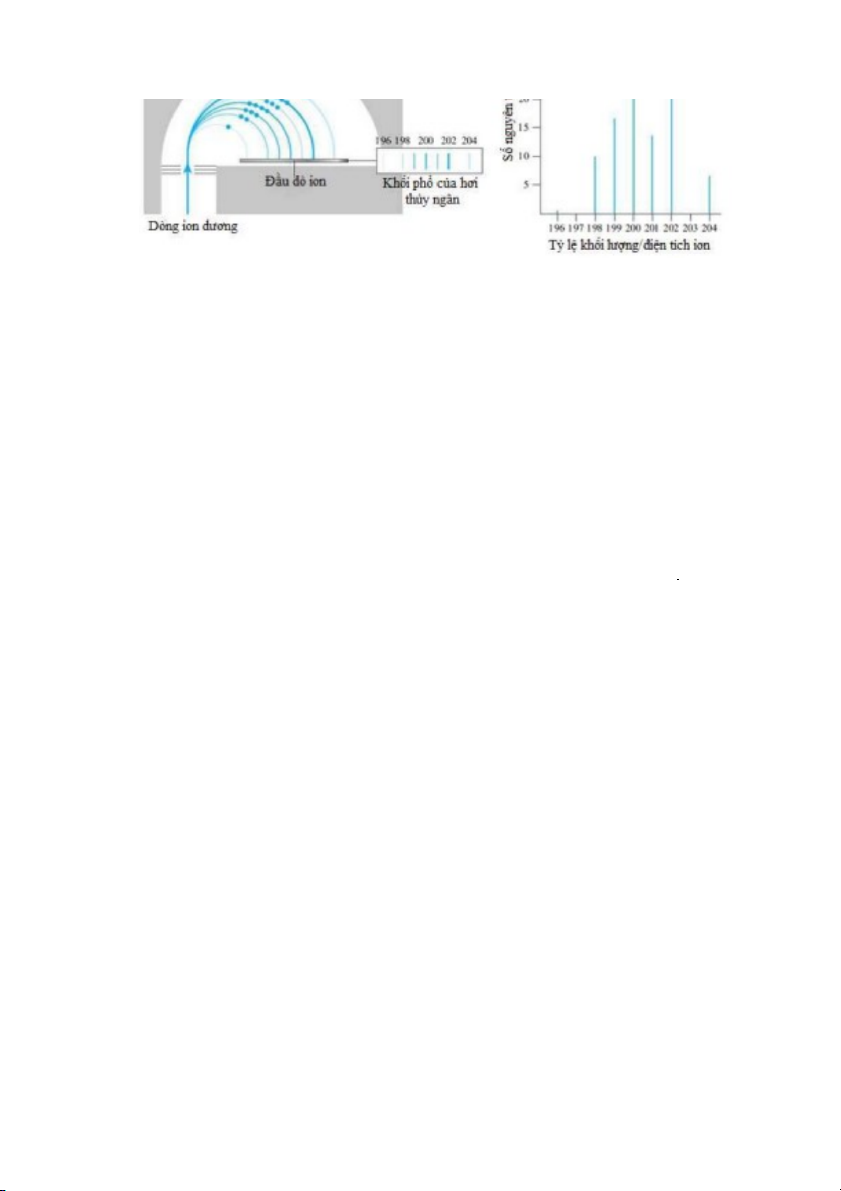
nguyên tử) và số khối của mỗi đồng vị, được biểu diễn thành sơ đồ khối phổ (hay phổ khối lượng)
như ví dụ trong Hình 2.11b. Hình 2.11b cho thấy khối phổ của thủy ngân gồm 6 mũi với phần trăm
số nguyên tử như sau: 0.146% 196Hg, 10.02% 198Hg, 16.84% 199Hg, 23.13% 200Hg, 13.22% 201Hg,
29.80% 202Hg, và 6.85% 204Hg.
Hình 2.11. a) Sơ đồ sự phân tách các đồng vị của thủy ngân trong máy khối phổ; b) Khối phổ của thủy ngân.
Việc tiếp theo là tìm khối lượng nguyên tử của từng đồng vị. Lưu ý rằng kết quả từ phổ khối lượng
nói trên chỉ cho ta biết phần trăm số nguyên tử và số khối của mỗi đồng vị. Số khối là các số
nguyên vì chúng là tổng số các hạt proton và neutron trong hạt nhân nguyên tử, nhưng khối lượng
nguyên tử của các đồng vị theo đơn vị amu hay kg đều không phải là số nguyên (trừ khối lượng
của nguyên tử 12C là 12 amu). Để xác định khối lượng đúng của mỗi nguyên tử (hay mỗi đồng vị),
người ta chọn khối lượng của một nguyên tử nào đó làm chuẩn, rồi từ khối phổ, ta 19
xác định chính xác tỷ lệ khối lượng của nguyên tử đó với khối lượng nguyên tử được chọn làm
chuẩn. Nguyên tử 12C là nguyên tử được chọn làm khối lượng chuẩn, với khối lượng là 12 amu. ଵଵ
Ví dụ, tỷ lệ khối lượng của các nguyên tử 16O và 12C được xác định từ khối phổ là ଵଵ = ଵ ଵ
1.33291, vậy khối lượng của nguyên tử 16O là m16O = 1.33291*12 amu = 15.9949 amu (số này rất
gần với số khối của nguyên tử 16O là 16). Bằng cách như vậy, người ta xác định được khối lượng
chính xác tính của từng nguyên tử theo đơn vị khối lượng quy ước (amu).
2.3.4. Nguyên tử lượng của nguyên tố hóa học
Mỗi nguyên tố hóa học trong tự nhiên thường là tập hợp của nhiều đồng vị nên khối lượng nguyên
tử dùng để cân đong trong thực tế là khối lượng nguyên tử trung bình có tính đến thành phần của
các đồng vị, được gọi là nguyên tử lượng trung bình, hay vắn tắt là nguyên tử lượng. Nếu gọi khối
lượng nguyên tử của đồng vị thứ i là mi và tỷ lệ thành phần nguyên tử của nó là xi, nguyên tử lượng
M của một nguyên tố nào đó được tính theo công thức (2.1):
M = x1 m1 + x2 m2 + x3 m3 + ... (2.1)
với: x1 + x2 + x3 + ... = 1 (2.2)
Ví dụ, kết quả phân tích khối phổ của nguyên tố carbon cho thấy có hai loại đồng vị carbon trong
tự nhiên, 98.93% các nguyên tử carbon là 12C với khối lượng nguyên tử là 12 amu (chính là khối
lượng quy ước), phần còn lại là các nguyên tử 13C với khối lượng được xác định từ khối phổ là
13.0033548378 amu. Do đó, nguyên tử lượng của carbon tính theo amu là:
MC = 0.9893 * 12 amu + (1 - 0.9893) * 13.0033548378 amu = 12.0107 amu
Nguyên tử lượng của các nguyên tố hóa học thường được ghi trong bảng phân loại tuần
hoàn. Trong các bảng tra cứu nguyên tử lượng, ta có thể thấy một số nguyên tố hóa học có nguyên
tử lượng với độ chính xác cao hơn những nguyên tố khác. Ví dụ, nguyên tử lượng của fluorine (F)
lại bao quanh nhân, electron ngoài cùng sẽ bị “hạt nhân tổng hợp” hút với điện tích hạt nhân hiệu
dụng – được ký hiệu là Z* hay Zeff – nhỏ hơn điện tích hạt nhân thực sự (Z = 3) của nguyên tử Li.
Nói cách khác, do các electron bên trong “che chắn” lực hút của nhân với electron bên ngoài nên
electron bên ngoài được nhân nguyên tử hút bằng điện tích hạt nhân hiệu dụng nhỏ hơn điện tích
hạt nhân thực sự của nguyên tử. Thuật ngữ hóa học gọi khái niệm này là hiệu ứng chắn (shielding
effect), hiệu ứng chắn càng mạnh, electron bên ngoài càng bị nhân hút yếu. Bằng cách như vậy, mô
hình nguyên tử đang xét trở thành “một nhân một electron”, tức là tương tự nguyên tử H. Mô hình
đơn giản hóa này cho phép ta khảo sát và giải phương trình Schrödinger cho từng electron trong
nguyên tử. Tiêu chuẩn thực nghiệm để kiểm tra độ chính xác và tính hợp lý của các phương trình
Schrödinger và kết quả tính toán là phổ nguyên tử, năng lượng ion hóa, cũng như hoạt tính hóa học của các nguyên tố. 46
Hình 3.16. Sơ đồ biểu diễn mật độ phân bố electron theo khoảng cách tới nhân nguyên tử cho các
orbital khác nhau trong nguyên tử có nhiều electron.
Với phương pháp gần đúng như vậy, kết quả giải phương trình Schrödinger cho các nguyên tử có nhiều
electron cũng tương tự như cho nguyên tử hydrogen, tức là chuyển động của các electron trong nguyên tử được
mô tả bởi các hàm sóng được đặc trưng bởi bộ ba số lượng tử (n, ℓ, m
ℓ) có ý nghĩa giống như trong trường hợp nguyên tử hydrogen.
Hình 3.16 biểu diễn kết quả tính mật độ phân bố electron trên các orbital khác nhau trong nguyên tử có
nhiều electron. Dễ dàng thấy với n = 2, đường phân bố mật độ electron của orbital 2p có một cực đại, nhưng của
orbital 2s có hai cực đại: một cực đại lớn ở khoảng cách xấp xỉ với cực đại của orbital 2p, và một cực đại nhỏ ở rất
gần nhân. Kết quả tính toán chi tiết cho thấy mật độ electron ở khoảng cách gần nhân trên orbital 2s cao hơn trên
orbital 2p. Người ta nói rằng, electron trên orbital 2s “xuyên thấu vào nhân” nhiều hơn electron trên orbital 2p.
Tương tự như vậy, electron trên orbital 3s xuyên thấu vào nhân nhiều hơn trên 3p, và 3p xuyên thấu hơn 3d. Tổng
quát, với các orbital có cùng số lượng tử chính n thì ℓ càng nhỏ, electron trên nó càng xuyên thấu vào nhân nhiều
hơn. Electron càng xuyên thấu vào nhân thì càng được nhân hút mạnh hơn, kết quả là năng lượng của electron
trên các orbital thuộc cùng một lớp không bằng nhau nữa, cụ thể là năng lượng của electron trên orbital 2s hơi thấp
hơn 2p, trên 3s hơi thấp hơn 3p và 3d. Đây là kết quả khác biệt đáng lưu ý về năng lượng của electron trên các AO
của nguyên tử hydrogen và các nguyên tử có nhiều electron. Kết quả này được minh họa trong Hình 3.17, trong đó
biểu diễn sơ đồ các mức năng lượng của các orbital trong nguyên tử hydrogen và một số nguyên tử có nhiều
electron khác. Ngoài ra, do sự kết hợp đồng thời của hai yếu tố, (i) sự khác biệt năng lượng giữa các lớp giảm dần
khi số lượng tử chính n tăng (vì năng lượng của các lớp tỷ lệ với –1/n2), và (ii) tính xuyên thấu mạnh của orbital s so
với các orbital p và d, dẫn đến có sự chồng lấp các mức năng lượng ở các lớp n cao. Ví dụ, nhiều nguyên tử thuộc
chu kỳ 4 có năng lượng orbital 3d và 4s xấp xỉ nhau (sẽ đề cập ở phần sau), đặc biệt, nguyên tử kalium (K) và
calcium (Ca) có năng lượng orbital 4s thấp hơn orbital 3d (xem sơ đồ năng lượng của K trong Hình 3.17). 47 Hình 3.17.
Sơ đồ các mức năng lượng của electron trên các orbital trong nguyên tử hydrogen và một số
nguyên tử khác có nhiều electron: Li, Na, và K.
Ngoài ra, tương tự như với nguyên tử hydrogen, electron trong nguyên tử có nhiều
electron cũng có số lượng tử spin, do đó mỗi electron được đại diện bởi một bộ gồm bốn số lượng
tử (n, ℓ, mℓ, ms) viết theo đúng trật tự đó. Trong nguyên tử hydrogen, ta đã thấy electron duy nhất
chiếm orbital 1s có năng lượng thấp nhất ứng với trạng thái bền của nguyên tử. Vậy với nguyên tử
có nhiều electron, các electron sẽ chiếm những orbital nào khi nguyên tử ở trạng thái nền? Ta sẽ
tìm hiểu câu trả lời cho câu hỏi này trong phần cấu hình electron của nguyên tử nhiều electron.
3.5.2. Cấu hình electron của nguyên tử có nhiều electron
Tương tự như trường hợp nguyên tử hydrogen, các nguyên tử có nhiều electron cũng có
một trạng thái nền, trạng thái ứng với năng lượng thấp nhất, và nhiều trạng thái kích thích khác
nhau. Vì vậy ta quy ước rằng khi nói “cấu hình electron nguyên tử” là nói cấu trúc electron của
nguyên tử cô lập ở trạng thái nền. Cấu hình electron nguyên tử là một trong các kết quả từ việc giải
phương trình Schrödinger, kết quả này chỉ có giá trị khi phù hợp với các dữ liệu thực nghiệm về phổ
nguyên tử, đồng thời phản ảnh được mối liên quan giữa cấu trúc nguyên tử và hóa tính của nó, đặc
biệt đối với những nguyên tố hóa học có hóa tính tương tự nhau. . Hiện nay, cấu trúc electron của
tất cả các nguyên tử từ chu kỳ 1 đến cuối chu kỳ 7 của bảng phân loại tuần hoàn đã được xác nhận
và có thể tìm thấy trong các bảng tra cứu. Trong tài liệu này, cấu hình electron lớp ngoài cùng và
phân lớp đang xây dựng (xem chi tiết các khái niệm này ở mục 3.6) của các nguyên tử được ghi
trong bảng phân loại tuần hoàn ở Bảng 4.2. Về phương diện lý thuyết và thực hành, người ta rất
muốn có các quy tắc để viết được cấu hình electron nguyên tử một cách dễ dàng mà không phải
học thuộc lòng hay tra cứu bảng. Sau đây là các quy tắc có tính hướng dẫn để viết cấu hình
electron nguyên tử của các nguyên tử có nhiều electron, và sau đó là cấu hình electron của chúng.
3.5.2.1. Các quy tắc hướng dẫn để viết cấu hình electron nguyên tử
1. Quy tắc năng lượng bền vững:
Quy tắc này dựa trên định luật về năng lượng và được áp dụng vào cấu hình electron nguyên tử
như sau: ở trạng thái cơ bản và cô lập, các electron trong nguyên tử chiếm các orbital sao cho
nguyên tử đạt trạng thái năng lượng thấp nhất, nguyên tử bền nhất. Kinh nghiệm cho 48
thấy, trừ một số trường hợp ngoại lệ, các electron sẽ lần lượt chiếm đầy các orbital nguyên tử theo thứ tự sau:
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s (3.26)
Dãy orbital trên còn được gọi là dãy quy tắc kinh nghiệm Klechkowski. Có thể dùng sơ đồ ở
Hình 3.18 để dễ dàng viết được dãy trên. Theo sơ đồ, trật tự các orbital được viết theo chiều mũi
tên từ trên xuống, từ đuôi đến đầu mũi tên.
Hình 3.18. Sơ đồ kinh nghiệm trật tự điền electron vào các orbital nguyên tử. 2.
Nguyên lý loại trừ Pauli:
Như đã giới thiệu ở phần 3.4, mỗi electron đều có moment từ nội tại, dẫn đến số lượng tử
spin đặc trưng cho electron. Để ứng dụng số lượng tử spin cho nguyên tử nhiều electron,
Wolfgang Pauli (1900–1958) đề nghị rằng trong một nguyên tử không thể có hai electron có cùng
bốn số lượng tử. Nguyên tắc đó được gọi là nguyên lý loại trừ Pauli.
Nếu có hai electron trong cùng một orbital, đương nhiên chúng được gán cho ba số lượng
tử orbital n, ℓ, và mℓ giống nhau, vì vậy chúng phải có spin ms khác nhau. Vì chỉ có hai giá trị spin
khác nhau (1/2 và -1/2) nên hệ quả của nguyên lý loại trừ Pauli là mỗi orbital nguyên tử chỉ có thể
chứa tối đa hai electron với spin khác nhau. Ngoài ra, để thuận tiện cho việc biểu diễn spin của
electron, các electron có spin giống nhau được quy ước biểu diễn bằng các mũi tên (hoặc các nửa
mũi tên) cùng chiều, hai electron có spin khác nhau được biểu diễn bằng hai mũi tên ngược chiều nhau. 3. Quy tắc Hund:
Từ quan sát thực tế, năm 1927, Friedrich Hund (1896 – 1997) nêu quy luật sắp xếp các
electron vào các orbiral có năng lượng bằng nhau, được gọi là quy tắc Hund. Quy tắc Hund cho
các nguyên tử ở trạng thái nền như sau: khi có nhiều electron xếp vào cùng một phân lớp với
nhiều orbital có năng lượng bằng nhau (ví dụ, phân lớp 2p có ba orbital có năng lượng bằng
nhau), các electron có khuynh hướng phân bố đều vào các orbital sao cho tổng spin của các
electron trong nguyên tử là cực đại để tương tác đẩy giữa các electron trong cùng phân lớp là thấp nhất.
3.5.2.2. Viết cấu hình electron nguyên tử
Như đã biết, electron duy nhất trong nguyên tử hydrogen chiếm orbital 1s là orbital có
năng lượng thấp nhất. Cấu hình electron của nguyên tử hydrogen được viết là H: 1s1. 49
Áp dụng ba quy tắc đã nói trên, ta có thể viết cấu hình electron nguyên tử của các nguyên tố
tiếp theo. Helium (He) có hai electron trong nguyên tử, theo quy tắc năng lượng bền vững và
nguyên lý loại trừ Pauli, cấu hình electron của He là: 1s2. Hai electron trong nguyên tử He chiếm
cùng một orbital nên có spin khác nhau, tổng spin của các electron trong nguyên tử He là S = 1/2 + (–1/2) = 0.
Nguyên tử lithium (Li) có ba electron, sau khi hai electron đầu tiên đã chiếm đầy orbital 1s,
electron thứ ba phải vào orbital có năng lượng cao hơn, orbital 2s. Cấu hình electron nguyên tử của
Li là: 1s2 2s1. Như vậy nguyên tử Li có tổng spin của các electron là S = 1/2.
Nguyên tử beryllium (Be) với bốn electron, có cấu hình electron là: 1s2 2s2, tổng spin
electron của nguyên tử Be là S = 0. Dễ dàng nhận thấy, các lớp và phân lớp chứa đầy electron có
tổng spin của các electron là S = 0.
Nguyên tử boron (B) với năm electron có cấu hình electron là B: 1s2 2s2 2p1, tổng spin của
các electron của nguyên tử Bo có thể xác định từ phân lớp 2p chưa đầy đủ electron là S = 1/2.
Nguyên tử carbon (C) có sáu electron: hai electron đầu tiên chiếm orbital 1s, hai electron kế
tiếp chiếm orbital 2s, và hai electron còn lại chiếm các orbital 2p. Vì có ba orbital 2p có cùng mức
năng lượng nên theo quy tắc Hund, cấu hình electron của nguyên tử C là:
Cấu hình electron của nguyên tử C thường được viết vắn tắt là: C: 1s2 2s2 2p2; hay chi tiết hơn, C: 1s2 1 1
2s2 2px 2py . Nguyên tử carbon như vậy có hai electron độc thân, tổng spin của các
electron của nguyên tử C là S = 1.
Tương tự như vậy, cấu hình electron của các nguyên tử nitrogen (N), oxygen (O),
fluorine (F), và neon (Ne) lần lượt là: N: 1s2 2s2 2p3 O: 1s2 2s2 2p4 F: 1s2 2s2 2p5 Ne: 1s2 2s2 2p6
Đến nguyên tử Ne, 10 electron đã sắp đầy phân lớp 2p. Nguyên tử natrium (Na) có 11
electron, mười electron đầu tiên của nguyên tử Na sắp xếp giống như của nguyên tử Ne, electron
thứ 11 của nguyên tử Na chiếm orbital 3s. Vậy cấu hình electron của nguyên tử Na là: 1s2 2s2 2p6
3s1. Để cho gọn, người ta cũng biểu diễn cấu hình electron của nguyên tử Na dưới dạng: [Ne] 3s1.
Tương tự như trên, cấu hình electron của nguyên tử magnesium (Mg) là [Ne] 3s2, của nguyên tử
nhôm (Al) là [Ne] 3s2 3p1. Từ silicon (Si) đến argon (Ar), cấu hình electron của các nguyên tử sẽ thay đổi dần từ 3p2 6
đến 3p . Như vậy, các nguyên tử từ Na đến Ar (có điện tích hạt nhân Z từ 11 –
18) có cấu hình electron các lớp bên trong (lớp 1 và lớp 2) giống nhau và giống cấu hình electron
của nguyên tử Ne, chúng chỉ khác nhau cấu hình electron của lớp ngoài cùng 50
(lớp 3). Để cho ngắn gọn mà vẫn chỉ ra được sự khác biệt quan trọng trong cấu hình electron
giữa các nguyên tử, đôi khi người ta chỉ viết cấu hình electron lớp ngoài cùng của chúng. Cấu
hình electron lớp ngoài cùng của các nguyên tử từ Na đến Ar được tóm tắt như sau: Na 3s1 2 2 1 2 2 2 3 2 4 2 5 2 6 Mg 3s 3s 3p 3s 3p 3s 3p 3s 3p 3s 3p 3s 3p Si P S Cl Ar Al
Tổng spin 1/2 0 1/2 1 3/2 1 1/2 0
Cấu hình electron của nguyên tử Ar đã bão hòa các phân lớp 3s và 3p, vì vậy hai nguyên tố
tiếp theo, kalium (K, Z = 19) và calcium (Ca, Z = 20) lần lượt có cấu hình electron nguyên tử là: K: [Ar] 4s1 2 Ca: [Ar] 4s
Kalium và calcium là hai nguyên tử có orbital thuộc phân lớp 4s có năng lượng thấp hơn phân lớp
3d như đã đề cập ở mục 3.5.1. Mười nguyên tố theo sau đó, từ scandium (Sc) đến kẽm (Zn) – các
nguyên tử có điện tích hạt nhân nguyên tử từ 21 đến 30 – có electron nguyên tử tiếp tục xếp vào
các orbital 3d, tức là chúng có cấu hình electron nguyên tử dạng [Ar] 4s2 3d1-10. Sau đây là cấu hình
electron nguyên tử trong thực tế của các nguyên tử từ Sc đến Zn:
Có hai điểm đáng lưu ý trong cấu hình electron nguyên tử của dãy trên. Điểm thứ nhất, nếu viết
theo quy tắc kinh nghiệm Klechkowski, ta thường viết là [Ar] 4s2 3d1-10, nhưng cấu hình electron của
dãy trên được viết theo kiểu [Ar] 3d1-10 4s1-2. Cả hai cách viết trên đều được dùng. Cách viết thứ
nhất thuận tiện khi ta viết liền mạch cấu hình electron nguyên tử theo kinh nghiệm Klechkowski.
Thực tế thấy rằng khi các nguyên tử trong dãy Sc – Zn bị ion hóa, các electron trên orbital 4s của
chúng sẽ bị mất đầu tiên, ví dụ, các nguyên tử sắt và kẽm sau khi mất hai electron 51
sẽ có cấu hình electron của các ion cô lập là Fe2+: [Ar] 3d6, và Zn2+: [Ar] 3d10. Do đó, cách viết
cấu hình electron thứ nhì thuận tiện vì các electron được xếp theo lớp, các electron thuộc lớp
ngoài cùng sẽ bị mất trước khi nguyên tử bị ion hóa.
Ngoài ra, các nhà Hóa học thường chấp nhận hai giả định: (i) khi nguyên tử bị ion hóa,
electron có năng lượng cao nhất sẽ bị mất trước, (ii) không có sự sắp xếp lại của các electron trong
nguyên tử sau khi nguyên tử bị ion hóa. Áp dụng hai giả định đó vào các nguyên tử trong dãy Sc –
Zn, các electron trên orbial 4s được cho là có năng lượng hơi cao hơn các electron trên orbital 3d,
trái ngược với trường hợp của hai nguyên tử K và Ca. Như đã nói trong mục 3.5.1, năng lượng của
các orbital 3d và 4s là xấp xỉ nhau, các nguyên tử trong dãy Sc – Zn có điện tích hạt nhân lớn hơn
hai nguyên tử K và Ca, do đó hạt nhân của các nguyên tử Sc – Zn hút các electron trên orbital 3d
mạnh hơn so với hạt nhân của K và Ca. Kết quả là các nguyên tử trong dãy Sc – Zn có xác suất bắt
gặp electron cao nhất của các electron trên orbital 3d trở nên gần nhân hơn so với các electron trên
orbital 4s, và vì vậy lực chắn của các electron 3d lên 4s thắng thế so với tính xuyên thấu của
electron trên orbital 4s, do đó electron trên orbital 4s được nhân hút kém hơn trên orbital 3d, dẫn
đến năng lượng của orbital 4s cao hơn 3d. Vì vậy, cấu hình electron nguyên tử viết theo cách thứ
nhì nói trên cũng được gọi là cấu hình electron viết theo trật tự năng lượng.
Điểm thứ hai, dễ dàng nhận thấy sự phân bố electron trên các orbital 3d và 4s của nguyên
tử chromium (Cr) và đồng (Cu) không theo đúng quy tắc kinh nghiệm Klechkowski. Như ta sẽ thấy ở
bảng phân loại tuần hoàn trong Chương 4, nhiều nguyên tử trong bảng phân loại tuần hoàn có cấu
hình electron nguyên tử trong thực tế không đúng với dự đoán theo quy tắc Klechkowski. Lưu ý
rằng, quy tắc Klechkowski chỉ là quy tắc kinh nghiệm giúp ta dễ dàng viết được cấu hình electron
nguyên tử của hầu hết các nguyên tố hóa học; trong thực tế, electron trong nguyên tử phân bố sao
cho tổng năng lượng của nguyên tử là thấp nhất, tức là theo đúng quy tắc năng lượng bền vững đã
đề cập ở phần trên. Cho đến nay, ta vẫn chưa định lượng được một cách chính xác tương tác giữa
các electron và nhân nguyên tử trong các nguyên tử có nhiều electron, do đó ta vẫn chưa có mô
hình nào có thể dự đoán đúng cấu trúc electron của tất cả các nguyên tử. Vì vậy, ta chấp nhận dùng
quy tắc Klechkowski để dự đoán cấu hình electron của các nguyên tử với một số ngoại lệ.
Tiếp tục tương tự như trên, có thể dùng quy tắc Klechkowski để viết cấu hình electron
nguyên tử của hầu hết các nguyên tố còn lại:
Từ gallium (Ga, Z = 31) đến krypton (Kr, Z = 36), các electron điền vào phân lớp 4p, cấu
hình electron nguyên tử của nguyên tố cuối cùng trong dãy này là Kr: [Ar] 3d10 4s2 4p6.
Chuỗi 18 nguyên tố kế tiếp, từ rubidium (Rb, Z = 37) đến xenon (Xe, Z = 54), có electron
lần lượt lấp đầy vào các phân lớp 5s, 4d, và 5p. Nguyên tố cuối cùng trong dãy này có cấu hình
electron nguyên tử là Xe: [Kr] 4d10 5s2 5p6.
Chuỗi kế tiếp gồm 32 nguyên tố, từ cesium (Cs, Z = 55) đến radon (Rn, Z = 86), electron của
chúng lần lượt xếp vào các phân lớp 6s, 4f, 5d, và 6p theo quy tắc Klechkowski. Dãy này được kết
thúc với nguyên tố radon có cấu hình electron nguyên tử là Rn: [Xe] 4f14 5d10 6s2 6p6.
Nguyên tố francium (Fr, Z = 87) mở đầu cho dãy 32 nguyên tố hóa học có các electron lần lượt điền
vào các phân lớp 7s (hai nguyên tố), 5f (14 nguyên tố), 6d (10 nguyên tố), và 7p (6 nguyên tố).
Ngoài ra, tất cả các nguyên tố hóa học có điện tích hạt nhân nguyên tử Z > 92, tức là 52
các nguyên tố đứng sau uranium (U) đều không được tìm thấy trong tự nhiên, chúng là các
nguyên tố được tạo thành trong phòng thí nghiệm và có tính phóng xạ với đời sống khá ngắn.
Cấu hình electron của tất cả các nguyên tử và mối liên quan giữa cấu hình electron
nguyên tử, tính chất hóa học của nguyên tố, và vị trí của chúng trong bảng phân loại tuần hoàn sẽ
được đề cập chi tiết ở chương sau. Để dễ dàng đọc các phần tiếp theo, ta cần biết một số thuật
ngữ thông dụng cho electron, orbital, và nguyên tử.
3.6. Một số thuật ngữ thông dụng
Electron nằm riêng lẻ trong orbital được gọi là electron độc thân, hai electron khác spin
cùng chiếm một orbital được gọi là electron ghép cặp. Ví dụ, nguyên tử C đã nói ở phần trên có 2
electron độc thân và hai cặp electron ghép cặp. Cấu hình electron độc thân hay ghép cặp ảnh
hưởng đến từ tính của vật chất: các chất có electron độc thân có tính thuận từ, nghĩa là bị từ
trường hút; các chất không có electron độc thân thì nghịch từ, nghĩa là bị từ trường đẩy. Ví dụ, Fe
có bốn electron độc thân trong mỗi nguyên tử, nên sắt kim loại là chất thuận từ.
Các electron nằm trong các orbital có số lượng tử chính n cao nhất trong nguyên tử được
gọi là các electron lớp ngoài cùng. Các electron thuộc về các orbital của phân lớp điền vào cuối
cùng trong cấu hình electron theo quy tắc kinh nghiệm Klechkowski được gọi là các electron của
phân lớp đang xây dựng. Ví dụ, Fe có cấu hình electron nguyên tử viết theo quy tắc Klechkowski là: 1s2 2s2 6 2 6
2p 3s 3p 4s2 3d6, lớp ngoài cùng của cấu hình electron của nguyên tử Fe là lớp 4, nguyên
tử Fe có hai electron ở lớp ngoài cùng, đó là các electron trên orbital 4s; phân lớp electron đang xây
dựng của nguyên tử Fe là 3d, Fe có sáu electron ở phân lớp orbital đang xây dựng. Cấu hình
electron của nguyên tử Na là 1s2 2s2 2p6 3s1, có lớp ngoài cùng là lớp 3 và phân lớp đang xây dựng
là 3s, vì vậy số electron thuộc lớp ngoài cùng của Na bằng số electron thuộc phân lớp đang xây dựng, là một electron.
Trong nguyên tử, các electron ở xa nhân nguyên tử có năng lượng cao hơn và liên kết
tương đối yếu hơn với nhân nguyên tử. Các electron đó có khả năng tham gia liên kết hóa học với
electron của các nguyên tử khác, do đó chúng được gọi là electron hóa trị. Kinh nghiệm cho thấy
electron hóa trị là các electron thuộc lớp ngoài cùng và phân lớp đang xây dựng. Ví dụ, nguyên tử F
có cấu hình electron nguyên tử là 1s2 2s2 2
2p5, nguyên tử Cl có cấu hình electron nguyên tử là 1s 2s2 2p6 2 5
3s 3p , vậy hai nguyên tử F và Cl đều có bảy electron ở lớp ngoài cùng (các electron này thuộc
lớp 2 với F, và lớp 3 với Cl), phân lớp electron đang xây dựng của F là 2p và của Cl là 3p, các phân
lớp này cũng thuộc về lớp ngoài cùng. Do đó F và Cl đều có bảy electron hóa trị. Tương tự như
vậy, các nguyên tố O và S có sáu electron hóa trị; N và P có năm electron hóa trị. Nguyên tử Cr có
cấu hình electron là 1s2 2s2 2p6 3s2 3p6 3d5 4s1, vì vậy Cr có sáu electron hóa trị, một electron ở lớp
ngoài cùng 4s, và năm electron ở phân lớp đang xây dựng 3d. Tương tự, nguyên tử Fe với cấu
hình electron là 1s2 2s2 2p6 3s2 3p6 3d6 4s2 có tám electron hóa trị. Trong chương sau, ta sẽ thấy số
electron hóa trị của các nguyên tử có liên quan đến vị trí nhóm của nguyên tố hóa học trong bảng phân loại tuần hoàn.
Orbital hóa trị của nguyên tử là những orbital có năng lượng cao, có khả năng tham gia vào sự
tạo liên kết hóa học. Đó là các orbital chứa các electron hóa trị và các orbital trống có năng lượng
xấp xỉ với các orbital chứa electron hóa trị. Đối với các nguyên tố chu kỳ 1, chỉ có một orbital hóa
trị là orbital 1s. Các nguyên tố chu kỳ 2 có bốn orbital hóa trị: orbital 2s và ba orbital 2p. Các
nguyên tố chu kỳ 3 có thể sử dụng các orbital 3s, 3p, và cả các orbital 3d không chứa electron
làm orbital hóa trị. Các nguyên tố d thuộc chu kỳ 4, ngoài các orbital 3d và 4s đang chứa electron
hóa trị, chúng có thể dùng thêm các orbital 4p còn trống, và có thể cả các 53
orbital 4d còn trống làm orbital hóa trị. Như vậy, số orbital hóa trị của nguyên tử tăng lên theo chu
kỳ của chúng trong bảng phân loại tuần hoàn. Phần này sẽ được nói chi tiết hơn ở chương tiếp theo.
Trong nguyên tử, các phân lớp đã chứa đầy electron gọi là các phân lớp bão hòa electron. Các
phân lớp chứa số electron bằng số orbital của nó gọi là các phân lớp bán bão hòa. Ví dụ, nguyên tử
khí trơ Ne (Z=10) có cấu hình electron bão hòa: 1s2 2s2 2p6; nguyên tử P (Z=15) có cấu hình
electron bán bão hòa 1s2 2s2 2p6 3s2 3p3. Các quan sát cho thấy các cấu hình electron bão hòa và
bán bão hòa thường tương đối bền hơn so với các cấu hình khác.
Ngoài ra, dựa vào cấu hình electron của nguyên tử, các nguyên tố hóa học được phân thành 4 nhóm:
Nguyên tố s: có electron đang xây dựng ở phân lớp s;
Nguyên tố p: có electron đang xây dựng ở phân lớp p;
Nguyên tố d: có electron đang xây dựng ở phân lớp d;
Nguyên tố f: có electron đang xây dựng ở phân lớp f.
Ví dụ, Na với cấu hình electron nguyên tử 1s2 2s2 2p6 3s1 là nguyên tố s; P với cấu hình
electron 1s2 2s2 2p6 3s2 3p3 là nguyên tố p; Fe với cấu hình electron nguyên tử viết theo quy tắc kinh
nghiệm Klechkowski là 1s2 2s2 2p6 3s2 3p6 4s2 3d6, electron đang điền vào phân lớp 3d nên Fe là nguyên tố d.
Trong thực tế nguyên tử có thể nhận thêm hoặc mất đi electron để thành các ion. Trong
hầu hết các trường hợp, nguyên tử cô lập sẽ nhận thêm electron vào các orbital thuộc phân lớp
đang xây dựng để tạo thành ion âm, còn gọi là anion. Ví dụ, nguyên tử F có cấu hình electron là 1s2 2s2 5 –
2p nên các nguyên tử F có thể nhận thêm electron vào orbital 2p để trở thành anion F với
cấu hình electron là 1s2 2s2 2
2p6; nguyên tử O với cấu hình electron nguyên tử là 1s 2s2 2p4 nên có
thể nhận thêm một hoặc hai electron vào các orbital 2p để thành anion O– với cấu hình electron là 1s2 2s2 5 2– 2
2p , hoặc trở thành O với cấu hình electron là 1s 2s2 2p6.
Trong điều kiện thích hợp, các nguyên tử cô lập có thể mất một hoặc vài electron để tạo ion
dương, hay còn được gọi là cation. Một cách đơn giản, ta có thể xem electron có năng lượng cao
nhất và được nhân hút yếu nhất sẽ dễ dàng bị lấy ra khỏi nguyên tử nhất. Đó là các electron ở lớp
ngoài cùng. Ví dụ, nguyên tử Na với cấu hình electron nguyên tử là 1s2 2s2 2p6 3s1 có thể mất một
electron ở lớp ngoài cùng thuộc lớp 3 để tạo thành ion Na+ 2
với cấu hình electron 1s 2s2 2p6. Nguyên
tử sắt với cấu hình electron nguyên tử Fe: 1s2 2 6
2s2 2p6 3s2 3p6 4s 3d , có thể mất hai electron có năng
lượng cao nhất ở lớp ngoài cùng (lớp 4) để tạo thành ion Fe2+: 1s2 2s2 2p6 3s2 3p6 3d6. Ion Fe2+ có thể
mất thêm một electron ở lớp kế cận bên trong, lớp 3, để tạo thành ion Fe3+. Lớp 3 trong cấu hình
electron của nguyên tử Fe có các phân lớp 3s, 3p, và 3d với năng lượng tăng dần theo thứ tự đó, vì
vậy electron bị mất kế tiếp trong trường hợp này sẽ nằm ở phân lớp 3d. Cấu hình electron của ion Fe3+ 6 là: 1s2 2 2s 2p 3s2 3p6 3d5.
Trên đây là cấu trúc electron của các nguyên tử và ion ở trạng thái cô lập, nghĩa là nguyên
tử hoặc ion không liên kết với các nguyên tử và ion khác. Trong tự nhiên, hầu hết các nguyên tử và
ion ở trạng thái liên kết với các nguyên tử hay ion khác, khi đó, cấu hình electron của nguyên tử và
ion cũng như trạng thái năng lượng của chúng có thể khác so với nguyên tử và ion cô lập. Một
phần của vấn đề này sẽ được bàn ở các chương liên kết hóa học trong chương trình Hóa đại
cương, một số phần khác sẽ được nói đến trong các giáo trình Hóa học ở cấp độ cao hơn. 54 Chương 4
BẢNG HỆ THỐNG TUẦN HOÀN VÀ SỰ BIẾN THIÊN TUẦN HOÀN
CỦA TÍNH CHẤT CỦA CÁC NGUYÊN TỐ HÓA HỌC
Thế kỷ thứ XVIII là khoảng thời gian các nhà khoa học bắt đầu khám phá các nguyên tố
hóa học. Đầu thế kỷ XIX, người ta biết khoảng 30 nguyên tố. Đến năm 1840, số nguyên tố hóa học
được biết tăng đến 55, và lên đến 63 nguyên tố vào năm 1870. Cũng trong giai đoạn này, các nhà
Hóa học đã có được nhiều kiến thức về phản ứng hóa học và tính chất của các nguyên tố. Họ
nhận thấy có nhiều nguyên tố hóa học có tính chất khá giống nhau, có thể xếp chúng thành từng
nhóm. Ví dụ, ba kim loại rất mạnh và cùng thể hiện hóa trị I được xếp vào nhóm các kim loại kiềm,
đó là lithium (Li), natrium (Na), và kalium (K). Ba chất khí có màu và có hoạt tính hóa học cao,
phân tử của chúng đều có hai nguyên tử; chúng được xếp vào nhóm halogen, đó là chlorine (Cl2),
bromine (Br2), iodine (I2), v.v… Từ những nhận xét đó, các nhà hóa học muốn tìm ra quy luật thay
đổi tính chất của các nguyên tố hóa học để có thể nghiên cứu chúng một cách có hệ thống hơn.
Nhiều nhà hóa học đã nhận thấy tính chất các nguyên tố hóa học biến đổi tuần hoàn theo
khối lượng nguyên tử của chúng. Họ tìm cách sắp xếp các nguyên tố hóa học theo nhiều kiểu khác
nhau. Lothar Meyer (1830–1895) và Dmitri Mendeleev (1834–1907) là những người đầu tiên xếp
các nguyên tố hóa học thành hàng và cột theo thứ tự tăng dần khối lượng nguyên tử. Trong đó,
bảng sắp xếp của Mendeleev xuất bản năm 1872 là bảng thành công nhất. Trong chương này, ta sẽ
bắt đầu với bảng hệ thống tuần hoàn các nguyên tố hóa học của Mendeleev, sau đó là bảng hệ
thống tuần hoàn các nguyên tố hóa học ngày nay, và sự biến thiên tuần hoàn tính chất của các nguyên tố hóa học.
4.1. Bảng hệ thống tuần hoàn các nguyên tố hóa học của Mendeleev
Mendeleev sắp xếp các nguyên tố hóa học theo thứ tự tăng dần khối lượng nguyên tử và
sự thay đổi tính chất hóa học của các nguyên tố theo công thức của các hợp chất oxide và hydride
của chúng. Trong bảng của Mendeleev, các nguyên tố hóa học có công thức oxide và hydride
tương tự nhau được Mendeleev xếp vào cùng một cột và gọi là một nhóm nguyên tố. Hình 4.1 là
bảng phân loại tuần hoàn của Mendeleev, bảng này gồm có 8 nhóm (Gruppe) và 12 dòng (Reihen),
trên đầu của mỗi cột có ghi công thức của oxide và hydride của các nguyên tố thuộc nhóm đó. Ví
dụ, “Gruppe IV” gồm các nguyên tố có công thức hydride và oxide lần lượt là RH4 2 và RO (ngày nay ta viết là RH4 và RO2).
Thành công đáng nói đầu tiên của Mendeleev là ông đã để trống một số vị trí trong bảng, và
dự đoán đúng tính chất hóa học của các nguyên tố ở các vị trí trống đó. Ví dụ, Mendeleev cho rằng
ở hàng thứ 5, cột Gruppe III, bên dưới nguyên tố nhôm (Al, aluminium) phải có một nguyên tố khác
có tính chất hóa học tương tự nhôm nhưng có nguyên tử lượng cao hơn nhôm. Ông gọi nguyên tố
đó là eka-aluminium, về sau ta biết đó là gallium (Ga). Không lâu sau khi Medeleev đưa ra bảng
phân loại tuần hoàn, ba nguyên tố mà ông để trống đã được tìm thấy, đó là gallium (được tìm thấy
năm 1875), scandium (Sc, có khối lượng nguyên tử là 45 và được tìm thấy năm 1879), và
germanium (Ge, khối lượng nguyên tử 72, tìm thấy năm 1886). Germanium ở hàng thứ 5, được
Mendeleev gọi là eka-silicon. Các tính chất của eka-silicon được Mendeleev dự đoán năm 1871 và
của germanium được tìm thấy năm 1886 rất gần nhau, và được so sánh trong Bảng 4.1. 55
Hình 4.1. Bảng hệ thống tuần hoàn của Mendeleev xuất bản năm 1872.
Bảng 4.1. So sánh tính chất của germanium được dự đoán bởi Mendeleev
và tính chất thực của nó
Tính chất của germanium Dự đoán năm 1871 Quan sát năm 1886
Khối lượng nguyên tử (g/mol) 72 72.3
Khối lượng riêng (g/cm3) 5.5 5.47
Nhiệt dung riêng (J oC–1 g–1) 0.31 0.32 Nhiệt độ nóng chảy Rất cao 960 oC Công thức oxide RO2 GeO2
Khối lượng riêng của oxide 4.7 4.70
(g/cm3) Công thức hợp chất RCl4 GeCl4 chloride 100 oC 86 oC
Nhiệt độ sôi hợp chất chloride (oC)
Một thành công khác của Mendeleev là ông đã chỉnh lại đúng khối lượng nguyên tử của
nhiều nguyên tố. Ví dụ, trước đó khối lượng nguyên tử của indium (In) được cho là 76 vì các nhà
hóa học thời đó tin rằng công thức oxide của nó là InO. Dựa vào tính chất của indium, Mendeleev
xếp nó vào Gruppe III. Ông cho rằng oxide của indium phải là In2O3 và tính lại khối lượng nguyên tử
của indium là 113 (xem Hình 4.1). Sau này, khối lượng đúng của indium được biết là 114.8, rất gần
với dự đoán của Medeleev. Tương tự, Mendeleev cũng hiệu chỉnh lại khối lượng nguyên tử của
beryllium (Be) là 9.4, của uranium (U) là 240.
Bảng phân loại tuần hoàn của Mendeleev nhanh chóng được các nhà Hóa học thời bấy giờ chấp
nhận rộng rãi. Ta dễ dàng nhận thấy các nguyên tố khí hiếm không có mặt trong bảng năm 1872
của Mendeleev vì chúng chưa được biết đến ở thời điểm đó. Năm 1892, khí hiếm đầu tiên là argon
(Ar) đã được phát hiện. Nguyên tử lượng của argon được xác định là 39.9, nằm giữa nguyên tử
lượng của kalium (K = 39) và calcium (Ca = 40). Vào lúc đó, Mendeleev cho rằng có thể có sai sót
trong việc xác định khối lượng nguyên tử của argon vì không thể có nhóm 56
nguyên tố nào khác nằm giữa kalium và calcium. Nhưng không lâu sau đó, các khí hiếm khác
được tìm thấy. Dựa trên tính chất của chúng, các nguyên tố khí hiếm được xếp vào cùng một
nhóm, gọi là nhóm 0 (không), đứng trước “Gruppe I” trong bảng của Mendeleev. Tuy nhiên,
Mendeleev vẫn không giải thích được tại sao argon có nguyên tử lượng cao hơn kalium, lại đứng
trước kalium. Mendeleev gọi argon là nguyên tố ngoại lệ vì không theo đúng “trật tự khối lượng
nguyên tử”. Như ta sẽ thấy ở phần tiếp theo, điểm khác biệt căn bản của bảng phân loại tuần
hoàn hiện nay so với bảng của Mendeleev là bảng phân loại tuần hoàn hiện nay xếp các nguyên
tố hóa học theo chiều tăng dần điện tích hạt nhân nguyên tử, do đó vướng mắc về trật tự nguyên
tử theo khối lượng nói trên không còn nữa.
4.2. Bảng phân loại tuần hoàn hiện đại – mối liên quan giữa cấu hình electron nguyên tử và vị trí
của các nguyên tố trong bảng phân loại tuần hoàn
4.2.1. Điện tích hạt nhân nguyên tử – cơ sở của định luật tuần hoàn hiện đại
Đầu thế kỷ XX, Henry Moseley (1887 – 1915) nghiên cứu tia X phát ra khi chùm electron
trong ống phát tia âm cực (đã đề cập ở mục 2.2.1) đập vào anode. Ông thấy tần số của tia X phát
ra phụ thuộc vào bản chất kim loại làm anode trong ống âm cực (Hình 4.2). Dựa vào mô hình
nguyên tử Bohr đưa ra năm 1913, Moseley cho rằng khi electron với năng lượng đủ lớn đập vào
các nguyên tử của anode, chúng có thể làm bắn electron ở các lớp gần nhân ra khỏi nguyên tử,
nguyên tử khi đó chuyển sang trạng thái kích thích. Trạng thái kích thích của nguyên tử không bền,
do đó electron ở các lớp bên ngoài của nguyên tử sẽ rơi vào để lấp chỗ trống của electron bị mất,
đồng thời phát ra tia X với năng lượng bằng sự khác biệt năng lượng của orbital lớp ngoài và orbital
lớp bên trong của nguyên tử. Moseley lập luận, năng lượng của orbital nguyên tử phụ thuộc vào
điện tích hạt nhân nguyên tử, do đó tần số tia X phát ra phải liên quan với điện tích hạt nhân
nguyên tử. Từ các dữ liệu thực nghiệm, ông đã lập được phương trình biểu diễn mối tương quan
giữa tần số tia X phát ra và điện tích hạt nhân nguyên tử và thấy rằng, điện tích hạt nhân nguyên tử
không phải là các giá trị tùy ý, mà cách nhau từng đơn vị – đơn vị đó bằng đúng điện tích của electron.
Hình 4.2. Phổ tia X phát ra khi chùm electron trong ống cathode đập vào các kim loại làm anode
khác nhau. Trong các phổ này, mỗi kim loại làm anode phát ra hai vạch tia X, các anode phát ra
nhiều hơn hai vạch là do có lẫn các kim loại kế cận, brass là hợp kim Cu–Zn. 57
Sau đó Moseley thiết kế thí nghiệm để kiểm tra các nguyên tố hóa học có điện tích hạt nhân
từ 13 (nhôm) đến 79 (vàng). Ông kết luận trong khoảng này chỉ có ba nguyên tố chưa biết, đó là các
nguyên tố có điện tích hạt nhân bằng 43, 61, và 75. Ba nguyên tố đó sau này được biết là
technetium (Tc), promethium (Pm), và rhenium (Re), chúng lần lượt được tìm thấy vào các năm
1925 (Re), 1937 (Tc), và 1945 (Pm). Moseley cũng phân định rõ điện tích hạt nhân của các nguyên
tố có nguyên tử lượng bằng nhau hoặc còn nghi vấn trong bảng phân loại tuần hoàn. Ví dụ, ông xác
nhận điện tích hạt nhân nguyên tử của cobalt (Co) và nickel (Ni) lần lượt là 27 và 28, mặc dù
nguyên tử lượng của Co và Ni xấp xỉ nhau. Tương tự, Ar (Z = 18) có điện tích hạt nhân nguyên tử
nhỏ hơn K (Z = 19), nên Ar phải đứng trước K trong bảng phân loại tuần hoàn mặc dù nguyên tử
lượng của Ar (39.9) cao hơn của K (39). Vấn đề các nguyên tử “không đúng trật tự khối lượng” đề
cập ở mục 4.1 đã được giải đáp.
4.2.2. Bảng phân loại tuần hoàn hiện đại
Ta đã biết rằng trong phản ứng hóa học, hạt nhân nguyên tử không thay đổi, nhưng trật tự
kết hợp giữa các nguyên tử có thể thay đổi. Từ đó suy ra chỉ có vỏ nguyên tử – hay cấu trúc
electron của nguyên tử – liên quan đến tính chất hóa học của nguyên tử. Khoảng những năm
1920, với những kiến thức mới về hóa học lượng tử và cấu hình electron của nguyên tử, Niels
Bohr đề nghị rằng các nguyên tố hóa học có tính chất tương tự nhau phải có cấu hình electron
nguyên tử tương tự nhau.
Từ kết quả nghiên cứu của Moseley và đề nghị của Bohr, các nguyên tố hóa học được sắp xếp
theo chiều tăng dần điện tích hạt nhân nguyên tử trong bảng phân loại tuần hoàn sao cho các
nguyên tố trong cùng một cột (nay gọi là nhóm) có tính chất hóa học tương tự nhau, biểu hiện
qua cấu hình electron lớp ngoài cùng và phân lớp đang xây dựng của các nguyên tử này là
tương tự nhau. Từ đó định luật tuần hoàn được phát biểu lại như sau: tính chất các nguyên tố
hóa học biến thiên tuần hoàn theo chiều tăng dần điện tích hạt nhân nguyên tử.
Bảng 4.2 là bảng phân loại tuần hoàn được dùng hiện nay theo đề nghị của Hiệp hội hóa
học quốc tế (IUPAC, International Union of Pure and Applied Chemistry) gồm có 7 chu kỳ xếp thành
7 hàng ngang và 18 nhóm xếp thành 18 cột. Các nguyên tố hóa học trong một chu kỳ có số lớp
electron giống nhau, tên của chu kỳ là tên của lớp electron ngoài cùng. Trong một chu kỳ, nguyên tố
hóa học mở đầu chu kỳ (nguyên tố nằm ở cột đầu tiên) có cấu hình electron thuộc lớp ngoài cùng
là ns1, nguyên tố kết thúc chu kỳ (nguyên tố nằm ở cột cuối cùng) có cấu hình electron thuộc lớp ngoài cùng là ns2 2
np6, trừ nguyên tố kết thúc chu kỳ 1 có cấu hình electron là 1s vì lớp 1 không có phân lớp 1p.
4.2.2.1. Sự sắp xếp các nguyên tố hóa học vào các chu kỳ và nhóm trong bảng phân loại tuần hoàn
Như đã nói, các nguyên tố hóa học trong một chu kỳ có số lớp electron giống nhau,
nguyên tố mở đầu chu kỳ có cấu hình electron ns1, nguyên tố kết thúc chu kỳ có cấu hình electron ns2 6
np , trừ chu kỳ 1. Theo quy tắc đó, chu kỳ 1 chỉ có hai nguyên tố với cấu hình elctron nguyên
tử là H (1s1) và He (1s2), ứng với sự làm đầy electron trong lớp 1. Người đọc có thể xem Bảng 4.2
để theo dõi phần này một cách dễ dàng hơn.
Chu kỳ 2 có tám nguyên tố, với sự thay đổi dần cấu hình electron nguyên tử ở lớp ngoài cùng từ Li: 2s1 2
đến Ne: 2s 2p6. Chu kỳ này có hai nguyên tố s và sáu nguyên tố p.
Chu kỳ 3 cũng có tám nguyên tố, ứng với sự thay đổi dần cấu hình electron nguyên tử ở
lớp ngoài cùng từ Na: 3s1 2
đến Ar: 3s 3p6. Chu kỳ 3 cũng có hai nguyên tố s và sáu nguyên tố p 58
tương tự như chu kỳ 2, do đó các nguyên tố hóa học ở chu kỳ 2 và chu kỳ 3 có cấu hình electron
lớp ngoài cùng tương tự nhau được xếp vào cùng cột – tức là cùng nhóm – với nhau.
Đến đây, các “ngoại lệ” bắt đầu xuất hiện trong bảng phân loại tuần hoàn. Ở chu kỳ 1, mặc dù
nguyên tố He (1s2) có cấu hình electron không giống với Ne và Ar (ns2 np6), nhưng He được xếp
vào cùng cột với các nguyên tố Ne và Ar do tính chất hóa học của các nguyên tố này rất giống
nhau. Ngoài ra, H được xếp vào cùng nhóm với các kim loại kiềm (Li, Na) do chúng đều có cấu
hình electron nguyên tử tương tự nhau (ns1). Tuy nhiên, tính chất hóa học căn bản của hydrogen
là phi kim, không giống tính chất của các kim loại kiềm đứng cùng nhóm với nó.
Chu kỳ 4 có 18 nguyên tố hóa học với electron ở lớp ngoài cùng là lớp 4, các electron của
chúng được thêm vào lần lượt để làm đầy các orbital 4s – 3d – 4p. Vì vậy, chu kỳ này có hai nguyên tố s (K: [Ar] 4s1 2
và Ca: [Ar] 4s ), tiếp theo là mười nguyên tố d với cấu hình electron nguyên tử từ Sc: [Ar] 4s2 2
3d1 đến Zn: [Ar] 4s 3d10, và cuối cùng là sáu nguyên tố p với cấu hình electron nguyên tử từ Ga: [Ar] 4s2 2
3d10 4p1 đến Kr: [Ar] 4s 3d10 4p6. Để cho gọn, cấu hình electron nguyên tử
trong Bảng 4.2 chỉ viết các electron lớp ngoài cùng và phân lớp đang xây dựng của các nguyên tố,
do đó cấu hình electron của dãy nguyên tố p trong chu kỳ này được viết là Ga: 4s2 2 4p1 – Kr: 4s 4p6.
Chu kỳ 4 là chu kỳ đầu tiên có mười nguyên tố d. Để xếp các nguyên tố hóa học theo chiều tăng
dần điện tích hạt nhân nguyên tử và các nguyên tố có cấu hình electron và tính chất hóa học tương
tự nhau vào cùng cột, mười cột của các nguyên tố d được xếp chen vào giữa các cột của nguyên tố s và p.
Sau chu kỳ 4, electron của nguyên tử của các nguyên tố tiếp theo tiếp tục điền vào các orbital 5s –
4d – 5p tạo thành chu kỳ 5. Như vậy, chu kỳ 5 gồm 18 nguyên tố tương tự như chu kỳ 4. Đó là các
nguyên tố từ rubidium (Rb) đến xenon (Xe), trong đó có hai nguyên tố s (dãy 5s1- 2 ), tiếp đến là
mười nguyên tố d (dãy 4d1-10), và cuối cùng là sáu nguyên tố p (dãy 5p1-6). Trong Bảng 4.2, tương
tự như với các nguyên tố thuộc chu kỳ 4, các nguyên tố thuộc chu kỳ 5 chỉ được viết các electron
lớp ngoài cùng và phân lớp đang xây dựng. Ví dụ, nguyên tố cuối cùng của chu kỳ 5 có cấu hình electron là Xe: [Kr] 4d10 2
5s2 5p6, được viết vắn tắt là Xe: 5s 5p6.
Đến đây, ta dễ dàng nhận thấy sự sắp xếp electron vào các orbital nguyên tử qua các chu
kỳ trùng với dãy quy tắc kinh nghiệm Klechkowski và theo trật tự sau: 1s 2s 2p 3s 3p 4s 3d 4 p
5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
, trong đó các chu kỳ được phân cách bởi các vạch đứng.
Như vậy, các nguyên tố hóa học ở chu kỳ 6 có electron lần lượt sắp đầy theo dãy 6s1-2 4f1-14 5d1-10
6p1-6 nên chu kỳ 6 có nhiều nguyên tố hơn các chu kỳ trước. Hai nguyên tố đầu tiên là caesium (Cs)
và barium (Ba) lần lượt có cấu hình electron lớp ngoài cùng là 6s1 và 6s2, chúng được xếp vào hai
cột nguyên tố s. Sau barium là lanthanum (La) có cấu hình electron thực tế là [Xe] 6s2 5d1 (không
theo quy tắc Klechkowski). Sau lanthanum là 14 nguyên tố có electron điền vào các orbital 4f nên
chúng được gọi là các nguyên tố f. Tiếp theo sau đó là chín nguyên tố có electron tiếp tục điền vào các orbital 5d (từ 5d2 10
đến 5d ), và cuối cùng là sáu nguyên tố có electron điền vào các orbital 6p.
Như vậy, chu kỳ 6 có tổng cộng 32 nguyên tố. Nếu để 32 nguyên tố thuộc chu kỳ 6 nằm cùng một
hàng thì hàng này quá dài (cũng có bảng trình bày như vậy), vì vậy lanthanium và 14 nguyên tố f
đứng sau nó thường được ngắt thành dòng riêng để ở phía dưới bảng, không để chen vào giữa các
nguyên tố 5d (trong một số bảng, người ta chỉ đưa 14 nguyên tố theo sau lanthanum xuống dưới).
Mười bốn nguyên tố theo sau lanthanum có tính chất hóa học tương tự nhau, và tương tự
lanthanum nên được gọi là các nguyên tố Lanthanoids (nguyên tố giống La), hay dãy Lanthanide
(Lanthanide series), hay dãy 4f.
Bảng 4.2. Bảng phân loại tuần hoàn các nguyên tố hóa học Chu IA IIA Nhóm IIIA IVA VA VIA VIIA VIIIA kỳ 1 2 13 14 15 16 17 18 1 1 H 1s1 3 4 5 6 7 Li Be B C N 2 1 2 2s1 2s2 2s 2p 2s 2p 2 2s22p 2 3 11 12 IIIB IVB VB VIB VIIB VIIIB VIIIB VIIIB IB IIB 13 14 15 Na Mg 3 Al S 5 7 8 9 10 11 12 3s1 3s2 4 6 Si 3s23p1 P 3 3s23p 2 3s23p 3 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 K C Sc V 4s1 a 3d14s2 Ti Cr Mn Fe Co Ni Cu Zn Ga Ge As S 4s2 3d34s2 3d74s 4 2 3d54s1 3d54s2 3d64s 3d104s 3d104s 4s24p1 4s24p 4s24p 2 2 2 3 3d24s2 8 2 1 3d 4s 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 Rb Sr Y Nb Sn 1 2 5s1 5s2 4d 5s Zr Mo Tc Ru Rh Pd Ag Cd In Sb T 4d45s1 5s25p 4d25s2 4d55s1 4d55s2 4d75s 4d85s 4d105s0 4d105s 4d105s 5s25p1 2 5s25p 5 1 1 1 2 3 55 56 57-71 72 73 74 75 76 77 78 79 80 81 82 83 Cs Ba La Re 6s1 6s2 Lu Hf Ta W Os Ir Pt Au Hg Tl Pb Bi P 5d36s2 5d56s2 6 5d26s2 5d46s2 5d66s 5d76s 5d96s1 5d106s 5d106s 6s26p1 6s26p 6s26p 2 2 1 2 2 3 87 88 89-103 104 105 106 107 108 109 110 111 112 113 114 115 Fr Ra Ac Db Bh 7s1 7s2 Lr Rf 6d37s2 Sg Hs Mt Ds Rg Cn Nh Fl Mc 6d57s2 6d47s2 6d67s77s2) 8 2 9 10 2 1 2 2 4 (6d 7s (6d 7s (6d 7 (7s 7p (7s2 (7s 7 7p 2 2 6d27s2 2 7p2) 3 ) ) s ) ) p ) 2 3 4 5 6 7 57 58 59 60 61 62 63 64 65 66 67 68 69 La Ce Nd 5d16s2 4f15d16s Pr Pm Sm Eu Gd Tb Dy Ho Er Tm 2 4f46s2 4f76s2 4f36s2 4f56s2 4f66s2 4f96s2 4f106s2 4f11 2 6s 4f126s 4f136s 4 7 1 2 2 4f 5d 6s 2 89 90 91 92 93 94 95 96 97 98 99 100 101 Ac Th Pa U 6d17s2 6d27s2 Np Pu Am Cm Bk Cf Es Fm Md 5f26d17s 5f36d17s 5 2 2 5f46d17s 5f67s2 5f77s2 5f76d17s 5f97s2 5f107s2 5f11 2 7s 5f127s 5f137s 2 2 2 2 Lanthanoids Actinoids
Ghi chú: - Cấu hình electron nguyên tử của các nguyên tố theo C.E. Housecroft and A.G. Sharpe, Inorganic
Chemistry (2nd Ed.), 2005 và https://www.ptable.com/#Writeup/Wikipedia
- Cấu hình electron lớp vỏ ngoài cùng của các nguyên tố p thuộc chu kỳ 4 – 7 và nguyên tố d thuộc chu kỳ 6 – 7 có phân lớp (n-1)d10 14
và/hoặc (n-2)f đã đầy đủ electron sẽ được bỏ qua trong cấu hình electron ở bảng trên.
- Các nguyên tố có điện tích hạt nhân từ 109 trở lên: cấu hình electron nguyên tử theo dự đoán và được viết trong dấu ngoặc đơn. 60
Chu kỳ 7 tương tự chu kỳ 6, với cấu hình electron của các nguyên tử trong chu kỳ lần lượt
xếp theo dãy 7s1-2 5f1-14 6d1-10 1-6 7p
. Trong chu kỳ này, tất cả các nguyên tố đứng sau uranium (U, Z =
92): [Rn] 7s2 5f3 6d1, thuộc dãy 5f) đều không tìm được trong tự nhiên, chúng là các nguyên tố được
tạo thành trong phòng thí nghiệm và có tính phóng xạ với đời sống khá ngắn. Đến năm 2016, các
nhà khoa học đã xác nhận đầy đủ 32 nguyên tố thuộc chu kỳ 7, tuy nhiên cấu hình electron nguyên
tử của các nguyên tố có điện tích hạt nhân nguyên tử từ 109 trở lên chưa được biết rõ ràng. Tương
tự như ở chu kỳ 6, actinium (Ac) và 14 nguyên tố theo sau nó được xếp thành dòng riêng ở dưới
bảng, chúng được gọi là các nguyên tố Actinoids, hay dãy Actinide, hay dãy 5f.
Hình 4.3 là dạng khối của bảng phân loại tuần hoàn, trong đó tóm tắt các phân lớp electron
đang xây dựng của các nguyên tố. Dễ dàng nhận thấy bảng phân loại tuần hoàn gồm bốn khối
nguyên tố: các nguyên tố s chiếm hai cột đầu tiên bên trái bảng, kế tiếp là mười cột của các nguyên
tố d – các nguyên tố d chỉ bắt đầu xuất hiện từ chu kỳ 4 trở đi, bên phải bảng là sáu cột của các
nguyên tố p. Ngoài ra, hai dòng cuối cùng là các nguyên tố f thuộc chu kỳ 6 và 7. Ba chu kỳ đầu của
bảng phân loại tuần hoàn được gọi là các chu kỳ ngắn, chu kỳ 4 trở đi được gọi là các chu kỳ dài.
Hình 4.3. Dạng khối của bảng phân loại tuần hoàn.
4.2.2.2. Nhóm và phân nhóm trong bảng phân loại tuần hoàn
Bảng phân loại tuần hoàn của Mendeleev trước đây có tám nhóm, được đặt tên từ nhóm I
đến nhóm VIII. Bảng phân loại tuần hoàn hiện nay gồm 18 cột, lúc đầu cũng được đặt tên theo tám
nhóm như bảng Mendeleev. Vì có 18 cột chia làm tám nhóm, nên bảng được chia làm hai phân
nhóm lớn và đặt tên là phân nhóm A (còn gọi là phân nhóm chính) và phân nhóm B (phân nhóm
phụ) (xem Bảng 4.2). Các nguyên tố s và p được quy ước thuộc về các phân nhóm chính, gồm hai
nhóm nguyên tố s được đánh số IA và IIA, sáu cột của các nguyên tố p được đánh số từ IIIA đến
VIIIA. Dễ nhận thấy số thứ tự của các phân nhóm A bằng tổng số electron lớp ngoài cùng của nguyên tử. 61
Các nguyên tố d được quy ước là phân nhóm phụ, hay phân nhóm B. Các nguyên tố thuộc
phân nhóm B đầu tiên (đứng ngay sau các nguyên tố s) có cấu hình electron là ns2 (n-1)d1 và được
đánh số IIIB, tức là số thứ tự nhóm bằng tổng số electron lớp ngoài cùng và phân lớp đang xây
dựng. Tương tự, các nhóm nguyên tố d tiếp theo được đánh số từ IVB đến VIIIB. Riêng phân
nhóm VIIIB gồm có ba cột, với các nguyên tử có tổng số electron lớp ngoài cùng và phân lớp d
đang xây dựng là 8, 9, và 10. Hai cột cuối cùng của các nguyên tố d có tổng số electron lớp ngoài
cùng và phân lớp d đang xây dựng là 11 và 12, chúng được đánh số là IB và IIB. Dễ dàng nhận
thấy rằng nếu ta xếp các cột cùng số của phân nhóm A và B chồng lên nhau, ví dụ IA với IB, IIA với
IIB, v.v… sao cho các nguyên tố trong một cột xếp theo trật tự tăng dần điện tích hạt nhân nguyên
tử, ta có bảng phân loại tuần hoàn tương tự như bảng của Mendeleev.
Năm 1985, IUPAC quy ước cách đặt tên mới cho các nhóm trong bảng phân loại tuần hoàn. Theo
quy ước này, 18 cột của bảng phân loại tuần hoàn được đánh số từ 1 đến 18, ứng với 18 nhóm
như trong Bảng 4.2 và Hình 4.3. Với số thứ tự nhóm theo cách này, ta có:
- Các nguyên tố s có số thứ tự nhóm bằng số electron lớp ngoài cùng;
- Các nguyên tố p có số thứ tự nhóm bằng số electron lớp ngoài cùng + 10; - Các nguyên tố
d có số thứ tự nhóm bằng tổng số electron lớp ngoài cùng và phân lớp đang xây dựng (tức
là tổng số electron thuộc phân lớp ns và (n-1)d);
- Hai dãy nguyên tố f, Lanthanide và Actinide, được quy ước thuộc về nhóm 3, là nhóm của
hai nguyên tố lanthanum và actinium.
Hiện nay, hầu hết các sách giáo khoa hóa học và các công bố khoa học trên thế giới đều
dùng tên nhóm theo quy ước năm 1985 của IUPAC. Đặc biệt, tên nhóm theo quy ước này rất thuận
tiện khi ta nghiên cứu các nguyên tố d, nhất là nhóm VIIIB trước đây gồm ba cột, ta phải chỉ ra cột
trái – giữa – phải cho từng trường hợp. Trong khi dùng tên nhóm mới, ta có mỗi cột là một nhóm
riêng biệt, với tên nhóm bằng đúng tổng số electron lớp ngoài cùng và phân lớp đang xây dựng: 8,
9, và 10. Ta cần biết và sử dụng thành thạo cả hai cách gọi tên nhóm đã trình bày trên, đặc biệt là cách gọi tên mới.
Bên cạnh đó, bảng phân loại tuần hoàn hiện đại cho phép ta xác định một cách dễ dàng cấu
hình electron nguyên tử của một nguyên tố nào đó khi biết vị trí của nó (chu kỳ và nhóm) trong bảng
phân loại tuần hoàn, và ngược lại. Ví dụ, Chlorine thuộc chu kỳ 3 và nhóm 17 (VIIA) trong bảng
phân loại tuần hoàn, vậy Cl là nguyên tố p, có 7 electron hóa trị, do đó cấu hình electron của nguyên tử Cl là: 1s2 2
2s2 2p6 3s2 3p5. Sắt với cấu hình electron nguyên tử là Fe: 1s 2s2 2p6 3s2 3p6 4s2
3d6, do đó Fe là nguyên tố d (nhóm B) thuộc chu kỳ 4, có 8 electron hóa trị, vì vậy Fe ở nhóm 8 (hay
nhóm VIIIB, cột đầu tiên).
4.2.3. Vấn đề các nguyên tử có cấu hình electron không theo quy tắc Klechkowski
Với lý thuyết về cấu trúc electron trong nguyên tử mà chúng ta có hiện nay, cấu hình electron
nguyên tử là cấu hình electron của nguyên tử cô lập ở trạng thái có năng lượng thấp nhất, cấu hình
electron này phải được kiểm chứng qua hóa tính của nguyên tố hóa học và nhiều dữ kiện thực
nghiệm khác như phổ nguyên tử, từ tính, năng lượng ion hóa nguyên tử, v.v… trước khi được ghi
nhận vào các bảng tra cứu và bảng phân loại tuần hoàn. Bảng phân loại tuần hoàn với các nguyên
tố hóa học được biết tới ngày nay cùng với cấu hình electron lớp vỏ ngoài cùng và phân lớp đang
xây dựng của các nguyên tử được dẫn ra trong Bảng 4.2. Ta thấy rất nhiều nguyên tố d và f có cấu
hình electron nguyên tử không theo đúng quy tắc kinh nghiệm Klechkowski (để ý các cấu hình
electron được in đậm). Mặc dù đó là cấu hình electron đã được 62
kiểm chứng của các nguyên tử, nhưng chúng thường được gọi theo cách không chính xác là “cấu
hình electron bất thường”. Vậy ta cần để ý “bất thường” nói ở đây nghĩa là không theo đúng quy tắc
kinh nghiệm Klechkowski, hay những trường hợp ngoại lệ. Một số nguyên tố hóa học có cấu hình
electron nguyên tử không theo đúng quy tắc Klechkowski thường được chú ý là: Nhóm 6 Nhóm 11
24Cr: [Ar] 3d5 4s1 29Cu: [Ar] 3d10 4s1
42Mo: [Kr] 4d5 5s1 47Ag: [Kr] 4d10 5s1 79Au: [Xe] 4f14 5d10 6s1
Cấu hình electron nguyên tử của năm nguyên tố trên đều có lớp ngoài cùng là ns1 2 thay vì ns theo
dự đoán, phân lớp đang xây dựng của chúng là (n-1)d5 10
hoặc (n-1)d , tức là chúng có cấu hình
electron bán bão hòa hoặc bão hòa. Để giải thích cho cấu hình electron không theo quy tắc
Klechkowski của các nguyên tố trên, người ta thường cho rằng các electron sắp xếp để đạt cấu
hình bão hòa hoặc bán bão hòa, là các cấu hình tương đối bền. Tuy nhiên, cách giải thích này
không áp dụng đúng cho nhiều cấu hình electron không theo quy tắc Klechkowski khác, ví dụ, ruthenium ( 7 8
44Ru: [Xe] 4d 5s1) và rhodium (45Rh: [Xe] 4d 5s1) cũng có cấu hình electron nguyên tử là
ns1 nhưng không đi kèm với cấu hình bán bão hòa (n-1)d5 10
hay bão hòa (n-1)d . Ngoài ra, tungsten
(74W) và seaborgium (106Sg) cùng thuộc nhóm 6, chúng đều nằm cùng cột với chromium (24Cr) và
molybdenum (42Mo), nhưng vẫn có cấu hình electron nguyên tử theo đúng quy tắc Klechkowski: 14 14
74W: [Xe] 4f 5d4 6s2 và 106Sg: [Rn] 5f 6d4 7s2, cấu hình electron nguyên tử của hai nguyên tố này
không chuyển qua “bán bão hòa bền” như hai nguyên tố đứng phía trên chúng. Đến nay, lời giải
thích tổng quát nhất cho tất cả các cấu hình electron nguyên tử là electron trong nguyên tử phân bố
sao cho nguyên tử đạt trạng thái năng lượng bền nhất.
Vì vậy, đôi khi ta khó dự đoán đúng cấu hình electron nguyên tử của những nguyên tố
không theo đúng quy tắc Klechkowski. Tuy nhiên, vấn đề này không dẫn đến quá nhiều khó khăn
trong dự đoán tính chất hóa học của các nguyên tố vì các nguyên tố hóa học thuộc cùng một
nhóm trong bảng phân loại tuần hoàn vẫn có số electron hóa trị tối đa bằng nhau. Chi tiết vấn đề
này có thể tìm thấy trong các giáo trình hóa học vô cơ.
4.3. Mối liên quan giữa cấu hình electron nguyên tử và tính chất hóa học căn bản của các nguyên
tố trong bảng phân loại tuần hoàn
Các nguyên tố hóa học được chia thành hai loại chính – kim loại và phi kim – dựa vào tính
chất vật lý và hóa học của chúng. Các kim loại có tính chất chung là dẫn nhiệt, dẫn điện tốt, có ánh
kim, mềm dẻo, có nhiệt độ nóng chảy cao, và là các chất khử. Các phi kim có tính chất ngược lại
với kim loại, chúng là các chất oxi hóa và có thể ở dạng khí, lỏng, hoặc rắn ở điều kiện thường, có
tính dẫn nhiệt và dẫn điện kém. Các quan sát thực nghiệm cho thấy tính chất hóa học căn bản của
các nguyên tố thay đổi theo cấu hình electron nguyên tử của các nguyên tố hóa học trong bảng
phân loại tuần hoàn như sau:
Các nguyên tố nhóm 18 (hay VIIIA) có cấu hình electron nguyên tử bão hòa với 8 electron lớp
ngoài cùng (trừ helium thuộc chu kỳ 1). Nguyên tử của các nguyên tố này đều ít có khuynh
hướng phản ứng hóa học với các nguyên tử khác, do đó chúng không được xếp vào
nhóm kim loại lẫn phi kim. Ở điều kiện thường, chúng là các chất khí đơn nguyên tử. Do
hàm lượng của chúng trong tự nhiên rất thấp nên chúng được gọi là các khí hiếm.
Các nguyên tố s (nguyên tố nhóm 1 và 2) hoạt động hóa học rất mạnh. Chúng rất dễ
nhường các electron ở lớp ngoài cùng để tạo thành các ion dương có lớp vỏ electron 63
bão hòa. Đây là các kim loại, tính chất tiêu biểu của chúng là tính khử. Các kim loại thuộc
nhóm 1 thường được gọi là kim loại kiềm, nhóm 2 được gọi là kiềm thổ. Riêng hydrogen,
mặc dù nguyên tố này được xếp vào cùng nhóm với các kim loại kiềm nhưng cấu trúc của
nguyên tử này chỉ gồm một hạt nhân mang điện tích dương và một electron, nên hydrogen
không thể nhường một electron duy nhất để tạo ion dương H+ như các kim loại kiềm cùng
nhóm với nó. Thực tế, hydrogen là phi kim dù được xếp ở nhóm 1.
Các nguyên tố p trong cùng một chu kỳ có cấu hình electron lớp ngoài cùng thay đổi từ ns2 np1
đến ns2 np6, đồng thời tính chất của chúng thay đổi từ kim loại qua phi kim. Các nguyên tố p
thuộc nhóm 13 – 15 có 3 đến 5 electron lớp ngoài cùng, các nguyên tố ở chu kỳ 2 và 3 trong
nhóm này có bán kính khá nhỏ nên electron lớp ngoài cùng của chúng bị nhân giữ mạnh,
chúng không dễ nhường electron trong phản ứng hóa học. Trong các nguyên tố đó, chỉ có
duy nhất nhôm là kim loại. Kim loại nhôm có thể tạo thành ion Al3+ với cấu hình electron khí
hiếm tương tự như các kim loại kiềm và kiềm thổ: Al3+: 1s2 2s2 2p6 (hay [Ne]).
Nguyên tử của các nguyên tố nhóm 13 – 15 thuộc chu kỳ 4 trở đi có bán kính khá lớn, do đó
các electron ở lớp ngoài cùng của các nguyên tố này thường không bị nhân hút mạnh; vì
vậy chúng có khả năng nhường electron và thể hiện tính khử khi tham gia phản ứng hóa
học. Các nguyên tố này là kim loại. Các kim loại của nguyên tố p thuộc chu kỳ 4 trở đi không
tạo cation với cấu hình khí hiếm. Cấu hình cation hay gặp của chúng có 18 electron ở lớp
ngoài cùng (còn được gọi là cấu hình giả khí hiếm), hoặc cấu hình (18 + 2) electron. Ví dụ:
+ Cation với cấu hình giả khí hiếm (18 electron ở lớp ngoài cùng): Ga3+: 1s2 2 6 2 10
2s 2p 3s 3p 6 3d10 (hay [Ar] 3d ) Tl3+: 1s2 2 6 2 6 10 2 6 10 14 2 6 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d10 14 (hay [Xe] 4f 5d10)
+ Cation với cấu hình (18 + 2) electron: In+: 1s2 2 6 2 6 10 2 6
2s 2p 3s 3p 3d 4s 4p 4d 10 5s2 (hay [Kr] 4d10 5s2) Pb2+: 1s2 2 6 2 6 10 2 6 10 14 2 6 10 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 6s 2 (hay [Xe] 4f14 5d10 6s2)
Các nguyên tố p có 5 – 7 electron ở lớp vỏ ngoài cùng (thuộc các nhóm 15 – 17) thường
thể hiện tính oxi hóa bằng cách nhận thêm electron trong các phản ứng hóa học và tạo
thành các ion âm có cấu hình electron bão hòa. Các nguyên tố này là các phi kim. Ngoài ra,
có một số nguyên tố p nằm giữa các kim loại và phi kim, chúng có một vài tính chất giống
kim loại, vài tính chất khác giống phi kim nên được gọi là các á kim (metalloid). Đó là silicon
(Si), germanium (Ge), arsenic (As), antimony (Sb), và tellurium (Te).
Bảng 4.3 tóm tắt một số kiểu cation hay gặp, Hình 4.4 tóm tắt khuynh hướng tạo ion của các nguyên tố s và p.
Các nguyên tố d: các nguyên tố d trong cùng chu kỳ có số electron ở phân lớp đang xây dựng
(n-1)d thay đổi từ 1 – 10, đó là các electron thuộc lớp bên trong; lớp electron ngoài cùng của
chúng (ns) luôn chỉ có một hoặc hai electron, do đó chúng đều dễ mất các electron ns trong
phản ứng hóa học, chúng là các kim loại với tính chất tiêu biểu là tính khử. Tuy nhiên, các
electron ở phân lớp (n-1)d cũng có khả năng tham gia tạo liên kết hóa học nên hóa tính của các
kim loại nguyên tố d phức tạp hơn các kim loại nguyên tố s 64
và p. Các nguyên tử nguyên tố d có thể tạo các ion dương với cấu hình electron (n-1)dx với x
thay đổi trong khoảng 0 – 10. Ví dụ, ion Cr2+ 4 3+ 3
có cấu hình electron là [Ar] 3d , Cr là [Ar] 3d , Cu2+ 9
là [Ar] 3d . Đây là nhóm các ion có “cấu hình electron khác” trong Bảng 4.3.
Bảng 4.3. Một số kiểu cấu hình electron hay gặp của các cation Cấu hình electron giả
Cấu hình electron khí hiếm khí hiếm (18 electron)
Các cấu hình electron khác Cấu hình (18 + 2) electron
Các nguyên tố f có cấu hình electron lớp ngoài cùng là 6s2 2
hoặc 7s (xem Bảng 4.2). Thực tế,
tính chất hóa học của chúng rất giống lanthanum và actinium, chúng dễ mất hai electron lớp
ngoài cùng và một hoặc hai electron thuộc phân lớp (n-1)d hoặc (n-2)f để tạo các cation R2+,
R3+, hoặc R4+. Các nguyên tố f đều là các kim loại. a) b)
Hình 4.4. Khuynh hướng tạo ion của các nguyên tố s và p:
a) Các kim loại có khuynh hướng tạo cation với cấu hình electron khí hiếm ở cột trái; b)
Các phi kim có khuynh hướng tạo anion với cấu hình electron khí hiếm ở cột phải.
Như vậy, dựa vào cấu hình electron nguyên tử và vị trí của các nguyên tố trong bảng phân loại
tuần hoàn, ta có thể dự đoán tính chất hóa học căn bản của các nguyên tố. Hầu hết các nguyên
tố trong bảng phân loại tuần hoàn đều là kim loại, chỉ một số ít các nguyên tố p ở góc phải của
bảng là phi kim, các nguyên tố thuộc nhóm 18 là khí hiếm. Trong các phần tiếp theo, ta sẽ xem
sự biến thiên tuần hoàn một số tính chất quan trọng khác của nguyên tử. 65
4.4. Biến thiên tuần hoàn một số tính chất của nguyên tử
4.4.1. Bán kính nguyên tử và biến thiên bán kính nguyên tử trong bảng phân loại tuần hoàn
4.4.1.1. Khái niệm bán kính nguyên tử
Theo thuyết cơ học lượng tử, càng xa nhân nguyên tử, mật độ electron càng giảm, nhưng
không bằng không. Vì vậy, nguyên tử không có giới hạn không gian một cách chính xác. Bán kính
nguyên tử là một khái niệm có tính quy ước, là bán kính của orbital chứa electron lớp ngoài cùng,
sao cho trong bán kính đó tổng xác suất tìm thấy electron là 95%.
Trong thực tế, ta xác định được khoảng cách giữa các nguyên tử trong các chất bằng
nhiều phương pháp khác nhau. Tùy theo bản chất liên kết giữa các nguyên tử mà người ta có
các quy ước về bán kính nguyên tử như sau:
- Bán kính kim loại là 1/2 khoảng cách giữa hai nguyên tử giống nhau, liên kết với nhau
bằng liên kết kim loại trong mạng tinh thể kim loại. Khái niệm bán kính này được dùng cho các kim loại.
- Bán kính cộng hóa trị là 1/2 khoảng cách giữa hai nguyên tử giống nhau, liên kết với nhau
bằng liên kết cộng hóa trị. Như sẽ đề cập chi tiết hơn ở Chương 5, liên kết cộng hóa trị có
thể là liên kết đơn hoặc liên kết bội, chiều dài liên kết đơn và liên kết bội không bằng nhau,
do đó, bán kính cộng hóa trị của nguyên tử thường được quy ước là bán kính cộng hóa trị
với liên kết đơn, và được gọi là bán kính cộng hóa trị đơn, hay vắn tắt là bán kính cộng hóa
trị. Khái niệm bán kính cộng hóa trị thường được dùng cho các phi kim. Ví dụ, hai nguyên tử
bromine trong phân tử Br2 liên kết với nhau bằng một liên kết cộng hóa trị, khoảng cách đo
được giữa hai hạt nhân nguyên tử Br là 2.28 Å, do đó bán kính cộng hóa trị của nguyên tử bromine là 1.14 Å.
- Bán kính van der Waals là 1/2 khoảng cách giữa hai nguyên tử của cùng một nguyên tố
nhưng thuộc hai phân tử khác nhau trong mạng tinh thể, lực liên kết giữa hai phân tử khi đó
là lực van der Waals, sẽ được nói chi tiết ở Chương Y). Bán kính van der Waals luôn luôn
có giá trị lớn hơn bán kính cộng hóa trị do các nguyên tử tiến đến gần nhau hơn khi chúng
tạo thành liên kết cộng hóa trị, điều này sẽ được nói rõ hơn ở Chương 6. Ví dụ, bán kính
cộng hóa trị đơn và bán kính van der Waals của bromine lần lượt là 1.14 Å và 1.85 Å. Hình
4.5B minh họa sự khác biệt giữa bán kính cộng hóa trị và bán kính van der Waals đối với
các phân tử cộng hóa trị. Đối với các khí hiếm, trạng thái bền của chúng là đơn nguyên tử.
Ở nhiệt độ thấp, các khí hiếm hóa rắn, khi đó lực tương tác giữa các nguyên tử khí hiếm
trong mạng tinh thể là lực van der Waals, vì vậy, 1/2 khoảng cách giữa các nguyên tử khí
hiếm trong mạng tinh thể ứng với bán kính van der Waals của chúng.
Hình 4.5 biểu diễn các loại bán kính quy ước khác nhau. Các giá trị bán kính kim loại,
bán kính cộng hóa trị đơn, và bán kính van der Waals là các giá trị thực nghiệm, chúng còn
được gọi là bán kính hiệu dụng và thường được dùng trong thực tế. Trong khi đó, bán kính
orbital nguyên tử chỉ có giá trị lý thuyết. 66
Hình 4.5. A) Các kiểu bán kính quy ước khác nhau
B) So sánh bán kính cộng hóa trị và bán kính van der Waals.
4.4.1.2. Biến thiên bán kính nguyên tử của các nguyên tố trong bảng phân loại tuần hoàn Hìn
h 4.6. Bán kính kim loại và bán kính cộng hóa trị của các nguyên tử thuộc các chu kỳ từ 2 đến
6 trong bảng phân loại tuần hoàn.
Bán kính nguyên tử của các nguyên tố hóa học mặc dù được đo theo những quy ước khác nhau,
nhưng chiều hướng biến thiên của bán kính nguyên tử vẫn tương tự như của bán kính orbital
nguyên tử. Biến thiên bán kính kim loại và bán kính cộng hóa trị của các nguyên tử trong bảng
phân loại tuần hoàn được biểu diễn trong Hình 4.6. Vì không đo được bán kính kim loại và bán
kính cộng hóa trị của các khí hiếm nên không có giá trị bán kính nguyên tử các 67
nguyên tố hiếm trong hình này. Dễ dàng nhận thấy trong mỗi chu kỳ, khuynh hướng chung là bán
kính nguyên tử của các nguyên tố hóa học giảm từ đầu đến cuối chu kỳ. Ta thấy điều này rõ ràng
nhất trong chu kỳ 2 và 3, tức là các chu kỳ ngắn. Người ta cho rằng các nguyên tố trong một chu kỳ
có số lớp electron bằng nhau, nhưng điện tích hạt nhân nguyên tử tăng (Z tăng), do đó electron
ngày càng bị hút về gần nhân hơn, dẫn đến bán kính nguyên tử giảm dần.
Trong các chu kỳ 4, 5, và 6 ở Hình 4.6, ta thấy bán kính nguyên tử của các dãy nguyên tố d
và f giảm rất ít vì qua mỗi nguyên tử, điện tích hạt nhân tăng một đơn vị, lại có một electron thêm
vào phân lớp (n-1)d hay (n-2)f nằm bên trong, các electron này chắn sức hút của nhân nguyên tử
với electron ns ở lớp bên ngoài, dẫn đến sức hút của nhân nguyên tử đối với electron bên ngoài
thay đổi không đáng kể, do đó bán kính nguyên tử thay đổi rất ít. Hiện tượng bán kính nguyên tử
giảm chậm trong dãy nguyên tố d được gọi là hiện tượng co d, ở dãy nguyên tố f được gọi là hiện tượng co f.
Trong các nhóm của các nguyên tố s và p, bán kính nguyên tử tăng từ trên xuống dưới trong nhóm: Ví dụ Li Na K Rb r(Å) 1.52 1.86 2.27 2.48
Có hai yếu tố tác động ngược chiều nhau đến bán kính nguyên tử của các nguyên tố trong
cùng một nhóm: (i) số lớp electron tăng làm bán kính nguyên tử tăng, (ii) điện tích hạt nhân tăng,
electron được nhân hút mạnh hơn, làm bán kính nguyên tử giảm. Nói một cách tổng quát, yếu tố
nào tác động mạnh hơn sẽ quyết định xu thế chung. Trong trường hợp này, bán kính nguyên tử của
các nguyên tố trong các nhóm s và p tăng được quyết định bởi số lớp electron tăng. Tuy nhiên,
trong nhóm 13 có hiện tượng gallium (Ga) ở chu kỳ 4 có bán kính nguyên tử là 1.22 Å, hơi nhỏ hơn
bán kính của nguyên từ nhôm (Al) là 1.43 Å ở chu kỳ 3. Hiện tượng này cũng được gọi là sự co d:
số lớp electron tăng 1 từ Al đến Ga, nhưng điện tích hạt nhân nguyên tử tăng 18 từ Al đến Ga vì có
dãy nguyên tố 3d, do đó hạt nhân nguyên tử Ga hút các electron lớp ngoài cùng mạnh hơn, vì vậy
bán kính nguyên tử Ga hơi giảm so với Al.
Ngược lại với các nhóm nguyên tố s và p, bán kính nguyên tử trong các phân nhóm nguyên
tố d tăng nhẹ từ chu kỳ 4 qua chu kỳ 5 do điện tích hạt nhân nguyên tử tăng 18 đơn vị qua hai chu
kỳ này. Bán kính nguyên tử của các nguyên tố ở chu kỳ 5 và chu kỳ 6 gần như bằng nhau do điện
tích hạt nhân tăng 32 đơn vị giữa hai chu kỳ. Hiện tượng bán kính nguyên tử các nguyên tố d ở chu
kỳ 5 và 6 bằng nhau được gọi là hiện tượng co f.
Ví dụ; Ti Zr Hf Cu Ag Au r(Å) 1.47 1.61 1.60 1.28 1.44 1.44
4.4.2. Bán kính ion và biến thiên bán kính ion
Bán kính ion đóng vai trò quan trọng trong việc suy luận một số tính chất của các hợp chất ion.
Cũng như đối với nguyên tử, ta không thể xác định chính xác bán kính của ion tự do. Đối với các
hợp chất ion, ta thường đo được khoảng cách giữa hai hạt nhân của cation và anion: d = rcation +
ranion. Trong hầu hết các trường hợp, bán kính của cation và anion trong hợp chất ion không bằng
nhau, do đó ta không thể suy ra bán kính ion từ các giá trị d một cách đơn giản.
Có nhiều yếu tố ảnh hưởng đến kích thước của ion. Ta sẽ xem kích thước tương đối của ion so với
nguyên tử. Một cách hợp lý, người ta lập luận rằng khi nguyên tử mất electron để tạo thành ion
dương, các electron còn lại sẽ bị hạt nhân hút mạnh hơn, vì vậy kích thước ion dương sẽ nhỏ hơn
kích thước nguyên tử. Khi nguyên tử càng mất nhiều electron thì kích thước ion 68
dương tạo thành càng nhỏ. Ngược lại, khi nguyên tử nhận thêm electron để tạo thành ion âm thì
bán kính của nó sẽ tăng lên. Do đó, đối với một nguyên tố hóa học, ta có: r M2+ < rM+< rM < rM-… Vì
vậy, khi nói đến bán kính ion ta phải luôn luôn kèm theo điện tích ion.
Từ các số liệu khoảng cách d giữa cation và anion trong hợp chất ion, người ta ước lượng
gần đúng bán kính của một ion để làm chuẩn và từ đó tính ra bán kính của các ion khác, rồi lập ra
bảng bán kính quy ước của ion. Ví dụ, nếu dùng bán kính ion O2– là 140 pm làm chuẩn, từ khoảng
cách Mg–O trong hợp chất MgO ta tính được bán kính ion Mg2+, tiếp theo, từ khoảng cách Mg–Cl trong hợp chất MgCl –
2 ta có bán kính ion Cl , v.v… Bán kính các ion đơn giản trong Hình 4.7 là một
trong các bảng dữ liệu lập ra theo cách trên.
Thực tế, có nhiều yếu tố khác ảnh hưởng đến bán kính ion. Hiện nay, chúng đã được
xem xét và đưa vào các phép ước lượng gần đúng, kết quả là ta có các bảng số liệu bán kính
ion thay đổi theo các yếu tố ảnh hưởng, các bảng số liệu như vậy có thể tìm thấy trong các tài liệu chuyên sâu hơn.
Hình 4.7. Bán kính nguyên tử và bán kính ion (nm) của một số nguyên tố.
Từ dữ liệu bán kính ion của một số ion đơn giản trong Hình 4.7, ta có thể nhận thấy một số
quy luật biến thiên bán kính ion như sau:
- Các ion có điện tích ion giống nhau trong cùng nhóm nguyên tố s hay p: bán kính ion biến
thiên tương tự như bán kính nguyên tử, nghĩa là các ion có cùng điện tích ion có bán
kính tăng dần trong nhóm. Ví dụ: Li+ Na+ K+ Rb+ r+(Å) 0.59 0.99 1.38 1.48 69 F– Cl– Br– I– r– (Å) 1.33 1.81 1.96 2.20
- Trong một chu kỳ, bán kính ion thay đổi theo điện tích ion: cation có điện tích dương càng
lớn thì bán kính ion càng nhỏ, anion có điện tích ion âm càng lớn thì bán kính ion càng lớn.
- Các ion có số electron bằng nhau và cấu hình electron giống nhau được gọi là các ion đẳng
điện tử. Các ion đẳng điện tử có bán kính giảm khi điện tích hạt nhân nguyên tử tăng. Ví dụ,
các ion S2–, Cl–, K+, và Ca2+ có điện tích hạt nhân nguyên tử tăng dần, nhưng có số electron
trong ion bằng nhau và cấu hình electron giống nhau: 1s2 2s2 2p6 3s2 3p6, bán kính ion của
chúng giảm dần theo thứ tự trên. S2– Cl– K+ Ca2+ Z 16 17 19 20 rion(Å) 1.84 1.81 1.38 1.00
4.4.3. Năng lượng ion hóa nguyên tử và biến thiên năng lượng ion hóa của các nguyên tử trong
bảng phân loại tuần hoàn
Năng lượng ion hóa nguyên tử (hoặc ion), thường được gọi ngắn gọn là năng lượng ion hóa, là
năng lượng cần thiết để lấy electron ra khỏi nguyên tử (hoặc ion) cô lập ở trạng thái khí. Năng
lượng ion hóa là năng lượng ứng với các quá trình biến đổi sau:
X (k) → X+ (k) + 1e I1: năng lượng ion hóa thứ nhất (4.1)
X+ (k) → X2+ (k) + 1e I2: năng lượng ion hóa thứ hai (4.2) v.v…
Bảng 4.4. Năng lượng ion hóa nguyên tử (kJ/mol) của một số nguyên tố hóa học H He 1312 2372 Li Be 899 Al 578 Si P S Cl Ar 520 C 786 1012 1000 1251 1521 Mg 738 N O F Ne 1086 Na 496 B 801 1402 1314 1681 2081 K 419 Rb 403 Ca 599 Sr 550 Sc 631 Y 617 Ti 658 Zr 661 V 650 Nb 664 Cr 652 Mo 685 Mn 717 Tc 702 Fe 759 Ru 711 Co 758 Rh 720 Ni 757 Pd 804 Cu 745 Ag 731 Zn 906 Cd 868 Ga 579 In 558 Ge 762 Sn 709 As 947 Sb 834 Se 941 Te 869 Br 1140 I 1008 Kr 1351 Xe 1170 Cs Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 377 503 538 681 761 770 760 840 880 870 890 1007 589 715 703 812 890 1037
Năng lượng ion hóa của nguyên tử thường được ký hiệu là I (Ionization – năng lượng ion hóa) với
đơn vị kJ/mol, kcal/mol, hoặc eV (1eV = 23 kcal/mol, hay 1.602 x 10–29 J/nguyên tử). Năng lượng ion
hóa I1 là năng lượng cần cung cấp để lấy electron có năng lượng cao nhất, tức 70
là electron được nhân giữ yếu nhất, ra khỏi nguyên tử. Khi bị lấy ra khỏi nguyên tử, electron được xem như ở xa
nhân vô tận và không còn bị nhân hút nữa. Các nhà hóa học lượng tử thường chấp nhận giả định rằng nếu không
có sự sắp xếp lại cấu hình electron trong ion dương tạo thành sau quá trình ion hóa nguyên tử thì năng lượng ion
hóa cũng chính là năng lượng của orbital nguyên tử chứa electron bị mất đi trong quá trình ion hóa. Mặc dù giả
định trên chỉ là tương đối, nhưng các giá trị năng lượng ion hóa là một trong những thông tin quan trọng để các
nhà khoa học kiểm chứng mô hình cấu trúc electron của nguyên tử.
Có nhiều cách khác nhau để đo năng lượng ion hóa. Thông thường, mẫu nghiên cứu được cho vào ống
phóng điện, nguyên tử hóa, và tăng dần điện thế giữa hai điện cực cho tới khi nguyên tử phóng điện qua ống. Bảng
4.4 là năng lượng ion hóa nguyên tử của một số nguyên tố hóa học. Từ đồ thị biểu diễn biến thiên năng lượng ion
hóa thứ nhất của các nguyên tử ở Hình 4.8, ta thấy trong cùng một chu kỳ, năng lượng ion hóa của các nguyên tố
có xu hướng tăng mặc dù không đều đặn. Người ta cho rằng các nguyên tử trong cùng chu kỳ có số lớp electron
bằng nhau, nhưng điện tích hạt nhân nguyên tử tăng dần kèm theo với bán kính nguyên tử giảm dần từ trái qua
phải nên electron của các nguyên tử ở cuối chu kỳ càng bị nhân nguyên tử giữ chặt hơn. Kết quả là cần nhiều năng
lượng hơn để ion hóa các nguyên tử ở cuối chu kỳ.
Hình 4.8. Biến thiên năng lượng ion hóa thứ nhất của các nguyên tố hóa học.
Sự biến thiên không đều đặn của năng lượng ion hóa của các nguyên tử trong một chu kỳ tạo nên
những cực đại nhỏ, điều này thấy rõ nhất ở chu kỳ 2 và chu kỳ 3. Các nguyên tử của nguyên tố có
năng lượng ion hóa ở vị trí cực đại (ví dụ, Be và N ở chu kỳ 2) sẽ khó mất electron hơn các nguyên
tử của nguyên tố đứng trước và sau nó. Ta thấy các cực đại như vậy xảy ra ở những nguyên tố có
cấu hình electron bán bão hòa hay bão hòa, đó là Be (2s2), N (2s2 2 2
2p3), Mg (3s ), và P (3s 3p3). Dữ
kiện này ủng hộ lập luận rằng các cấu hình electron bão hòa và bán bão hòa tương đối bền hơn các
cấu hình khác. Tương tự như vậy, các khí hiếm cuối chu kỳ có cấu hình electron bão hòa bền và có
năng lượng ion hóa cao nhất chu kỳ.
Ngoài ra, hiện tượng năng lượng ion hóa thứ nhất của Be cao hơn của B, của N cao hơn của O cũng có
thể được giải thích theo cách khác. Trong quá trình ion hóa nguyên tử, nguyên tử Be mất electron trên orbital 2s, B
mất electron trên orbital 2p. Vì phân lớp 2p của B có năng lượng cao hơn 2s của Be, do đó năng lượng ion hóa
nguyên tử của B sẽ nhỏ hơn của Be. Trong trường hợp các nguyên tử N và O, khi xảy ra sự ion hóa nguyên tử, N
sẽ mất một electron độc thân thuộc phân lớp 2p, nhưng O mất một electron ghép cặp ở 2p. Vì có tương tác đẩy giữa các 71
electron ghép cặp nên O sẽ dễ mất electron thứ nhất hơn N, do đó năng lượng ion hóa thứ nhất của O nhỏ hơn của N.
Hình 4.9. Cấu hình electron nguyên tử của các nguyên tử Be, B, N, và O.
Hình 4.8 cũng cho thấy năng lượng ion hóa thứ nhất tăng rất ít ở dãy các nguyên tố d trong
chu kỳ 4. Điều đó là do khi tăng điện tích hạt nhân nguyên tử, số electron d điền vào phân lớp bên
trong tăng, chắn sức hút của nhân với electron bên ngoài, nên năng lượng ion hóa của các nguyên
tử tăng không đáng kể. Hiện tượng này được gọi là hiệu ứng chắn của các electron d.
Số liệu trong Bảng 4.4. cho thấy năng lượng ion hóa thứ nhất của các nguyên tố s và p
trong cùng một nhóm giảm do bán kính nguyên tử của các nguyên tố trong cùng nhóm tăng mạnh
hơn sự tăng điện tích hạt nhân nguyên tử, vì vậy lực hút giữa nhân nguyên tử và electron ngoài cùng giảm đi.
Chiều hướng thay đổi năng lượng ion hóa nguyên tử trong các nhóm nguyên tố d phức
tạp hơn. Trong nhiều nhóm nguyên tố d, ta thấy sự thay đổi năng lượng ion hóa xảy ra theo
hướng ngược lại với các nguyên tố s và p: năng lượng ion hóa trong các nhóm này hơi tăng do
bán kính nguyên tử tăng không đáng kể hoặc không tăng, mà điện tích hạt nhân tăng đáng kể giữa các chu kỳ. Ví dụ: V Nb Ta I1 (kJ/mol) 646 664 761
Nhìn chung, trong chu kỳ, năng lượng ion hóa tăng nên tính kim loại của các nguyên tố
giảm. Đối với các nguyên tố s và p, năng lượng ion hóa giảm trong nhóm nên tính kim loại của
các nguyên tố trong cùng nhóm tăng. Ngược lại tính kim loại của các nguyên tố d trong cùng nhóm hơi giảm.
Bảng 4.5. Năng lượng ion hóa (kJ/mol) của các nguyên tố chu kỳ 3 72
Bảng 4.5 là các giá trị năng lượng ion hóa (kJ/mol) thứ nhất (I1), thứ hai (I2), v.v… của các
nguyên tố chu kỳ 3. Các giá trị trong bảng này cho thấy việc tách các electron thứ hai, thứ ba… ra
khỏi nguyên tử càng ngày càng khó khăn hơn vì sau khi mất các electron đầu tiên, các electron
còn lại bị nhân nguyên tử hút mạnh hơn. Tổng quát, với tất cả các nguyên tố hóa học, ta luôn
thấy I1 < I2 < I3 < I4…
Khi phân tích dãy số liệu năng lượng ion hóa thứ nhất, thứ hai, thứ ba… của các nguyên tử
của nguyên tố s và p, ta có thể xác định được nguyên tố đó thuộc nhóm nào trong bảng phân loại
tuần hoàn. Ví dụ, xét các giá trị năng lượng ion hóa của nguyên tử nhôm (Al), đồ thị trên Hình 4.10
cho thấy các giá trị I1, I2, và I3 tăng tương đối đều, nhưng có sự tăng vọt giá trị từ I3 đến I4. Dữ liệu
thực nghiệm này hoàn toàn phù hợp với nguyên tử nhôm có ba electron lớp ngoài cùng. Năng
lượng ion hóa I1, I2, và I3 của nguyên tử nhôm ứng với sự mất lần lượt ba electron ở lớp ngoài
cùng, electron thứ tư của nguyên tử nhôm thuộc lớp bên trong, ở gần nhân hơn, và được nhân hút
mạnh hơn rất nhiều so với ba electron đã nói, do đó năng lượng ion hóa thứ tư của nguyên tử
nhôm lớn hơn các giá trị I1, I2, và I3 rất nhiều. Như vậy, các giá trị năng lượng ion hóa trên cùng với
thông tin nhôm thuộc chu kỳ 3 cho phép ta dự đoán nhôm có ba electron lớp ngoài cùng, cấu hình
electron nguyên tử lớp ngoài cùng của nó là Al: 3s2 3p1, và Al thuộc nhóm 13 trong bảng phân loại tuần hoàn.
Hình 4.10. Biểu diễn năng lượng ion hóa I1, I2, I3, và I4 của nguyên tử nhôm
Ngoài ra, năng lượng ion hóa của nguyên tử còn đặc trưng cho khả năng nhường electron
của nguyên tử để trở thành cation. Nguyên tố hóa học có năng lượng ion hóa nguyên tử càng thấp
càng dễ nhường electron trong phản ứng hóa học, tính kim loại và tính khử của nguyên tố đó càng
mạnh. Do có mối liên quan giữa năng lượng ion hóa nguyên tử và tính chất của nguyên tố hóa học,
đôi khi người ta cũng dùng cụm chữ “năng lượng ion hóa của nguyên tố hóa học” mặc dù cách
dùng này không chính xác.
4.4.4. Ái lực điện tử và biến thiên ái lực điện tử của các nguyên tử trong bảng phân loại tuần hoàn
Ái lực điện tử đặc trưng cho khuynh hướng nhận thêm electron của nguyên tử. Có nhiều
quy ước khác nhau về năng lượng ứng với ái lực điện tử. Trong tài liệu này, ta quy ước ái lực điện
tử của nguyên tử là năng lượng tương ứng với quá trình nguyên tử cô lập ở trạng thái khí kết hợp
với electron để tạo thành ion âm, tức là quá trình sau:
X (k) + e → X– (k) A1 (4.3)
Bảng 4.6 là giá trị ái lực điện tử (kJ/mol) của một số nguyên tố hóa học trong bảng phân
loại tuần hoàn. Ta thấy hầu hết các nguyên tử có ái lực điện tử âm, một vài nguyên tử có ái lực
điện tử dương. Khi A1 dương, nguyên tử chống lại sự nhận thêm electron, nói cách khác, sự 73
nhận thêm electron không thuận lợi về mặt năng lượng; khi A1 âm, nguyên tử nhận thêm electron
kèm theo sự phát ra năng lượng, tức là quá trình nhận thêm electron thuận lợi về mặt năng lượng.
Như vậy, nguyên tử có ái lực với electron càng mạnh khi giá trị A1 càng âm. Điều cần để ý khi đọc
các tài liệu khác là có một số tài liệu có thể dùng ái lực điện tử theo quá trình ngược lại với (4.3),
khi đó A1 có dấu ngược với quy ước ta đang dùng; hoặc đơn giản hơn nữa, một số tài liệu chỉ
dùng giá trị tuyệt đối (không có dấu) của A1.
Việc nhận thêm electron thứ hai hoặc thứ ba vào nguyên tử luôn luôn không thuận lợi về
năng lượng do có sự đẩy nhau giữa ion âm và electron thêm vào, nên các giá trị A2, A3 luôn luôn dương.
Bảng 4.6. Ái lực điện tử (kJ/mol) của các nguyên tử của một số nguyên tố hóa học
trong bảng phân loại tuần hoàn Đến nay, chỉ có
một vài nguyên tố hóa học được đo ái lực điện tử một cách trực tiếp. Ái lực điện tử của một số
nguyên tố khác được xác định bằng các phương pháp gián tiếp. Do đó,
các số liệu về ái lực điện tử không phổ biến như giá trị năng lượng ion hóa nguyên tử. Ái lực điện
tử đặc trưng cho khả năng nhận thêm electron của nguyên tử, ái lực điện tử càng mạnh (ứng với
A1 càng âm) thì nguyên tử càng dễ nhận thêm electron, do đó tính phi kim của nguyên tố càng mạnh.
Biến thiên ái lực điện tử của các nguyên tố hóa học trong một chu kỳ khá phức tạp. Một số
nguyên tử có cấu hình electron bão hòa hoặc bán bão hòa như Be, N, Mg, và các khí hiếm có A1
dương, tức là ái lực điện tử rất yếu. Các nguyên tử có ái lực điện tử mạnh nhất trong chu kỳ là các
halogen, phù hợp với tính phi kim của chúng cao nhất trong chu kỳ. Trong một chu kỳ, nếu ta bỏ
qua các nguyên tố có ái lực điện tử dương, ta thấy ái lực điện tử của các nguyên tử tăng dần, phù
hợp với tính phi kim của các nguyên tố tăng dần trong chu kỳ.
Biến thiên ái lực điện tử trong từng nhóm nguyên tố cũng không đơn giản. Ví dụ, từ các giá trị ái
lực điện tử của các halogen trong Bảng 4.6 ta thấy ái lực điện tử của các halogen giảm dần từ Cl
đến I. Điều này được giải thích là do bán kính của các nguyên tử halogen tăng dần từ Cl đến I nên
lực hút của nhân nguyên tử với electron nhận thêm giảm dần. Tuy nhiên, trái với xu hướng trên,
nguyên tử F ở chu kỳ 2 có ái lực điện tử kém hơn Cl. Lý do là nguyên tử F có bán 74
kính khá nhỏ, điều đó dẫn đến mật độ electron trên phân lớp 2p đã khá cao nên việc nhận thêm
electron vào nguyên tử F không thuận như nguyên tử Cl với kích thước lớn hơn, vì vậy ái lực điện
tử của F thấp hơn của Cl.
4.4.5. Độ âm điện và biến thiên độ âm điện của các nguyên tố trong bảng phân loại tuần hoàn
Trong thực tế, hầu hết các nguyên tử không tồn tại ở trạng thái đơn nguyên tử. Chúng
thường kết hợp với nhau để tạo thành các đơn chất và hợp chất. Dễ dàng nhận thấy số hợp chất
quanh chúng ta vượt xa nhiều so với số đơn chất. Các dữ liệu thực nghiệm cho thấy trong phần
lớn các hợp chất, electron có khuynh hướng phân bố không đều trên các nguyên tử và tạo thành
các trung tâm tích điện âm và dương. Điều đó ảnh hưởng mạnh tới tính chất của các hợp chất.
Các nhà hóa học rất muốn tìm ra đại lượng nào đó để đánh giá khuynh hướng và mức độ hình
thành các trung tâm tích điện âm và điện dương trên các nguyên tử trong hợp chất. Đại lượng đó
được đặt tên là độ âm điện.
Độ âm điện là đại lượng đặc trưng cho khả năng của nguyên tử hút electron liên kết về phía
mình khi nó liên kết với nguyên tử khác. Nói cách khác, khi hai nguyên tử của hai nguyên tố khác
nhau liên kết với nhau thì nguyên tử của nguyên tố có độ âm điện cao hơn sẽ kéo electron liên kết
về phía nó nhiều hơn và tạo thành trung tâm tích điện âm, nguyên tử còn lại có có độ âm điện thấp
hơn sẽ là trung tâm mang điện tích dương.
Linus Pauling (1901–1995) là người đầu tiên đề nghị thang độ âm điện dựa trên năng lượng
liên kết. Pauling giả thiết rằng khi tạo thành phân tử HX, nếu các electron tạo liên kết phân bố đều
giữa hai nguyên tử H và X thì năng lượng liên kết H – X theo dự đoán sẽ bằng trung bình cộng của
năng lượng liên kết H – H và X – X như phương trình (4.4):
��ೠೠೠ (ೠự đೠáೠ) = ଵଵଵଵ ଵଵଵ ଵ (4.4)
Thực tế, độ âm điện của hai nguyên tử khác nhau thường không bằng nhau. Nếu nguyên tử
X âm điện hơn nguyên tử H, electron liên kết sẽ lệch về phía nguyên tử X nhiều hơn, và tạo thành
phân tử có lưỡng cực H+ X-. Khi đó tương tác tĩnh điện giữa các cực làm năng lượng liên kết EH –
X (thực tế) lớn hơn EH – X (dự đoán).
Pauling đặt: ∆ = ��ଵଵଵ (ଵଵựଵ ଵế) − ��ೠೠೠ (ೠự đೠáೠ) (4.5) Hay: ∆ = �� ଵ
ଵଵଵ − ଵଵଵ ଵଵଵ ଵ (4.6)
và ∆ = �� ೠଵ − ଵଵଵ (4.7)
Trong phương trình (4.7), x và H là độ âm điện của X và H, k là hệ số tỷ lệ. Nếu năng
lượng liên kết được đo bằng eV thì k = 1; nếu năng lượng được đo theo kJ/mol thì k = 96.5. Công
thức (4.7) có thể chuyển thành: ଵ − ଵ = 0.102 ∆ଵ/ଵ (năng lượng tính theo kJ/mol). Do đó,
Pauling tính được hiệu số độ âm điện của từng cặp nguyên tử X và H. Theo lập luận về biến thiên
tính chất của các nguyên tử trong bảng phân loại tuần hoàn, nguyên tử F được xem là có độ âm
điện cao nhất và được Pauling gán cho giá trị F = 4, từ đó người ta tính được độ âm điện của các
nguyên tố khác và lập nên bảng độ âm điện như trong Hình 4.7.
Thang độ âm điện của Pauling được lập nên trên cơ sở năng lượng liên kết. Nhiều nhà hóa học
đã lập các thang độ âm điện trên các cơ sở khác, ví dụ, thang độ âm điện của Mulliken dựa trên
năng lượng ion hóa và ái lực điện tử của nguyên tử, thang của Sanderson dựa trên 75
kích thước nguyên tử, v.v… Đến nay, có khoảng 20 thang độ âm điện khác nhau đã được đề nghị,
nhưng giá trị tuyệt đối của độ âm điện của các nguyên tố hóa học theo các thang đó khá giống
nhau. Lưu ý rằng, độ âm điện của các nguyên tố hóa học không phải là một đại lượng vật lý thuần
túy mà là một đại lượng hoàn toàn mang tính quy ước, nhưng rất tiện dụng. Biết được độ âm điện
của các nguyên tố hóa học, ta có thể đánh giá một cách tương đối tính kim loại hay phi kim của nó:
nguyên tố hóa học có độ âm điện của càng cao thì tính phi kim của nó càng mạnh. Ngoài ra, liên kết
hóa học tạo thành giữa các nguyên tử của các nguyên tố có chênh lệch độ âm điện cao thường sẽ
có tính ion cao; ngược lại, các nguyên tử của các nguyên tố có chênh lệch độ âm điện nhỏ sẽ có
khuynh hướng tạo thành liên kết cộng hóa trị với nhau. Tuy nhiên, không có giá trị hiệu số độ âm
điện nhất định để phân loại liên kết giữa hai nguyên tử là mang tính ion hay cộng hóa trị. Ví dụ, hiệu
số độ âm điện của F và H rất lớn, 1.9, tuy nhiên liên kết hóa học trong phân tử HF là liên kết cộng hóa trị.
Bảng 4.7. Giá trị độ âm điện theo Pauling của các nguyên tố hóa học
trong bảng phân loại tuần hoàn
Từ giá trị độ âm điện trong Bảng 4.7, ta thấy khuynh hướng biến thiên độ âm điện của các nguyên
tố trong bảng phân loại tuần hoàn như sau:
Độ âm điện của nguyên tử tăng dần trong mỗi chu kỳ, các phi kim ở cuối chu kỳ có độ âm
điện cao hơn các kim loại;
Trong nhóm của các nguyên tố s và p, độ âm điện của các nguyên tố giảm dần, phù hợp với
tính kim loại của các nguyên tố tăng dần;
Trong các nhóm nguyên tố d, biến thiên độ âm điện của nguyên tử phức tạp hơn, những nhóm
d đầu dãy có độ âm điện giảm dần trong nhóm, những nhóm d cuối dãy có độ âm điện tăng dần. 76
4.4.6. Tóm tắt biến thiên tuần hoàn một số tính chất căn bản của các nguyên tố trong bảng phân loại tuần hoàn
Hình 4.11. Chiều hướng biến thiên một số tính chất căn bản của các nguyên tố
trong bảng phân loại tuần hoàn
Trong các phần trước của chương này, ta đã xét biến thiên một số tính chất của các nguyên tử
trong bảng phân loại tuần hoàn. Ta sẽ tổng kết các tính chất đó trong phần này. Hình 4.11 tóm tắt
khuynh hướng biến thiên của bán kính nguyên tử (atomic radius), năng lượng ion hóa (ionization
energy), và tính kim loại (metallic character) – phi kim (nonmetallic character) của các nguyên tố s,
d, và p. Dễ thấy rằng, bán kính nguyên tử và năng lượng ion hóa biến thiên ngược chiều nhau, bán
kính nguyên tử càng lớn, năng lượng ion hóa của nguyên tử càng nhỏ, do đó nguyên tử càng dễ
nhường electron, tính kim loại của nó càng mạnh và tính phi kim càng yếu. Theo lập luận đó, tính
phi kim của các nguyên tố tăng trong chu kỳ và giảm trong phân nhóm. Vì vậy, trong bảng phân loại
tuần hoàn, tính phi kim của các nguyên tố tăng theo chiều đường chéo từ góc dưới bên trái của
bảng sang góc phải phía trên của bảng (xem Hình 4.11), tính kim loại tăng theo chiều từ góc phải
trên của bảng đến góc trái bên dưới bảng. Nguyên tố có tính kim loại mạnh nhất trong bảng phân
loại tuần hoàn là caesium (Cs) nằm ở bên dưới - góc trái của bảng (francium (Fr) nằm dưới
caesium thường không được kể vì nguyên tố này có tính phóng xạ). Nguyên tố có tính phi kim
mạnh nhất là fluorine (F) nằm ở phía trên - góc phải của bảng phân loại tuần hoàn (các khí hiếm
không được tính đến vì chúng khá trơ hóa học).
Ngoài ra, đối với các nguyên tố s và p, các nguyên tố nằm trên đường chéo ngược lại ở
Hình 4.11 (đường chéo từ góc trên – bên trái đến góc dưới – bên phải bảng) có tính kim loại tương
đương, điều đó dẫn tới tính chất acid – base của oxide của chúng cũng gần giống nhau. Hình 4.12a
tóm tắt công thức hóa học và chiều hướng thay đổi tính acid – base của các oxide với số oxi hóa
cao nhất của các nguyên tố s và p. Công thức oxide với số oxi hóa cao nhất của các nguyên tố thay
đổi theo số thứ tự nhóm của chúng. Góc trái – bên dưới của bảng là các oxide base (các ô màu
xanh), góc phải – trên của bảng là các oxide acid (các ô màu hồng), giữa các ô đó là các oxide
lưỡng tính (các ô màu tím, gồm BeO, Al2O3, Ga2O3, SnO2, PbO2). Vậy, tính chất acid – base của các
oxide thay đổi dần trong chu kỳ và nhóm: trong chu kỳ, tính acid của oxide tăng dần, trong nhóm,
tính base của oxide tăng dần (tức là tính acid của oxide giảm). Do đó, theo đường chéo từ góc trên
bên trái xuống, tính acid – base của các oxide tương đương nhau. 77
Hình 4.12. a) Hợp chất oxide với số oxi hóa cao nhất của các nguyên tố s và p, các ô
màu xanh là oxide base, màu tím là oxide lưỡng tính, màu hồng là oxide acid; b) Hợp
chất hydride của các nguyên tố s và p, các ô màu xanh là hydride ion, màu hồng là
hợp chất cộng hóa trị phân tử.
Công thức hóa học của các hợp chất với hydrogen của các nguyên tố s và p được tóm tắt
trong Hình 4.12b. Tương tự như các oxide, công thức hợp chất hydride thay đổi theo nhóm,
nhưng bản chất của liên kết trong hợp chất thay đổi trong chu kỳ và trong nhóm. Các hydride trong
các ô màu xanh ở góc trái là hydride ion, trong đó H có số oxi hóa –1. Các hợp chất trong các ô
màu hồng ở góc phải là các phân tử cộng hóa trị, trong đó H có số oxi hóa +1. Hydride ở các ô
giữa (BeH2, MgH2, InH3, TlH) mang tính chất trung gian.
Như vậy, trong chương này ta đã thấy sự biến thiên tuần hoàn một số tính chất của các nguyên tố
hóa học trong bảng phân loại tuần hoàn. Trong chương trình trung học, ta đã biết các khái niệm và
cách xác định hóa trị và số oxi hóa của các nguyên tử trong các chất. Sự biến thiên tuần hoàn của
hóa trị và số oxi hóa của các nguyên tử không đề cập trong phần này. Ta sẽ nói rõ lại khái niệm hóa
trị ở Chương 5, nhưng sẽ không nói lại cách xác định số oxi hóa của các nguyên tử trong hợp chất
hóa học ở chương trình Hóa học đại cương. Sinh viên tự xem lại cách xác định số oxi hóa để sử
dụng trong các chương kế tiếp. Sự biến thiên tuần hoàn số oxi hóa của các nguyên tố hóa học sẽ
được đề cập chi tiết trong chương trình hóa học vô cơ. 78 Chương 5
KHÁI NIỆM CƠ BẢN VỀ LIÊN KẾT HÓA HỌC
VÀ CÁC MÔ HÌNH LIÊN KẾT HÓA HỌC ĐƠN GIẢN
5.1. Khái niệm cơ sở về liên kết hóa học và ba kiểu liên kết hóa học chính
Trong tự nhiên, chỉ có các khí hiếm có thể bền ở dạng đơn nguyên tử và không cần liên kết
với nguyên tử nào khác. Ngoài khí hiếm, tất cả vật chất quanh ta, từ không khí, nước, đất đá, đến
dầu mỏ, cây cối, sinh vật, v.v… đều là các nguyên tử liên kết với nhau tạo thành các đơn chất, hợp
chất, hoặc hỗn hợp của các đơn chất và hợp chất. Với hơn 100 nguyên tố hóa học đã biết, các
nguyên tử của các nguyên tố liên kết với nhau theo nhiều kiểu khác nhau và tạo nên vô số các chất
khác nhau. Câu hỏi đặt ra là tại sao các nguyên tử không tồn tại riêng lẻ mà liên kết với nhau? Các
nhà khoa học đều đồng ý rằng các nguyên tử liên kết với nhau để tạo thành các chất có năng lượng
thấp hơn, tức là tương đối bền hơn các nguyên tử cô lập.
Các nguyên tử liên kết với nhau bằng liên kết hóa học. Liên kết hóa học là lực giữ các
nguyên tử lại với nhau để tạo thành một chất nào đó có thể biểu hiện các tính chất vật lý và hóa học
như một thể thống nhất. Các kết quả nghiên cứu cho thấy rằng tùy theo bản chất liên kết giữa các
nguyên tử với nhau mà mỗi chất có tính chất đặc trưng riêng. Ví dụ như than chì (graphite) và kim
cương đều được tạo thành từ các nguyên tử carbon liên kết với nhau nhưng chúng rất khác nhau:
than chì có màu đen, khá mềm, được dùng làm ruột bút chì và chất bôi trơn trong các động cơ, kim
cương trong suốt và rất cứng nên được dùng làm dao để cắt các vật liệu khác. Tại sao than chì và
kim cương đều được tạo thành từ các nguyên tử carbon nhưng tính chất của chúng khác xa nhau
như vậy? Nguyên nhân là các nguyên tử carbon liên kết với nhau theo các kiểu khác nhau trong than chì và kim cương.
Một ví dụ khác, carbon và silicon cùng thuộc nhóm 14 (nhóm IVA) trong bảng phân loại tuần
hoàn. Ở dạng đơn chất, chúng đều có cấu trúc giống nhau và giống cấu trúc của kim cương. Chúng
tạo thành các oxide có công thức hóa học tương tự nhau, CO2 và SiO2. Từ kiến thức về sự biến
thiên tuần hoàn tính chất của các chất, ta có thể dự đoán CO2 và SiO2 đều là các hợp chất cộng hóa
trị. Tuy nhiên, SiO2 là thành phần chính của cát và thạch anh, là chất rắn ở điều kiện thường và có
nhiệt độ nóng chảy rất cao. Trong khi đó CO2 là sản phẩm của sự hô hấp, là chất khí ở điều kiện
thường. Nói cách khác, CO2 có nhiệt độ nóng chảy rất thấp. Tại sao carbon và silicon cùng thuộc
một nhóm trong bảng phân loại tuần hoàn, các oxide của chúng có công thức tương tự nhau nhưng
tính chất của chúng lại khác xa nhau như vậy? Để trả lời cho các câu hỏi như vậy, các nhà hóa học
phải đề nghị các mô hình để mô tả liên kết hóa học trong các chất. Từ đó, các học thuyết về liên kết
hóa học để giải thích cấu tạo và tính chất các chất ra đời.
Rất nhiều dữ liệu thực nghiệm khác nhau đã được xem xét kỹ lưỡng để đưa ra học thuyết về liên
kết hóa học: nhiệt độ nóng chảy, nhiệt độ sôi, độ cứng, độ dẫn điện, tính tan của các chất, tính chất
của dung dịch, năng lượng liên kết, quang phổ, từ tính, v.v… Trong lịch sử phát triển của thuyết
liên kết hóa học, các nhà khoa học đã tìm cách giải thích liên kết hóa học theo nhiều cách khác
nhau. Ví dụ, Issac Newton (1642–1727) tin rằng có các lực tương tự như lực trọng trường hay lực
điện từ hấp dẫn các nguyên tử với nhau khiến các nguyên tử liên kết với nhau. Jons Jacob
Bezelius (1779–1848) cho rằng các nguyên tử liên kết với nhau bởi lực tĩnh điện để tạo thành các
chất, v.v… Đến năm 1916, khi Gilbert Lewis (1875–1946) và Walther Kossel (1888–1956) dựa vào
cấu trúc nguyên tử theo thuyết cơ học lượng tử để đề nghị các mô




