Preview text:
10/3/2025 Chương 3. ACID – BAZ 1 3.1. Định nghĩa Theo Arrhenius:
Acid: chất khi hòa tan trong nước, phân ly cho ra H+ Baz: OH- HCl → H+ + Cl- (acid) NaOH → Na+ + Cl- (baz) 2 1 10/3/2025 Hạn chế:
- Al2(SO4)3: có tính acid Na2CO3: tính baz
→ không áp dụng cho các acid và baz
không phân ly cho H+ và OH-
- HCl: acid mạnh trong nước
HCl: acid yếu trong acetone 3 Theo Bronsted:
Acid là chất có khả năng cho proton (H+)
Baz là chất có khả năng nhận proton
Acid: HCl + H2O → H3O+ + Cl- Al3+ + H2O → AlOH2+ + H3O+ Baz: NaOH + H+ → Na+ + H2O CO 2- - 3 + H+ → HCO3 4 2 10/3/2025
Acid sau khi cho proton trở thành baz liên hợp với acid đó.
Cặp acid – baz liên hợp: Acid H+ + Baz HCl H+ + Cl−
HCl và Cl−: cặp acid – baz liên hợp
H2S HS− + H+
CH3COOH CH3COO− + H+ 5
- H3O+ và H2O: cặp acid – baz liên hợp
- Acid càng mạnh (càng dễ cho proton)
→ baz liên hợp càng yếu (càng khó nhận proton) và ngược lại.
conjugate acid: acid liên hợp 6 3 10/3/2025
3.2. Cân bằng trong nước – thang pH
Tích số ion của nước:
Nước là dung môi tự proton hóa: vừa có tính acid và tính baz
Phản ứng tự proton hóa của nước:
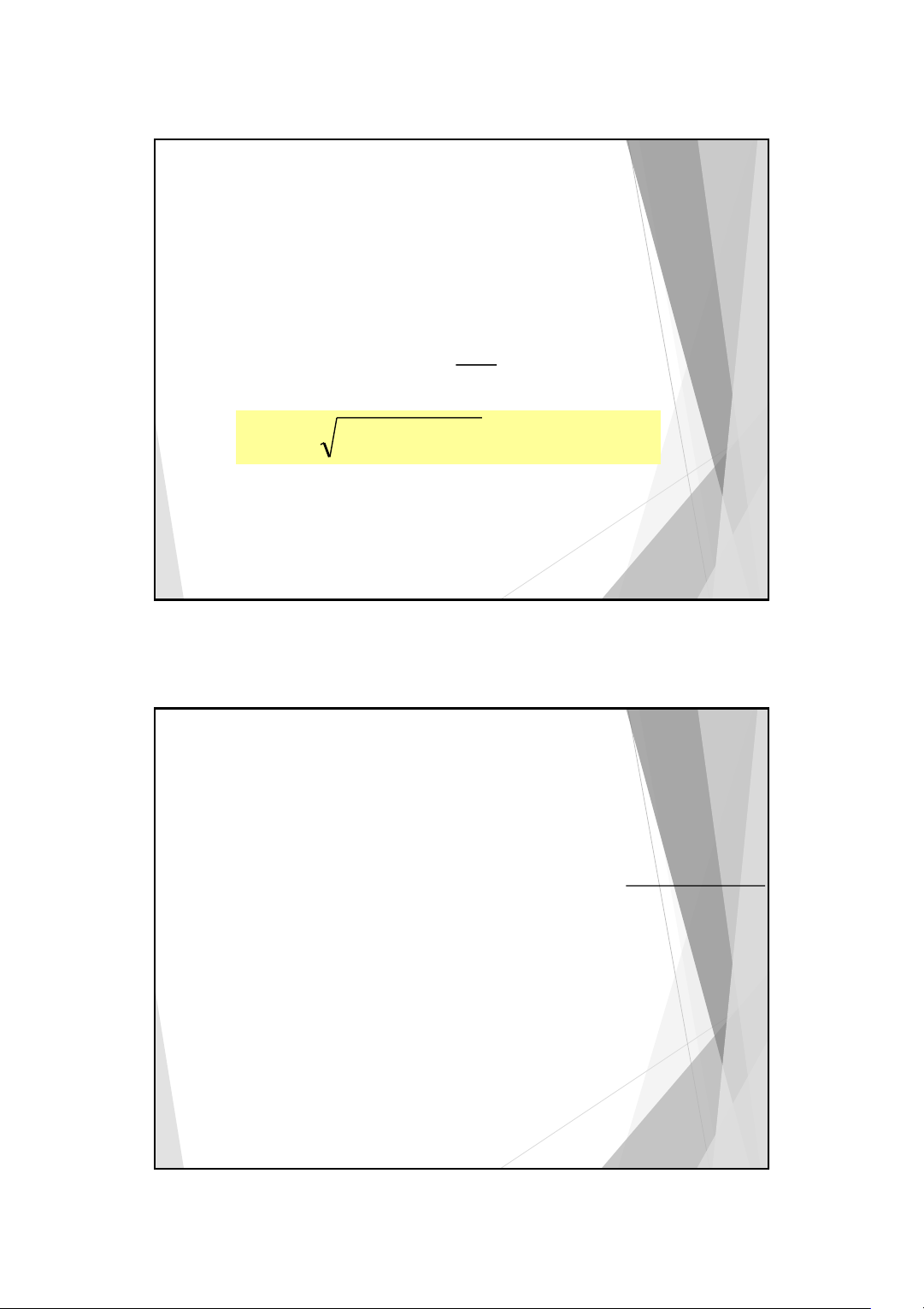
H2O + H2O H3O+ + OH− [H O+ OH ][ − ] 3 K = 2 [H O] 2 7
H2O phân ly rất ít : [H2O]: xem như hằng số
K[H O]2 = K [ + = H O ][ − OH ] 2 H O 3 2
K : tích số ion của nước H O 2
Hằng số, chỉ phụ thuộc nhiệt độ, không phụ
thuộc nồng độ ion H+ và OH- Ở 25oC, 14 K 10− = H2O pK = −logK =14 H2O H2O 8 4 10/3/2025 Thang pH: [H+][OH-] = KH2O
Ở 25oC: [H+][OH-] = 10-14 pH + pOH = pKH2O = 14
Nước nguyên chất: [H+] = [OH-] = 10-7 pH = 7
Tính baz tăng: pH tăng; tính acid tăng: pH giảm 9
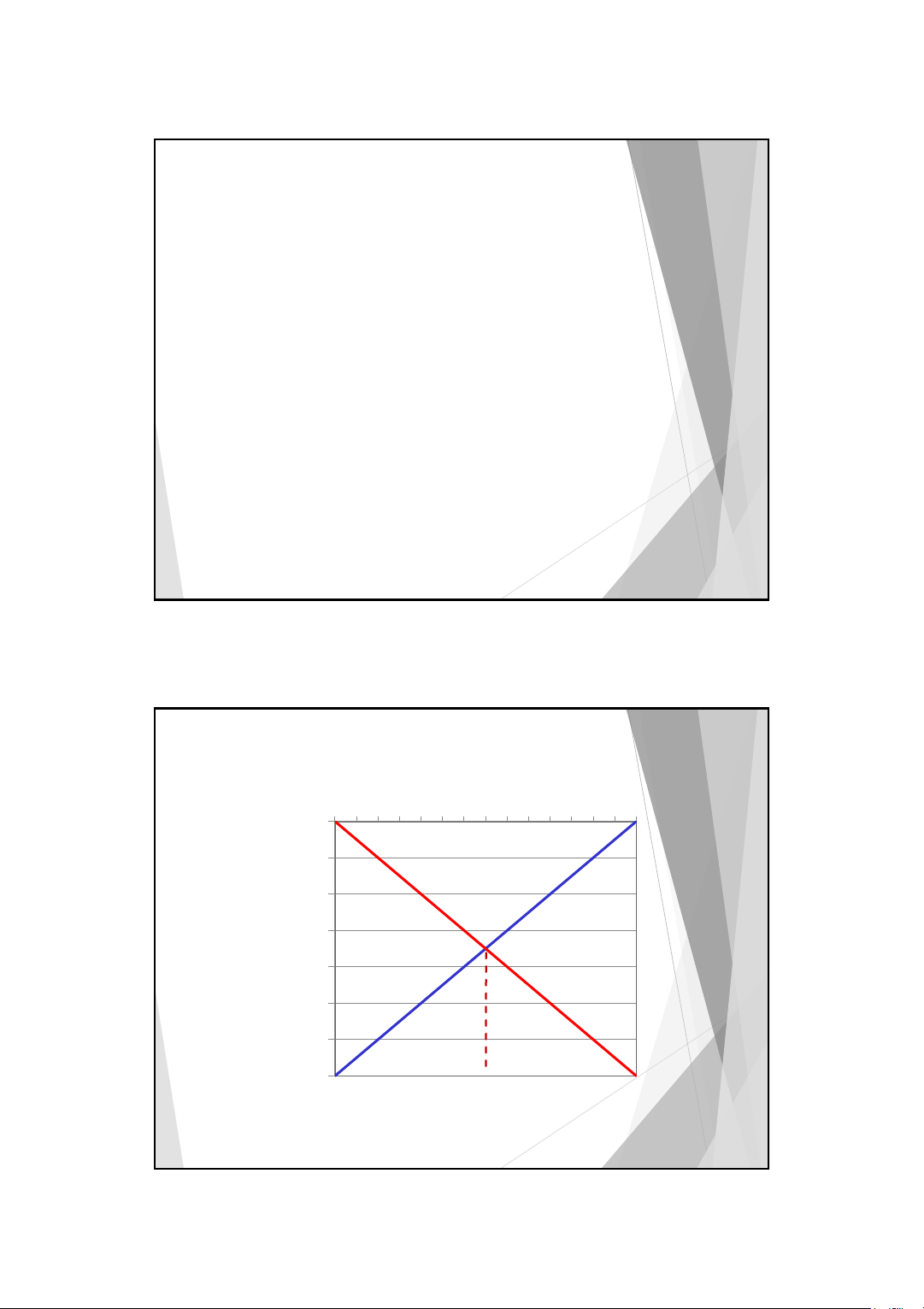
Giản đồ logarit nồng độ 0 [H+] [OH-] -2 -4 logC -6 -8 -10 -12 -14 pH 0 2 4 6 8 10 12 14 10 5 10/3/2025
3.3. Cường độ của acid và base. Hằng số acid Ka và hằng số base Kb:
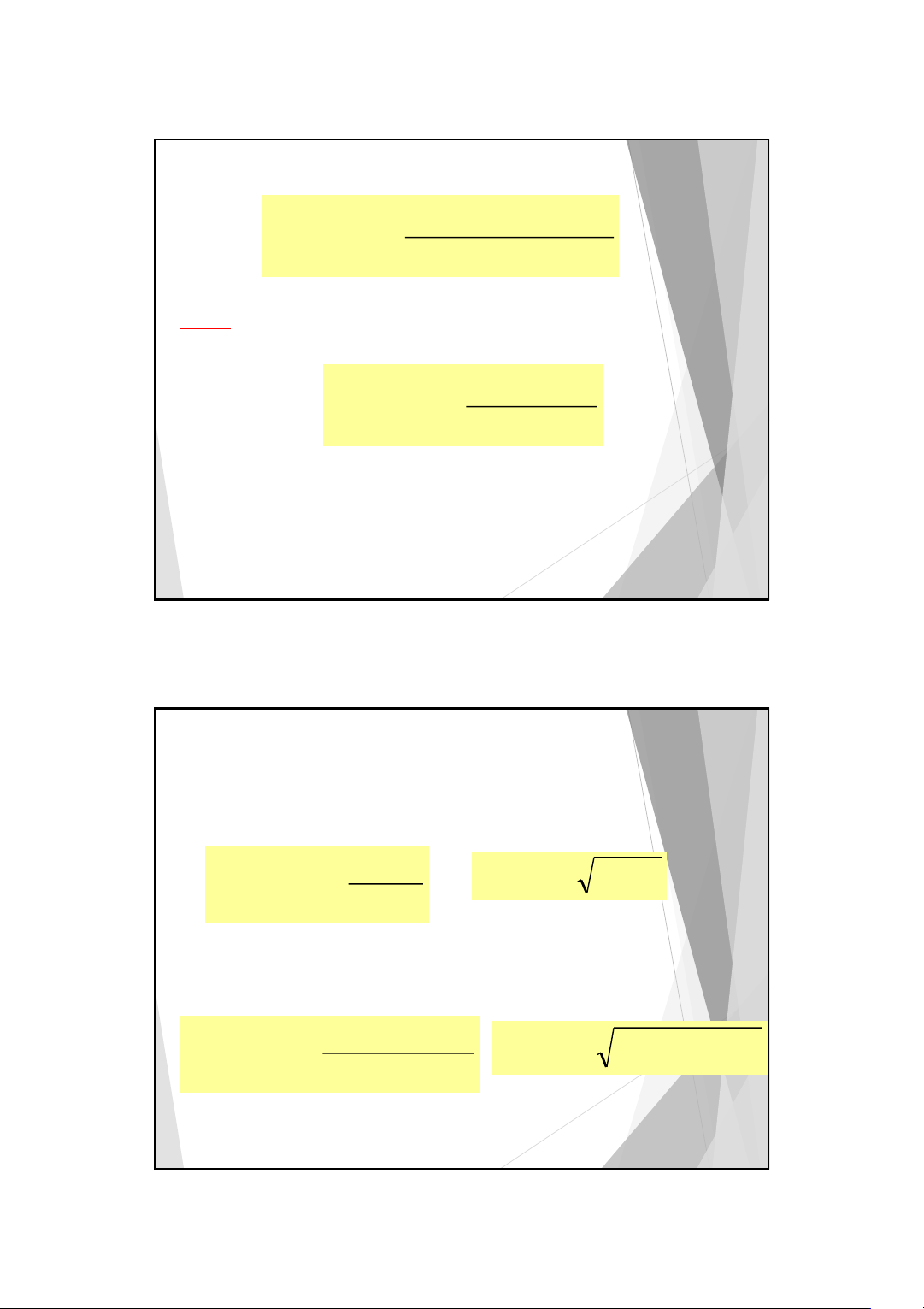
☻Hằng số acid Ka: Acid + H2O Baz + H3O+ [B][H O+ ] [B][H O+ ] 3 3 K = K[H O] = = Ka [ ][ A H O] 2 [A] 2 11
- Ka: hằng số acid, biểu thị cường độ của acid
- Acid càng mạnh: Ka càng lớn pKa = - logKa
CH3COOH, Ka = 1,74.10-5; pKa = 4,76
HCN, Ka = 6,2.10-10; pKa = 9,21
CH3COOH mạnh hơn HCN
Lưu ý: Acid mạnh phân ly hoàn toàn (HCl, HNO3,
H2SO4,…): Ka ~ +∞ 12 6 10/3/2025
☻Hằng số base Kb: B + H2O A + OH− [A OH ][ − ] − K = [A OH ][ ] [ ][ B H O] [ K H O] = = K 2 b 2 [ ] B
- Kb: hằng số base, biểu thị cường độ của base
- Base càng mạnh, Kb càng lớn pKb = - logKb
Base mạnh (KOH, NaOH…): phân ly hoàn toàn
trong nước: Kb = + 13
Hệ thức giữa Ka và Kb của một cặp acid baz liên hợp:
Ka.Kb = [H3O+][ OH−] = KH2O = 10-14 pKa + pKb = pKH2O = 14
- Ka càng lớn (acid càng mạnh),
Kb càng nhỏ (base liên hợp càng yếu) 14 7 10/3/2025
Vd: HF, pKa = 3,2; pKb = 14 -3,2 = 10,8 HCN, pKa = 9,4; pKb = 4,6
pKa HF < pKa HCN: acid HF mạnh hơn HCN
pKb F– > pKb CN– : baz F– yếu hơn CN–
- Acid rất mạnh: HCl → Cl–: base vô cùng yếu
- Base rất mạnh: NaOH → Na+: acid vô cùng yếu 15
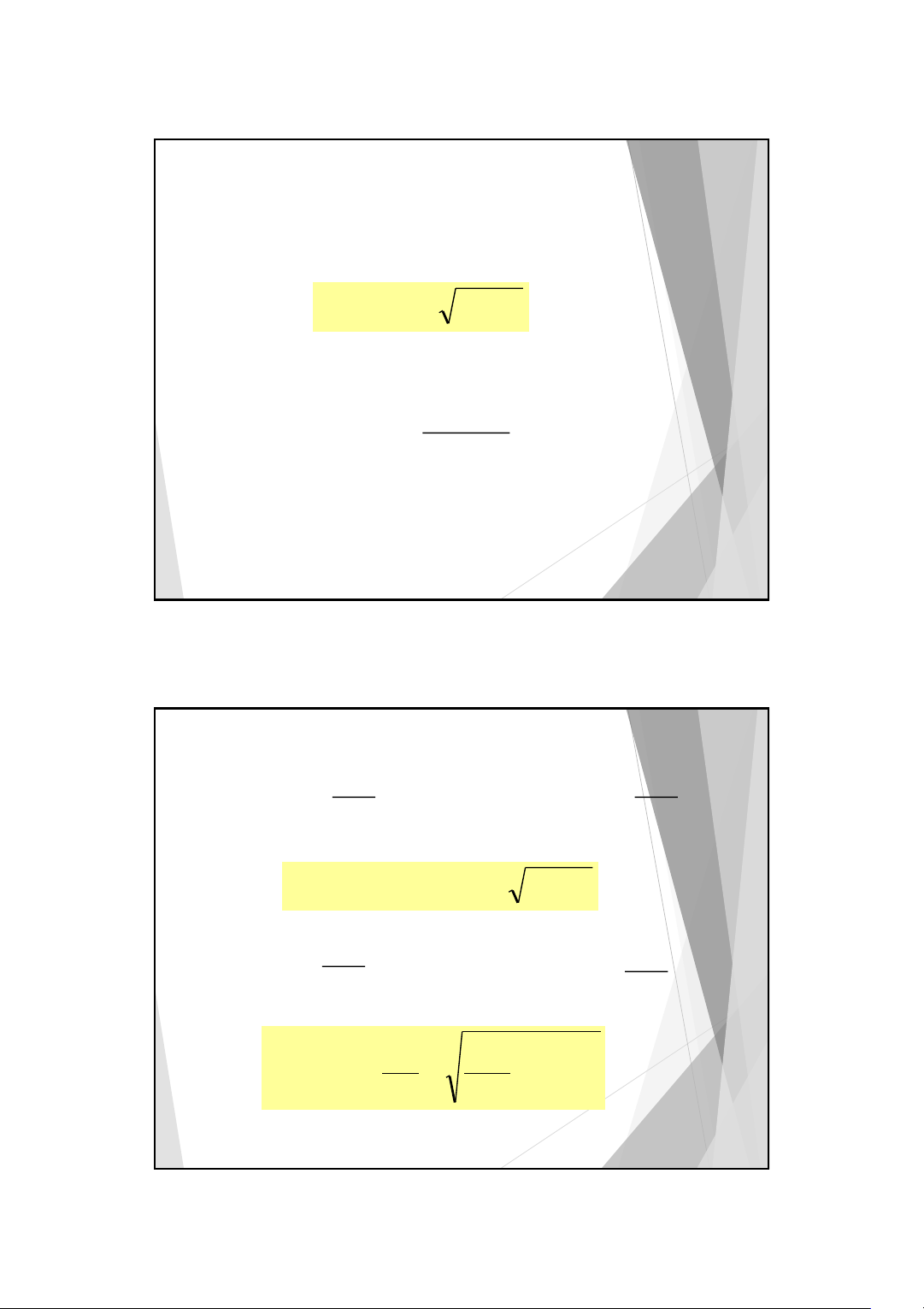
Ví dụ: Tính hằng số Kb của NH3, biết Ka của NH + 4 là 5,7.10-10 NH + 3 + H2O OH- + NH4 − + 14 [OH ][NH ] K − H O 10 4 K 2 = = = b 10 [NH ] K 10 . 7 , 5 − 3 a Kb = 1,8.10-5 16 8 10/3/2025
3.4. pH trong các đơn acid – base mạnh
3.4.1. Dd đơn acid mạnh (HCl, HBr, HI, HNO3,
HClO4): các acid mạnh đều là đơn acid, trừ H2SO4 Tính [H+]
Acid mạnh HA, nồng độ Ca: như thế nào? HA + H2O → H3O+ + A− H2O + H2O H3O+ + OH−
Để đơn giản, thay H3O+ bằng H+ : HA → H+ + A− Các cân bằng H trong dung dịch 2O H+ + OH− 17
H+, OH−, A−, vậy cần có 3 pt :
Pt bảo toàn khối lượng : [A−] = Ca (1)
Pt trung hòa điện (bảo toàn proton) : [H+] = [A−] + [OH−] (2)
Pt tích số ion của nước : [H+][OH−] = KH2O (3) 18 9 10/3/2025
Thay (1) vào (2) và (3) vào (2) ta có:
[H+] = Ca + [OH−] = Ca + KH2O/[H+]
[H+]2 - Ca[H+] - KH2O = 0 (*) ☻ C a 10−6 M :
Bỏ qua [OH−] cạnh Ca (vì [OH−] 10-8M ) → [H+] = Ca pH = - logCa
Ca < 10−6 M : giải phương trình * 19
Vd 1: tính [H+] và pH của dung dịch acid HCl 0,01M CHCl > 10-6 M
→ [H+] = CHCl = 0,01 = 10-2 M pH = - log[H+] = 2
Vd 2: Tính pH của dd HCl Ca = 5*10-8 M
[H+]2 – 5*10-8[H+] - 10-14 = 0
[H+] = 1,28*10-7M, pH = 6,89 20 10 10/3/2025
3.4.2. Dd đơn base mạnh (KOH, NaOH): Base BOH, Cb : BOH → B+ + OH− H2O H+ + OH− BH+, OH− và H+ BTKL: [B+] = Cb THĐT: [OH−] = [B+] + [H+] 21 KH2O/[H+] = Cb + [H+]
[H+]2 + Cb[H+] – KH2O = 0 ☻ C b 10−6 M : Bỏ qua [H+] cạnh Cb → [OH−] = Cb → pOH = - logCb
Cb < 10−6 M : giải phương trình 22 11 10/3/2025
3.6. pH trong các đơn acid – base yếu Tính [H+]
3.6.1. Dd đơn acid yếu: như thế nào?
Acid yếu HA, có nồng độ Ca, hằng số acid Ka : HA H+ + A− [H+ ][A− ] K = (1) a H [HA] 2O H+ + OH−
BTKL: [HA] + [A−] = Ca (2)
THĐT: [H+] = [OH−] + [A−] (3)
[H+][OH−] = KH2O (4) 23 + [HA] (1): [H ] = Ka [A−] (3): [A-] = [H+] – [OH-]
(2): [HA] = Ca - [A-] = Ca - [H+] + [OH-]
→ Thay (2) (3) vào (1) ta có: C −[H+ + ] +[OH− ] [H ] = K a a [H+ ] −[OH− ]
Pt tổng quát để tính [H+] của dd acid yếu 24 12 10/3/2025
TH1 : [OH−] << [H+] (H2O phân ly không đáng kể) : C [H+ + − ] [H ] = K a a [H+ ]
TH2: OH− << [H+] << Ca : H2O và HA phân ly không đáng kể + C [H ] = K a [H+ ] = K C a a a [H+ ] 25
TH3: [H+] OH− và [H+], [OH−] << Ca + C [H ] = K a a [H+]−[OH−] + 14 [H ] = K C +10− a a
Cách tính gần đúng (cách giải bài toán):
1. Tính một giá trị gần đúng của [H+] : [H+ ] = K C gđ a a 26 13 10/3/2025 2. Tính 14 − 10− [OH ] = gđ [H+ ]gđ 3 trường hợp: − 1 + 1 + OH [ ] [H + ] [H ] C gđ gđ 100 gđ a 100 [H+ ] = [H+ ] = K C gđ a a
Quy ước: nhỏ hơn 100 lần thì xem như không đáng kể trong phương trình 27 − 1 + [OH ] [H+ ] + 1 gđ gđ [H ] C 100 gđ a 100 C [H+ + − ] [H ] = K a a [H+ ] 2 + K K a a [H ] = − + + K C a a 2 4 1 + [H+] [OH−] << C + 14 − a = + 100 [H ] K C 10 a a 28 14 10/3/2025
Vd1: Tính [H+] và pH của dung dịch acid
CH3COOH có Ca = 1M và Ka=1,8.10-5. + 5 − 3 [H ] = 8 , 1 10 1 = , 4 210− gđ 14 10− − 1 12 [OH ] = = , 2 410− [H+ ] gđ [H+ ] gđ 100 gđ + 1 −2 [H ] C = 10 gđ 100 a [H+ ] = [H+ ] = , 4 210 3 − M pH = 38 , 2 gđ 29
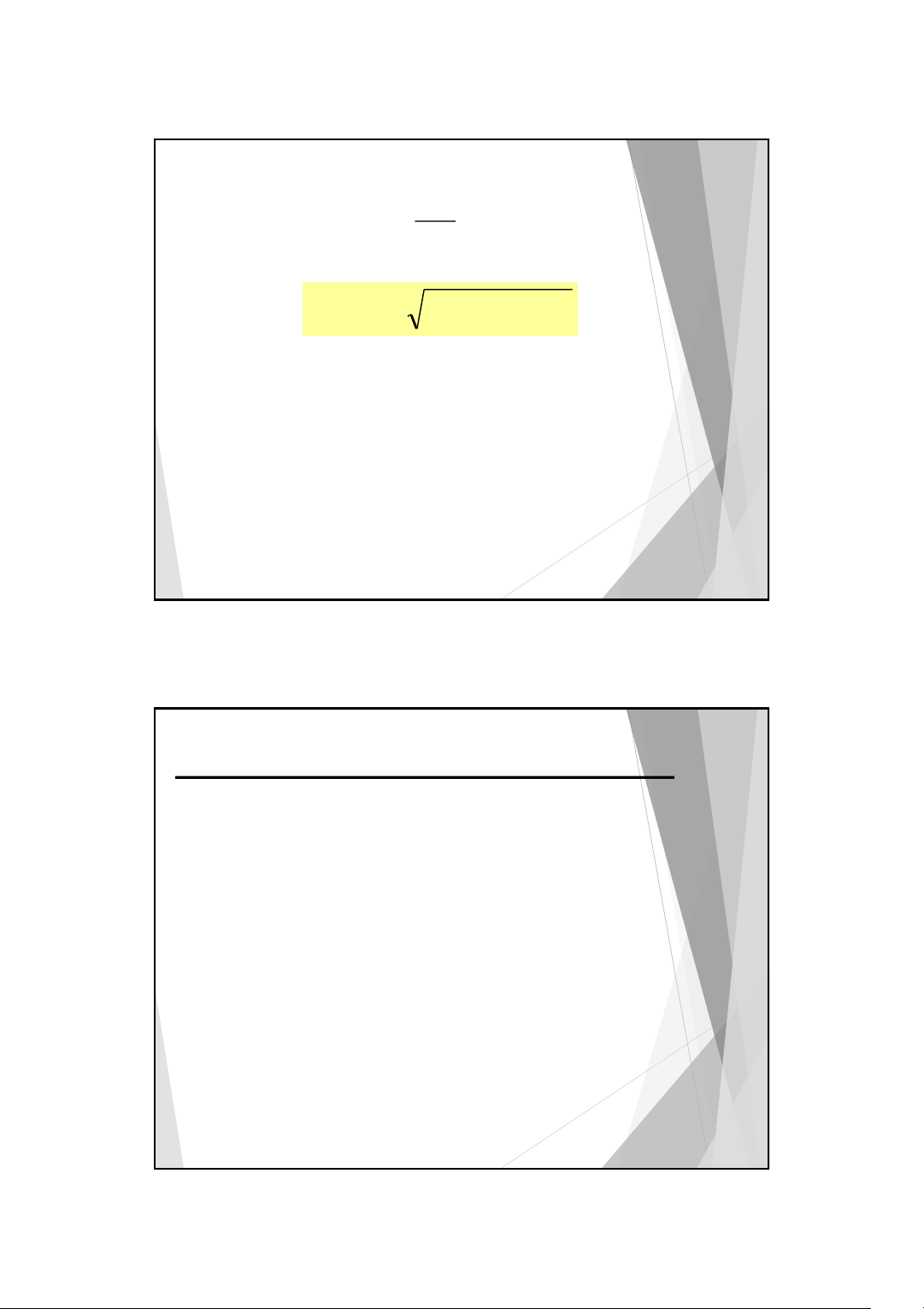
Vd2: Tính pH của dung dịch acid salisilic 10-3M có pKa =3 + 3 [H ] =10− gđ + 1 − 1 [OH ] [H+ ] [H ] C gđ gđ gđ a 100 100 + K K 2 [H ] a a = − + + K C = , 6 210−4 M 2 4 a a pH = 3,21 30 15 10/3/2025
Vd 3: tính pH của dung dịch acid HCN 10-4M với Ka = 6,2.10-10 [H+ ] = 5 , 2 10 7 − M gđ 1
[H+] OH− = 410-8 << Ca 100 [H+ ] = K C +10 14 − = 68 , 2 10 7 − M a a pH = 6,57 31
3.6.2. Dd đơn base yếu Base yếu B, Cb, Kb :
B + H2O BH+ + OH− [BH+ OH ][ − ] K = H b
2O H+ + OH− [ ] B BTKL: [B] + [BH+] = Cb
THĐT: [OH−] = [BH+] + [H+]
[H+][OH−] = KH2O 32 16 10/3/2025 C −[OH− − ] +[H+ ] [OH ] = K b b [OH− ] −[H+ ]
TH1 : [H+] << [OH−] (H2O phân ly không đáng kể): C [OH− − − ] [OH ] = K b b [OH− ] 33
TH2: [H+] << [OH−] << Cb : H2O và B phân ly không đáng kể − C − [OH ] = K b [OH ] = K C b b b [OH− ]
TH3: [OH−] [H+] và [H+], [OH−] << Cb − C [OH ] = K b − 14 OH [ ] = K C +10− b [OH−]−[H+] b b 34 17 10/3/2025 Cách tính gần đúng:
1. Tính một giá trị gần đúng của [H+] : [OH− ] = K C gđ b b 2. Tính 14 + 10− [H ] = gđ [OH− ]gđ
3. Chia thành 3 trường hợp: 35 + 1 − 1 - [H ] [OH− ] [OH ] C gđ gđ 100 gđ b 100 [OH− ] = [OH− ] = K C - gđ b b + 1 [H ] [OH− ] − 1 gđ gđ [OH ] C 100 gđ b 100 2 − K K b b [OH ] = − + + K C b b 2 4 36 18 10/3/2025 1 - [H+] [OH−] << Cb 100 − 14 OH [ ] = K C +10− b b
Vd: Tính pH của dung dịch NH3 có Cb = 10-2 M và pKb=4,75 37
3.5. pH của hỗn hợp acid và base liên hợp. 3.5.1. Tính pH:
Dd acid và baz liên hợp HA + A-: CH3COOH + CH3COO- NH + 4 + NH3 Tính pH của dd: HA, Ca Trộn axit và base NaA, C liên hợp b 38 19 10/3/2025 + − HA H+ + A− [H ][A ] K = a [HA] H2O H+ + OH− NaA Na+ + A-
PTBTKL: [HA] + [A−] = Ca + Cb
→ [HA] = Ca + Cb –[A-] (1)
PTTHĐ: [H+] + [Na+] = [OH−] + [A−]
→[A-] = Cb + [H+] - [OH-] (2) ([Na+] = Cb)
→Thay (2) vào (1): [HA] = Ca – [H+] + [OH-] (3) 39 [H+ ][A− ] K = a [HA]
Thay (2) và (3) vào phương trình trên ta có: + [HA] C −[H+ ] +[OH− ] → [H ] = K = K a a [A−] a C +[H+ ]−[OH−] b 40 20