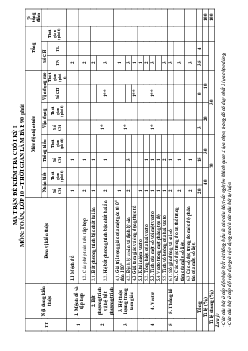


Preview text:
Bài tập Hóa Đại cương Huỳnh Nguyễn Anh Tuấn
CHÖÔNG 1: CAÁU TAÏO NGUYEÂN TÖÛ VAØ HEÄ THOÁNG TUAÀN HOAØN
CAÙC NGUYEÂN TOÁ HOÙA HOÏC ---oOo--- PHAÀN TRAÉC NGHIEÄM C. 76; 24 D. 24; 76
Caâu 1.1 Soá proton vaø nôtron trong haït nhaân: nguyeân
Caâu 1.7 Cho X coù 4 soá löôïng töû cuûa e cuoái cuøng nhö töû laø:
sau: n = 4; l = 0; ml = 0; ms = - ½. X naèm ôû nhoùm naøo A. 92 proton, 235 nôtron trong baûng HTTH? B.235 proton, 92 nôtron A. IA B. IIA C. 92 nôtron, 143 proton C. IB D. IIB D. 143 nôtron, 92 proton
Caâu 1.8 Boä boán soá löôïng töû naøo döôùi ñaây coù theå chaáp nhaän ñöôïc
Caâu 1.2 Cho caùc nguyeân töû: , , ,
Khoâng cuøng teân goïi laø caùc caëp nguyeân töû sau:
A. n = 3, l = +3, ml = +1, ms = +1/2 A. (A, B) B. (C, D)
B. n = 3, l = +1, ml = +2, ms = +1/2 C. (B, C) D. (A,C; A,D; B,C; B,D)
C. n = 2, l = +1, ml = -1, ms = -1/2
Caâu 1.3 Nguyeân töû R coù toång soá caùc haït caùc loaïi laø
D. n = 4, l = +3, ml = -4, ms = -1/2
18. Số hạt mang ñiện gấp ñoâi số hạt khoâng mang ñiện.
Caâu 1.9 Trong boán boä soá löôïng töû n, l, ml döôùi ñaây:
Soá thöù töï cuûa Z trong baûng heä thoáng tuaàn hoaøn laø: 1. n = 4, l = 3, ml = 0 A. 5 B. 6 C. 7 D. 8 2. n = 3, l = 3, ml = -1 3.
Caâu 1.4 Nguyeân töû R coù toång soá haït caùc loaïi laø 115. n = 1, l = 0, ml = 1 4.
Soá haït mang ñieän nhieàu hôn soá haït khoâng mang ñieän n = 3, l = 2, ml = -2
Nhöõng boä coù theå chaáp nhaän ñöôïc laø:
laø 25 haït. A vaø Z cuûa R laàn löôït laø: A. (1) B. (2) vaø (3) A. 80; 35 B. 35; 80 C. (1) vaø (4) D. (4) C. 40; 17 D. 17; 40
Caâu 1.10 Moät orbital nguyeân töû 3d töông öùng vôùi boä
Caâu 1.5 ÔÛ traïng thaùi töï nhieân silic chöùa 3 ñoàng vò
hai soá löôïng töû naøo döôùi ñaây: Ñoàng vò Khoái löôïng Haøm löôïng, A. n = 2, l = 3 B. n = 3, l = 2 nguyeân töû % C. n = 2, l = 2 D. n = 3. l = 1 28Si 27,977 92,23
Caâu 1.11 Moät orbital nguyeân töû 5f töông öùng vôùi boä 29Si 28,976 4,67
soá löôïng töû naøo sau ñaây: 30Si 29,974 3,10 A. n = 3, l = 3 B. n = 4, l = 2
Khoái löôïng nguyeân töû trung bình cuûa silic laø: C. n = 5, l = 3 D. n = 5, l = 4 A. 28,005 B. 28,085
Caâu 1.12 Töông öùng vôùi boä soá löôïng töû n=3, l=2, coù C. 29.058 C. 27.999 toång coäng
Caâu 1.6 Clo töï nhieân (khoái löôïng nguyeân töû laø A. 1 orbital nguyeân töû B. 3 orbital nguyeân töû 35,45) coù 2 ñoàng vò: C. 5 orbital nguyeân töû D. 7 orbital nguyeân töû Ñoàng vò
Khoái löôïng nguyeân töû
Caâu 1.13 Ngöôøi ta xeáp moät soá orbital nguyeân töû coù 35Cl 34,97
naêng löôïng taêng daàn. Caùch saép xeáp naøo döôùi ñaây laø 37Cl 36,97 ñuùng
Haøm löôïng % soá nguyeân töû cuûa 35Cl vaø 37Cl trong töï A. 3s < 3p < 3d < 4s nhieân laàn löôït laø: B. 2s < 2p < 3p < 3s A. 75; 25 B. 25; 75 C. 3s < 3p < 4s < 3d
Chương 1: Cấu tạo nguyên tử và bảng hệ thống tuần hoàn các nguyên tố hóa học Trang 1
Bài tập Hóa Đại cương Huỳnh Nguyễn Anh Tuấn D. 4s < 4p < 4d < 5s
Caâu 1.19 Electron choùt cuøng ñieàn vaøo caáu hình cuûa
Caâu 1.14 Moät nguyeân töû naøo ñoù ôû traïng thaùi bình
nguyeân töû R coù boä 4 soá löôïng töû n = 3, l = 2, ml =-2,
thöôøng coù theå coù caáu hình electron naøo döôùi ñaây:
ms = -1/2. Vaäy nguyeân toá R coù soá thöù töï Z laø: 3s 3p 3d A. 24 B. 26 C. 30 D. 28
Caâu 1.20 Soá electron ñoäc thaân cuûa nguyeân toá A. Fe (Z = 26) laø: B. A. 0 B. 2 C. 4 D. 5
Caâu 1.21 Soá electron ñoäc thaân cuûa nguyeân toá C. Cr (Z = 24) laø: D. A. 4 B. 6 C. 5 D. 3
Caâu 1.15 Nguyeân töû cuûa nguyeân toá coù soá thöù töï
Caâu 1.22 Nguyeân toá Fe coù soá thöù töï Z = 26, ion Fe3+
Z = 35 coù caáu hình electron töông öùng vôùi:
coù caáu hình electron töông öùng laø: A. (Ne) 3s23p1 A. 1s22s22p63s23p63d34s2 B. (Ne) 3s23p63d34s2 B. 1s22s22p63s23p63d44s1 C. (Ne) 3s23p63d104s24p5 C. 1s22s22p63s23p63d5 D. (Ar) 4s24p64d75s2 D. 1s22s22p63s23p63d4
Caâu 1.16 Electron coù 4 soá löôïng töû n = 4, l = 2,
Caâu 1.23 Nguyeân toá R thuoäc chu kyø 4, phaân nhoùm
ml =+1, ms = -1/2 (giaù trò ml xeáp taêng daàn) laø electron
chính nhoùm V (töùc nhoùm VA) coù caáu hình electron thuoäc: nhö theá naøo?
A. Lôùp N, phaân lôùp p, electron thöù hai thuoäc phaân A. 1s22s22p6 3s23p63d104s24p3 lôùp naøy B. 1s22s22p63s23p6 3d104s24p0
B. Lôùp N, phaân lôùp d, electron thöù saùu thuoäc phaân
C. 1s22s22p63s23p6 3d104s24p24d1 lôùp naøy D. 1s22s22p63s23p6 3d54s1
C. Lôùp N, phaân lôùp f, electron thöù nhaát thuoäc phaân
Caâu 1.24 Caáu hình electron lôùp ngoaøi cuøng cuûa lôùp naøy nguyeân toá R laø: 3s23p4
D. Lôùp N, phaân lôùp d, electron thöù chín thuoäc phaân
A. R thuoäc chu kyø 3, nhoùm IVA, laø phi kim lôùp naøy
B. R thuoäc chu kyø 3, nhoùm VIA, laø kim loaïi
Caâu 1.17 Electron choùt cuøng ñieàn vaøo caáu hình
C. R thuoäc chu kyø 3, nhoùm VIA, laø phi kim
electron cuûa nguyeân töû Na (Z = 11) coù boä 4 soá löôïng
D. R thuoäc chu kyø 3. nhoùm VIB, laø kim loaïi töû laø:
Caâu 1.25 Nguyeân toá R coù soá thöù töï Z = 28 ñöôïc xeáp
A. n = 2, l = 1, ml = -1, ms = -1/2 loaïi laø:
B. n = 2, l = 1, ml = 0, ms = -1/2 A. Nguyeân toá s B. Nguyeân toá p
C. n = 3, l = 0, ml = 0, ms = +1/2 C. Nguyeân toá d D. Nguyeân toá f
D. n = 3, l = 1, ml = 0, ms = +1/2
Caâu 1.26 Electron hoùa trò cuûa löu huyønh (Z = 16) laø
Caâu 1.18 Vôùi giaù trò ml xeáp theo thöù töï taêng daàn,
nhöõng electron thuoäc lôùp vaø phaân lôùp sau ñaây:
electron choùt cuøng ñieàn vaøo caáu hình coù boä 4 soá A. 3s B. 3s vaø 3p
löôïng töû: n = 3; l = 1; ml = 0, ms = -1/2. Ñoù laø nguyeân C. 2s, 2p vaø 3s D. 2s, 2p, 3s vaø 3p
toá naøo trong caùc nguyeân toá döôùi ñaây
Caâu 1.27 Electron hoùa trò cuûa Cu (Z = 29) laø nhöõng A. Flo (Z = 9) B. Löu huyønh (Z = 16)
electron thuoäc lôùp vaø phaân lôùp sau ñaây: C. Clo (Z = 17) D. Argon (Z = 18) A. 3d vaø 4s B. 3s, 3p vaø 3d C. 2s, 3p vaø 3s D. 2s, 2p, 3s vaø 3p
Chương 1: Cấu tạo nguyên tử và bảng hệ thống tuần hoàn các nguyên tố hóa học Trang 2
Bài tập Hóa Đại cương Huỳnh Nguyễn Anh Tuấn
Caâu 1.28 Caáu hình electron cuûa ba nguyeân toá Ne,
Caâu 1.34 Xeáp caùc tieåu phaân trong töøng nhoùm sau Na vaø Mg nhö sau:
theo thöù töï taêng daàn cuûa naêng löôïng ion hoùa: Ne 1s22s22p6 a. K+, Ar, Cl- Na 1s22s22p63s1 b. Na, Mg, Al Mg 1s22s22p63s2 c. C, N, O
Caëp nguyeân toá coù naêng löôïng ion hoùa I1 lôùn nhaát vaø
Caâu 1.35 Xeáp caùc nguyeân toá trong töøng daõy döôùi
I2 lôùn nhaát theo thöù töï laø caëp:
ñaây theo thöù töï taêng daàn aùi löïc vôùi electron A. Ne vaø Mg B. Ne vaø Na a. K, Na, Li C. Na vaø Mg D. Na vaø Ne b. F, Cl, Br, I
Caâu 1.29 Nguyeân toá B thuoäc chu kyø 5, nhoùm IIA,
Caâu 1.36 Nguyeân töû cuûa nguyeân toá A coù toång soá
vieát caáu hình electron cuûa B?
electron trong caùc phaân lôùp p laø 7. Nguyeân töû cuûa A. [Kr] 5s2 B. [Ar] 5s2
nguyeân toá B coù toång soá haït mang ñieän nhieàu hôn C. [Kr] 5d2 B. [Ne] 5s2
toång soá haït mang ñieän cuûa A laø 8. Xaùc ñònh vò trí cuûa
Caâu 1.30 Cho bieát: Na (chu kyø 3 nhoùm IA); K (chu A vaø B trong baûng HTTH?
kyø 4 nhoùm IA), Al (chu kyø 3 nhoùm IIIA). Saép xeáp
Caâu 1.37 Moät ion kim loaïi ñieän tích +3 coù 5 electron
theo chieàu taêng daàn baùn kính nguyeân töû?
treân phaân lôùp 3d. Xaùc ñònh teân kim loaïi. A. Al < K < Na
Caâu 1.38 Toång soá caùc haït cô baûn cuûa moät nguyeân töû B. K < Na < Na laø 34. C. Na < K < Al
a. Cho bieát soá thöù töï cuûa nguyeân toá trong baûng D. Al < Na < K HTTH
Caâu 1.31 Cho ion A3+ coù 20 electron, vieát caáu hình
b. Tính soá khoái cuûa nguyeân töû
electron cuûa A. Haõy cho bieát vò trí cuûa A trong baûng
c. Vieát caáu hình electron cuûa nguyeân töû phaân loaïi tuaàn hoaøn?
d. Ñònh vò trí cuûa nguyeân toá trong baûng HTTH
A. [Ar] 4s2, chu kyø 4, nhoùm IIA, oâ 20
Caâu 1.39 Cho bieát caáu hình electron cuûa caùc ion döôùi
B. [Ar] 3d3 4s2, chu kyø 4, nhoùm IIA, oâ 23
ñaây, moãi ion coù bao nhieâu electron lôùp ngoaøi cuøng,
C. [Ar] 3d3 4s2, chu kyø 4, nhoùm VB, oâ 23
ion naøo coù caáu hình electron töông töï khí hieám?
D. [Ar] 3d3 4s2, chu kyø 4, nhoùm VB, oâ 20 Ca2+, Cr3+, Al3+, Zn2+, S2-
Caâu 1.40 Nguyeân toá R taïo hôïp chaát khí vôùi hidro coù coâng thöùc RH PHẦ N TỰ LUẬ N
3. Trong oxit cao nhaát, nguyeân toá R
chieám xaáp xæ 25,93% khoái löôïng. Ñònh teân nguyeân
Caâu 1.32 Cho nguyeân toá X coù z = 26, vieát cấu hình toá.
electron cuûa X, X2+, X3+, ion naøo beàn hôn?
Caâu 1.41 Nguyeân toá R taïo ñöôïc oxit cao nhaát coù khoái
Caâu 1.33 Moät soá nguyeân toá coù caáu hình electron nhö
löôïng phaân töû 102. Ñònh teân R vaø coâng thöùc phaân töû sau: oxit cao nhaát cuûa noù? (A) 1s22s22p1 (B) 1s22s22p6
Caâu 1.42 Vieát caáu hình electron cuûa töøng nguyeân töû (C) 1s22s22p63s23p5 (D) 1s22s22p63s23p63d34s2
hay ion sau. Cho bieát soá electron ñoäc thaân cuûa noù:
Xaùc ñònh vò trí cuûa chuùng (chu kyø, nhoùm, phaân nhoùm, a. Sc (Z = 21)
soá thöù töï) trong baûng HTTH. Nguyeân toá naøo laø kim b. Ni2+ (Z = 28)
loaïi, laø phi kim, laø khí hieám? c. Fe (Z = 26) d. Fe3+ (Z = 26) e. Cu (Z = 29)
Chương 1: Cấu tạo nguyên tử và bảng hệ thống tuần hoàn các nguyên tố hóa học Trang 3