











Preview text:
DẠNG BÀI TẬP ĐÚNG SAI PIN ĐIỆN VÀ ĐIỆN PHÂN A. NỘI DUNG CÂU HỎI
Câu 1. Xét tính đúng sai của các phát biểu sau đây khi nói về cặp oxi hóa khử của kim loại
a. Chất oxi hóa là chất nhận electron còn chất khử là chất nhường electron.
b. Cặp oxi hóa - khử được kí hiệu chung là oxh/kh.
c. Một kim loại chỉ có một cặp oxi hóa - khử.
d. Không nhất thiết phải luôn có sự tham gia của chất oxi hóa và chất khử trong phản ứng oxi hóa - khử.
Câu 2. Xét tính đúng sai của các phát biểu sau đây khi nói về thế điện cực chuẩn của kim loại.
a. Đơn vị thường dùng của thế điện cực là Volt (V)
b. Thế điện cực chuẩn của cặp oxi hóa – khử càng lớn thì tính khử của dạng khử càng lớn,
tính oxi hóa của dạng oxi hóa càng lớn.
c. Thế điện cực chuẩn của cặp oxi hóa – khử càng lớn thì tính khử của dạng khử càng
nhỏ, tính oxi hóa của dạng oxi hóa càng lớn
d. Không thể dựa vào giá trị thế điện cực chuẩn để so sánh tính oxi hóa và tính khử giữa các cặp oxi hóa - khử.
Câu 3. Thế điện cực chuẩn của cặp Au3+/Au bằng +1,520V. Đây là giá trị tương đối lớn
đối với cặp oxi hóa khử của kim loại. Chứng tỏ
a. Au là kim loại có tính khử mạnh.
b. Au là không phản ứng với các acid như HCl, H2SO4 loãng.
c. Ion Au3+ có tính oxi hóa yếu hơn các ion kim loại khác như Fe2+, Al3+.
d. Ion Au3+ có tính oxi hóa mạnh nên được sử dụng để mạ vàng cho các vật liệu khác,
tạo ra lớp phủ vàng đẹp và bền.
Câu 4. Cho các phản ứng xảy ra sau đây:
(1) AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag (2) Mn + 2HCl → MnCl2 + H2
a. Tính oxi hóa: Ag+ < Fe3+.
b. Tính oxi hóa: H+ > Mn2+.
c. Ag là kim loại có tính khử yếu.
d. Mn là kim loại có tính khử khá mạnh.
Câu 5. Cho kim loại A vào dung dịch FeSO4. Sau khi phản ứng xảy ra hoàn toàn, đem
cân thấy khối lượng kim loại tăng.
a. Trong dãy kim loại: Al, Zn, Ag, Mg, Ba, có 2 kim loại có thể là kim loại A.
b. Có thể thay thế FeSO4 bằng Fe(NO3) 2, FeS hoặc FeCl2.
c. Nếu A là Cu thì kim sau khi phản ứng xảy ra hoàn toàn, đem cân thấy khối lượng kim loại giảm.
d. A không thể là Na vì Na phản ứng mãnh liệt với nước trong dung dịch.
Câu 6. Xét bảng giá trị thế điện cực của các cặp oxi hóa – khử sau: Cặp oxi hóa - khử Al3+/Al Zn2+ /Zn Fe2+ /Fe E0(V) -1,676 -0,763 -0,440
a. Aluminium là chất có tính khử mạnh nhất trong các chất trên.
b. Zn2+ có tính oxi hóa mạnh hơn Fe2+ .
c. Thứ tự tính khử tăng dần là Zn < Fe < Al.
d. Tính oxi hóa của Fe2+ > Al3+.
Câu 7. [KNTT - SBT] Ở điều kiện chuẩn, cho bột Cu dư vào dung dịch Fe2(SO4)3 tới
khi phản ứng hoàn toàn, thu được chất rắn X và dung dịch Y Cặp oxi hoá - khử Fe2+/Fe Cu2+/Cu Fe3+/Fe2+
Thế điện cực chuẩn (V) -0,44 +0,340 +0,771
a. X gồm hai kim loại.
b. Cu có tính khử mạnh hơn Fe2+ ở điều kiện chuẩn.
c. Y gồm hai chất tan là CuSO4 và FeSO4.
d. Trong điều kiện Fe2(SO4)3 dư thì Y gồm ba muối.
Câu 8. Mỗi phát biểu sau là đúng hay sai?
a. Quá trình chuyển từ dạng oxi hoá sang dạng khử của cặp oxi hoá - khử được gọi là quá trình khử.
b. Dạng oxi hoá và dạng khử của cùng một nguyên tố kim loại M: Mn+ + ne → M tạo
nên cặp oxi hoá - khử và kí hiệu là Mn+/M.
c. Trong một cặp oxi hoá - khử, dạng oxi hoá và dạng khử không phản ứng với nhau.
e. Trong cặp oxi hoá - khử, tính oxi hoá của dạng oxi hoá luôn mạnh hơn tính oxi hoá của dạng khử.
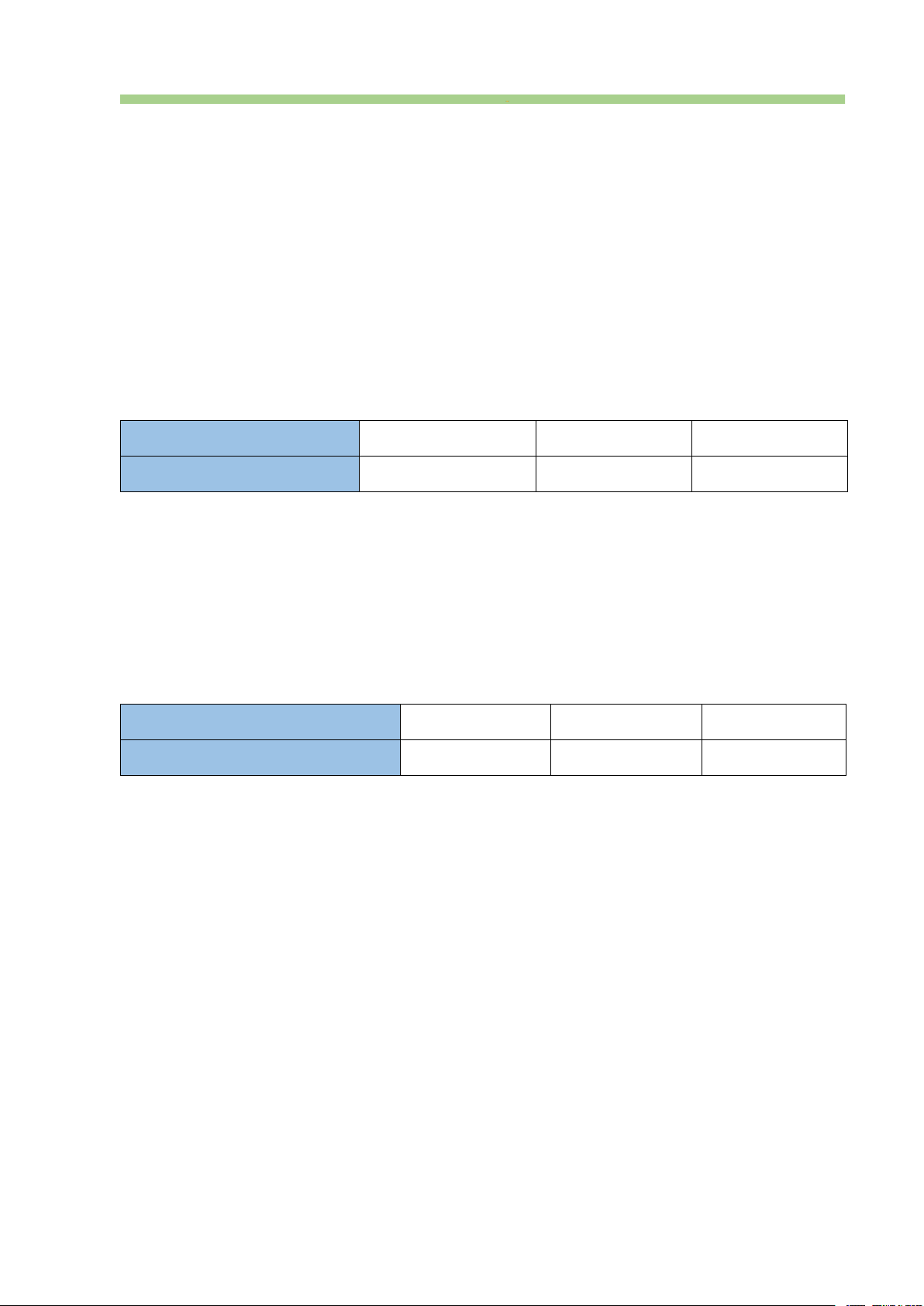
Câu 9. Nhúng thanh kim loại X và thanh kim loại Y (cùng hoá trị II) vào các dung
dịch muối sulfate nồng độ 1 M của chúng ở 25°C. Quá trình thí nghiệm được mô tả bởi hình vẽ sau:
Mỗi phát biểu sau là đúng hay sai?
a. Bề mặt thanh kim loại X mang điện tích âm và bề mặt thanh kim loại Y mang điện tích dương.
b. Giữa bề mặt thanh kim loại và dung dịch muối tồn tại cân bằng giữa dạng oxi hoá và dạng khử.
c. Tính khử của kim loại Y mạnh hơn tính khử của kim loại X.
d. Khi nối hai thanh kim loại với nhau bằng dây dẫn và nối hai dung dịch muối với nhau
bằng cầu muối, sẽ xuất hiện một dòng điện trên dây dẫn. Câu 10. Cho biết: o o E
. Mỗi phát biểu sau là đúng hay sai? 2,713V;E 0,340V 2 Na /Na Cu /Cu
a. Tính khử của kim loại Na mạnh hơn tính khử của kim loại Cu.
b. Tính oxi hoá của ion Cu2+ mạnh hơn tính oxi hoá của ion Na+.
c. Trong dung dịch, kim loại Na khử được ion Cu2+ thành kim loại Cu.
d. Trong dung dịch, kim loại Cu khử được ion Na+ thành kim loại Na.
Câu 11. Mỗi phát biểu sau là đúng hay sai?
a. Trong cặp oxi hoá - khử, các nguyên tử trong dạng oxi hoá có số oxi hoá khác với các
nguyên tử trong dạng khử.
b. Các kim loại có tính khử mạnh hơn sẽ khử được các cation của kim loại yếu hơn trong dung dịch muối.
c. Trong dãy điện hoá, các cặp oxi hoá - khử được sắp xếp theo chiều tăng dần giá trị thế điện cực chuẩn.
d. Mỗi phản ứng oxi hoá - khử đều có lớn hơn một cặp oxi hoá - khử.
Câu 12. Thực hiện thí nghiệm cho bột Fe vào dung dịch AgNO3
a. Có phản ứng hóa học xảy ra vì Fe có tính khử mạnh hơn Ag.
b. Có thể dùng kim loại Na thay thế Fe để khử Ag+ thành Ag trong thí nghiệm trên.
Sau thí nghiệm, ta luôn thu được Ag
c. Sau thí nghiệm, ta luôn thu được dung dịch muối có màu lục nhạt.
Câu 13. Thực hiện các thí nghiệm với 4 kim loại (X, Y, Z, T) và dung dịch muối của
chúng (X2+, Y2+, Z+ T2+) cho kết quả như sau:
(1) T đẩy được Z ra khỏi dung dịch muối của nó.
(2) Y không đẩy được Z ra khỏi dung dịch muối của nó.
(3) X đẩy được Z ra khỏi dung dịch muối của nó.
(4) X không đẩy được T ra khỏi dung dịch muối của nó.
(5) X không đẩy được Y ra khỏi dung dịch muối của nó.
a. Trong 4 kim loại trên, X có tính khử yếu nhất.
b. T2+ có tính khử mạnh hơn Z+.
c. Trong 4 ion kim loại trên, Y2+ có tính oxi hóa yếu nhất.
d. X có tính khử yếu hơn T.
Câu 14. Cho các kim loại sau: Ag, Ca, Pb, Mg, Li, Fe, Cu, Al, K, Zn, Ba.
a. Trong dãy trên, có 5 kim loại mà oxide của nó có thể bị khử bởi CO.
b. Trong dãy trên, Ba là kim loại có tính khử mạnh nhất.
c. Trong dãy trên, có 3 kim loại có thể phản khử nước ở điều kiện thường.
d. Trong dãy trên, có 3 kim loại mà dạng oxi hóa của nó có tính oxi hóa mạnh hơn Fe2+.
Câu 15. [CD – SBT] Những phát biểu sau đây về phản ứng Ce4+ + 2I- → I2 + Ce3+ là đúng hay sai?
a. Phương trình trên đã cân bằng.
b. Chất oxi hoá là Ce4+, chất khử là I-.
c. Cặp oxi hoá – khử của kim loại cerium là Ce4+/Ce, của iodine là I2/I-).
d. Phương trình hoá học của phản ứng là: 2Ce4+ + 2I- → I2 + 2Ce3+
Câu 16. [CD – SBT] Những phát biểu sau đây là đúng hay sai?
a. Cu2+ có tính oxi hoá mạnh hơn Fe3+ và Cu có tính khử mạnh hơn Fe2+.
b. Zn có tính khử mạnh hơn Pb và Zn2+ có tính oxi hoá yếu hơn Pb2+.
c. Những kim loại có thế điện cực chuẩn âm đều khử được H+ thành H2 và phản ứng
được trong dung dịch HCl, H2SO4.
d. Trong dãy hoạt động hoá học, những kim loại đứng trước có thế điện cực chuẩn
lớn hơn thế điện cực chuẩn của những kim loại đứng sau.
Câu 17. Cặp oxi hóa - khử của kim loại có thể bao gồm nhiều dạng oxi hóa và khử khác nhau.
a. Cặp Fe²⁺/Fe là một ví dụ của cặp oxi hóa - khử của sắt.
b. Cặp oxi hóa - khử Na⁺/Na bao gồm dạng oxi hóa Na⁺ và dạng khử Na.
c. Một kim loại chỉ có thể có một cặp oxi hóa - khử duy nhất.
Cặp oxi hóa - khử Fe³⁺/Fe²⁺ không thuộc về một kim loại duy nhất
Câu 18. Thế điện cực chuẩn của một cặp oxi hóa - khử thể hiện tính chất hóa học của nó.
a. Thế điện cực chuẩn càng lớn thì khả năng khử của dạng khử càng mạnh.
b. Thế điện cực chuẩn càng nhỏ thì tính oxi hóa của dạng oxi hóa càng yếu.
c. Thế điện cực chuẩn gắn liền với cặp oxi hóa - khử tương ứng.
d. Thế điện cực chuẩn của cặp oxi hóa - khử được biểu diễn bằng đơn vị volt (V).
Câu 19. Trong điều kiện chuẩn, giữa hai cặp oxi hóa - khử, cặp nào có thế điện cực
chuẩn nhỏ hơn sẽ có chất khử mạnh hơn.
a. Tính khử của Cu mạnh hơn Ag vì E₀ (Cu²⁺/Cu) < E₀ (Ag⁺/Ag).
b. Tính oxi hóa của Ag⁺ mạnh hơn Cu²⁺ vì E₀ (Ag⁺/Ag) > E₀ (Cu²⁺/Cu).
c. Cặp oxi hóa - khử có thế điện cực chuẩn nhỏ hơn thì dạng oxi hóa có tính oxi hóa mạnh hơn.
d. Chất khử của cặp oxi hóa - khử có thế điện cực chuẩn lớn hơn sẽ yếu hơn.
Câu 20. Chất khử của cặp oxi hóa - khử đứng trước trong dãy điện hóa có thể tác dụng
với chất oxi hóa của cặp đứng sau.
a. Na có thể khử Cu²⁺ trong dung dịch vì E₀ (Na⁺/Na) < E₀ (Cu²⁺/Cu).
b. Zn có thể khử H⁺ trong dung dịch vì E₀ (Zn²⁺/Zn) < E₀ (H⁺/H₂).
c. Ag có thể khử Fe³⁺ trong dung dịch vì E₀ (Ag⁺/Ag) > E₀ (Fe³⁺/Fe²⁺).
d. Al có thể khử Mg²⁺ trong dung dịch vì E₀ (Al³⁺/Al) < E₀ (Mg²⁺/Mg).
Câu 21. Cặp oxi hóa - khử của kim loại X là Xn+/X. a. X là chất khử.
b. Xn+ là chất oxi hóa.
c. X có thể bị oxi hóa.
d. Xn+ có thể bị khử.
Câu 22. Trong phản ứng oxi hóa - khử:
a. Chất nhường electron là chất khử.
b. Chất nhận electron là chất oxi hóa.
c. Electron di chuyển từ chất oxi hóa sang chất khử.
d. Số oxi hóa của chất khử giảm.
Câu 23. Trong cặp oxi hóa - khử Zn/Zn2+:
a. Zn2+ là chất khử. b. Zn là chất khử.
c. Zn bị oxi hóa thành Zn2+.
d. Zn2+ nhận electron để trở thành Zn.
Câu 24. Thế điện cực chuẩn của cặp Fe3+/Fe2+:
Phụ thuộc vào nồng độ ion
a. Được đo trong điều kiện chuẩn (nồng độ ion 1M).
b. Cho biết khả năng oxi hóa của Fe3+.
c. Có đơn vị là volt (V).
Câu 25. So sánh thế điện cực chuẩn:
a. Thế điện cực chuẩn của Ag/Ag+ lớn hơn Fe/Fe2+.
b. Thế điện cực chuẩn của Zn/Zn2+ lớn hơn Cu/Cu2+.
c. Thế điện cực chuẩn của Fe3+/Fe2+ lớn hơn Cu/Cu2+.
d. Thế điện cực chuẩn của Mg/Mg2+ nhỏ hơn Na/Na+.
Câu 26. Trong phản ứng oxi hóa - khử:
a. Chất có thế điện cực chuẩn lớn hơn là chất oxi hóa mạnh hơn.
b. Chất có thế điện cực chuẩn nhỏ hơn là chất khử mạnh hơn.
c. Phản ứng sẽ xảy ra khi chất oxi hóa mạnh gặp chất khử mạnh.
d. Phản ứng sẽ không xảy ra nếu thế điện cực của chất khử lớn hơn chất oxi hóa.
Câu 27. Phản ứng giữa Zn và HCl: a. Zn bị oxi hóa. b. H2 bị khử. c. Zn là chất khử.
d. HCl là chất oxi hóa.
Câu 28. Phản ứng giữa Ag+ và Cu:
a. Ag+ là chất oxi hóa. b. Cu là chất khử.
c. Cu2+ bị khử thành Cu.
d. Ag bị oxi hóa thành Ag+.
Câu 29. Điện phân dung dịch CuSO4 với điện cực đồng:
a. Ở cực dương, Cu bị oxi hóa.
b. Ở cực âm, Cu2+ bị khử.
c. CuSO4 bị phân hủy thành Cu và SO42-
d. Dung dịch trở nên axit hơn sau khi điện phân.
Câu 30. Thế điện cực chuẩn:
a. Được đo trong điều kiện chuẩn.
b. Là đại lượng đo khả năng khử của kim loại.
c. Có đơn vị là volt.
d. Ảnh hưởng bởi nồng độ ion kim loại.
Câu 31. Kim loại có thế điện cực chuẩn lớn
a. Có tính oxi hóa mạnh.
b. Có tính khử mạnh.
c. Thường là kim loại quý. d. Dễ bị oxi hóa.
Câu 32. Thế điện cực chuẩn của cặp Cu/Cu2+:
a. Lớn hơn cặp Zn/Zn2+.
b. Nhỏ hơn cặp Ag/Ag+.
c. Lớn hơn cặp Fe/Fe3+.
d. Lớn hơn cặp Na/Na+.
Câu 33. Phản ứng giữa Fe và Ag+: a. Fe là chất khử.
b. Ag+ là chất oxi hóa.
c. Fe3+ được tạo thành.
d. Ag được tạo thành.
Câu 34. Thế điện cực chuẩn ảnh hưởng bởi: a. Nhiệt độ. b. Nồng độ ion. c. Áp suất.
d. Bản chất của điện cực.
Câu 35. Phản ứng giữa Zn và Cu2+:
a. Zn bị oxi hóa thành Zn2+.
b. Cu2+ bị khử thành Cu.
c. Zn là chất oxi hóa.
d. Cu2+ là chất khử.
Câu 36. Trong phân tích hóa học, thế điện cực chuẩn đóng vai trò quan trọng. Điện cực
tham chiếu sử dụng thế điện cực chuẩn làm điểm chuẩn trong các phép đo điện thế để xác
định nồng độ của các ion trong dung dịch. Trong các phép chuẩn độ điện hóa, thế điện
cực chuẩn được dùng để xác định điểm tương đương trong các phản ứng chuẩn độ, chẳng
hạn như chuẩn độ oxi hóa-khử. Dưới đây nội dung nào đúng, nội dung nào sai?
a. Điện cực tham chiếu không sử dụng thế điện cực chuẩn làm điểm chuẩn trong các phép đo điện thế.
b. Thế điện cực chuẩn được dùng để xác định điểm tương đương trong các phản ứng chuẩn độ điện hóa.
c. Thế điện cực chuẩn không liên quan đến chuẩn độ oxi hóa-khử.
Thế điện cực chuẩn giúp xác định nồng độ ion trong dung dịch qua phép đo điện thế
Câu 37. Trong bảo vệ cathodic, thế điện cực chuẩn được sử dụng để lựa chọn các kim
loại hy sinh (anode hi sinh) như kẽm, nhôm hoặc magiê nhằm bảo vệ các kim loại quan
trọng như thép khỏi ăn mòn trong nước biển hoặc các môi trường ăn mòn khác. Lớp phủ
chống ăn mòn cũng sử dụng các kim loại có thế điện cực chuẩn thấp hơn để phủ lên bề
mặt kim loại cần bảo vệ, giúp giảm tốc độ ăn mòn.
a. Thế điện cực chuẩn không liên quan đến việc lựa chọn các kim loại hy sinh trong bảo vệ cathodic.
b. Kẽm, nhôm hoặc magiê có thể được sử dụng làm anode hi sinh để bảo vệ thép.
c. Kim loại có thế điện cực chuẩn thấp hơn được sử dụng để phủ lên bề mặt kim loại cần
bảo vệ, giúp giảm tốc độ ăn mòn.
d. Bảo vệ cathodic không liên quan đến thép trong môi trường nước biển.
Câu 38. "Thế điện cực chuẩn được sử dụng để phân tích khả năng chống ăn mòn của kim
loại trong các thiết bị công nghiệp, giúp đảm bảo độ bền và hiệu quả của thiết bị trong
môi trường khắc nghiệt.” Phát biểu nào đúng, phát biểu nào sai.
a. Thế điện cực chuẩn không có ứng dụng trong việc phân tích khả năng chống ăn mòn
của kim loại trong thiết bị công nghiệp.
b. Thế điện cực chuẩn giúp đảm bảo độ bền của thiết bị trong môi trường khắc nghiệt.
c. Việc phân tích thế điện cực chuẩn không có tác động đến hiệu quả của thiết bị công
nghiệpThế điện cực chuẩn được sử dụng để đảm bảo hiệu quả của thiết bị trong các điều kiện khắc nghiệt.
Câu 39. "Thế điện cực chuẩn có ứng dụng quan trọng trong ngành chế biến kim loại,
giúp đánh giá và điều chỉnh các quá trình điện hóa. Điều này góp phần vào việc cải thiện
chất lượng và hiệu suất của các sản phẩm kim loại."Phát biểu nào đúng, phát biểu nào sai.
a. Thế điện cực chuẩn không liên quan đến việc cải thiện chất lượng sản phẩm kim loại.
b. Ngành chế biến kim loại sử dụng thế điện cực chuẩn để điều chỉnh các quá trình điện hóa.
c. Việc hiểu thế điện cực chuẩn không ảnh hưởng đến hiệu suất sản phẩm kim loại.
d. Thế điện cực chuẩn giúp đánh giá và điều chỉnh các quá trình điện hóa trong ngành chế biến kim loại.
Câu 40. "Trong ngành công nghiệp điện hóa, thế điện cực chuẩn được sử dụng để tối ưu
hóa thiết kế các pin điện. Thế điện cực chuẩn giúp điều chỉnh các phản ứng hóa học, từ
đó cải thiện hiệu suất và tuổi thọ của pin." Phát biểu đúng, phát biểu sai.
a. Thế điện cực chuẩn có vai trò quan trọng trong việc tối ưu hóa thiết kế pin điện.
b. Việc sử dụng thế điện cực chuẩn không ảnh hưởng đến tuổi thọ của pin điện.
c. Thế điện cực chuẩn không liên quan đến các phản ứng hóa học trong pin điện.
d. Thế điện cực chuẩn giúp cải thiện hiệu suất của pin điện
Câu 41. Cho cấu tạo của pin Galvani Zn-Cu như hình dưới:
a. Thanh Zn là cực âm (anode) và thanh Cu là cực dương (cathode).
b. Phản ứng xảy ra trong pin là: Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s).
c. Khi Zn(s) hoặc Cu2+(aq) hết thì phản ứng trong pin sẽ ngừng lại.
d. Sức điện động của pin không thay đổi cho đến khi phản ứng trong pin xảy ra hoàn toàn. Câu 42. Cho biết: 0 0 E
. Một pin điện có cấu tạo như hình 0,257V;E 0,340V 2 2 Ni /Ni Cu /Cu sau.
Biết rằng cầu muối chứa KCl. Các dung dịch muối là CuSO4 và NiSO4.
a. Thanh Cu là cực dương và thanh Ni là cực âm của pin điện.
b. Sức điện động của pin ở 298 K là 0,597 V và không đổi cho đến khi pin ngừng hoạt động.
c. Cầu muối KCl có tác dụng trung hoà điện tích của hai dung dịch muối.
d. Khối lượng điện cực Ni và Cu không thay đổi trong quá trình pin hoạt động.
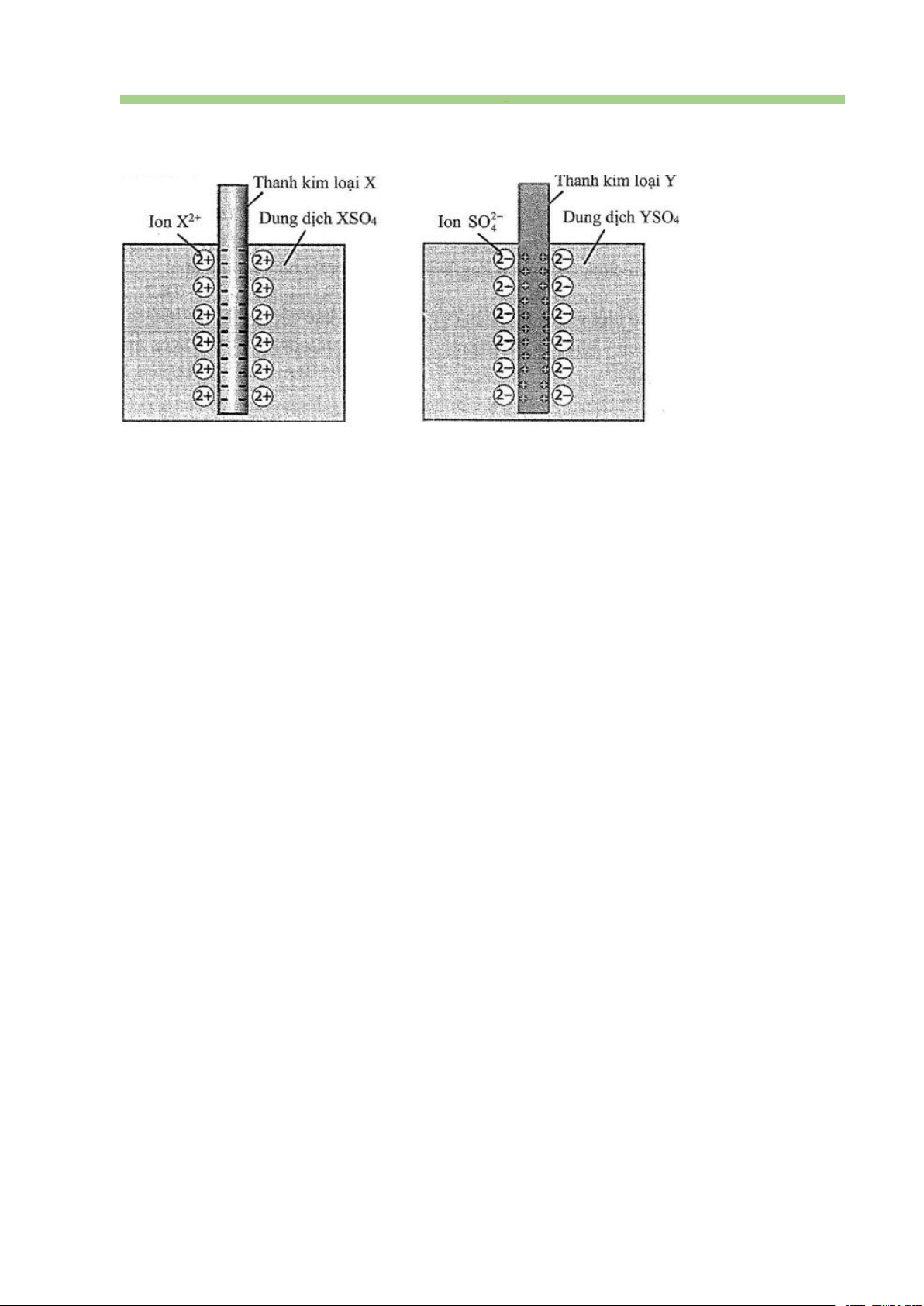
Câu 43. Cho pin điện hoá có cấu tạo như sau:
a. Sức điện động chuẩn của pin là 0,76 V.
b. Tại điện cực âm xảy ra quá trình oxi hoá Zn(s) thành ion Zn2+(aq).
c. Tại điện cực dương xảy ra quá trình khử ion H+(aq) thành khí H2(g).
d. Phản ứng xảy ra trong pin là: H2(g) + Zn2+(aq) → Zn(s) + 2H+(aq).
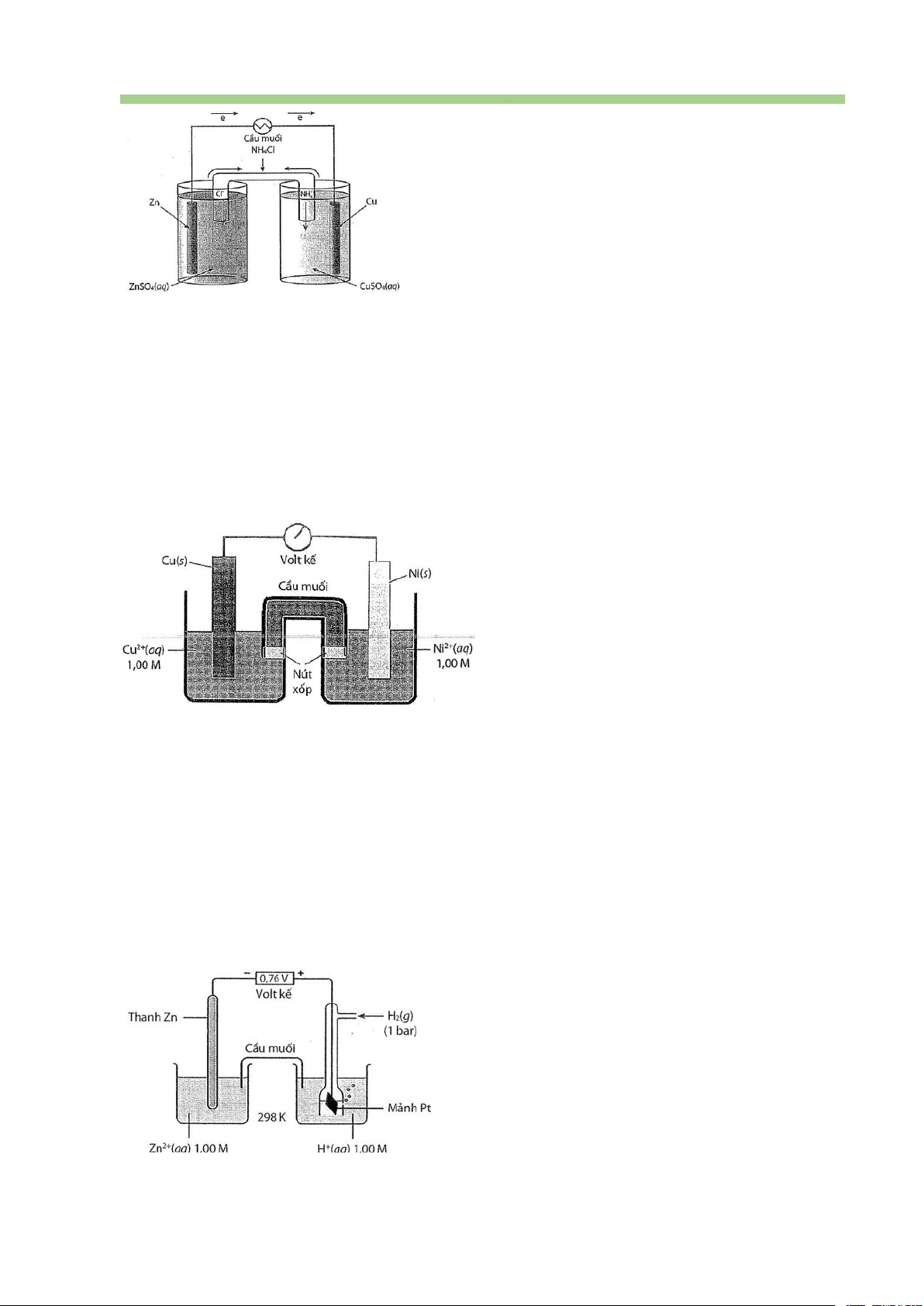
Câu 44. Một pin Galvani có cấu tạo như sau:
Trong đó, màng bán thẩm chỉ cho nước và các anion đi qua. Biết rằng thể tích của các
dung dịch đều là 0,50 L và nồng độ chất tan trong dung dịch là 1,00 M. Cho biết: 0 0 E 0,763V;E 0,340V 2 2 Zn /Zn Cu /Cu
a. Khối lượng điện cực zinc giảm đúng bằng khối lượng điện cực copper tăng.
b. Nồng độ ion SO 2- 4
(aq) trong dung dịch ZnSO4 tăng và trong dung dịch CuSO4 giảm dần.
c. Sức điện động chuẩn của pin là 1,103 V.
d. Phản ứng chung xảy ra trong pin điện là Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s).
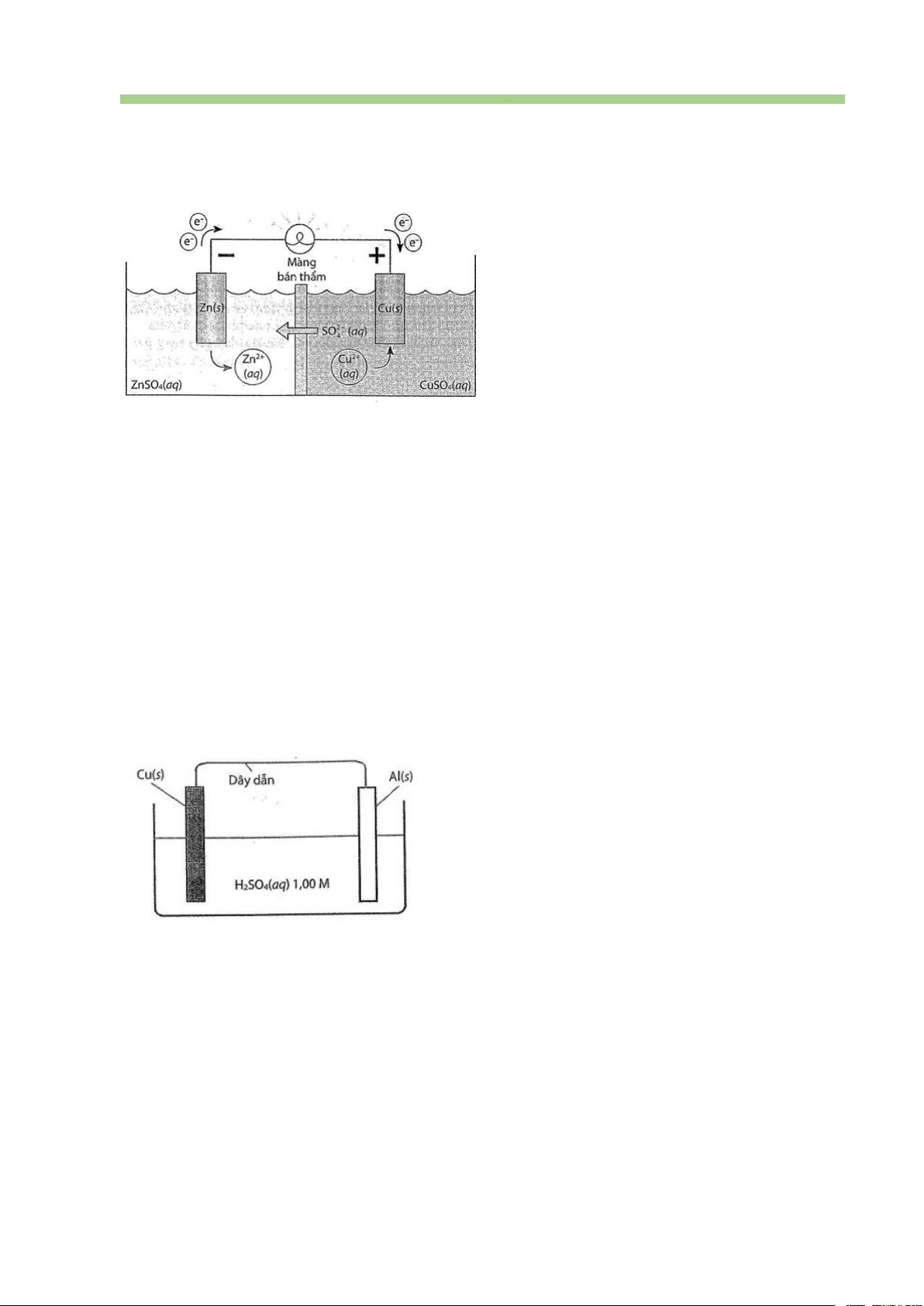
Câu 45. Tiến hành thí nghiệm như hình vẽ dưới đây:
Mỗi phát biểu sau là đúng hay sai?
a. Tại thanh nhôm (Al) xảy ra quá trình oxi hoá Al thành cation Al3+ và tan vào nước.
b. Các electron chuyển từ thanh nhôm sang thanh đồng (Cu) qua dây dẫn.
c. Tại thanh nhôm và thanh đồng đều có quá trình khử ion H+ thành khí H2.
d. Nồng độ H2SO4 trong dung dịch không thay đổi trong quá trình thí nghiệm.
Câu 46. Acquy chỉ có cấu tạo như hình vẽ dưới đây: Cấu tạo acquy chì
Cực dương là thanh than chì (C) được phủ PbO2 và cực âm là tấm chì (Pb), cùng nhúng
vào dung dịch H2SO4 nồng độ 28%. Phản ứng xảy ra khi acquy xả điện là:
Pb(s) + PbO2 (s) + 2H2SO4 (aq) → 2PbSO4 (s) + 2H2O(l)
Biết rằng PbSO4 sinh ra từ điện cực nào đều bám hết vào điện cực đó.
a. Tại anode, Pb bị khử và tạo thành PbSO4.
b. Tại cathode, PbO2 bị oxi hoá và tạo thành PbSO4.
c. Khi acquy xả điện, khối lượng các điện cực tăng lên.
d. Nồng độ H2SO4 trong acquy chỉ giảm xuống khi acquy xả điện.
Câu 47. Mỗi phát biểu sau là đúng hay sai?
a. Trong các pin điện hoá, tại cực âm xảy ra quá trình oxi hoá.
b. Các pin nhiên liệu hoạt động dựa trên các phản ứng oxi hoá hoàn toàn các nhiên liệu.
c. Phản ứng trong các pin nhiêu liệu methanol-oxygen là phản ứng oxi hoá methanol
bởi khí O2 thành fomaldehyde.
d. Các acquy được sạc lại bằng cách nối cùng cực (âm với âm, dương với dương) của dòng điện một chiều.
Câu 48. Giá trị thế điện cực chuẩn của một số cặp oxi hóa – khử như sau 0 0 0 0 E 0,763V;E 0,140V;E 0,250V;E 0,130V; 2 2 2 2 Zn /Zn Sn /Sn Ni /Ni Pb /Pb
a. Tính oxi hóa được xếp tăng dần theo thứ tự Zn2+/Zn < Ni2+/Ni < Pb2+/Pb < Sn2+/Sn
b. Tính khử giảm dần theo thứ tự Zn2+/Zn > Ni2+/Ni > Sn2+/Sn > Pb2+/Pb
c. Sức điện động chuẩn của pin tạo bởi hai cặp oxi hóa – khử Zn2+/Zn và Pb2+/Pb là 0.63V
d. Nếu Pin tạo bởi hai cặp oxi hóa – khử Ni2+/Ni và Sn2+/Sn thì trong pin cực âm là Sn, cực dương là Ni.
Câu 49. Một học sinh thực hiện các thí nghiệm và thu được kết quả giá trị vôn kế khác 0.
Các thí nghiệm dưới đây là đúng hay sai?
a. Cắm hai thanh kim loại khác nhau vào quả chanh và không để chúng chạm vào nhau,
hai đầu còn lại gắn với vôn kế.
b. Cắm hai thanh kim loại khác nhau vào cốc nước muối, hai đầu còn lại gắn với vôn kế.
c. Cắm hai thanh kim loại khác nhau vào cốc nước đường, hai đầu còn lại gắn với vôn kế.
d. Cắm hại thanh kim loại khác nhau vào cốc nước cât, hai đầu còn lại gắn với vôn kế.
Câu 50. Một học sinh muốn tìm hiểu và so sánh hai loại pin thông dụng là pin kiềm
(Alkaline) và pin lithium-ion (Li-ion) để sử dụng cho các thiết bị điện tử khác nhau. Học
sinh này đã thu thập được một số thông tin về hai loại pin này, được trình bày trong bảng dưới đây: Đặc điểm Pin Kiềm (Alkaline)
Pin Lithium-Ion (Li-ion) Điện áp danh định (V) 1.5 3.7 Dung lượng (mAh) 2800 3000 Hóa chất chính Zn/MnO₂ LiCoO₂, LiMn₂O₄, v.v. Phản ứng tại anode
Zn + 2OH⁻ → Zn(OH)₂ + 2e⁻
LiCoO₂ → Li⁺ + CoO₂ + e⁻ Phản ứng tại cathode
2MnO₂ + H₂O + 2e⁻ → Mn₂O₃ + 2OH⁻ Li⁺ + e⁻ → Li Khả năng sạc lại Không Có Giá thành Rẻ hơn Đắt hơn Ứng dụng phổ biến
Đồ chơi, đồng hồ, remote Điện thoại, laptop
a. Phản ứng tại cực dương của pin kiềm là sự oxi hóa MnO₂ thành Mn₂O₃.
b. Anode của pin kiềm giống với pin Galvani đều sử dụng Zn làm chất khử.
c. Pin lithium-ion có giá thành đắt hơn và được ứng dụng trong các thiết bị đắt tiền như
điện thoại, laptop là vì chúng có khả năng sạc lại nhờ trong pin có sẵn lượng nguyên liệu
rất lớn giúp pin có thể tạo ra nguồn hóa chất chính tạo điện năng liên tục.
d. Khả năng khử mạnh của zinc giúp pin kiềm ổn định hơn trong các ứng dụng yêu cầu
công suất cao so với pin lithium-ion.
B. ĐÁP ÁN HƯỚNG DẪN TRẢ LỜI Câu Lệnh hỏi Đáp án (Đ/S) Câu Lệnh hỏi Đáp án (Đ/S) a Đ a Đ b Đ b S 1 c S 6 c S d S d Đ a Đ a S b S b Đ 2 c Đ 7 c Đ d S d Đ a S a Đ b Đ b Đ 3 c S 8 c S d Đ d Đ a S a Đ b Đ b Đ 4 c Đ 9 c S d Đ d Đ a Đ a Đ b S b Đ 5 c S 10 c S d Đ d S a S a Đ 11 b S 16 b Đ c Đ c Đ d Đ d Đ 12 a Đ 17 a Đ b S b Đ c Đ c Đ d S d Đ a S a Đ 13 b S 18 b Đ c Đ c Đ d Đ d Đ a Đ a Đ 14 b S 19 b Đ c S c S d Đ d Đ a S a S 15 b Đ 20 b Đ c S c S d Đ d Đ a Đ a Đ 21 b Đ 26 b Đ c Đ c Đ d Đ d S a Đ a Đ 22 b Đ 27 b S c S c Đ d S d Đ a S a Đ 23 b Đ 28 b Đ c Đ c S d Đ d S a S a Đ 24 b Đ 29 b Đ c Đ c S d Đ d S a Đ a Đ 25 b S 30 b S c S c Đ d S d Đ a S a S 31 b S 36 b Đ c Đ c S d S d Đ a Đ a S 32 b Đ 37 b Đ c S c Đ d Đ d S a Đ a S 33 b Đ 38 b Đ c S c S d Đ d Đ a Đ a S 34 b Đ 39 b Đ c Đ c S d Đ d Đ a Đ a Đ 35 b Đ 40 b S c S c S d S d Đ a Đ a S 41 b Đ 46 b S c Đ c Đ d S d Đ a Đ a Đ 42 b S 47 b Đ c Đ c S d S d Đ a Đ a S 43 b Đ 48 b Đ c Đ c Đ d S d S a S a Đ 44 b Đ 49 b Đ c Đ c S d Đ d S a Đ a S 45 b Đ 50 b Đ c Đ c S d S d S Câu 1. a, b đúng
c. Sai. Một kim loại có thể có nhiều cặp oxi hóa khử khác nhau, tùy thuộc vào số oxi hóa
mà kim loại có thể đạt được. Ví dụ: Sắt có các cặp Fe2+/Fe, Fe3+/Fe2+.
d. Sai. Trong mọi phản ứng oxi hóa khử luôn xảy ra đồng thời quá trình oxi hóa và khử.
Chất bị oxi hóa sẽ nhường electron cho chất bị khử. Câu 2. a, c đúng
b. Sai. Thế điện cực chuẩn càng lớn, tính khử của dạng khử càng nhỏ, tính oxi hóa của dạng oxi hóa càng lớn
d. Sai. Thế điện cực chuẩn là một đại lượng đặc trưng cho khả năng oxi hóa khử của một
cặp oxi hóa khử. So sánh thế điện cực chuẩn của các cặp khác nhau cho phép ta so sánh
tương đối tính oxi hóa khử của chúng. Câu 3. b, d đúng
a. Sai. Giá trị thế điện cực chuẩn lớn dương cho thấy ion Au3+ có tính oxi hóa rất mạnh,
tức là vàng kim loại (Au) có tính khử rất yếu.
c. Sai. Ngược lại, ion Au3+ có tính oxi hóa mạnh hơn nhiều so với các ion kim loại khác như Fe2+, Al3+. Câu 4. b, c, d đúng
a sai tính oxi hóa: Ag+ > Fe3+. Câu 5. a, d đúng
b sai không thể thay thế FeSO4 bằng FeS vì chất này không tan, không tạo dung dịch.
c sai nếu A là Cu thì kim sau khi phản ứng không xảy ra. Câu 6. a, d đúng
b sai Zn2+ có tính oxi hóa yếu hơn Fe2+.
c sai thứ tự tính khử tăng dần là Zn > Fe > Al Câu 7. b, c, d đúng
a sai vì X chỉ có kim loại Cu dư. Câu 8. a, b, d đúng
c. Sai. Trong một số điều kiện nhất định, dạng oxi hóa và dạng khử của cùng một nguyên
tố có thể phản ứng với nhau để tạo thành một dạng trung gian hoặc cân bằng giữa hai dạng. Ví dụ: I2 + I- ⇌ I3-. Câu 9. a, b, d đúng
c. Sai. Vì X bị ăn mòn (bị oxi hóa) chứng tỏ X dễ nhường electron hơn Y. Do đó, tính khử của X mạnh hơn Y. Câu 10. a, b đúng
c. Sai, vì Na sẽ phản ứng với nước tạo NaOH, khi đó Cu2+ sẽ phản ứng tạo kết tủa Cu(OH)2.
d. Sai, Ngược lại, Cu có tính khử yếu hơn Na, nên Cu không thể khử được ion Na+. Câu 11. c, d đúng
a sai, trong cặp oxi hoá - khử của các phân tử hoặc ion đa phân tử, không phải số oxi hóa
của nguyên tố nào cũng khác nhau giữa các dạng.b sai, các kim loại kiềm không khử
được các cation của kim loại yếu hơn trong dung dịch muối do có phản ứng mãnh liệt với nước.
Câu 12. Thực hiện thí nghiệm cho bột Fe vào dung dịch AgNO3 a, c đúng
b sai. Không thể dùng kim loại Na thay thế Fe để khử Ag+ thành Ag trong thí nghiệm trên.
d sai. Nếu Ag+ dư sẽ phản ứng tiếp với Fe2+ tạo ion Fe3+. Câu 13. c, d đúng
a Sai. Y mới là kim loại có tính khử yếu nhất.
b. Sai. T2+ là ion, và khả năng khử thuộc về kim loại. Điều này không đúng vì tính khử
của kim loại T mạnh hơn Z, nhưng ion T2+ không phải là chất khử. Câu 14. a, d đúng
b sai. Li, K có tính khử mạnh hơn Ba
c sai. Các kim loại kiềm (Li, K) và một số kim loại kiềm thổ (Ca, Ba) có thể phản ứng
với nước ở điều kiện thường. Có ít nhất 4 kim loại trong dãy này thỏa mãn điều kiện này. Câu 15. b, d đúng
a sai. Phương trình trên chưa cân bằng vì điện tích ở 2 vế phương trình chưa bằng nhau.
c sai. Cặp oxi hoá – khử của kim loại cerium là Ce4+/Ce3+. Câu 16. b đúng
a sai. Cu có tính khử mạnh hơn Fe2+ nhưng Cu2+ có tính oxi hoá yếu hơn Fe3+.
c. Sai. Không phải tất cả các kim loại có thế điện cực chuẩn âm đều phản ứng với HCl, H2SO4 loãng. Ví dụ: Pb.
d. Sai. Trong dãy hoạt động hóa học, kim loại đứng trước có tính khử mạnh hơn, tương
ứng với thế điện cực chuẩn âm hơn. Câu 17. a, b đúng
c. Sai. Một kim loại có thể có nhiều cặp oxi hóa-khử khác nhau, tùy thuộc vào số oxi hóa
mà nó có thể đạt được.
d. Sai. Cặp oxi hóa - khử Fe³⁺/Fe²⁺ thuộc về một kim loại duy nhất là Fe Câu 18. c, d đúng
a) Sai. Thế điện cực chuẩn càng âm thì khả năng khử của dạng khử càng mạnh.
b) Sai. Thế điện cực chuẩn càng lớn thì tính oxi hóa của dạng oxi hóa càng mạnh. Câu 19. a, b, d đúng
c) Sai. Cặp oxi hóa-khử có thế điện cực chuẩn nhỏ hơn thì dạng khử có tính khử mạnh hơn. Câu 20. b, d đúng
a sai, Na không có thể khử Cu²⁺ trong dung dịch vì Na tác dụng với nước.
c) Sai. Ag có tính khử yếu hơn Fe3+. Câu 21.
Cả a, b, c, d đều đúng Câu 22. a, b đúng
c sai vì electron di chuyển từ chất khử (nhường electron) sang chất oxi hóa (nhận electron).
d sai vì số oxi hóa của chất khử tăng lên vì chất khử bị oxi hóa. Câu 23. b, c, d đúng
a sai vì Zn2+ là chất oxi hóa vì nó có khả năng nhận electron để bị khử. Câu 24. b,c,d đúng
a sai vì thế điện cực chuẩn được đo trong điều kiện chuẩn, không phụ thuộc vào nồng độ ion. Câu 25. a đúng
b sai vì Cu/Cu2+ có thế điện cực chuẩn lớn hơn Zn/Zn2+, tức là Cu2+ có khả năng oxi hóa mạnh hơn Zn2+.
c sai vì Cu/Cu2+ có thế điện cực chuẩn lớn hơn Fe3+/Fe2+, tức là Cu2+ có khả năng oxi hóa mạnh hơn Fe3+.
d sai vì Na/Na+ có thế điện cực chuẩn nhỏ hơn Mg/Mg2+, tức là Na dễ bị oxi hóa hơn Mg. Câu 26. a, b, c đúng
d sai vì phản ứng sẽ không xảy ra nếu thế điện cực của chất khử lớn hơn chất oxi hóa, vì
chất khử không đủ mạnh để khử chất oxi hóa. Câu 27. a, c, d đúng
b sai H2 không tham gia phản ứng này. H2 được giải phóng khi HCl bị khử. Câu 28. a, b đúng
c sai vì trong phản ứng này, Cu bị oxi hóa thành Cu2+, không phải bị khử.
d sai vì Ag+ bị khử thành Ag, không phải Ag bị oxi hóa thành Ag+ Câu 29. a, b đúng
c sai vì CuSO4 không bị phân hủy thành Cu và SO42-. Thay vào đó, Cu2+ và SO42- sẽ tham
gia vào các phản ứng tại các điện cực.
d sai vì dung dịch không trở nên axit hơn sau khi điện phân CuSO4 với điện cực đồng. Câu 30. a, c, d đúng
b sai vì thế điện cực chuẩn đo khả năng oxi hóa-khử của cặp oxi hóa-khử, không chỉ đo
khả năng khử của kim loại




