

















Preview text:
lOMoARcPSD|25518217
BỘ LAO ĐỘNG THƯƠNG BINH & XÃ HỘI
TRƯỜNG CAO ĐẲNG KỸ NGHỆ II
KHOA BẢO HỘ LAO ĐỘNG TIỂU LUẬN
XỬ LÝ NƯỚC THẢI XI MẠ
Giáo viên hướng dẫn: Ths. Nguyễn Xuân Thành Nam
Lớp: Cao Đẳng Bảo Hộ Lao Động 2020
Nhóm: 3 (Lớp BHLĐ 2020) HSSV thực hiện :
1. Nguyễn Hữu Duy Sơn (Nhóm trưởng) 2. Nguyễn Hồng Ngự 3. Huỳnh Tấn Phát 4. Trần Hoài Phương 5. Nguyễn Phước Thiện 6. Trần Quang Thống 7. Phan Văn Tiến 8. Trần Thành Tín 9. Cao Văn Hoàn TP.HCM, Tháng 5, Năm Trang 1 / 28
NHÓM 3 – XỬ LÝ NƯỚC THẢI XI MẠ
Downloaded by Van Le (mrl3v4n@gmail.com) lOMoARcPSD|25518217 Phụ lục
MỞ ĐẦU ............................................................................................................... 4
Chương 1: Tổng quan về Công nghệ Xi mạ ......................................................... 5
I. Lịch sử hình thành và phát triển ..................................................................... 5
II. Tìm hiểu về công nghệ xi mạ ........................................................................ 5
1. Xi mạ là gì ? ............................................................................................... 5
2. Sự hình thành lớp mạ ................................................................................. 6
3. Dây chuyền công nghệ Công nghệ xử lý bề mặt (xi mạ) thường bao gồm
các công đoạn sau: .......................................................................................... 7
Chương 2: NƯỚC THẢI NGÀNH CÔNG NGHỆ XI MẠ ................................ 10
I. Lưu lượng và thành phần, tính chất nước thải: ............................................ 10
II. Ảnh hưởng của nước thải ngành xi mạ đến môi trường và con người: ...... 11
1. Ảnh hưởng đến môi trường: ..................................................................... 11
2. Ảnh hưởng đến con người: ....................................................................... 11
3. Độc tính của Crôm: .................................................................................. 12
4. Độc tính xianua ........................................................................................ 13
III. Hiện trạng ô nhiễm môi trường do công nghiệp xi mạ tại Việt Nam: ....... 13
Chương 3: Phương pháp Xử lý nước thải Xi-mạ ................................................ 14
I. Giới thiệu các phương pháp và công nghệ xử lý nước thải xi mạ: .............. 14
1. Phương pháp kết tủa: ................................................................................ 14
2. Phương pháp trao đổi ion: ........................................................................ 15
3. Phương pháp điện hóa: ............................................................................. 16
4. Phương pháp hấp phụ sinh học: ............................................................... 16
5. Phương pháp hấp phụ .............................................................................. 16
Chương 4: Hệ thống xử lý nước thải xi mạ của công ty cổ phần Khóa Minh Khai
............................................................................................................................. 17
I.Thông tin về doanh nghiệp. ........................................................................... 17
II. Xử lý nước thải ............................................................................................ 19
III. Kết quả sau khi đi qua hệ thống xử lý ....................................................... 23
Chương 5:Một số mô hình xử lý tham khảo của các Công ty tư vấn Môi trường
............................................................................................................................. 24
I. CÔNG TY CỔ PHẦN TƯ VẤN ĐẦU TƯ MÔI TRƯỜNG THẢO
NGUYÊN XANH ............................................................................................ 24 Trang 2 / 28
NHÓM 3 – XỬ LÝ NƯỚC THẢI XI MẠ
Downloaded by Van Le (mrl3v4n@gmail.com) lOMoARcPSD|25518217
II. CÔNG TY TNHH THƯƠNG MẠI DỊCH VỤ XÂY DỰNG VÀ MÔI
TRƯỜNG SẠCH(SACO) ............................................................................... 27 Trang 3 / 28
NHÓM 3 – XỬ LÝ NƯỚC THẢI XI MẠ
Downloaded by Van Le (mrl3v4n@gmail.com) lOMoARcPSD|25518217 MỞ ĐẦU
Tại Việt Nam, công nghiệp ngày càng phát triển, với càng ngành đa dạng và
phức tạp. Điều đó dẫn tới những tác động môi trường ngày nhiều và theo chiều
hướng tiêu cực. Các ngành CN thải ra môi trường rất nhiều chất thải độc hại, đặc
biệt là nước thải. Ảnh hưởng trực tiếp đến đời sống của sinh vật cũng như con
người. Một trong những ngành gây ảnh hưởng nghiêm trọng, đó là Công nghiệp Xi mạ.
Vì vậy để giảm thiểu tác động của chất thải từ các nhà máy công nghiệp, chúng
ta phải nắm rõ bản chất của nó, cũng như quy trình xử lý cuối đường ống.
Trong phạm vi bài làm của nhóm, chỉ đề cập đến những vấn đề xung quanh
nước thải và cách xử lý nước thải từ nhà máy công nghiệp xi mạ. Nhằm giúp
nâng cao hiểu biết và cách xử lý nguồn nước thải này. Trang 4 / 28
NHÓM 3 – XỬ LÝ NƯỚC THẢI XI MẠ
Downloaded by Van Le (mrl3v4n@gmail.com) lOMoARcPSD|25518217
Chương 1: Tổng quan về Công nghệ Xi mạ
I. Lịch sử hình thành và phát triển
Ngành mạ điện được nhà hóa học ý Luigi V. Brugnatelli khai sinh vào năm
1805. Ông đã sử dụng thành quả của người đồng nghiệp Alessandro Volta, pin
Volta để tạo ra lớp phủ điện hóa đầu tiên. Phát minh của ông không có ứng dụng
trong công nghiệp trong suốt 30 năm và chỉ được nghiên cứu trong các phòng thí nghiệm.
Năm 1839, hai nhà hóa học Anh và Nga khác độc lập nghiên cứu quá trình mạ
kim loại đồng cho những nút bản in. Ngay sau đó, John Wright, Birmingham,
Anh sử dụng Kali Xyanua cho dung dịch mạ vàng, bạc.
Vào thời kì này, đó là dung dịch duy nhất có khả năng cho lớp mạ kim loại
quý rất đẹp. Tiếp bước Wright, George Elkington và Henry Elkington đã nhận
được bằng sáng chế kĩ thuật mạ điện vào năm 1840.
Hai năm sau đó, ngành công nghiệp mạ điện tại Birmingham đã có sản phẩm
mạ điện trên khắp thế giới. Cùng với sự phát triển của khoa học điện hóa, cơ chế
điện kết tủa lên bề mặt kim loại ngày càng được nghiên cứu và sáng tỏ. Kĩ thuật
mạ điện phi trang trí cũng được phát triển. Lớp mạ kền, đồng, kẽm, thiếc thương
mại chất lượng tốt đã trở nên phổ biến từ những năm 1850.
Kể từ khi máy phát điện được phát minh từ cuối thế kỉ 19, ngành công nghiệp
mạ điện đã bước sang một kỉ nguyên mới. Mật độ dòng điện tăng lên, năng suất
lao động tăng, quá trình mạ được tự động hóa từ một phần đến hoàn toàn.
Những dung dịch cùng với các phụ gia mới làm cho lớp mạ đạt chất lượng tốt
hơn. Các lớp mạ được nghiên cứu phát triển để thỏa mãn cả yêu cầu chống ăn
mòn lẫn trang trí, làm đẹp...
Kể từ sau chiến tranh thế giới thứ hai, người ta còn nghiên cứu thành công kĩ
thuật mạ crom cứng, mạ đa lớp, mạ đồng hợp kim. mạ kền sunfamat... Nhà vật
lý Mỹ Richard Feynman đã nghiên cứu thành công công nghệ mạ lên nền nhựa.
Hiện nay công nghệ này đã được ứng dụng rộng rãi. Kĩ thuật mạ hiện là một
trong ba quá trình trong chu trình LIGA - được sử dụng trong sản xuất robot
điện tử siêu nhỏ (MEMS).
II. Tìm hiểu về công nghệ xi mạ 1. Xi mạ là gì?
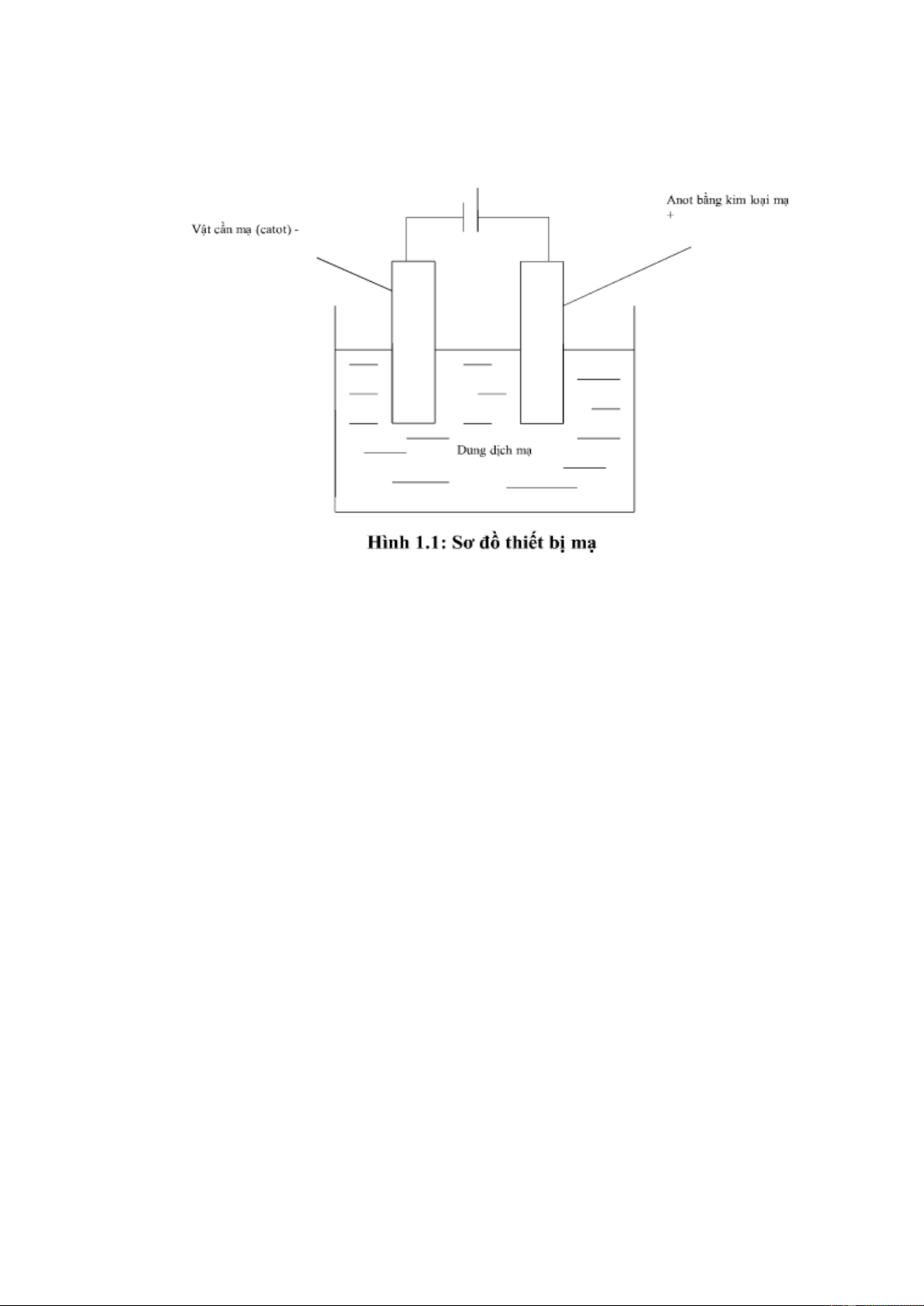
Kỹ thuật xi mạ hay kỹ thuật Galvano (lấy theo tên nhà khoa học Ý Luigi
Galvani), là tên gọi của quá trình điện hóa phủ lớp kim loại lên một vật.
Trong quá trình mạ điện, vật cần mạ được gắn với cực âm catôt, kim loại mạ gắn
với cực dương anôt của nguồn điện trong dung dịch điện môi. Cực dương của
nguồn điện sẽ hút các electron e- trong quá trình ôxi hóa và giải phóng các ion
kim loại dương, dưới tác dụng lực tĩnh điện các ion dương này sẽ di chuyển về
cực âm, tại đây chúng nhận lại e- trong quá trình ôxi hóa khử hình thành lớp kim Trang 5 / 28
NHÓM 3 – XỬ LÝ NƯỚC THẢI XI MẠ
Downloaded by Van Le (mrl3v4n@gmail.com) lOMoARcPSD|25518217
loại bám trên bề mặt của vật được mạ. Độ dày của lớp mạ tỉ lệ thuận với cường
độ dòng điện của nguồn và thời gian mạ.
( Theo Bách khoa điện tử Toàn thư Wikipedia )
2. Sự hình thành lớp mạ
Điều kiện tạo thành lớp mạ điện
Mạ điện là một công nghệ điện phân. Quá trình tổng quát là:
-Trên anot xảy ra quá trình hòa tan kim loại anot: M – ne → Mn+
-Trên catot xảy ra quá trình cation phóng điện trở thành kim loại mạ: Mn+ + ne → M
Thực ra quá trình trên xảy ra theo nhiều bước liên tiếp nhau, bao nhiều giai đoạn
nối tiếp nhau như: quá trình cation hidrat hóa di chuyển từ dung dịch vào bề mặt
catot (quá trình khuếch tán); cation mất lớp vỏ hidrat, vào tiếp xúc trực tiếp với
bề mặt catot (quá trình hấp phụ); điện tử chuyển từ catot điền vào vành hóa trị
của cation, biến nó thành nguyên tử kim loại trung hòa (quá trình phóng điện);
các nguyên tử kim loại này sẽ tạo thành mầm tinh thể mới, hoặc tham gia nuôi
lớn mầm tinh thể đã hình thành trước đó. Mọi trở lực của các quá trình trên đều
gây nên một độ phân cực catot, (quá thế catot), tức là điện thế catot dịch về phía
âm hơn một lượng so với cân bằng:
ηc = φcb - φ = ηnđ + ηđh + ηkt Trang 6 / 28
NHÓM 3 – XỬ LÝ NƯỚC THẢI XI MẠ
Downloaded by Van Le (mrl3v4n@gmail.com) lOMoARcPSD|25518217 Trong đó:
ηc: quá thế tổng cộng ở catot
φcb: điện thế cân bằng của catot
φ: điện thế phân cực catot (đã có dòng i)
ηnđ: quá thế nồng độ (phụ thuộc vào quá trình khuếch tán)
ηđh: quá thế chuyển điện tích ηkt: quá thế kết tinh
Do đó, điện kết tủa kim loại trên catot sẽ chỉ diễn ra khi nào điện thế catot dịch
chuyển khỏi vị trí cân bằng về phía âm một lượng đủ để khắc phục các trở lực nói trên.
Điều kiện xuất hiện tinh thể
Trong điều kiện điện kết tủa kim loại trong dung dịch, yếu tố quyết định tốc độ
tạo mầm tinh thể là tỷ số giữa mật độ dòng điện catot Dc và mật độ dòng trao đổi i0: β = Dc / i0
Mặt khác, theo phương trình Tafel: η = a + b.log Dc
Suy rộng ra, mọi yếu tố làm tăng phân cực catot đều cho lớp mạ có tinh thể nhỏ
mịn, và ngược lại. Các mầm tinh thể ban đầu mới xuất hiện được ưu tiên tham
gia vào mạng lưới tinh thể của kim loại nền ở vị trí có lợi nhất về mặt năng
lượng. Đó là những chỗ tập trung nhiều nguyên tử láng giềng nhất, vì ở đó năng
lượng dư bề mặt lớn nhất, các mối liên kết chưa được sử dụng là nhiều nhất.
Nếu kim loại nền và kim loại kết tủa có cấu trúc mạng khá giống nhau về hình
thái, kích thước thì cấu trúc của kim loại nền được bảo tồn và kim loại kết tủa sẽ
phát triển theo cấu trúc đó (cấu trúc lai ghép (epitaxy)), xảy ra ở những lớp
nguyên tử đầu tiên. Sau đó sẽ dần chuyển về cấu trúc vốn có của nó ở những lớp
kết tủa tiếp theo. Trường hợp này cho lớp kim loại mạ có độ gắn bám rất tốt, xấp
xỉ với độ bền liên kết của kim loại nền. Nếu thông số mạng của chúng khác khá
xa nhau, hoặc bề mặt chúng có tạp chất hay chất hấp phụ, thì sự lai ghép sẽ
không xảy ra. Đấy là một trong những nguyên nhân gây nên ứng suất nội và làm lớp mạ dễ bong.
3. Dây chuyền công nghệ Công nghệ xử lý bề mặt (xi mạ) thường bao gồm
các công đoạn sau:
- Bề mặt của vật liệu cần mạ phải được làm sạch để lớp mạ có độ bám dính cao
và không có khuyết tật. Để làm sạch bề mặt trước hết phải tẩy rửa lớp mỡ bảo
quản trên bề mặt bằng cách tẩy rửa với dung môi hữu cơ hoặc với dung dịch kiềm
nóng. Dung môi thường sử dụng là loại hydrocacbon đã được clo hoá như Trang 7 / 28
NHÓM 3 – XỬ LÝ NƯỚC THẢI XI MẠ
Downloaded by Van Le (mrl3v4n@gmail.com) lOMoARcPSD|25518217
tricloetylen, percloetylen. Dung dịch kiềm thường là hỗn hợp của xút, soda,
trinatri photphat, popyphotphat, natri silicat và chất hoạt động bề mặt (tạo nhũ).
- Hoạt hoá bề mặt của vật liệu mạ bằng cách nhúng chúng vào dung dịch axit
loãng (H2SO4, HCl), nếu mạ với dung dịch chứa xianua (CN) thì chúng được
nhúng vào dung dịch natri xianua.
- Giai đoạn mạ được tiến hành sau đó, dung dịch mạ ngoài muối kim loại còn
chứa axit hoặc kiềm đối với trường hợp mạ có chứa xianua.
Sau từng bước, vật liệu mạ đều được tráng rửa với nước. Một số dung dịch mạ có
các thành phần chủ yếu sau:
- Dung dịch chì: axit + muối chì (II) dạng borflorua hoặc silicoflorua.
- Dung dịch chì- thiếc: axit, muối chì, thiếc (II) dạng borflorua.
- Dung dịch đồng hun: dung dịch xianua trong đó đồng nằm trong phức xianua và
thiếc trong phức hydroxo. Ngoài ra dung dịch còn chứa xianua tự do (NaCN).
- Dung dịch cadmi: axit + cadmi dạng muối sunfat. Thông dụng hơn là dung dịch
cadmi dạng phức xianua và xianua tự do.
- Dung dịch crôm: axit crômic và axit sunfuric.
- Dung dịch vàng: dung dịch xianua, vàng nằm trong phức NaAu(CN)2 và xianua
tự do. Có thể sử dụng phức vàng-sunfit.
- Dung dịch đồng: axit + đồng sunfat hoặc đồng borflorua.
- Dung dịch đồng xianua (phức) và xianua tự do, dung dịch đồng dạng
polyphotphat và muối amoni.
- Dung dịch niken: muối niken sunfat, clorua và axit yếu (axit boric) hoặc dung
dịch niken trên nền của axit amonisulfonic.
- Dung dịch bạc: dung dịch bạc xianua hoặc dung dịch bạc thisunfat.
- Dung dịch kẽm: phức kẽm xianua và xianua tự do hoặc kẽm sunfat, clorua với
axit boric hoặc muối amoni làm chất đệm. Trang 8 / 28
NHÓM 3 – XỬ LÝ NƯỚC THẢI XI MẠ
Downloaded by Van Le (mrl3v4n@gmail.com) lOMoARcPSD|25518217 Dây chuyền công nghệ: Vì sao phải xi mạ?
Các kim loại để ngoài bề mặt không khí với các thành phần oxy, lưu huỳnh, các
chất ăn mòn gây nên tình trạng gĩ sét, ố màu làm cho kim loại không giữ được
màu sắc như ban đầu. Vì vậy chúng ta thường kết hợp các lớp xi mạ phủ lót để
tạo nên sự cách biệt kim loại nền với môi trường hoạt động.
Tùy vào tính chất và môi trường hoạt động mà chúng ta có thể sử dụng các lớp
phủ kim loại đặc trưng để đáp ứng yêu cầu . Trang 9 / 28
NHÓM 3 – XỬ LÝ NƯỚC THẢI XI MẠ
Downloaded by Van Le (mrl3v4n@gmail.com) lOMoARcPSD|25518217
Trên thị trường thông thường có các lớp xi mạ sau:
Xi mạ Crom, Xi Mạ Niken, Mạ Đồng,Mạ cadimi Xi Mạ Thiếc,Xi Mạ Kẽm
Các lớp phủ này đều có tính năng khác biệt và có thời gian cũng như vai tro
riêng biệt cho mỗi sản phẩm. Lợi ích xi mạ
Nhờ phản ứng bảo vệ chống ăn mòn cao của lớp phủ trên nền kim loại nên ngày
nay ngành xi mạ được áp dụng rộng rãi. Tùy vào nhu cầu và mục đích sử dụng,
người ta có thể lựa chọn những phương pháp xi mạ khác nhau: xi mạ điện phân hay mạ nhúng nóng. Ứng dụng xi mạ
Trong ngành công nghiệp, xi mạ được áp dụng trong trang trí, làm tăng khả
năng chống mài mòn, tăng độ cứng lên bề mặt, lớp mạ vừa trang trí vừa bảo vệ,
lớp mạ bóng sáng hoặc xi mạ Crôm cứng phục hồi ru lô trục, xy lanh thủy lực…
Chương 2: NƯỚC THẢI NGÀNH CN XI MẠ
I. Lưu lượng và thành phần, tính chất nước thải:
1. Nước thải từ xưởng xi mạ có thành phần đa dạng về nồng độ và pH biến đổi
rộng từ rất axit 2-3, đến rất kiềm 10-11. Đặc trưng chung của nước thải ngành mạ
là chứa hàm lượng cao các muối vô cơ và kim loại nặng. Tuỳ theo kim loại của
lớp mạ mà nguồn ô ề nhiễm có thể là Cu, Zn, Cr, Ni,… và cũng tuỳ thuộc vào loại
muối kim loại được sử dụng mà nước thải có chứa các độc tố như xianua, sunfat,
amoni, crômat,… Các chất hữu cơ ít có trong nước thải xi mạ, phần chủ yếu là
chất tạo bông, chất hoạt động bmặt … nên BOD, COD thường thấp và không
thuộc đối tượng xử lý. Đối tượng xử lý chính là các ion vô cơ mà đặc biệt là các
muối kim loại nặng như Cr, Ni, Cu, Fe,…
2. Nước thải nên tách riêng thành 3 dòng riêng biệt:
- Dung dịch thải đậm đặc từ các bể nhúng, bể ngâm.
- Nước rửa thiết bị có hàm lượng chất bẩn trung bình (muối kim loại, dầu mỡ và xà phòng,… - Nước rửa loãng
3. Để an toàn và dễ dàng xử lý, dòng axit crômic và dòng cyanide nên tách riêng.
Chất gây ô nhiễm nước thải xi mạ có thể chia làm vài nhóm sau:
- Chất ô nhiễm độc như cyanide CN-, Cr (VI), F-,…
- Chất ô nhiễm làm thay đổi pH như dòng axit và kiềm
- Chất ô nhiễm hình thành cặn lơ lửng như hydroxit, cacbonat và photphat
- Chất ô nhiễm hữu cơ như dầu mỡ, EDTA …
4. Các cuộc khảo sát cho thấy các quá trình trong ngành xử lý kim loại khá đơn
giản và tương tự nhau. Nguồn chất thải nguy hại phát sinh từ quá trình làm mát, Trang 10 / 28
NHÓM 3 – XỬ LÝ NƯỚC THẢI XI MẠ
Downloaded by Van Le (mrl3v4n@gmail.com) lOMoARcPSD|25518217
lau rửa và đốt cháy dầu. Xử lý kim loại đòi hỏi một số hoá chất như axit sunfuric,
HCl, xút, …để làm sạch bề mặt kim loại trước khi mạ. Thể tích nước thải được
hình thành từ công đoạn rửa bề mặt, làm mát hay làm trơn các bề mặt kim loại
khá lớn, gây ô nhiễm nguồn nước và ảnh hưởng đến sức khoẻ cộng đồng.
Bảng: Thành phần nước thải cơ sở xi mạ phụ tùng xe gắn máy (CEFINEA, 1996) Chỉ tiêu Đơn vị
Nước thải Ni Nước thải mạ Nước thải Cr ngâm NaOH pH 5.47 3064 11.49 TDS mg/l 502 82.3 2370 Cl- mg/l 100 24 58 SO4- mg/l 400 25 38 Alk mgCaCO3/l 60 0 1513 Ni mg/l 286 4.3 - Cr mg/l - 39.6 -
Bảng trên cho thấy nước thải ô nhiễm chủ yếu do các chất kiềm, axit và kim loại nặng Crôm và niken.
II. Ảnh hưởng của nước thải ngành xi mạ đến môi trường và con người:
1. Ảnh hưởng đến môi trường:
- Là độc chất đối với cá và thực vật nước
- Tiêu diệt các sinh vật phù du, gây bệnh cho cá và biến đổi các tính chất lí hoá
của nước, tạo ra sự tích tụ sinh học đáng lo ngại theo chiều dài chuỗi thức ăn.
Nhiều công trình nghiên cứu cho thấy, với nồng độ đủ lớn, sinh vật có thể bị chết
hoặc thoái hóa, với nồng độ nhỏ có thể gây ngộ độc mãn tính hoặc tích tụ sinh
học, ảnh hưởng đến sự sống của sinh vật về lâu về dài.
- Ảnh hưởng đến đường ống dẫn nước, gây ăn mòn, xâm thực hệ thống cống rãnh.
- Ảnh hưởng đến chất lượng cây trồng, vật nuôi canh tác nông nghiệp, làm thoái
hoá đất do sự chảy tràn và thấm của nước thải.
- Ảnh hưởng đến hệ thống xử lý nước thải, cần tách riêng nếu không sẽ ảnh hưởng
đến hoạt động của vi sinh vật khi thực hiện xử lý sinh học.
2. Ảnh hưởng đến con người:
Xi mạ là ngành có mật độ gây ô nhiễm môi trường cao bởi hơi hóa chất, nước thải
có chứa các ion kim loại nặng, kim loại độc ảnh hưởng tới sức khỏe con người
gây nên nhiều căn bệnh khó chữa, nguy hiểm tới tính mạng. Nước thải từ các quá
trình xi mạ kim loại, nếu không được xử lý, qua thời gian tích tụ và bằng con
đường trực tiếp hay gián tiếp, chúng sẽ tồn đọng trong cơ thể con người và gây
các bệnh nghiêm trọng, như viêm loét da, viêm đường hô hấp, eczima, ung thư,...
Trong khuôn khổ của Đồ án này chỉ chú trọng vào tính chất gây ô nhiễm môi
trường của nước thải xi mạ do độc tính của Crôm. Trang 11 / 28
NHÓM 3 – XỬ LÝ NƯỚC THẢI XI MẠ
Downloaded by Van Le (mrl3v4n@gmail.com) lOMoARcPSD|25518217
3. Độc tính của Crôm:
Mặc dù Crôm tồn tại ở nhiều trạng thái khác nhau, chỉ có Cr(III) và Cr(VI) gây
ảnh hưởng lớn đến sinh vật và con người.
a. Đường xâm nhập và đào thải:
Crôm xâm nhập vào cơ thể theo 3 đường: hô hấp, tiêu hóa và qua da. Cr(VI) được
cơ thể hấp thu dễ dàng hơn Cr(III) nhưng khi vào cơ thể Cr(VI) sẽ chuyển thành
dạng Cr(III). Dù xâm nhập vào cơ thể theo bất cứ đường nào, Crôm cũng được
hòa tan trong máu ở nồng độ 0.001mg/ml, sau đó được chuyển vào hồng cầu và
sự hòa tan ở hồng cầu nhanh hơn 10-20 lần. Từ hồng cầu, Crôm được chuyển vào
các tổ chức và phủ tạng. Crôm gắn với Sidero filing albumin và được giữ lại ở
phổi, xương, thận, gan, phần còn lại thì qua phân và nước tiểu. Từ các cơ quan
phủ tạng, Crôm lại được hòa tan dần vào máu, rồi được đào thải qua nước tiểu từ
vài tháng đến vài năm. Do đó nồng độ Crôm trong máu và nước tiểu biến đổi nhiều và kéo dài.
b. Tác động đến sức khoẻ:
Qua ngiên cứu người ta thấy Crôm có vai trò sinh học như chuyển hóa glucose,
protein, chất béo ở động vật hữu nhũ. Dấu hiệu của thiếu hụt Crôm ở người gồm
có giảm cân, cơ thể không thể loại đường ra khỏi máu, thần kinh không ổn định.
Tuy nhiên với hàm lượng cao Crôm làm giảm protein, axit nucleic và ức chế hệ thống men cơ bản.
Cr(VI) độc hơn Cr(III). IARC đã xếp Cr(VI) vào nhóm 1, Cr(III) vào nhóm 3 đối
với các chất gây ung thư. Hít thở không khí có nồng độ Crôm (ví dụ axit crômic
hay Cr(III) trioxit) cao (>2μg/m3) gây kích thích mũi làm chảy nước mũi, hen
suyễn dị ứng, ung thư (khi tiếp xúc với Crôm có nồng độ cao hơn 100-1000 lần
nồng độ trong môi trường tự nhiên). Ngoài ra Cr(VI) còn có tính ăn mòn, gây dị
ứng, lở loét khi tiếp xúc với da. c. Nồng độ giới hạn:
-US. EPA giới hạn nồng độ tối đa cho phép của Cr(VI) và Cr(III) trong nước uống là 100 μg/l.
-Quy định của SHA về nồng độ của Crôm trong không khí tại nơi làm việc là:
Giới hạn tiếp xúc nghề nghiệp cho ngày làm việc 8 giờ, tuần làm việc 40 giờ là
500 μg/m3 đối với Crôm tan trong nước và 1000 μg/m3 đối với Crôm kim loại và muối không tan.
Nồng độ của Crôm trioxit (axit crômic) và các hợp chất của Cr(VI) trong không
khí tại nơi làm việc không cao hơn 52 μg Cr(VI)/m3 cho ngày làm việc 10 giờ, tuần 40 giờ.
-NIOSH xem tất cả hợp chất Cr(VI) có tiềm năng gây ung thư nghề nghiệp và đưa
ra giới hạn nồng độ tiếp xúc là 1 μg Cr(VI)/m3 cho ngày làm việc 10 giờ, tuần 40 giờ. Trang 12 / 28
NHÓM 3 – XỬ LÝ NƯỚC THẢI XI MẠ
Downloaded by Van Le (mrl3v4n@gmail.com) lOMoARcPSD|25518217 4. Độc tính xianua
Xyanua ít thấy ở dạng đơn chất mà chủ yếu tồn tại ở dạng hợp chất. Xyanua có
thể phản ứng với kim loại và các hợp chất hữu cơ khác. Các hợp chất đơn giản
của Xyanua như kali xyanua, natri xyanua thường rất độc. Nhất là kali xyanua có
thể gây chết người với liều lượng thấp. Chỉ cần bị xâm nhập vào cơ thể từ 3 đến
4 mg chất này thì một người khỏe mạnh có thể mất ý thức trong vòng 10 giây đến
1 phút. Sau khoảng 45 phút thì rơi vào trạng thái hôn mê và có thể tử vong sau
khoảng 2 giờ nếu không có các biện pháp điều trị kịp thời.
Con người có thể bị nhiễm xyanua qua 3 đường: đường tiêu hóa thông qua thức
ăn và nước uống, đường hô hấp vì axít xyanua có thể bay hơi và sau cùng xyanua
cũng có thể xâm nhập xuyên qua da. Vào cơ thể, xyanua sẽ gắn kết chặt “không
thể hồi phục” với gốc sắt nhị Fe2+của men cytochrom oxidase trong “chuỗi hô
hấp vàng” Warburg. Cytochrom oxidase là nơi chủ chốt để trao đổi oxy cho cơ
thể, cho nên khi men cytochrom oxidase này bị khóa cơ thể không hô hấp được
và sẽ bị “ngạt” dù vẫn có đầy đủ dưỡng khí oxy.
Nhận xét: Lượng nước thải của ngành xi mạ không phải là lớn so với các ngành
công nghiệp khác như nước thải của ngành công nghiệp giấy, dệt,… song thành
phần và nồng độ các chất độc hai trong đó khá lớn. Hơn nữa các hóa chất độc hại
này lại có những biến thiên hết sức phức tạp và phụ thuộc vào quy trình công nghệ
cũng như từng công đoạn trong quy trình đó. Vì vậy, muốn xử lý đạt hiệu quả cao
thì chúng ta cần phải thu gom, tách dòng theo từng công doạn, từng trường hợp
cụ thể và lựa chọn phương án xử lý thích hợp.
III. Hiện trạng ô nhiễm môi trường do công nghiệp xi mạ tại Việt Nam:
1. Kết quả các nghiên cứu gần đây về hiện trạng môi trường ở nước ta cho thấy,
hầu hết các nhà máy, cơ sở xi mạ kim loại có quy mô vừa và nhỏ, áp dụng công
nghệ cũ và lạc hậu, lại tập trung chủ yếu tại các thành phố lớn, như Hà Nội, Hải
Phòng, TP.HCM, Biên Hoà (Đồng Nai) ... Trong quá trình sản xuất, tại các cơ
sở này (kể cả các nhà máy quốc doanh hoặc liên doanh với nước ngoài), vấn đề
xử lý ô nhiễm môi trường còn chưa được xem xét đầy đủ hoặc việc xử lý còn
mang tính hình thức, chiếu lệ, bởi việc đầu tư cho xử lý nước thải khá tốn kém
và việc thực thi Luật Bảo vệ môi trường chưa được nghiêm minh.
2. Nước thải mạ thường gây ô nhiễm bởi các kim loại nặng, như crôm, niken ...
và độ pH thấp. Phần lớn nước thải từ các nhà máy, các cơ sở xi mạ được đổ trực
tiếp vào cống thoát nước chung của thành phố mà không qua xử lý triệt để, đã
gây ô nhiễm cục bộ trầm trọng nguồn nước.
3. Kết quả khảo sát tại một số nhà máy cơ khí ở Hà Nội cho thấy, nồng độ chất
độc có hàm lượng các ion kim loại nặng, như crôm, niken, đồng ... đều cao hơn
nhiều so với tiêu chuẩn cho phép; một số cơ sở mạ điện tuy có hệ thống xử lý
nước thải nhưng chưa chú trọng đầy đủ đến các thông số công nghệ của quá
trình xử lý để điều chỉnh cho phù hợp khi đặc tính của nước thải thay đổi. Tại
TP.HCM, Bình Dương và Đồng Nai, kết quả phân tích chất lượng nước thải của Trang 13 / 28
NHÓM 3 – XỬ LÝ NƯỚC THẢI XI MẠ
Downloaded by Van Le (mrl3v4n@gmail.com) lOMoARcPSD|25518217
các nhà máy, cơ sở xi mạ điển hình ở cả 3 địa phương này cho thấy, hầu hết các
cơ sở đều không đạt tiêu chuẩn nước thải cho phép: hàm lượng chất hữu cơ cao,
chỉ tiêu về kim loại nặng vượt nhiều lần tiêu chuẩn cho phép, COD dao động
trong khoảng 320 - 885mg/lít do thành phần nước thải có chứa cặn sơn, dầu nhớt…
4. Hơn 80% nước thải của các nhà máy, cơ sở xi mạ không được xử lý. Chính
nguồn thải này đã và đang gây ô nhiễm nghiêm trọng đến môi trường nước mặt,
ảnh hưởng đáng kể chất lượng nước sông Sài Gòn và sông Đồng Nai. Ước tính,
lượng chất thải các loại phát sinh trong ngành công nghiệp xi mạ trong những
năm tới sẽ lên đến hàng ngàn tấn mỗi năm. Điều này cho thấy các khu vực ô
nhiễm và suy thoái môi trường ở nước ta sẽ còn gia tăng nếu không kịp thời đưa
ra các biện pháp hữu hiệu.
Chương 3: Phương pháp Xử lý nước thải Xi-mạ
I. Giới thiệu các phương pháp và công nghệ xử lý nước thải xi mạ:
Phương pháp xử lý nước thải xi mạ phổ biến nhất là dùng phương pháp hoá học
rồi đến trao đổi ion, phương pháp chưng cất, phương pháp điện thẩm tích. Chọn
phương pháp nào là tuỳ chỉ tiêu kinh tế - kĩ thuật cho phép, điều kiện môi trường
địa phương, yêu cầu, mục đích dùng lại hoặc thải thẳng ra môi trường… Chọn
phương pháp nào cũng phải bảo đảm chất lượng môi trường theo TCVN 5945- 2010.
1. Phương pháp kết tủa:
Quá trình kết tủa thường được ứng dụng cho xử lý nứơc thải chứa kim loại nặng.
Kim loại nặng thường kết tủa ở dạng hydroxit khi cho chất kiềm hóa (vôi, NaOH,
Na2CO3,…) vào để đạt đến giá trị pH tương ứng với độ hoà tan nhỏ nhất. Giá trị
pH này thay đổi tuỳ theo kim loại. Độ hoà tan nhỏ nhất của Crôm ở pH 7.5 và
kẽm là 10.2. Ở ngoài giá trị đó, hàm lượng hoà tan tăng lên.
Khi xử lý kim loại, cần thiết xử lý sơ bộ để khử đi các chất cản trở quá trình
kết tủa. Thí dụ như cyanide và ammonia hình thành các phức với nhiều kim loại
làm giảm hiệu quả quá trình kết tủa. Cyanide có thể xử lý bằng chlorine hoá-kiềm,
ammonia có thể khử bằng phương pháp chlorine hoá điểm uốn (breakthrough
point), tách khí (air stripping) hoặc các phương pháp khác trước giai đoạn khử kim loại.
Trong xử lý nước thải công nghiệp, kim loại nặng có thể loại bỏ bằng quá
trình kết tủa hydroxit với chất kiềm hóa, hoặc dạng sulfide hay carbonat.
Một số kim loại như arsenic hoặc cadmium ở nồng độ thấp có thể xử lý hiệu
quả khi cùng kết tủa với phèn nhôm hoặc sắt. Khi chất lượng đầu ra đòi hỏi cao,
có thể áp dụng quá trình lọc để loại bỏ các cặn lơ lửng khó lắng trong quá trình kết tủa.
Đối với Crôm VI (Cr6+), cần thiết tiến hành khử Cr6+ thành Cr3+ và sau đó kết
tủa với vôi hoặc xút. Hoá chất khử thông thường cho xử lý nước thải chứa Crôm Trang 14 / 28
NHÓM 3 – XỬ LÝ NƯỚC THẢI XI MẠ
Downloaded by Van Le (mrl3v4n@gmail.com) lOMoARcPSD|25518217
là ferrous sulphate (FeSO4), sodium-meta-bisulfit, hoặc sulfur dioxit. Ferrous
sulphate (FeSO4), sodium-meta-bisulfit có thể ở dạng rắn hoặc dung dịch. SO2 ở
dạng khí nén trong các bình chịu áp. Quá trình khử hiệu quả trong môi trường pH
thấp. Vì vậy các hoá chất khử sử dụng thường là các chất mang tính axit mạnh.
Trong quá trình khử, Fe2+ sẽ chuyển thành Fe3+. Nếu sử dụng meta-bisulfit hoặc sulfur dioxit, ion SO 2- 2- 3 chuyển thành SO4 .
Phản ứng tổng quát như sau:
Cr6+ + Fe2+ + H+ Cr3+ + Fe3+ Cr6+ + Na 2-
2S2O3 (hoặc SO2) + H+ Cr3+ + SO4 Cr3+ + 3OH- Cr(OH)3
Trong phản ứng oxy hoá khử, ion Fe2+ phản ứng với Cr6+, khử Cr6+ thành Cr3+
và oxy hoá Fe2+ thành Fe3+. Phản ứng xảy ra nhanh hơn ở pH nhỏ hơn 3. Axit có
thể được thêm vào để đạt pH thích hợp. Sử dụng FeSO4 là tác nhân khử có điểm
bất lợi khối lượng bùn sinh ra khá lớn do cặn Fe(OH)3 tạo thành khi cho chất kiềm
hoá vào. Để thu được phản ứng hoàn toàn, cần thiết phải thêm lượng FeSO4 dư,
khoảng 2.5 lần so với hàm lượng tính toán trên lí thuyết.
Lượng axit cần thiết cho quá trình khử Cr6+ phụ thuộc vào độ axit của nước
thải nguyên thuỷ, pH của phản ứng khử và loại hoá chất sử dụng.
Xử lý từng mẻ (batch treatment) ứng dụng có hiệu quả kinh tế, khi nhà máy xi
mạ có lưu lượng nước thải mỗi ngày ≤ 100m3/ngày. Trong xử lý từng mẻ cần dùng
hai loại bể có dung tích tương đương lượng nước thải trong một ngày Qngày. Một
bể dùng xử lý, một bể làm đầy.
Khi lưu lượng ≥ 100m3/ngày, xử lý theo mẻ không khả thi do dung tích bể lớn.
Xử lý dòng chảy liên tục đòi hỏi bể axit và khử, sau đó qua bể trộn chất kiềm hoá
và bể lắng. Thời gian lưu nước trong bể khử phụ thuộc vào pH, thường lấy tối
thiểu 4 lần so với thời gian phản ứng lý thuyết. Thời gian tạo bông thường lấy
khoảng 20 phút và tải trọng bể lắng không nên lấy ≥ 20m3/ngày.
Trong trường hợp nước rửa có hàm lượng crôm thay đổi đáng kể, cần thiết có
bể điều hoà trước bể khử để giảm thiểu dao động cho hệ thống châm hoá chất.
2. Phương pháp trao đổi ion:
Phương pháp này thường được ứng dụng cho xử lý nước thải xi mạ để thu
hồi Crôm. Để thu hồi axit crômic trong các bể xi mạ, cho dung dịch thải axit
crômic qua cột trao đổi ion resin cation (RHmạnh) để khử các ion kim loại (Fe,
Cr3+, Al,…). Dung dịch sau khi qua cột resin cation có thể quay trở lại bể xi mạ
hoặc bể dự trữ. Do hàm lượng Crôm qua bể xi mạ khá cao (105-120kg
CrO3/m3), vì vậy để có thể trao đổi hiệu quả, nên pha loãng nước thải axit
crômic và sau đó bổ sung axit crômic cho dung dịch thu hồi.
Đối với nước thải rửa, đầu tiên cho qua cột resin cation axit mạnh để khử các
kim loại. Dòng ra tiếp tục qua cột resin anion kiềm mạnh để thu hồi crômat và
thu nước khử khoáng. Cột trao đổi anion hoàn nguyên với NaOH. Dung dịch
qua quá trình hoàn nguyên là hỗn hợp của Na2CrO4 và NaOH. Hỗn hợp này cho Trang 15 / 28
NHÓM 3 – XỬ LÝ NƯỚC THẢI XI MẠ
Downloaded by Van Le (mrl3v4n@gmail.com) lOMoARcPSD|25518217
chảy qua cột trao đổi cation để thu hồi H2CrO4 về bể xi mạ. Axit crômic thu hồi
từ dung dịch đã hoàn nguyên có hàm lượng trung bình từ 4-6%. Lượng dung
dịch thu được từ giai đoạn hoàn nguyên cột resin cation cần phải trung hoà bằng
các chất kiềm hoá, các kim loại trong dung dịch kết tủa và lắng lại ở bể lắng trước khi xả ra cống.
3. Phương pháp điện hóa:
Dựa trên cơ sở của quá trình oxy hoá khử để tách kim loại trên các điện cực
nhúng trong nước thải chứa kim loại nặng khi cho dòng điện một chiều chạy qua.
Phương pháp này cho phép tách các ion kim loại ra khỏi nước mà không cần cho
thêm hoá chất, tuy nhiên thích hợp cho nước thải có nồng độ kim loại cao (> 1g/l)
4. Phương pháp hấp phụ sinh học:
Dựa trên nguyên tắc một số loài thực vật, vi sinh vật trong nước sử dụng kim
loại như chất vi lượng trong quá trình phát triển khối như bèo tây, bèo tổ ong,
tảo… Với phương pháp này, nước thải phải có nồng độ kim loại nặng nhỏ hơn 60
mg/l và phải có đủ chất dinh dưỡng (nitơ, phốtpho,…) và các nguyên tố vi lượng
cần thiết khác cho sự phát triển của các loài thực vật nước như rong tảo. Phương
pháp này cần có diện tích lớn và nước thải có lẫn nhiều kim loại thì hiệu quả xử lý kém.
5. Phương pháp hấp phụ
Nguyên tắc: Quá trình hấp phụ chủ yếu là hấp phụ vật lý tức là quá trình di
chuyển của các chất ô nhiễm (các ion kim loại) (chất bị hấp phụ) đến bề mặt phan rắn (chất hấp phụ)
Người ta thường dung biện pháp hấp phụ sinh học, tức là dùng các vật liệu sinh
học để tách các kim loại hay các hợp chất của nó ra khỏi nước thải. Chẳng hạn
như: Chitosan – một polymer sinh học dạng glucosamin là sản phẩm của deactyl
hóa chitin lấy từ vỏ tôm, cua, một vài loại nấm và một số loài động vật giáp xác. Phương pháp Ưu điểm Hạn chế xử lý
Hấp phụ sinh - Vận hành đơn giản
- Khó kiểm soát nồng độ học
- Giá thành vật liệu rẻ Điện hóa
- Nồng độ kim loại đầu vào - Chi phí điện năng rất lớn cao
- Thu hồi kim loại với độ tinh khiết cao
- Tự động hóa quá trình
Oxy hóa khử- - Xử lý nước thải lưu lượng - Chuyển chất thải từ dạng này kết tủa lớn sang dạng khác - Chi phí thấp
- Tạo lượng bùn kim loại lớn.
- Đơn giản, dễ vận hành Trang 16 / 28
NHÓM 3 – XỬ LÝ NƯỚC THẢI XI MẠ
Downloaded by Van Le (mrl3v4n@gmail.com) lOMoARcPSD|25518217
Trao đổi ion - Thu hồi kim loại quý
- Tái sinh vật liệu trao đổi
- Nhu cầu năng lượng thấp Sinh học
- Quá trình xử lý tạo ra chất - Yêu cầu mặt bằng lớn
thải ít nên than thiện với môi - Hiệu quá thấp nếu hàm lượng trường
chất ô nhiễm trong dòng thải - Giá thành thấp
không ổn định hoặc quá lớn
- Quá trình vận hành phải kiếm
soát các chất ô nhiễm trong dòng
thải và lượng chất dinh dưỡng
N,P cấp them vào dòng thải
Chương 4: Hệ thống xử lý nước thải xi mạ của công ty cổ phần Khóa Minh Khai
I.Thông tin về doanh nghiệp.
Địa chỉ: Km 14 - Quốc lộ 1A - Ngọc Hồi - Thanh Trì - Hà Nội Sản phẩm chính:
- Sản xuất thiết bị máy móc cho ngành xây dựng, vật liệu xâu dựng và công trình Đô thị.
- Sản xuất phụ tùng, phụ kiện bằng kim loại.
- Kinh doanh các sản phẩm cơ khí.
- Lắp đặt máy móc, thiết bị cho công trình xây dựng công nghiệp và dân dùng,
trang trí nội thất ngoại thất.
Xi mạ(bao gồm mạ Crom, mạ niken, mạ kẽm,….)là một trong các giai đoạn để hoàn thiện sản phẩm.
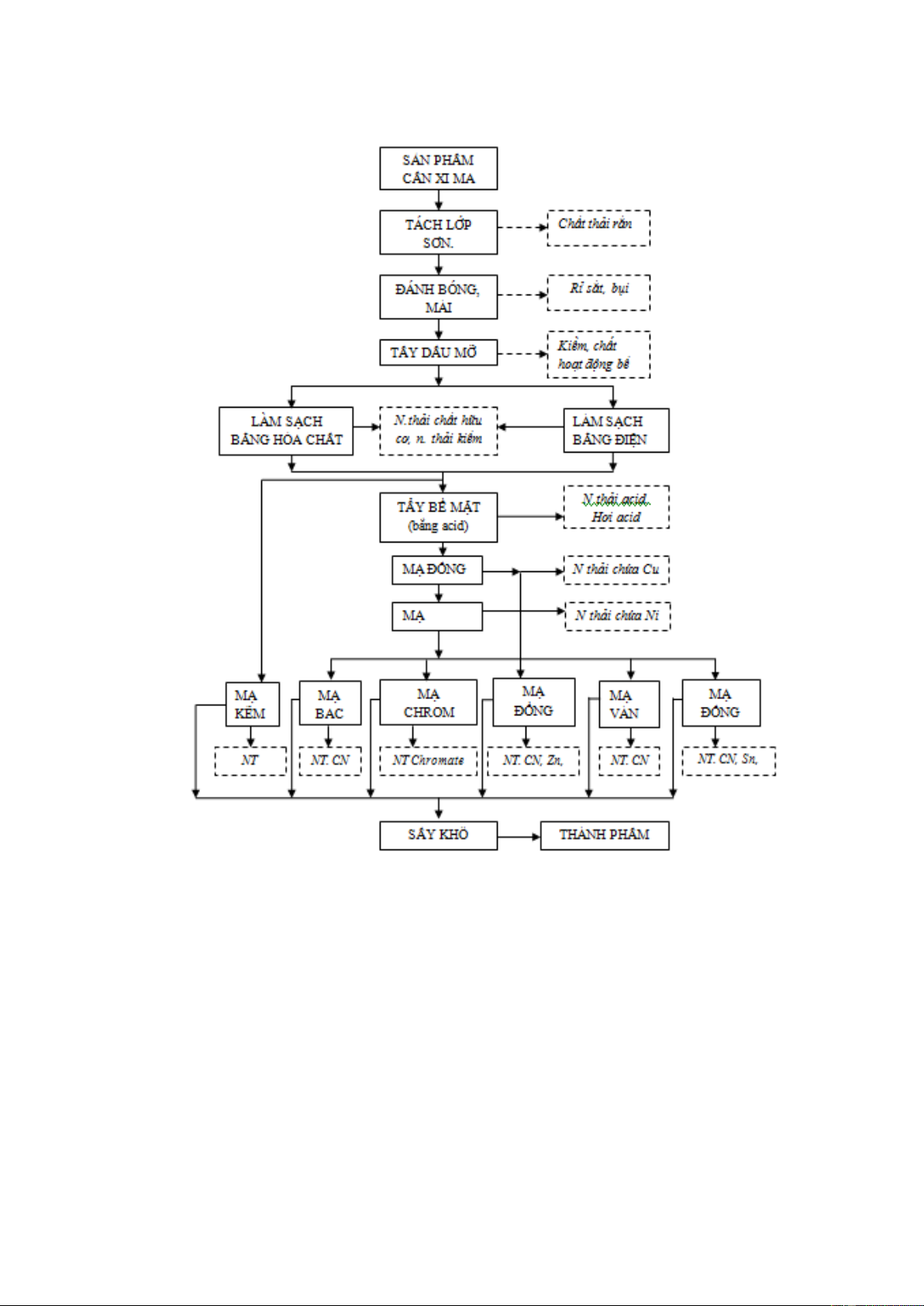
Mộ trong các quy trình xi mạ của công ty: Chi tiết Gia công cơ khí Đánh bóng Tẩy dầu mỡ, hóa NaOH học Nước Rửa
Nước thải kiềm, dầu mỡ H2SO4 1% Tẩy nhẹ Trang 17 / 28
NHÓM 3 – XỬ LÝ NƯỚC THẢI XI MẠ
Downloaded by Van Le (mrl3v4n@gmail.com) lOMoARcPSD|25518217 Nước Rửa Nước thải axit NiSO4 Mạ niken mờ NiSO4 Mạ niken bóng Rửa thu hồi Nước Rửa Nước thải axit, Ni CrO Mạ crom 2, H2SO4 Nước Rửa Nước thải axit,Cr Sấy Thành phẩm
Ngoài những dòng thải có trong quy trình trên, Công ty còn có các dòng thải
khác thuộc các quy trình khác như dòng thải xianua, dòng thải kẽm,…
Bảng: Các thông số có trong dòng thải xi mạ của công ty cổ phần Khóa Minh Khai Trang 18 / 28
NHÓM 3 – XỬ LÝ NƯỚC THẢI XI MẠ
Downloaded by Van Le (mrl3v4n@gmail.com) lOMoARcPSD|25518217
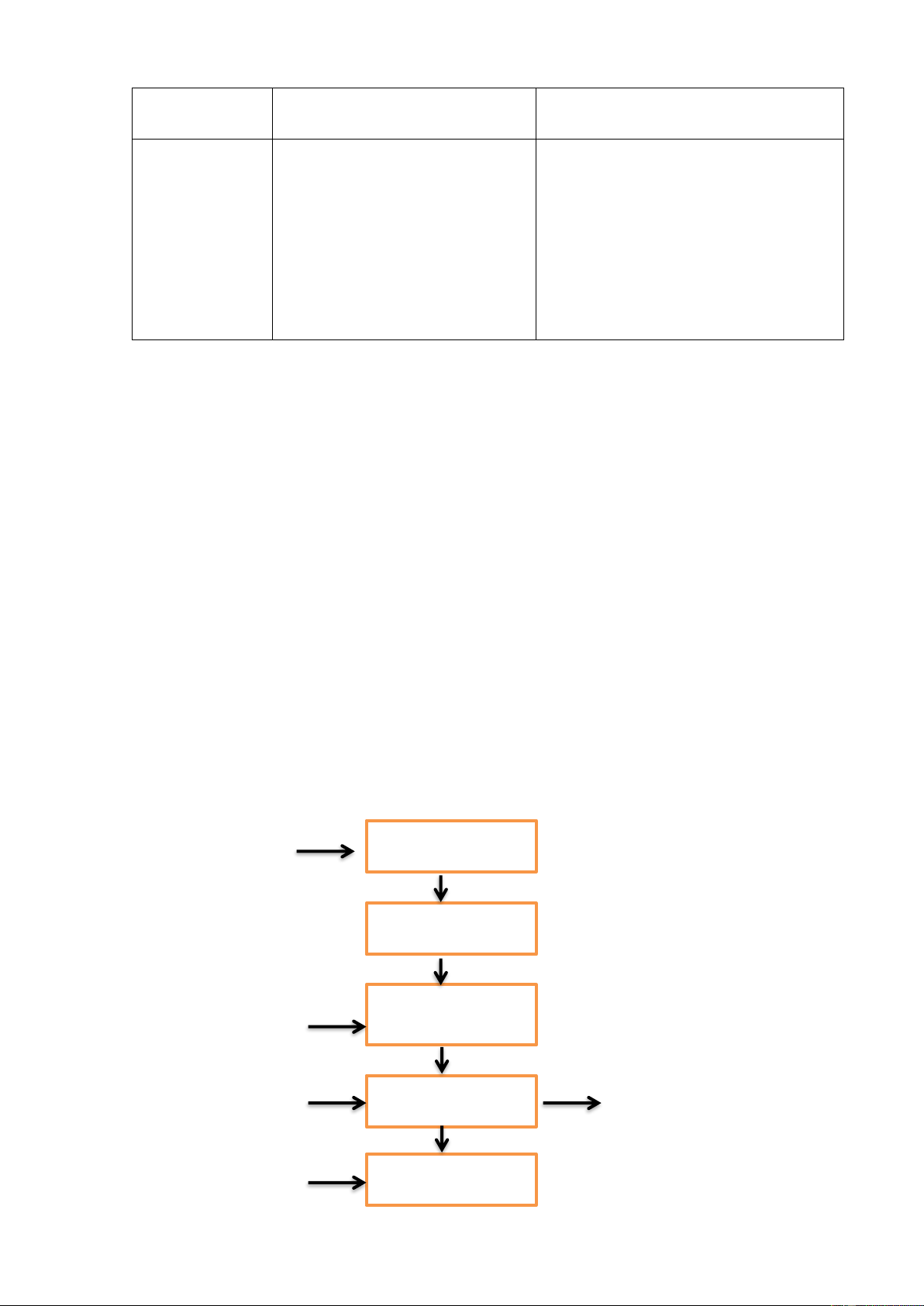
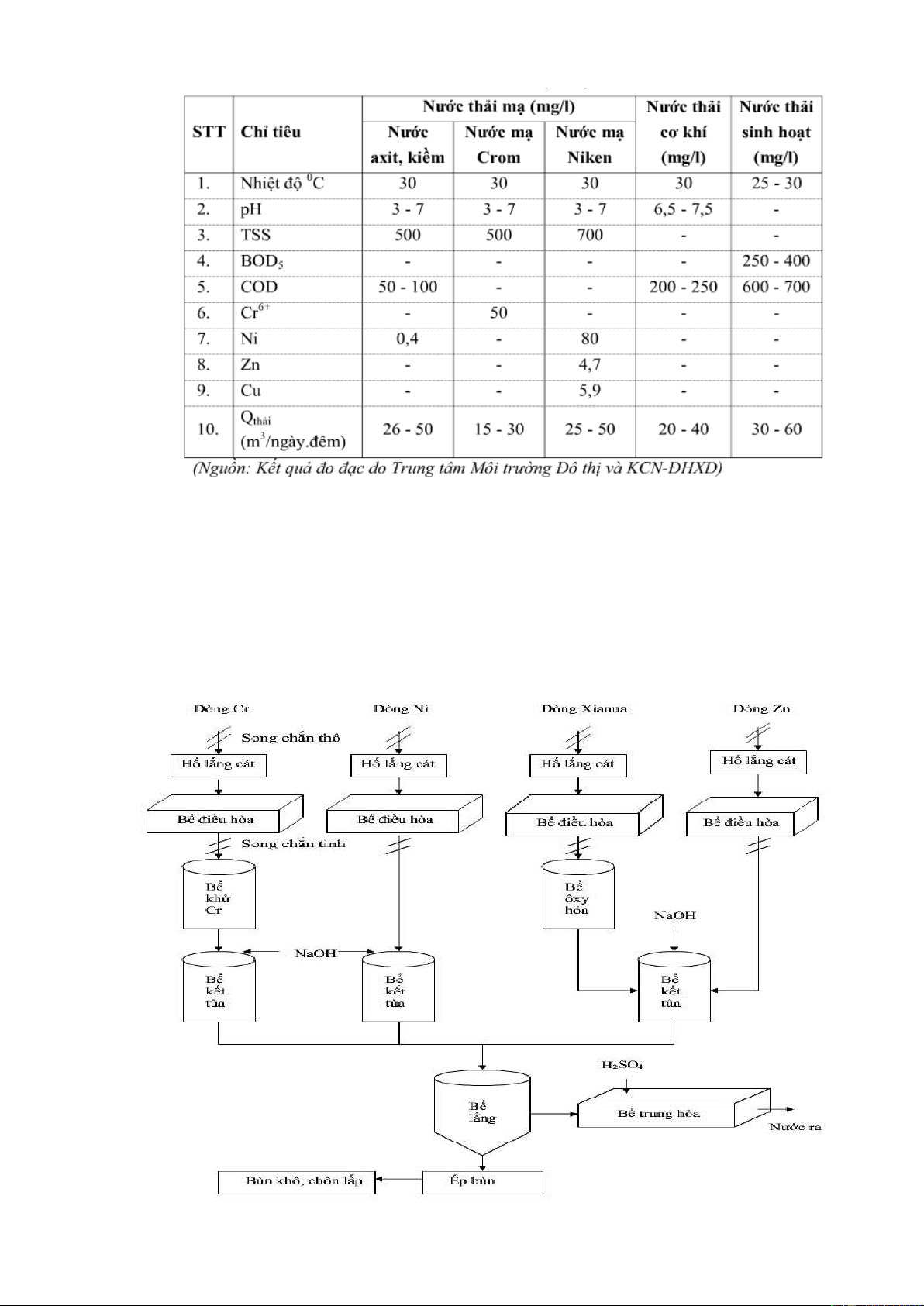
II. Xử lý nước thải 1. Phân luồng dòng thải
Nước thải xưởng mạ điện bao gồm 4 dòng thải chính là chứa nước thải mạ
xyanua, mạ Crom, mạ kẽm và mạ niken. Do quá trình oxy hóa khử và kết tủa
của các dòng thải này diễn ra ở các điều kiện pH khác nhau nên để đảm bảo cho
hiệu quả xử lý cao, chúng ta tiến hành tách dòng thải tại nguồn. Mỗi dòng thải
trên sẽ đi theo các tuyến khác nhau về hố thu nước thải riêng.
2. Sơ đồ xử lý nước thải Trang 19 / 28
NHÓM 3 – XỬ LÝ NƯỚC THẢI XI MẠ
Downloaded by Van Le (mrl3v4n@gmail.com) lOMoARcPSD|25518217
Thuyết minh các thiết bị chính a. Song chắn rác
Song chắn rác làm từ thành thép với khoảng cách giữa các thanh là 20mm. Do
nước thải của các cơ sở mạ điện không chứa nhiều tạp chất thô, có kích thước
lớn nên lượng rác tích lũy tại song chắn là không đáng kể. b. Bể điều hòa
Do đặc trưng của ngành mạ điện là lưu lượng cũng như nồng độ các chất ô
nhiễm trong nước thải dao động lớn nên bể điều hòa được sử dụng để ổn định
các thông số này, tạo điều kiện cho quá trình xử lý tiếp theo đạt hiệu quả cao.
Quá trình điều hòa cũng tránh cho tình trạng quá tải do đó giảm chi phí xây
dựng, vận hành và quản lý của hệ thống xử lý. c. Bể phản ứng khử
Trong bể phản ứng khử, Cr(VI) được chuyển hóa thành dạng Cr(III) ít độc hơn
và dễ xử lý hơn. Chất khử được lựa chọn là Na2SO3, môi trường phản ứng là
pH=3. Na2SO3 được pha chế thành dung dịch 20% sau đó được bơm vào bể phản ứng. Cr 2- 2- 2-
2O7 + 3SO3 + 8H+ 2Cr3+ + 3SO4 + 4H2O
Hóa chất Na2SO3 được định lượng đưa vào bể phản ứng. Dung dịch axit (98%)
từ bể chứa axit định lượng và đưa vào bể chứa để tạo môi trường thích hợp
(pH=3), thiết bị đo pH được gắn liền với thiết bị định lượng nhằm kiểm soát
lượng axit đưa vào bể, tạo điều kiện cho phản ứng xảy ra tối ưu. d. Bể phản ứng oxy hóa
Trong bể phản ứng oxy hóa, CN được oxy hóa thành CNO- và sau đó thành N2
và CO2. Chất oxy hóa được lựa chọn là NaOCl, môi trường phản ứng là ph = 8,5
-10. NaOCl được pha chế thành dung dịch 20% sau đó được bơm vào bể phản
ứng. Phản ứng xảy ra như sau NaCN + NaOCl NaCNO + NaCl Trang 20 / 28
NHÓM 3 – XỬ LÝ NƯỚC THẢI XI MẠ
Downloaded by Van Le (mrl3v4n@gmail.com) lOMoARcPSD|25518217
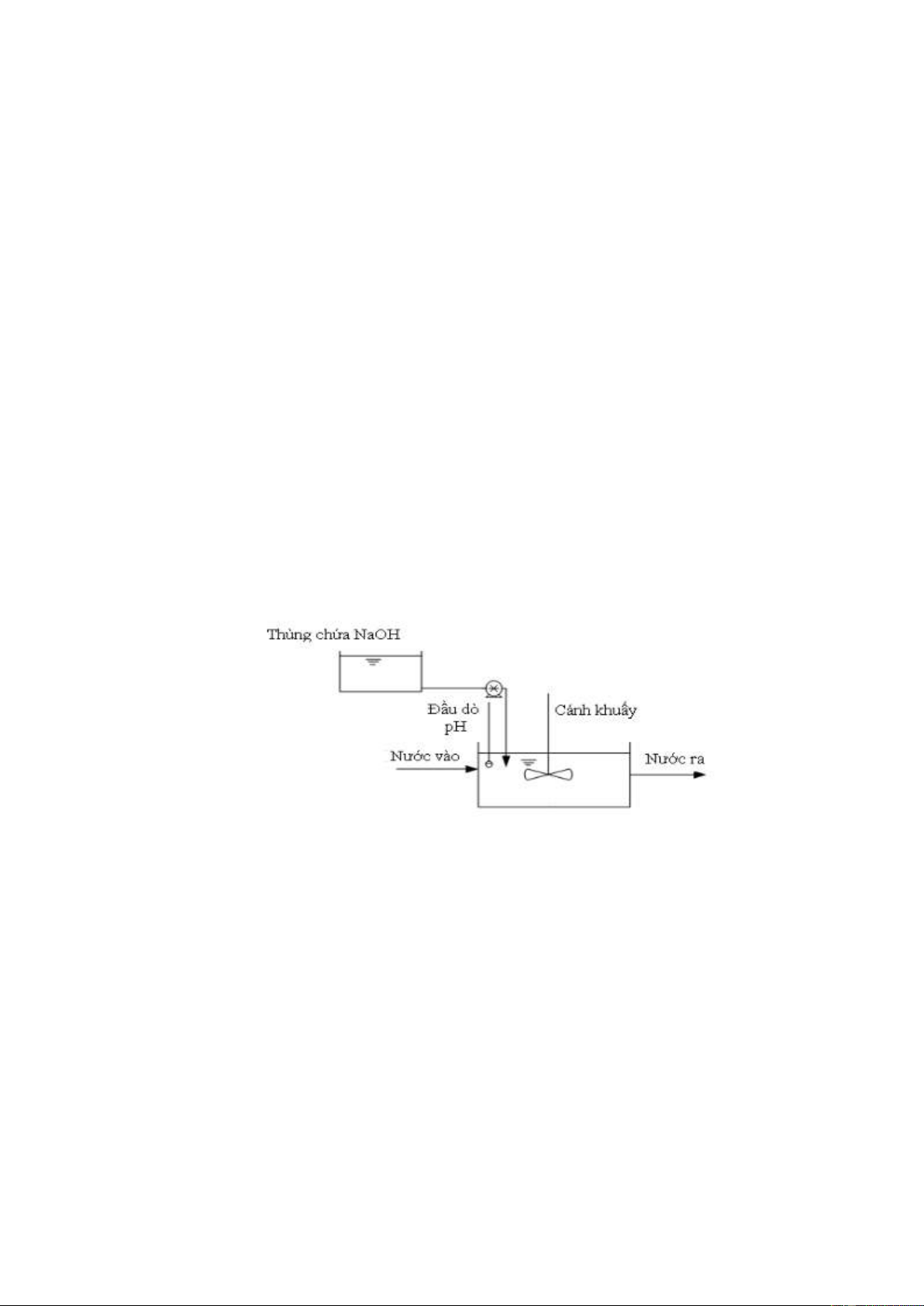
NaCNO + NaOCl + H2O CO2 + N2 + NaOH + NaCl c. Bể kết tủa
Bể kết tủa có tác dụng kết tủa các kim loại có trong nước thải. NaOH được chế
thành dung dịch 20%, sau đó được vào bể, ở đây ion kim loại phản ứng với
NaOH tạo dạng hydroxyt kết tủa. Phản ứng kết tủa: + Đối với Cr
Cr2(SO4)3 + 6NaOH 2Cr(OH)3 + 3Na2SO4 + Đối với Cu và Zn
Cu2+ + 2NaOH Cu(OH)2 + 2Na+
ZnSO4 + 2NaOH Zn(OH)2 + Na2SO4 + Đối với Ni
NiSO4 + 2NaOH Ni(OH)2 + Na2SO4
Xút từ bể chứa được đưa vào bể phản ứng để tạo kết tủa. Thiết bị đo pH được
gắn liền với thiết bị định lượng để đảm bảo pH của môi trường luôn ổn định
trong dải pH keo tụ, tạo điều kiện thuận lợi cho phản ứng kệt tủa xảy ra. f. Bể lắng
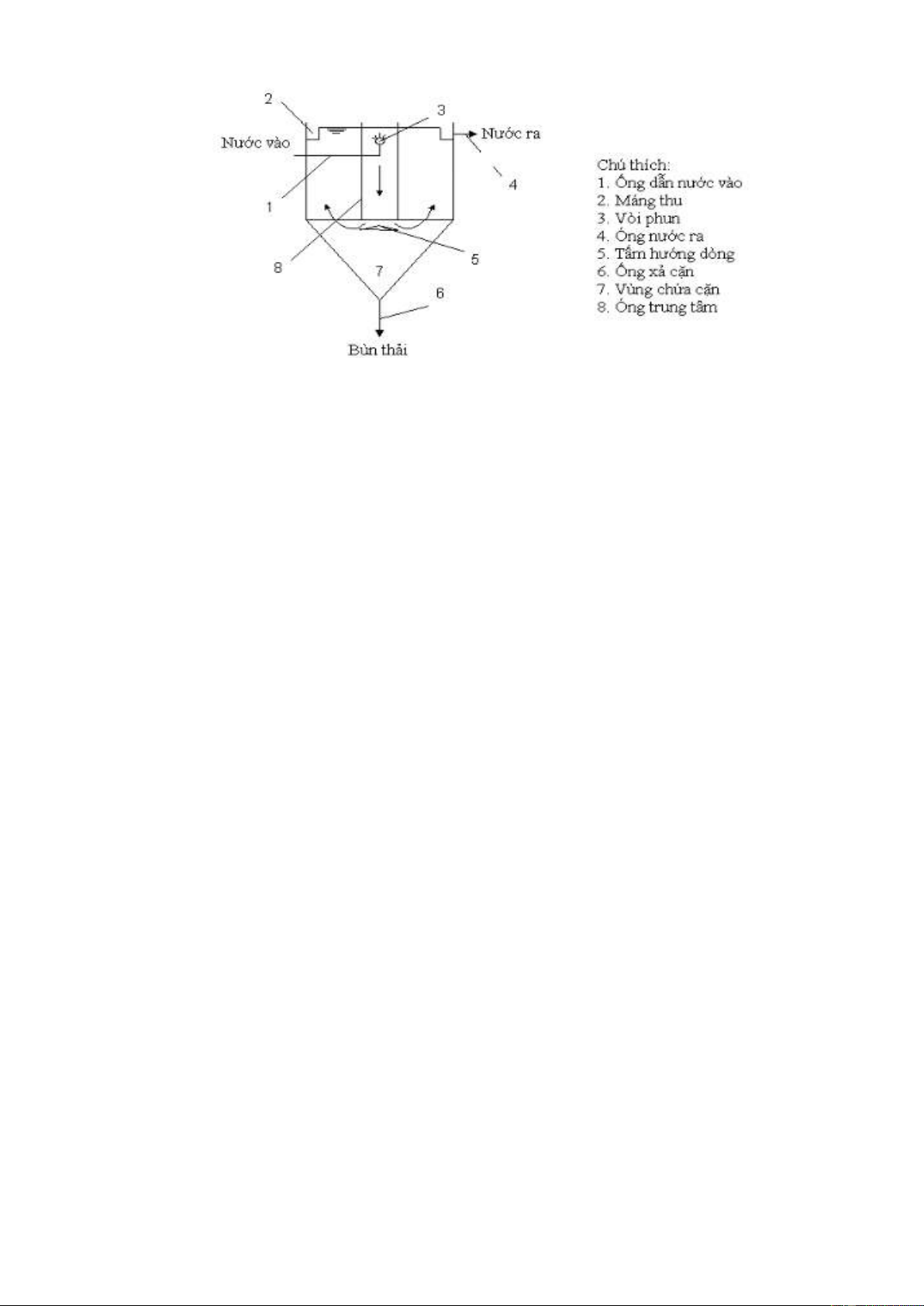
Nhiệm vụ của bể lắng là tách các hạt hydroxyt kim loại kết tủa và các hạt rắn lơ
lửng ra khỏi nước thải. Các hạt hydroxyl kết tủa có kích thước lớn nên dễ dàng
dàng lắng ngay khi vào bể lắng. Các hạt rắn lơ lửng có kích thướng nhỏ hơn nên khó lắng hơn. Trang 21 / 28
NHÓM 3 – XỬ LÝ NƯỚC THẢI XI MẠ
Downloaded by Van Le (mrl3v4n@gmail.com) lOMoARcPSD|25518217
Nước thải theo đường dẫn nước vào (1) chảy vào ống trung tâm (8) ở giữa bể.
Phía ống trung tâm có bố trí tấm hướng dòng (5) để thay đổi hướng chảy của
nước thải sang hướng ngang. Nước chảy ra khỏi ống trung tâm dâng lên theo
than bể, sau đó tràn ra máng thu (2) và theo ống dẫn nước ra (4) đi sang bể điều
chỉnh pH cuối cùng. Cặn lắng rơi xuống vùng chứa cặn hình chop (7) và theo
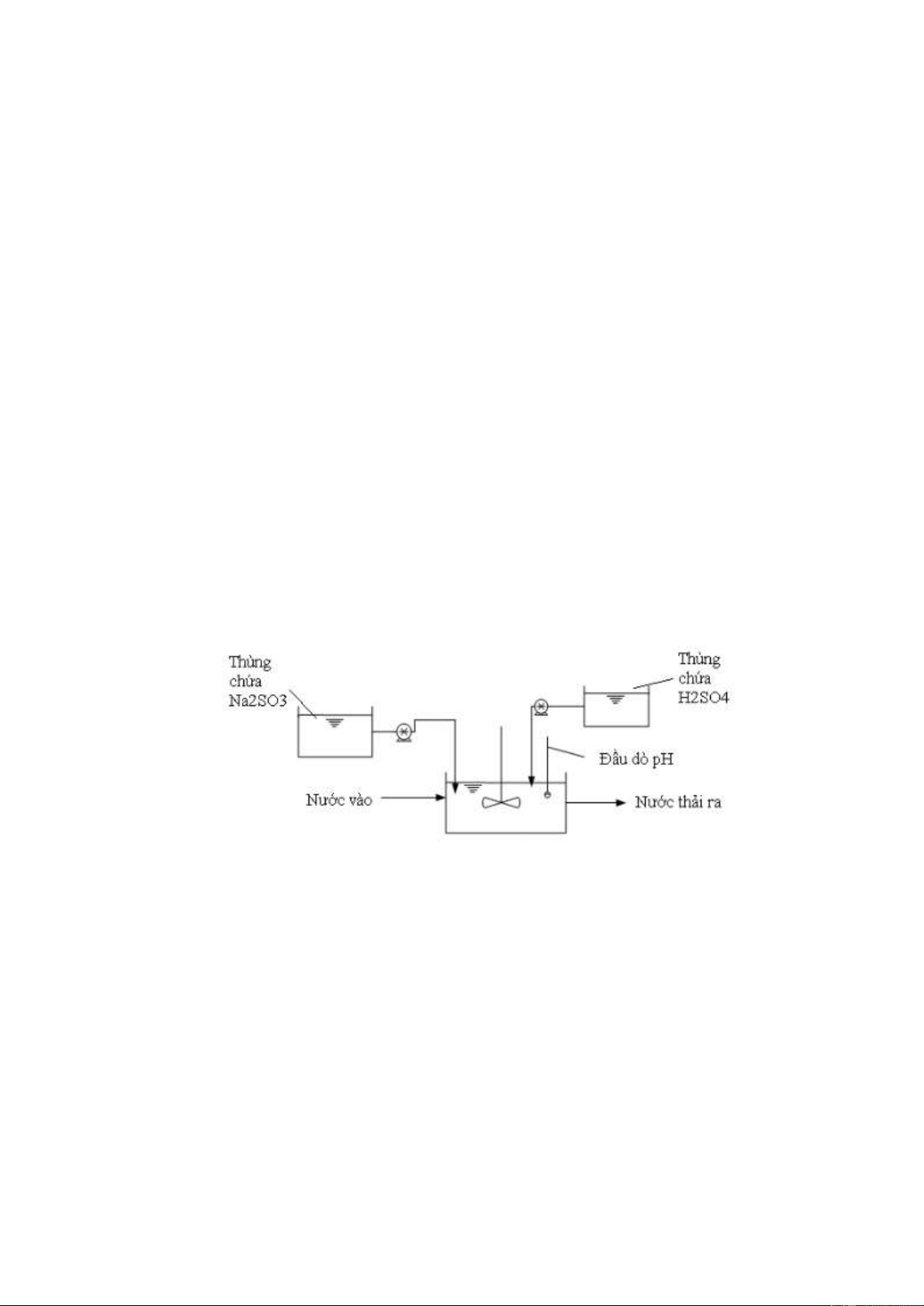
ống xả cặn (6) sang thiết bị xử lý cặn. g. Bể điều chỉnh pH
Nước sau khi ra khỏi bể lắng mang tính kiềm, vì vậy trước khi thải ra môi
trường cần phải qua bể điều điều chỉnh pH sao cho đạt QCVN 40:2011/BTNMT
(loại B). Axit từ bể chưa axit được định lượng và đưu vào bể để pH của nước
thải ra môi trường là 5,5 đến 9. h. Thiết bị xử lý bùn
Trong hệ thống xử lý này, thiết bị lọc ép khung bản có tác dụng tách nước ra
khỏi buồn lắng, giảm khối lượng chất thải rắn của hệ thống. Bùn thải sau khi
tách nước được đem đi chôn lấp. Trang 22 / 28
NHÓM 3 – XỬ LÝ NƯỚC THẢI XI MẠ
Downloaded by Van Le (mrl3v4n@gmail.com) lOMoARcPSD|25518217
III. Kết quả sau khi đi qua hệ thống xử lý
Nhận xét: Kết quả các thông số nước thải sau xử lý đều đạt chuẩn theo QCVN 40:2011/BTNMT (loại B) Trang 23 / 28
NHÓM 3 – XỬ LÝ NƯỚC THẢI XI MẠ
Downloaded by Van Le (mrl3v4n@gmail.com) lOMoARcPSD|25518217
Chương 5:Một số mô hình xử lý tham khảo của các Công ty tư vấn Môi trường
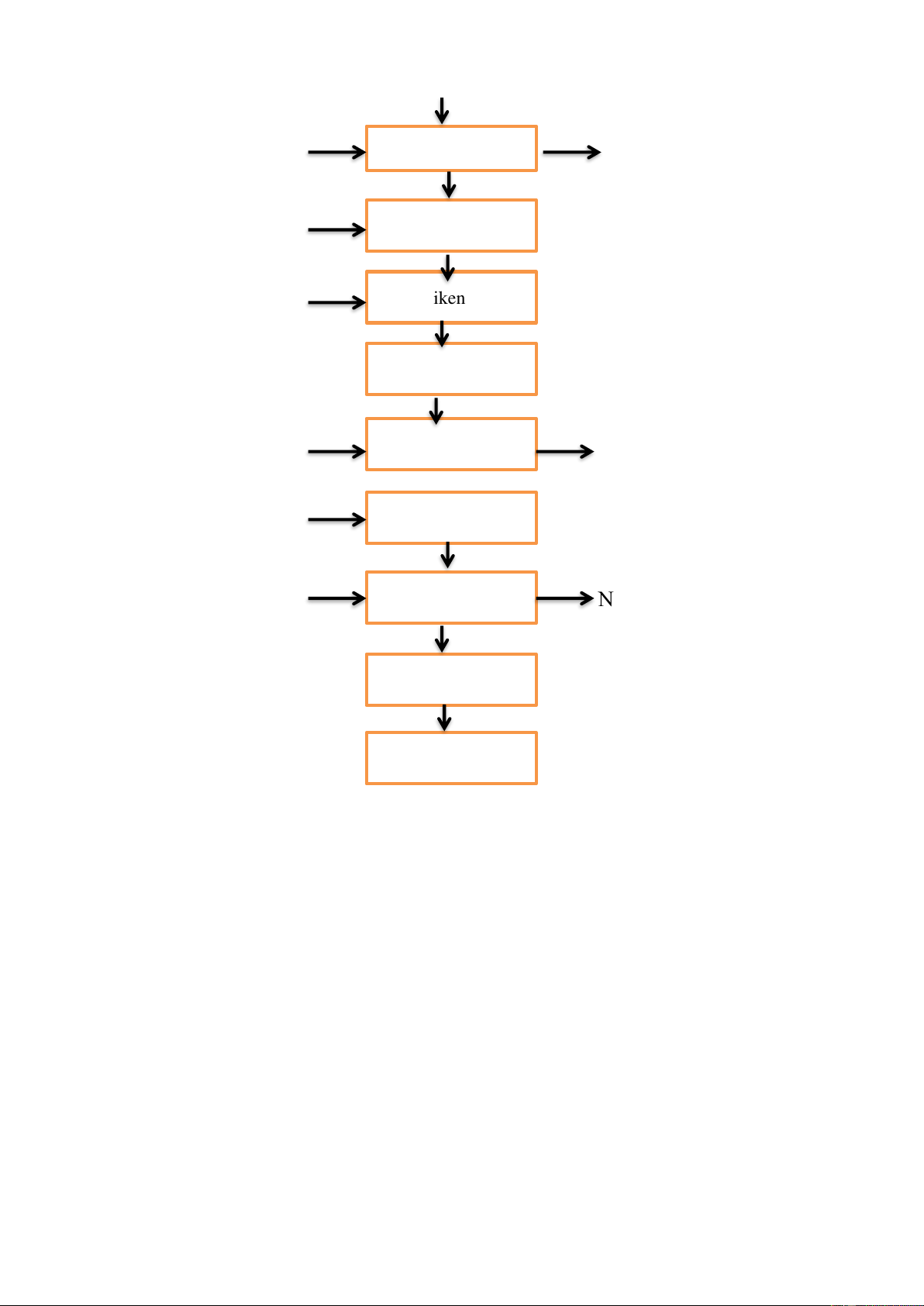
I. CÔNG TY CỔ PHẦN TƯ VẤN ĐẦU TƯ MÔI TRƯỜNG THẢO NGUYÊN XANH Quy trình xử lý:
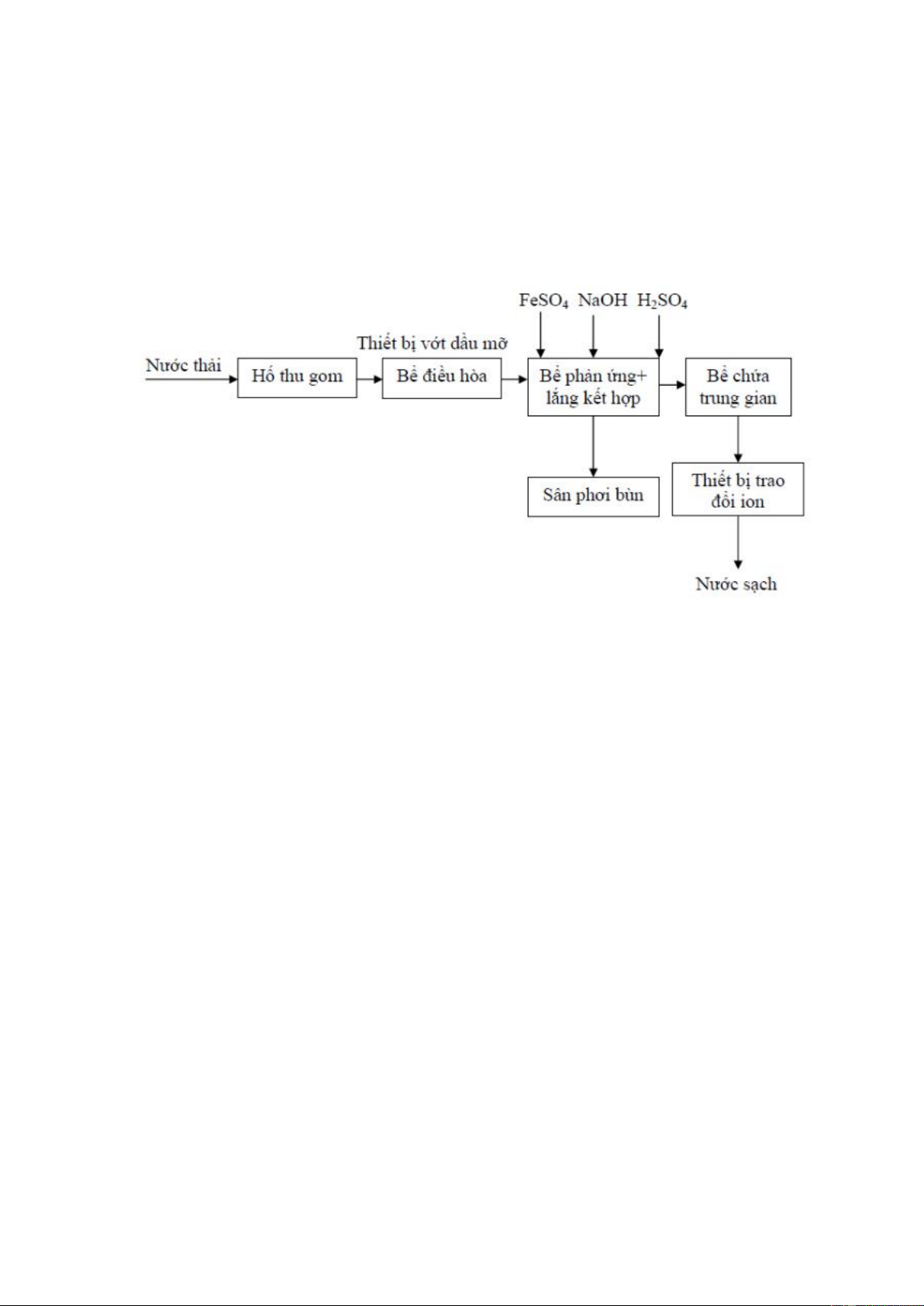
Thuyết minh sơ đồ công nghệ xử lý nước thải xi mạ
1. Nước thải: từ nhà máy xi mạ được thu gom lại tại hố thu gom. Nước thải tiếp
tục được bơm sang bể điều hoà lưu lượng, tại đây nước thải sẽ ổn định về lưu
lượng, đồng thời được loại bỏ lượng dầu mỡ do bố trí kết hợp thiết bị vớt dầu
mỡ với thời gian lưu nước là 5h. Sau đó nước thải được đưa sang bể phản ứng và lắng kết hợp.
Bùn sẽ được chuyển đến san phơi bùn, nước thải sẽ tiếp đến bể chứa trung gian,
sau đó qua thiết bị trao đổi ion 2. Hố thu gom:
a. Nhiệm vụ: Mục đích là nơi thu gom nước thải về một nơi để tiện cho việc xử lý, giúp các công
trình sau không phải thiết kế âm sâu dưới đất.
b. Hình dạng-kích thước: Hố thu gom được thiết kế hình chữ nhật, đặt âm dưới
đất, miệng hố cách mặt đất
khoảng 1m. Vật liệu xây dựng: bê tông cốt thép. Thành hố dày 10cm. Thời gian
lưu nước trong hố thu gom tối thiểu là 15-20 phút. 3. Bể điều hoà:
a. Nhiệm vụ: Nước thải thường có lưu lượng và thành phần các chất bẩn không
ổn định theo thời gian trong một ngày đêm. Sự dao động này nếu không được
điều hoà sẽảnh hưởng đến chế độcông tác của trạm xử lý nước thải, đồng thời
gây tốn kém nhiều về xây dựng cơ bản và quản lý. Do vậy, lưu lượng nước thải Trang 24 / 28
NHÓM 3 – XỬ LÝ NƯỚC THẢI XI MẠ
Downloaded by Van Le (mrl3v4n@gmail.com) lOMoARcPSD|25518217
đưa vào xử lý cần thiết phải điều hoà nhằm tạo cho dòng nước thải vào hệ thống
xử lý gần như không đổi, khắc phục những khó khăn cho chế độ công tác do lưu
lượng nước thải dao động gây ra và đồng thời nâng cao hiệu suất xử lý cho toàn bộ dây chuyền.
b. Hình dạng-kích thước: Bể điều hoà đặt sau hố thu gom, nhận nước thải bơm
trực tiếp từ hố gom, đặt nửa chìm nửa nổi trên mặt đất. Do chỉ có nhiệm vụ
chính là điều hoà lưu lượng nên không cần có thiết bị khuấy trộn nhưng có bố trí
hệ thống thổi khí để tuyển nổi dầu mỡ. Diện tích bề mặt bể khá nhỏ, do đó ta chỉ
cần vớt dầu bằng phương pháp thủ công. Vật liệu xây dựng: bê tông cốt thép.
Thành bể: 10cm Vì không có sơ đồ dùng nước của nhà máy, chúng ta chỉ tính
chọn sơ bộ bể điều hoà. Chọn thời gian lưu nước của bể điều hoà là 5 giờ.
c. Thiết bị vớt dầu mỡ: Dầu mỡ thường nhẹ hơn nước và nổi lên trên mặt nước.
Nước thải sau xử lý không có lẫn dầu mỡ mới được phép cho chảy vào các thuỷ
vực. Hơn nữa, nếu xử lý sinh học, nước thải lẫn dầu mỡ khi vào xử lý sinh học
sẽ làm bít các lỗ hổng ở vật liệu lọc, ở phin lọc sinh học và còn làm hỏng cấu
trúc bùn hoạt tính trong aeroten. Do vậy người ta cần đến thiết bị vớt dầu mỡ. Ở
đáy bể điều hòa ta bố trí hệ thống thổi khí để tuyển nổi dầu mỡ, vớt dầu bằng dụng cụ thủ công.
4. Bể phản ứng và lắng kết hợp:
a. Nhiệm vụ: Do chọn cách xử lý theo mẻ nên kết hợp hai chức năng phản ứng
và lắng vào chung một bể. Chức năng của bể là oxy hoá lượng Cr6+ thành Cr3+,
nâng pH, tạo kết tủa Cr(OH)3, cuối cùng là thực hiện quá trình lắng.
b. Mô tả: Do lưu lượng khá nhỏ Q = 30m3/ngày nên ta chọn cách xử lý theo mẻ.
Chia làm 4 mẻ, mỗi mẻ có thể tích 7.5m3, xử lý trong vòng 5 giờ. Trước tiên
châm dung dịch H2SO4 để hạ pH xuống thích hợp từ đó châm FeSO4 thực hiện
oxy hoá lượng Cr6+ thành Cr3+, khuấy trong 5-10 phút với tốc độ khoảng 8
vòng/phút, ngưng khuấy và để yên trong 5-10 phút cho phản ứng xảy ra. Sau đó
châm dung dịch NaOH để tạo kết tủa Cr(OH)3, khuấy trong 5-10 phút, tốc độ
khuấy như khi châm FeSO4, sau đó giảm tốc độ khuấy còn 20 vòng/giờ để thực
hiện lắng. Quá trình lắng xảy ra trong vòng 4 giờ. Bể được thiết kế dạng trụ tròn,
đáy nghiêng về tâm góc 600. Trong bể bố trí hệ thống cánh khuấy thực hiện quá
trình phản ứng và lắng. Đáy bể có ống xả bùn, trên thân bể thiết kế 3 van xả
nước. Bể được đỡ bằng chân đế đứng trên mặt đất. Vật liệu xây dựng: thép
không rỉ, thân bể dày 5mm. 5. Bể chứa trung gian:
a. Nhiệm vụ: Bể chứa nước trung gian đặt sau bể phản ứng, bên cạnh bể phản
ứng để thu nước sạch từ 3 van xả.
b. Mô tả- Tính toán kích thước: Bể chứa vuông, đặt âm xuống dưới đất, nủa
chìm nửa nổi, miệng bể cao hơn mặt đất khoảng 1m. Bể chứa có thời gian lưu Trang 25 / 28
NHÓM 3 – XỬ LÝ NƯỚC THẢI XI MẠ
Downloaded by Van Le (mrl3v4n@gmail.com) lOMoARcPSD|25518217
nước là 5 giờ. Thể tích bể được thiết kế lớn đủ để chứa thể tích nước sạch xả ra
từ 1 mẻ phản ứng, tức là 7.5m3. 6. Cột trao đổi ion:
a. Giới thiệu: Trao đổi ion là 1 quá trình trong đó các ion trên bề mặt của chất
rắn trao đổi ion với ion có cùng điện tích trong dung dịch khi tiếp xúc với nhau.
Các chất này gọi là các ionit (chất trao đổi ion), chúng hoàn toàn không tan
trong nước. Các chất trao đổi ion có thể là các chất vô cơ hoặc hữu cơ có nguồn
gốc tự nhiên hay tổng hợp nhân
tạo. Quá trình trao đổi ion gồm 4 giai đoạn: trao đổi ion, rửa ionit khỏi các tạp
chất, tái sinh ionit (dung dịch axit/kiềm) và rửa ionit khỏi dung dịch tái sinh. Kỹ
thuật trao đổi ion ứng dụng để xử lý nguồn nước thải chứa ion với mục đích:
phục hồi nước đã sử dụng, thu hồi các ion kim loại, tái sử dụng các thành phần quan tâm.
b. Tính toán: Hầu hết quá trình trao đổi ion xảy ra trong cột trao đổi ion. Cột trao
đổi ion đặt ngay sau bể chứa nhằm hoàn thiện quá trình xử lý nước. 7. Sân phơi bùn:
a. Nhiệm vụ: Bùn cặn của nhà máy xử lý được đưa sang thiết bị làm khô cặn nhằm mục đích:
- Giảm khối lượng vận chuyển ra bãi thải
- Cặn khô dễ đưa đi chon lấp hay cải tạo đất hơn cặn nước.
- Giảm lượng nước bẩn có thể ngấm vào nước ngầm ở bãi thải
- Ít gây mùi khó chịu và ít độc tính Có nhiều loại thiết bị làm khô cặn (sân phơi
bùn, máy lọc cặn chân không, máy lọc ép băng tải, máy ép cặn ly tâm,…).
Trong trường hợp này, ta sử dụng sân phơi bùn với tiêu chí tiết kiệm chi phí,
phù hợp với lượng bùn sinh ra trong 1 ngày không nhiều.
b. Mô tả: Sân phơi bùn chia thành từng ô, kích thước mỗi ô phụ thuộc vào cách
bố trí đường xe vận chuyển bùn ra khỏi sân phơi và độ xa khi xúc bùn từ ô phơi
lên xe. Số ô làm việc đồng thời phụ thuộc vào lưu lượng bùn xả ra hàng ngày,
độ dày bùn cần làm khô, thời gian của một chu kỳ phơi. Trang 26 / 28
NHÓM 3 – XỬ LÝ NƯỚC THẢI XI MẠ
Downloaded by Van Le (mrl3v4n@gmail.com) lOMoARcPSD|25518217
II. CÔNG TY TNHH THƯƠNG MẠI DỊCH VỤ XÂY DỰNG VÀ MÔI TRƯỜNG SẠCH(SACO) Quy trình xử lý:
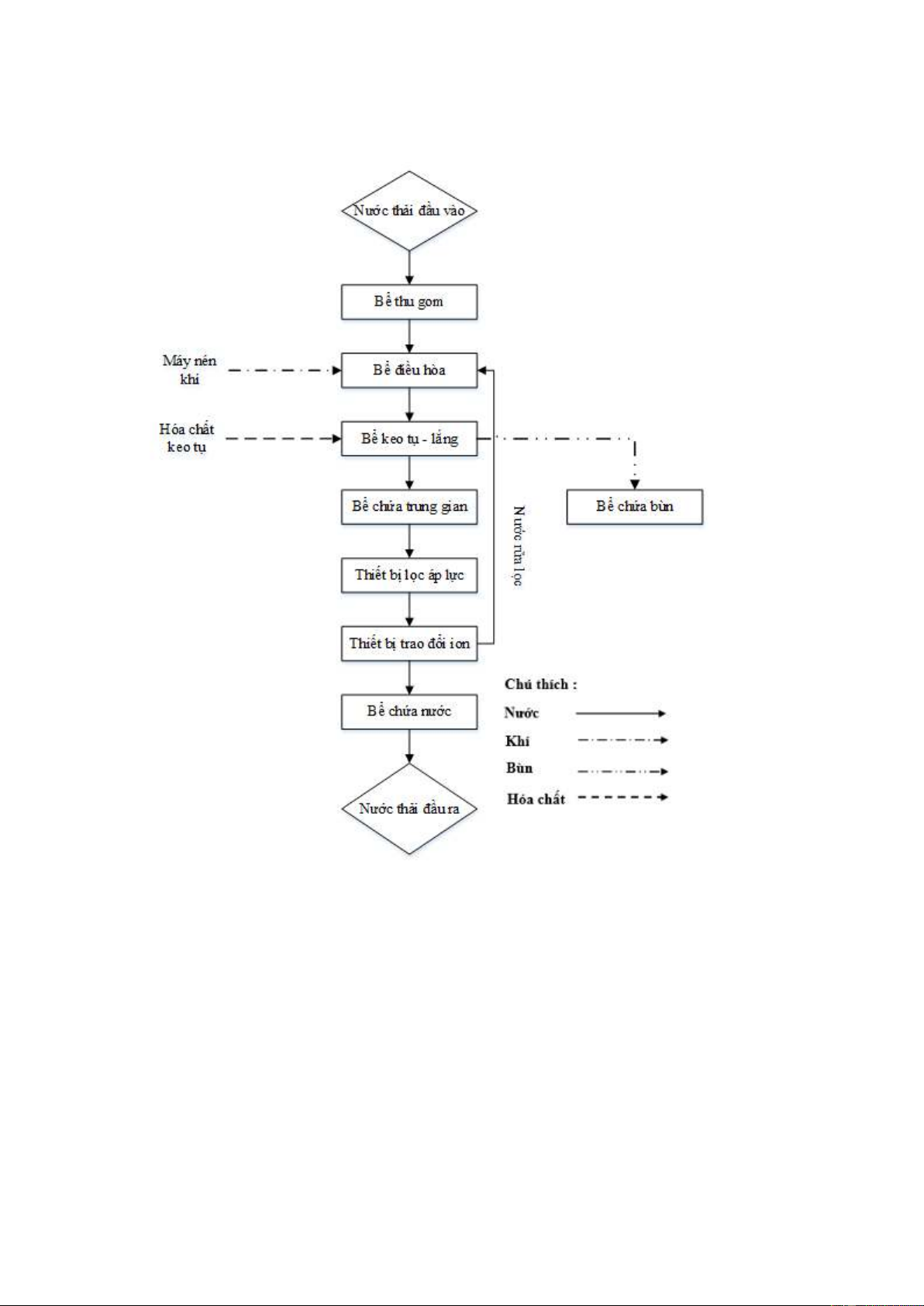
Thuyết minh quy trình xử lý nước thải xi mạ
Nước thải từ các công đoạn sản xuất của nhà máy được thu gom về bể tiếp nhận
tập trung. Tiếp đó, ta đặt song chắn rác để giữ lại các chất thải rắn, cặn có kích
thước lớn, tránh ảnh hưởng tới công trình phía sau. Tiếp tục thực hiện chu trình
xử lý nước thải được bơm sang bể điều hòa.
Tại đây bể điều hòa có tác dụng điều hòa lưu lượng và nồng độ nước thải. Trong
bể có trang bị hệ thống cánh khuấy ngầm để trộn đều nước thải, tránh hiện tượng
lắng cặn, tích tụ dưới đáy bể, điều hòa có sục khí. Từ bể điều hòa, nước thải
được bơm sang bể phản ứng. Tại đây, nước thải được đo và điều chỉnh pH cho Trang 27 / 28
NHÓM 3 – XỬ LÝ NƯỚC THẢI XI MẠ
Downloaded by Van Le (mrl3v4n@gmail.com) lOMoARcPSD|25518217
phù hợp phản ứng keo tụ, ta châm nước thải cùng acid H2SO4 và trộn đều. Trong
bể có trang bị cánh khuấy nhanh đảm bảo trộn đều nước thải.
Từ bể phản ứng nước thải tiếp tục được bơm qua bể keo tụ tạo bông. Đây là
công đoạn quan trọng, ảnh hưởng tới hiệu quả xử lý nước thải. Hóa chất phèn
nhôm được dùng cho phản ứng keo tụ, ngoài ra để tăng tính liên kết cho kết tủa
các chất xung quanh, ta còn phải thêm Ca(OH)2 vào ngăn phản ứng, sau khi xảy
ra phản ứng keo tụ, nước thải chảy tiếp sang ngăn tạo bông, tại đây, hóa chất
Polymer được thêm vào nhằm liên kết các kết tủa tạo thành.
Sau quá trình keo tụ, tạo bông, nước thải chảy qua bể lắng, tách riêng cặn với
nước. Phần cặn mới hình thành lắng xuống đáy bể và được dẫn ra bể chứa bùn,
sau đó định đi đem đi xử lý. Nước thải trên bề mặt chảy qua bể trung gian. Bể
trung gian nhằm điều hòa lưu lượng nước cho quá trình xử lý phía sau.
Từ bể trung gian, nước thải được bơm tiếp qua bể trao đổi ion. Tại đây, các ion
kim loại còn lại sẽ được xử lý, giữ lại tại bể , đảm bào chất lượng nước cho quá trình xử lý.
Sau khi qua bể trao đổi ion, nước thải chảy về bể chứa nước sau xử lý rồi mới
thải ra nguồn tiếp nhận.
Bùn từ bể lắng, bể điều hòa được hút sang bể chứa bùn. Tại đây bùn được lắng
xuống đáy và nước trong nổi lên và định kỳ có đơn vị chức năng hút bùn đi xử lý đúng quy định.
Như vậy khi dòng thải vào hệ thống xử lý nước thải xi mạ đạt tiêu chuẩn xả thải
loại B (TCVN 5945-2010) sẽ được xả vào môi trường tiếp nhận. Trang 28 / 28
NHÓM 3 – XỬ LÝ NƯỚC THẢI XI MẠ
Downloaded by Van Le (mrl3v4n@gmail.com)