















Preview text:
BÁO CÁO THÍ NGHIỆM
BÀI 1 : MỘT SỐ DỤNG CỤ VÀ THAO TÁC CƠ
BẢN TRONG PHÒNG THÍ NGHIỆM
Ngày TN:Thứ năm ngày 30 tháng 03 năm 2023
Tổ : …05… Lớp. . .Thứ 5 ( Chiều ) . . .
Họ và tên :Nguyễn Bảo Yến . . . MSSV:. .2274202070080.
Họ và tên :Phan Khánh Ngọc. . . MSSV:.2274202070037. . . . . .
Họ và tên :Phí Hồng Ánh Lam . .MSSV:.2274202070024. . . . . .
Họ và tên :Hoàng Nguyễn Khánh Trang. . .MSSV:.22742020700 I-KẾT QUẢ THÍ NGHIỆM 1.Thí nghiệm 4
-Mô tả các hiện tượng thí nghiệm :
+ Cho dung dịch NaOH 0,1M vào cốc thủy tinh sau đó dùng phễu đổ dung dịch NaOH 0,1M vào buret,
điều chỉnh đến vạch ngang 0.
+ Cho dung dịch HCl 0,1M ra cốc thủy tinh, dùng pipet lấy đúng 10ml dung dịch HCl 0,1M cho vào bình
tam giác, cho 2 giọt phenolphthalein vào bình tam giác chứa 10ml dung dịch HCl 0,1M.
+ Cho bình tam giác để dưới buret và mở khóa buret để dung dịch NaOH từ từ nhỏ vào bình tam giác
chứa HCl 0,1M, đồng thời lắc đều bình tam giác để 2 dung dịch trộn đều vào nhau cho đến khi dung dịch
trong bình tam giác chuyển sang màu hồng nhạt thì khóa buret. Ghi lại dung dịch NaOH đã tiêu tốn sử dụng ( ml ).
*Lưu Ý: Thực hiện lại thí nghiệm trên 3 lần.
-Các số liệu ghi vào bảng :
NGUYỄN BẢO YẾN Thể tích NaOH Lần 1 Lần 2 Lần 3 8.6 8.9 8.7 VNaOHtb 8,7
PHAN KHÁNH NGỌC Thể tích NaOH Lần 1 Lần 2 Lần 3 9,5 8,9 8,7 VNaOHtb 9,033
PHÍ HỒNG ÁNH LAM Thể tích NaOH Lần 1 Lần 2 Lần 3 9,3 9 8,9 VNaOHtb 9,067
HOÀNG NGUYỄN KHÁNH TRANG Thể tích NaOH Lần 1 Lần 2 Lần 3 9,1 9,3 8,9 VNaOHtb 9,1 II.CÂU HỎI
1.Xác định các nguyên nhân có thể gây sai số ở TN 4 ?
Các nguyên nhân gây sai số ở thí nghiệm trên :
-Trong quá trình chuẩn độ , “ QUÊN “ nhỏ chất chỉ thị phenolphthalein trong quá trình thực hiện .
- Các dụng cụ trong khi chuẩn độ đã bị nhiễm các chất khác .
- Do hóa chất không tinh khiết hoặc đã bị nhiễm chất khác trong quá trình chuẩn độ
- Sai các thao tác khi thực hiện ( muốn dung dịch nhanh chuyển màu nên đã mở lớn van buret làm cho
dung dịch bên trong buret chảy nhanh => Ảnh hưởng đến số liệu )
BÀI 2 . PHA DUNG DỊCH
Ngày TN : Thứ . năm. ngày…06. . tháng. .04. . .năm 2023
Tổ:. . .05. .Lớp:. . .Thứ 5 ( Chiều ). . . . . . .
Họ và tên :Nguyễn Bảo Yến . . . MSSV:. .2274202070080.
Họ và tên :Phan Khánh Ngọc. . . MSSV:.2274202070037. . . . . .
Họ và tên :Phí Hồng Ánh Lam . .MSSV:.2274202070024. . . . . .
Họ và tên :Hoàng Nguyễn Khánh Trang. . .MSSV:.22742020700 I.KẾT QUẢ THÍ NGHIỆM
1. Thí nghiệm 1 : Pha dụng dịch NaCl có nồng độ 5%
-Mô tả cân lượng cân NaCl bao nhiêu g ? Các bước pha dung dịch NaCl 5%
Bước 1 : Tính lượng cân NaCl cần lấy : m
%= Ct × 100 => m
C % ×mⅆd m => m Ct= =5( g) ⅆd 100 ct
Bước 2 : Tính lượng nước cất cần dùng:
mⅆd=mdm+mCt => mⅆm=mdd−mct =>mⅆm=100−5=95 (ml)
Bước 3 : Dùng bình định mức 100ml cho nước cất vào đến ngang vạch sau đó dùng pipet hút bớt 5ml nước cất đi.
Bước 4 : Cân 5g NaCl bằng cân kỹ thuật, cho vào becher 100ml, sau đó rót một ít nước (khoảng 1/3
becher) từ bình định mức vào, dùng đũa thủy tinh khuấy nhẹ cho đến khi NaCl tan hết.
Bước 5 :Dùng phễu rót dung dịch trong becher vào bình định mức, tiếp theo đậy nắp kỹ ,sau đó lắc đều
tay thu được dung dịch NaCl 5%.
2. Thí nghiệm 2 : Pha 100ml dng dịch NaOH có nồng độ 1M
-Mô tả cân lượng cân NaOH bao nhiêu g?Các bước pha dung dịch NaOH 1M:
Bước 1 : Tính lượng cân tinh thể NaOH cần lấy: n mct
CM= v= M ⋅v ⇒mct=CM⋅M ⋅v ⇒mct=4(g)
Bước 2 : Cân 4 gam tinh thể NaOH trên cân phân tích, sau đó thêm 100 ml vào becher, thêm nước cất đến
khoảng 1/3 becher , khuấy nhẹ bằng đũa thủy tinh cho đến khi các tinh thể hòa tan đều .
Bước 3: Cho dung dịch trong becher vào bình định mức 100ml , dùng bình tia nước cất tia xung quang
thành becher ; cho nước vừa tia trong becher rót vào bình định mức , cuối cùng là thêm nước cất vào bình
định mức đến ngang vạch.
Bước 4 : Đậy nắp bình định mức và lắc đều tay ,kết quả ta thu được dung dịch NaOH 1M.
3. Thí nghiệm 3: Pha 100ml dung dịch NaCl có nồng độ 0,1M từ dung dịch NaOH 1M pha ở TN 2
-Mô tả cách pha 100ml dung dịch NaOH 0,1 M từ dung dịch NaOH 1M:
Bước 1: Tính số ml dung dịch NaOH 1M cần lấy để pha loãng: V
V ∗C =V ∗C 2 ⋅ C2 đđ ⇒V = ⇒ V =10 (ml ). 1 1 2 2 1 NaOH C1
Bước 2: Dùng pipet lấy 10ml dung dịch NaOH 1M cho vào bình định mức 100ml.
Bước 3: Dùng bình tia cho nước cất vào cho đến ngang vạch, đậy nắp lại rồi lắc đều sẽ thu được dung dịch NaOH 0,1M.
4. Thí nghiệm 4 : Xác định lại nồng độ NaOH ở TN 2 và TN 3
* Mô tả cách xác định lại nồng độ ở TN 2
Bước 1: Dùng pipet lấy 5ml dung dịch NaOH 1M, cho vào bình erlen sau đó cho thêm 2 giọt chỉ thị
phenolphthalein và lắc nhẹ bình erlen.
Bước 2: Tráng buret bằng dung dịch chuẩn HCl 1M, sau đó cho dung dịch HCl vào buret đến ngang vạch 0.
Bước 3: Để bình erlen dưới vòi buret và mở khóa vòi buret cho từ từ dung dịch chuẩn HCl vào erlen
đồng thời tay lắc đều bình erlen để trộn đều dung dịch.
Bước 4: Quan sát dung dịch, khi thấy dung dịch từ màu hồng chuyển sang không màu thì lập tức khóa vòi của buret lại.
Bước 5: Đọc thể tích dung dung HCl đã tiêu tốn và tính toán.
*KẾT QUẢ THÍ NGHIỆM CỦA CÁC THÀNH VIÊN : 1.NGUYỄN BẢO YẾN
* Mô tả cách xác định lại nồng độ NaOH ở TN 3:
Bước 1: Dùng pipet lấy 5ml dung dịch NaOH 0,1M, cho vào bình erlen sau đó cho thêm 2 giọt chỉ thị
phenolphthalein và lắc nhẹ bình erlen để dung dịch hòa vào nhau ;
Bước 2: Tráng buret bằng dung dịch chuẩn HCl 1M, sau đó cho dung dịch HCl vào buret đến ngang vạch 0;
Bước 3: Để bình erlen dưới vòi buret và mở khóa vòi buret cho từ từ dung dịch chuẩn HCl vào erlen
đồng thời tay lắc đều bình erlen để trộn đều dung dịch;
Bước 4: Quan sát dung dịch, khi thấy dung dịch từ màu hồng chuyển sang không màu thì lập tức khóa vòi của buret lại;
Bước 5: Đọc thể tích dung dung HCl đã tiêu tốn và tính toán.
-Các số liệu ghi vào bảng Thể tích HCl tiêu tốn Lần 1 Lần 2 Lần 3 5,2 5,1 5,3 V 5,2 HCtb N HCl∗V HCl
- Tính nồng độ NaOH: V =
NaOH∗N NaOH=V HCl∗N HCl ⇒ N NaOH V tbNaOH ⇒ N NaOH=¿ 2.PHÍ HỒNG ÁNH LAM Thể tích HCl tiêu tốn Lần 1 Lần 2 Lần 3 VHCtb N HCl∗V HCl
- Tính nồng độ NaOH: V =
NaOH∗N NaOH=V HCl∗N HCl ⇒ N NaOH V tbNaOH ⇒ N NaOH=¿
* Mô tả cách xác định lại nồng độ NaOH ở TN 3:
Bước 1: Dùng pipet lấy 5ml dung dịch NaOH 0,1M, cho vào bình erlen sau đó cho thêm 2 giọt chỉ thị
phenolphthalein và lắc nhẹ bình erlen.
Bước 2: Tráng buret bằng dung dịch chuẩn HCl 1M, sau đó cho dung dịch HCl vào buret đến ngang vạch 0.
Bước 3: Để bình erlen dưới vòi buret và mở khóa vòi buret cho từ từ dung dịch chuẩn HCl vào erlen
đồng thời tay lắc đều bình erlen để trộn đều dung dịch.
Bước 4: Quan sát dung dịch, khi thấy dung dịch từ màu hồng chuyển sang không màu thì lập tức khóa vòi của buret lại.
Bước 5: Đọc thể tích dung dung HCl đã tiêu tốn và tính toán.
- Các số liệu ghi vào bảng: Thể tích HCl tiêu tốn Lần 1 Lần 2 Lần 3 0,6 0,6 0,6 VHCltb N HCl∗V HCl
- Tính nồng độ NaOH: V =
NaOH∗N NaOH =V HCl∗N HCl ⇒ N NaOH V tbNaOH ⇒ N NaOH=¿ 3.PHAN KHÁNH NGỌC
* Mô tả cách xác định lại nồng độ NaOH ở TN 3:
Bước 1: Dùng pipet lấy 5ml dung dịch NaOH 0,1M, cho vào bình erlen sau đó cho thêm 2 giọt chỉ thị
phenolphthalein và lắc nhẹ bình erlen.
Bước 2: Tráng buret bằng dung dịch chuẩn HCl 1M, sau đó cho dung dịch HCl vào buret đến ngang vạch 0.
Bước 3: Để bình erlen dưới vòi buret và mở khóa vòi buret cho từ từ dung dịch chuẩn HCl vào erlen
đồng thời tay lắc đều bình erlen để trộn đều dung dịch.
Bước 4: Quan sát dung dịch, khi thấy dung dịch từ màu hồng chuyển sang không màu thì lập tức khóa vòi của buret lại.
Bước 5: Đọc thể tích dung dung HCl đã tiêu tốn và tính toán
-Các số liệu ghi vào bảng: Thể tích HCl tiêu tốn Lần 1 Lần 2 Lần 3 5,2 5 5,3 VHCtb N HCl∗V HCl
- Tính nồng độ NaOH: V =
NaOH∗N NaOH=V HCl∗N HCl ⇒ N NaOH V tbNaOH ⇒ N NaOH=¿
4.HOÀNG NGUYỄN KHÁNH TRANG
-Các số liệu ghi vào bảng Thể tích HCl tiêu tốn Lần 1 Lần 2 Lần 3 VHCltb II.CÂU HỎI
1. Xác định các nguyên nhân có thể gây sai số ở các TN trên
*Một số nguyên nhân có thể gây sai số ở các thí nghiệm trên:
-Trong quá trình chuẩn độ , không nhỏ chất chỉ thị trong quá trình thực hiện .
- Các dụng cụ trong khi chuẩn độ đã bị nhiễm các chất khác .
- Do hóa chất không tinh khiết hoặc đã bị nhiễm chất khác trong quá trình chuẩn độ
- Sai các thao tác khi thực hiện ( muốn dung dịch nhanh chuyển màu nên đã mở lớn van buret làm cho
dung dịch bên trong buret chảy nhanh => Ảnh hưởng đến số liệu )
- Do sử dụng chất chỉ thị có khoảng pH chuyển màu khác với pH ở điểm tương đương của phản ứng
hóa học dùng để chuẩn độ.
2. Khi thực hiện cân trên cân phân tích , cần chú ý những điều gì ?
*Khi thực hiện các thí nghiệm trên cần chú ý:
- Xác định cụ thể thể tich hóa chất cần lây để tránh sai số và phung phí ảnh hưởng đến các nhóm khác
- Xác định và sử dụng đúng chất chỉ thị phù hợp
- Luôn chú ý và quan sát trong quá trình chuẩn độ , để kịp thời dừng quá trình chuẩn độ
-Cẩn thận trong quá trình lây hóa chất để không bị nhiễm các chất khác
BÀI 4. TỐC ĐỘ PHẢN ỨNG
Ngày TN : Thứ . . . . . ngày . . . . .tháng. . . . . . năm 2023
Tổ: 5. . . . . . . . . . . . . . Lớp: Thứ 5 Buổi Chiều. . . . . . . . . . . . . . . . . . .
Họ và tên : Nguyễn Bảo Yến. . . . . . . . . . . . . . . . MSSV: 2274202070056. . . . . . . . .
Họ và tên :Phan Khánh Ngọc. . . . . . . . . . . . . . . . MSSV:2274202070037. . . . . . . . .
Họ và tên :Phí Hồng Ánh Lam. . . . . . . . . . . . . . . . MSSV:2274202070024. . . . . . . . .
Họ và tên :Hoàng Nguyễn Khánh Trang . . . . . . . . . . .MSSV:22742020700. . . . . . . . . I.
KẾT QUẢ THÍ NGHIỆM
1. Thí nghiệm 1: Ảnh hưởng của nồng độ đến tốc độ phản ứng Số TT Nồng độ dd Nồng độ
Thời gian phản ứng
Tốc độ phản ứng ống Na2 S2 O3 dd ( giây ) nghiệm H2O Ống 1 T1 T1 T1 T1tb V1 V1 V1 V1tb (lặp lại 0,2 ml 0,8 ml 35, 87 32, 34 33,26 32,816 0,027 0,030 0,030 0,029 3 lần) Ống 2 T2 T2 T2 T2tb V2 V2 V2 V2tb (lặp lại 0,4 ml 0,6 ml 16, 94 17,96 16,93 17,276 0,059 0,055 0,059 0,034 3 lần ) Ống 3 T3 T3 T3 T3tb V3 V3 V3 V3tb (lặp lại 0,6 ml 0,4 ml 10,65 11,01 11,20 10,953 0,093 0,090 0,089 0,090 3 lần ) Ống 4 Y4 Y4 Y4 Y4tb V4 V4 V4 V4tb (lặp lại 0.8 ml 0,2 ml 9,08 10,85 8,90 9,611 0,110 0,092 0,112 0,104 3 lần )
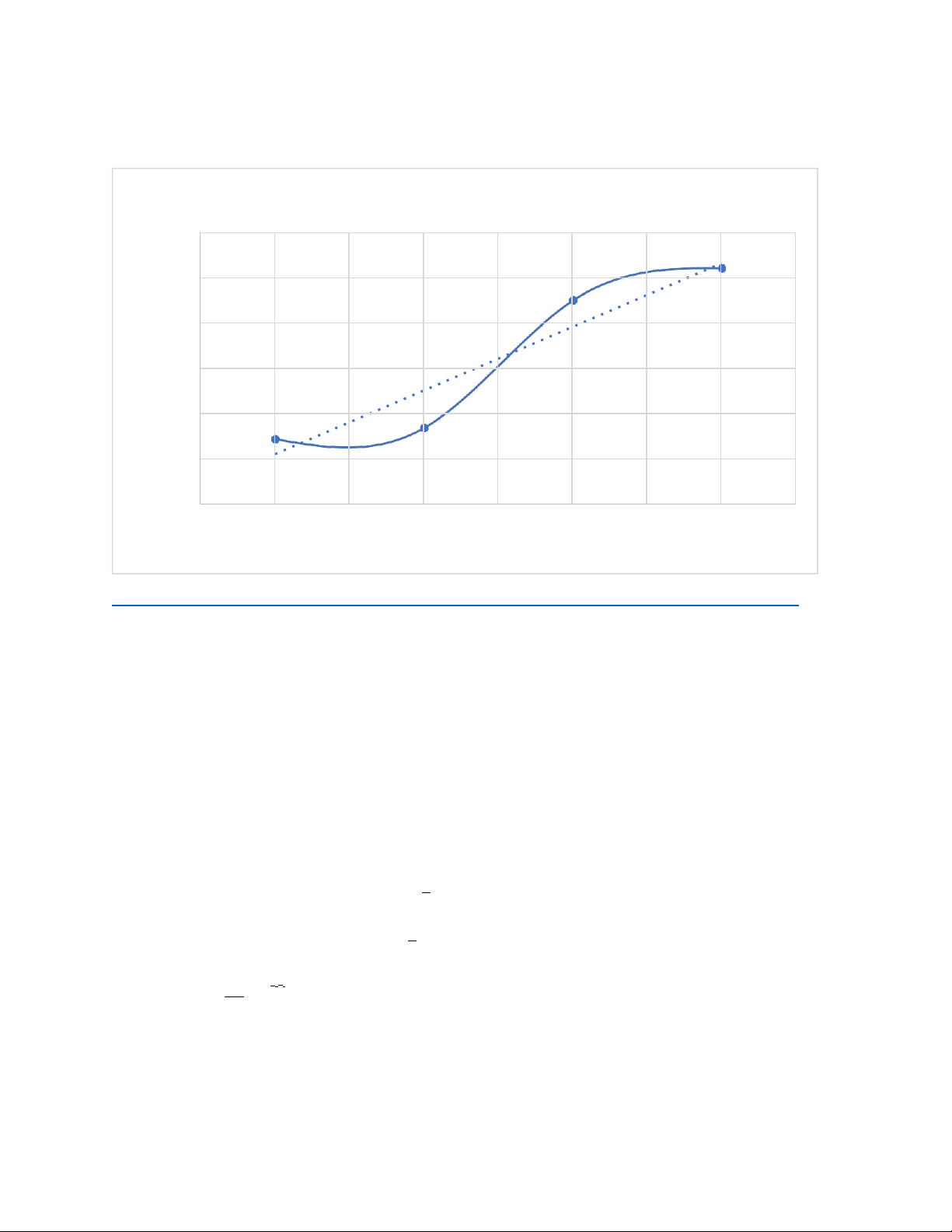
- Vẽ đồ thị biểu diễn thiên tốc độ phản ứng theo nồng độ Na2S2O3 :
Đồ thị biểu diễn tốc độ phản ứng theo nồng độ Na2S2O3 0.12 0.1
f(x) = 0.1405 x − 0.00599999999999999 R² = 0.897131170823155 0.08 0.06 V 0.04 0.02 00.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 C(mg/l)
Đồ thị biểu diễn tốc độ phản ứng theo nồng độ Na2S2O3 ( tổ 4 , chiều thứ 5).xlsx
*Từ kết quả nhận xét tốc độ phản ứng và nồng độ các chất tham gia phản ứng :
=> Tốc độ phản ứng phụ thuộc vào nồng độ phản ứng , khi ở nồng độ thấp thì tốc độ
phản ứng chậm hơn. Khi ở nồng độ cao , tốc độ phản ứng xảy ra nhanh .
2. Thí nghiệm 2: Ảnh hưởng của nhiệt độ đến tốc độ phản ứng
1. Thí nghiệm 2: Ảnh hưởng của nhiệt độ đến tốc độ phản ứng
Kết quả thí nghiệm của sinh viên: 1) Lý Tú Quyên
T = 30℃, t = 1’50s => V 1 = = 0,009 1 1 1 t1
T = 40℃, t = 53s => V 1 = = 0,019 2 2 2 t2 v t2−t1
t2 =γ 10 => γ=¿2,21 vt1 2) Hứa Vũ Thảo My
T = 30℃, t = 2’ => V 1 = = 0,008 1 1 1 t1
T = 40℃, t = 55’ => V 1 = = 0,018 2 2 2 t2 v t2−t1
t2 =γ 10 => γ=2,25 vt1 3) Huỳnh Thanh Sáng
T = 30℃, t = 1:54 => V 1 = = 0,008 1 1 1 t1
T = 40℃, t = 58 => V 1 = = 0,017 2 2 2 t2 v t2−t1
t2 =γ 10 => γ=2,125 vt1
Kết luận: Qua các thí nghiệm trên ta thấy, nhiệt độ có ảnh hưởng rất lớn đối với tốc độ phản ứng.
Trong đại đa số trường hợp tốc độ phản ứng tăng lên khi tăng nhiệt độ của phản ứng. Để nói lên ảnh
hưởng to lớn này của nhiệt độ, dựa trên kinh nghiệm thực tế, năm 1884 Van't Hoff đưa ra quy tắc gần đúng như sau:
Khi tăng nhiệt độ lên 10° thì tốc độ của phản ứng tăng lên khoảng 2-4 lần.
3. Thí nghiệm 3: Ảnh hưởng của xúc tác
3.1 Thí nghiệm 1:
Bước 1 :Chuẩn bị 2 ống nghiệm ( đánh số 1 , 2) ; cho lần lượt 500 micropipet dung dịch
H2O2 10% vào mỗi ống nghiệm ;
Bước 2 : Để 2 ống thí nghiệm vào giá đỡ ống nghiệm;
Bước 3 : Dùng 200 micropopet K2CrO4 0,1M đã chuẩn bị vào ống nghiệm số 2 ; nhỏ
từng giọt và quan sát hiện tượng ;
Bước : Thu được hiện tượng sau :
-Giọt 1 : Chuyển sang màu đồng nhạt
- Giọt 2 : Chuyển sang màu đồng nhạt đậm
- Giọt 3 : Chuyển sang màu đồng đậm hơi nâu
- Giọt 4 : chuyển sang màu nâu đen , có khí thoát ra
- Giọt 5 : Xuất hiện nhiều bọt khí
- Giọt 6 : Các bọt khí xuất hiện nhiều hơn
- Giọt 7 : Vẫn còn bọt khí và màu nhạt dần
- Giọt 8 : Vẫn còn bọt khí , màu dần trong hơn
- Giọt 9 : Sủi bọt ít lại , màu sắc không thay đổi
- Giọt 10 : Bọt khí dần dần ít lại , màu nhạt hơn vào trong hơn
- Giọt 11 : bọt khí ít , màu trong hơn và dần chuyển sang màu vàng
- Giọt 12 : Không có sự thay đổi
- Giọt 13 : Bọt khí ít đi , màu vàng và trong hơn
- Giọt 14: Không thay đổi
- Giọt 15 : rất ít khí thoát ra , chuyển hẳn sang màu vàng trong ( vàng của bia )
- Giọt 16 , 17 , 18, 19: không thay đổi
- Giọt 20 : khí thoát rất rất ít , màu sắt không thay đổi
- Giọt 21 : hết sủi bọt , hết khí , dung dịch chuyển hẳn sang màu vàng
=> KẾT THÚC THÍ NGHIỆM
*Hình Ảnh Thu Được Sau Thí Nghiệm : a. Thí nghiệm 2:
Kết quả của sinh viên:
1. Huỳnh Thanh Sáng: sủi bọt nhiều, đổi màu xám đen
2. Hứa Vũ Thảo My: sủi bọt nhiều, đổi màu xám đen
3. Lý Tú Quyên: sủi bọt nhiều, đổi màu xám đen Giải thích:
Khi cho H2O2 nguyên chất vào ống nghiệm, ta xét phản ứng phân huỷ: H2O2 + 2H2O2 = 2H2O + O2T
Khi cho MnO2 vào trong ống nghiệm chứa H2O2 nguyên chất, ta nhận thấy ống nghiệm nóng
lên chứng tỏ phản ứng tỏa rất nhiều nhiệt, khí sủi bọt thoát ra mạnh mẽ, khí đó chính là khí O2.
Kết quả thí nghiệm cho thấy MnO2 là xúc tác dương vì nó thúc đẩy quá trình phản ứng diễn ra nhanh hơn, mãnh liệt hơn.
BÀI 5. CÂN BẰNG HÓA HỌC
Ngày TN : Thứ 5. . . . . ngày 20. . . . .tháng 4. . . . . . năm 2023
Tổ: 2. . . . . . . . . . . . . . . . . . . . . . . . . . . . . .Lớp: Thứ 5 Buổi Chiều. . . . . . . . . .
Họ và tên : Huỳnh Thanh Sáng. . . . . . . . . MSSV: 2274202070056. . . . . . . . .
Họ và tên : Hứa Vũ Thảo My. . . . . . . . . . .MSSV: 2274202070031. . . . . . . . .
Họ và tên : Lý Tú Quyên. . . . . . . . . . . . . . MSSV: 2274202070053. . . . . . . . . I.KẾT QUẢ THÍ NGHIỆM
3.1. Ảnh hưởng của nồng độ đến cân bằng hóa học a. Thí nghiệm 1.
Ta có phương trình: FⅇCl3+ KSCN ⇌ K n[ Fe ( SCN )3n ]+KCN Vàng Không màu Đỏ máu Không màu
Khi cho KSCN vào ống nghiệm nó sẽ tác dụng với FeCl3 tạo ra phức chất Kn[Fe(SCN)3n] có màu đỏ máu
do đó trong cả bốn ống nghiệm đều xuất hiện màu đỏ máu.
Khi cho thêm 1 giọt FeCl3 vào trong ống nghiệm 2 và 1 giọt KSCN vào trong ống nghiệm 3, sẽ làm tăng
nồng độ của các tác chất, do đó theo nguyên lí chuyển dịch cân bằng Le Chatelier thì cân sẽ chuyển dịch
theo chiều chống lại sự thay đổi đó, nghĩa là sẽ chuyển dịch theo chiều thuận. Do đó ta thấy màu đỏ máu
của cả 2 ống nghiệm 2 và 3 đều trở nên đậm hơn do sự tăng phức chất Kn[Fe(SCN)3n].
Khi cho thêm vài hạt tinh thể KCl vào trong ống nghiệm 4, sẽ làm tăng nồng độ của các chất sản phẩm,
do đó theo nguyên lí chuyển dịch cân bằng Le Chatelier thì cân sẽ chuyển dịch theo chiều nghịch, nghĩa
là phức chất Kn[Fe(SCN)3n] giảm và tăng FeCl3, do đó ta thấy màu đỏ của ống nghiệm nhạt đi cũng như
ống nghiệm có màu hơi vàng của FeCl3.
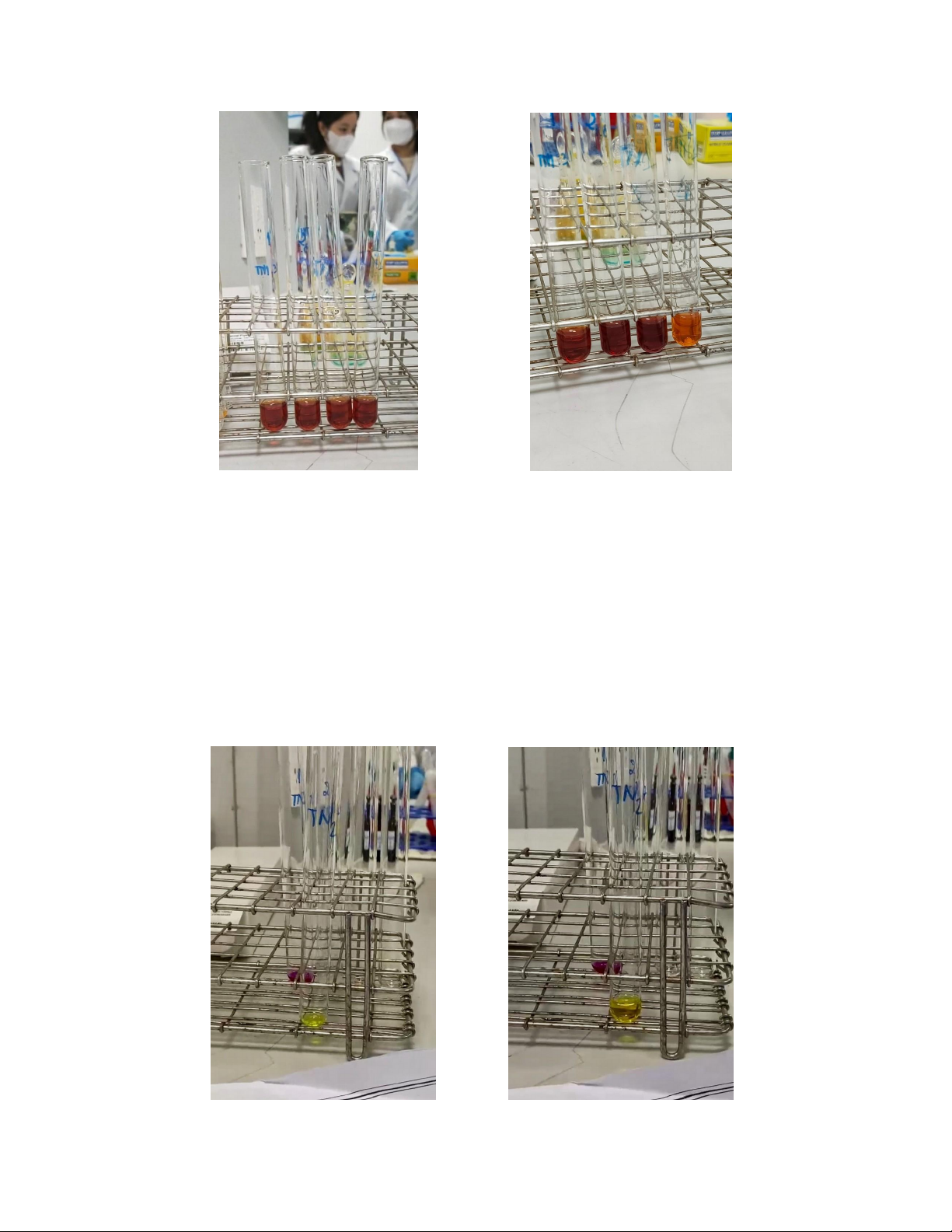
⇨ Ống 1: Không thay đổi, ống 2,3: màu đỏ đậm hơn, ống 4: màu nhạt đi. 4 ống nghiệm giống nhau
4 ống nghiệm có sự khác nhau b. Thí nghiệm 2:
2K2CrO4 + H2SO4 ⇌K2Cr2O7 + K2SO4 + H2O
Hay phương tình ion: 2CrO42- + 2H+ ⇌Cr₂O7²- + H₂O
Do H+ tác dụng với CrO4- màu từ vàng chuyển sang da cam do nồng độ H+ tăng, cân bằng xảy ra theo
chiều giảm nồng độ màu từ vàng chuyển sang cam (Cr2O7-) theo nguyên lí Le Chtelier. do đó màu của
dung dịch chuyển từ màu vàng của Cr₂O4²- sang màu da cam của Cr₂O7²-.
Dung dịch có màu vàng Cr₂O4²-
Dung dịch chuyển sang màu của Cr₂O7²-
Khi cho dung dịch NaOH đồng nghĩa với thêm OH- vào Cr2O 2-7 thì nồng độ OH- tăng vì vậy cân bằng
dịch chuyển sang phải tạo CrO 2- 4 có màu vàng chanh.
K2CrO7 + 2NaOH → H2O + Na2CrO4 + K2CrO4 Dung dịch vàng cam
Dung dịch vàng Dung dịch vàng
Dung dịch màu cam của Cr₂O7²-
Dung dịch chuyển sang màu vàng Cr₂O4²
3.2. Ảnh hưởng của nhiệt độ đến cân bằng hóa học.
Đầu tiên khi cho dung dịch HNO3 đậm đặc cùng với 1 mảnh kim loại Cu vào trong bình erlen thì trong
bình sẽ xuất hiện dung dịch Cu(NO3)2 có màu xanh lam và xuất hiện khí NO2 có màu nâu đỏ.
Cu+4 H NO3→Cu (NO3)2+2 N O2↑+2 H2O
Hai bình có màu giống nhau
Sau khi giữ bình 1 và nhúng bình 2 vào khay đá và muối ăn thì sau 5 phút ta thấy màu nâu đỏ của bình
nhạt đi cho đến khi mất màu nghĩa là lượng khí NO2 đã mất vì nó đã được chuyển thành khí N2O4. Do khi
ngâm vào đá, cân bằng sẽ chuyển dịch theo chiều thuận. Điều này chứng tỏ nguyên lý Le Chatelier vì cân
bằng chuyển dịch theo hướng tiêu thụ năng lượng. 2NO2 (khí) ⇌ N2O4 (khí) Ngâm nước đá
Bình ngâm nước đá bị mất màu
Khi đưa bình số 2 vào cốc có nhiệt độ 60℃, cân bằng chuyển dịch theo chiều nghịch thì lượng khí N2O4
(không màu) có trong bình sẽ được chuyển thành NO2 (màu nâu) nên hỗn hợp trong bình sẽ phục hồi lại màu nâu. Ngâm vào nước nóng
Màu nâu dần được phục hồi
3.3. Cân bằng trong dung dịch chất điện li yếu a. Thí nghiệm 1:
Ta có phương trình: C H3 COOH H+¿+C H3COO−¿¿¿
Giải thích: vì metyl da cam là chất chỉ thị màu, mà CH3COOH là chất axit yếu nên khi cho chất chỉ thị
vào thì dung dịch có màu vàng cam đậm.
Hai ống nghiệm có màu của metyl da cam
Khi cho thêm CH3COONa vào bên trong dung dịch nó sẽ phân li thành CH3COO- và Na+ làm cho nồng độ CH3COO- tăng lên.
C H COONa Na+¿+CH3COO−¿¿¿ 3
Khi nồng độ CH3COO- tăng lên thì cân bằng sẽ chuyển dịch theo chiều nghịch làm cho màu của dung dịch nhạt hơn.
C H COOH H+¿+C H3CO O−¿¿¿ 3
Ống nghiệm 2 bị nhạt màu đi b. Thí nghiệm 2:
Do Phenolphthalein là chất chỉ thị màu nên khi gặp môi trường base nó sẽ chuyển màu sang hồng.
Ta có phương trình: NH3 + H2O ⇆ NH4+ + OH−
Khi cho thêm vài hạt tinh thể NH4Cl vào trong dung dịch nó sẽ phân li thành NH4+ và Cl- làm cho cân
bằng chuyển dịch theo chiều âm tức là nồng độ OH- bị giảm đi và mất đi pH của base vì vậy nó sẽ khiến
dung dịch chuyển từ màu hồng sang mất màu.
N H Cl N H +¿+Cl−¿¿¿ 4 4
Hai ống nghiệm có màu của chỉ thị phenolphthalein
Ống nghiệm 2 mất màu hồng




