














Preview text:
ĐẠI HỌC Y DƯỢC THÀNH PHỐ HỒ CHÍ MINH
KHOA ĐIỀU DƯỠNG – KỸ THUẬT Y HỌC LỚP XÉT NGHIỆM 22 NHÓM 4.3 BÁO CÁO THỰC HÀNH HÓA SINH NHÓM 4.3
SINH VIÊN THỰC HIẸN TÊN MSSV LÊ THỊ MỸ TRÂM 611228654 NGUYỄN NGỌC BẢO TRÂN 611228656 TRẦN NGỌC BẢO TRÂN 611228657 LÊ LIỄU HỒNG TRANG 611228658 LÊ THỊ THÙY TRANG 611228659 LẠI TRẦN THANH TRÚC 611228660 LÊ PHẠM THANH TRÚC 611228661 LÊ THỊ MINH TRÚC 611228662 MỤC LỤC
HÓA HỌC GLUCID. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1
THÍ NGHIẸM 1: PHẢN ỨNG FEHLING. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1
THÍ NGHIẸM 2: PHẢN ỨNG MÀU CỦA POLYSACCHARIDE. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4
XÉT NGHIẸM GLUCOSE. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .7
HÓA HỌC LIPID. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 9
THÍ NGHIẸM 1: PHẢN ỨNG TAN CỦA LIPID. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .9
THÍ NGHIẸM 2: PHẢN ỨNG NHŨ TƯƠNG HÓA LIPID. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .9
ĐỊNH LƯỢNG CHOLESTEROL TOÀN PHẦN. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .12
HÓA HỌC PROTID. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .14
THÍ NGHIẸM 1: PHẢN ỨNG NINHYDRIN. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .14
THÍ NGHIẸM 2: PHẢN ỨNG BIURET. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 15
THÍ NGHIẸM 3: PHẢN ỨNG TỦA PROTEIN BỞI NHIẸT VỚI MÔI TRƯỜNG ACID NHẸ. . . . . . . . . . . . . . . . . . . 17
THÍ NGHIẸM 4: PHẢN ỨNG TỦA PROTEIN BỞI ACID MẠNH VÀ KHÔNG ĐUN NÓNG. . . . . . . . . . . . . . . . . . . 19
XÉT NGHIẸM PROTEIN TOÀN PHẦN. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .21
ENZYM – XÉT NGHIẸM ALT VÀ AST. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 23
XÉT NGHIẸM NƯỚC TIỂU. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 25 Nhóm 4.3
BÁO CÁO THỰC HÀNH HÓA SINH HÓA HỌC GLUCID
THÍ NGHIẸM 1: PHẢN ỨNG FEHLING • Mục đích
Được ứng dụng trong sinh hóa lâm sàng để kiểm tra nhanh lượng đường có trong nước tiểu
của bệnh nhân tiểu đường. • Nguyên tắc
Các monosaccharide (MS) đều chứa nhóm chức khử ( aldehyd hoặc ceton ) , chúng có khả
năng khử các ion kim lọai nặng (Cu 2+, Ag+, Hg2+ ) trong môi trường kiềm mạnh , đun nóng
để giải phóng kim lọai hoặc oxyd kim loại có hóa trị thấp hơn và các MS sẽ bị oxy hóa thành
acid.• Mẫuthử/Thuốcthử Thuốc thử: Fehling Mẫu thử: Monosaccharide
• Kỹ thuật / Cách tiến hành
Cho vào 5 ống nghiệm các dung dịch sau:
- Ống nghiệm 1: 1ml dd Glucose 1% + 1ml dd thuốc thử Fehling
- Ống nghiệm 2: 1ml dd Maltose 1% + 1ml dd thuốc thử Fehling
- Ống nghiệm 3: 1ml dd Lactose 1% + 1ml dd thuốc thử Fehling
- Ống nghiệm 4: 1ml dd Hồ tinh bột 1% + 1ml dd thuốc thử Fehling
- Ống nghiệm 5: 1ml dd Saccarose 1% + 1ml dd thuốc thử Fehling
Lắc đều các ống nghiệm. Đem đun sôi trong 3 phút. Quan sát • Nhận xét
Ống nghiệm 1: dd glucose 1% 1ml + dd thuốc thử Fehling 1ml
—> Sau khi đun thấy xuất hiện kết tủa đỏ gạch lắng xuống ống nghiệm
Ống nghiệm 2: dd Maltose 1% 1ml + dd thuốc thử Fehling 1ml
—> Sau khi đun thấy kết tủa đỏ gạch lắng xuống đáy ống nghiệm 1
Ống nghiệm 3: dd Lactose 1% 1ml + dd thuốc thử Fehling 1ml
—> Sau khi đun thấy kết tủa đỏ gạch lắng xuống đáy ống nghiệm, nhưng kết tủa chậm hơn ống 1, 2
Ống nghiệm 4: dd Hồ tinh bột 1% 1ml + dd thuốc thử Fehling 1ml
—> Sau khi đun không thấy hiện tượng thay đổi
Ống nghiệm 5: dd Saccarose 1% 1ml + dd thuốc thử Fehling 1ml
—> Sau khi đun không thấy hiện tượng thay đổi
• Giải thích hiện tượng
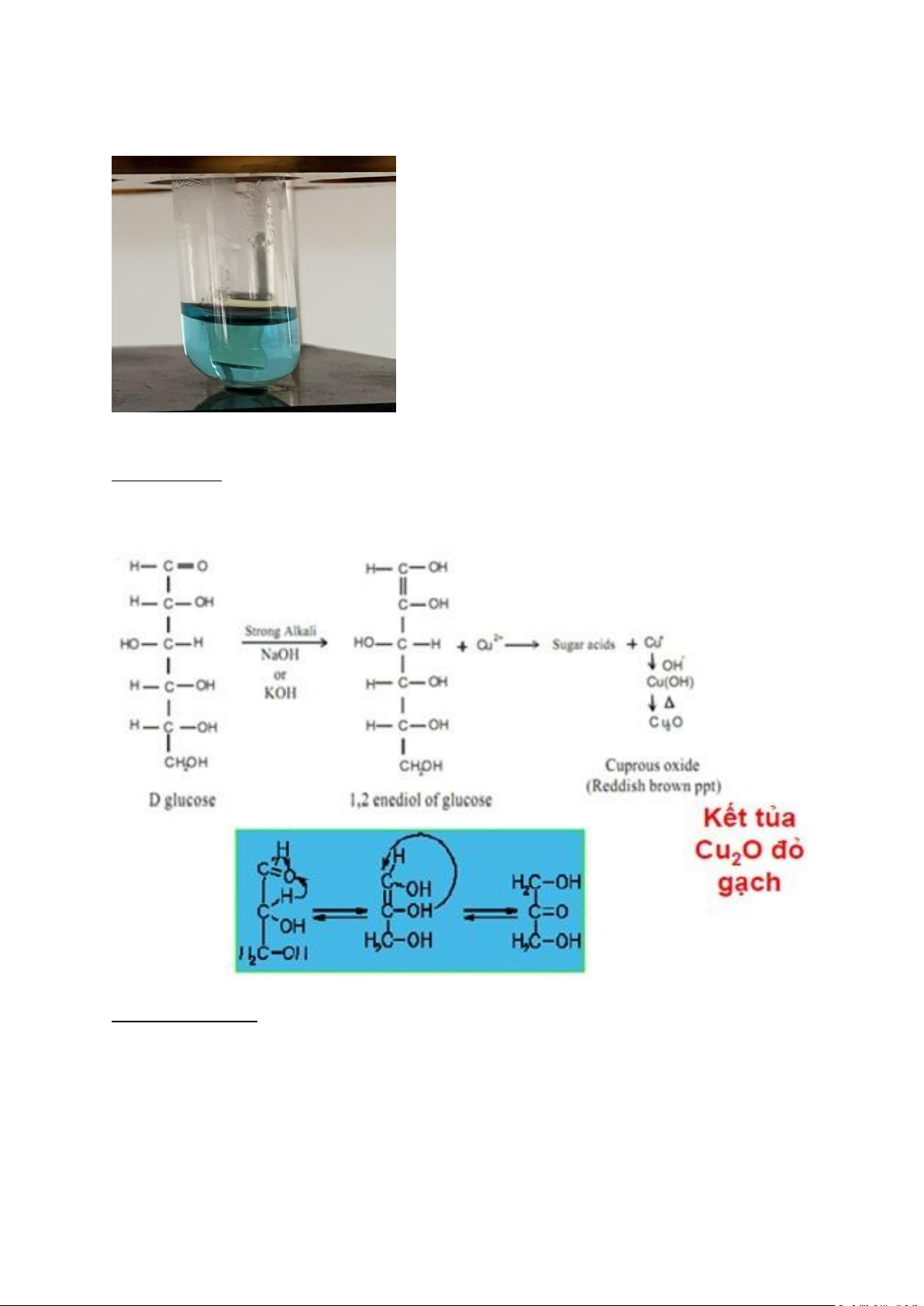
Ống nghiệm 1: Vì Glucose là 1 bán - acetan vòng nội của 1 aldehyd - ancol và trong môi
trường kiềm nóng của thuốc thử Fehling nên Glucose sẽ khử Cu2+ thành Cu+. Sau đó, Cu+
được tạo ra từ quá trình trên sẽ kết hợp với nhóm OH- tạo thành kết tủa Cu2O màu đỏ gạch,
glucose bị oxy hóa thành acid đường (acid gluconic hoặc acid glucuronic).
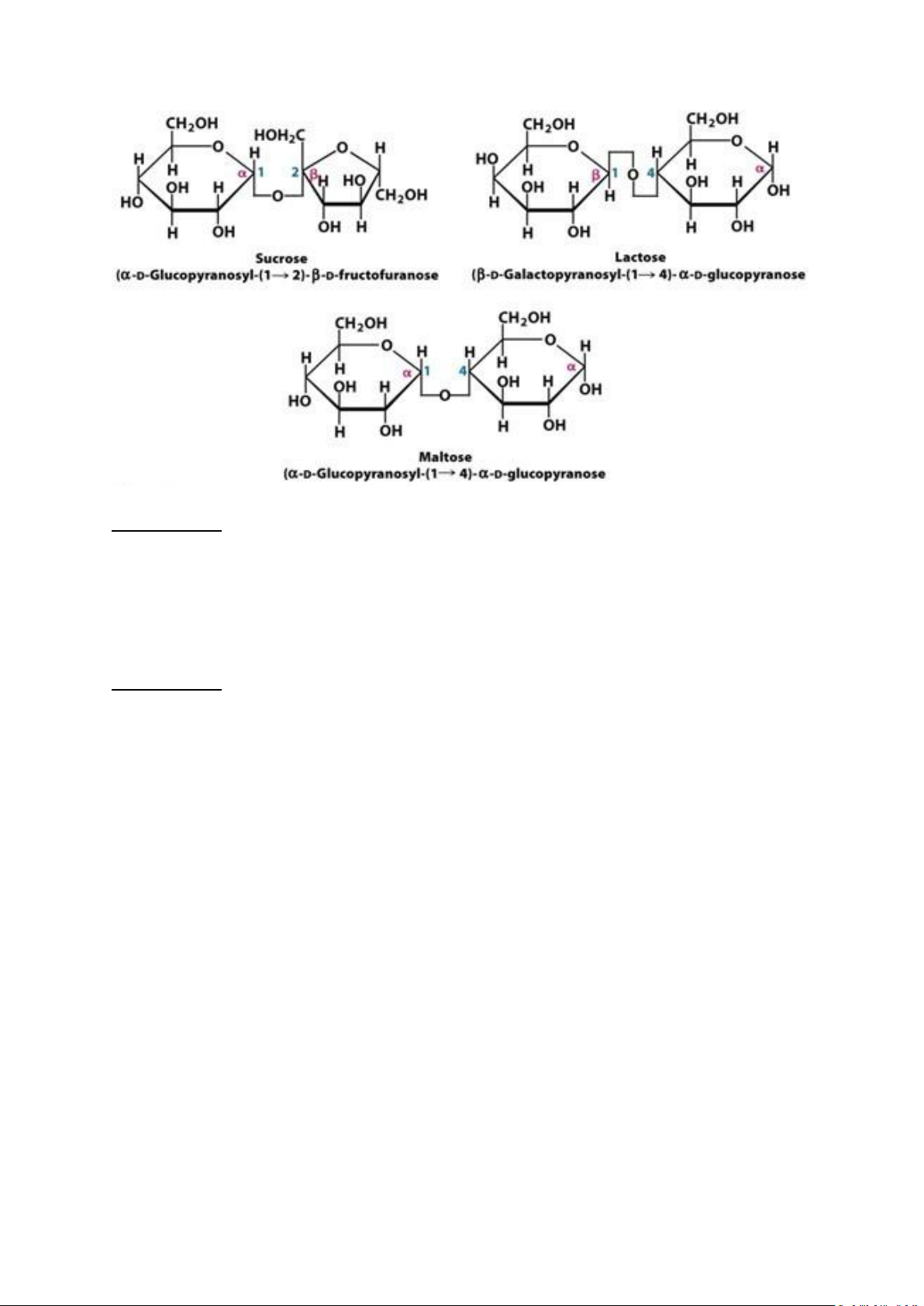
Ống nghiệm 2 và 3: Maltose và lactose đều được tạo thành do nhóm –OH bán acetal của
monosacarid thứ nhất liên kết với nhóm –OH alcol của MS thứ 2 nên DS sẽ còn thừa 1 nhóm
–OH bán acetal có tính khử. Vì thế mà khi cho thuốc thử Fehling và đun nóng xuất hiện kết
tủa đỏ gạch do Cu2+ bị khử thành Cu+ bởi nhóm –OH bán acetal này. 3
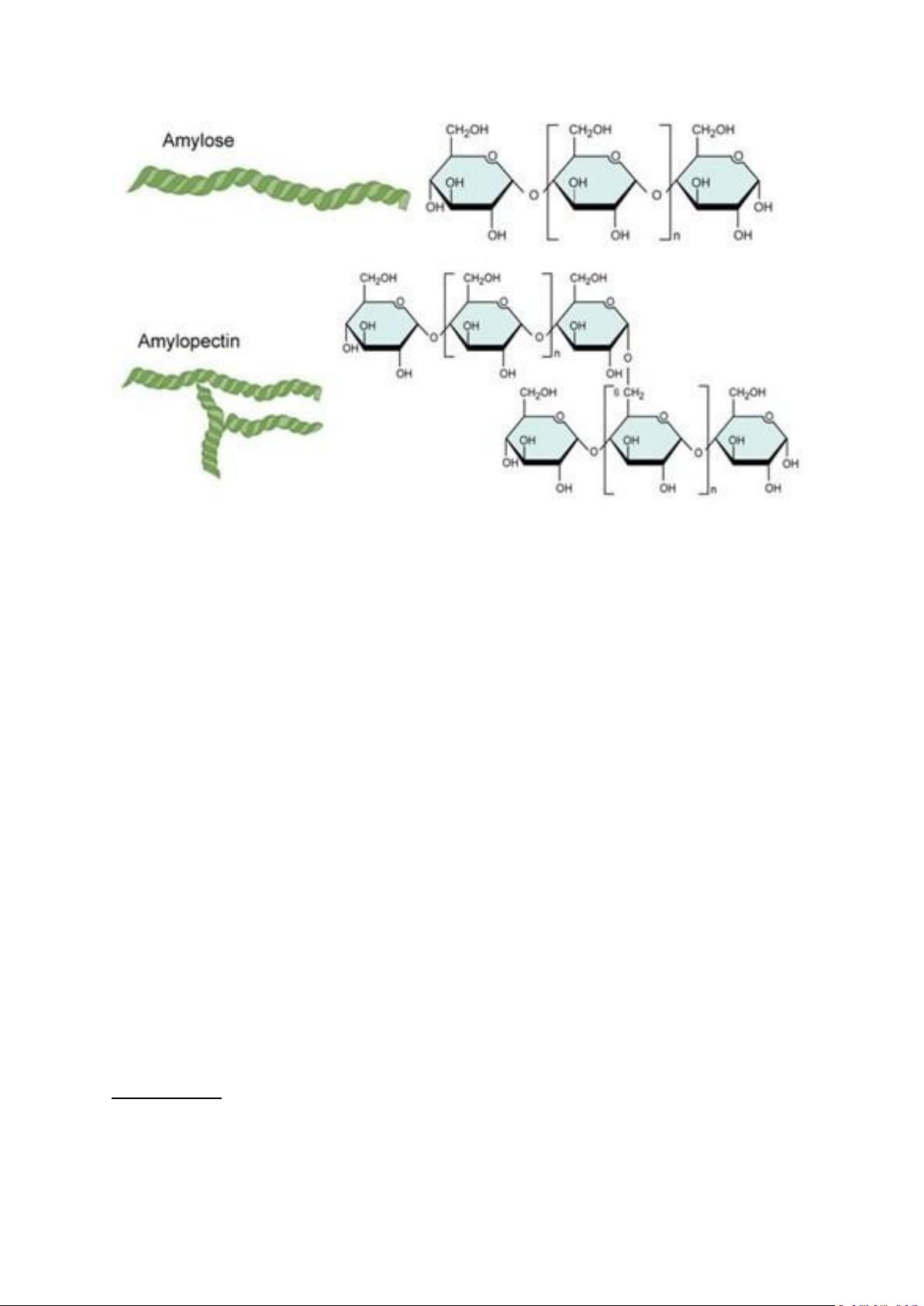
Ống nghiệm 4: Hồ tinh bột là loại polysaccharide cấu tạo bởi hàng ngàn gốc a-D-Glucose,
gồm 2 loại phân tử: amylose và amylopectin. Amylose có cấu tạo mạch thẳng bởi liên kết a
1-4 glycoside, còn amylopectin có cấu tạo mạch chính bởi liên kết a 1-4 glycoside và mạch
nhánh bởi liên kết a 1-6 glycoside. Vì có cấu tạo phúc tạp như trên mà hồ tinh bột khó thực
hiện được tính khử của nhóm –OH bán acetal và không gây kết tủa đỏ gạch. Do đó trong ống
nghiệm không xảy ra hiện tượng kết tủa.
Ống nghiệm 5: Sacarose (sucrose) có cấu tạo từ việc kết nối 2 nhóm –OH bán acetal của 2
MS với nhau và không còn nhóm chức khử nào nên không có khả năng khử Cu2+ thành Cu+
và không gây kết tủa đỏ gạch. Vì thế mà màu của dung dịch vẫn giữ nguyên màu xanh của thuốc thử Fehling.
THÍ NGHIẸM 2: PHẢN ỨNG MÀU CỦA POLYSACCHARIDE • Mục đích
Dùng để phân biệt các loại polysaccharide khác nhau. • Nguyên tắc
Các Polysaccharide (PS) kết hợp với Iode cho những phức hợp có màu khác nhau tuỳ mức độ phân tử Polysaccharide.
Nếu là tinh bột : sẽ có màu xanh dương
Nếu là Glycogen : sẽ có màu đỏ nâu.
• Mẫu thử / Thuốc thử Thuốc thử:
- Dung dịch Hồ tinh bột 1% - Dung dịch Lugol 0,1% Mẫu thử: PS
• Kỹ thuật / Cách tiến hành
Cho vào 2 ống nghiệm các dung dịch sau:
- Ống nghiệm 1: 1ml dd Hồ tinh bột 1% + 1 giọt dd Lugol 0,1%
- Ống nghiệm 2: 1ml dd Glucose + 1 giọt dd Lugol 0,1% Lắc đều. Quan sát • Nhận xét
Ống nghiệm 1: dd Hồ tinh bột 1% 1ml + dd Lugol 0,1% 1 giọt
—> Dung dịch xuất hiện màu xanh tím, sau khi đun nóng dung dịch mất màu, để nguội
dung dịch màu xanh tím xuất hiện trở lại
Ống nghiệm 2: dd Glucose 1ml + dd Lugol 0,1% 1 giọt —> Không đổi màu
• Giải thích hiện tượng Ống nghiệm 1 Giải thích:
Trong tinh bột có 2 loại phân tử chính amylose và amylopectin.
- Amylose là một loạt các đơn vị glucose liên kết với nhau thông qua các liên kết α-
(1→4) glycosid. Điều đặc biệt là amylose có cấu trúc tuyến tính, khiến cho nó có khả
năng tự xoắn và tạo thành một cấu trúc vòng xoắn tự nhiên - khả năng hấp phụ của tinh bột.
- Amylopectin cũng là một chuỗi glucose, liên kết với nhau thông qua các liên kết α-
(1→4) glycosidic giống như amylose và liên kết α-(1→6) glycosidic. Các liên kết này
tạo thành các nhánh chứa nhiều đơn vị glucose, làm cho amylopectin có cấu trúc
phân tán và không tuyến tính. 5
I2 tan rất kém trong nước nên thường phải có thêm I- từ muối iod để tan tốt hơn, do đó tạo ra anion tri iodine I3-. I2 + I- → 3I-
- Khi cho dung dịch iod vào hồ tinh bột, vì anion I3- có kích thước và hình dạng phù
hợp với cấu trúc vòng xoắn của amylose nên I3- bị mắc kẹt bên trong và tạo nên
phức hợp tinh bột- tri iodine. Khi quan sát dưới ánh sáng trắng, phức hợp này hấp
thụ ánh sáng ở các vùng bước sóng khác nhưng không hấp thụ tốt ánh sáng ở vùng
màu xanh lam nên bị phản lại mắt làm cho dung dịch được nhìn thấy có màu xanh lam.
- Khi đun nóng, do ảnh hưởng của nhiệt độ mà cấu trúc không gian của tinh bột bị
biến đổi. Các hạt tinh bột sẽ hấp thụ nước và trương phồng lên làm dãn nở cấu trúc
vòng xoắn. Do đó mà anion I3- thoát ra ngoài và iod có hiện tượng thăng hoa khi tiếp
xúc nhiệt độ làm cho dung dịch màu nhạt dần rồi mất màu.
- Khi để nguội, cấu trúc vòng xoắn của amylose sẽ co lại như ban đầu và sẽ bắt giữ I3-
vào bên trong cấu trúc nên dung dịch trở về màu xanh lam. Do cấu trúc không gian
của amylose có thể bị biến đổi một phần bởi nhiệt độ nên màu dung dịch có thể nhạt hơn ban đầu.
** Vì sao cùng là polysaccharide nhưng glycogen không cho ra màu xanh lam với dung dịch iod như hồ tinh bột?
Vì glycogen không có cấu trúc vòng xoắn đặc biệt như amylose của tinh bột mà có cấu trúc
giống như amylopectin, gồm các chuỗi phân nhánh phức tạp có kết cấu nằm thành một dạng
hình cầu - không phù hợp với hình dạng của iod nên glycogen không có khả năng bắt giữ iod
làm cho màu dung dịch có màu đỏ nâu của glugol 0,1%.
Ống nghiệm 2: Vì glucose là monosaccharide không có cấu trúc vòng xoắn như amylose
trong tinh bột nên không có khả năng bắt giữ iod do đó màu của dung dịch không thay đổi trước và sau khi đun. Nhóm 4.3
BÁO CÁO THỰC HÀNH HÓA SINH CHUYỂN HOÁ GLUCID XÉT NGHIẸM GLUCOSE PHƯƠNG PHÁP ENZYM • Mục đích
Xét nghiệm đo lượng glucose trong huyết thanh hoặc huyết tương, nước tiểu để xác định
lượng glucose trong máu ở trong phạm vi bình thường, tầm soát, chẩn đoán và theo dõi
bệnh tiểu đường và tiền tiểu đường. • Nguyên tắc
Kết hợp sử dụng emzym glucose oxydase và Peroxydase. Nguyên lý của phương pháp như sau: Glucose oxidase
Glucose + H2O ---------------------------> Acid gluconic + H2O2 Peroxidase
2H2O2+ Phenol + 4 amino-Antipyrin (PAP)--------------------> Quinonemin + 4H2O
• Mẫu thử / Thuốc thử
Thuốc thử: thuốc thử pha sẵn
Mẫu thử: Huyết thanh hoặc huyết tương
• Kỹ thuật / Cách tiến hành
Cho vào các ống nghiệm các dung dịch sau:
- Ống nghiệm chuẩn: 500µl thuốc thử pha sẵn + 5µl dd chuẩn (Glucose standard) 100 mg/dl
- Ống nghiệm bệnh nhân: 500µl thuốc thử pha sẵn + 5µl huyết thanh bệnh nhân
Lắc đều. Để yên 10 phút. Đo Abs • Nhận xét
Ta có: Hệ số tham chiếu kết quả: 74 - 106mg/dL là bình thường. mg/dL - Cs = 100 - ODS = 0.5033 -
ODU1 = 1.3730 -> CU1 = 273mg/dL -
ODU2 = 1.5190 -> CU2 = 302mg/dL -
ODU3 = 1.4540 -> CU3 = 289mg/dL - ODU4 = 1.6 -> CU4 = 318mg/dL -
ODU5 = 1.6020 -> CU5 = 318mg/dL -
ODU6 = 1.5010 -> CU6 = 298mg/dL -
ODU7 = 1.4540 -> CU7 = 289mg/dL - ODU8 = 1.6 -> CU8 = 318mg/dL
ODtb = 1.5551 và Ctb = 301mg/dL Nhận xét:
- Từ giá trị Ctb có thể kết luận được chỉ glucose máu ở mức ranh giới cao, bất thường
so với hệ số tham chiếu. 7
- Có sự chênh lệnh nhiều so với giá trị Ctb. Cụ thể: CU1= 273mg/dL < Ctb = 301mg/dL
và CU5 = 318mg/dL > Ctb = 301mg/dL và CU8 = 318mg/dL > Ctb = 301mg/dL. -
Không có sự chênh lệch nhiều so với các ống còn lại. • Giải thích
Có sự chênh lệch kết quả đo giữa các sinh viên là do
- Sai số trong thí nghiệm: sai số xảy ra có thể là do sự chính xác của thiết bị đo lường,
sai số trong quá trình lấy mẫy và thuốc thử,. .
- Kỹ năng của mỗi sinh viên ảnh hưởng đến quá trình lấy mẫu và thuốc thử dấn đến kết quả khác nhau.
Trị số bình thường : 75 –115 mg/dl. Kết quả đo được có nồng độ cao hơn trị số bình thường là do: + Bệnh đái tháo đường + Tiểu đường thai kỳ
+ Rối loạn nội tiết (Hội chứng Cushing, bệnh cường giáp Basedow. .) + Suy thận mạn + Bệnh cực to (Acromegaly)
+ Căng thẳng cấp tính (chấn thương, đau tim, đột quỵ) + Ung thư tuyến tuy + Viêm tụy + Ăn quá nhiều Nhóm 4.3
BÁO CÁO THỰC HÀNH HÓA SINH HÓA HỌC LIPID
THÍ NGHIẸM 1: PHẢN ỨNG TAN CỦA LIPID • Mục đích
Khảo sát tính hòa tan của lipid trong dung môi phân cực và dung môi không phân cực. • Nguyên tắc
Dựa vào tính chất vật lý của hợp chất lipid là các hợp chất không tan hoặc ít tan trong nước
và dung môi phân cực, có khả năng hòa tan dễ dàng trong các loại dung môi hữu cơ ( không
phân cực ) như là cloloroform, methanol, benzene….
• Mẫu thử / Thuốc thử Thuốc thử - Ether - Nước cất (ED) Mẫu thử: Dầu ăn
• Kỹ thuật / Cách tiến hành
Cho vào 2 ống nghiệm các dung dịch sau:
- Ống nghiệm 1: 1ml nước cất (ED) + 0,5ml dầu ăn
- Ống nghiệm 2: 1ml ether + 0,5ml dầu ăn
Lắc đều các ống, quan sát. • Nhận xét
Ống nghiệm 1: 0,5 ml dầu ăn + 5ml nước cất
Lắc đều có hiện tượng dầu ăn không tan trong nước tạo thành các hạt nhũ tương
Ống nghiệm 2: 0,5 ml dầu ăn + 1ml Ether
Lắc đều có hiện tượng dầu ăn tan trong Ether
• Giải thích hiện tượng Ống nghiệm 1:
- Giải thích: Vì dầu ăn (lipid) là chất không phân cực, nước là dung môi phân cực nên
dầu ăn không tan trong nước do không đồng tính chất. Sức căng bề mặt của dầu nhỏ
hơn nước nên khi dầu rơi vào mặt nước, nước co lại hết mức kéo dầu dãn ra thành
màng mỏng nổi lên trên bề mặt nước
- Giải thích: Do dầu ăn có tỉ trọng nhẹ hơn nước và là dung môi không phân cực còn
nước cất là dung môi phân cực, nên dầu ăn không tan được trong nước và tách ra
làm 2 lớp (lớp dầu ở trên, nước ở dưới). Dầu ăn (khối lượng riêng khoảng 0,8g/L) nổi
lên trên vì có khối lượng riêng nhỏ hơn nước (khối lượng riêng 1g/L). Ống nghiệm 2:
- Giải thích: Vì dầu ăn (lipid) là chất không phân cực và ether là dung môi không phân
cực nên dầu ăn tan được trong ether
- Giải thích: Do dầu ăn và ether có cùng bản chất đều là dung môi không phân cực nên
chúng tan hoàn toàn tạo thành một hỗn hợp trong suốt.
THÍ NGHIẸM 2: PHẢN ỨNG NHŨ TƯƠNG HÓA LIPID • Mục đích
Nhận biết lipid bằng sự tạo nhũ tương hóa • Nguyên tắc 9
Dầu hoặc mỡ không hòa tan trong nước, khi tác động mạnh sẽ tạo thành nhũ tương không
bền ( để yên một thời gian chúng phân chia làm 2 lớp dầu ở trên nước ở dưới ).
Nếu thêm một chất làm nhũ tương hóa như Na2CO3, protein, muốt mật thì sẽ tạo thành nhũ tương bền.
• Mẫu thử / Thuốc thử Thuốc thử: - Nước cất (ED) - Dung dịch Na2CO3 10%
- Dung dịch lòng trắng trứng Mẫu thử: Dầu ăn
• Kỹ thuật / Cách tiến hành
Cho vào 3 ống nghiệm các dung dịch sau:
- Ống nghiệm 1: 5ml nước cất (ED) + 0,5ml dầu ăn
- Ống nghiệm 2: 5ml nước cất (ED) + 0,5ml dầu ăn + 5 giọt dung dịch Na2CO3 10%
- Ống nghiệm 3: 5ml nước cất (ED) + 0,5ml dầu ăn + 5 giọt dung dịch lòng trắng trứng
Lắc đều các ống nghiệm, quan sát. • Nhận xét
Ống nghiệm 1: 0,5ml dầu ăn + 5ml nước cất
Lắc đều thấy dầu ăn không tan trong nước cất, kết cụm tạo thành các hạt nhũ tương không bền.
Ống nghiệm 2: 0,5ml dầu ăn + 5ml nước cất + 5 giọt Na2CO3 10%
Lắc đều thấy hiện tượng tách hạt nhỏ, khi cho Na2CO3 vào làm đục hỗn hợp dầu trong
nước, cùng với các hạt li ti bám vào thành ống nghiệm
Ống nghiệm 3: 0.5 ml dầu ăn + 5ml nước cất + 5 giọt lòng trắng trứng.
Lắc đều thấy hiện tượng lớp dầu nổi trên bề mặt nhưng ít và có các hạt nhũ tương lớn và nhỏ không đều nhau.
• Giải thích hiện tượng Ống nghiệm 1: Giải thích:
- Khi nhỏ dầu ăn vào nước cất, giữa các hạt phân tử nước hình thành lực hút với nhau
- liên kết hydro, cũng như có lực hút giữa các hạt phân tử dầu ăn - liên kết Van der
Waals nên tạo thành sức căng bề mặt của nước và của dầu. Mà khối lượng riêng của
nước lớn hơn dầu nên sức căng bề mặt của nước lớn hơn dầu ăn do đó nước có xu
hướng co lại sao cho diện tích bề mặt tiếp xúc với dầu ăn là nhỏ nhất và làm cho dầu
bị kéo dãn thành lớp màng nổi lên trên.
- Sau khi lắc đều, dầu ăn bị phân tán ra vào tạo thành các hạt dầu nhỏ trong nước hay
còn gọi là hạt nhũ tương dầu trong nước. Các hạt nhũ tương này không bền nên dầu
ăn sẽ có xu hướng liên kết nhau và tạo thành lớp dầu nổi lên trên. Ống nghiệm 2:
- Giải thích: Những hạt nhũ tương dầu trong nước không bền nên sẽ làm cho hỗn hợp
tự tách trở lại thành 2 lớp. Nhũ tương hóa dầu ăn bằng Na2CO3 có thể tạo ra chất
hoạt động bề mặt (surfactant) làm giảm sức căng bề mặt của nước, giọt dầu nhỏ
hơn, tạo điều kiện thuận lợi để giọt dầu phân tán trong nước và tạo thành dung dịch nhũ tương bền vững. Ống nghiệm 3: Giải thích:
- Lòng trắng trứng có chứa protein, có khả năng làm giảm sức căng bề mặt của nước.
Khi dầu và lòng trắng trứng được trộn đều, protein trong lòng trắng trứng tạo thành
các hạt micel e có phần ngoài là đầu ưa nước tương tác với nước và phần trong là
đuôi kị nước tương tác với dầu → giúp giọt dầu trở nên nhỏ hơn và phân tán trong
nước tạo thành một dung dịch nhũ tương ổn định
- Protein trong lòng trắng trứng là các phân tử lưỡng tính ngăn ngừa sự mất ổn định
của nhũ tương dầu trong nước thông qua sự kết hợp của tương tác tinh điện và
không gian. Chúng làm giảm sức căng bề mặt bằng cách hấp phụ lên bề mặt phân
cách dầu trong nước và tạo thành một lớp.
- Polysaccharide trong lòng trắng trứng tạo sự ổn định cho nhũ tương dầu trong nước,
làm thay đổi tính chất lưu biến của pha liên tục bằng các tăng độ nhớt hoặc tạo gel,
do đó giảm khả năng di chuyển của giọt, làm cố định các giọt
- Trong quá trình nhũ hóa, độ ổn định nhũ tương ảnh hưởng trực tiếp đến sự hình
thành và kích thước giọt, làm cho những hạt nhũ tương trong mẫu ống nghiệm lớn,
nhỏ không đều nhau tùy thuộc vào độ ổn định nhũ tương
=> Các polysaccharide và protein trong lòng trắng trứng là các chất hoạt động bề mặt có khả
năng hình thành màng tiếp xúc làm giảm sức căng bề mặt giữa các pha => giọt dầu trở nên
nhỏ hơn và phân tán trong nước tạo thành một dung dịch nhũ tương ổn định. 11 Nhóm 4.3
BÁO CÁO THỰC HÀNH HÓA SINH CHUYỂN HÓA LIPID
ĐỊNH LƯỢNG CHOLESTEROL TOÀN PHẦN
PHƯƠNG PHÁP CHOD PAP: • Mục đích
Xét nghiệm đo lượng cholesterol toàn phần trong huyết thanh hoặc huyết tương để chẩn
đoán và theo dõi các bệnh tim mạch, gan, thận cũng như các rối loạn chuyển hóa lipid (tăng
lipid máu) hay lipoprotein và được sử dụng để phát hiện nguy cơ, điều trị xơ vữa động mạch. • Nguyên tắc
Cholesterol toàn phần được tổng hợp ở nhiều mô khác nhau nhưng chủ yếu là ở
gan và tế bào thành ruột.
Cholesterol là một thành phần của mật và có mặt trong hồng cầu - màng tế bào - cơ. Gan là
cơ quan chủ yếu tổng hợp cholesterol và cũng là bộ phận duy nhất este hóa cholesterol.
Khi xét nghiệm, cả 2 dạng cholesterol trên không phân biệt ra mà thường được đo chung với
nhau. Chính vì vậy, gọi cholesterol toàn phần là sự kết hợp của cholesterol tự
do và cholesterol ester.
Cholesterol toàn phần trong máu được định lượng theo phương pháp enzym so màu: Cholesterol esterase Cholesterol esters Cholesterol + free fatty acids Cholesterol oxidase Cholesterol + O2 Cholesterol 4 one 3 + H2O2 Perroxidase 2H2O2 + Phenol + PAP Quinoneimine (tím) + 4H2O • Mẫu thử Thuốc thử: - Thuốc thử Cholesterol
- Dung dịch Cholesterol chuẩn 200mg/dl
Mẫu thử: Huyết thanh hoặc huyết tương
• Kỹ thuật / Cách tiến hành
Cho vào các ống nghiệm các dung dịch sau:
- Ống nghiệm Blank (B): 500µl thuốc thử Cholesterol
- Ống nghiệm chuẩn (S): 500µl thuốc thử Cholesterol + 5µl dd Cholesterol chuẩn 200mg/dl
- Ống nghiệm huyết thanh: 500µl thuốc thử Cholesterol + 5µl huyết thanh bệnh nhân
Lắc đều, để yên 10 phút. Đo Abs. • Nhận xét
Ta có: Hệ số tham chiếu kết quả: 200 – 220mg/dL là bình thường. mg/dL - Cs = 200 - ODS = 0.5817 - ODB = 0.1169
- ODU1 = 0.6723 -> CU1= 191mg/dL
- ODU2 = 0.8354 -> CU2 = 247mg/dL
- ODU3 = 0.6928 -> CU3 = 198mg/dL
- ODU4 = 1.0380 -> CU4 = 316mg/dL
- ODU5 = 0.7543 -> CU5 = 219mg/dL
- ODU6 = 0.6785 -> CU6 = 193mg/dL
- ODU7= 0.7268 -> CU7 = 209mg/dL
- ODU8= 0.7545 -> CU8 = 219mg/dL
⇨ ODtb = 0.7690 và Ctb= 224mg/dL Nhận xét:
- Từ giá trị Ctb có thể kết luận được mức cholesterol toàn phần ở mức ranh giới cao, bất
thường so với hệ số tham chiếu.
- Có sự chênh lệnh so với giá trị Ctb. Cụ thể: CU1 = 191mg/dL < Ctb = 224mg/Dl và CU4 = 316mg/dL > Ctb = 224mg/dL. • Giải thích
Có sự chênh lệch kết quả đo giữa các sinh viên so với giá trị Ctb là do
- Sai số trong thí nghiệm: sai số xảy ra có thể là do sự chính xác của thiết bị đo lường,
sai số trong quá trình lấy mẫu và thuốc thử,. .
- Kinh nghiệm và kĩ năng của mỗi sinh viên khác nhau ảnh hưởng đến quá trình lấy
mẫu và thuốc thử dẫn đến kết quả khác nhau.
Trị số bình thường Cholesterol < 200 mg/dl ( or < 5,7 mmol/L). Kết quả mức cholesterol toàn
phần ở mức ranh giới cao, bất thường là do:
+ Chế độ ăn uống và lối sống không lành mạnh: hút thuốc lá, uống rượu bia, ăn nhiều thịt
mỡ, nội tạng động vật, …
+ Tuổi tác: Cholesterol thường tăng theo tuổi tác, đặc biệt là phụ nữ trong thời kì mãn kinh.
+ Di truyền: Gen có ảnh hưởng nhất định đến quá trình sản xuất và chuyển hóa Cholesterol.
+ Thói quen ít hoạt động thể chất: có thể làm tăng cholesterol LDL và giảm cholesterol HDL.
+ Bệnh lý: một số bệnh như tiểu đường, tuyến giáp, thận, béo phì và tăng huyết áp có thể làm tăng cholesterol.
+ Sử dụng thuốc trong thời gian dài: thuốc lợi tiểu, thuốc chẹn beta, các loại hormone sinh
dục nữ, glucorticoid có thể làm tăng cholesterol. Nhóm 4.3 13
BÁO CÁO THỰC HÀNH HÓA SINH HÓA HỌC PROTID
THÍ NGHIẸM 1: PHẢN ỨNG NINHYDRIN • Mục đích
Dùng để định tính và định lượng acid amin α. • Nguyên tắc
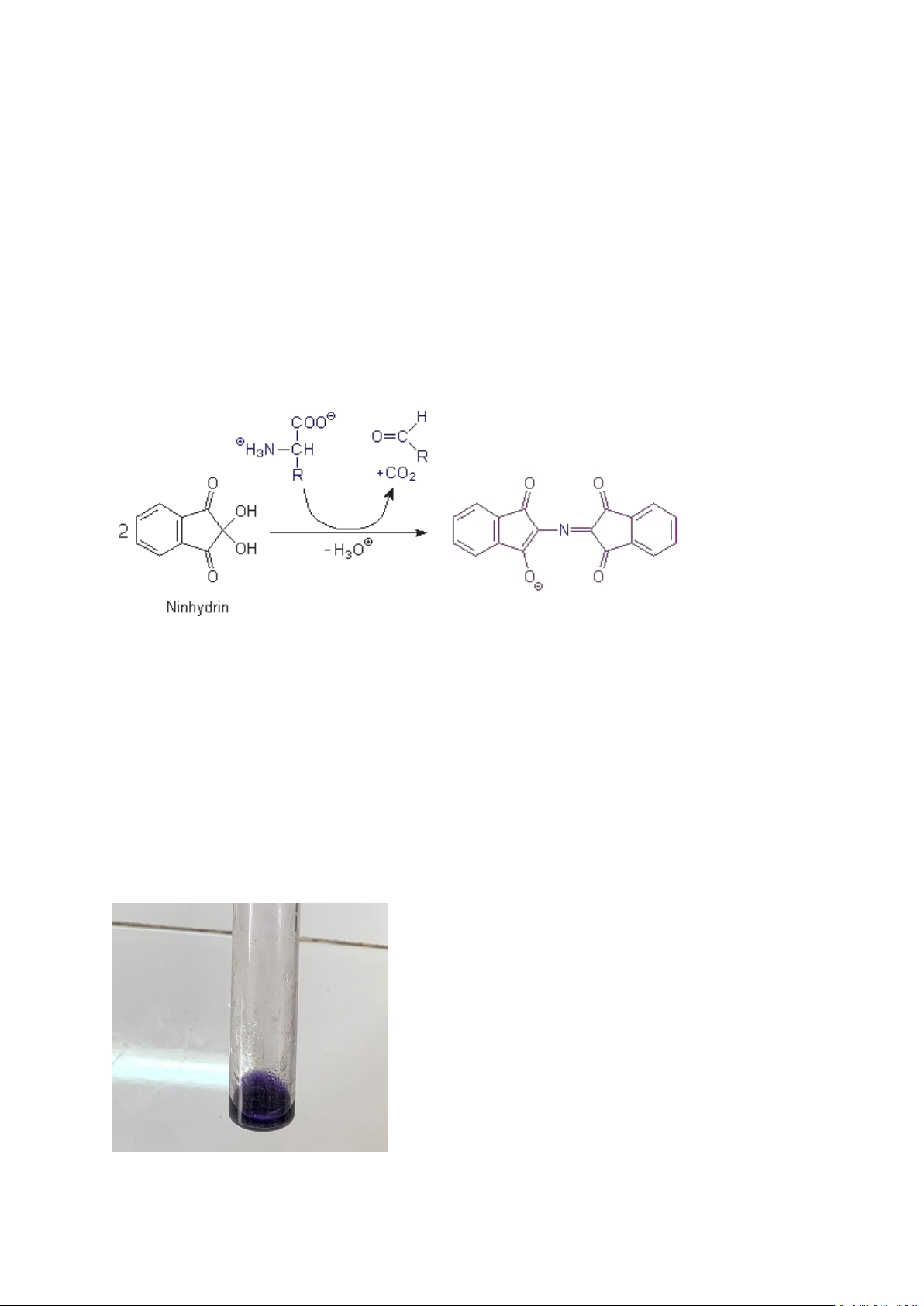
Ninhydrin là chất oxyhóa mạnh , có khả năng khử carboxyl oxy hóa acid amin tạo thành CO2 ,
NH3 và andehyd kém 01 carbon so với acid amin ban đầu . Sau đó Ninhydrin bị khử tác dụng
lại với NH3 vừa được phóng thích và kết hợp với một phân tử Ninhydrin thứ hai ,tạo thành
sản phẩm ngưng kết có màu xanh tím.
• Mẫu thử / Thuốc thử
Thuốc thử: thuốc thử Ninhydrin 0,1%
• Kỹ thuật / Cách tiến hành
Cho vào các ống nghiệm các dung dịch sau:
- Ống nghiệm 1: 1ml dd Glycin 0,1% + 5 giọt thuốc thử Ninhydrin 0,1%
- Ống nghiệm 2: 1ml dd Tryptophan 0,1% + 5 giọt thuốc thử Ninhydrin 0,1%
- Ống nghiệm 3: 1ml dd protein lòng trắng trứng 0,1% + 5 giọt thuốc thử Ninhydrin 0,1%
Lắc đều. Đun sôi cách thủy 5-10 phút. Quan sát • Nhận xét
Ống nghiệm 1: Dung dịch Glycin 0,1% 1ml + dd Ninhydrin 1% 5 giọt
—> Cho dung dịch xanh tím
Ống nghiệm 2: Dung dịch Tryptophan 0,1% 1ml + dd Ninhydrin 1% 5 giọt
—> Cho dung dịch xanh tím
Ống nghiệm 3: Dung dịch protein(lòng trắng trứng) 0,1% 1ml + Ninhydrin 1% 5 giọt
—> Cho dung dịch xanh tím
• Giải thích hiện tượng Ống nghiệm 1:
Dung dịch glycin 0,1% có chứa nhiều α-acid amin nên khi cho thuốc thử Ninhydrin 0,1% vào
ống nghiệm sau đó đun sôi cách thủy từ 3-5 phút thì các acid amin phản ứng với Ninhydrin
sẽ bị dezamine hóa, oxy hóa và decarbon hóa tạo NH3, CO2 , andehyd mất đi 1 carbon so với
glycin ban đầu, còn ninhydrin bị khử tiếp tục tác dụng với NH3 mới được phóng thích và
ninhydrin không bị khử tạo nên phức hợp màu xanh tím. Ống nghiệm 2:
Cũng giống như dung dịch Glycin 0,1%, dung dịch Tryptophan 0,1% cũng chứa nhiều α- acid
amin nên khi phản ứng với Ninhydrin sẽ tạo phức có màu tím Ống nghiệm 3:
Dung dịch lòng trắng trứng ngoài Albumin còn có các α-axit amin tự do liên kết với nhau
bằng liên kết peptid nên làm giảm số lượng nhóm chức amin (- NH2) và carboxyl (-COOH) tự
do phản ứng tạo phức màu với Ninhydrin do đó mà màu quan sát được là xanh tím nhạt. Do
ảnh hưởng của nhiệt độ làm cho lòng trắng trứng bị biến tính làm xuất hiện kết tủa trong dung dịch.
THÍ NGHIẸM 2: PHẢN ỨNG BIURET • Mục đích
Dùng để nhận biết sự có mặt của liên kết peptit trong cấu trúc hóa học của hợp chất hữu cơ.
Phản ứng màu biuret cũng có thể dùng để đánh giá nồng độ của protein trong huyết tương 15
hoặc huyết thanh phản ánh tinh trạng dinh dưỡng và để sàng lọc, chẩn đoán bênh thận, gan,
các nguyên nhân bệnh lý khác. • Nguyên tắc
Trong môi trường kiềm , các liên kết peptid trong protein sẽ kết hợp Ion của kim lọai nặng
như Cu2+ cho một phức chất màu tím.
• Mẫu thử / Thuốc thử Thuốc thử:
- Dung dịch lòng trắng trứng 0,1% - Dung dịch Glycin 0,1% - Thuốc thử Biuret
• Kỹ thuật / Cách tiến hành
Cho vào 2 ống nghiệm các dung dịch sau:
- Ống nghiệm 1: 1ml dd lóng trắng trứng 0,1% + 1ml thuốc thử Biuret
- Ống nghiệm 2: 1ml dd Glycin 0,1% + 1ml thuốc thử Biuret Lắc đều. Quan sát • Nhận xét
Ống nghiệm 1: Dung dịch lòng trắng trứng 0,1% 1ml + NaOH 40% 0,5ml + dung dịch CuSO4 1% 3 giọt
—> Cho dung dịch đổi màu xanh tím
Ống nghiệm 2: Dung dịch Glycin 0,1% 1ml + dd Biuret 1ml
—> Cho dung dịch không đổi màu vẫn giữ nguyên màu Biuret
• Giải thích hiện tượng Ống nghiệm 1:
Dung dịch lòng trắng trứng có chứa protein được tạo thành từ các α-acid amin nối với nhau
bằng liên kết peptide (liên kết đơn giữa 1 nguyên tử α - carboryl và 1 nguyên tử α -
nitrogen), mà chất có chứa từ 2 liên kết peptide trở lên có thể phản ứng với CuSO4 trong
môi trường kiềm tạo phức có màu xanh tím đặc trưng. Ống nghiệm 2:
Glycin là α- acid amin, không chứa liên kết peptit (-CO-NH-) nên không xảy ra phản ứng với
thuốc thử Biuret tạo phức hợp màu xanh tím đặc trưng.
THÍ NGHIẸM 3: PHẢN ỨNG TỦA PROTEIN BỞI NHIẸT VỚI MÔI TRƯỜNG ACID NHẸ • Mục đích
Có thể được sử dụng để phát hiện và định lượng các protein sinh ra bởi các tế bào
ác tính trong nước tiểu của bệnh nhân ung thư qua kết tủa protein. Điều này giúp
trong việc chẩn đoán bệnh và theo dõi tiến triển của bệnh. • Nguyên tắc
Protein hòa tan trong nước thành dung dịch keo ưa nước, trong dung dịch các tiểu phân
protein cùng lọai tích điện cùng dấu , xung quanh tiểu phân protein có lớp áo nước ( phân tử
lưỡng cực liên kết các nhóm phân cực như –OH , - COOH, -NH2 ,=NH…).Nhờ hai yếu tố trên ,
protein tồn tại dưới dạng dung dịch keo bền vững.
• Mẫu thử / Thuốc thử Thuốc thử: - Dung dịch Acid acetic 1% - Dung dịch Acid acetic 10% - Dung dịch NaCl bão hòa - Dung dịch NaOH 10%
• Kỹ thuật / Cách tiến hành
Cho vào các ống nghiệm các dung dịch sau:
- Ống nghiệm 1: 1ml lòng trắng trứng
- Ống nghiệm 2: 1ml lòng trắng trứng + 2 giọt dd Acid acetic 1%
- Ống nghiệm 3: 1ml lòng trắng trứng + 5 giọt dd Acid acetic 10%
- Ống nghiệm 4: 1ml lòng trắng trứng + 5 giọt dd Acid acetic 10% + 2 giọt dd NaCl bão hòa
- Ống nghiệm 5; 1ml lòng trắng trứng + 2 giọt dung dịch NaOH 10%
Lắc đều. Đun sôi cách thủy các ống nghiệm 3-5 phút. Quan sát • Nhận xét
Ống nghiệm 1: Lòng trắng trứng 1ml sau khi đun
—> Cho chất kết tủa nhẹ 17