













Preview text:
TRƯỜNG ĐẠI HỌC Y KHOA PHẠM NGỌC THẠCH KHOA DƯỢC
BÁO CÁO THỰC TẬP TẠI PHARMEDIC
HỌC PHẦN THỰC HÀNH BÀO CHẾ 1
Sinh viên :
NGUYỄN HUỲNH BẢO NGỌC
MSSV: 1952010017
TRẦN LINH NHI
MSSV: 1952010068
Lớp: Dược 2019 Nhóm: 1
Tiểu nhóm: 4
Tp. Hồ Chí Minh – Tháng 06/2022
LỜI CẢM ƠN
Lời đầu tiên cho phép chúng em xin gửi lời cám ơn đến ban lãnh đạo Công ty Cổ
Phần Dược Phẩm Dược Liệu Pharmedic và toàn thể các thầy cô, anh chị đang công tác
tại Công ty, đã tạo điều kiện cho lớp Dược2019 của chúng em được học tập và trải
nghiệm thực tế, tận tình giảng dạy, hướng dẫn và chia sẻ những kinh nghiệm quý giá
cho chúng em trong suốt buổi học.
Bên cạnh đó, chúng em cũng xin gửi lời cám ơn sâu sắc đến quý thầy cô tại Khoa
Dược của Trường Đại học Y khoa Phạm Ngọc Thạch đã tổ chức cho chúng em chuyến
đi thực tế vô cùng hữu ích này, giúp chúng em có những cái nhìn tổng quan về quy trình
xử lý nước, kiểm nghiệm vi sinh cũng như được tham quan dây chuyền sản xuất thuốc dạng lỏng của Công ty.
Trong quá trình kiến tập tại Công ty, cũng như trong quá trình thực hiện bài báo
cáo, do thiếu kiến thức chuyên ngành lẫn các kinh nghiệm thực tế, chúng em chắc chắn
không thể nào tránh khỏi những sai sót, chúng em rất mong sẽ nhận được những lời góp
ý quý giá từ thầy cô để có thể hoàn thành tốt hơn trong những lần kiến tập sau này.
Cuối cùng, chúng em xin kính chúc quý thầy cô và các anh chị đang công tác tại
Công ty thật nhiều sức khỏe, niềm vui và thành công trong cuộc sống.
Chúng em xin chân thành cảm ơn. i
Nhận xét của cán bộ hướng dẫn: Ký tên:
Điểm bài báo cáo: MỤC LỤC
I. QUY TRÌNH KIỂM NGHIỆM VI SINH VÀ CÁC TIÊU CHUẨN CỦA THUỐC
DẠNG LỎNG ................................................................................................................... 1
1. Quy trình kiểm nghiệm vi sinh thuốc dạng lỏng ...................................................... 1
1.1. Sơ đồ quy trình kiểm nghiệm vi sinh của nhà máy pharmedic ............................ 1
1.2. Tiêu chuẩn kiểm nghiệm vi sinh .............................................................................. 1
2. Các tiêu chuẩn chất lượng của thuốc dạng lỏng ....................................................... 2
2.1. Các chỉ tiêu chất lượng ............................................................................................. 2
3. Thẩm định quy trình phân tích .................................................................................. 4
II. THAM QUAN DÂY CHUYỀN SẢN XUẤT THUỐC DẠNG LỎNG .................. 5
1. Quy trình sản xuất thuốc theo GMP .......................................................................... 5
2. Quy trình sản xuất thuốc dạng lỏng ........................................................................... 6
2.1. Yêu cầu chung ........................................................................................................... 6
2.2. Sơ đồ bố trí dây chuyền sản xuất thuốc dạng lỏng ................................................ 9
2.3. Sơ đồ quy trình sản xuất thuốc dạng lỏng ............................................................ 10
2. Giới thiệu một số sản phẩm thuốc dạng lỏng tại Pharmedic ................................. 10
III. Quy trình xử lý nước cung cấp cho sản xuất các dạng thuốc dạng lỏng ........... 11
1. Hệ thống xử lí nước ................................................................................................... 11
TÀI LIỆU THAM KHẢO ............................................................................................. 13
TỔNG KẾT .................................................................................................................... 13 iii
DANH MỤC BẢNG
Bảng 1: Giới hạn cho phép thể tích thuốc dạng lỏng .................................................. 2
DANH MỤC HÌNH
Hình 1: Sơ đồ quy trình kiểm nghiệm vi sinh của nhà máy pharmedic ..................... 1
Hình 2: Sơ đồ bố trí dây chuyền sản xuất thuốc dạng lỏng ......................................... 9
Hình 3: Sơ đồ quy trình sản xuất thuốc dạng lỏng ..................................................... 10
Hình 4: Sơ đồ hệ thống xử lí nước ................................................................................ 11 iv
I. QUY TRÌNH KIỂM NGHIỆM VI SINH VÀ CÁC TIÊU CHUẨN CỦA
THUỐC DẠNG LỎNG
1. Quy trình kiểm nghiệm vi sinh thuốc dạng lỏng
Thuốc dạng lỏng có nguy cơ nhiễm khuẩn cao hơn các loại thuốc khác (viên nén, viên nang).
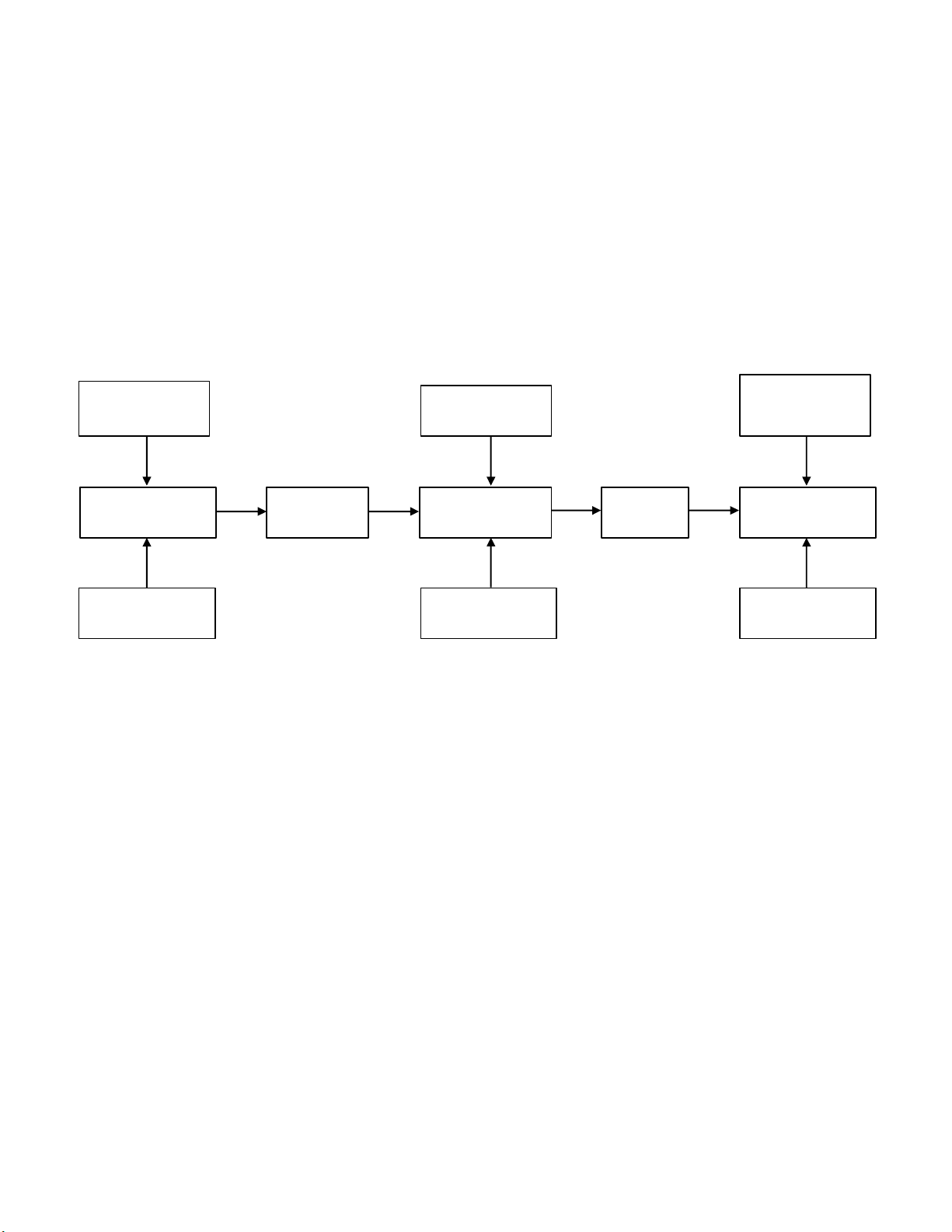
1.1. Sơ đồ quy trình kiểm nghiệm vi sinh của nhà máy pharmedic Vi khuẩn nấm Nhiễm khuẩn Nhiễm khuẩn mốc M ẫu Pha loãng Cấy vi sinh Ủ/tủ ấm Đọc kết quả
Hình 1: Sơ đồ quy trình kiểm nghiệm vi sinh của nhà máy pharmedic Vô trùng Vô trùng Vô trùng
Quy trình gồm 2 phần quan trọng nhất: -
Đo độ vô trùng: thường cần khá nhiều thời gian (khoảng 14 ngày). -
Giới hạn nhiễm khuẩn: để thời gian ngắn (khoảng 2-3 ngày).
Môi trường: thực hiện trong phòng vi sinh được kiểm soát cấp độ sạch, có điều kiện
thích hợp với đời sống của vi khuẩn, không chứa độc tố tiêu diệt vi khuẩn. Phương pháp cấy:
- Cấy màng lọc: dùng cho cấy vô trùng.
- Cấy trộn: đếm tổng số vi sinh vật, cấy trên môi trường đĩa thạch.
- Trải: tìm vi sinh vật gây bệnh.
1.2. Tiêu chuẩn kiểm nghiệm vi sinh -
Thử vô khuẩn: cấy vi sinh vật, cấy ở tất cả các giai đoạn ( từ nơi đem về, nơi sản
xuất , giai đoạn sản xuất cuối cùng,…). 1 -
Thử giới hạn nhiễm khuẩn:
+ Đếm tổng số vi sinh vật: cấy màng lọc , cấy trộn.
+ Tìm vi sinh vật gây bệnh: trải.
2. Các tiêu chuẩn chất lượng của thuốc dạng lỏng
2.1. Các chỉ tiêu chất lượng : -
Tính chất: Gồm thể chất, màu sắc, mùi vị tùy theo từng chuyên luận. Và thông
thường được thử bằng cảm quan. - Độ trong:
+ Thuốc uống dạng dung dịch phải đạt yêu cầu về độ trong theo từng chuyên luận.
+ Các xác định được tiến hành như sau: Dung dịch thuốc phải trong suốt, không có
các tiểu phân quan sát được bằng mắt thường. Hỗn dịch có thể lắng đọng khi để yên
nhưng phải dễ dàng phân tán đồng nhất khi lắc và phải duy trì được sự phân tán đồng
nhất đó trong khi nhỏ thuốc để sử dụng đúng liều. -
Thể tích: Thể tích thuốc phải nằm trong giới hạn cho phép ở bảng sau: Loại thuốc
Thể tích ghi trên nhãn
Giới hạn cho phép
Thuốc dạng lỏng để uống – Tới 20 ml + 10 %
(Dung dịch, hỗn hợp, nhũ – Trên 20 ml đến 50 ml + 8 % dịch, rượu) – Trên 50 ml đến 150 ml + 6 % – Trên 150 ml + 4 % Siro thuốc và cao thuốc – Tới 100 ml + 10 %
– Trên 100 ml đến 250 ml + 8 % – Trên 250 ml + 6 %
Bảng 1: Giới hạn cho phép thể tích thuốc dạng lỏng -
Độ pH: Phải nằm trong giới hạn quy định theo từng chuyên luận riêng. Tiến hành đo pH bằng máy đo pH. - Độ nhiễm khuẩn:
+ Độ nhiễm khuẩn phải đạt giới hạn quy định cho chế phẩm theo từng chuyên luận riêng. 2
+ Nếu không có quy định riêng thì tiến hành thử và đánh giá theo quy định về “thử
giới hạn nhiễm khuẩn”. -
Tạp chất liên quan: giới hạn tạp chất phải đạt giới hạn quy định cho chế phẩm
theo từng chuyên luận riêng. -
Tỷ trọng: Tỷ trọng của chế phẩm phải nằm trong giới hạn quy định cho chế phẩm
theo từng chuyên luận. Được thử theo “Xác định tỷ trọng chất lỏng” – Phụ lục 6.5 – DĐVN IV. -
Độ đồng đều hàm lượng: Một số chế phẩm yêu cầu thì phải tiến hành xác định
độ đồng đều hàm lượng. Hàm lượng hoạt chất dưới 2mg hoặc dưới 2% ( chế phẩm lỏng)
phải thử độ đồng đều hàm lượng. -
Định tính: Tiến hành định tính theo các phương pháp được quy định trong tiêu
chuẩn, chế phẩm thuốc phải cho các phản ứng của các hoạt chất có trong chế phẩm. -
Giới hạn chất bảo quản (bắt buộc nếu có dùng chất bảo quản): theo tiêu chuẩn Mỹ +
Sử dụng cho một số loại thuốc dạng lỏng, thuốc tiêm, thuốc nhỏ mắt cần được vô
trùng, chống lại sự phát triển của nấm mốc, vi khuẩn. +
Các loại chất bảo quản thường dùng: nipasol, nipagin, acid benzoic, acid salicylic,… +
Các chất bảo quản có thể gây ra những tác dụng không mong muốn nghiêm trọng,
vì vậy nồng độ chất bảo quản sử dụng luôn được giới hạn chặt chẽ. +
Tên và hàm lượng các chất bảo quản phải ghi trên nhãn thuốc. - Các tiêu chuẩn khác: +
Khối lượng, kích thước tiểu phân. +
Nội độc tố vi khuẩn chất gây sốt. +
Hàm lượng ethanol, giới hạn methanol, cắn sau bay hơi.
Tùy theo dạng bào chế và thành phần hoạt chất mà mỗi tiêu chuẩn chất lượng của các
loại thuốc dạng lỏng khác nhau sẽ có các phương pháp thử khác nhau để đảm bảo yêu
cầu chất lượng của thuốc. 3
3. Thẩm định quy trình phân tích
Việc thẩm định quy trình phân tích là nhằm chứng minh quy trình đó có phù hợp với
mục đích ứng dụng không.
Thẩm định quy trình phân tích gồm 4 loại quy trình chung sau đây: - Định tính -
Định lượng hàm lượng các tạp chất -
Phép thử giới hạn tạp chất -
Định lượng các hoạt chất trong mẫu nguyên liệu hoặc thành phẩm thuốc hoặc
một hay nhiều thành phần được chọn khác trong thành phẩm thuốc.
Định tính: nhằm để khẳng định sự có mặt của các chất phân tích trong mẫu thử. Thông
thường được thực hiện bằng cách so sánh các kết quả phân tích (ví dụ như : phổ đồ, đáp
ứng sắc ký, phản ứng hoá học, vv. ) của mẫu thử với chất chuẩn.
Phép thử tạp chất: có thể là định lượng hoặc thử giới hạn tạp chất trong mẫu thử,
nhưng đều nhằm mục đích phản ánh chính xác mức độ tinh khiết của mẫu thử. So với
phép thử giới hạn tạp chất thì phép thử định lượng tạp chất còn yêu cầu thêm một số chỉ tiêu thẩm định khác.
Định lượng: nhằm mục đích đo lượng chất phân tích có mặt trong mẫu thử.
Mục đích của quy trình phân tích phải được hiểu rõ ràng vì điều này sẽ quyết định
những chỉ tiêu cần được đánh giá.
Các chỉ tiêu điển hình trong thẩm định cần được xem xét gồm: - Độ đúng - Độ chính xác - Độ lặp lại - Độ chính xác trung gian - Độ tái lặp - Tính đặc hiệu -
Giới hạn phát hiện (DL) -
Giới hạn định lượng (QL) - Tính tuyến tính - Khoảng xác định - Độ thô 4
Ngoài ra việc thẩm định lại quy trình phân tích có thể cần thiết trong các trường hợp dưới đây: -
Thay đổi trong khâu tổng hợp dược chất. -
Thay đổi thành phần của thành phẩm. -
Thay đổi quy trình phân tích.
II. THAM QUAN DÂY CHUYỀN SẢN XUẤT THUỐC DẠNG LỎNG
1. Quy trình sản xuất thuốc theo GMP
Các cơ sở sản xuất dựa theo Bộ nguyên tắc thực hành tốt sản xuất thuốc GMP để tiến
hành đánh giá, thẩm định, kiểm soát các khía cạnh quan trọng trong hoạt động cụ thể
của quá trình sản xuất. Hoạt động này cần được duy trì tiến hành theo định kỳ. Thành
viên của nhóm thanh tra có thể được chỉ định từ nội bộ hoặc người từ cơ sở bên ngoài.
Các yêu cầu cơ bản của GMP là:
- Tất cả các quy trình sản xuất được xác định rõ ràng, được đánh giá một cách hệ
thống theo kinh nghiệm và chứng minh là có khả năng sản xuất một cách nhất quán
dược phẩm đạt yêu cầu chất lượng và phù hợp với tiêu chuẩn;
- Các công đoạn trọng yếu của quá trình sản xuất và những thay đổi đáng kể đối
với quy trình phải được thẩm định;
- Phải cung cấp tất cả các phương tiện cần thiết cho GMP, bao gồm: +
Nhân viên có trình độ chuyên môn và được đào tạo thích hợp; +
Có đủ nhà xưởng và không gian; +
Thiết bị và dịch vụ phù hợp; +
Nguyên liệu, bao bì và nhãn chính xác; +
Các quy trình và hướng dẫn được phê duyệt; +
Bảo quản và vận chuyển phù hợp.
- Các quy trình và hướn dẫn được viết dưới dạng hướng dẫn với ngôn ngữ rõ ràng,
không mơ hồ, có thể áp dụng cụ thể đối với các cơ sở;
- Nhân viên thao tác được huấn luyện để thực hiện đúng quy trình;
- Các ghi chép được thực hiện trong quá trình sản xuất, bằng tay và/hoặc thiết bị
ghi chép chứng minh rằng trong thực tế tất cả các công đoạn quy định của quy trình và
hướng dẫn đều được thực hiện, số lượng và chất lượng sản phẩm là như dự kiến.
- Mọi sự sai lệch đáng kể đều được ghi chép đầy đủ; điều tra với mục đích xác định
nguyên nhân gốc rễ và áp dụng hành động sửa chữa/khắc phục. 5
- Hồ sơ sản xuất bao gồm cả phân phối cho phép truy xuất nguồn gốc lịch sử đầy
đủ của một lô phải được lưu giữ theo mẫu, dễ hiểu và dễ tiếp cận;
- Việc phân phối (bán buôn) sản phẩm phải hạn chế mọi nguy cơ với chất lượng
sản phẩm và tính đến sự phù hợp với Thực hành tốt phân phối thuốc (GDP);
- Có một hệ thống để thu hồi bất cứ lô sản phẩm nào, đã bán ra hoặc cung cấp;
- Mọi khiếu nại về sản phẩm lưu hành trên thị trường phải được kiểm tra, điều tra
nguyên nhân khiếm khuyết chất lượng và thực hiện các biện pháp thích hợp đối với sản
phẩm bị lỗi để phòng ngừa việc tái xảy ra.
2. Quy trình sản xuất thuốc dạng lỏng
2.1. Yêu cầu chung Nhân viên: -
Trước khi vào khu vực sản xuất thuốc, nhân viên nhà máy phải rửa tay bằng xà
phòng, sấy khô, trang bị đầy đủ quần áo bảo hộ, đội mũ che kín tai, đeo khẩu trang y tế
(mới hoàn toàn, chưa qua sử dụng), mang ủng nilon. -
Quần áo bảo hộ sau khi sử dụng được đựng trong rổ chứa đậy kín đến khi được giặt sạch. -
Nhân viên khi đi vào xưởng phải ngồi lên bục, nhấc chân lên và xoay người 180o để vào cửa. -
Không sử dụng điện thoại quay phim, chụp ảnh trong khu vực sản xuất thuốc nói
riêng và nhà máy nói chung. -
Không ăn uống, hút thuốc trong khu vực sản xuất. -
Khu vực sản xuất ngăn cách với khu vực ngoài bằng cửa airlock (hệ thống đặt
cạnh phòng sạch nhằm ngăn cách việc hỗn loạn không khí giữa các phòng sạch có cấp
sạch khác nhau hoặc ngăn không khí trong phòng sạch với không khí ngoài khu vực đi
lại bình thường), từ đó giúp ngăn ngừa việc lây nhiễm chéo không khí giữa các vùng kiểm soát với nhau.
- Nhân viên phải bước qua hai lớp cửa airlock mới có thể vào bên trong khu vực
sản xuất. Hệ thống không cho phép mở một lúc cả hai cửa. Khi người bên ngoài đi vào
thì không khí chưa sạch sẽ đi vào airlock trước và được xử lí bằng quạt hút và bộ lọc.
Khi người đó mở cửa thứ 2 (sau khi cửa thứ nhất đã đóng) thì không khí bên trong khu
vực sản xuất sẽ đẩy ra ngoài do chênh lệch áp suất, giảm thiểu tối đa sự nhiễm từ khu 6
vực bên ngoài do lớp không khí trong airlock đã được lọc sơ bộ và không bị gió từ bên
ngoài thổi vào gây xáo trộn không khí. Nguyên liệu, bao bì: -
Nguyên liệu trước khi đưa vào sản xuất cần phải đạt tiêu chuẩn chất lượng. -
Nguyên liệu được đưa vào xưởng sản xuất theo con đường riêng biệt bằng tủ
trung chuyển: pass-box (là một trong những thiết bị phòng sạch) và được lưu ở phòng
biệt trữ (khu vực bảo quản cần đảm bảo thoáng mát khô ráo và được thông khí tốt, có
kiểm soát về nhiệt độ và độ ẩm, được sắp xếp có hệ thống). -
Nhân viên vận hành máy không được tiếp xúc trực tiếp bằng tay vào các nguyên liệu ban đầu. -
Nguyên liệu bắt buộc di chuyển một chiều, tuyệt đối không di chuyển ngược lại tránh nhiễm chéo. -
Bao bì có 2 loại : bao bì cấp 1 (vỉ nhôm, lọ) và bao bì cấp 2 (hộp giấy). Bao bì
cũng cần đảm bảo đầy đủ các tiêu chuẩn về nhiệt độ, độ ẩm,… Thiết bị: -
Thiết bị được bố trí, thiết kế phù hợp các thao tác sẽ thực hiện nhằm mục đích
giảm tối đa nguy cơ sai sót và cho phép làm vệ sinh và bảo dưỡng có hiệu quả, tránh
nhiễm chéo, tích tụ bụi và bẩn, tránh những tác động bất lợi đối với chất lượng sản phẩm. -
Các thiết bị phải được kiểm tra, hiệu chuẩn theo lịch, có sổ theo dõi cẩn thận. -
Máy và trang thiết bị hỏng, không sử dụng cần được chuyển ra khỏi khu vực sản
xuất và kiểm tra chất lượng. Nếu không chuyển ra ngoài được, phải đánh dấu hoặc dán
nhãn ghi rõ là đã hỏng, đề phòng vô ý sử dụng. Khu vực sản xuất: -
Nhà xưởng được bố trí theo nguyên tắc 1 chiều: Nguyên liệu → Bán thành phẩm → Thành phẩm. -
Các khu nối tiếp nhau tương ứng với giai đoạn sản xuất (có sự ngăn cách giữa các khu). -
Đường đi của người và đường đi của nguyên liệu là 2 đường riêng biệt. -
Những nơi sản xuất khác nhau có quy định tiêu chuẩn về cấp sạch của phòng khác nhau: 7
+ Cấp sạch B: thuốc tiêm, dịch truyền.
+ Cấp sạch A: thuốc nhỏ mắt. -
Giữa 2 môi trường cấp độ sạch khác nhau được ngăn bởi airlock và có sự chênh
lệch áp suất (áp suất phòng cấp sạch bậc cao lớn hơn áp suất phòng cấp sạch bậc thấp hơn). -
Máy móc thiết bị và nguyên vật liệu được sắp xếp hợp lý, hạn chế tối đa sự sai
sót và nhầm lẫn, tránh nhiễm chéo giữa các nguyên vật liệu và thành phẩm. -
Khu vực đủ sáng, thông gió tốt, có thiết bị lọc không khí (lỗ cấp khí trên trần và
thu hồi khí ở tường dưới đất), có thiết bị kiểm soát nhiệt độ, độ ẩm. -
Nguyên vật liệu bao gói trực tiếp và sản phẩm trung gian, bán thành phẩm tiếp
xúc với môi trường, bề mặt bên trong phải nhẵn và không có kẽ nứt. -
Tường được sơn Epoxy chống bám bụi, chống thấm nước. Góc chân tường (nơi
tiếp giáp giữa tường và sàn) được thiết kế bo tròn để dễ dàng làm sạch. -
Trần phân xưởng khá thấp để tiết kiệm năng lượng cho việc điều hòa nhiệt độ,
tạo áp suất và lọc không khí. -
Được trang bị hệ thống lọc khí tuần hoàn (cấp trên và hồi dưới). -
Nhiệt độ duy trì ở mức 30°C. -
Tường và nền được tráng polymer hạn chế được sự tích tụ bụi và dễ vệ sinh. -
Môi trường bên trong khu vực sản xuất có áp suất thấp hơn bên ngoài hành lang
(sản xuất thuốc dạng lỏng ngược với các dạng bào chế khác). Thành phẩm: -
Bán thành phẩm sau khi được đóng gói cấp 1 sẽ được vận chuyển trên dây chuyền
đến nơi đóng gói cấp 2 và trở thành thành phẩm. Thành phẩm sau đó được đưa qua khu
kiểm nghiệm chờ kiểm nghiệm. -
Trước khi đưa qua khu khác, thành phẩm và bán thành phẩm sẽ được lưu trong
khu vực biệt trữ có dán nhãn nhận biết: +
Nhãn xanh lá: đạt yêu cầu đảm bảo chất lượng, có thể chuyển sang giai đoạn tiếp theo. +
Nhãn vàng: chờ kiểm định. +
Nhãn đỏ: không đảm bảo chất lượng, chờ tiêu hủy. 8
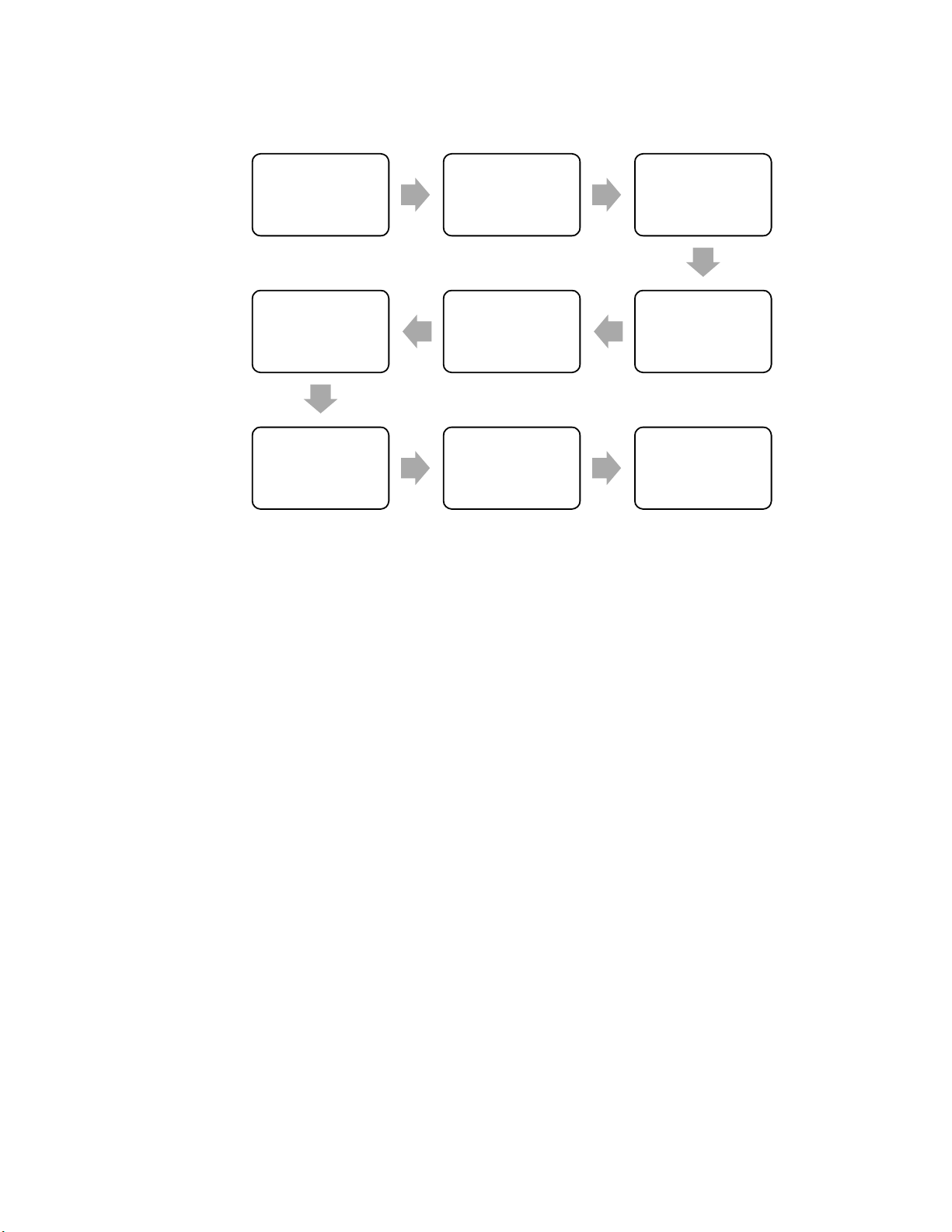
2.2. Sơ đồ bố trí dây chuyền sản xuất thuốc dạng lỏng Cân nguyên liệu Bơm nước Bồn pha trộn Thiết bị tiệt Thiết bị chiết Thiết bị lọc trùng rót dung dịch Kiểm tra độ Đóng hộp, trong Dán nhãn nhập kho
Hình 2: Sơ đồ bố trí dây chuyền sản xuất thuốc dạng lỏng 9
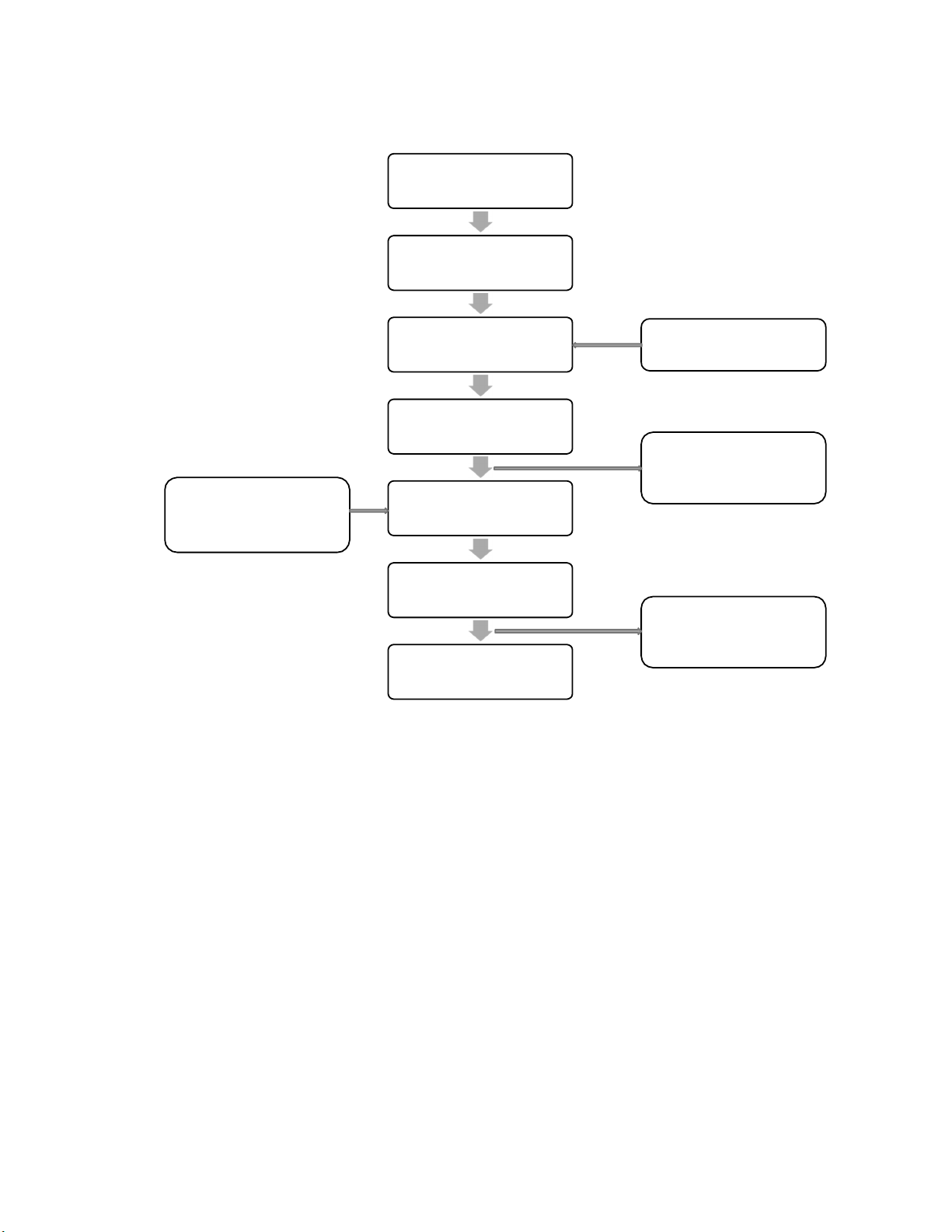
2.3. Sơ đồ quy trình sản xuất thuốc dạng lỏng Kiểm tra vệ sinh, thiết bị, nguyên liệu,... Cân nguyên liệu Hòa tan Nước tinh khiết Lọc trong Kiểm bán thành phẩm Chai, nắp kiểm tra Đóng chai, tiệt trùng đạt tiêu chuẩn Vào hộp, đóng kiện Kiểm bán thành phẩm Nhập kho
Hình 3: Sơ đồ quy trình sản xuất thuốc dạng lỏng
2. Giới thiệu một số sản phẩm thuốc dạng lỏng tại Pharmedic
- Dung Dịch Vệ Sinh Phụ Nữ Gynofar - Povidine
- Chlofast nước súc miệng kháng khuẩn
- Vệ sinh mũi dạng xịt Nacofar
- Dung dịch uống cemofar 10%
- Nước mắt nhân tạo Cooldrop - Siro trẻ em Farzincol
- Thuốc nhỏ mắt, nhỏ mũi Natri clorid 0,9%
- Thuốc rửa mắt chống mỏi mắt Optamedic - Thuốc nhỏ mũi Xylofar
- Dung dịch uống Vitarals. 10
III. Quy trình xử lý nước cung cấp cho sản xuất các dạng thuốc dạng lỏng
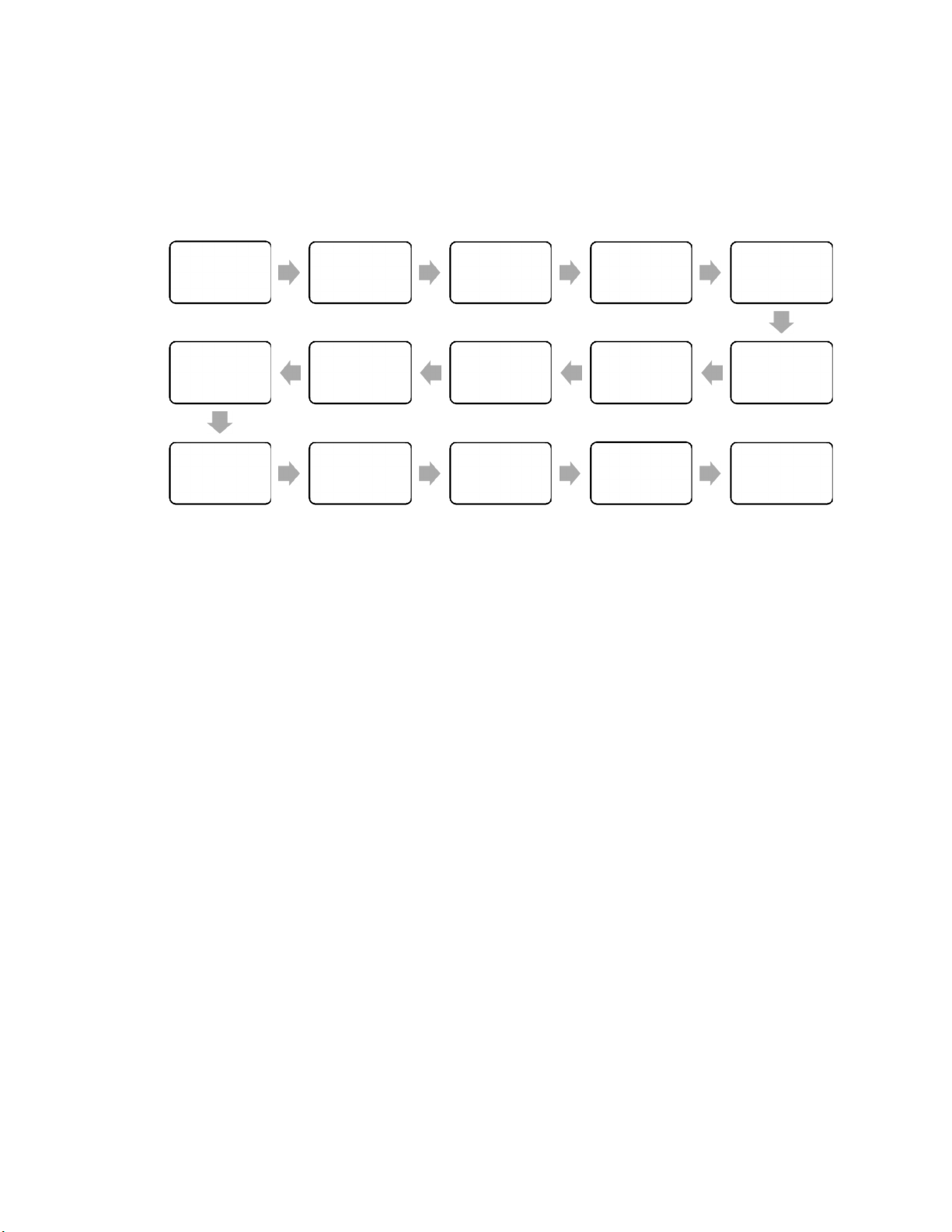
1. Hệ thống xử lí nước Nước thủy cục hoặc Bồn chứa nước giếng nước thô Bơm Lọc cát Lọc than Bồn chứa Hệ RO2 Hệ RO1 nước mềm Lọc tinh Làm mềm Bồn chứa Hệ DI Đo độ dẫn Điểm sử điện online Đèn UV nước tinh khiết dụng
Hình 4: Sơ đồ hệ thống xử lí nước
Nước thủy cục hoặc nước giếng được bơm lên bồn chứa nước thô, tại đây các kim
loại sẽ được tủa lại.
Sau đó lượng nước thô này sẽ được bơm đưa vào hệ thống tiền xử lý bao gồm các
lọc: lọc cát, lọc than, làm mềm và lọc tinh:
- Lọc cát (MMF): vật liệu lọc bằng cát, sỏi, loại bỏ các kim loại nặng như Fe2+ , Mn2+ ,…
- Lọc than hoạt tính (GAC): vật liệu lọc bằng than, tại đây nước được khử mùi,
khử màu, loại bỏ các chất hữu cơ.
- Làm mềm (SFT): vật liệu là hạt nhựa trao đổi ion, giúp làm mềm nước, loại bỏ
các thành phần làm tăng độ cứng của nước như Ca2+ , Mg2+ ,…
- Lọc tinh (CTF): vật liệu là những lõi lọc có kích thước 5-10μm, tất cả các cặn
bẩn có kích thước lớn hơn 5μm đều được giữ lại.
Giai đoạn này giúp loại bỏ các tạp chất có kích thước lớn, các hạt lơ lửng trong nước,
hấp phụ Clo dư thừa để ngăn chặn sự oxy hóa, tránh làm hỏng hệ RO lúc sau. Đồng thời
giai đoạn này cũng cải thiện phần lớn độ đục của nước. 11
Tiếp theo nước được đưa đến bồn chứa nước mềm, bồn này thường được làm bằng thép không gỉ.
Sau đó nước mềm được đưa đến hệ thống lọc thẩm thấu ngược RO 2 cấp. Đây là hệ
thống khử muối quan trọng, đồng thời giúp loại bỏ vi khuẩn, virus và nguồn nhiệt.
Nước tiếp tục được đưa đến hệ thống DI – hệ thống khử các ion khoáng, sử dụng vật
liệu là hạt nhựa trao đổi ion để loại bỏ các ion trong nước, tạo ra nước thành phẩm có
độ dẫn điện thấp, được đo bằng hệ thống đo độ dẫn điện online.
Nước đạt yêu cầu về độ dẫn điện sẽ được đưa qua hệ thống đèn diệt khuẩn UV rồi
vào bồn chứa nước tinh khiết, và cuối cùng được đưa đến điểm sử dụng. 12
TÀI LIỆU THAM KHẢO
Thông tư số 35/2018/TT-BYT của bộ y tế
Thông tư số 09/2010/TT-BYT của bộ y tế Dược điển Việt Nam V TỔNG KẾT
Để xây dựng một quy trình sản xuất thuốc, cụ thể là thuốc dạng lỏng, nhà sản xuất
cần đáp ứng đầy đủ những yêu cầu chung về tiêu chuẩn chất lượng thuốc, cơ sở sản
xuất,… được quy định trong Dược điển Việt Nam, tiêu chuẩn của Cục Quản lí Dược,
tiêu chuẩn GMP hoặc các Dược điển tham chiếu như Dược điển Châu Âu, Hoa Kỳ,…
Trong quá trình sản xuất, các nhà máy cần có những quy định về vị trí đặt nhà máy,
thiết kế, loại nguyên vật liệu để xây dựng nhà xưởng, thiết bị phù hợp để tạo ra những
sản phẩm đạt chất lượng, hạn chế tối đa việc nhiễm khuẩn, sai sót dẫn đến việc gây hại cho người sử dụng.
Cục Quản lý Dược và Cục Quản lý Y, Dược cổ truyền có trách nhiệm thẩm định,
đánh giá một đơn vị sản xuất thuốc, nguyên liệu làm thuốc có đạt tiêu chuẩn GMP hay
không. Trong đó, Cục Quản lý Y, Dược cổ truyền thẩm định đối với cơ sở sản xuất đề
nghị cấp Giấy chứng nhận đủ điều kiện kinh doanh dược với phạm vi chỉ sản xuất dược
liệu, thuốc cổ truyền, vị thuốc cổ truyền; Cục Quản lý Dược thẩm định các hồ sơ đề nghị
cấp Giấy chứng nhận đủ điều kiện kinh doanh dược với phạm vi sản xuất nguyên liệu
làm thuốc (không bao gồm dược liệu), thuốc hóa dược, thuốc dược liệu, vắc xin, sinh phẩm. 13




