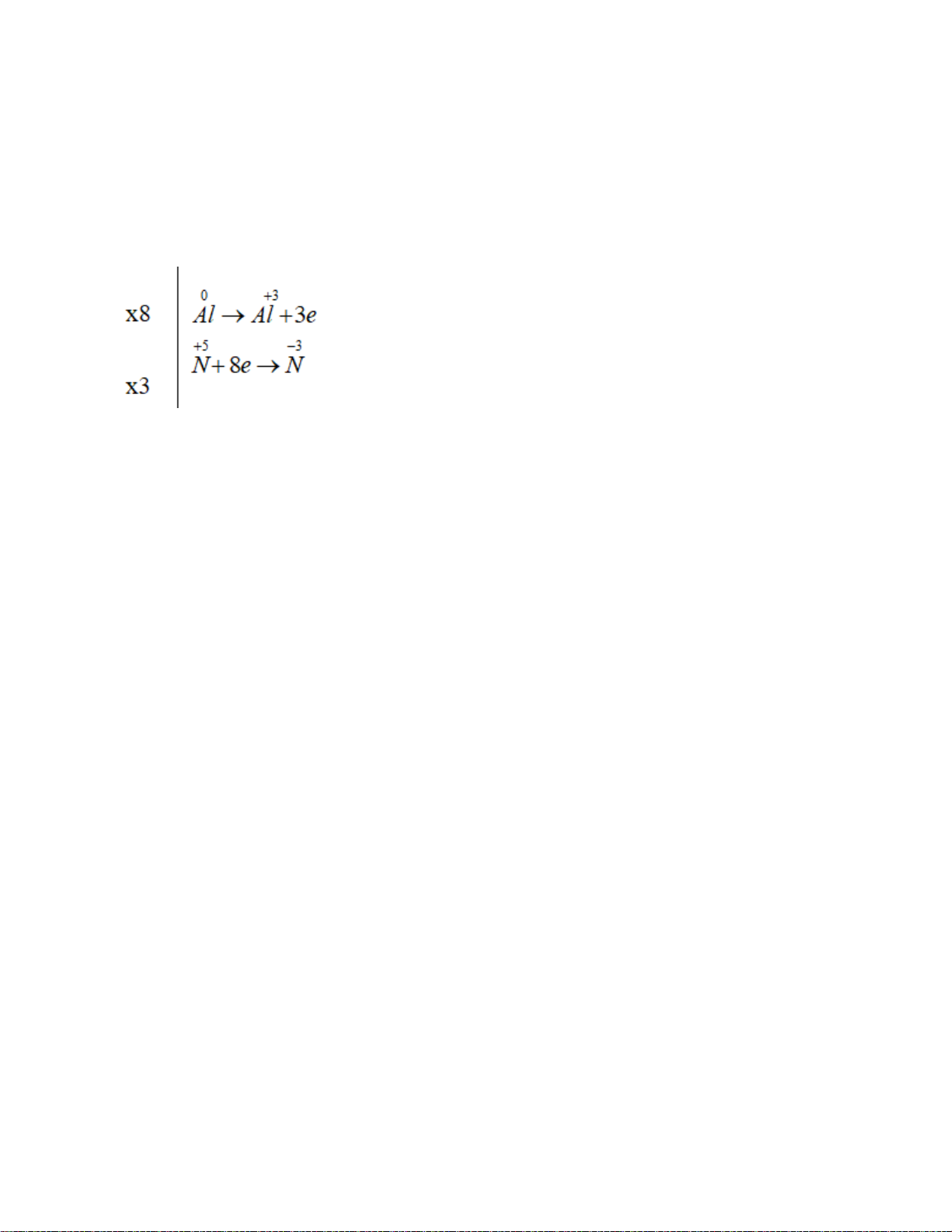





Preview text:
Cân bằng phản ứng Al + HNO3 → Al(NO3)3 + NH4NO3 + H2O và bài tập
1. Căn bằng hóa học Al + HNO3 -> Al(NO3)3 + NH4NO3 + H2O
Cân bằng hóa học Al + HNO3 -> Al(NO3)3 + NH4NO3 + H2O
Nhôm + Axit Nitric = Nhôm Nitrat + Nitrat Amoni + Nước
=> 8Al + 30HNO3→ 8Al(NO3)3 + 3NH4NO3 + 9H2O
Như vậy thì hệ số cân bằng là số nguyên, số tố giản của các chất trong sản phẩm lần lượt là 8,3 và 0
Còn hệ số cân bằng trong các chất tham gia là 8 và 3.
2. Một số bài tập về cân bằng hóa học
Bài tập 1: Cân bằng hóa học
a) Cân bằng phản ứng cháy của methane (CH4) trong không khí để tạo ra CO2 và H2O: CH4 + O2 -> CO2 + H2O
b) Cân bằng phản ứng tạo nước (hydrogenation) của ethene (C2H4) để tạo ra ethane (C2H6): C2H4 + H2 -> C2H6
c) Cân bằng phản ứng tạo amoniac (NH3) từ nitro sunfat (HNO3) và hydrogen (H2): HNO3 + H2 -> NH3 + H2O
d) Cân bằng phản ứng phân huỷ nước (hydrolysis) của natri sunfat (Na2SO4) để tạo ra natri
hydroxide (NaOH) và axit sulfuric (H2SO4):
Na2SO4 + H2O -> NaOH + H2SO4
e) Cân bằng phản ứng tạo sắt(III) oxit (Fe2O3) từ sắt (Fe) và oxi (O2): 4Fe + 3O2 -> 2Fe2O3
f) Cân bằng phản ứng tạo nước với bảo toàn khối lượng: 2H2 + O2 -> 2H2O
g) Cân bằng phản ứng tạo amoniac từ nitro sunfat, có sự hiện diện của bảo toàn khối lượng: 2HNO3 + 3H2 -> 2NH3 + 4H2O
h) Cân bằng phản ứng tạo sulfur dioxide (SO2) từ sunfat (SO3) và nước: SO3 + H2O -> H2SO4
i) Cân bằng phản ứng tạo dinitrogen pentoxide (N2O5) từ dinitrogen tetroxide (N2O4) và oxi (O2): N2O4 + O2 -> 2N2O5
k) Cân bằng phản ứng tạo kali chlorat (KClO3) từ kali chlorua (KCl) và oxi (O2): 4KCl + 3O2 -> 2KClO3
Bài tập 2: Hãy viết biểu thức cân bằng cho phản ứng cháy hoàn toàn etanol (C2H5OH) thành
CO2 và H2O, và sau đó tính số mol CO2 và H2O tạo ra khi bạn đốt cháy 5 mol etanol. Giải quyết:
Viết biểu thức cân bằng cho phản ứng: C2H5OH + 3 O2 → 2 CO2 + 3 H2O
Tìm tỷ số số mol của CO2 và H2O so với etanol trong biểu thức cân bằng.
Sử dụng số mol etanol đã cho để tính số mol CO2 và H2O.
Bài tập 3: Cho phản ứng sau: N2 + 3H2 → 2NH3 Nếu bạn có 4 mol N2 và 12 mol H2, hãy tính số
mol NH3 tạo ra sau phản ứng. Giải quyết:
iết biểu thức cân bằng cho phản ứng.
Tìm tỷ số số mol của NH3 so với N2 trong biểu thức cân bằng.
Sử dụng số mol của N2 đã cho để tính số mol NH3 tạo ra.
Bài tập 4: Cho phản ứng sau: CH4 + 2 O2 → CO2 + 2 H2O Hãy tính số mol CO2 tạo ra nếu bạn có
10 mol CH4 và đủ lượng O2. Giải quyết:
Viết biểu thức cân bằng cho phản ứng.
Tìm tỷ số số mol của CO2 so với CH4 trong biểu thức cân bằng.
Sử dụng số mol CH4 đã cho để tính số mol CO2 tạo ra.
Bài tập 5: Một hợp chất AX2 phân hủy thành A và X2. Nếu bạn có 5 mol hợp chất AX2, hãy tính
số mol của A và X2 tạo ra sau phản ứng phân hủy. Giải quyết:
Viết biểu thức cân bằng cho phản ứng phân hủy.
Tìm tỷ số số mol của A và X2 so với AX2 trong biểu thức cân bằng.
Sử dụng số mol AX2 đã cho để tính số mol của A và X2 tạo ra.
Bài tập 6: Tiến hành thí nghiệm nhỏ từ từ cho đến dư dung dịch NaOH vào dung dịch AlCl3 hiện tượng xảy ra là
A. Có kết tủa keo trắng, sau đó kết tủa tan.
B. Chi ̉ có kết tủa keo trắng.
C. Có kết tủa keo trắng và khi ́ bay lên.
D. Không có kết tủa, có khi ́ bay lên.
Tiến hành nhỏ từ từ cho đến dư dung di ̣ch NaOH vào dung di ̣ch AlCl3, ban đầu có kết tủa keo trắng xuất hiện.
3NaOH + AlCl3 → Al(OH)3 ↓ + 3NaCl
Sau đó thì kết tủa keo trắng tan trong NaOH dư tạo dung di ̣ch trong suốt (vì Al(OH)3 có tính
lưỡng tính tan được trong dung dịch axit dư, và kiềm dư)
NaOH + Al(OH)3 → NaAlO2 + 2H2O
Câu 7: Cân bằng Mg + H2SO4 → MgSO4 + H2S + H2O
Bây giờ chúng ta sẽ sử dụng hệ số để cân bằng phản ứng và sau đó tính số phân tử H2O tạo
thành. Để cân bằng phản ứng, chúng ta có thể thêm các hệ số thích hợp:
Mg + H2SO4 → MgSO4 + H2S + H2O
Hãy thử sử dụng hệ số sau để cân bằng phản ứng:
Mg + H2SO4 → MgSO4 + H2S + H2O 1 1 1 1 1
Bây giờ hãy kiểm tra xem số nguyên tử của mỗi nguyên tố có cân bằng không:
Magiê (Mg): 1 nguyên tử (trái) = 1 nguyên tử (phải)
Hydro (H): 2 nguyên tử (trái) = 2 nguyên tử (phải)
Lưu huỳnh (S): 1 nguyên tử (trái) = 1 nguyên tử (phải)
Oxy (O): 4 nguyên tử (trái) = 1 nguyên tử (phải)
Nhưng theo biểu thức cân bằng trên, số nguyên tử oxy (O) trái và phải không cân bằng. Vậy
chúng ta cần điều chỉnh hệ số của H2O để cân bằng số nguyên tử oxy (O). Chúng ta có thể sử
dụng hệ số 4 cho H2O để đảm bảo cân bằng oxy:
Mg + H2SO4 → MgSO4 + H2S + 4H2O 1 1 1 1 4
Bây giờ, số nguyên tử của mỗi nguyên tố đã cân bằng:
Magiê (Mg): 1 nguyên tử (trái) = 1 nguyên tử (phải)
Hydro (H): 2 nguyên tử (trái) = 2 nguyên tử (phải)
Lưu huỳnh (S): 1 nguyên tử (trái) = 1 nguyên tử (phải)
Oxy (O): 4 nguyên tử (trái) = 4 nguyên tử (phải)
Vậy khi hệ số cân bằng là nguyên và tối giản, số phân tử H2O tạo thành là 4.
3. Hướng dẫn cân bằng hóa học
Cân bằng hóa học là quá trình điều chỉnh số lượng các chất tham gia trong một phản ứng hóa
học để đảm bảo rằng tỷ lệ giữa các chất đã tham gia và các sản phẩm đã tạo ra là đúng theo
phương trình phản ứng hóa học. Để làm điều này, bạn cần thực hiện các bước sau:
Viết phương trình phản ứng: Bắt đầu bằng việc viết phương trình phản ứng hóa học cho
phương trình muốn cân bằng. Đảm bảo rằng bạn đã viết đúng công thức cho tất cả các chất tham gia và sản phẩm.
Đếm số lượng nguyên tử: Đếm số nguyên tử của mỗi nguyên tố trong phản ứng. Điều này sẽ
giúp bạn xác định số lượng tối thiểu của mỗi chất tham gia để cân bằng phản ứng.
Sử dụng hệ số: Thêm hệ số vào trước các chất tham gia và sản phẩm trong phản ứng để đảm
bảo số nguyên tử của mỗi nguyên tố cân bằng trên cả hai bên của phương trình. Bạn có thể sử
dụng hệ số nguyên tố hoặc hệ số phân tử.
Kiểm tra cân bằng: Kiểm tra xem phản ứng đã cân bằng chưa bằng cách kiểm tra số nguyên tử
của mỗi nguyên tố ở cả hai bên của phản ứng. Nếu chưa cân bằng, điều chỉnh hệ số cho đến khi cân bằng.
Kiểm tra lại: Sau khi điều chỉnh hệ số, hãy kiểm tra lại phản ứng để đảm bảng rằng tất cả các
chất tham gia và sản phẩm đều cân bằng với nhau.
Kiểm tra quy luật bảo toàn khối lượng: Đảm bảo rằng tổng khối lượng các chất tham gia bằng
tổng khối lượng các sản phẩm. Điều này là do nguyên tắc bảo toàn khối lượng.
Ghi nhớ cân bằng: Nhớ luật cân bằng hóa học, đó là số lượng các nguyên tử và khối lượng phải
được bảo toàn trong phản ứng.
Ví dụ: Phản ứng: C3H8 + O2 -> CO2 + H2O Đếm số nguyên tử: C: 3(C) = 3 H: 8(H) = 8
O: 2(O) (trong C3H8) + 2(O) (trong O2) = 4
Để cân bằng O2, bạn có thể thêm hệ số 5 trước O2 để đảm bảo số nguyên tử O bằng nhau: C3H8 + 5O2 -> 3CO2 + 4H2O
Ví dụ 2: Cân bằng phản ứng cháy etanol (C2H5OH) thành CO2 và H2O: Phản ứng không cân
bằng ban đầu: C2H5OH + O2 → CO2 + H2O
Bước 1: Xác định số nguyên tử của mỗi nguyên tố trong mỗi phân tử tham gia và sản phẩm.
C2H5OH: Có 2 nguyên tử carbon (C), 6 nguyên tử hydro (H), 1 nguyên tử oxy (O).
CO2: Có 1 nguyên tử carbon (C), 2 nguyên tử oxy (O).
H2O: Có 2 nguyên tử hydro (H), 1 nguyên tử oxy (O).
O2: Có 2 nguyên tử oxy (O).
Bước 2: Xác định số nguyên tử của mỗi nguyên tố trên cả hai bên của phương trình.
Carbon (C): 2 nguyên tử (trái) = 1 nguyên tử (phải).
Hydro (H): 6 nguyên tử (trái) = 2 nguyên tử (phải).
Oxygen (O): 1 nguyên tử (trái) + 2 nguyên tử (trái) = 2 nguyên tử (phải).
Bước 3: Sử dụng hệ số để cân bằng số nguyên tử trên cả hai bên của phản ứng.
Phản ứng cân bằng: C2H5OH + 3 O2 → 2 CO2 + 3 H2O
Sau đó, kiểm tra lại để đảm bảo tất cả các nguyên tử cân bằng và kiểm tra quy luật bảo toàn
khối lượng. Hãy luyện tập thường xuyên để trở thành một người làm phản ứng hóa học thành thạo.




