


Preview text:
Cân bằng phản ứng sau: Al + H2SO4 → Al2(SO4)3 + SO2 + H2O
1. Lý thuyết phương trình hóa học
- Định nghĩa: Phương trình hóa học là phương trình biểu diễn ngắn gọn phản ứng hóa học
Ví dụ: Phương trình chữ của phán ứng hóa học giữa khi Hydro và khí Oxi tạo ra nước là
Khí Hydro + khí Oxi -> nước
Khi thay tên chất bằng công thức hóa học ta được sơ đồ của phản ứng hóa học : H2 + O2 ---> H2O
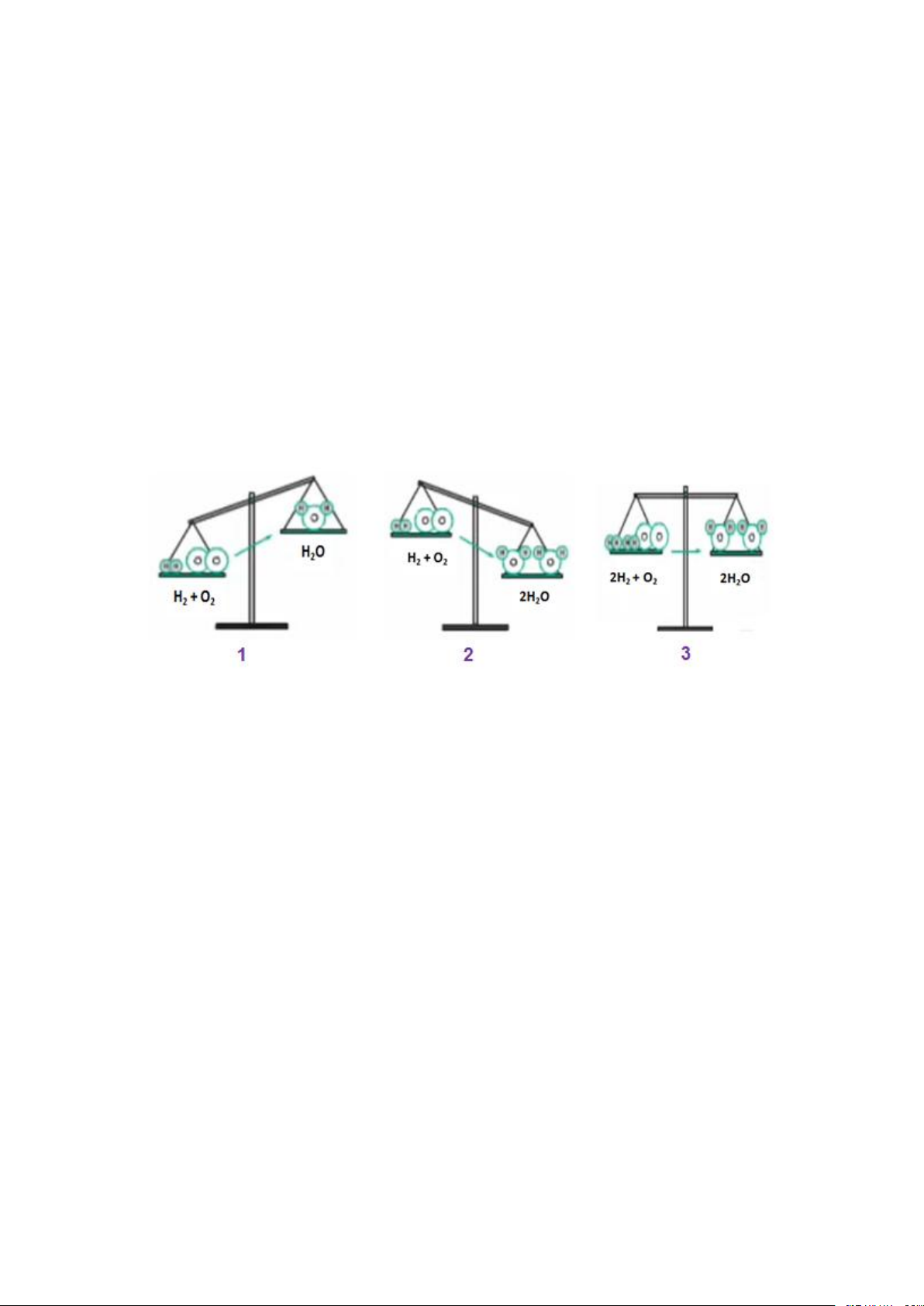
- Ở hình 1 : nếu sơ đồ phản ứng H2 + O2 ---> H2O thì :
+ Vế trái có 2 nguyên tử H và 2 nguyên tử O
+ Vế phải có 2 nguyên tử H và 1 nguyên tử O
=> Vế trái có khối lượng lớn hơn 1 nguyên tử O
- Ở hình 2 : Nếu vế trái nhều hơn vế phải 1 nguyên tử O thù ta thêm hệ số 2
trược vế phảu, lúc này được :
+ Vế trái : 2 nguyên tử H và 2 nguyên tử O
+ Vế phải : 4 nguyên từ H và 2 nguyên từ o
=> Vế phải có khối lượng lớn hơn , do hơn 2 nguyên tử H
- Ở hình 3 : Ta thêm hệ số 2 vào trước H2 và H2O
+ Vế trái : 4 nguyên tử H và 2 nguyên tử O
+ Vế phải : 4 nguyên tử H và 2 nguyên tử O
=> Khối lượng của 2 vế đã bằng nhau, số nguyên tử của mỗi nguyên tố đã
bằng nhau. Phương trình hóa học của phản ứng được viết đúng như sau : 2H2 + O 2 ---> 2H2O
2. Các bước thực hiện lập phương trình hóa học
- Bước 1: Viết sơ đồ phản ứng, gồm công thức hóa học của chất tham gia, sản phẩm .
- Bước 2 : Căng bằng số nguyên tử mỗi nguyên tố : tìm hệ số thích hợp đặt
trước các công thức sao cho số nguyên tử của các nguyên tố ở chất tham gia
và chất tạo thành bằng nhau .
- Bước 3 : Viết thành phương trình hóa học hoàn chỉnh. Chú ý :
- Không được thay đổi các chỉ số trong công thức hóa học đã viết đúng . Ví
dụ như 3O2 ( đúng ) chuyển thành 6O ( là sai ) .
- Viết hệ số cao bằng ký hiệu hóa học. Ví dụ : 2Al , 3 Fe, (đúng ) , không viết 2Al ; 3Fe ( sai )
- Trong các công thức hóa học có các nhóm nguyên từ như OH, SO4 , .... thì
coi cả nhóm đó như một đơn vị để cân bằng trước và sau phản ứng số nhóm
nguyên tử phải bằng nhau .
Ví dụ : Lập phương trình hóa học cho phản ứng hóa học sau : photpho + oxi -
--> điphotpho pentaoxit ( P2O5 )
Hướng dẫn cách cân bằng phương trình trên
- Bước 1 : Thay tên chất bằng ký hiệu hóa học của chất đó : P + O2 ----> P2O5
- Bước 2: Đặt hệ số thích hợp trược từng công thức, ta thấy số nguyên tử P
và O đều chưa bằng nhau, nhưng nguyên tố oxi có số nguyên tử nhiều hơn
số nguyên từ photpho. Ta bắt đầu từ nguyên tố này. Trước hết ta làm chẵn
số nguyên tử O ở bên phải, đặt hệ số 2 trước P2O5 thì ta được: P + O2 ---> 2P2O5
Bên trái cần có 4 P và 10 hay 5O2, các hệ số 4 và 5 là thích hợp
- Bước 3: Viết lại phương trình hóa học : 4P + 5O2 ---> 2P2O5
3. Các cách cân bằng phương trình hóa học
Cách 1 : Phương pháp cân bằng phương trình hóa học theo nguyên từ nguyên tố
- Đây là cách cân bằng phương trình hóa học đơn giản nhất mà các em có
thể dễ dàng áp dụng. Nếu làm nhiều, các em chỉ nhìn là biết được đáp án với cách cân bằng này
- Các bước để cân bằng:
+ Bước 1: viết lại phương trình duwois dạng nguyên tử riêng biệt như H2, O2
+ Bước 2: Lập luận số nguyên tử theo thành phần của chất sản phẩm.
+ Bước 3: Viết lại đúng bản chất của các chất tham gia
Ví dụ : Cân bằng phương trình hóa học sau : P + O2 ---> P2O5
- Ta viết : P + O ---> P2O5
- Lập luận: để tại thành 1 phân tử P2O5 cần 2 nguyên tử P và 5 nguyên tử O, do đó 2P + 5O ---> P2O5
- Phân tích : Phân tử oxi luôn tồn tại gồm 2 nguyên tử, nếu ta lấy 5 phân tử
oxi tứ là số nguyên tử oxi tăng lên gấp 2 thì số nguyên tử P và số nguyên tử
P2O5 cũng tăng lên gấp 2 lần tức là cần 4 nguyên tử P và 2 phân tử P2O5
- Cuối cùng : ta có phương trình hóa học : 4P + 5O2 ---> 2P2O5
Cách 2: Cân bằng phương trình hóa học bằng phương pháp chẵn lẻ
- Có thể thấy, nếu một phương trình đã được cân bằng thì tổng số nguyên tử
của một nguyên tố ở vế trái bằng với vế phải. Chính vì vậy, số nguyên tử
nguyên tố này ở vế trái là số chẵn thì tổng số nguyên tử nguyên tố đó ở vế
phải cũng là số chẵn. Khi đó, số nguyên tử nguyên tố ở vế trái là số lẻ thì số
nguyên tử của nguyên tố đó ở vế phải được nhân đoi lên. Sau đó , ta sẽ cân
bằng tiếp các hệ số còn lại
Ví dụ : Cân bằng phương trình : FeS2 + O2 ---> Fe2O3 + SO2
- Xét thấy, ở vế trái hiện đang có 2 nguyên tử O2 luôn chẵn với bất kỳ hệ số
nào, Trong khi vế bên phải, oxi trong SO2 chẵn nhưng trong Fe2O3 lại là lẻ,
do đó chúng ta cần nhân đôi số nguyên tử oxi trong Fe2O3
- Sau đó, cân bằng thêm các hệ số còn lại, ta được : 4 FeS2 + 11O2 ---> 2Fe2O3 + 11O2
Cách 3 : Phương pháp cân bằng phương trình hóa học dựa trên nguyên tố chung nhất .
- Cách cân bằng phương trình hóa học này cũng rất dễ áp dụng, các em sẽ
bắt dầu cân bằng hệ số của phân tử có chứa nguyên tố xuất hiện nhiều nhất
trong phản ứng, sau đó cân bằng lại hệ số còn lại .
Ví dụ: Cân bằng phản ứng : Cu + HNO3 ----> Cu ( NO3)2 + NO + H2O
- Ta thấy, trong phản ứng trên, nguyên tố xuất hiện nhiều nhất là nguyên tố
oxi, do vậy, ta sẽ bắt đầu cân bằng số các nguyên tố nguyên tử oxi trước. Vế
trái hiện có 3 nguyên tử oxi, vế phải có 8 nên sẽ lấy bội chung của 3 và 8 là
24, suy ra hệ số của HNO3 là 24 : 3 = 8
- Kế đến, tiến hành cân bằng các hệ số còn lại của phương trình, ta được :
3Cu + 8 HNO3 ----> 3Cu (NO3)2 + 2NO + 4H2O
4. Ý nghĩa của phương trình hóa học
- Phương trình hóa học cho ta biết được tỉ lệ về số nguyên tử, số phân tử
giữa các chất cũng như từng cặp chất trong phản ứng. Tỉ lẹ này bằng đúng tỉ
lệ hệ số mỗi chất cần có trong phản ứng hóa học.
Ví dụ : Phương trình phản ứng hóa học 4P + 5 O2 ----> 2 P2O5
Tỷ lệ số nguyên tử P : số phân tử O2 : số phân tử P2O5 = 4 : 5 : 2
5. Cân bằng phương trình Al + H2SO4 ---> Al2(SO4)3 + SO2 + H2O
- Cách cân bằng phương trình trên như sau:
+ Bước 1: xác định các nguyên tố thay đổi số oxi hóa Al và S là các nguyên tố thay đổi số oxi hóa
+ Bước 2: Viết quá trình nhường e và nhận e Al 0 ----> Al3 + 3e S+ 6 + 2e ---> S + 4
+ Bước 3: tìm hệ số thích hợp để nhân cho các quá trình, sao cho ne nhường = ne nhận
+ Bước 4: ĐIều hệ số tương ứng vào phương trình
2Al + 6 H2SO4 đặc nóng ---> Al2(SO4) 3 + 3SO2 + 6 H2O
- Đây là một phương trình nhôm tác dụng với axit H2SO4 đặc nóng, điều kiện
phản ứng là nhiệt độ thường.
- Cách tiến hành : bỏ mẩu nhôm vào ống nghiệm, sau đó nhỏ vài giọt dung
dịch H2SO4 đặc nóng vào trong ống nghiệm đựng sẵn mẩu kẽm.
- Hiện tưởng sau phản ứng: mẩu nhôm bị tan dần, xuất hiện khí không màu,
có mùi hắc chính là lưu huỳnh đioxit ( SO 2)
Document Outline
- Cân bằng phản ứng sau: Al + H2SO4 → Al2(SO4)3 + SO
- 1. Lý thuyết phương trình hóa học
- 2. Các bước thực hiện lập phương trình hóa học
- 3. Các cách cân bằng phương trình hóa học
- 4. Ý nghĩa của phương trình hóa học
- 5. Cân bằng phương trình Al + H2SO4 ---> Al2(SO4)3


