



Preview text:
1. Phương trình phản ứng CO2 + NaOH -> Na2CO3 + H2O
Phản ứng trao đổi : CO2 + 2NaOH -> Na2CO3 + H20
Điều kiện phản ứng : điều kiện nhiệt độ bình thường
Cách thức thực hiện : Sục khí CO2 từ từ vào dung dịch NaOH
Hiện tượng phản ứng xảy ra : Phương trình không có hiện tượng nhận biết đặc biệt. Trong trường hợp này thường chỉ phải quan sát chất sản phẩm là muối natri carbonat Na2CO3 dung dịch màu trắng và H2O nước không màu hoặc quan sát chất tham gia là dung dịch natri hidroxit NaOH và khí không màu cacbondioxit CO2 biến mất. Phản ứng này thường được sử dụng trong quá trình hấp thụ CO2 từ không khí hoặc khí thải để giảm lượng CO2 trong môi trường.
2. Tính chất hoá học của CO2 và NaOH
2.1. Tính chất hoá học của CO2
CO2 là chất khí không màu, nặng gấp 1,5 lần không khí, tan ít trong nước và khi bị làm lạnh đột ngột thì chuyển sang trạng thái rắn gọi là nước đá khô. Nước đá khô không nóng chảy mà thăng hoa nên thường được dùng để làm môi trường lạnh và khô, vô cùng tiện lợi trong bảo quản thực phẩm.
- CO2 không than gia phản ứng cháy và có thể bị phân huỷ tại nhiệt độ cao 2000 độ C thành CO và O2.
- CO2 là oxit axit, khi tan trong nước tạo thành axit cacbonic (một axit yếu)
CO2 + H2O -> H2CO3
- CO2 tác dung với oxit bazo tạo thành muối
CO2 + CaO -> CaCO3
- CO2 tác dụng với dụng dịch kiềm tạo thành muối và nước
CO2 + KOH -> KHCO3
CO2 + 2KOH -> K2CO3 + H2O
2.2. Tính chất hoá hoc của NaOH
NaOH là công thức hoá học của natri hidroxit hay còn gọi là xút hoặc xút ăn da là một hợp chất vô cơ của natri. Natri hydroxit tạo thành dung dịch bazo mạnh khi hoà tan trong dung môi như nước. NaOH dễ hấp thụ CO2 trong không khí nên thường được bảo quản bằng bình có nắp kín.
- Làm đổi màu chất chỉ thị : dung dịch NaOH làm quỳ tím chuyển thành màu xanh và thường được ứng dụng trong xử lý nước bể bơi để làm tăng nồng độ pH cho nước bể bơi; ngoài ta dung dịch NaOH làm phenolphthalein không màu chuyển sang màu đỏ và đổi màu methyl da cam thành màu vàng.
- Tác dụng với oxit axit : dung dịch NaOH khi tác dụng với oxit axit trung bình, yếu thì tuỳ theo tỉ lệ mol các chất tham gia mà muối thu được có thể là muối axit, muối trung hoà hay cả hai.
NaOH + CO2 -> NaHCO3
2NaOH + CO2 -> Na2CO3 + H2O
- Tác dụng với axit : NaOH là một bazo mạnh nên tính chất đặc trưng của NaOH là tác dụng với axit tạo thành muối tan và nước. Phản ứng này còn gọi là phản ứng trung hoà.
2NaOH + H2SO4 -> Na2SO4 + 2H2O
- Tác dụng với muối : Natri hidroxit tác dụng với dung dịch muối tạo thành muối mới và bazo mới. Điều kiện để có phản ứng xảy ra : muối tạo thành phải là muối không tan hoặc bazo tạo thành phải là bazo không tan.
2NaOH + MgCl2 -> 2NaCl + Mg(OH)2
- Tác dụng với một số phi kim : NaOH tác dụng với một số phi kim như Si, C, P, S, Halogen
Si + 2NaOH + H2O -> Na2SiO3 + 2H2
- Hoà tan một hợp chất của kim loại : dung dịch NaOH có khả năng hoà tan một hợp chất của kim loại lưỡng tính Al, Zn, Be, Sn, Pb
2NaOH + 2Al + 2H2O -> 2NaAlO2 + 3H2
2NaOH + Al2O3 -> 2NaAlO2 + H2O
NaOH + Al(OH)3 -> NaAlO2 + 2H2O
Chất được tạo ra dung dịch có thể chứa ion Na[Al(OH)4] hoặc có thể viết Al(OH)3 + NaOH -> Na[Al(OH)4].
3. Một số bài tập trắc nghiệm vận dụng liên quan
Bài 1. Dãy các chất nào sau đây tan trong nước?
A. Al2O3, CaO, P2O5, CuO, CO2
B. CuO, CaO, P2O5, CO, CO2
C. Na2O, CaO, P2O5, SO3, SO2
D. Fe2O3, BaO, SO2, SO3, CO2
Bài 2. Sản phẩm của phản ứng phân huỷ canxicacbonat bởi nhiệt là :
A. CaO và CO
B. CaO và CO2
C. CaO và SO2
D. CaO và P2O5
Bài 3. Để nhận biết 3 khí không màu: CO2, O2, H2 đựng trong 3 lọ mất nhãn ta dùng:
A. Giấy quỳ tím ẩm
B. Giấy quỳ tím ẩm và dùng que đóm cháy dở còn tàn đỏ
C. Than hồng trên que đóm
D. Dẫn các khí vào nước vôi trong
Bài 4. Trong hơi thở, chất khí làm đục nước vôi trong là:
A. SO2
B. CO2
C. NO2
D. SO3
Bài 5. Cho các oxit: Na2O, CO, CaO, P2O5, SO2. Có bao nhiêu cặp chất tác dụng được với nhau?
A. 2
B. 3
C. 4
D. 5
Bài 6. Hấp thụ hoàn toàn 0,16 mol CO2 vào 2 lít dung dịch Ca(OH)2 0,05M thu được kết tủa X và dung dịch Y. Cho biết khối lượng dung dịch Y tăng hay giảm bao nhiêu so với dung dịch Ca(OH)2 ban đầu?
A. 3.04 gam
B. 7,04 gam
C. 6,04 gam
D. 5,04 gam
Bài 7. Cho 3,36 lít khí CO2 tác dụng với 200l dung dịch NaOH 1M. Xác định sản phẩm thu được sau khi kết thúc phản ứng
A. Na2CO3
B. NaHCO3
C. Na2CO3 và NaHCO3
D. Không tạo ra sản phẩm
Bài 8. Khí nào dưới đây gây ra hiệu ứng nhà kính?
A. SO2
B. NH3
C. CO2
D. CH4
Bài 9. Dung dịch bazo có độ bazo mạnh nhất trong các dụng dịch có giá trị pH sau:
A. pH = 7
B. pH = 8
C. pH = 13
D. pH = 14
Bài 10. Cho các dung dịch: NaOH, NaCl, H2SO4, Na2SO4, Ba(OH)2. Chỉ dùng thêm một thuốc thử nào sau đây để nhận biết?
A. phenolphtalein
B. quỳ tím
C. BaCl2
D. AgNO3
Bài 11. Biết rằng 2,24 lít khí CO2 (ở đktc) tác dụng vừa đủ với 200ml NaOH tạo thành muối. Tính khối lương muối thu được bao nhiêu gam?
A. 1M
B. 0,2M
C. 0,5M
D. 1,5M
Bài 12. Thổi V lít khí CO2 (đktc) vào 100ml dd Ca(OH)2 1M thu được 6g kết tủa. Lọc kết tủa đun nóng dung dịch lại thấy có kết tủa nữa. Tìm V?
A. 3,136 lít
B. 6,272 lít
C. 4,181 lít
D. 7,840 lít
Bài 13. A là hh khí gồm CO2, SO2, d(A/H2) = 27. Dẫn a mol hỗn hợp khí A qua bình đựng 1 lít dung dịch NaOH 1,5aM. Sau phản ứng cô cạn cẩn thận dung dịch thu được m gam muối khan. Tìm m theo a?
A. 105a
B. 68a
C. 52,5a
D. 70a
Bài 14. Sục khí CO2 vào dung dịch nước vôi trong, hiện tượng xảy ra:
A. Có kết tủa ngay, lượng kết tủa tăng dần qua một cực đại rồi sau đó tan trở lại hết
B. Một lúc mới có kết tủa, lượng kết tủa tăng dần quan một cực đại rồi lại giảm
C. Có kết tủa ngay, nhưng kết tủa tan trở lại ngay sau khi xuất hiện
D. Có kết tủa ngay, lượng kết tủa tăng dần đến một giá trị không đổi
Bài 15. Sục V lít (đktc) CO2 vào 200ml dung dịch Ca(OH)2 1M, thu được 15 gam kết tủa. Lọc bỏ kết tủa lấy dung dịch đun nóng lại có kết tủa nữa. Giá trị của V là:
A. 5,6
B. 5,6 hoặc 2,24
C. 2,8 hoặc 9,272
D. 2,8
Bài 16. Nhận định nào sau đây không đúng về kim loại kiềm?
A. Đều có cấu tạo mạng tinh thể giống nhau: lập phương tâm khối
B. Là những nguyên tố mà nguyên tử có 1e ở phân lớp p
C. Dễ bị oxi hoá
D. Năng lượng ion hoá thứ nhất của các nguyên tử kim loại kiềm thấp hơn so với các nguyên tố khác trong cùng chu kì
Bài 17. Phát biểu nào sau đây không đúng về kim loại kiềm
A. Khối lượng riêng nhỏ
B. Độ dẫn điện thấp
C. Nhiệt độ nóng chảy và nhiệt độ sôi thấp
D. Độ cứng thấp
Bài 18. Kim loại nào sau đây không phải kim loại kiềm ?
A. Ca
B. K
C. Cs
D. Li
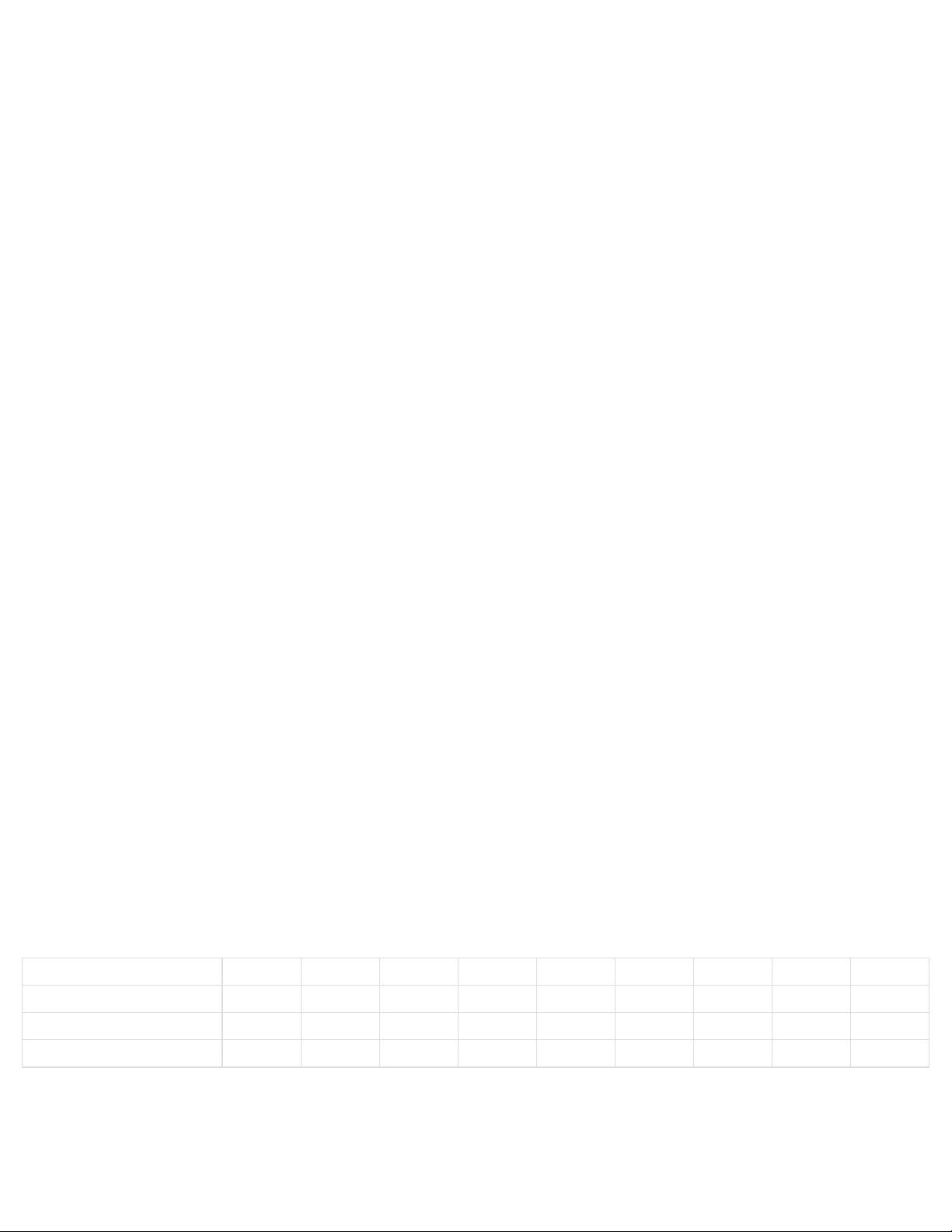
Bài | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
Đáp án | A | B | A | B | C | A | C | C | D |
Bài | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
Đáp án | A | A | A | A | A | A | B | B | A |




