





Preview text:
Cân bằng phản ứng sau: Fe3O4 + HCl → FeCl3 + FeCl2 + H2O
1. Cân bằng phản ứng: Fe3O4 + HCl -> FeCl3 + FeCl2 + H2O?
Phương trình phản ứng giữa Fe3O4 và dung dịch axit HCl, mặc dù đơn giản, nhưng lại đóng một
vai trò rất quan trọng trong nhiều ứng dụng thực tế. Phản ứng này được ứng dụng rộng rãi
trong các lĩnh vực khác nhau, bao gồm công nghiệp, y học, và môi trường, vv.
Phương trình phản ứng giữa Fe3O4 và dung dịch axit HCl có thể được biểu diễn như sau:
Fe3O4 + 8HCl → 2FeCl3 + FeCl2 + 4H2O
Điều kiện phản ứng Fe3O4 tác dụng với dung dịch axit HCl là Nhiệt độ
Cho Fe3O4 vào ống nghiệm, nhỏ 1-2ml dung dịch axit HCl vào ống nghiệm đã bỏ sẵn Fe3O4 rồi
đun trên ngọn lửa đèn cồn.
2. Kiến thức liên quan đến phản ứng: Fe3O4 + HCl -> FeCl3 + FeCl2 + H2O?
Khi hợp chất Fe3O4 tác dụng với axit clohidric (HCl), phản ứng tạo ra một sản phẩm mới được
gọi là muối, và sản xuất khí hidro (H2) cùng với sự gia nhiệt. Quá trình này có thể được mô tả
như sau: ban đầu, Fe3O4 tan trong dung dịch axit, tạo ra ion sắt (Fe2+) và ion clo (Cl-); sau đó,
ion sắt tương tác với ion H+ để tạo thành khí hidro, trong khi ion clo kết hợp với ion sắt để tạo
ra sản phẩm muối. Để tách sản phẩm muối ra khỏi dung dịch, ta có thể sử dụng phương pháp
kết tủa, trong đó sử dụng một chất điều chỉnh pH để điều chỉnh độ acid của dung dịch và kết tủa
muối. Tuy nhiên, quá trình này có thể chịu ảnh hưởng của nhiều yếu tố, bao gồm nhiệt độ,
lượng chất tham gia trong phản ứng và chất lượng của chúng.
Fe3O4 là một hợp chất quan trọng của sắt và oxi, thường được tìm thấy abundantly trong
quặng magnetite và có tính từ tính mạnh. Công thức hóa học của Fe3O4 là FeO.Fe2O3. Nó có
một loạt các tính chất hóa học và ứng dụng đa dạng.
Tính chất vật lý: Fe3O4 là một chất rắn màu đen, không hòa tan trong nước và có tính từ tính
mạnh. Điều này làm cho nó trở thành một thành phần quan trọng trong nhiều ứng dụng từ tính,
bao gồm sản xuất nam châm.
Tính chất hóa học: Fe3O4 có khả năng oxi hóa và khử. Khi tiếp xúc với các axit như HCl và H2SO4
loãng, nó tạo ra một hỗn hợp muối sắt (II) và sắt (III). Nó cũng có thể tác động như một chất
khử khi tiếp xúc với các chất có tính oxi hóa mạnh. Ở nhiệt độ cao, Fe3O4 có thể tác động như
một chất oxi hóa khi tiếp xúc với các chất khử mạnh như H2, CO và Al.
Fe3O4 có nhiều ứng dụng quan trọng trong nhiều lĩnh vực khác nhau. Nó được sử dụng trong
xử lý nước thải và sản xuất mực in. Trong lĩnh vực y tế, nó được sử dụng để điều trị ung thư và
hình thành hình ảnh y tế. Fe3O4 cũng đóng vai trò quan trọng trong sản xuất thiết bị điện tử và
các thiết bị y tế như máy siêu âm.
Nhờ những tính chất đa dạng của nó, Fe3O4 đóng một vai trò quan trọng trong hóa học của sắt
và oxi, và có nhiều ứng dụng trong nhiều lĩnh vực khác nhau.
3. Bài tập vận dụng liên quan 3.1 Đề bài
Câu 1. Phản ứng xảy ra khi đốt cháy sắt trong không khí là A. 3Fe + 2O2 → Fe3O4. B. 4Fe + 3O2 → 2Fe2O3. C. 2Fe + O2 → 2FeO.
D. tạo hỗn hợp FeO, Fe2O3, Fe3O4.
Câu 2. Cho các phản ứng sau:
(1) Fe(OH)2 + H2SO4 đặc → (2) Fe + H2SO4 loãng →
(3) Fe(OH)3 + H2SO4 đặc → (4) Fe3O4 + H2SO4 loãng →
(5) Cu + H2SO4 loãng + dd NaNO3 → (6) FeCO3 + H2SO4 đặc →
Số phản ứng hóa học trong đó H2SO4 đóng vai trò là chất oxi hóa là: A. 2 B. 4 C. 3 D. 5
Câu 3. Nhận xét nào sau đây không đúng
A. Trong dung dịch Fe khử được ion Cu2+ thành Cu.
B. Bột nhôm bốc cháy khi gặp khí clo.
C. Các kim loại Na, K, Ba đều phản ứng với nước ở điều kiện thường.
D. Fe phản ứng với dung dịch HCl hay phản ứng với Clo đều tạo thành một loại muối.
Câu 4. Cho dung dịch NaOH đến dư vào dung dịch FeCl2 thấy xuất hiện kết tủa
A. trắng xanh, sau đó chuyển nâu đỏ.
B. keo trắng, sau đó tan dần. C. keo trắng không tan. D. nâu đỏ
Câu 5. Cho Zn dư vào dung dịch AgNO3, Cu(NO3)2, Fe(NO3)3. Số phản ứng hoá học xảy ra là: A. 1. B. 2. C. 3. D. 4
Câu 6. Hòa tan Fe3O4 vào dung dịch HCl dư, thu được dung dịch X. Cho dãy các chất: KMnO4;
Cl2; KOH; Na2CO3; CuSO4, HNO3; Fe; NaNO3. Số chất trong dãy tác dụng được với dung dịch X là A. 7 B. 5 C. 4 D. 6
Câu 7. Cho 23,2 gam Fe3O4 tác dụng với dung dịch HCl dư thu được muối sắt có khối lượng là: A. 48,6 gam B. 28,9 gam C. 45,2 gam D. 25,4 gam
Câu 8. Cho 2,24 gam Fe tác dụng với oxi, thu được 3,04 gam hỗn hợp X gồm 2 oxit. Để hoà tan
hết X cần thể tích dung dịch HCl 2M là A. 25 ml. B. 50 ml. C. 100 ml. D. 150 ml.
Câu 9. Cho dung dịch NaOH dư vào dung dịch chứa FeCl2 và FeCl3, thu được kết tủa X. Nung X
trong không khí đến khối lượng không đổi, thu được chất rắn là A. FeO. B. FeO và Fe2O3. C. Fe3O4. D. Fe2O3.
Câu 10. Dãy các chất và dung dịch nào sau đây khi lấy dư có thể oxi hoá Fe thành Fe (III)?
A. HCl, HNO3 đặc, nóng, H2SO4 đặc, nóng
B. Cl2, HNO3 nóng, H2SO4 đặc, nguội
C. bột lưu huỳnh, H2SO4 đặc, nóng, HCl D. Cl2, Cu(NO3)2, HNO3 loãng 3.2 Đáp án Câu 1: Đáp án A
Phản ứng xảy ra khi đốt cháy sắt trong không khí là 3Fe + 2O2 → Fe3O4. Câu 2: Đáp án C
Các phản ứng : (1) , (2) , (6)
(1) 8Fe(OH)2 + 13H2SO4 đặc → 4Fe2(SO4)3 + H2S + 20H2O
(2) Fe + H2SO4 loãng → FeSO4 + H2
(3) 2 Fe(OH)3 + 3 H2SO4 → Fe2(SO4)3 + 6 H2O
(4) Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
(5) Cu + 4H2SO4 + 2NaNO3⟶ 3CuSO4 + Na2SO4 + 2NO + 4H2O
(6) 2FeCO3 + 4H2SO4→ Fe2(SO4)3+ SO2 + 2CO2 + 4H2O Câu 3: Đáp án D
Fe phản ứng với dung dịch HCl hay phản ứng với Clo đều tạo thành một loại muối.
Phương trình phản ứng minh họa Fe + 2HCl → FeCl2 + H2↑
2Fe + 3Cl2→ 2FeCl3 ⇒ thu được 2 loại muối. Câu 4: Đáp án A
Ban đầu tạo Fe(OH)2 có màu trắng xanh:
FeCl2 + 2NaOH → Fe(OH)2 (trắng xanh) + 2NaCl
Sau đó Fe(OH)2 bị O2 (trong dung dịch và không khí) oxi hóa thành Fe(OH)3 có màu nâu đỏ:
Fe(OH)2 + 1/4O2 + 1/2H2O → Fe(OH)3(nâu đỏ)
Vậy hiện tượng là tạo kết tủa trắng xanh, sau đó chuyển nâu đỏ. Câu 5: Đáp án D
Phương trình phản ứng minh họa
Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
Zn + 2Fe(NO3)3 → Zn(NO3)2+ 2Fe(NO3)2
Zn + Cu(NO3)2 → Zn(NO3)2+ Cu
Zn + Fe(NO3)2 → Zn(NO3)2+ Fe Câu 6: Đáp án A
Fe3O4 + HCl dư → dung dịch X gồm: FeCl2; FeCl3; HCl dư.
Vậy dung dịch X tác dụng được với các chất là: KMnO4; Cl2; KOH; Na2CO3; HNO3; Fe; NaNO3
Phương trình phản ứng minh họa
5FeCl2+ KMnO4 + 8HCl → 5FeCl3 + KCl + MnO2↓ + Cl2↑ + 4H2O 2FeCl2 + Cl2 → 2FeCl3
FeCl2 + KOH → Fe(OH)2↓ + 2KCl
FeCl3 + KOH → Fe(OH)3↓ + 3KCl HCl + KOH → KCl + H2O
2FeCl3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓ + 3CO2↑ + 6NaCl
2HCl + Na2CO3 → 2NaCl + H2O + CO2↑
FeCl2+ 4HNO3 → Fe(NO3)3 + 2HCl + NO2 ↑ + H2O 2FeCl3 + Fe → 3FeCl2 2HCl + Fe → FeCl2 + H2↑
3Fe2+ + NO3- + 4H+ → 3Fe3+ + NO + 2H2O
=> vậy có tất cả 7 chất phản ứng với dd X Câu 7: Đáp án C nFe3O4 = 23,2: 232 = 0,1 mol
Phương trình phản ứng minh họa
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O Mol 0,1 → 0,1 → 0,2
mmuối = mFeCl2 + mFeCl3 = 0,1.127 + 0,2.162,5 = 45,2g Câu 8: Đáp án B
Áp dụng bảo toàn nguyên tố (mol nguyên tử)
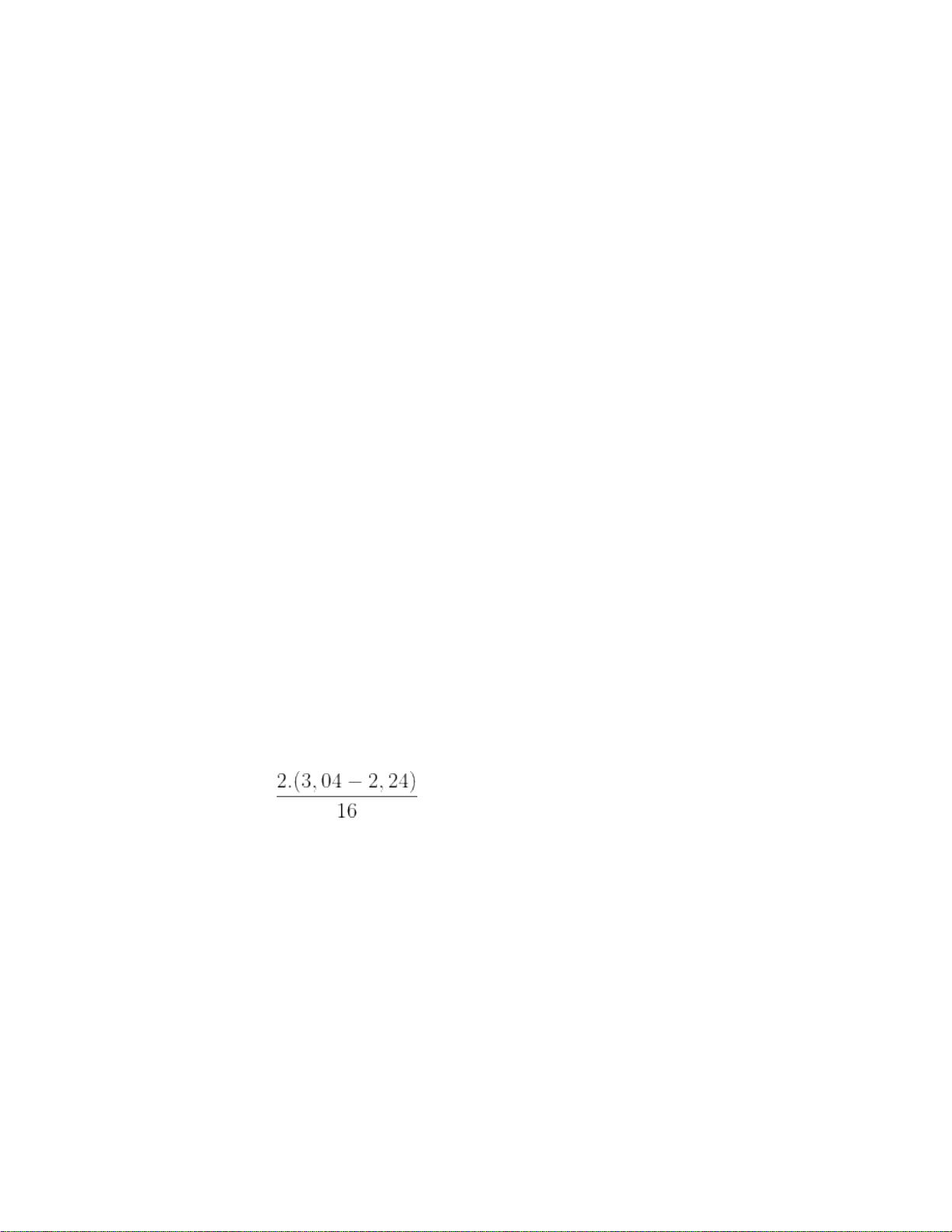
Oxit + HCl → muối clorua + H2O nHCl = nH = 2.nO = 2. = 0,1mol VddHCl2M = 0,1.1000/2 = 50ml Câu 9: Đáp án D
Phương trình phản ứng xảy ra
FeCl2 + NaOH → Fe(OH)2 + NaCl
FeCl3 + NaOH → Fe(OH)3 + NaCl
X gồm Fe(OH)2 và Fe(OH)3. Nung X ngoài không khí thu được Fe2O3: Fe(OH)2 + O2 → Fe2O3 + H2O Câu 10: Đáp án D
Phương trình phản ứng minh họa 2Fe + 3Cl2 → 2FeCl3
2Fe + 3Cu(NO3)2 →2Fe(NO3)3 + 3Cu
Fe + 4HNO3 loãng → Fe(NO3)3 + NO + 2H2O Fe(OH)3 → Fe2O3 + H2O




