



Preview text:
Cân bằng phương trình hoá học Fe + O2 → Fe2O3
1. Cân bằng phương trình hoá học Fe + O2 → Fe2O3 4Fe + 3O2 → 2Fe2O3
Đây là một phản ứng oxi hóa, trong đó sắt (Fe) tương tác với không khí chứa oxi (O2) để tạo ra
oxit sắt (III) hay Fe2O3, còn gọi là oxide sắt (III) hoặc rỉ sắt. Mỗi phân tử sắt (Fe) với một phân tử
O2, tạo ra hai phân tử Fe2O3. Quá trình này có thể xảy ra trong điều kiện nhiệt độ cao, chẳng
hạn như trong lò chảo, khi sắt được đốt cháy trong không khí có chứa oxi. Sản phẩm cuối cùng
là Fe2O3, là một dạng của rỉ sắt, thường có màu đỏ nâu.
Dưới đây là mô tả của phản ứng:
+ Sắt (Fe): Đây là chất khử, nó thường ở dạng kim loại.
+ Oxi (O2): Khí oxi đóng vai trò là chất oxi hóa. Trong điều kiện thường, không khí chứa khoảng
21% khí oxi. Trong phản ứng này, mỗi phân tử O2 kết hợp với ba nguyên tử sắt.
+ Oxide sắt (III) (Fe2O3): Là sản phẩm của phản ứng, có màu đỏ nâu và thường được biết đến
như rỉ sắt trong điều kiện môi trường tự nhiên. Phản ứng này diễn ra trong điều kiện nhiệt độ
cao, chẳng hạn như khi sắt được đốt cháy hoặc khi nó tiếp xúc với không khí ở nhiệt độ cao. Đây
là một ví dụ về quá trình rỉ sắt xảy ra trên bề mặt các vật dụng sắt khi chúng tiếp xúc với không
khí và nước trong môi trường.
Phản ứng này được thực hiện ở nhiệt độ cao và áp suất không. Trong điều kiện không có chất
gắn kết hoặc chất xúc tác, sắt (Fe) tương tác với oxi (O2) một cách tự nhiên. Quá trình này diễn
ra trong môi trường không chứa chất xúc tác hoặc chất gắn kết, và thường xảy ra ở nhiệt độ
khoảng 800-900 độ C. Nhiệt độ này đủ cao để đảm bảo phản ứng diễn ra hoàn toàn, tạo
thành Fe2O3, còn được gọi là sắt (III) oxit.
2. Ứng dụng phản ứng 4Fe + 3O2 → 2Fe2O3
Quá trình tổng hợp Fe2O3 từ sắt (Fe) và oxi (O2) có nhiều ứng dụng quan trọng trong các lĩnh vực khác nhau:
+ Sản xuất thép: Fe2O3 là một thành phần chính của rỉ sắt, thường gặp dưới dạng hematite.
Trong quá trình sản xuất thép, quặng sắt thường chứa các tạp chất không mong muốn như silic,
phosphorus và sulfur. Trong lò cao, Fe2O3 có vai trò quan trọng trong quá trình lọc và loại bỏ các
tạp chất này. Quá trình sản xuất thép thông thường bắt đầu bằng việc đưa quặng sắt (thường là
hematite) vào lò cao cùng với một lượng lớn than cốc và một số vật liệu khác như đá vôi. Trong
lò cao, ở nhiệt độ cao, than cốc sẽ phản ứng với oxit sắt trong quặng sắt, tạo ra khí CO (carbon
monoxide) có khả năng khử Fe2O3 thành sắt (Fe) và CO2. Sắt lỏng thu được sau đó có thể được
sử dụng để sản xuất thép hoặc gang. Fe2O3 thường được coi là chất chủ yếu giúp loại bỏ các
tạp chất và tạo ra sắt lỏng, trong khi CO cung cấp năng lượng cần thiết cho quá trình này. Sản
phẩm cuối cùng của quá trình này là gang chưa chứa carbon, và từ đó, các bước tiếp theo của
quá trình sản xuất thép sẽ được thực hiện để kiểm soát lượng carbon trong sản phẩm cuối cùng.
+ Mực in Magnet: Fe2O3 có tính từ trường mạnh, vì vậy nó thường được sử dụng trong việc sản
xuất mực in magnet. Các sản phẩm từ mực in magnet được sử dụng rộng rãi trong các ứng dụng
như thẻ nhớ, loa, và các thiết bị điện tử khác.
+ Chất nhuộm: Fe2O3 cũng được sử dụng như một chất nhuộm trong công nghiệp dệt may và in
ấn. Màu đỏ nâu của nó làm cho nó trở thành một chất nhuộm phổ biến trong nghệ thuật và
công nghiệp. Trong công nghiệp dệt may, Fe2O3 thường được sử dụng để nhuộm sợi tự nhiên
và tổng hợp để tạo ra các màu đỏ và nâu. Nó có khả năng tạo ra màu sắc ổn định và bền vững
trên vải. Trong in ấn, Fe2O3 thường được sử dụng trong mực in, đặc biệt là trong quá trình in
offset và in flexo. Chất nhuộm này có thể cung cấp màu sắc đậm và nổi bật, làm cho nó trở
thành lựa chọn phổ biến cho nhiều ứng dụng in ấn. Do khả năng tạo ra màu sắc ổn định và giá
thành phải chăng, Fe2O3 là một chất nhuộm được ưa chuộng trong nhiều ngành công nghiệp và ứng dụng nghệ thuật.
+ Chất chống cháy: Trong một số ứng dụng, Fe2O3 được sử dụng làm chất chống cháy. Sự chống
cháy của nó có thể giúp ngăn cháy trong một số sản phẩm và vật liệu. Fe2O3 có thể được thêm
vào các chất đàn hồi, nhựa, chất cách điện và các sản phẩm khác để cải thiện khả năng chống
cháy của chúng. Khi sử dụng trong vật liệu chống cháy, Fe2O3 thường được tích hợp vào các sản
phẩm để làm tăng khả năng chống cháy và làm giảm khả năng lan truyền của ngọn lửa. Việc này
có thể cực kỳ quan trọng để đảm bảo an toàn và tuân thủ các quy định về chống cháy trong
nhiều lĩnh vực, như xây dựng, ô tô, và điện tử.
+ Dược học và mỹ phẩm: Fe2O3 được sử dụng trong mỹ phẩm và dược học để tạo màu cho các
sản phẩm như son môi, phấn mắt, và kem chống nắng.
+ Công nghiệp gốm sứ: Trong công nghiệp gốm sứ, Fe2O3 có thể được sử dụng làm chất chống
cháy và tạo màu cho gốm sứ.
Những ứng dụng này chỉ là một số ví dụ, và Fe2O3 có thể có nhiều ứng dụng khác tùy thuộc vào
tính chất của sản phẩm cụ thể và yêu cầu của các ngành công nghiệp khác nhau.
3. Một số bài tập vận dụng có liên quan
Câu 1. Khi thanh sắt được để ngoài không khí trong một khoảng thời gian, hiện tượng xảy ra là gì? A. Thanh sắt bị gỉ
B. Thanh sắt chuyển sang màu đỏ
C. Thanh sắt bị xỉn màu
D. Không có hiện tượng gì.
Hướng dẫn giải: Đáp án A
Phản ứng hóa học: 4Fe + 3O2 → 2Fe2O3
Câu 2: Khi thanh sắt được để ngoài không khí ẩm trong một khoảng thời gian, phản ứng nào sau đây xảy ra? A. 3Fe + 2O2 → Fe3O4 B. 4Fe + 3O2 → 2Fe2O3 C. 2Fe + O2 → 2FeO
D. Không xảy ra phản ứng.
Hướng dẫn giải: Đáp án B
Câu 3: Cho kim loại X để trong không khí, thu được chất rắn Y. Chất Y tác dụng với dung dịch HCl
tạo dung dịch Z, và phản ứng Z với dung dịch NaOH dư tạo kết tủa màu nâu đỏ. Kim loại X là gì? A. Al B. Cu C. Fe D. Zn
Hướng dẫn giải: Đáp án C
Phản ứng: 4Fe + 3O2 → 2Fe2O3; Fe2O3 + 6HCl → 2FeCl3 + 3H2O; FeCl3 + NaOH → Fe(OH)3 + 3NaCl
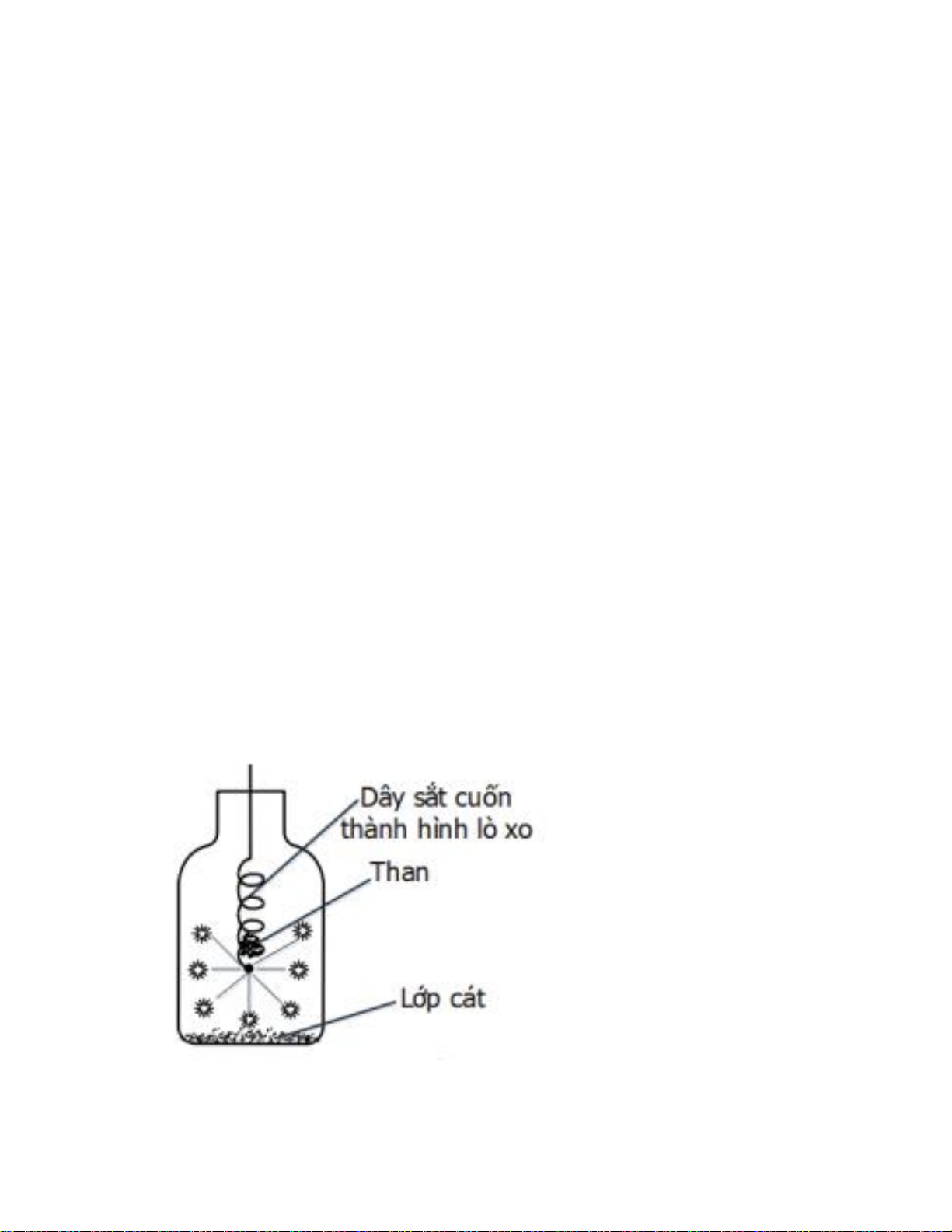
Câu 4. Cho phản ứng của sắt (Fe) với oxi (O2) như hình vẽ bên: Cho các phát biểu sau:
(1) Sản phẩm của phản ứng là Fe2O3.
(2) Khi đưa vào lọ chứa oxi, dây thép cháy trong oxi sáng chói, nhiều hạt nhỏ sáng bắn tóe như pháo hoa.
(3) Nước trong bình có vai trò là chất xúc tác để cho phản ứng xảy ra nhanh hơn.
(4) Mẩu than gỗ có tác dụng làm mồi vì khi than cháy, tỏa nhiệt lượng đủ lớn để phản ứng giữa
Fe và O2 xảy ra (có thể thay mẩu than bằng que diêm).
(5) Cần làm sạch và uốn sợi dây thép thành hình lò xo để tăng diện tích tiếp xúc, phản ứng xảy ra nhanh hơn. Số phát biểu đúng là A. 5. B. 2. C. 4. D. 3. Hướng dẫn giải:
Phương pháp giải: Dựa vào lý thuyết tổng hợp về thí nghiệm phản ứng đốt cháy sắt trong oxi. Giải chi tiết:
(1) sai vì sản phẩm của phản ứng là Fe3O4. PTHH: 3Fe + 2O2 -> Fe3O4.
(3) sai vì nước trong bình có vai trò tránh vỡ bình vì phản ứng tỏa nhiều nhiệt. (2), (4), (5) đúng. Đáp án D.
Câu 5. Đốt cháy 16,8 g Fe. Tính khối lượng khí oxi tham gia phản ứng và khối lượng Fe2O3.
Phương trình phản ứng giữa Oxi và Fe là: 4Fe + 3O2 → 2Fe2O3
Chúng ta biết rằng 4 mol Fe phản ứng với 3 mol O2 để tạo thành 2 mol Fe2O3, do đó tỉ lệ số mol giữa Fe và O2 là 4:3.
Đầu tiên, chúng ta cần xác định số mol của Fe từ khối lượng được cung cấp, sử dụng công thức:
mol = khối lượng chất : khối lượng mol
Với khối lượng Fe là 16,8 g, ta có: nFe = 16,8 : 56 g/mol = 0,3 mol
Do tỉ lệ số mol giữa Fe và O2 là 4:3, số mol O2 cần để phản ứng hoàn toàn với Fe là: 0,3 mol × 3/4 = 0,225 mol nFe2O3 = 0,3 x 1/2 = 0,15 mol
Vậy khối lượng Fe2O3 là: mFe2O3 = 0,15 × 160 = 24g




