




Preview text:
KIỂM TRA HÓA LÝ 1 - LẦN 2 (23.51) Set D Họ và tên: Lê Quang Thành Mã sinh viên: 107230258 Lớp: 23KTHH2 Start date: 2024-11-28 20:00 End date: 2024-11-28 20:30 Test passed Total score: 90% (90/100)
Lý thuyết - Score: 77.8% (35/45)
Bài tập - Score: 100% (55/55) Question 1/15
A. Sơ đồ pin: (-) Pb | PbCl || CdCl | Cd (+) 2 2 E = 0,276 (V) pin
B. Sơ đồ pin: (-) Cd | CdCl || PbCl | Pb (+) 2 2 E = 0,187 (V) pin
C. Sơ đồ pin: (-) Pb | PbCl || CdCl | Cd (+) 2 2 E = 0,187 (V) pin
D. Sơ đồ pin: (-) Cd | CdCl || PbCl | Pb (+) 2 2 E = 0,276 (V) pin Score: 9/9p. 1
KIỂM TRA HÓA LÝ 1 - LẦN 2 (23.51) Set D Question 2/15
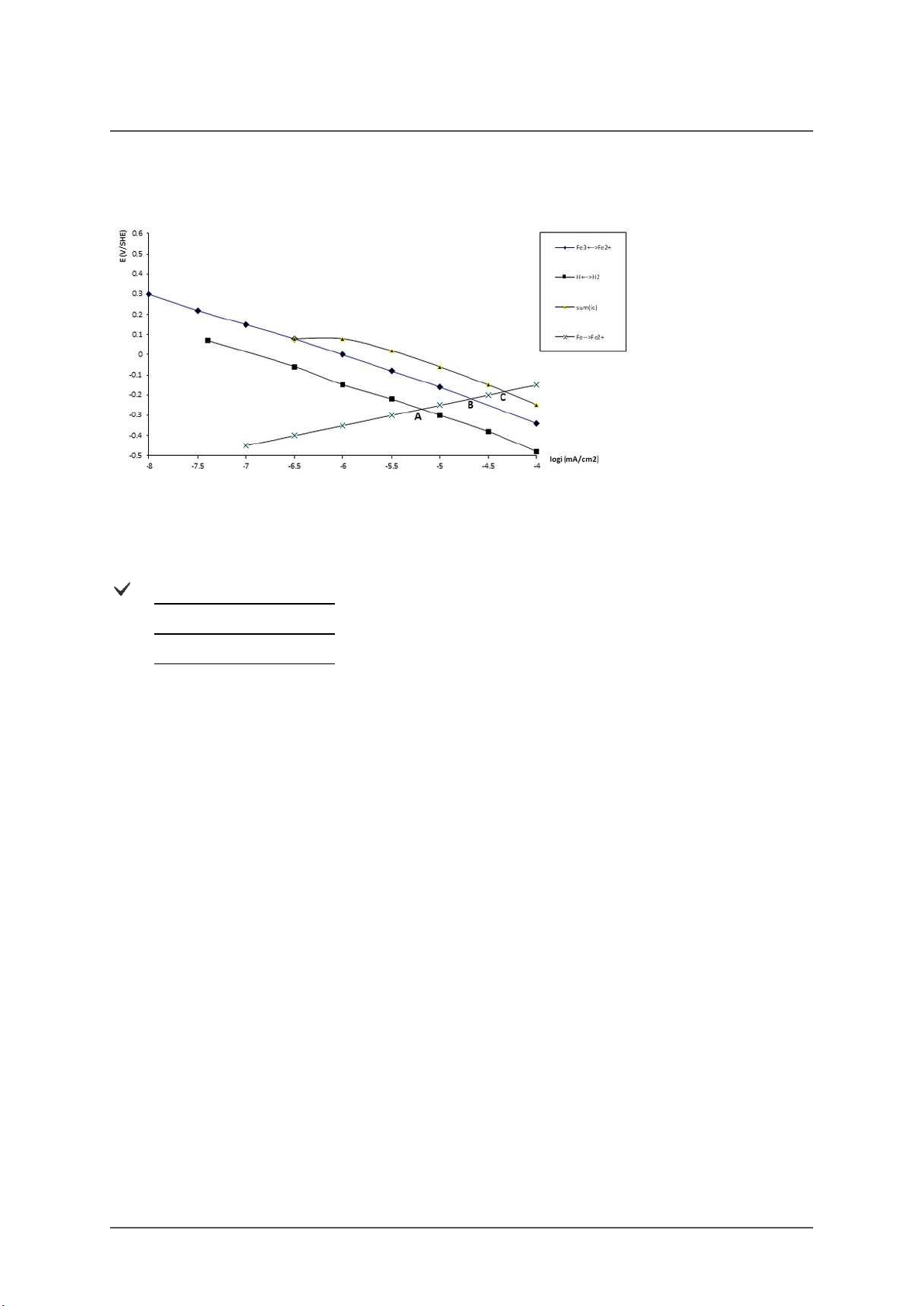
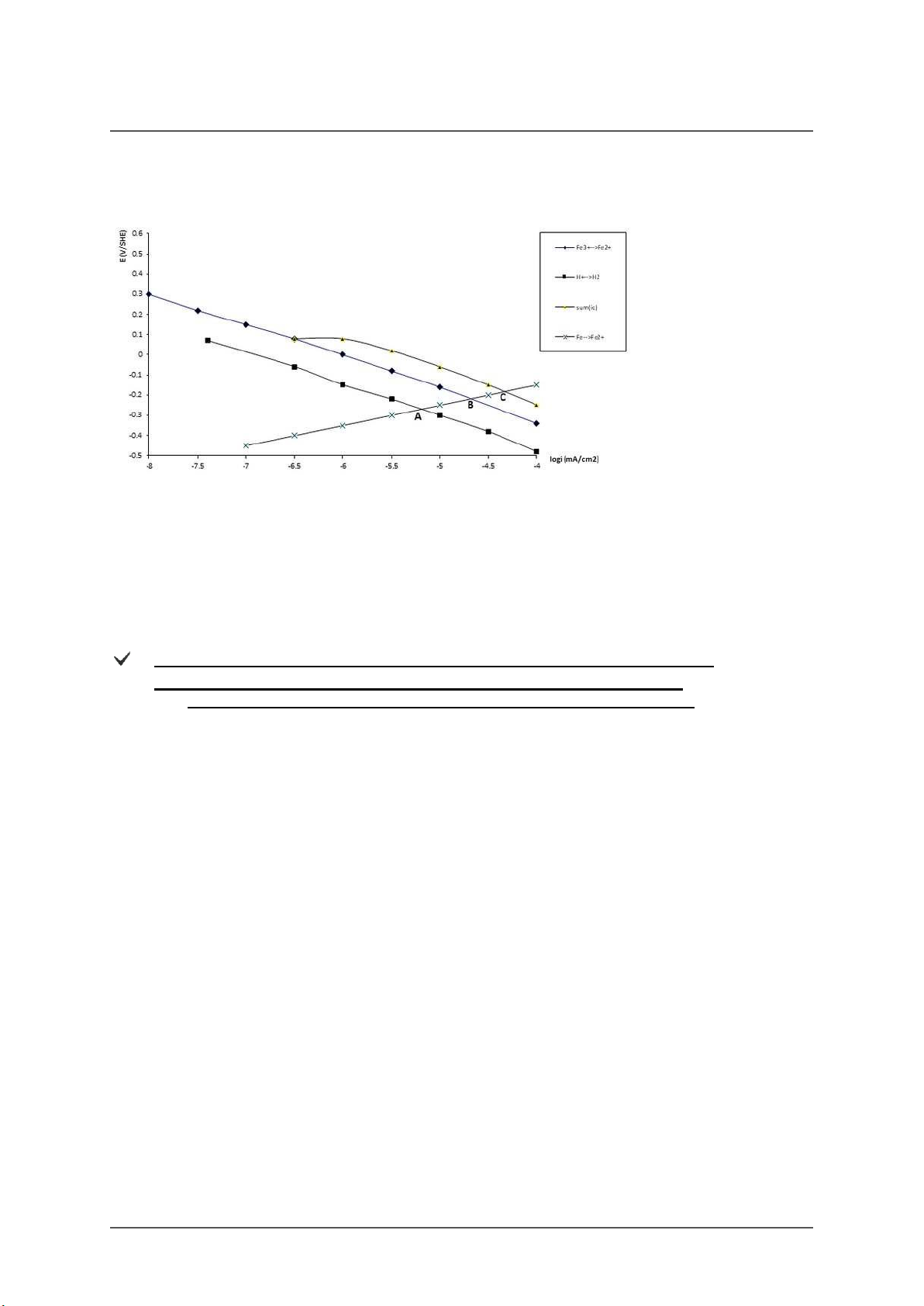
Dựa vào đồ thị trên tính gần đúng tốc độ ăn mòn của sắt trong các trường hợp sau:
1/ Tốc độ ăn mòn của sắt trong dung dich axit khi không có mặt chất oxy hoá
2/ Tốc độ ăn mòn của sắt trong môi trường chỉ có mặt chất oxy hoá
3/ Tốc độ ăn mòn của sắt trong môi trường axit có mặt chất oxy hoá A. 1/ i =10-5,2 (mA/cm2) corr,Fe 2/ i = 10-4,7 (mA/cm2) corr,Fe 3/ i = 10-4,3 (mA/cm2) corr,Fe B. 1/ i =10-4,7 (mA/cm2) corr,Fe 2/ i = 10-5,2 (mA/cm2) corr,Fe 3/ i = 10-4,3 (mA/cm2) corr,Fe C. 1/ i =10-4,7 (mA/cm2) corr,Fe 2/ i = 10-4,3(mA/cm2) corr,Fe 3/ i = 10-5,2 (mA/cm2) corr,Fe Score: 9/9p.
KIỂM TRA HÓA LÝ 1 - LẦN 2 (23.51) Set D Question 3/15 Cho hai điện cực sau: Cu | Cu2+ (a =0,1) với φo = 0,34 (V) Cu2+ Cu2+/Cu Sn | Sn2+ (a =0,02) với φo = -0,14 (V) Sn2+ Sn2+/Sn
Viết sơ đồ pin khi ghép hai điện cực trên với nhau; viết các phản ứng xảy ra trên các cực và phản ứng xảy ra trong pin
A. Sơ đồ pin khi ghép hai điện cực trên với nhau: (-) Cu | Cu2+ || Sn | Sn2+ (+)
Phản ứng trên cực dương (cathode): Sn2+ + 2e → Sn
Phản ứng trên cực âm (anode): Cu → Cu2+ + 2e
Phản ứng trong pin: Cu + Sn2+ = Sn + Cu2+
B. Sơ đồ pin khi ghép hai điện cực trên với nhau: (-) Cu | Cu2+ || Sn2+ | Sn (+)
Phản ứng trên cực dương (cathode): Sn2+ + 2e → Sn
Phản ứng trên cực âm (anode): Cu → Cu2+ + 2e
Phản ứng trong pin: Cu + Sn2+ = Sn + Cu2+
C. Sơ đồ pin khi ghép hai điện cực trên với nhau: (-) Sn| Sn2+ || Cu2+ | Cu (+)
Phản ứng trên cực dương (cathode): Cu2+ + 2e → Cu
Phản ứng trên cực âm (anode): Sn → Sn2+ + 2e
Phản ứng trong pin: Sn + Cu2+ = Cu + Sn2+
D. Sơ đồ pin khi ghép hai điện cực trên với nhau: (-) Sn2+| Sn || Cu | Cu2+ (+)
Phản ứng trên cực dương (cathode): Cu2+ + 2e → Cu
Phản ứng trên cực âm (anode): Sn → Sn2+ + 2e
Phản ứng trong pin: Sn + Cu2+ = Cu + Sn2+ Score: 5/5p. Question 4/15
Nhúng một tấm kẽm vào dung dịch axit có pH = 2 đã đuổi hết khí hoà tan ở 25oC, thấy kẽm bị hoà tan với tốc độ i
=10(A/m2) đồng thời có khí hydro thoát ra (cho P
=1atm). Tính điện thế ăn mòn của Zn (φ ). corr,Zn H2 corr,Zn Biết φo =-0,76 (V); a =10-6 (mol/l); i =10-2 (A/m2) và α = 0,5 Zn2+/Zn Zn2+ o,Zn2+ Zn2+ A. φ = -0,94 (V) corr,Zn B. φ = 0,82 (V) corr,Zn C. φ = -0,82 (V) corr,Zn D. φ = -0,76 (V) corr,Zn Score: 9/9p.
KIỂM TRA HÓA LÝ 1 - LẦN 2 (23.51) Set D Question 5/15
Hãy cho biết ý nghĩa của các điểm A, B, C ở đồ thị trên
A. A. Xác định tốc độ ăn mòn của kim loại Fe trong dung dịch axit có mặt chất oxy hóa
B. Xác định tốc độ ăn mòn của kim loại Fe trong dung dịch chỉ chứa chất oxy hóa.
C. Xác định tốc độ ăn mòn của kim loại Fe trong dung dịch axit không có chất oxy hóa.
B. A. Xác định tốc độ ăn mòn của kim loại Fe trong dung dịch chỉ chứa chất oxy hóa B.
Xác định tốc độ ăn mòn của kim loại Fe trong dung dịch axit (không có chất oxy hóa) C.
Xác định tốc độ ăn mòn của kim loại Fe trong dung dịch axit có mặt chất oxy hóa.
C. A. Xác định tốc độ ăn mòn của kim loại Fe trong dung dịch axit (không có chất oxy hóa) B.
Xác định tốc độ ăn mòn của kim loại Fe trong dung dịch chỉ chứa chất oxy hóa. C.
Xác định tốc độ ăn mòn của kim loại Fe trong dung dịch axit có mặt chất oxy hóa. Score: 5/5p.
KIỂM TRA HÓA LÝ 1 - LẦN 2 (23.51) Set D Question 6/15
Đối với một hệ oxy hóa khử nhất định: Ox + ne Red
Trong trường hợp khuếch tán nhanh thì động học của toàn bộ quá trình điện hóa bị khống chế bởi giai đoạn trao
đổi electron, được cho bởi phương trình:
Trong đó mật độ dòng trao đổi i là một thông số rất quan trọng vì: o A.
Có quan hệ chặt chẽ với tốc độ ăn mòn trên bề mặt kim loại nào đó
Mật độ dòng trao đổi i của một hệ oxy hóa khử phụ thuộc vào bản chất kim loại o
Mật độ dòng trao đổi i là thước đo khả năng xúc tác của vật liệu được dùng làm điện o cực B.
Có quan hệ chặt chẽ với tốc độ phản ứng oxy hóa khử nào đó xảy ra trên bề mặt kim loại nhất định
Mật độ dòng trao đổi i của một hệ oxy hóa khử phụ thuộc vào bản chất kim loại o
Mật độ dòng trao đổi i là thước đo khả năng xúc tác của vật liệu được dùng làm điện o cực C.
Có quan hệ chặt chẽ với tốc độ ăn mòn trên bề mặt kim loại nào đó
Mật độ dòng trao đổi i phụ thuộc tốc độ khuếch tán của một hệ oxy hóa khử o
Mật độ dòng trao đổi i là thước đo khả năng xúc tác của vật liệu được dùng làm điện o cực D.
Có quan hệ chặt chẽ với tốc độ phản ứng oxy hóa khử nào đó xảy ra trên bề mặt kim loại nhất định
Mật độ dòng trao đổi i phụ thuộc tốc độ khuếch tán của một hệ oxy hóa khử o
Mật độ dòng trao đổi i là thước đo khả năng ăn mòn của kim loại o Score: 5/5p.
KIỂM TRA HÓA LÝ 1 - LẦN 2 (23.51) Set D Question 7/15
Giả sử có một chiếc pin:
(-) Zn | ZnSO || CuSO | Cu (+) 4 4
Giá trị sức điện động (E ) của pin chính là: pin
a/ Hiệu thế giữa hai điện cực ở trạng thái cân bằng
b/ Hiệu thế giữa hai điện cực khi có dòng điện chạy qua A. a/ Đúng b/ Đúng B. a/ Đúng b/ Sai C. a/ Sai b/ Đúng D. a/ Sai b/ Sai Score: 5/5p. Question 8/15
Nhúng một thanh sắt vào dung dich axit có pH = 3, ở 25oC không có sự hòa tan oxy song lại bão hòa khí hydro (P
=1atm), ta thấy sắt bị hòa tan và có khí thoát ra. Viết các phản ứng xảy ra và xác định thế điện cực cân bằng H2 của φcb và φcb . Cho biết φo = -0,44 (V) và a =10-6 (mol/l) Fe2+/Fe H+/H2 Fe2+/Fe Fe2+
A. Quá trình anode: 2H+ + 2e → H2 O + 4H+ + 4e → 2H O 2 2
Quá trình cathode: Fe → Fe2+ + 2e φcb = -0, 44 (V) và φcb = -0,12 (V) Fe2+/Fe H+/H2
B. Quá trình anode: 2H+ + 2e → H2
Quá trình cathode: Fe → Fe2+ + 2e φcb = -0, 617 (V) và φcb = -0,177 (V) Fe2+/Fe H+/H2
C. Quá trình anode: Fe → Fe2+ + 2e
Quá trình cathode: 2H+ + 2e → H2 φcb = -0, 617 (V) và φcb = -0,177 (V) Fe2+/Fe H+/H2
D. Quá trình anode: Fe → Fe2+ + 2e
Quá trình cathode: 2H+ + 2e → H2 O + 4H+ + 4e → 2H O 2 2 φcb = -0, 44 (V) và φcb = -0,177 (V) Fe2+/Fe H+/H2 Score: 9/9p.
KIỂM TRA HÓA LÝ 1 - LẦN 2 (23.51) Set D Question 9/15
Ăn mòn điện hóa xảy ra khi cho kim loại tiếp xúc với dung dich điện ly là sự phá hủy kim loại xảy ra trên ranh
giới hai pha kim loại và dung dịch điện ly. Khi đó: A.
Kim loại bị hòa tan xảy ra trên vùng cathode
Phản ứng giải phóng hydro hoặc tiêu thụ oxy xảy ra trên vùng anode của kim loại
Có dòng điện xuất hiện B.
Kim loại bị hòa tan xảy ra trên vùng anode
Phản ứng giải phóng hydro hoặc tiêu thụ oxy xảy ra trên vùng cathode của kim loại
Có dòng điện xuất hiện C.
Kim loại bị hòa tan xảy ra trên vùng anode
Phản ứng giải phóng hydro hoặc tiêu thụ oxy xảy ra trên vùng cathode của kim loại
Không có dòng điện xuất hiện ở mạch trong D.
Kim loại bị hòa tan xảy ra trên vùng anode
Phản ứng giải phóng hydro hoặc tiêu thụ oxy xảy ra trên vùng cathode của kim loại
Có dòng điện xuất hiện ở mạch ngoài, kèm theo màng oxyt được hình thành trên bề mặt kim loại Score: 0/5p. Question 10/15
Phương pháp bảo vệ kim loại bằng anode hy sinh để bảo vệ các công trình bằng sắt, thép như đường ống dẫn
nhiên liệu dưới đất, vỏ tàu biển, các giàn khoan dưới biển. Trong trường hợp đó kim loại làm anode hy sinh
thường dùng là Al, Zn, Mg và hợp kim của chúng. Vậy vật liệu làm anode hy sinh phải thõa mãn các yêu cầu cơ bản nào dưới đây: A.
Có điện thế âm hơn so với kim loại cần bảo vệ
Có phân cực nhỏ khi có dòng điện chạy qua
Có dung lượng cao, ổn định, không bị thụ động, ăn mòn đều, đủ bền cơ, hiệu suất cao B.
Có điện thế âm hơn so với kim loại cần bảo vệ
Có phân cực lớn khi có dòng điện chạy qua
Có dung lượng cao, ổn định, không bị thụ động, ăn mòn đều, đủ bền cơ, hiệu suất cao C.
Có điện thế dương hơn so với kim loại cần bảo vệ
Có phân cực nhỏ khi có dòng điện chạy qua
Có dung lượng cao, ổn định, không bị thụ động, ăn mòn đều, đủ bền cơ, hiệu suất cao D.
Có điện thế dương hơn so với kim loại cần bảo vệ
Có phân cực lớn khi có dòng điện chạy qua
Có dung lượng cao, ổn định, không bị thụ động, ăn mòn đều, đủ bền cơ, hiệu suất cao Score: 5/5p.
KIỂM TRA HÓA LÝ 1 - LẦN 2 (23.51) Set D Question 11/15
Sử dụng đường cong phân cực φ-logi của phản ứng hòa tan kim loại: M → M2+ + 2e trong dung dịch axit đã
đuổi hết khí hòa tan: 2H+ + 2e → H . Hãy xác định sự thay đổi của điện thế ăn mòn (φ ) và tốc độ ăn mòn 2 corr,M (i
) khi giảm nồng độ ion H+ trong dung dịch. corr,M A. φ tăng corr,M i tăng corr,M B. φ tăng corr,M i giảm corr,M C. φ giảm corr,M i tăng corr,M D. φ giảm corr,M i giảm corr,M Score: 5/5p. Question 12/15
Cho một chiếc pin có sơ đồ: (-) Pb | Pb2+ || Cu2+ | Cu (+)
Tính hệ số nhiệt độ của sức điện động (∂E/∂T) của pin. Biết sức điện động của pin ở 25oC là E =0,476(V) và p pin
hiệu ứng nhiệt của phản ứng trong pin là ΔH=-69152(J).
A. (∂E/∂T) = 0,0028 (V/K) p
B. (∂E/∂T) = -0,000395 (V/K) p
C. (∂E/∂T) = 0,000395 (V/K) p
D. (∂E/∂T) = -0,0028 (V/K) p Score: 10/10p. Question 13/15 A. pH = 9,86 B. pH = 5,62 C. pH = 1,39 D. pH = 4,23 Score: 9/9p.
KIỂM TRA HÓA LÝ 1 - LẦN 2 (23.51) Set D Question 14/15
Sự thụ động hóa kim loại xảy ra khi nhúng kim loại đó vào dung dịch điện ly có chứa cấu tử oxy hóa khử thích
hợp. Chất oxy hóa khử thích hợp phải thõa mãn đồng thời hai điều kiện nào dưới đây để đưa kim loại vào trạng thái thụ động. A. 1/ E < Ecb < Ecb pass trans Redox 2/ | i | > i c,Redox crit B. 1/ E > Ecb > Ecb pass Redox trans 2/ | i | > i c,Redox crit C. 1/ E < Ecb < Ecb pass Redox trans 2/ | i | < i c,Redox crit D. 1/ E < Ecb < Ecb pass Redox trans 2/ | i | > i c,Redox crit Score: 0/5p. Question 15/15
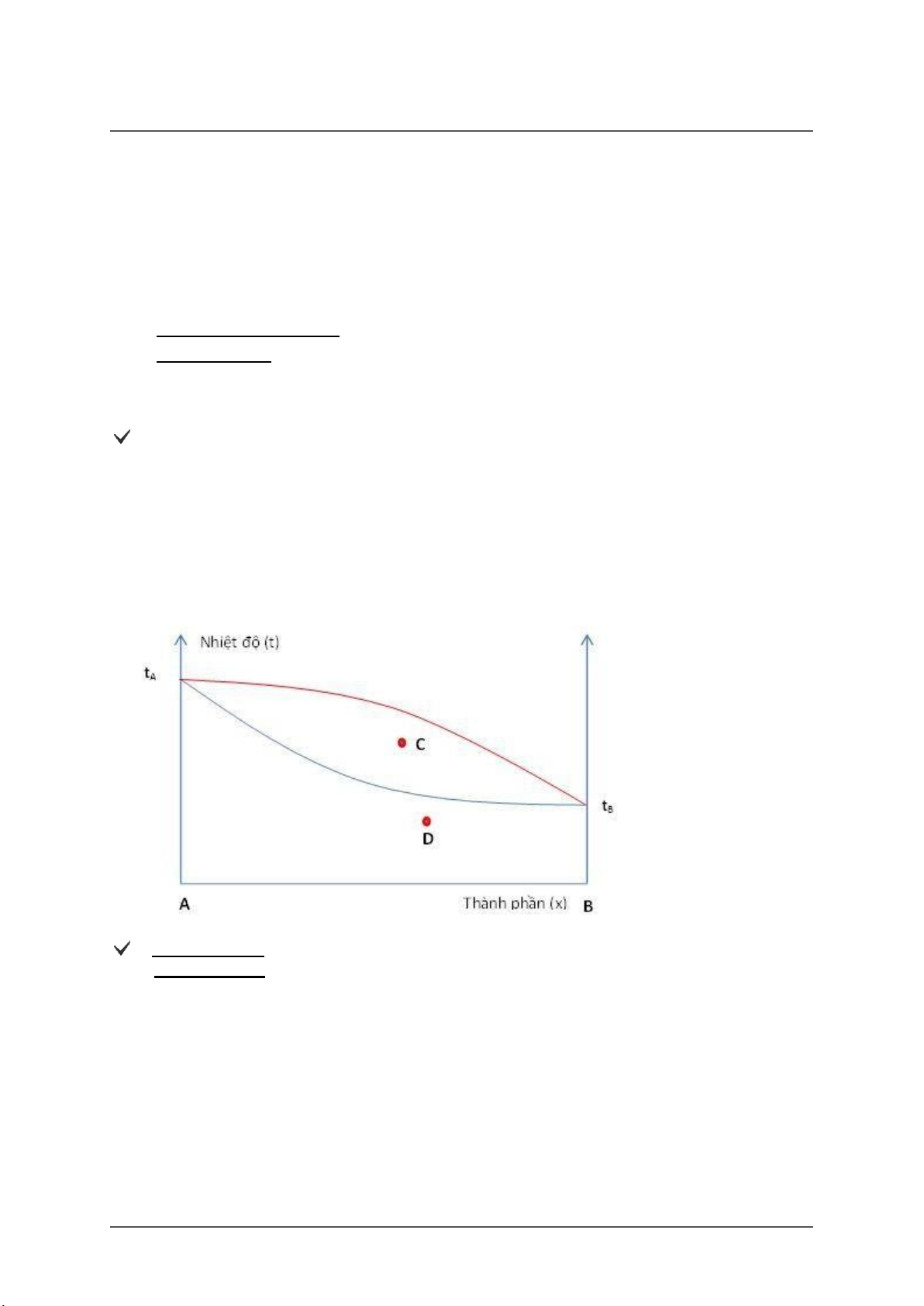
Giản đồ cân bằng lỏng-hơi hệ hai cấu tử không tạo thành hợp chất hóa học cho dưới đây. Anh (chị) hãy cho biết
tại các điểm C, D hệ tồn tại bao nhiêu pha
A. Tại điểm C: 2 pha Tại điểm D: 1 pha
B. Tại điểm C: 1 pha Tại điểm D: 1 pha
C. Tại điểm C: 2 pha Tại điểm D: 2 pha
D. Tại điểm C: 1 pha Tại điểm D: 2 pha Score: 5/5p.