






Preview text:
BÀI TẬP NHIỆT ĐỘNG HÓA HỌC
Câu 1: Một hệ kín chứa 40g khí Argon (MAr = 39,94 g/mol; giả sử cho khí là lý tưởng)
được dãn nở đẳng nhiệt thuận nghịch từ thể tích 5 lít tới thể tích 12 lít ở nhiệt độ 298K. Tính: 1/ Công hệ tiến hành
2/ P =dP của quá trình trên. c
Câu 2: Một vật bị đẩy đi một khoảng cách z theo phương tác dụng của lực được cho bởi
công thức Fz = az + b (với a=300N.m-1; b=500N). Tính công cần thiết để di chuyển vật từ z=0 đến z=12 m.
Câu 3: Cho 2 mol khí lý tưởng ban đầu được chứa trong xylanh có thể tích 22,4l ở nhiệt
độ 273K. Áp suất bên ngoài tăng lên 1,8105 Pa và khí bị nén đẳng nhiệt bất thuận
nghịch tới áp suất trên. Tìm giá trị lớn nhất và nhỏ nhất của công có thể có.
Câu 4: Tính khối lượng nước lỏng khi nâng nhiệt độ của nó từ 250C đến 90 0C bằng cách
cho nó tiếp xúc với 100g hơi nước có nhiệt độ 1000C. Cho biết nhiệt hóa hơi của nước
Hvap = 539,55cal/g và nhiệt dung của nước lỏng là Cp=4,184J/g.K
Câu 5: Tính U của quá trình khi cho 1mol khí Ar từ nhiệt độ T=298K, V=2lit đến T=373K và V=10 lit
Câu 6: Một hệ chứa 1mol khí Ar (xem như lý tưởng) dãn nở đoạn nhiệt bất thuận nghịch
từ thể tích 5lit, nhiệt đô 373K tới thể tích 10 lit ở áp suất bên ngoài Pext=1atm. Tìm nhiệt
độ cuối của hệ. Cho biết nhiệt dung đẳng tích của Ar là Cv=3nR/2
Câu 7: Tính H khi thay đổi trạng thái 1 mol heli từ thể tích 4 lit, nhiệt độ 298K tới thể
tích 12 lit ở nhiệt độ 353K. Cho Cp=5R/2 và khí xem như lý tưởng.
Câu 8: Tính H và nhiệt q khi cho 1 mol nước lỏng quá lạnh (supercooled liquid water)
ở nhiệt độ -150C chuyển bất thuận nghịch sang pha rắn ở cùng một nhiệt độ -150C. Cho
biết nhiệt dung của nước ở trạng thái lỏng Cp,l=75,48J/mol.K; nhiệt dung của nước ở
trạng thái rắn Cp,r=37,15J/mol.K. Nhiệt nóng chảy Hfus=120,2kJ
Câu 9: Người ta thực hiện phản ứng nhiệt nhôm để khử Fe2O3 với tỷ lệ mol của các chất
phản ứng trong nguyên liệu tương ứng với tỷ lệ của các hệ số tỷ lượng trong phương trình phản ứng.
a/ Hãy viết phương trình cân bằng của phản ứng nhiệt nhôm nói trên b/
Tính Enthalpy tiêu chuẩn của phản ứng ở 298K ( 298 H 0 ,r )
c/ Xác định khối lượng nhôm cần thiết cho phản ứng để sinh ra một lượng nhiệt là 800
kJ d/ Xác định khối lượng nhôm cần thiết để nhiệt phản ứng sinh ra đủ để cung cấp cho
quá trình chuyển hóa 50g nước đá ở -80C đến trạng thái hơi ở nhiệt độ 1150C Các
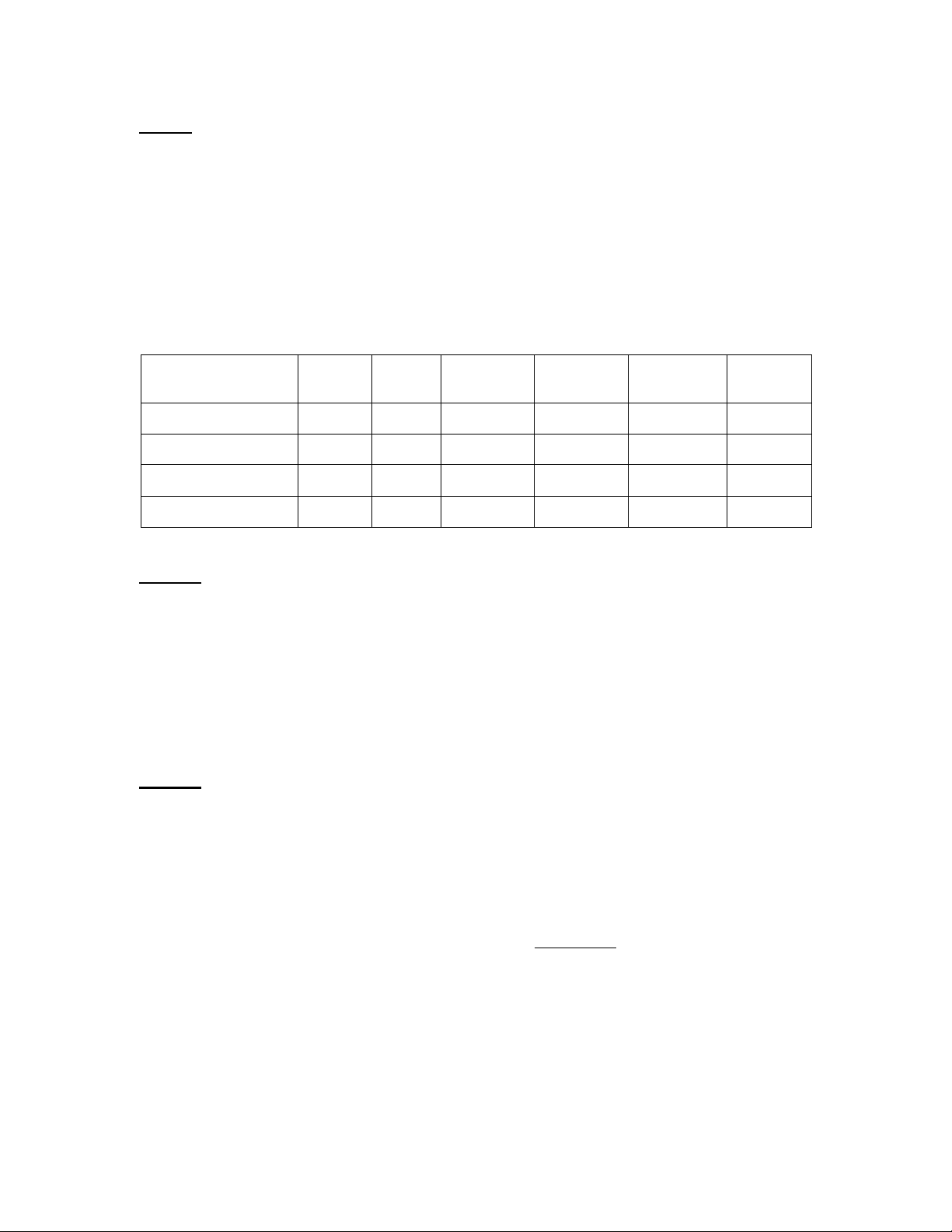
số liệu nhiệt động liên quan được cho ở bảng sau: Fe2O3 Al2O3 H2O Nước đá Nước lỏng Hơi nước
H 0f ,298(kJ.mol−1) -46,9 -95,5
Cp (J.K−1.g−1) 2,03 4,18 2,01
H 0fuss(kJ.mol−1) 6,01
Hvap0 (kJ.mol−1) 40,7
Câu 10: Tính nhiệt tạo thành của amoniac ở điều kiện áp suất chuẩn và nhiệt độ 298K (
H 0 f (NH
) từ nhiệt của các phản ứng sau: 3), 298 2H + = 2 O2
2H2O(l) +H1 0 4NH + = + 3 3O2
6H 2O(l) + 2N2 H 0 2 với: H 0 =− 1
571,68 kJ; H2 0 =−1530,28 kJ
Câu 11: Tính sự thay đổi enthalpy khi AgCl được đốt nóng từ nhiệt độ 298K đến 900K ở
áp suất chuẩn ( H 0 −
0 ) và tính tổng enthalpy của AgCl ở 900K. Cho biết ở 728K 1000 H298
AgCl bị nóng chảy và Hnc = 13,21kJ/mol, và: -
Nhiệt dung của AgCl ở thể rắn cho bởi phương trình sau: 0
62,26+ 4,1810−3T−1 1,30T2 105 (J/mol.K) C = p(r) -
Nhiệt dung của AgCl ở thể lỏng từ khoảng nhiệt độ 728K đến 900K xem
như không đổi và bằng 66,99 J/mol.K. -
Nhiệt tạo thành AgCl ở điều kiện chuẩn: H 0 =− f (AgCl),298 126,8 kJ /mol
Câu 12: Xác định sự thay đổi enthalpy (ΔH), nội năng (U), và entropy (S), khi cho
2,7 kg nước ở áp suất p1 = 1,0133105 Pa và nhiệt độ T1 = 303K hoá hơi ở p2=
0,5066105 Pa và 2
T = 373K. Cho biết C long p V C long =
4,187 103 J /kg.K , ẩn nhiệt hoá hơi bằng Hvap
= 2260,98103 J/kg. Giả sử rằng hơi nước nhận được ở trạng thái khí lý tưởng. (
MH2O =18 g /mol; R = 8,314 J / mol.K )
Câu 13: Tính lượng nhiệt Q, biến thiên nội năng U, biến thiên entropy S và công W
của 100g nitơ ở 00C và 1atm khi:
1/ Dãn đẳng nhiệt đến thể tích 300 lit
2/ Tăng áp suất tới 2,5 atm khi thể tích không đổi
3/ Dãn đẳng áp tới thể tích gấp đôi
Cho biết: Cv = 5 cal/mol.K; MN2 = 28 g/mol
Ở điều kiện chuẩn hằng số khí lý tưởng R = 0,082 lit.atm/mol.K
Trong hệ SI: R = 8,314J/mol.K = 1,987 cal/mol.K
Câu 14: Trong công nghiệp metanol được tổng hợp theo phản ứng sau: CO(k) + 2H2(k) CH3OH(k)
Các số liệu nhiệt động của các chất như sau: CO(k) H2(k) CH3OH(k)
H 0f ,298 ,kJ /mol -110,5 - -201,2 S 0
298 , J / K.mol 197,9 130,7 238,0 C 0
p ,J / K.mol 28,6 27,8 8,4 + 0,125T 1/ Tính G 0 của 298 ,r
phản ứng ở nhiệt độ 298K.
2/ Thiết lập phương trình H 0 = T f (T).
Câu 15: Cho 200g khí CO2 (xem như lý tưởng) ở 00C và 1atm . Tính nhiệt Q, công W,
biến thiên nội năng U, biến thiên enthalpy H, và biến thiên entropy S trong các quá trình sau:
1/ Dãn đẳng nhiệt tới thể tích 0,3m3
2/ Dãn đẳng áp tới thể tích 0,3m3
3/ Đun nóng đẳng tích tới áp suất bằng 3 atm Cho biết : C = = P,CO
8,875 cal / mol.K ; M 44g /mol 2 CO2
Ở điều kiện chuẩn hằng số khí lý tưởng R = 0,082 lit.atm/mol.K
Trong hệ SI: R = 8,314J/mol.K = 1,987 cal/mol.K
Câu 16: Tính H0 , U0 , A0 , G0 , và S0 ở điều kiện chuẩn và nhiệt độ 298K đối
với phản ứng sau: C2H2(k) + 2H2O(l) = CH3COOH(l) + H2(k)
Các số liệu nhiệt động của các chất như sau: C2H2 H2O(l) CH3COOH(l) H2
H 0f ,298 ,kJ /mol 226,75 -285,84 -484,9 0 S 0
298 , J / K.mol 200,8 69,96 159,8 130,6
G0f ,298 ,kJ /mol 209,25 -334,46 -576,64 0
Câu 17: Phát biểu nguyên lý thứ II của nhiệt động học. Viết các biểu thức toán học của
nguên lý II của nhiệt động học.
Tính S, Ssurr, q, W và U đối với quá trình dãn nở đẳng nhiệt thuận nghịch 3mol
khí Argon (cho lý tưởng) từ thể tích 100 lit tới thể tích 500 lít ở nhiệt độ 298K
Câu 18: (2,5 điểm)
Tính q, W, U, S, H, A, và G trong quá trình bay hơi 1mol nước ở áp suất P =
0,18 atm, nhiệt độ T = 336,6K. Cho biết:
- Thể tích pha hơi và pha lỏng tương ứng là 10,21 m3/kg và 0,0010137 m3/kg -
Nhiệt hoá hơi Hvap = 2370 J/g ( 1atm =101325 Pa )
Câu 19: Lưu huỳnh (S) và lưu huỳnh (S) đều cấu tạo từ các phân tử S8. Ở 368,3K tồn tại cân bằng sau: S S (1) a/ Tính H 0 của 298
quá trình (1). Cho biết nhiệt tạo thành SO2(k) từ S bằng H 0
298 , f (SO 2 )= -296,8 kJ/mol và từ S bằng H 0
298 , f (SO 2 )= -299,7 kJ/mol b/ Tính S 0 của 298
quá trình (1). Giả sử H 0 và S 0 là hằng số đối với nhiệt độ. Câu 20:
a/ Dựa vào biểu thức thống nhất của hai nguyên lý của nhiệt động học:
dU = TdS-PdV và hệ thức của hàm Helmholtz: dA = -PdV-SdT.
Hãy chứng minh đối với chất bất kỳ: U =T
P −P V T T V
b/ Tính biến thiên entropy trong quá trình khuếch tán vào nhau của 28g N2 và 32g O2,
khi bỏ vách ngăn ngăn cách 2 buồng chứa khí có thể tích như nhau bằng 30 lít và có cùng
điều kiện về nhiệt độ và áp suất. Câu 21:
Cho phản ứng: Ag + Cl2 = AgCl ở áp suất P = 1atm và nhiệt độ T = 298K. Tính G 0
và cho biết phản ứng trên có tự xảy ra hay không? Cho biết nhiệt r ,298
tạo thành của AgCl, H 0 =− 0 = f (AgCl),298
127,068kJ /mol và S AgCl ,298 96,07J /mol.K; S 0 = Ag 0 = ,298
42,69J /mol.K; SCl 2,298
223,0J /mol.K; Câu 22: Cho 2 mol khí
O2 và 1mol khí N2 trộn với nhau ở 298K. Áp suất của oxy và của nitơ ban đầu
bằng nhau và bằng P i = P i =1,013105 Pa. Áp suất riêng phần của của oxy O 2 N 2
và của nitơ trong hỗn hợp khí, lần lượt P = = O
0,668 105 Pa;P 0,334 105 2 N2 Pa .
Tính G, S, vàH đối với quá trình trộn lẫn hai khí. Câu 23:
Trong công nghiệp metanol được tổng hợp theo phản ứng sau: CO(k) + 2H2(k) CH3OH(k)
Các số liệu nhiệt động của các chất như sau: CO(k) H2(k) CH3OH(k)
H 0f ,298 ,kJ /mol -110,5 - -201,2 S 0
298 , J / K.mol 197,9 130,7 238,0 C 0
p ,J / K.mol 28,6 27,8 8,4 + 0.125T a/ Tính G298 0 ,r và K của p
phản ứng ở nhiệt độ 298K.
b/ Thiết lập phương trình H 0 = T f (T). Câu 24: 1 3 Cho phản ứng sau: NH3(k)
N2(k)+ H2(k) 2 2
a/ Tính độ phân ly của amôniac thành nitơ và hydrô ở nhiệt độ 473K, áp suất chung của
hệ lúc cân bằng là 1atm và 0,8atm.
b/ Có nhận xét gì về độ phân ly của NH3 khi thay đổi áp suất từ 1atm xuống còn 0,8atm. Rút ra kết luận chung.
Cho biết sự biến đổi enthalpy tự do chuẩn của phản ứng trên như sau: T G 0 = ,r
43513,6 − 29,706T lgT −15,86T (J / mol) Câu 25:
Cho SO2 phản ứng với O2 không khí ở 973oC có mặt chất xúc tác tạo thành SO3 theo phản ứng: 2SO2(k) + O2(k) 2SO3(k)
Khi cân bằng ở áp suất 1atm thu được hỗn hợp khí chứa: 0.35 mol SO2; 6.07 mol
O2; 12.20 mol SO3 và 81.18 mol N2. Tính:
a/ Hằng số cân bằng Kp ở 973oC.
b/ Thành phần ban đầu của hỗn hợp khí
c/ Tỉ lệ chuyển hóa SO2 thành SO3. d/ Nếu trong hỗn hợp ban đầu không có N2, còn số
mol SO2 và O2 vẫn giữ như cũ thì tỉ lệ chuyền hóa là bao nhiêu? Ap suất của hệ khi cân bằng vẫn giữ là 1 atm. Câu 26:
Phản ứng phân ly I2 thành nguyên tử i-ốt ở nhiệt độ tương đối cao. Ở 1000 K, hệ ban đầu
gồm 1 Lít I2 ở 6 × 10-3 mol, ở trạng thái cuối áp suất cân bằng bằng 0.75 atm. Xác định
lượng I2 và nguyên tố I, tính hằng số cân bằng và xác định bước phản ứng. Câu 27:
tính áp suất cần thiết để làm tan chảy nước đá ở -10 oC nếu như thể tích của 1 mol nước là
18.01 mL và của nước đá là 19.64 mL.
ΔS = 22.04 J/K và giả định rằng giá trị này không phụ thuộc vào nhiệt độ Câu 28:
Một phương pháp điều chế HCl trong công nghiệp theo phản ứng sau: H 0 =− 2(k) + Cl2(k) 2HCl(k) H 298 184,42kJ
1/ Tính số bậc tự do của cân bằng trong trường hợp tổng quát và trong trường hợp phản
ứng bắt đầu với số mol H2 bằng số mol Cl2
2/ Thiết lập phương trình G 0 = T
f (T) dựa vào bảng số liệu sau: H2(k) Cl2(k) HCl(k) S 0
298 (J / K.mol) 130,4 222,7 186,5
CP (J / K.mol) 0 27,7 34,6 28,0
3/ Cho 0,01g H2 và 0,355g Cl2 vào bình chân không có dung tích không đổi ở
1000K và P = 1atm. Tính số mol HCl được tạo thành khi cân bằng. Câu 29: Cho phản ứng: COCl2(k) CO(k)+ Cl2(k)
1/ Tính số bậc tự do của hệ cân bằng
2/ Thiết lập phương trình G 0 = T
f (T) dựa vào bảng số liệu sau. Thừa nhận rằng H0 và
S0 là hằng số đối với nhiệt độ: COCl2(k) CO(k) Cl2(k)
H 2980, f (kJ /mol) -218,8 -110,5 - S 0
298 (J / K.mol) 283,4 197,6 223
3/ Nhiệt độ và áp suất ảnh hưởng đến cân bằng như thế nào?
4/ Tính độ phân ly của COCl2 ở 8000C và áp suất 1atm khi cân bằng được thiết lập Câu 30:
Cho phản ứng: CO(k) + H2O(k) = CO2(k) + H2(k) Ở
9300C hằng số cân bằng của phản ứng trên bằng 1 1.
Tính thành phần (%) của các chất ở trạng thái cân bằng khi cho 1.5 mol
CO tác dụng với 3 mol H2O 2.
Thành phần hỗn hợp ở trạng thái ban đầu (%) phải bằng bao nhiêu để nhận
được 20% CO2 và 22% H2 ở trạng thái cân bằng 3.
Thành phần hỗn hợp ở trạng thái cân bằng có thay đổi không khi thay đổi áp suất? Giải thích?
Câu 31: cho phản ứng CH3COOC2H5 + H2O CH3COOH + C2H5OH
Hằng số cân bằng K bằng 4 ở 120 °C
a. Nếu áp suất ban đầu của ethyl acetate và nước trong bình chứa (10 L) là 1 bar.
Bước phản ứng ở điều kiện cân bằng là bao nhiêu?
b. Giá trị ∆G ở điều kiện cân bằng? Giải thích
c. Giá trị ∆G° ở điều kiện cân bằng? Giải thích
Câu 32: Cho một lượng khí hydro vào bình chân không dung tích 5 lít sao cho áp suất
khí trong bình là 0,84 atm ở 800K. Sau đó cho thêm 0,25 mol khí HI, xảy ra cân bằng sau: H2(k) + I2(k) 2HI(k)
Ở 800K hằng số cân bằng K = 37,2. Tính:
1. Áp suất chung của hệ khi cân bằng
2. Độ phân ly của HI
3. Áp suất riêng phần của mỗi khí trong hệ cân bằng.
Cho biết hằng số khí R = 0,082 lit.atm.mol-1.K-1; hệ SI: R = 8,314 J.mol-1.K-1 Câu 33:
Cho SO2 phản ứng với O2 không khí ở 973oC có mặt chất xúc tác tạo thành SO3 theo phản ứng: 2SO2(k) + O2(k) = 2SO3(k)
Khi cân bằng ở áp suất 1atm thu được hỗn hợp khí chứa: 0.22 mol SO2; 6.18 mol
O2; 12.32 mol SO3 và 81.28 mol N2. Tính:
1. Hằng số cân bằng Kp ở 973oC.
2. Thành phần ban đầu của hỗn hợp khí
3. Tỉ lệ chuyển hóa SO2 thành SO3.
Câu 34: Một hỗn hợp gồm 65% benzen (C6H6) và 35% toluen (C6H5CH3) (tính theo phần
khối lượng) tạo với nhau một dung dịch lý tưởng. Ở 300C áp suất hơi của benzen bằng
120,2 mmHg và của toluen bằng 36,7 mmHg. Hãy xác định:
1/ Áp suất hơi riêng phần của từng cấu tử và áp suất hơi chung của dung dịch ở 35 0C
2/ Thành phần (theo phần mol) của các cấu tử trong pha hơi khi cân bằng với pha lỏng
3/ Vẽ đồ thị cân bằng lỏng hơi y - x của hệ đã cho (x, y nồng độ phần mol)
Câu 35: Các chất A và B tạo thành một dung dịch lý tưởng. Có một dung dịch gồm 1
mol chất A và 2 mol chất B cân bằng với áp suất hơi của nó ở 50 0C dưới áp suất chung là
240 mmHg. Nếu người ta thêm 1mol chất A vào dung dịch ở trên thì áp suất chung tăng
lên tới 320 mmHg. Hãy xác định:
1/ Áp suất hơi bão hòa của A và B nguyên chất ở 500C
2/ Thành phần (theo phần mol) của các cấu tử trong pha hơi khi cân bằng với pha lỏng
3/ Vẽ đồ thị cân bằng lỏng hơi y - x của hệ đã cho (x, y nồng độ phần mol)
Câu 36: Benzen (C6H6) và toluen (C6H5CH3) tạo với nhau một dung dịch lý tưởng. Ở
300C áp suất hơi của benzen bằng 125,2 mmHg, của toluen bằng 34,7 mmHg. Hãy xác định:
1. Áp suất hơi riêng phần của từng cấu tử và áp suất hơi của dung dịch ở 350C
2. Thành phần của các cấu tử trong pha hơi khi cân bằng với pha lỏng Nếu
dung dịch được hình thành từ sự trộn 80 g benzen với 80 g toluen.
3. Vẽ đồ thị cân bằng lỏng hơi y - x của hệ (x, y nồng độ phần mol)
Câu 37: Ở 1atm nước sôi ở 1000C, nhiệt hóa hơi là 2249,25 (J/g), thể tích riêng của lỏng
là Vl = 1 (ml/g), của hơi là Vh = 1656 (ml/g). Xác định nhiệt độ sôi của nước ở 3.5 atm.
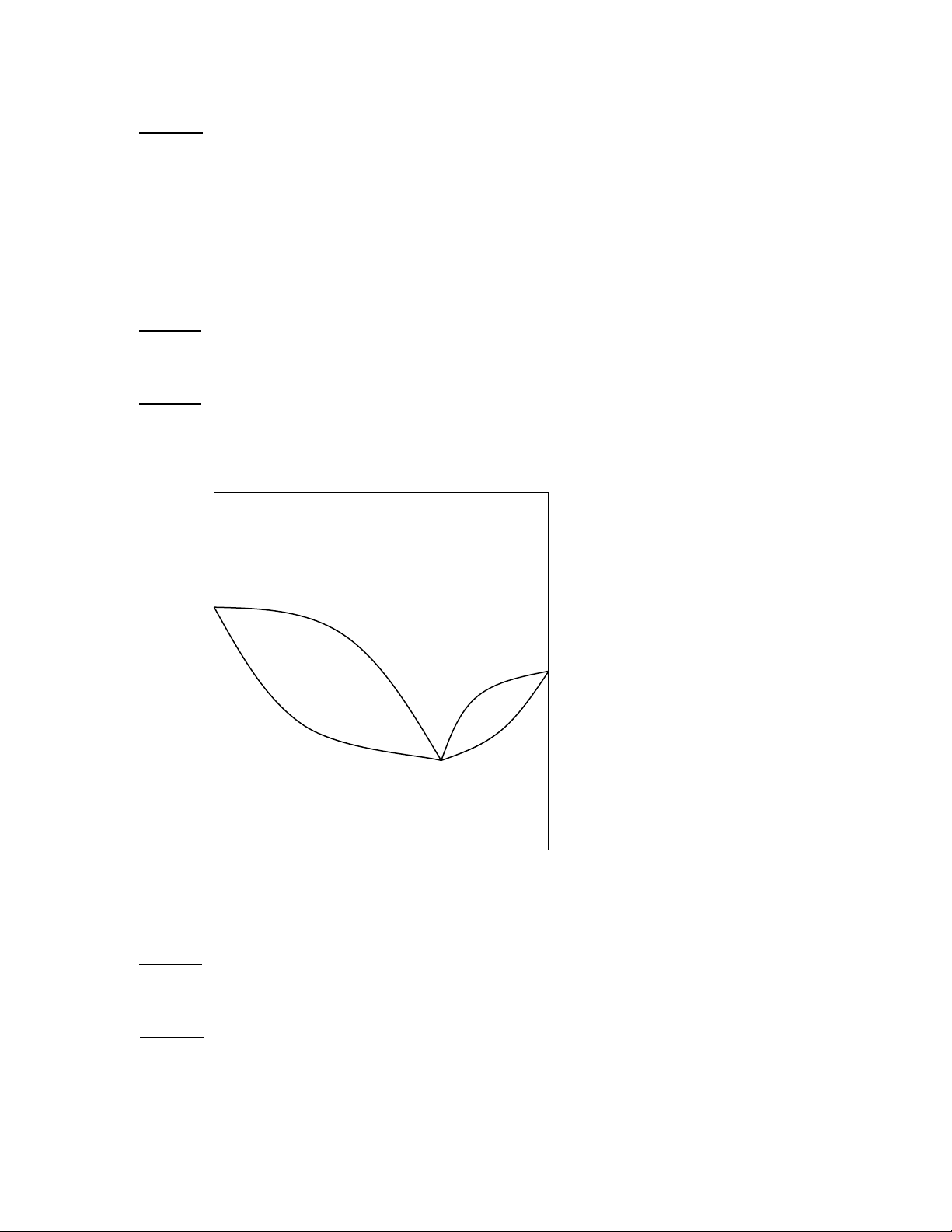
Câu 38: Từ đồ thị cân bằng lỏng – hơi ở dưới cho biết:
1/ Ý nghĩa của điểm K (nhiệt độ, thành phần của hỗn hợp) 2/ Trạng thái của hệ ở
vùng trong đường cong A, B; vùng ngoài đường cong C, D? 0 t( C) D 1 A 2 B K C x
3/ Ý nghĩa của các đường cong 1, 2.
Câu 39: Xác định nhiệt độ bay hơi của nước ở 2atm nếu ở 1000C và 1atm nhiệt bay hơi
của nước bằng Hvap=2254,757 J/g. Cho biết thể tích của nước ở pha lỏng và pha hơi lần
lượt bằng V(l)=0,018 lít và V(g)=36,6 lít; khối lượng mol của nước bằng MH2O = 18g/mol
Câu 40: Một hỗn hợp 42% phenol trong nước phân thành hai lớp. Lớp thứ nhất chứa
70% phenol và 30% nước; lớp thứ hai chứa 8% phenol và 92% nước. Xác định số mol
của các chất trong mỗi lớp, nếu lượng hỗn hợp tổng cộng là 1kg.
Cho biết: MH2O = 18g/mol, Mphenol = 94g/mol
Câu 41: Áp suất hơi của axit xyanhydric HCN phụ thuộc vào nhiệt độ theo phương trình: lgP(mmHg) = 7,04 – 1237/T Tính:
a/ Nhiệt độ sôi ở điều kiện thường b/ Nhiệt hóa hơi
Câu 42: Một dung dịch lý tưởng ở 900C gồm toluen và xylen trong đó toluen chiếm
55,1% khối lượng; áp suất chung của hệ bằng 760mmHg. Tính:
a/ Áp suất riêng phần của toluen và xylen b/ Nồng độ phần mol của toluen và xylen
trong pha hơi cân bằng với với pha lỏng. Cho biết áp suất hơi bão hòa của toluen ở 900C
là 985mmHg. Trọng lượng phân tử của toluen MT = 92kg/kmol và của xylen MX=106kg/kmol Câu 43:
An unknown liquid has a vapor pressure of 85 mmHg at 43oC and 32 mm Hg at 20oC.
What is its heat of vaporization ? Câu 44:
Estimate the boiling point of benzene given that its vapour pressure is 20.0 kPa at 35°C and 50.0 kPa at 58.8°C? Câu 45:
Áp suất cần thiết để đun sôi nước ở 97 °C là bao nhiêu? Ở 1 atm, nhiệt độ sôi của nước là 100 °C?
Enthalpy hóa hơi của nước là 40.7 kJ/mol. Tỉ trọng của nước ở 100 °C là 0.958 g/mL và tỉ
trọng của hơi nước là 0.5983 g/L. Cho biết 101.32 J= 1 L.atm




