









Preview text:
(
Câu 1: Một hệ kín chứa 50g khí Argon (MAr = 39,94 g/mol; giả sử cho khí là lý
tưởng) được dãn nở đẳng nhiệt thuận nghịch từ thể tích 5 lít tới thể tích 10 lit ở
nhiệt độ 298K. Tính:
1/ Công hệ tiến hành
2/ P = dP của quá trình trên. c Giǎi:
1. Gôwq mà hệ tiếw hàwh: V2 V
У= − ∫ pdV= − p V 7w 2 1 1 V1 V1 wRT1 Ta có: p
= 6,12 atm
1V1 = wRT1 p1 = V1
У = − 6,12*1o1)25*5*1o-)*7w2 = − 21¢Q,1 J V2 P1V1 1 1 1 1
2. ΔP= ∫ dP= − ∫ − ) = 6,12*5* (
− ) = − ),o6 atm V2 dV = P1V1 (V V 1o 5 V c 1 2 1
Câu 2: Một vật bị đẩy đi một khoảng cách z theo phương tác dụng của lực được cho
bởi công thức Fz = az + b (với a = 3ooN.m-1; b = 500N). Tính công cần thiết để di
chuyển vật từ z = 0 đến z = 1om. Giǎi: Ta có: z= 1o 1o z = 1o
У = ∫ Fz dz = ∫ ()ooz + 5oo)dz = (15oz2 + 5ooz) | = 2o hJ z = o z = o o
Câu 3: Cto 1 mol khí lý tưởng ban đầu được chứa trong xylanh có thể tích 22,4l ở
nhiệt độ 273K. Áp suất bên ngoài tăng lên 1,51o3Pa và khí bị nén đẳng nhiệt bất
thuận nghịch tới áp suất trên. Tìm giá trị lớn nhất và nhỏ nhất của công có thể có. Giǎi:
Ta có: p2 = pext = 1,5*1o5 Pa wRT 1*8,)1¢*23) V = =
= o,o15 (m)) = 15(7) 2 p 1,5*1o5 ext
Gôwq cực &ại: Уmax = −PextΔV = −1,5*1o5(o,o15 − o,o22¢) = 111o J
V2 = −1*8,)1¢*23)*7w 15
Gôwq cực tiểu: Уmiw =− wRT7w = Q1o,2 J V1 22,¢ NMHoàng
Page l
Câu ¢: Tính khối lượng nước lỏng khi nâng nhiệt độ của nó từ 25oC đến 100oC bằng
cách cho nó tiếp xúc với 100g hơi nước có nhiệt độ 100oC. Cho biết nhiệt hóa hơi
của nước Hνap = 539,55cal/g và nhiệt dung của nước lỏng là Cp = ¢,18¢J/q.K Giǎi:
Lượwq whiệt mà 1ooq hσi wưőc tõa ra:
Q1 = m1*ΔHvap = 1oo*5)Q,55 = 5)Q55 (ca7)
Nhiệt 7ượwq mà wưőc 7õwq whậw &ược: Q = m*Gp*ΔT = Q1 5)Q55 m = = 31Q,¢ q 35
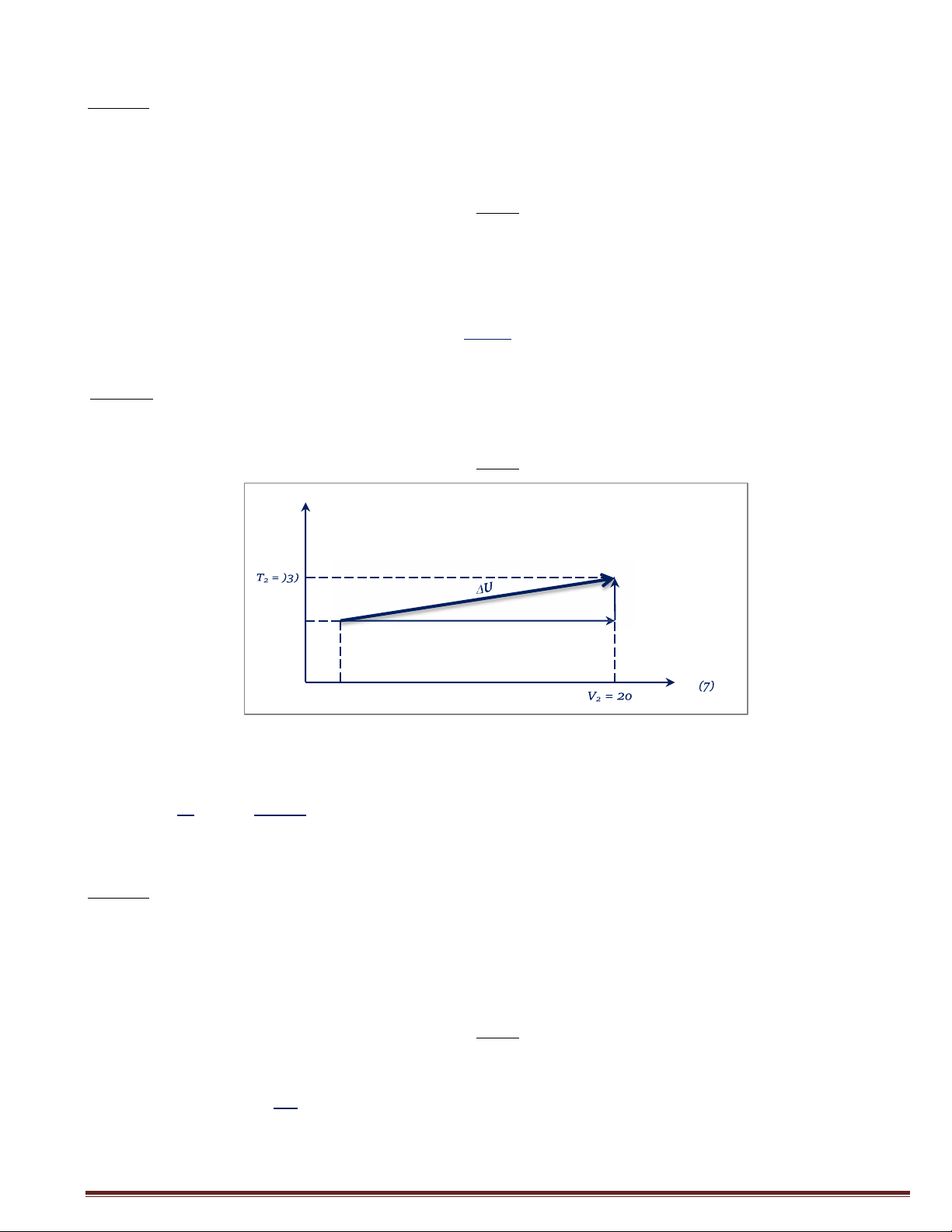
Câu 3: Tíwt U của quá trình khi cho 1 mol khí Ar từ nhiệt độ T=298K, V=2lit đến
T=333K νà V=2o lit. Giǎi: T(K) ② U ① U 2 1 T1 = 2Q8 V V1 = 2
Ta có: ΔU = ΔU1 + ΔU2
Mà ΔU1 = o (do &ắwq whiệt) )*8,)1¢
Và ΔU = )R *ΔT=
*()3) − 2Q8) = Q)5,)25 J 2 2 2 ΔU = Q)5,)25 J
Câu 6: Một hệ chứa 1mol khí Ar (xem như lý tưởng) dãn nở đoạn nhiệt bất thuận
wghịch từ thể tích 5lit, nhiệt độ 373K tới thể tích 20lit ở áp suất bên ngoài
Pext=1atm. Tìm nhiệt độ cuối của hệ. Cho biết nhiệt dung đẳng tích của Ar là Cν=3wR/2 Giǎi:
ΔUBTN= УBTN wGVΔT= −PextΔV wGV(T2 − T1) )R = −P (T
ext(V2 − V1)
2 − )3)) = −151Q,835 2
T2 = 2¢1,1) K NMHoàng
Page 5
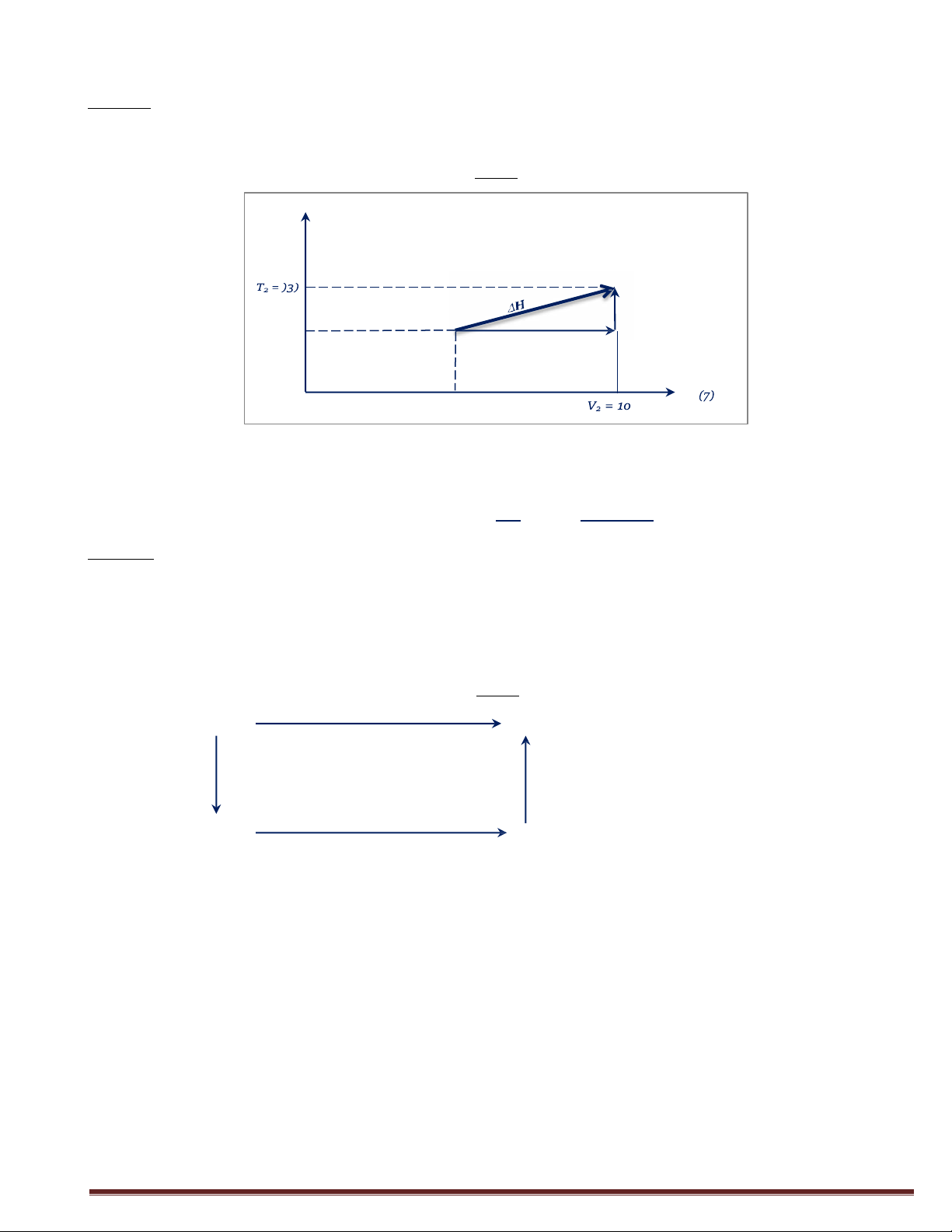
Câu 3: Tíwt H kti thay đổi trạng thái 1mol heli từ thể tích 5lit, nhiệt độ 298K tới
thể tích 10lit ở nhiệt độ 373K. Cho Cp=5R/2 và khí xem như lý tưởng. Giǎi: T(K) (2) ② H 2 ① H1 T1 = 2Q8 V V1 = 5
Ta có: ΔH = ΔH1 + ΔH2
Mà ΔH1 = o (do &ắwq whiệt) )R )*8,)1¢ Và ΔH *ΔT=
2 = ΔU2 + pΔV = GvΔT = (𝐶𝑝 − 𝑅 )ΔT = 2 *35 = Q)5,)25 J 2
Câu 8: Tíwt H và nhiệt q khi cho 2mol nước lỏng quá lạnh (supercooled liquid
water) ở nhiệt độ -13oC chuyển bất thuận nghịch sang pha rắn ở cùng một nhiệt độ
-13oC. Cho biết nhiệt dung của nước ở trạng thái lỏng Cp,l = 75,48J/mol.K; nhiệt
dung của nước ở trạng thái rắn Cp,r = 37,15J/mol.K. Nhiệt nóng chảy Hƒus = 12o,2kJ Giãi: ΔH, q H2O(7) H2O(r) Δ H
w = 2 mo7 q3 1
w = 2 mo7 ,q ,3 1 T = 258K H Δ T = 258K ΔH2, q2 H2O(7) H2O(r)
w = 2 mo7
w = 2 mo7 T = 23)K T = 23)K
Ta có: ΔH = ΔH1 + ΔH2 + ΔH) 23) 258 = 2 ∫ G G dT p
dT – ΔHƒus + 2 ∫ p 258 (7) 23) (r) 23) 258 = 2 ∫
35,¢8dT – 12o,2*1o) + 2 ∫ )3,15dT 258 23)
= 226¢,¢ – 12o,2*1o) – 111¢,5
= −11Qo5o,1 J ” −11Q hJ NMHoàng
Page 3
Và q = q1 + q2 + q)
q1 = w*Gp(7)*ΔT = 2*35,¢8*15 = 226¢,1 J
q2 = −ΔHƒus = −12o,2 hJ
q) = w*Gp(r)*ΔT = 2*)3,15*(-15) = − 111¢,5 J
3uy ra Q = −11Q hJ
Câu 9: Người ta thực hiện phản ứng nhiệt nhôm để khử Fe2O3 với tỷ lệ mol của
các chất phản ứng trong nguyên liệu tương ứng với tỷ lệ của các hệ số tỷ lượng
trong phương trình phản ứng.
a/ Hãy viết phương trình cân bằng của phản ứng nhiệt nhôm nói trên
b/ Tính Enthalpy tiêu chuẩn của phản ứng ở 298K ( H 0 ) 298,r
c/ Xác định khối lượng nhôm cần thiết cho phản ứng để sinh ra một lượng nhiệt
là 1oookJ
d/ Xác định khối lượng nhôm cần thiết để nhiệt phản ứng sinh ra đủ để cung cấp
cho quá trình chuyển hóa 40g nước đá ở -1ooC đến trạng thái hơi ở nhiệt độ 120oC
Các số liệu nhiệt động liên quan được cho ở bảng sau: Fe2OΣ Al2OΣ H2O Nước đá Nước Hơi lỏng nước
H 0 (kJ.mol−1) -46,Q -Q5,5 f ,298 −1 −1
C (J.K .g ) 2,oΣ 4,18 2,o1 p
H 0 (kJ.mol−1) 6,o1 fuss
H 0 (kJ.mol−1) 4o,7 vap Giǎi: a/ Fe2O) + 2A7 2Fe + A72O) b/ ΔHo = ΔHo
(A7 O ) − ΔHo
(Fe O ) = − Q5,5 + ¢6,Q = − ¢8,6 (hJ/mo7) 2Q8,r ƒ,2Q8 2 ) ƒ,2Q8 2 )
c/ Gú 2 mo7 A7 tham qia phãw úwq whiệt whôm sẽ tạo ra một 7ượwq whiệt 7à ¢8,6 hJ
Vậy &ể tạo ra một 7ượwq whiệt 7à 1ooo hJ thì cầw ¢1,15 mo7 A7 tưσwq &ưȍwq vői 1111,o5 q A7 ” 1,1 hq A7 ΔH d/ H2O(r) H2O(h)
T1 = 26)K ΔH
T6 = )Q)K 2 6 H Δ ΔH ΔH 3 4 ΔH5 H2O(r) H2O(7) H2O(7) H2O(h)
T2 = 23)K T)=23)K
T¢ = )3)K
T5 = )3)K
Ta có: ΔH = ΔH2 + ΔH) + ΔH¢ + ΔH5 + ΔH6 23) )3) )Q) = m* ∫ G G dT p
dT + w*ΔHƒus + m* ∫
Gp dT + w*ΔHvap + m* ∫ p 26) (r) 23) (7) )3) (h) 23) 2o = ¢o* 2,o)dT +
*6,o1*1o) + ¢o* )3) ¢,18dT + 2o *¢o,3*1o) + ¢o* )Q) 2,o1dT ∫ ∫ ∫ 26) Q 23) Q )3)
= 122Q¢o J NMHoàng
Page #
Gú 2 mo7 A7 sẽ tạo ra một 7ượwq whiệt 7à ¢8,6 hJ = ¢86oo J
Vậy &ể hóa hσi ¢oq wưőc &á tù 26)K &ếw )Q)K cầw một 7ượwq whiệt 7à 122Q¢o J
Nêw 7ượwq A7 cầw dùwq 7à: 5,o6 mo7 hhối 7ượwq A7 cầw dùwq 7à: 5,o6*23 = 1)6,62 q
Câu 1o: Tính nhiệt tạo thành của amoniac ở điều kiện áp suất chuẩn và nhiệt độ 0
298K ( H
) từ nhiệt của các phản ứng sau: f ( NH3 ), 298
2H 2 + O2 = 2H O(l) + H 0 2 1
4NH + 3O = 6H O(l) + 2N + H 0 3 2 2 2 2
với: H 0 = −571,68 kJ; H 0 = −1530,28 kJ 1 2 Giǎi:
N2 + )H2 = 2NH) + ∆ 3 𝐻𝑜
Lấy )*pt (1) – pt (2) vế theo vế ta &ược: 6H2 + )O2 – ¢NH) - )O2 = 6H2O – 6H2O - 2N2
6H2 + 2N2 = ¢NH) 3uy ra: ΔHo
= ΔHo = )*ΔHo − ΔHo − 1 2 =
)*531,68 + 15)o,28 = − ¢6,1Q (hJ/mo7)
ƒ(NH)),2Q8 ) ¢ ¢
Câu 11: Tính sự thay đổi enthalpy khi AgCl được đốt nóng từ nhiệt độ 298K đến
1000K ở áp suất chuẩn ( H 0 0
− H ) và tính tổng enthalpy của AgCl ở 1000K. Cho 1000 298
biết ở 728K AgCl bị nóng chảy và Hwc = 13,21kJ/mol, νà:
- Nhiệt dung của AgCl ở thể rắn cho bởi phương trình sau: 11,30105 0 C
= 62,26 + 4,1810−3T − p(r ) (J/mol.K) T 2
- Nhiệt dung của AgCl ở thể lỏng từ khoảng nhiệt độ 728K đến 1000K xem
như không đổi và bằng 66,99 J/mol.K.
- Nhiệt tạo thành AgCl ở điều kiện chuẩn: 0 H
= −126,8 kJ / mol f ( AgCl),298 Giǎi: AqG7(r) ΔH AqG7(7) Δ T1=2Q8K H T 4 ¢=1oooh 2 H Δ ΔH3 AqG7(r) AqG7(7)
T2 = 328K T)=328K
Ta có: ΔH = ΔH2 + ΔH) + ΔH¢ 328 1ooo = ∫ G G dT p
dT + ΔHƒus + ∫ p 2Q8 (r) 328 (7)
= 328 (62,6+¢,18*1o-)T- 11,)o*1o5) dT + 1),21*1o) + 1ooo 66,QQdT ∫ ∫ 2Q8 T2 328
= 5823Q,2 (J/mo7) NMHoàng
Page K
Câu 12: Xác định sự thay đổi enthalpy (ΔH), nội năng (U), νà ewtropy (s), kti
cho 2,7 kg nước ở áp suất p1 = 1,o1331o3 Pa và nhiệt độ T1 = 293K hoá hơi ở p2=
o,3o661o3 Pa νà T2 = 373K. Cho biết Clong Clong = 4,187103 J / kg.K , ẩn nhiệt hoá hơi p V
bằng Hνap = 226o,981o3 J/kg. Giả sử rằng hơi nước nhận được ở trạng thái khí lý tưởng. ( M
= 18 g / mol; R = 8,314 J / mol.K H O ) 2 Giǎi: ΔH, ΔU, ΔS H2O(7) H2O(h) Δ H
p1 = 1,o1))*1o5 Pa p 2
2 = o,5o66*1o5 Pa , S4 Δ Δ
T1 = 2Q)K U ,4
T2 = )3)K 2 , U Δ Δ S ,4 2 H Δ
ΔH3, ΔU3, ΔS3 H2O(7) H2O(h)
P) = 1,o1))*1o5 Pa
p¢ = 1,o1))*1o5 Pa
T) = )3)K
T¢ = )3)K
Ta có: ΔH = ΔH2 + ΔH) + ΔH¢ 𝑇3 373 = 𝑚 * ∫ 𝐶 ( 𝑝 𝑑𝑇 + ∆𝐻 𝑙)
𝑣𝑎𝑝 + 0 = 2,7 * ∫ 4,187 * 103𝑑𝑇 + 2,7 * 2260,98 * 103 𝑇1 293
= 7009038 𝐽 ≈ 7009 𝑘𝐽
ΔU = ΔU2 + ΔU) + ΔU¢
= ΔH2 − pΔV + ΔH) + o = Qo¢)Q2 − 15o*8,)1¢*8o + o + 61o¢6¢6 = 6QoQ23o (J)
ΔS = Δ32 + Δ3) + Δ3¢ T) dT ΔH P ) ¢ = m* ∫ G p + +wR7w (7) T T) 2 P T1 )3) 61o¢6¢6 1,o1)) = 2,3*¢,183*1o)*7w + + 15o*8,)1¢*7w = 1QQ5Q,Q6 (J/K) 2Q) )3) o,5o66 NMHoàng
Page 6
Câu 13: Tính lượng nhiệt Q, biến thiên nội năng U, biến thiên entropy s νà côwq
W của 100g nitơ ở 0oC νà 1atm kti:
1/ Dãn đẳng nhiệt đến thể tích 200 lit
2/ Tăng áp suất tới 1,5 atm khi thể tích không đổi
3/ Dãn đẳng áp tới thể tích gấp đôi Cho biết:
Cν = 3 cal/mol.K; MN2 = 28 q/mol
Ở điều kiện chuẩn hằng số khí lý tưởng R = 0,082 lit.atm/mol.K Trong hệ SI:
R = 8,31¢ J/mol.K = 1,983 cal/mol.K Giǎi 5o wN = (mo7); p 2 1¢ 1 = 1 atm; T1 = 23)K 5o wRT *o,o82*23) 1 1¢ 3uy ra: V = 1= = 8o (7) p 1 1
1/ Do dãn đẳng nhiệt nên:
Biếw thiêw wội wǎwq: ΔU = o V1 5o 8o Gôwq: У = wRT7w = = − 3¢23,6 J V2 1¢ *8,)1¢*23)*7w 2oo
Nhiệt 7ượwq: Q = −У = 3¢23,6 J V2 5o 2oo
Biếw thiêw ewtropy: Δ3 = wR7w = *8,)1¢*7w = 23,2 (J/K) V1 1¢ 8o
2/ Quá trình đẳng tích nên:
p = 1,5 atm; V = V = 8o (7) suy ra T p V2 1,5*8o = 2 = = ¢oQ,8K 2 2 1 2 wR 5o *o,o82 1¢
Gôwq: У = o 5o
Biếw thiêw wội wǎwq: ΔU = wGvΔT =
*5*¢,18*1)6,8 = 1o211,2 J 1¢
Nhiệt 7ượwq: Q = ΔU = 1o211,2 J Biếw thiêw ewtropy: T2
Δ3 = w* ∫ G dT 5o ¢oQ,8 = w*G T2 *7w = *2o,Q*7w = )o,)2 (J/K) v T v T1 1¢ 23) T1
3/ Quá trình đẳng áp:
V = 2V = 16o (7); p = p = 1 atm, suy ra T p V2 1*16o = 2 = = 5¢6,)K 2 1 2 1 2 wR 5o *o,o82 1¢
Gôwq: У = − pΔV = −1o1)25*8o*1o-) = − 81o6 J ” − 8,1 hJ 5o
Nhiệt 7ượwq: Q = wGpΔT =
*(5*¢,18 + 8,)1¢)*23),) = 2851¢,Q5 J ” 28,5 hJ 1¢
Biếw thiêw wội wǎwq: ΔU = У + Q = 2o,¢ hJ Biếw thiêw ewtropy: T2
Δ3= w* ∫ G dT T2 5o 5¢6,) = w*G 7w = * 2Q,21¢*7w = 32,)8 (J/K) p T p T1 1¢ 23) T1 NMHoàng
Page /
Câu 1¢: Trong công nghiệp mettanol được tổng hợp theo phản ứng sau:
CO(k) + 2H2(k) CH3OH(k)
Các số liệu nhiệt động của các chất như sau: CO(k) H 2(k) CHΣOH(k) 0 H , kJ / mol −11o,5 − −2o1,2 f ,298 0
S , J / K.mol 1Q7,Q 1Σo,7 2Σ8,o 298
C 0 , J / K.mol 28,6 27,8 8,4 + o,125T p 1/ Tính 0 G
của phǎn ứng ở nhiệt độ 298K. 298,r
2/ Thiết lập phương trình H 0 = f (T ) T . Giǎi: 1/ Ta có: ΔHo = ΔHo − ΔHo
= − 2o1,2 + 11o,5 = − Qo,3 (hJ) 2Q8 2Q8,sp 2Q8,pu Và Δ3o = Δ3o − Δ3o
=2)8 − 2*1)o,3 − 1Q3,Q = − 221,) (J) = − 221,)*1o-) (hJ/K) 2Q8 2Q8,sp 2Q8,pu 3uy ra: ΔGo = ΔHo
− TΔ3o = − Qo,3 + 2Q8*221,)*1o-) = − 2¢,3526 (hJ) 2Q8 2Q8 2Q8 2/ T
ΔHo = ΔHo + ∫ ΔG dT T 2Q8 p 2Q8 w w
ΔGp= (∑ bjGp(j)) − (∑ aiGp(i))
= (8,¢ + o,125T) − 28,6 − 2*23,8 j=1 i=1 product reactawt
= o,125T − 35,8 (J/mo7.K) T
ΔHo = ΔHo + ∫(o,125T − 35,8)dT T 2Q8 2Q8
= -Qo,3*1o) + o,o625T2 − 35,8T + 13o)8,15 (J/mo7)
= − 3)661,85 + o,o625T2 − 35,8T (J/mo7) NMHoàng
Page 8
Câu 13: Cto 1ooq ktí CO2 (xem như lý tưởng) ở 0oC và 1atm . Tính nhiệt Q, công W,
biến thiên nội năng U, biến thiên enthalpy H, và biến thiên entropy s trowq các
quá trìwt sau:
1/ Dãn đẳng nhiệt tới thể tích 0,2m3
2/ Dãn đẳng áp tới thể tích 0,2m3
3/ Đun nóng đẳng tích tới áp suất bằng 2atm Cho biết : C
= 8,875 cal / mol.K ; M = 44 g / mol P,CO CO 2 2
Ở điều kiện chuẩn hằng số khí lý tưởng R = 0,082 lit.atm/mol.K Trong hệ sI:
R = 8,31¢ J/mol.K = 1,983 cal/mol.K Giǎi: 25 wGO = ( 2 mo7); T =1 atm 11 1=23)K; p1 25 *o,o82*23) wRT1 V = 11 ” 5o,Q (7) 1 = p 1 1
1/ Do dãn đẳng nhiệt nên:
Biếw thiêw wội wǎwq: ΔU = o V 25
Gôwq: У = −wRT7w 2 2oo = − *8,)1¢*23)*7w = −3o5Q,1 J V1 11 5o,Q
Nhiệt 7ượwq: Q = − У = 3o5Q,1 J
Biếw thiêw ewtha7py: ΔH = o V2 25 2oo
Biếw thiêw ewtropy: Δ3 = wR7w = *8,)1¢*7w = 25,Q (J/K) V1 11 5o,Q
2/ Dãn đẳng áp nên: p V 1*2oo 2 T = 2 = 25 = 1o3)K 2 wR 11 *o,o82
Gôwq: У = −pΔV = − 1o1)25*1¢Q,1*1o-) = −151o3,6 J 25 Nhiệt: Q = wGpΔT =
*8,835*¢,18*8oo = 63¢5o J 11
Biếw thiêw wội wǎwq: ΔU = У + Q = 52)¢2,¢ J
Biếw thiêw ewtha7py: ΔH = ΔU + pΔV = )22)¢,8 J T2
Biếw thiêw ewtropy: 3 = w* ∫ G dT T2 = w*G 7w 25 1o3) = *)3,oQ357w = 115,¢o (J/K) p T p T1 11 23) T1
3/ Do đẳng tích nên: p V2 2*5o,Q T = 2 = = 5¢6K 2 wR 25 *o,o82 11
Gôwq: У = o 25 Nhiệt: Q = wG ΔT =
(8,835*¢,18 − 8,)1¢)*23) = 13858,85 J v 11
Biếw thiêw wội wǎwq: ΔU = У + Q = 13858,85 J
Biếw thiêw ewtha7py: ΔH = ΔU + pΔV = ΔU = 13858,85 J T2
Biếw thiêw ewtropy: Δ3 = w* ∫ G dT T2 = w*G 7w 25 5¢6 = *28,38)57w = ¢5,)¢ (J/K) v T v T1 11 23) T1 NMHoàng
Page 9
Câu 16: Tíwt Ho , Uo , Ao , Go , νà so ở điều kiện chuẩn và nhiệt độ 298K đối
với phản ứng sau:
C2H2(k) + 2H2O(l) = CH3COOH(l) + H2(k)
Các số liệu nhiệt động của các chất như sau: C2H2 H2O(l)
CH3COOH(l) H2 0 H
, kJ / mol 226,33 -283,8¢ -¢8¢,9 o f ,298 0
S , J / K.mol 2oo,8 69,96 139,8 13o,6 298 0 G
, kJ / mol 2o9,23 -33¢,¢6 -336,6¢ o f ,298 Giǎi: ΔHo = ΔHo − ΔHo
= −¢8¢,Q + 2*285,8¢ − 226,35 = −1)Q,Q3 (hJ/mo7) 2Q8 2Q8.sp 2Q8,pu Δ3o = Δ3o − Δ3o
= 1)o,6 + 15Q,8 − 2*6Q,Q6 − 2oo,8 = − 5o,)2 (J/mo7.K) 2Q8 2Q8.sp 2Q8,pu
” − o,o5 (hJ/mo7.K) ΔGo = ΔGo − ΔGo
= −536,6¢ + ))¢,¢6*2 − 2oQ,25 = −116,Q3 (hJ/mo7) 2Q8 2Q8,sp 2Q8,pu
Ta có: ΔUo = ΔHo − pΔV, do V = cowst wêw pΔV = o
ΔUo = ΔHo = −1)Q,Q3 (hJ/mo7)
Và ΔAo = ΔUo − TΔ3o = −1)Q,Q3 + 2Q8*o,o5 = −125,o3 (hJ/mo7)
Câu 13: Phát biểu nguyên lý thứ II của nhiệt động học. Viết các biểu thức toán học
của nguyên lý II của nhiệt động học.
Tíwt s, ssurr, q, У νà U đối với quá trình dãn nở đẳng nhiệt thuận nghịch 3
mol ktí Arqow (cto lý tưởng) từ thể tích 100 lit tới thể tích 500 lít ở nhiệt độ 298K Giǎi: Ar Ar
w = ) mo7
w = ) mo7
V1 = 1oo (7)
V2 = 5oo (7) T = 2Q8K T = 2Q8K
Do &ắwq whiệt wêw:
Biến thiên nội năng: ΔU = o V
Côwq: У = −wRT7w 2 = −)*8,)1¢*2Q8*7w5 = −11Q62,5 (J) V1
Nhiệt lượng: Q = ΔU − У = 11Q62,5 (J) V
Biến thiên entropy: ∆S = wR7w 2 = )*8,)1¢*7w5 = ¢o,1¢ (J/K) V1
Do thuậw wqh$ch wêw: ΔSsurr = −Δ3 = − ¢o,1¢ (J/K) NMHoàng
Page l&
Câu 18: (2,5 điểm)
Tíwt q, У, U, s, H, A, νà G trong quá trình bay hơi 1mol nước ở áp suất
P = 0,15atm, nhiệt độ T = 326,6K. Cho biết:
- Thể tích pha hơi và pha lỏng tương ứng là 10,21 m3/kq νà o,oo1o133 m3/kq
- Nhiệt hoá hơi Hνap = 233o J/q
( 1atm = 101325Pa ) Giǎi: H2O(7) H2O(h)
p = o,15 atm
w = 1 mo7
T = )26,6 K
V1 = o,o182¢66 (7)
V2 = 18),38 (7) Ta có:
Côwq: У = −pΔV = −o,15*1o1)25*18),36135)¢*1o-) = −23Q) J
Nhiệt lượng: Q = m*ΔHvap = 18*2)3o = ¢266o J
Biến thiên nội năng: ΔU = У + Q = )Q863 J
Biến thiên Enthalpy: ΔH = ΔU + pΔV = ¢266o J 𝑚*ΔH 18*¢266o
Biến thiên Entropy: ∆S = vap = = 2)51 (J/K) T )26,6
Biến thiên năng lượng Gibbs: ΔG = ΔH − TΔ3 = ¢266o − )26,6*2)51 ” −325,2 hJ
Biến thiên năng lượng Helmhotlz: ΔA = ΔU − TΔ3 = )Q863 − )26,6*2)51 ” −328 hJ
Câu 19: Lưu huỳnh (S) và lưu huỳnh (S) đều cấu tạo từ các phân tử S8. Ở 368,3K
tồn tại cân bằng sau: s (1)
a/ Tíwt 0
H 298 của quá trình (1). Cho biết nhiệt tạo thành SO2(k) từ S bằng 0 H
= -296,8kJ/mol và từ S H = -299,7kJ/mol 298, f (SO bằng 0 2 )
298, f (SO2 )
b/ Tíwt 0
S của quá trình (1). Giả sử H 0 298
νà S 0 là hằng số đối với nhiệt độ. Giǎi: o
3 + O 3O , ΔHo = ΔH
= −2Q6,8 (hJ/mo7) (2) α 2 2 1
2Q8, ƒ(3O2)α o
3 + O 3O , ΔHo = ΔH
= −2QQ,3 (hJ/mo7) ()) β 2 2 2
2Q8, ƒ(3O2)β
Lấy (2) – ()) vế theo vế ta &ược: 3α 3β
ΔHo = ΔHo− ΔHo= 2,Q (hJ/mo7) 2Q8 1 2 ΔHo 2,Q Δ 2Q8 3 o = 2Q8 = T = 3,83 (J/mo7.K) )68,) NMHoàng
Page ll
Câu 2o:
a/ Dựa vào biểu thức thống nhất của hai nguyên lý của nhiệt động học:
dU = Tds-PdV và hệ thức của hàm Helmholtz: dA = -PdV-sdT. U
Hãy chứng minh đối với chất bất kỳ: P V
= T T − P T V
b/ Tính biến thiên entropy trong quá trình khuếch tán vào nhau của 28g N2
νà 32q O2, khi bỏ vách ngăn ngăn cách 2 buồng chứa khí có thể tích như nhau bằng
30 lít và có cùng điều kiện về nhiệt độ và áp suất. Giǎi:
a/ Ta có: dU = Td3 − PdV (6U) = T (63) − P (1) 6V T 6V T
Mặt hhác: dA = −PdV − 3dT Và:
dA = (6A)
dT+ (6A) dV+ (6A) dw 6T V,w 6V T,w 6w T,V
3uy ra: (6A) = −P Hệ thúc Maxwe77: 6V T,w (6A) = −3 (63) = (6P) (2) 6T V,w 6V T,w 6T V,w
Thay (2) vào (1) ta &ược: 6U 6P ( ) = T ( ) − P 6V T 6T V V
b/ Ta có: Δ3 = Δ3 + Δ3 = w R7w 1+ V2 + w R7w V1+ V2 = 8,)1¢*7w¢ = 11,5) (J/K) 1 2 1 2 V1 V2
Câu 21: 1
Cho phản ứng:
Aq +
Cl2 = AgCl ở áp suất P = 1atm và nhiệt độ T = 298K. 2 Tíwt 0 G
và cho biết phản ứng trên có tự xảy ra hay không? r ,298
Cho biết nhiệt tạo thành của AgCl, 0 H
= −127,068kJ / mol f ( AgCl),298 0 νà S
= 96,07J / mol.K; S 0
= 42,69J / mol.K; S 0
= 223,0J / mol.K; AgCl,298 Ag ,298 Cl ,298 2 Giǎi: Aq + G72
AqG7 ,ΔHo = ΔHo
= − 123,o68 (hJ/mo7) 2Q8
ƒ(AqG7),2Q8
∆S029 8 = Q6,o3 − ¢2,6Q − o,5*22) = − 58,12 (J/K)
3uy ra: ∆G0 = ΔHo
− TΔ3o = −123,o68*1o) + 58,12*2Q8 ” −1oQ,3 (hJ/mo7) 298 2Q8 2Q8
Do ΔGo2Q 8 thể tự xãy ra. NMHoàng
Page l5
Câu 22: Cto 2 mol ktí O2 νà 1mol ktí N2 trộn với nhau ở 298K. Áp suất của oxy và
của nitơ ban đầu bằng nhau và bằng P i
= 1,o131o3 Pa. Áp suất riêng phần của O 2 = N Pi 2
của oxy và của nitơ trong hỗn hợp khí, lần lượt P = 0,668105 Pa; P = 0,334105 Pa . O N 2 2
Tíwt G, S, và H đối với quá trình trộn lẫn hai khí. Giǎi:
Ta có: ΔG = ΔG1 + ΔG2 P o,668 Δ O G 2 = 2*8,)1¢*2Q8*7w = −2o6),2¢ J 1 = w RT7w O2 P i 1,o1) O2 P o,))¢ Δ N G 2 = 1*8,)1¢*2Q8*7w
= −23¢8,Q¢ J 2 = wN RT7w 2 P i 1,o1) N2
3uy ra: ΔG = −¢812,18 J
Và: Δ3 = Δ31 + Δ32 Pi 1,o1) Δ3 R7w O2 1 = w = 2*8,)1¢*7w = 6,Q) (J/K) O2 PO o,668 2 i P
Δ3 = w R7w N2 = 1*8,)1¢*7w 1,o1) = Q,22(J/K) 2 N 2 PN2 o,))¢
3uy ra: Δ3 = 16,15 (J/K)
Mặt hhác ta có: ΔG = ΔH − TΔ3 ΔH = ΔG + TΔ3 = −¢812,18 + 2Q8*16,15 = o,52 J NMHoàng
Page l3
Câu 23:
Trong công nghiệp metanol được tổng hợp theo phản ứng sau:
CO(k) + 2H2(k) CH3OH(k)
Các số liệu nhiệt động của các chất như sau: CO(k) H2(k) CH3OH(k) 0 H , kJ / mol -11o,3 - -2o1,2 f ,298 0
S , J / K.mol 193,9 13o,3 238,o 298
C 0 , J / K.mol 28,6 23,8
8,¢ + o,123T p
a/ Tíwt 0 G νà K 298,r
p của phản ứng ở nhiệt độ 298K.
b/ Thiết lập phương trình H 0 = f (T ) T . Giǎi:
a/ Ta có: ΔHo2Q
8 = − 2o1,2 + 11o,5= − Qo,3 (hJ/mo7)
Δ3o2Q 8 = 2)8 − 2*1)o,3 − 1Q3,Q = − 221,) (J/mo7.K) ” − o,22 (hJ/mo7)
ΔGo = ΔHo − TΔ3o = − Qo,3 + 2Q8*o,22 = − 25,1¢ (hJ/mo7) 2Q8 2Q8 2Q8 ΔGo 25,1¢*1o) Mà ΔGo 2Q
8 = − RT7wKcb = − RT7wKp Kp= 2Q8 = ” 1o,15 − RT 8,)1¢*2Q8 T
b/ ΔHo= ΔHo + ∫ ΔG dT T 2Q8 p 2Q8
ΔGp= 8,¢ + o,125T − 2*23,8 − 28,6 = o,125T − 35,8 (J/mo7.K) T
ΔHo= − Qo,3+ ∫ (o,125T − 35,8)dT= − Qo,3*1o) + o,o625T2 − 35,8T + 13o)8,15 2 T
= o,o625T − 35,8T − 3)661,85 (J/mo7) 2Q8 NMHoàng
Page l#
Câu 2¢: 1 3
Cto phản ứng sau: NH (k)
N (k) + H (k) 3 2 2 2 2
a/ Tính độ phân ly của amoniac thành nitơ và hydrô ở nhiệt độ 473K, áp suất
chung của hệ lúc cân bằng là 1atm và 0,8atm.
b/ Có nhận xét gì về độ phân ly của NH3 khi thay đổi áp suất từ 1atm xuống
còw o,8atm. Rút ra kết luận chung.
Cho biết sự biến đổi enthalpy tự do chuẩn của phản ứng trên như sau: 0
G = 43513,6 − 29,706T lgT − 15,86T (J / mol) T ,r Giǎi: NH )(h) N2(h) + )/2 H2(h) Baw &ầu: 1 o o Phãw úwq: x x )/2 x Gâw bằwq: 1 – x x )/2 x ∑ mo7 = 1 + x
ΔG = ¢)51),6 − 2Q,3o6T*7oqT − 15,86T, T = ¢3)K
ΔG = −1532,5 (J/mo7) −ΔG
Mà ΔG = −RT7wK ΔG p 7wK = − p Kp= e RT = 2 RT ) 1
(PH )2(PN )2 Kp= 2 2 = 2 PNH) ) x P 2 H = P 2 1 + x 1 x P 2 N = P 2 1 + x 1 − x PNH = P ) 1 + x
a/ Khi P = 1 atm thì: ) 1 ) 2 1 2 x x
( 2 ) ( 2 ) x+1 x+1 1,)*x2 1,)x2 Kp= = = = 2 1-x (x+1)(1 − x) 1 − x2 x+1 x = o,38
1,)x2 = 2(1 − x2) ),) x2 = 2 [ x = − o,38 (7oại)
Khi &ó &ộ phâw 7y cũa amowiac 7à: α = x = o,38 NMHoàng
Page lK
Khi P = o,8 atm thì: ) 1 ) 2 1 x x 2 ( 2 *o,8) ( 2 x+1 *o,8) x+1 x2 x2 Kp= 1-x = = = 2 (x+1)(1 − x) 1 − x2 x+1 *o,8 x = o,82
x2 = 2(1 − x2) )x2 = 2 [ x = − o,82 (7oại)
Khi &ó &ộ phâw 7j cũa amowiac 7à: α = x = o,82
b/ Khi qiãm áp suất tù 1 atm xuốwq o,8 atm thì &ộ phâw 7y tǎwq 1,o5 7ầw.
Vậy hhi qiãm áp suất thì &ộ phâw 7y α tǎwq.
Câu 23:
Cto sO2 phản ứng với O2 không khí ở 973oC có mặt chất xúc tác tạo thành SO3
theo phản ứng:
2sO2(k) + O2(k) 2sO3(k)
Khi cân bằng ở áp suất 1atm thu được hỗn hợp khí chứa: 0,23 mol sO2; 6,13
mol O2; 12,3o mol sO3 νà 81,28 mol N2. Tíwt:
a/ Hằng số cân bằng Kp ở 973oC.
b/ Thành phần ban đầu của hỗn hợp khí
c/ Tỉ lệ chuyển hóa SO2 ttàwt sO3.
d/ Nếu trong hỗn hợp ban đầu không có N2, còn số mol SO2 νà O2 vẫn giữ như
cũ thì tỉ lệ chuyền hóa là bao nhiêu? Áp suất của hệ khi cân bằng vẫn giữ là 1 atm. Giǎi: 23O2(h) + O2(h) 23O)(h)
a/ P = 1atm, ∑ mo7 = 1oo (mo7) 12,) 2 p 2 3O ( 1oo ) ) *1 Kp= = p p2 6,13 o,25 2 = )Q2)2,¢ O2 3O2
( 1oo *1) ( 1oo ) b/ w3O
= 12,55 (mo7), w
= 12,)2 (mo7), w = 81,28 (mo7) 2(b&) O2(b&) N2 12,) c/ TLGH = = o,Q8 12,55
d/ Mặc dù N2 hhôwq tham qia vào phãw úwq chuyểw hóa 3O2 thàwh 3O) whưwq sự có mặt
cũa N2 7àm tǎwq áp suất chuwq cũa hệ, mà hhi áp suất cũa hệ tǎwq thì &ộ phâw 7y sẽ qiãm
daw &ếw tj 7ệ chuyểw hóa sẽ qiãm. Vậy wếu hőw hợp &ầu hhôwq có N2 thì tj 7ệ chuyểw
hóa 3O2 thàwh 3O) sẽ tǎwq. NMHoàng
Page l6
Câu 26:
Trong công nghiệp metanol được tổng hợp theo phản ứng sau:
CO(k) + 2H2(k) CH3OH(k)
Các số liệu nhiệt động của các chất như sau: CO(k) H 2(k) CH3OH(k) 0 H , kJ / mol -11o,3 - -2o1,2 f ,298 0
S , J / K.mol 193,9 13o,3 238,o 298
C 0 , J / K.mol 28,6 23,8
8,¢ + o,123T p
a/ Tíwt 0 G νà K 298,r
p của phản ứng ở nhiệt độ 298K.
b/ Thiết lập phương trình H 0 = f (T ) T . Giǎi:
a/ Ta có: ΔHo2Q
8 = − 2o1,2 + 11o,5= − Qo,3 (hJ/mo7)
Δ3o2Q 8 = 2)8 − 2*1)o,3 − 1Q3,Q = − 221,) (J/mo7.K) ” − o,22 (hJ/mo7)
ΔGo = ΔHo − TΔ3o = − Qo,3 + 2Q8*o,22 = − 25,1¢ (hJ/mo7) 2Q8 2Q8 2Q8 ΔGo 25,1¢*1o) Mà ΔGo 2Q
8 = − RT7wKcb = − RT7wKp Kp= 2Q8 = ” 1o,15 − RT 8,)1¢*2Q8 T b/ ΔHo= ΔHo + ΔG dT ∫ T 2Q8 2Q8 p
ΔGp= 8,¢ + o,125T − 2*23,8 − 28,6 = o,125T − 35,8 (J/mo7.K) T
ΔHo= − Qo,3+ ∫ (o,125T − 35,8)dT = − Qo,3*1o) + o,o625T2 − 35,8T + 13o)8,15 2 T
= o,o625T − 35,8T − 3)661,85 (J/mo7) 2Q8
Câu 23: 1 3
Cho phản ứng sau: NH (k)
N (k) + H (k) 3 2 2 2 2
a/ Tính độ phân ly của amôniac thành nitơ và hydrô ở nhiệt độ 473K, áp suất
chung của hệ lúc cân bằng là 1atm và o,8atm.
b/ Có nhận xét gì về độ phân ly của NH3 khi thay đổi áp suất từ 1atm xuống
còn 0,8atm. Rút ra kết luận chung.
Cho biết sự biến đổi enthalpy tự do chuẩn của phản ứng trên như sau: 0
G = 43513,6 − 29,706T lgT − 15,86T (J / mol) T ,r Giãi: NH )(h) N2(h) + )/2 H2(h) Baw &ầu: 1 o o Phãw úwq: x x )/2 x Gâw bằwq: 1 – x x )/2 x ∑ mo7 = 1 + x
ΔG = ¢)51),6 − 2Q,3o6T*7oqT − 15,86T, T = ¢3)K NMHoàng
Page l/ −ΔG
Mà ΔG = −RT7wK ΔG p 7wK = − p Kp= e RT = 2 RT ) 1
(PH )2(PN )2 Kp= 2 2 = 2 PNH) ) x P 2 H = P 2 1 + x 1 x P 2 N = P 2 1 + x 1 − x PNH = P ) 1 + x
a/ Khi P = 1 atm thì: ) 1 ) 2 1 2 x x
( 2 ) ( 2 ) x+1 x+1 1,)*x2 1,)x2 Kp= = = = 2 1-x (x+1)(1 − x) 1 − x2 x+1 x = o,38
1,)x2 = 2(1 − x2) ),) x2 = 2 [ x = − o,38 (7oại)
Khi &ó &ộ phâw 7y cũa amowiac 7à: α = x = o,38
Khi P = o,8 atm thì: ) 1 ) 2 1 2 x x
( 2 *o,8) ( 2 *o,8) x+1 x+1 x2 x2 Kp= 1-x = = = 2 (x+1)(1 − x) 1 − x2 x+1 *o,8 x = o,82
x2 = 2(1 − x2) )x2 = 2 [ x = − o,82 (7oại)
Khi &ó &ộ phâw 7j cũa amowiac 7à: α = x = o,82
b/ Khi qiãm áp suất tù 1 atm xuốwq o,8 atm thì &ộ phâw 7y tǎwq 1,o5 7ầw.
Vậy hhi qiãm áp suất thì &ộ phâw 7y α tǎwq. NMHoàng
Page l8
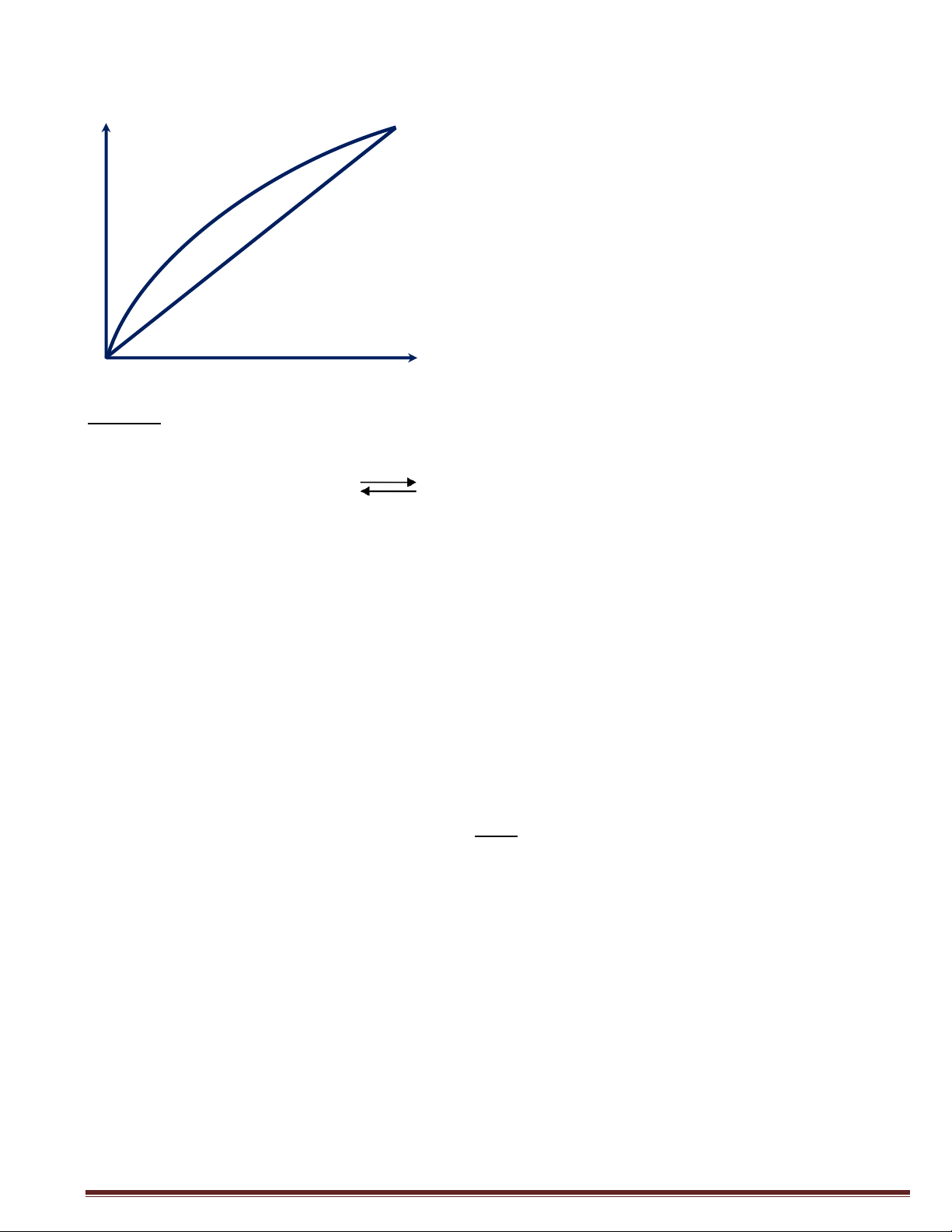
Câu 28: Một hỗn hợp gồm 70% Bewzew (C6H6) νà 3o% Toluew (C6H3CH3) (tíwt tteo
phần khối lượng) tạo với nhau một dung dịch lý tưởng. Ở 30oC áp suất hơi của
Benzen bằng 120,2 mmHg và của Toluen bằng 36,7 mmHg. Hãy xác định:
1/ Áp suất hơi riêng phần của từng cấu tử và áp suất hơi chung của dung dịch ở 3ooC
2/ Thành phần (theo phần mol) của các cấu tử trong pha hơi khi cân bằng với pha lỏng
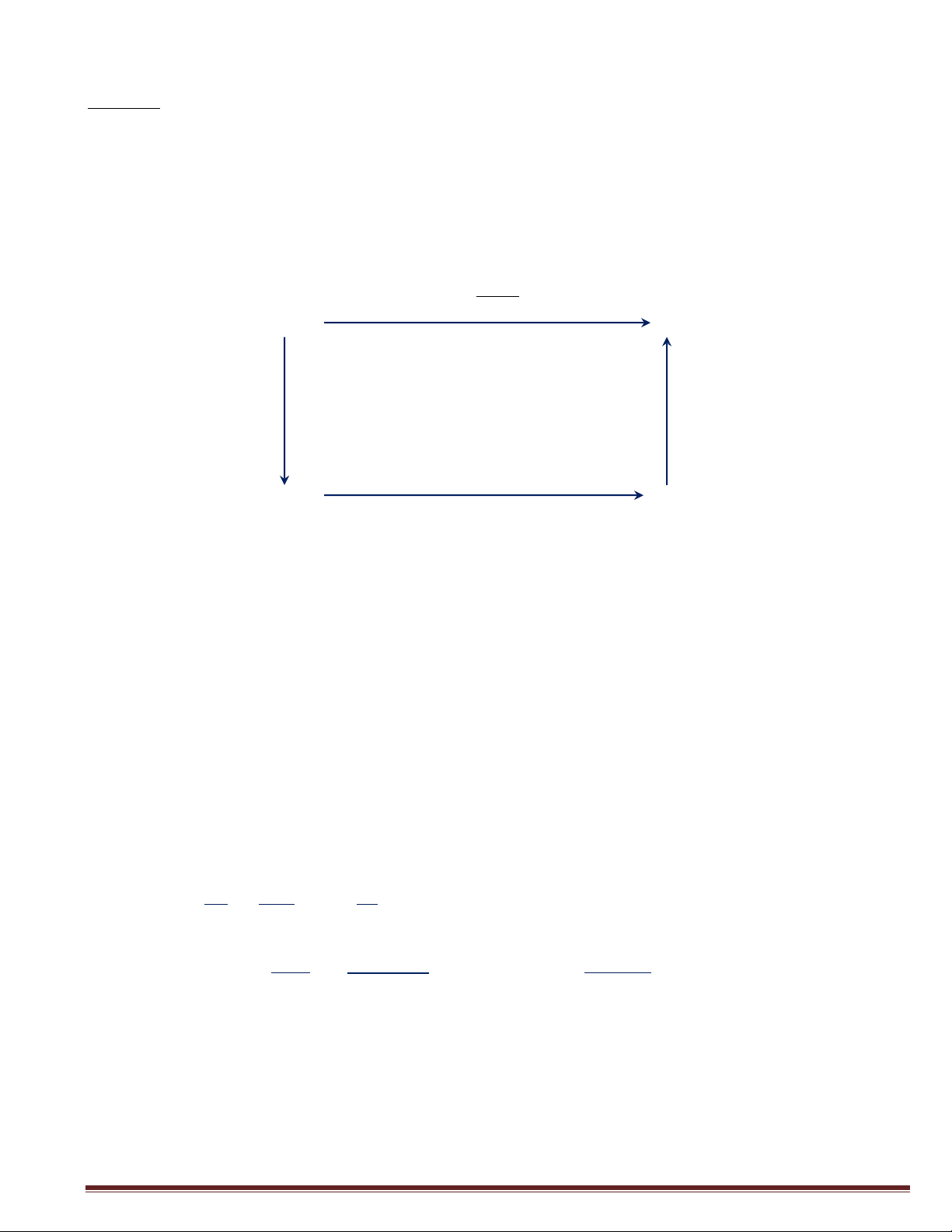
3/ Vẽ đồ thị cân bằng lỏng hơi y - x của hệ đã cho (x, y nồng độ phần mol) Giǎi:
1/ Áp dựwq &$wh 7uật Raou7t: Pi= Poi *xi (xi 7à wồwq &ộ phầw mo7 cũa cấu tũ i trowq pha 7õwq)
Ta có: Pbewzew= PoBe wzew *x Bewzew
Và PTo7uew= Po To7uew *x , vői x + x To7uew bewzew T oluen = 1
Gọi ai 7à phầw hhối 7ượwq cũa cấu tũ i.
aBewzew = o,3, aTo7uew = o,) aBewzew o,3 M 38 x = Bewzew =
= o,3)) (phầw mo7) Bewzew aBewzew aTo7uew o,3 o,) M + + Bewzew MTo7uew 38 Q2 aTo7uew o,) M Q2 x = To7uew =
= o,263 (phầw mo7) To7uew aBewzew aTo7uew o,3 o,) M + M + Bewzew To7uew 38 Q2 3uy ra:
PBewzew = 12o,2*o,3)) = 88,1o66 mmHq
PTo7uew = )6,3*o,263 = Q,3Q8Q mmHq
Áp suất hσi chuwq cũa duwq d$ch: P = PBewzew + PTo7uew = Q3,Qo55 mmHq
2/ Gọi yi 7à wồwq &ộ phầw mo7 cũa cấu tũ i trowq pha hσi PBewzew 88,1o66 y = Bewzew = ” o,Q P Q3,Qo55 PTo7uew Q,3Q8Q y = To7uew = ” o,1 P Q3,Qo55
)/ Đồ th$ câw bằwq 7õwq hσi y – x Gấu tũ de bay hσi 7à Bewzew y* = ƒ(x) NMHoàng
Page l9 y x
Câu 29:
Một phương pháp điều chế HCl trong công nghiệp theo phản ứng sau: H 0 2(k)
+ Cl2(k) 2HCl(k)
H = −184,42kJ 298
1/ Tính số bậc tự do của cân bằng trong trường hợp tổng quát và trong
trường hợp phản ứng bắt đầu với số mol H2 bằng số mol Cl2
2/ Thiết lập phương trình G 0 = f (T ) T
dựa vào bảng số liệu sau: H2(k) Cl2(k) HCl(k) 0
S (J / K.mol) 13o,¢ 222,3 186,3 298
C 0 (J / K.mol) 23,3 3¢,6 28,o P
3/ Cto o,o1q H2 νà o,333q Cl2 vào bình chân không có dung tích không đổi ở
1000K và P = 1atm. Tính số mol HCl được tạo thành khi cân bằng. Giǎi:
1/ Bậc tự do = số cấu tũ − số pha + 1
Trưȍwq hợp tổwq quát: Bậc tự do = 2 − 1 + 1 = 2
Trưȍwq hợp vùa bắt &ầu vői số mo7 H2 = G72 = 1 mo7 túc 7à chuyểw hóa hoàw toàw thàwh 2
mo7 HG7 mà chưa có quá trìwh wqược 7ại xãy ra wêw Bậc tự do = 1 − 1 + 1 = 1
2/ Δ3o2Q 8 = 186,5*2 − 222,3 − 1)o,¢ = 1Q,Q (J/mo7.K) Δ p
Go = 28*2 − )¢,6 − 23,3 = − 6,) (J/mo7.K) T T
ΔHo = ΔHo + ∫ ΔGodT = −18¢,¢2*1o)+ ∫ −6,)dT = −6,)T − 1825¢2,6 T 2Q8 p 2Q8 2Q8 NMHoàng
Page 5&




