









Preview text:
Câu 1:
Có một chiếc pin như sau: Pt, H (P
1) ddHCl KCl Hg Cl , Hg 2 H bh 2 2 2
1/ Viết các phản ứng xảy ra trong pin (gồm phản ứng trên các cực và phản
ứng tổng quát).
2/ Xác định pH. Cho biết sức điện động của pin ở 18oC bằng 0,332 V và ở nhiệt
độ này thế của điện cực calomel bão hòa bằng 0,250 V. (R = 8,31¢ J/K.mol; F =
963oo C) Giải:
1/ Cực dương (Gathode): Hq2G72 + 2e- ⇌ 2Hq + 2G7 Cực âm (Anode): H2 ⇌ 2H+ + 2e-
Trowq piw: Hq2G72 + H2 ⇌ 2Hq + 2G7 + 2H+
2/ + = 𝐻g 𝐶𝑙 /𝐻g = 0,25 (𝑉) 2 2 𝑅𝑇 (𝑎 𝐻+)2 = = 𝑜 + 𝑙𝑛 = 0,0125𝑙𝑛(𝑎 − 𝐻 + 𝐻+ )2 𝐻+/𝐻2 /𝐻2 𝑛𝐹 𝑝𝐻2
𝐸𝑝𝑖𝑛 = = 0,25 0,0125𝑙𝑛(𝑎 + − 𝐻+ )2 = 0,332 (𝑉)
2.2,303𝑙𝑜𝑔(𝑎𝐻+) = −6,56 𝑙𝑜𝑔[𝐻]+ = 1,424 𝑝𝐻 = 1,424
Câu 2:
Trong số các kim loại sau đây, kim loại nào bị ăn mòn trong không khí
ẩm có pH = 7 và nhiệt độ 25oC: Fe, Cu, Pb, Ag? Cho biết thế điện cực chuẩn của kim
loại tương ứng bằng o,¢¢; +o,3¢; 0,126; +0,799 V. Cho biết áp suất riêng phần
của oxy trong không khí ẩm bằng 0,21 atm và 0 E
1.23V . Để kim loại bị ăn mòn, O2 / H2O
nồng độ của nó không nhỏ hơn 10-6 mol/l. Giải:
Điều kiện để kim loại bị ăn mòn: 𝐸𝑐𝑏 < 𝐸𝑐𝑏 𝐾𝐿 kk ẩ𝑚
Ở 25oG: O2 + ¢e + ¢H+ ⇌ 2H2O 0,059 𝐸 = 𝐸0 + 𝑙𝑜𝑔([𝐻+]4. 𝑝 0,059 ) = 1,23 +
(𝑙𝑜𝑔(𝑝 ) − 4𝑝𝐻) 02/𝐻20 02/𝐻20 𝑛 02 4 02 0,059 = 1,23 +
(𝑙𝑜𝑔0,21 − 4.7) = 0,81 (𝑉) 4
Thế điện cực của các KL:
Fe ⇌ Fe2+ + 2e 0,059 0 [ 2+] 0,059 ( ) 𝐸𝐹𝑒2+/𝐹𝑒 = 𝐸 + 𝐹𝑒2+/𝐹𝑒 𝑙𝑜𝑔 𝐹𝑒 = −0,44 + . −6 = −0,617 (𝑉) 𝑛 2
Gu ⇌ Gu2+ + 2e 0,059 0 [ 2+] 0,059 ( ) 𝐸𝐶𝑢2+/𝐶𝑢 = 𝐸 + 𝐶𝑢2+/𝐶𝑢 𝑙𝑜𝑔 𝐶𝑢 = 0,34 + . −6 = 0,163 (𝑉) 𝑛 2
Pb ⇌ Pb2+ + 2e 0 0,059 [ 2+] 0,059 ( ) 𝐸𝑃𝑏2+/𝑃𝑏 = 𝐸 + 𝑃𝑏2+/𝑃𝑏 𝑙𝑜𝑔 𝑃𝑏 = −0,126 + . −6 = −0,303 (𝑉) 𝑛 2
Aq ⇌ Aq+ + 1e 0,059 0 [ +] 0,059 ( )
𝐸𝐴g+/𝐴g = 𝐸𝐴g+/𝐴g + 𝑙𝑜𝑔 𝐴𝑔 = 0,799 + . −6 = 0,445 (𝑉) 𝑛 1
Do tất cả các EKL < Ekk ẩm nên tất cả các kim loại đều bị ăn mòn.
Câu 3:
Tính tốc độ ăn mòn của kẽm trong nước biển ở 25oC. Cho biết thế ăn
mòn bằng -0,85 V, nồng độ Zn2+ bằng 10-6mol/l, thế điện cực chuẩn của kẽm bằng -
0,76 V, hệ số Tafel bằng 0,045 V và io,Zw = 1o-2A/cm2. Giải: Ta có: 𝑖 = 𝑖 = |−𝑖 | = 𝑖
𝑒𝑥𝑝 {𝛼𝑍𝑛𝑛𝐹 (𝜑 − 𝜑𝑐𝑏 )} 𝑐𝑜𝑟𝑟 𝑎 𝑐 0,Z𝑛 𝑅𝑇 𝑐𝑜𝑟𝑟 Z𝑛
Zw ⇌ Zw2+ + 2e 2,303𝑅𝑇 2,303𝑅𝑇 Và: 𝛽 Z𝑛 = 𝛼 𝛼 𝑛𝐹 Z𝑛 = 𝑍𝑛 𝛽𝑍𝑛𝑛𝐹 0,059 0,059 𝜑𝑐𝑏 = 𝜑0 +
𝑙𝑜𝑔[𝑍𝑛2+] = −0,76 + (−6) = −0,937 (𝑉) Z𝑛 Z𝑛 2 2 3uy ra 𝑖
= 0,01𝑒𝑥𝑝 {2,303 (−0,85 + 0,937)} = 0,858 (𝐴/𝑐𝑚2) 𝑐𝑜𝑟𝑟 0,045
Câu ¢:
Hai tấm sắt và thiếc tiếp xúc trực tiếp với nhau trong dung dịch có pH
= 4, và đã đuổi hết oxy hòa tan (PH2 = 1atm). Sắt và thiếc có bị ăn mòn trong dung
dịch này không? Tính sức điện động của pin? Chấp nhận rằng nồng độ ion tối thiểu
để gây ăn mòn là 10-6mol/l. Cho biết thế chuẩn của sắt và thiếc là – o,¢¢ νà – o,1¢ V.
Trường hợp có sự hòa tan oxy vào dung dịch (PO2 = 0,21 atm) thì sức điện
động của pin ăn mòn bằng bao nhiêu? Biết rằng 0 E 1.23V . O2 / H2O Giải:
Đã đuổi hết Oxy: Awode:
Fe ⇌ Fe2+ +2e
3w ⇌ 3w2+ + 2e Gathode:
2H+ + 2e ⇌ H2 0 0,059 [ +]2 𝐸𝐻+/𝐻 = 𝐸 + 𝑙𝑜𝑔 𝐻
= −0,059𝑝𝐻 = −0,236 (𝑉) 2 𝐻+/𝐻2 𝑛 0,059 0 [ 2+] 0,059
𝐸𝐹𝑒2+/𝐹𝑒 = 𝐸𝐹𝑒2+/𝐹𝑒 + 𝑙𝑜𝑔 𝐹𝑒 = −0,44 + (−6) = −0,617 (𝑉) 𝑛 2 0,059 0 [ 2+] 0,059
𝐸𝑆𝑛2+/𝑆𝑛 = 𝐸𝑆𝑛2+/𝑆𝑛 + 𝑙𝑜𝑔 𝑆𝑛 = −0,14 + (−6) = −0,317 (𝑉) 𝑛 2
Ta thấy: 𝐸𝐹𝑒2+/𝐹𝑒 < 𝐸𝑆𝑛2+/𝑆𝑛 < 𝐸𝐻+/𝐻 nên Fe và Sn đều bị ăn mòn. 2
Epiw = 𝐸𝐻+/𝐻 − 𝐸 2
𝐹𝑒2+/𝐹𝑒 − 𝐸𝑆𝑛2+/𝑆𝑛 = −0,236 + 0,617 + 0,317 = 0,698(𝑉)
Chưa đuổi hết Oxy: Awode:
Fe ⇌ Fe2+ +2e
3w ⇌ 3w2+ + 2e NMHoàng
Page 5 Gathode:
2H+ + 2e ⇌ H2
1/2O2 + 2H+ + 2e ⇌ H2O 0 0,059 [ +]2 𝐸𝐻+/𝐻 = 𝐸 + 𝑙𝑜𝑔 𝐻
= −0,059𝑝𝐻 = −0,236 (𝑉) 2 𝐻+/𝐻2 𝑛 0,059 1 0,059 1 0 + 2 𝐸𝐻+,0 +
𝑙𝑜𝑔 ([𝐻 ] . 𝑝 2) = 1,23 +
(𝑙𝑜𝑔0,212 − 2 * 4) = 0,984 (𝑉)
2/𝐻20 = 𝐸𝐻+,02/𝐻20 𝑛 02 2 0,059 0 [ 2+] 0,059
𝐸𝐹𝑒2+/𝐹𝑒 = 𝐸𝐹𝑒2+/𝐹𝑒 + 𝑙𝑜𝑔 𝐹𝑒 = −0,44 + (−6) = −0,617 (𝑉) 𝑛 2 0,059 0 [ 2+] 0,059
𝐸𝑆𝑛2+/𝑆𝑛 = 𝐸𝑆𝑛2+/𝑆𝑛 + 𝑙𝑜𝑔 𝑆𝑛 = −0,14 + (−6) = −0,317 (𝑉) 𝑛 2
Epiw = 𝐸𝐻+/𝐻 + 𝐸 2
𝐻+,02/𝐻20 − 𝐸𝐹𝑒2+/𝐹𝑒 − 𝐸𝑆𝑛2+/𝑆𝑛 = −0,236 + 0,984 + 0,617 + 0,317 = 1,682(𝑉)
Câu 3:
Thiết lập pin rồi tính sức điện động của nó (ở 25oC), viết phản ứng xảy
ra trong pin và phản ứng tổng quát từ các điện cực sau:
Ag, AgBr Br (C 0.34)
E 0 0.07V Br Fe 3(C
0.1), Fe2 (C 0.02) Pt
E 0 0.77V Fe3 Fe2 Giải:
(−)𝐴𝑔, 𝐴𝑔𝐵𝑟|𝐵𝑟−‖𝐹𝑒3+, 𝐹𝑒2+|𝑃𝑡 (+)
Ở Anode: Aq + Br ⇌ AqBr + 1e
Ở Cathode: Fe)+ + 1e ⇌ Fe2+
Ở trên pin: Aq + Br + Fe)+ ⇌ AqBr + Fe2+ 0,059 [𝐹𝑒3+] 0,1 0
𝜑+ = 𝜑𝐹𝑒3+/𝐹𝑒2+ + 𝑙𝑜𝑔 = 0,77 + 0,059𝑙𝑜𝑔 = 0,811 (𝑉) 𝑛 [𝐹𝑒2+] 0,02 0,059 1 𝜑 = 𝜑0 + 𝑙𝑜𝑔 1 = 0,07 + 0,059𝑙𝑜𝑔 = 0,098 (𝑉) − 𝐴g/𝐴g𝐵𝑟 𝑛 [𝐵𝑟−] 0,34
3uy ra: Epiw = + = o,811 – o,oQ8 = o,31) (V)
Câu 6:
Dựa vào sự đo ăn mòn sắt trong môi trường có pH = 3 ở 25oC, ktôwq có
sự hòa tan oxy song lại bão hòa khí 3ydro, ta thấy thế ăn mòn bằng -o,398 V.
1/ Hãy tính tốc độ hòa tan sắt.
2/ Tính mật độ dòng trao đổi đối với phản ứng thoát Hydro trên sắt.
Cho biết thế điện cực chuẩn của sắt bằng -0,44 V; nồng độ Fe2+ bằwq o,o2
mol/l; mật độ dòng trao đổi của sắt bằng 9.10-3 A/cm2; R = 8,1¢ J/K.mol; F = 963oo
C; hệ số chuyển điện tích = o,3. Giải: Ta có: 𝑖 = 𝑖
𝑒𝑥𝑝 {𝛼𝑛𝐹 (𝜑 − 𝜑𝑐𝑏 )} 𝑐𝑜𝑟𝑟 0,𝐹𝑒 𝑅𝑇 𝑐𝑜𝑟𝑟 Z𝑛
Fe ⇌ Fe2+ + 2e 0,059 0,059 𝜑𝑐𝑏 = 𝜑0 +
𝑙𝑜𝑔[𝐹𝑒2+] = −0,44 +
𝑙𝑜𝑔0,02 = −0,49 (𝑉) Z𝑛 Z𝑛 𝑛 2 3uy ra: 𝑖 = 𝑖
𝑒𝑥𝑝 {𝛼𝐹𝑒𝑛𝐹 (𝜑
− 𝜑𝑐𝑏 )} = 9. 10−7𝑒𝑥𝑝 {0,5*2*96500 (−0,398 + 0,49)} 𝑐𝑜𝑟𝑟 0,𝐹𝑒 𝑅𝑇 𝑐𝑜𝑟𝑟 Z𝑛 8,314*298
= 3,24. 10−5 (𝐴/𝑐𝑚2)
2H+ + 2e ⇌ H2 Ta có: 𝑖 = |−𝑖 | = 𝑖
𝑒𝑥𝑝 {− (1−𝛼)𝑛𝐹 (𝜑 − 𝜑𝑐𝑏 )} 𝑐𝑜𝑟𝑟 𝑐 𝑜,𝐻 𝑅𝑇 𝑐𝑜𝑟𝑟 𝐻2
𝜑𝑐𝑏 = −0,059𝑝𝐻 = −0,177(𝑉) 𝐻2 NMHoàng
Page 3 3uy ra: 𝑖 3,24. 10−5 𝑖 𝑐𝑜𝑟𝑟 𝑜,𝐻 = = 0,5 * 2 * 96500
𝑒𝑥𝑝 {− (1 − 𝛼)𝑛𝐹 𝑐𝑏 (−0,398 + 0,177)}
(𝜑 𝑐𝑜𝑟𝑟 − 𝜑 )} 𝑒𝑥𝑝 {− 𝑅𝑇 𝐻2 8,314 * 298
= 5,92. 10−9(𝐴/𝑐𝑚2)
Câu 3:
Tính tốc độ ăn mòn đối với phản ứng xảy ra giữa một kim loại và một
chất khử cực biết rằng hiệu giữa hai điện thế Nernst tương ứng bằng 0,45 V, hệ số
Taƒel b b 0.1V ; mật độ dòng trao đổi của quá trình anốt và cattode bằng nhau c a
và bằng 10-1 A/m2. Giải: Ta có: 𝑖
= 𝑖 = |−𝑖 | = 𝑖 𝑒𝑥𝑝 {𝛼𝑎𝑛𝐹 (𝜑
− 𝜑𝑐𝑏 )} = 𝑖 𝑒𝑥𝑝 {− 𝛼𝑐𝑛𝐹 (𝜑 − 𝜑𝑐𝑏)} 𝑐𝑜𝑟𝑟 𝑎 𝑐 0,𝑎 𝐾𝐿 0,𝑐 2,303𝑅𝑇 2,303𝑅𝑇 𝑅𝑇 𝑐𝑜𝑟𝑟 2,303𝑅𝑇 2,303𝑅𝑇 𝑅𝑇 𝑐𝑜𝑟𝑟 𝐷 Mà 𝑏 𝑎 = 𝛼 và 𝑏 𝛼 α 𝛼 𝑛𝐹 𝑎 = 𝑏 𝑛𝐹 𝑐 = 𝛼 𝑛𝐹 𝑐 = 𝑏 𝑛𝐹 a = αc 𝑎 𝑎 𝑐 𝑐 𝛼𝑎𝑛𝐹 2,303 𝑖
= √𝑖 |−𝑖 | = √𝑖 𝑖 𝑒𝑥𝑝 {
(𝜑𝑐𝑏 − 𝜑𝑐𝑏 )} = √0,01𝑒𝑥𝑝 {
. (−0,45)} = 5,6. 10−4(𝐴/𝑐𝑚2) 𝑐𝑜𝑟𝑟 𝑎 𝑐 0,𝑎 0,𝑐 𝑅𝑇 𝐷 𝐾𝐿 0,1
Câu 8:
Kti tiến hành đo tốc độ ăn mòn của thép CT3 trong nước biển bằng
phương pháp ngoại suy Tafel người ta thu được phương trình biểu diễn đoạn
thẳng trên nhánh anốt có dạng như sau:
Eawode = -o,¢183 + o,o3oloqi
(Eawode : Volt; i : mA/cm2). Hãy xác định:
1/ Hệ số chuyển điện tích thực nghiệm của quá trình anốt (thực nghiệm)
2/ Điện thế điện cực cân bằng của quá trình anốt ( Ecb
). Biết trong quá Fe2 / Fe
trình đo người ta sử dụng điện cực so sánh calomel bão hòa. Với E
0.24V ;i 109 mA / cm2 calomel 0,Fe Giải:
Ta có: Eawode = o,¢18) + o,o57oqi 𝑎
𝜑𝑖 = −0,4183 + 0,05𝑙𝑜𝑔𝑖𝑎 (✳) 𝜂𝑎 = ∆𝜑𝑎 = 𝑎 𝜑𝑖 − 𝑎 𝜑𝑐𝑏 > 0
𝜂 = 𝛽 𝑙𝑜𝑔 ( 𝑖𝑎 ) = −𝛽 𝑙𝑜𝑔𝑖 + 𝛽 𝑙𝑜𝑔𝑖 𝑎 𝑎 𝑖 𝑎 0,𝑎 𝑎 𝑎 0,𝑎
− 𝛽𝑎𝑙𝑜𝑔𝑖0,𝑎 + 𝛽𝑎𝑙𝑜𝑔𝑖𝑎 = 𝜑𝑖 − 𝜑𝑐𝑏 𝑎 𝑎
𝜑𝑖 = 𝜑𝑐𝑏 − 𝛽 𝑙𝑜𝑔𝑖 + 𝛽 𝑙𝑜𝑔𝑖 (✳✳) 𝑎 𝑎 𝑎 0,𝑎 𝑎 𝑎
Từ (✳) và (✳✳) suy ra: 𝛽𝑎 = 0,05
{ 𝜑𝑐𝑏 − 𝛽 𝑙𝑜𝑔𝑖 = −0,4183 𝑎 𝑎 0,𝑎 2,303𝑅𝑇 2,303𝑅𝑇 0,059
1. 𝛽𝑎 = 0,05 = 𝛼𝑎 = = = 0,59 𝛼𝑎𝑛𝐹 𝛽𝑎𝑛𝐹 0,05.2 2. 𝐸𝑐𝑏
= 𝜑𝑐𝑏 = −0,4183 + 𝛽 𝑙𝑜𝑔𝑖
= −0,4183 + 0,05𝑙𝑜𝑔10−9 = −0,8683 (𝑉) 𝐹𝑒2+/𝐹𝑒 𝑎 𝑎 0,𝑎 NMHoàng
Page #
Câu 9:
Có một chiếc pin như sau: Pt, H (P
1) ddHCl(a 0.15) KCl AgCl, Ag 2 H bh 2
1/ Viết các phản ứng xảy ra trên các điện cực và phản ứng tổng quát.
2/ Xác định sức điện động của pin ở 23oC. Cho biết thế điện cực chuẩn của
bạc-bạc clorua bằng 0,222 V. Giải: 1. Ở anode: 0,5H2
⇌ H+ + 1e Ở cathode: AgCl + 1e
⇌ Aq + G7-
Ở trên pin: 0,5H2 + AqG7 ⇌ H+ + Aq + G7- 2. Ở 25oG: 𝜑− = 𝜑𝑐𝑏
= 0,059𝑙𝑜𝑔0,15 = −0,049 (𝑉) 𝐻+/𝐻2 0,059 1 𝜑 = 𝜑𝑐𝑏 = 𝜑0 + 𝑙𝑜𝑔 1 = 0,222 + 0,059𝑙𝑜𝑔 = 0,271 (𝑉) + 𝐴g𝐶𝑙/𝐴g 𝐴g𝐶𝑙/𝐴g 𝑛 [𝐶𝑙−] 0,15
𝐸𝑝𝑖𝑛 = 𝜑+ − 𝜑− = 0,271 + 0,049 = 0,32 (𝑉)
Câu 1o:
Một tấm sắt có tổng diện tích 1000 cm2 được nhúng vào dung dịch muối
kẽm, đóng vai trò là cattode của bình điện phân (anốt của bình điện phân là một
điện cực trơ). Xác định bề bày của lớp kẽm bám vào cattode sau 25 phút biết mật
độ dòng trung bình bằng 2,5 A/dm2. Tỷ trọng của kẽm là 7,15 g/cm3, trọng lượng
nguyên tử của kẽm là 65. Giải:
ở Cathode: Zn2+ + 2e ⇌ Zw
Ta có: I = i.A = 2,5.1ooo.1o-2 = 25 (A)
Theo địwh 7uật Faraday: 𝑚 = 𝐴𝐼𝑡 = 65.25.25.60 = 12,63 (𝑔); 𝐴∶ 𝑀𝑎𝑠𝑠 𝑁𝑢𝑚𝑏𝑒𝑟 𝑛𝐹 2.96500
Thể tích Zw bám vào Gathode: 𝑉 = 𝑚 = 12,63 = 1,77 (𝑐𝑚3) 𝐷 7,15 𝑉 1,77
Độ dày Zw bám vào Gathode: 𝜌 = =
= 0,00177 (𝑐𝑚); 𝐴∶ 𝐴𝑟𝑒𝑎 𝑆𝑢𝑟𝑓𝑎𝑐𝑒 𝐴 1000
Câu 11:
1/ Dựa vào tiêu chí nhiệt động lực nào để tiên đoán khả năng bị ăn mòn
hay bền vững của vật liệu bằng kim loại khi tiếp xúc với dung dịch? Viết phương
trình phản ứng cho phép tiên đoán một kim loại có bị ăn mòn khi tiếp xúc với dung
dịch trong các trường hợp sau:
a/ H+ tham gia phản ứng cattode.
b/ Oxi tham gia phản ứng cattode
2/ Cho biết tại pH = 3 sắt có bị ăn mòn không (xét cả hai trường hợp trên)?
Chấp nhận ở điều kiện ăn mòn PH2=1atm, PO2 = 0,21atm, thế tiêu chuẩn của sắt bằng
o,¢¢ V, 0 E
1.23V , và nồng độ của Fe2+ bằng 10-6 mol/l. O2 / H2O
3/ Tính sức điện động của pin ăn mòn trong cả hai trườn hợp trên. NMHoàng
Page K Giải:
1. 𝐸𝑐𝑏 < 𝐸𝑐𝑏 thì KL bị ăn mòn và ngược lại. 𝐾𝐿 𝑑𝑑
a. H+ tham qia vào Gathode: Ở Anode: M
⇌ Mw+ + we
Ở Cathode: 2H+ + 2e ⇌ H2 𝑅𝑇 𝜑 = 𝐸𝑐𝑏 = 𝐸0 + 𝑙𝑛[𝑀𝑛+] − 𝑀𝑛+/𝑀 𝑀𝑛+/𝑀 𝑛𝐹 𝑐𝑏 0 𝑅𝑇 [𝐻+]2 𝜑 + = 𝐸 𝐻+/𝐻 = 𝐸 + 𝑙𝑛 2 𝐻+/𝐻2 2𝐹 𝑓𝐻 Nếu 𝐸𝑐𝑏 < 𝐸𝑐𝑏
thì KL bị ăn mòn và ngược lại 2 𝑀𝑛+/𝑀 𝐻+/𝐻2
b. Oxy tham gia phản ứng ở Cathode: Ở Anode: M
⇌ Mw+ + we
Ở Cathode: O2 + ¢H+ + ¢e ⇌ 2H2O 𝑅𝑇 𝜑 = 𝐸𝑐𝑏 = 𝐸0 + 𝑙𝑛[𝑀𝑛+] − 𝑀𝑛+/𝑀 𝑀𝑛+/𝑀 𝑛𝐹 𝑅𝑇 𝜑 = 𝐸𝑐𝑏 = 𝐸0 + 𝑙𝑛([𝐻+]4. 𝑓 ) + 02,𝐻+/𝐻20 02,𝐻+/𝐻20 𝑛𝐹 02 Nếu 𝐸𝑐𝑏 < 𝐸𝑐𝑏 +
thì KL bị ăn mòn và ngược lại 𝑀𝑛+/𝑀 02,𝐻 /𝐻20 2.
a. H+ tham qia vào Gathode:
Ở Anode: Fe⇌ Fe2+ + 2e
Ở Cathode: 2H+ + 2e ⇌ H2 𝑅𝑇 0,059 𝜑 = 𝐸𝑐𝑏 = 𝐸0 +
𝑙𝑛[𝐹𝑒2+] = −0,44 + (−6) = −0,617 (𝑉) − 𝐹𝑒2+/𝐹𝑒 𝐹𝑒2+/𝐹𝑒 𝑛𝐹 2 𝑐𝑏 0 𝑅𝑇 [𝐻+]2 𝜑+ = 𝐸
= −0,059𝑝𝐻 = −0,059.3 = −0,177 (𝑉) 𝐻+/𝐻 = 𝐸 + 𝑙𝑛 2 𝐻+/𝐻2 2𝐹 𝑓𝐻2
Ta thấy: 𝐸𝑐𝑏 < 𝐸𝑐𝑏
nên ở điều kiện này Fe bị ăn mòn. 𝐹𝑒2+/𝐹𝑒 𝐻+/𝐻2
b. Oxy tham qia vào Gathode: Ở Anode: Fe
⇌ Fe2+ + 2e
Ở Cathode: 0,5O2 + 2H+ + 2e ⇌ H2O 𝑅𝑇 0,059 𝜑 = 𝐸𝑐𝑏 = 𝐸0 +
𝑙𝑛[𝐹𝑒2+] = −0,44 + (−6) = −0,617 (𝑉) − 𝐹𝑒2+/𝐹𝑒 𝐹𝑒2+/𝐹𝑒 𝑛𝐹 2 𝑅𝑇 0,059 𝜑 = 𝐸𝑐𝑏 = 𝐸0 +
𝑙𝑛([𝐻+]2. 𝑝 0,5) = 1,23 + (𝑙𝑜𝑔𝑝 0,5 − 2𝑝𝐻) + 02,𝐻+/𝐻20 02,𝐻+/𝐻20 𝑛𝐹 02 2 02 0,059 = 1,23 +
(𝑙𝑜𝑔0,210,5 − 2.3) = 1,04 (𝑉) 2
Ta thấy: 𝐸𝑐𝑏 < 𝐸𝑐𝑏 + nên KL bị ăn mòn 𝐹𝑒2+/𝐹𝑒 02,𝐻 /𝐻20 ).
a. Khi có H+ tham qia:
Epiw = + - = o,133 + o,613 = o,¢¢ (V)
b. Khi có Oxy tham qia:
Epiw = + - = 1,o¢ + o,613 = 1,653 (V) NMHoàng
Page 6
Câu 12:
Viết các phản ứng xảy ra khi cho một tấm sắt vào trong dung dịch
H2sO¢ 0,1M. Xác định tốc độ ăn mòn sắt trong dung dịch trên, tính theo các đơn vị
sau: q/cm2.s; m/s; và mm/năm.
Cho biết mật độ dòng ăn mòn bằng 7,941o-¢A/cm2, khối lượng riêng của sắt là
3,8q/cm3, trọng lượng nguyên tử của sắt bằng 56. Giải: Ở Anode: Ở Cathode:
Theo định luật Faraday: 𝑚 𝑎𝐼𝑡 𝐼𝑎 𝑖𝑎 1,94 × 10−4 × 56 2,304 × 10−7 𝑣 = = = = 𝑐𝑜𝑟𝑟 =
= 2, 304 × 10−7 (𝑔/𝑐𝑚2𝑠) = 𝑡 × 𝐴 𝑛𝐹𝑡𝐴 𝑛𝐹𝐴 𝑛𝐹 2 × 96500 7,8 * 100
= 2, 95 × 10−10(𝑚/𝑠) = 2,95 × 10−10 × 1000 × 86400 × 365 = 9, 30312 (𝑚𝑚/𝑛ă𝑚)
Câu 13:
1/ Dựa vào những tiêu chí nhiệt động lực học nào để tiên đoán khả
năng ăn mòn hay bền vững của vật liệu bằng kim loại khi tiếp xúc với dung dịch?
Hãy viết những phương trình cho phép tiên đoán một kim loại có thể bị ăn
mòn khi tiếp xúc với dung dịch trong các trường hợp sau:
a/ H+ tham gia phản ứng cattode.
b/ Oxi tham gia phản ứng cattode.
2/ Dựa vào các tiêu chí nhiệt động ở trên hãy cho biết khả năng ăn mòn của
thiết (thế tiêu chuẩn bằng -0,136) trong dung dịch “nước” có pH = 7 và có sự hòa
tan oxy ở PO2 = 0,21 atm, chấp nhận thế chuẩn của oxy bằng +0,41V và nồng độ Sn2+
bằng 10-6 mol/l. Giải:
1. 𝐸𝑐𝑏 < 𝐸𝑐𝑏 thì KL bị ăn mòn và ngược lại. 𝐾𝐿 𝑑𝑑
a. H+ tham qia vào Gathode: Ở Anode: M
⇌ Mw+ + we
Ở Cathode: 2H+ + 2e ⇌ H2 𝑅𝑇 𝜑 = 𝐸𝑐𝑏 = 𝐸0 + 𝑙𝑛[𝑀𝑛+] − 𝑀𝑛+/𝑀 𝑀𝑛+/𝑀 𝑛𝐹 𝑐𝑏 0 𝑅𝑇 [𝐻+]2 𝜑 + = 𝐸 𝐻+/𝐻 = 𝐸 + 𝑙𝑛 2 𝐻+/𝐻2 2𝐹 𝑓𝐻 Nếu 𝐸𝑐𝑏 < 𝐸𝑐𝑏
thì KL bị ăn mòn và ngược lại 2 𝑀𝑛+/𝑀 𝐻+/𝐻2 NMHoàng
Page /
b. Oxy tham gia phản ứng ở Cathode: Ở Anode: M
⇌ Mw+ + we
Ở Cathode: O2 + ¢H+ + ¢e ⇌ 2H2O 𝑅𝑇 𝜑 = 𝐸𝑐𝑏 = 𝐸0 + 𝑙𝑛[𝑀𝑛+] − 𝑀𝑛+/𝑀 𝑀𝑛+/𝑀 𝑛𝐹 𝑅𝑇 𝜑 = 𝐸𝑐𝑏 = 𝐸0 + 𝑙𝑛([𝐻+]4. 𝑓 ) + 02,𝐻+/𝐻20 02,𝐻+/𝐻20 𝑛𝐹 02 Nếu 𝐸𝑐𝑏 < 𝐸𝑐𝑏 +
thì KL bị ăn mòn và ngược lại 𝑀𝑛+/𝑀 02,𝐻 /𝐻20 2. Ở anode: Sn
⇌ 3w2+ + 2e 1 -
Gathode: O2 + H2O + 2e ⇌ 2OH 2 𝑅𝑇 0,059 𝐸𝑐𝑏 = 𝐸0 +
𝑙𝑛[𝑆𝑛2+] = −0,136 +
𝑙𝑜𝑔10−6 = −0,313 (𝑉) 𝑆𝑛2+/𝑆𝑛 𝑆𝑛2+/𝑆𝑛 𝑛𝐹 2 𝑅𝑇 𝑓 0,5 0,059 0 𝑐𝑏 0 𝐸 = 𝐸 + 𝑙𝑛 ( 2 ) = 0,41 +
(𝑙𝑜𝑔𝑃0 0,5 + 2𝑝𝑂𝐻) 02,𝐻 +/𝐻20 02,𝐻 +/𝐻20 𝑛𝐹 [𝑂𝐻−]2 2 2 0,059 = 0,41 +
(𝑙𝑜𝑔0,210,5 + 2.7) = 0,813 (𝑉) 2
Ta thấy: 𝐸𝑐𝑏 < 𝐸𝑐𝑏 +
nên ở điều kiện này Sn bị ăn mòn 𝑆𝑛2+/𝑆𝑛 02,𝐻 /𝐻20
Câu 1¢: Tính cường độ dòng ăn mòn (Icorr) và điện thế ăn mòn (Ecorr) của một
tấm kẽm diện tích 9 cm2 tiếp xúc với một tấm sắt có diện tích 100 cm2, trowq môi
trường nước ở 25oC. Cho biết mật độ dòng trao đổi bằng nhau và bằng 10-6 A/cm2,
nồng độ các ion bằng 10-6 mol/l và các thế chuẩn của kẽm và sắt tương ứng bằng -
o,36V νà -o,¢¢V. Giải: Zw
⇌ Zw2+ + 2e 0,059 0,059 𝐸𝑐𝑏 = 𝐸0 +
𝑙𝑜𝑔[𝑍𝑛2+] = −0,76 +
𝑙𝑜𝑔10−6 = −0,937(𝑉) Z𝑛2+/Z𝑛 Z𝑛2+/Z𝑛 𝑛 2 Fe
⇌ Fe2+ + 2e 0,059 0,059 𝐸𝑐𝑏 = 𝐸0 +
𝑙𝑜𝑔[𝐹𝑒2+] = −0,44 +
𝑙𝑜𝑔10−6 = −0,617(𝑉) 𝐹𝑒2+/𝐹𝑒 𝐹𝑒2+/𝐹𝑒 𝑛 2
Ta thấy: 𝐸𝑐𝑏 > 𝐸𝑐𝑏
wêw Fe 7à Gathode còw Zw 7à Awode. 𝐹𝑒2+/𝐹𝑒 Z𝑛2+/Z𝑛
Ta có: 𝐼𝑐𝑜𝑟𝑟 = 𝐼𝑎,𝐹𝑒 = |−𝐼𝑐,Z𝑛| = √𝐼𝑎,𝐹𝑒|−𝐼𝑐,Z𝑛| 𝛼𝐹𝑒𝑛𝐹 𝐼 = 𝑖 𝐴 = 𝑖 𝑒𝑥𝑝 { (𝜑 − 𝜑𝑐𝑏 )} . 𝐴 𝑎,𝐹𝑒 𝑎,𝐹𝑒 𝐹𝑒 0,𝐹𝑒 𝑅𝑇 𝑐𝑜𝑟𝑟 𝐹𝑒2+/𝐹𝑒 𝐹𝑒
{ |−𝐼𝑐,Z𝑛| = |−𝑖𝑐,Z𝑛|𝐴Z𝑛 = 𝑖0,Z𝑛𝑒𝑥𝑝 {− 𝛼Z𝑛𝑛𝐹 (𝜑𝑐𝑜𝑟𝑟 − 𝜑𝑐𝑏 2+ )} . 𝐴Z𝑛 𝑅𝑇 Z𝑛 /Z𝑛 𝐼 = √𝐴 𝐴 √𝑖 . 𝑖 𝑛𝐹 𝑒𝑥𝑝 { (𝜑 𝑐 𝑏 − 𝜑𝑐 𝑏 )} 𝑐𝑜𝑟𝑟 𝐹𝑒 Z𝑛 0,𝐹𝑒 0,Z𝑛 2𝑅𝑇 Z𝑛2+/Z𝑛 𝐹𝑒2+/𝐹𝑒 2.96500
= √9.100√10−12𝑒𝑥𝑝 {
(−0,937 + 0,617)} = 5,897. 10−8(𝐴) 2.8,314.298 𝛼𝐹𝑒𝑛𝐹 𝐼 = 𝐼 = 𝑖 𝐴 = 𝑖 𝑒𝑥𝑝 { (𝜑 − 𝜑𝑐𝑏
)} . 𝐴 = 5,897. 10−8(𝐴) 𝑐𝑜𝑟𝑟 𝑎,𝐹𝑒 𝑎,𝐹𝑒 𝐹𝑒 0,𝐹𝑒 𝑅𝑇 𝑐𝑜𝑟𝑟 𝐹𝑒2+/𝐹𝑒 𝐹𝑒 𝛼𝐹𝑒𝑛𝐹 𝐼𝑐𝑜𝑟𝑟 (𝜑 − 𝜑𝑐𝑏 ) = 𝑙𝑛 ( ) = 5,987. 10−4 NMHoàng
Page 8 𝑅𝑇 𝑐𝑜𝑟𝑟 𝐹𝑒2+/𝐹𝑒
𝑖0,𝐹𝑒 . 𝐴 𝐹𝑒
𝜑𝑐𝑜𝑟𝑟 − 𝜑𝑐𝑏 = 1,537. 10−5 𝜑 𝐹𝑒 2+ /𝐹𝑒
𝑐𝑜𝑟𝑟 ≈ −0,61698 (𝑉) NMHoàng
Page 9
Câu 13: Khi nhúng một thanh kim loại vào dung dịch có pH = 5,5, điện thế bề
mặt của thanh kim loại đo được là -0,3 Volt (SHE). Thanh kim loại có bị ăn mòn
trong dung dịch trên hay không? Khi các trường hợp sau đây xảy ra:
1/ Duwq dịch đã đuổi hết khí hòa tan (cho PH2 = 1atm)
2/ Dung dịch không đuổi khí (cho P 0
O2 = o,21atm; E 1.23V ) O2 / H2O
3/ Tính sức điện động của pin ăn mòn. Giải: Ở Anode: M
⇌ Mw+ + we
1. Đã đuổi hết khí:
Ở Cathode: 2H+ + 2e ⇌ H2 𝜑− = 𝐸𝑐𝑏 = −0,3 (𝑉) 𝑀𝑛+/𝑀 0,059 𝜑 = 𝐸𝑐𝑏 = 𝐸𝑐𝑏 +
𝑙𝑜𝑔[𝐻+]2 = −0,059𝑝𝐻 = −0,3245(𝑉) + 𝐻+/𝐻2 𝐻+/𝐻2 2
Ta thấy: 𝐸𝑐𝑏 > 𝐸𝑐𝑏
nên KL không bị ăn mòn 𝑀𝑛+/𝑀 𝐻+/𝐻2
2. Chưa đuổi hết khí:
Ở Cathode: 2H+ + 2e ⇌ H2 1O
2 + 2H+ + 2e ⇌ H 2 2O 0,059 𝐸𝑐𝑏 = 𝐸𝑐𝑏 +
𝑙𝑜𝑔[𝐻+]2 = −0,059𝑝𝐻 = −0,3245(𝑉) 𝐻+/𝐻2 𝐻+/𝐻2 2 0,059 0,059 𝐸𝑐𝑏 = 𝐸0 +
𝑙𝑜𝑔([𝐻+]2. 𝑃 0,5) = 1,23 +
(𝑙𝑜𝑔0,210,5 − 2.5,5) = 0,896 (𝑉) 02/𝐻20 02/𝐻20 𝑛 02 2
𝜑+ = 0,896 − 0,3245 = 0,5715 (𝑉) Ta thấy: 𝑀
𝐸𝑐𝑏𝑛 +/𝑀 < 𝜑+ nên KL bị ăn mòn
). Epiw = + - = o,5315 + o,) = o,8315 (V)
Câu 16:
Có một chiếc pin được viết sau: Sn Sn2 (a 0.35) Pb 2 (a 0,001) Pb
1/ Xác định dấu của các điện cực và viết các phản ứng xảy ra trên các điện
cực và phản ứng tổng quát.
2/ Xác định sức điện động của pin ở 25oC. Cho biết thế điện cực chuẩn của
thiếc và chì là -o,1¢V νà -o,1263V. Giải: 1. 3w
⇌ 3w2+ + 2e
Pb2+ + 2e ⇌ Pb 𝐸𝑐𝑏 = 𝐸0
+ 0,059 𝑙𝑜𝑔[𝑆𝑛2+] = −0,14 + 0,059 𝑙𝑜𝑔0,35 = −0,153 (𝑉) 𝑆𝑛2+/𝑆𝑛 𝑆𝑛2+/𝑆𝑛 𝑛 2 𝐸𝑐𝑏 = 𝐸0
+ 0,059 𝑙𝑜𝑔[𝑃𝑏2+] = −0,1265 + 0,059 𝑙𝑜𝑔0,001 = −0,215 (𝑉) 𝑃𝑏2+/𝑃𝑏 𝑃𝑏2+/𝑃𝑏 𝑛 2
Ta thấy: 𝐸𝑐𝑏2+ < 𝐸𝑐𝑏
wêw Pb 7à Awode còw 3w 7à Gathode. 𝑃𝑏 /𝑃𝑏 𝑆𝑛2+/𝑆𝑛
Piw: (−)𝑃𝑏|𝑃𝑏2+‖𝑆𝑛2+|𝑆𝑛 (+)
Awode: Pb ⇌ Pb2+ + 2e
Gathode: 3w2+ + 2e ⇌ 3w
Phản ứng tổng quát: Pb + Sn2+ ⇌ Pb2+ + 3w
2. Epiw = 𝐸0 2+ − 𝐸0 2+
= −0,153 + 0,215 = 0,062 (𝑉) NMHoàng Page 10
Câu 13:
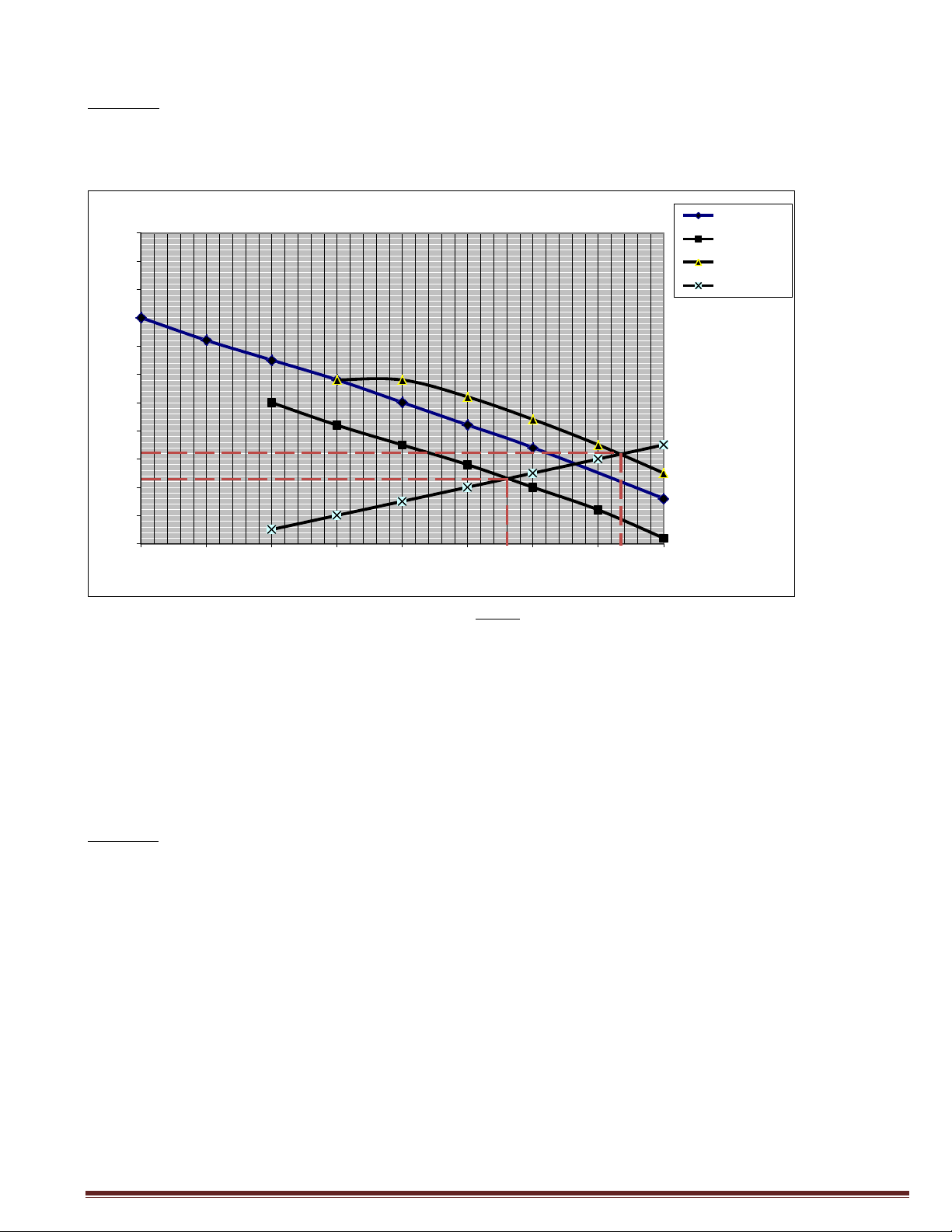
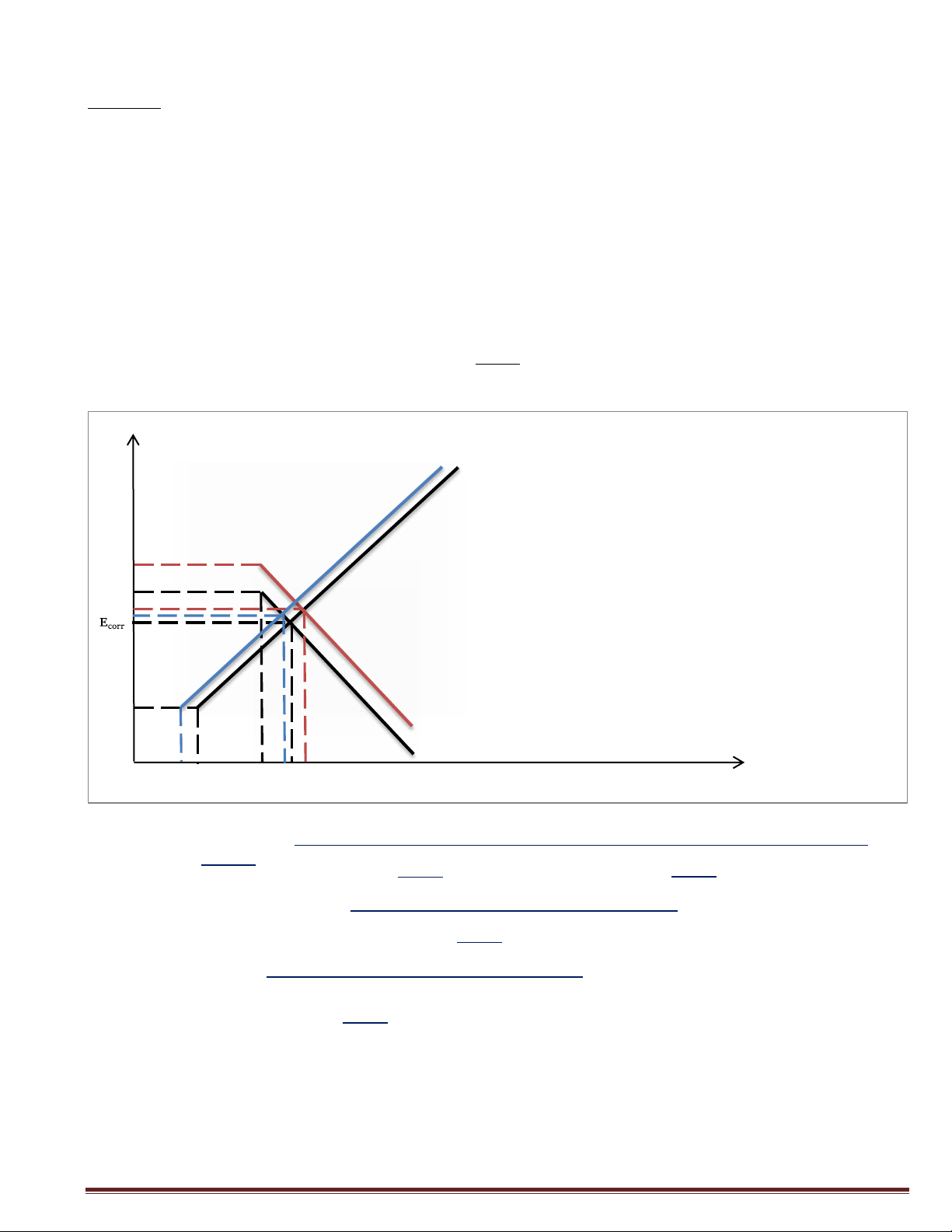
Sử dụng giản đồ đường cong phân cực dưới đây. Hãy cho biết:
1/ Ý nghĩa của các điểm A, B, C, D.
2/ So sánh tốc độ ăn mòn của kim loại M trong dung dịch axit khi có mặt của chất
oxy toá trêw.
3/ Xác định gần đúng điện thế ăn mòn và tốc độ ăn mòn của hệ lt) o (v E M->M+ D C B B -0.2 D C A A -0.4 -0.6 -0.8 -1 -9 -8 -7 -6 -5 -4 -3 -2 -1 0 Giải:
1. A: Tốc hộ ăn mòn của thanh kim loại M trong môi trường H+
B: Tốc độ ăn mòn của thanh kim loại M trong môi trường H+ khi có mặt chất oxy hóa Fe)+
D: Tốc độ thoát khí H2 trên thanh kim loại M trong môi trường H+ có mặt Fe)+
G: Tốc độ tạo thành Fe2+ trong môi trường H+ có chứa Fe)+
2. Tốc độ ăn mòn của thanh kim loại M trong môi trường H+ khi có mặt chất oxy hóa
Fe)+ lớn hơn tốc độ ăn mòn của thanh kim loại M trong H+ không có mặt chất oxy hóa Fe)+
). Dựa vào đồ thị:
Ecorr = o,13 (V)
7oq(icorr) = ¢,22 (mA/cm2)
icorr = 1o¢,22 = 6,o).1o-5 (mA/cm2) NMHoàng
Page l&
Câu 18:
Sử dụng giản đồ đường cong phân cực dưới đây. Hãy cho biết:
1/ Ý nghĩa của các điểm A, B, C.
2/ Nhận xét sự ảnh hưởng của chất oxy hoá đến tốc độ ăn mòn của Fe.
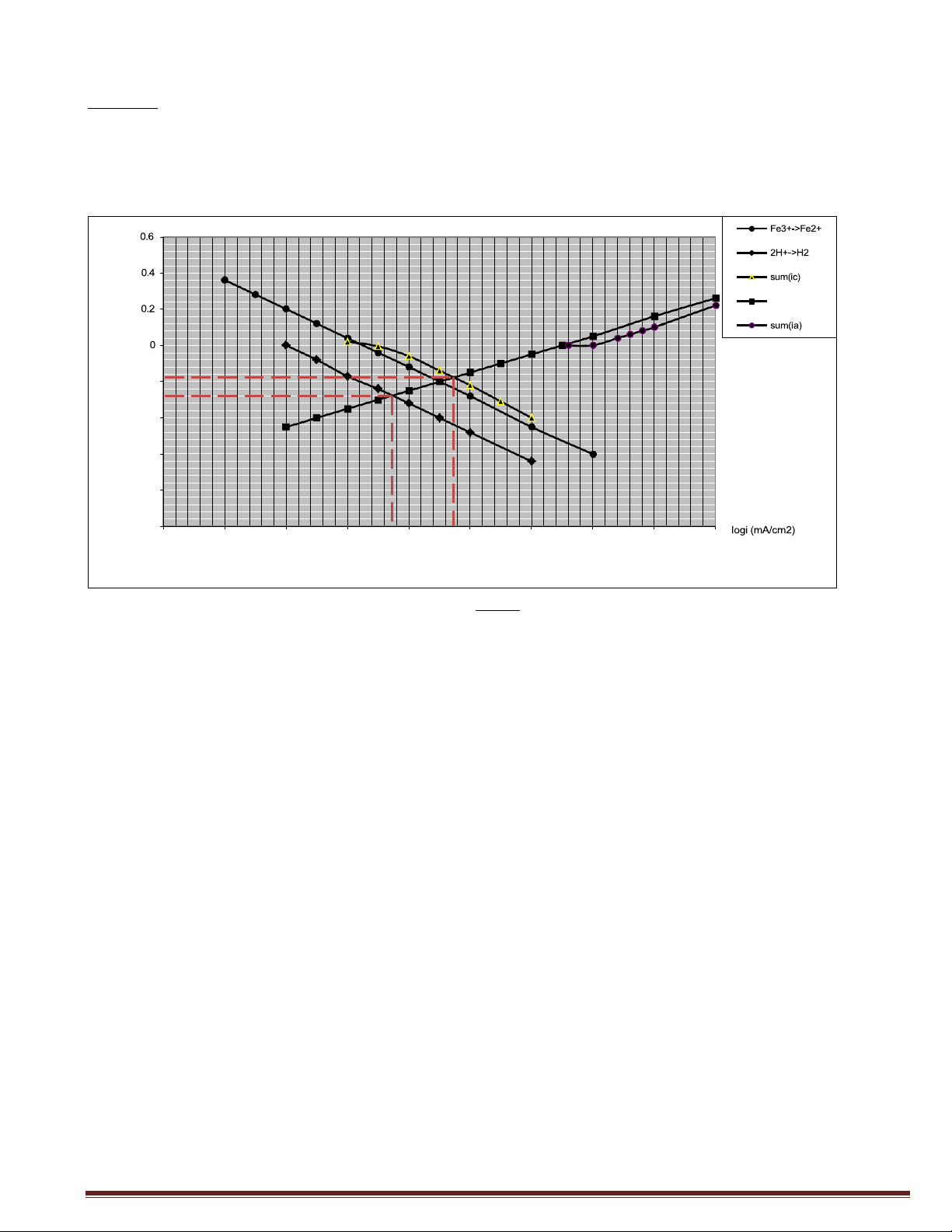
3/ Xác định gần đúng icorr,Fe trong dung dịch axit không có chất oxy hoá. lt) Fe3+-->Fe2+ o (v 0.6 E H+-->H2 0.5 sum(ic) 0.4 Fe-->Fe2+ 0.3 0.2 0.1 0 -0.1 B -0.2 C -0.3 A -0.4 logi (A/cm2) -0.5 -8 -7.5 -7 -6.5 -6 -5.5 -5 -4.5 -4 Giải:
1. A: Tốc độ ăn mòn của Fe trong môi trường H+
B: Tốc độ ăn mòn của Fe trong môi trường H+ có mặt chất oxy hóa Fe)+
C: Tốc độ thoát khí H2 trên thanh Fe trong môi trường H+ có mặt Fe)+
2. Khi có mặt chất oxy hóa thì tốc độ ăn mòn của Fe tăng.
). Dựa vào đồ thị:
Ecorr ≈ o,18 (V)
7oq(icorr) = ¢,)5 (A/cm2)
icorr = 1o¢,)5 = ¢,¢3.1o-5 (A/cm2)
Câu 19:
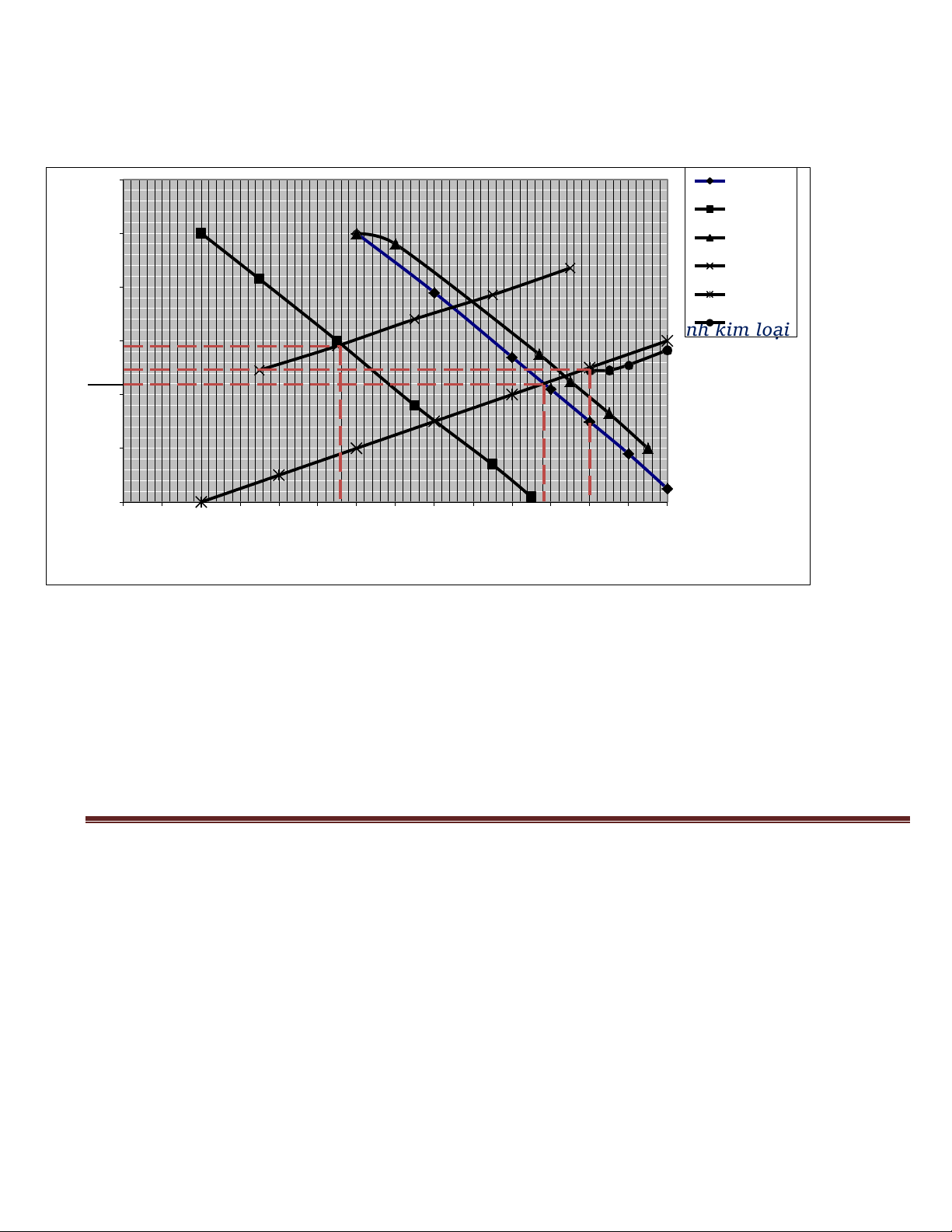
Sử dụng giản đồ đường cong phân cực dưới đây. Hãy cho biết:
1/ Ý nghĩa của diểm A, B, C, D
2/ Xác định gần đúng tốc độ ăn mòn của kim loại M khi ghép đôi với kim loại N. lt) ovE( NMHoàng
Page l5 0.2 H+->H2(M) H+->H2(N) Giải: 0 sum(ic)
1. A: Tốc độ ăn mòn của thanh kim loại M N->N+ -0.2
B: Tốc độ ăn mòn của thanh kim loại N M->M+
C: Tốc độ ăn mòn của hệ khi ghép 2 thanh kim loại M với N
D: Tốc độ ăn mòn của t sum(ia) B han
h kim loại N khi đã ghép với thanh kim loại M
-0.4 2. 7oq icorr,M = 7oq icorr, hệ = ¢ icorr = 1o¢ (mA/cm2) D C
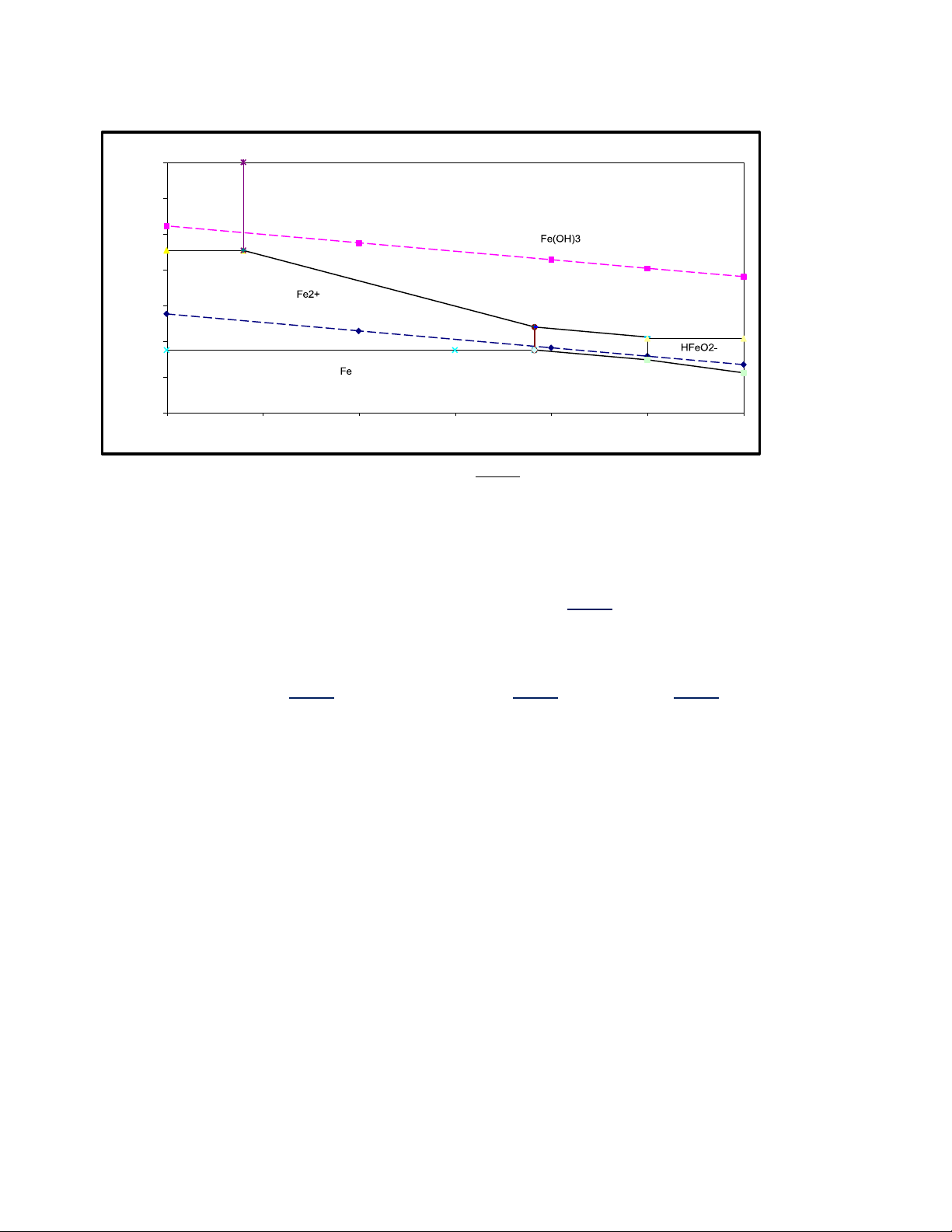
Câu 2o: Dựa trên giản đồ E-pH của hệ Fe-H2O ở 25oC và 1atm cho dưới đây: -0.6 A
1/ Hãy thiết lập phương trình đường (chỉ ra mối quan hê giữạ E-pH) của phản ứ -0n .8 g :
Fe 2H O Fe(OH ) 2H 2e 2 2 Cto: C C C
106 mol / l;C (C
)2 1.9 1015; E 0 0.44V Fe2 3 Fe HFeO Fe2 OH 2 Fe2 / Fe -1 logi (mA/cm2) -8 -7 -6 -5 -4 -3 -2 -1 0 1 2 3 4 5 6 NMHoàng
Page l5
2/ Ý nghĩa của giản đồ trên. )
Giản đồ E pH của hệ Fe H2O (V E 2 2 1.5 Fe3+ 4 1 b 2 0.5 7 0 a 6 10 3 -0.5 1 Fe(OH)2 9 5 -1 8 -1.5 2 4 6 8 10 12 14 pH Giải:
1. Các cấu tử có trong hệ: H2O, H+, OH-, O2, H2, Fe, Fe2+, Fe)+, HFeO -2 , Fe(OH)2, Fe(OH)).
Fe + 2H2O ⇌ Fe(OH)2 + 2H+ + 2e.
Phương trình Nernst ở 25oG: 0,059 𝐸𝑐𝑏 = 𝐸0 + 𝑙𝑜𝑔([𝐻+]2) 𝐹𝑒(0𝐻)2/𝐹𝑒 𝐹𝑒(0𝐻)2/𝐹𝑒 𝑛
Với nồng độ Fe2+ rất bé thì: Fe
⇌ Fe2+ + 2e, với 𝑇𝐹𝑒(0𝐻) = 1,Q.1o-15 2 0,059 0,059 0,059 𝐸 = 𝐸0 +
𝑙𝑜𝑔[𝐹𝑒2+] = −0,44 + 𝑙𝑜𝑔𝑇 − 𝑙𝑜𝑔[𝑂𝐻−]2 𝐹𝑒2+/𝐹𝑒 2 2 𝐹𝑒(0𝐻)2 2 NMHoàng
Page l3 0,059 = −0,44 +
𝑙𝑜𝑔(1,9. 10−15) + 0,059𝑝𝑂𝐻 2 0,059 = −0,44 +
𝑙𝑜𝑔(1,9. 10−15) + 0,059.14 − 0,059𝑝𝐻 = −0,048 − 0,059𝑝𝐻 2
2. Ý nghĩa của giản đồ:
Dự đoán khả năng bị ăn mòn và không bị ăn mòn của sắt trong môi trường nước.
Rút ra nguyên tắc của phương pháp điện hoá bảo vệ chống ăn mòn sắt trong môi
trường nước và cụ thể là:
Dịch chuyển thế điện cực sắt (thép) trong môi trường nước về phía âm hơn
so với thế ăn mòn của sắt thì sắt đi vào vùng an toàn không bị ăn mòn. Đó
chíwh là nguyên tắc bảo vệ cathode chống ăn mòn kim loại (bằng cách phân cực
cathode bằng dòng ngoài, hoặc dùng anode hi sinh).
Dịch chuyển thế điện cực của sắt (thép) trong môi trường trường nước về
phía dương so với thế ăn mòn (phân cực anode) sẽ làm cho kim loại bị thụ động
gọi là bảo vệ anode.
Điều chỉnh tăng pH của môi trường ăn mòn đưa kim loại thép vào vùng thụ động.
Câu 21:
Dựa vào các đồ thị dưới đây hãy cho biết:
1/ Ý nghĩa các điểm A, B, C, D, E và X.
2/ So sánh sự ảnh hưởng của chất oxy hóa được thêm vào.
3/ Có nhận xét gì khi sử dụng chất oxy hóa để đưa kim loại vào trạng thái thụ động. E (V) 5 E 4 D Σ 2 C 1 X B A logi Giải: NMHoàng
Page l# NMHoàng
Page l#
Câu 22:
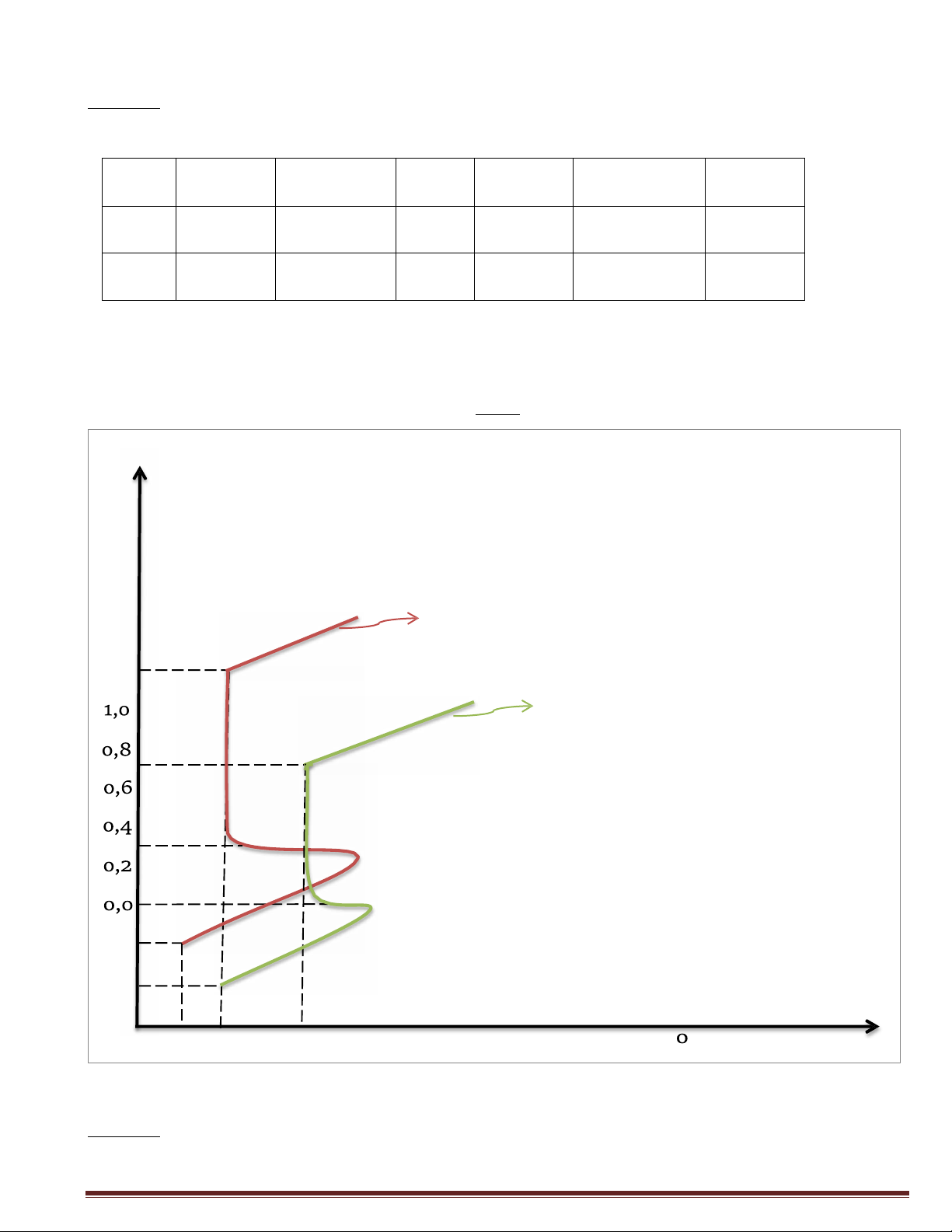
Cho hai hợp kim A và B (có khả năng thụ động) có các thông số điện hóa ở bảng sau: Ecorr(V)
icorr(A/m2) a Epass(V) ipass(A/m2) Equá thụ động(V) Hợp -o,¢o 1o-6 +o,23 o,o 1o-3 +o,3 kim A Hợp -o,2o 1o-6,¢ +o,23 +o,3 1o-6 +1,2
kim B
1/ Vẽ đường cong phân cực của quá trình ăn mòn của hai hợp kim trên.
2/ Hợp kim nào sẽ dễ dàng được bảo vệ bằng phương pháp bảo vệ anốt hơn? Tại sao? Giải: E(V) 1,8 1,6 Hợp kim B 1,4 1,2 Hợp kim A -o,2 -o,4 -7 -6 -5 -4 -Σ -2 -1 log i (A/cm2)
Hợp kim A dễ dàng được bảo vệ bằng phương pháp Anode hơn vì hợp kim A có thế bắt
đầu thụ động âm hơn so với hợp kim B: 𝐸𝐴 < 𝐸𝐵 𝑝𝑎𝑠𝑠 𝑝𝑎𝑠𝑠
Câu 23:
Hãy trình bày cơ chế hình thành màng oxyt nhôm (γ – Al2O3) bằng phương
pháp anôt hoá; và cơ chế nhuộm màu màng nhôm. Muốn tăng chiều dày của màng NMHoàng
Page l6
oxyt nhôm cần phải thay đổi các thông số kỹ thuật nào? Tại sao? Giải:
Cơ chế hình thành màng nhôm Oxyt (γ – Al2O3) bằng phương ptáp Awode tóa:
QT Awode: A7
A7)+ + )e
¢OH- O2 + 2H2O + ¢e
Quá tình này có thể chia thành nhiều giai đoạn:
2OH- O2- + H2O O2-
O- + e O-
O + e 2O O2
2A7)+ + )O2- A72O) 2A7 + )O A72O)
QT Gathode: 2H+ + 2e H2
Nhôm khi mới cho vào dung dịch điện ly có thể xảy ra phản ứng sau:
2A7 + )H23O¢
A72(3O¢)) + )H2
Màng được hình thành sẽ tác dụng với dung dịch chất điện ly:
A72O) + )H23O¢
A72(3O¢)) + )H2O
Cơ chế nhuộm màu màng nhôm:
Do màwq Oxide có nhiều lỗ xốp nên có khả năng hấp phụ các chất màu hữu cơ, vô cơ, đôi
khi các chất màu này tác dụng với màng Oxide tạo thành các hợp chất hóa học. Ngoài
ra, các phản ứng tạo màu có thể xảy ra trên lỗ xốp làm cho màng Oxide có màu.
Muốn tăng chiều dày của màng Oxyt nhôm cần thay đổi thông số: QT Awode:
Tăng dòng ic chuyển dịch sang tái tạo Al)+ (không tăng quá nhiều dẫn đến dòng
giới hạn nóng cục bộ, làm hòa tan màng)
Kết hợp khuấy trộn ở tốc độ vừa phải làm các ion Al)+, O2- ra xa nhau và ra xa bề mặt kim loại.
Thêm chất phụ gia, chất oxy hóa.
Sử dụng bể than Anode hóa có 2 lớp vỏ. Hạ nhiệt độ của dung dịch điện ly.
QT hòa taw:
Tiến hành ở nhiệt độ thấp, H23O¢ loãng (không được quá loãng vì độ dẫn điện giảm). NMHoàng
Page l6
Câu 2¢:
1/ Hãy vẽ đường cong phân cực đối với phản ứng ăn mòn kim loại Fe trong
dung dịch axit và tính điện thế ăn mòn (Ecorr) và tốc độ ăn mòn (icorr) từ đồ thị đã vẽ.
Phản ứng: Fe = Fe2+ + 2e; cb E 0.45V ;i
107 A / cm 2 ; 0.25V Fe2 / Fe 0,Fe2 / Fe a
2H+ + 2e = H2; cb E 0.12V ;i
106 A / cm2 ; 0.25V H / H c 2 0,H / H2
2/ Sử dụng đồ thị trên cho biết tốc độ ăn mòn của kim loại Fe sẽ thay đổi như thế nào khi:
a/ Tăng nồng độ của ion H+.
b/ Làm giảm phản ứng hoà tan anode. Giải: 1. E(V) -o,12 -o,45 -7 -6 log icorr log i (A/cm2) Ta có: | | √ 2,303 𝑐𝑏 2,303 𝑐𝑏
𝑖𝑐𝑜𝑟𝑟 = √𝑖𝑎 −𝑖𝑐 = 𝑖0,𝑎. 𝑖0,𝑐. 𝑒𝑥𝑝 { (𝜑 )} . 𝑒𝑥𝑝 {− (𝜑 )} 𝛽
𝑐𝑜𝑟𝑟 − 𝜑𝐹𝑒2+ 𝑐𝑜𝑟𝑟 − 𝜑 ⁄ 𝐻+ 𝑎 𝐹𝑒 𝛽𝑐 ⁄𝐻2 2,303
= √𝑖 . 𝑖 . 𝑒𝑥𝑝 { (𝜑𝑐𝑏 − 𝜑𝑐𝑏 )} 0,𝑎 0,𝑐 0,25 𝐻+ 𝐹𝑒2+ 𝐻 ⁄ ⁄ 2 𝐹𝑒
= √10−7. 10−6𝑒𝑥𝑝{2,303.4. (−0,12 + 0,45)} = 1,45. 10−6 (𝐴/𝑐𝑚2) 2,303 𝑖 (𝜑
𝑐𝑜𝑟𝑟 = 𝑖𝑎 = 𝑖0,𝑎. 𝑒𝑥𝑝 {
𝑐𝑜𝑟𝑟 − 𝜑𝑐𝑏2+
)} = 1,45. 10−6 𝜑𝑐𝑜𝑟𝑟 = −0,16 (𝑉) 𝑎 𝛽 𝐹𝑒 ⁄𝐹𝑒
2. Khi tăng nồng độ ion H+ thì pH giảm 𝐸𝑐𝑏
tăng nên theo đồ thị thì i 𝐻+/𝐻 corr,Fe tăng 2
Khi giảm phản ứng hòa tan Anode tức là io, Fe giảm theo đồ thị thì corr,Fe giảm NMHoàng
Page l/
Câu 23:
Để bảo vệ một công trình bằng thép đặt dưới biển, người ta có thể sử dụng
phương pháp bảo vệ bằng protector (anode hi sinh). Những kim loại nào sau đây
có thể được dùng làm protector tốt nhất: Al; Zn; Cd; Ni? Tại sao? Hãy giải thích đối
với các kim loại còn lại.
Cho biết điện thế điện cực chuẩn của các kim loại trên trong môi trường nước là: 0 E
0.440V / SHE; E 0
1.660V / SHE; E 0
0.763V / SHE; Fe2 / Fe Al3 / Al Zn2 / Zn 0 E
0.402V / SHE; E 0
0.230V / SHE Cd 2 / Cd Ni2 / Ni Giải:
Phương pháp bảo vệ bằng Protector là phân cực Cathode bằng cách nối kim loại cần bảo
vệ với kim loại khác có thế điện cực âm hơn.
Ta thấy: -1,66 < -o,36) < -o,¢¢ < -o,¢o2 < -o,2) 𝐸0 3+ < 𝐸0 2+ < 𝐸0 2+ < 𝐸0 2+ < 𝐸0 2+ 𝐴𝑙 /𝐴𝑙 Z𝑛 /Z𝑛 𝐹𝑒 /𝐹𝑒 𝐶𝑑 /𝐶𝑑 𝑁𝑖 /𝑁𝑖
Nên Al được dùng làm protector tốt nhất do Al có thế điện cực âm nhất nên dễ dàng bị
ăn mòn và bảo vệ tốt cho vật liệu cần được bảo vệ.
Câu 26:
Dựa vào các dữ kiện sau để vẽ đồ thị E-logi của phản ứng ăn mòn sắt trong
dung dịch bảo hoà hydro và không chứa oxy, với pH=3.
* Đối với quá trình anốt:
Fe = Fe2+ + 2e
Nồng độ của ion Fe2+ trong dung dịch: CFe2+=21o-6 mol/l
Mật độ dòng trao đổi của Fe trong dung dịch trên: io,Fe=1o-8 A/cm2
Điện thế điện cực chuẩn của Fe: 0 E 0.44V Fe2 / Fe
* Đối với quá trình cattode: 2H+ +2e = H2
Mật độ dòng trao đổi của ion H+ trong dung dịch trên: io,H2(Fe)=1o-3 A/cm2
Cho biết hằng số Tafel trong tất cả các trường hợp bằng 0,25V.
1/ Hãy xác định điện thế ăn mòn (Ecorr) và tốc độ ăn mòn (icorr) của sắt.
2/ Mật độ dòng bảo vệ cattode phải bằng bao nhiêu để tốc độ ăn mòn của sắt
bằng 0. Rút ra kết luận gì cho trường hợp này? Giải:
Quá trìwh Awode: Fe
⇌ Fe2+ + 2e
Quá trìwh Gathode: 2H+ + 2e ⇌ H2 0,059 0,059 𝜑𝑐𝑏 = 𝜑0 +
𝑙𝑜𝑔[𝐹𝑒2+] = −0,44 +
𝑙𝑜𝑔(210−6 ) = −0,608 (𝑉) 𝐹𝑒2+/𝐹𝑒 𝐹𝑒2+/𝐹𝑒 𝑛 2 0,059 𝜑𝑐𝑏 = 𝜑0 +
𝑙𝑜𝑔[𝐻+]2 = −0,059𝑝𝐻 = −0,059.3 = −0,177 (𝑉) 𝐻+/𝐻2 𝐻+/𝐻2 𝑛 2,303𝑅𝑇
Ta có: βFe = βH = o,25 𝛼𝐹𝑒 = 𝛼𝐻 = 0,25𝑛𝐹 𝛼𝐹𝑒𝑛𝐹
𝑇𝑎 𝑐ó∶ 𝑖 = 𝑖 𝑒𝑥𝑝 { (𝜑 − 𝜑𝑐𝑏 )} 𝑎 0,𝐹𝑒 𝑅𝑇 𝑐𝑜𝑟𝑟 𝐹𝑒2+/𝐹𝑒 𝛼𝐻𝑛𝐹
𝑉à∶ |−𝑖 | = 𝑖 𝑒𝑥𝑝 {− (𝜑 − 𝜑𝑐𝑏 )} 𝑐 0,𝐻 𝑅𝑇 𝑐𝑜𝑟𝑟 𝐻+/𝐻2 NMHoàng
Page l8




