


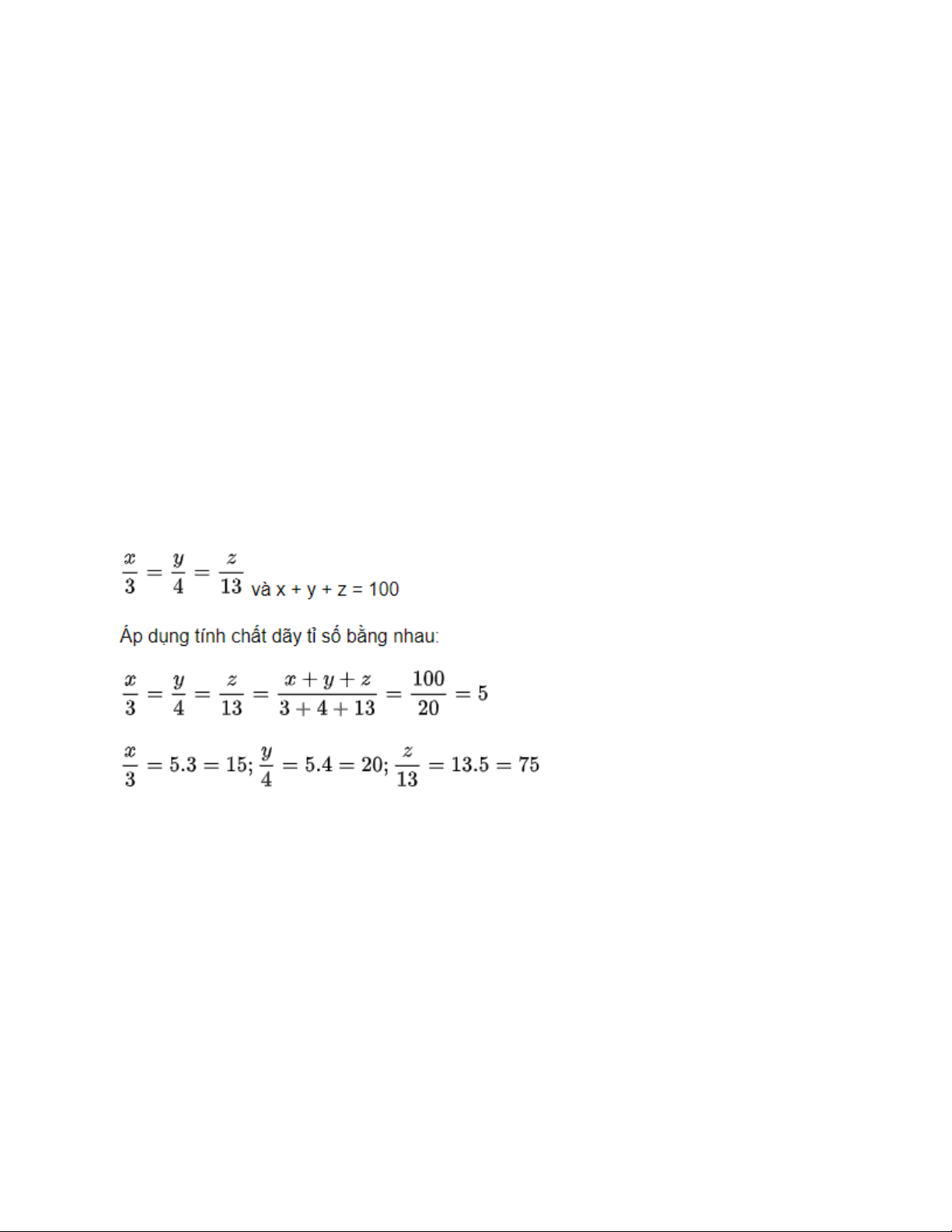

Preview text:
ĐỂ KIỂM TRA HỌC KÌ I - NĂM HỌC
UBND QUẬN THỦ ĐỨC
MÔN: HÓA HỌC - LỚP 9
PHÒNG GIÁO DỤC VÀ ĐÀO TẠO
Thời gian làm bài: 45 phút Câu 1: (2.5 điểm)
Viết phương trình hóa học thực hiện chuỗi phản ứng sau:
Zn → ZnO → ZnCl2 → Zn(NO3)2 → Zn(OH)2 → ZnSO4 Câu 2: (1.5 điểm)
Bằng phương pháp hóa học hãy phân biệt các dung dịch dựng trong các bình riêng
biệt mất nhãn sau: KCl, HNO3, BaCl2, KOH. Viết phương trình hóa học. Câu 3: (0,75 điểm)
Thành phần chính của không khí là O2 và N2. Khi không khí có lẫn khí độc là Cl2 thì
có thể cho lội qua dung dịch nào sau đây để loại bỏ chúng? a. Dung dịch CuSO4 b. Dung dịch H2SO4 c. Nước d. Dung dịch NaOH
Viết phương trình phản ứng Câu 4: (1.5 điểm)
Cho các kim loại sau: Al, Ag, Cu, Au. Hãy cho biết kim loại nào có tác dụng với: a. Dung dịch HCl b. Dung dịch AgNO3
Viết phương trình phản ứng Câu 5: (2.0 điểm)
Cho 200ml dung dịch KOH 1M tác dụng vừa đủ dung dịch MgSO4 2M
a. Tính khối lượng kết tủa thu được.
b. Tính thể tích dung dịch MgSO4 2M cần dùng
c. Tính nồng độ mol/lit dung dịch sau phản ứng.
(Biết thể tích dung dịch thay đổi không đáng kể) Câu 6: (0,75 điểm)
Đồng bạc là một hợp kim gồm Niken, kẽm và đồng. Khối lượng của chúng lần lượt
tỉ lệ với 3:4:13. Hỏi phải cần bao nhiêu kilogam mỗi loại để sản xuất ra được 100kg đồng bạch? Câu 7: (1.0 điểm)
Từ các chất Na, Fe2O3, Al, H2O và dung dịch HCl. Viết các phương trình hóa học điều chế AlCl3, Fe(OH)3
(Cho biết:K = 39; H = 1; Mg = 24; O = 16; S = 32)
Hướng dẫn giải chi tiết đề thi học kì 1 Hóa 9 Câu 1: (2.5 điểm) 2Zn + O2 → 2ZnO ZnO + 2HCl → ZnCl2 + H2O
ZnCl2 + 2AgNO3 → Zn(NO3)2 + 2AgCl
Zn(NO3)2 + 2NaOH → Zn(OH)2 + 2NaNO3
Zn(OH)2 + CuSO4 → ZnSO4 + Cu(OH)2 Câu 2.
Trích mẫu thử và đánh số thứ tự
Dùng quỳ tím để nhận biết được 2 dung dịch KOH quỳ chuyển sang màu xanh,
HNO3 quỳ tím chuyển sang màu đỏ.
Hai dung dịch còn lại không làm quỳ đổi màu là BaCl2 và KCl
Nhận biết 2 dung dịch này bằng axit H2SO4, ống nghiệm xuất hiện kết tảu trắng là
BaCl2, không hiện tượng gì là KCl
BaCl2 + H2SO4 → BaSO4 + 2HCl Câu 3.
Để loại bỏ Cl2 ra khỏi không khí ta cho nội qua dung dịch NaOH khi đó NaOH bị
hấp thụ theo các phương trình phản ứng hóa học sau:
Cl2 + 2NaOH → NaCl + NaClO + H2O Câu 4. a. Dung dịch HCl: Al 2Al + 6HCl → 2AlCl3 + 3H2 b. Dung dịch AgNO3 Al + AgNO3 → Al(NO3)3 + Ag Cu + AgNO3 → Cu(NO3)2 + Ag Câu 5. nKOH = 0,2 mol
2KOH + MgSO4 → Mg(OH)2 + K2SO4 0,2 0,1 0,1 0,1 mMg(OH)2 = 0,1.48 = 4,8 gam Vdd = n/CM = 0,1/1 = 0,1 lít CM K2SO4 = 0,1/0,2 = 0,5M Câu 6.
Gọi số kg niken, kẽm, đồng để sản xuất đồng bạch lần lượt là: x(kg),y(kg),z(kg) và
x,y,z phải là số dương. Theo đề bài, ta có:
Vậy số kg Niken, kẽm, đồng để sản xuất đồng bạch lần lượt là: 15, 20, 75 Câu 7. Điều chế AlCl3 2Al + 6HCl → 2AlCl3 + 3H2 Điều chế Fe(OH)3 2Na + 2H2O → 2NaOH + H2
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl



