



Preview text:
SỞ GD-ĐT QUẢNG BÌNH
KÌ THI CHỌN HỌC SINH GIỎI LỚP 11 THPT ĐỀ CHÍNH THỨC
Ngày 27 – 3 – 2013
Số BD:…………….. Môn: Hóa
Thời gian 180 phút (không kể thời gian giao đề) Bài 1 (2,25 điểm)
1. Viết phương trình hoá học của các phản ứng xảy ra trong các thí nghiệm sau (nếu có):
a) Sục khí Cl2 vào dung dịch FeSO4.
b) Sục khí etilen vào dung dịch KMnO4.
c) Sục khí H2S vào dung dịch nước brom.
d) Sục khí O3 vào dung dịch KI.
e) Sục khí SO2 vào dung dịch Fe2(SO4)3.
f) Nung hỗn hợp quặng photphorit, cát và than cốc ở 1200oC trong lò điện.
2. Hoàn thành phương trình hóa học của các phản ứng sau (nếu có): a) Fe2O3 + HNO3 (đặc) o t ⎯⎯→ b) Cl2O6 + NaOH (dư) ⎯⎯ →
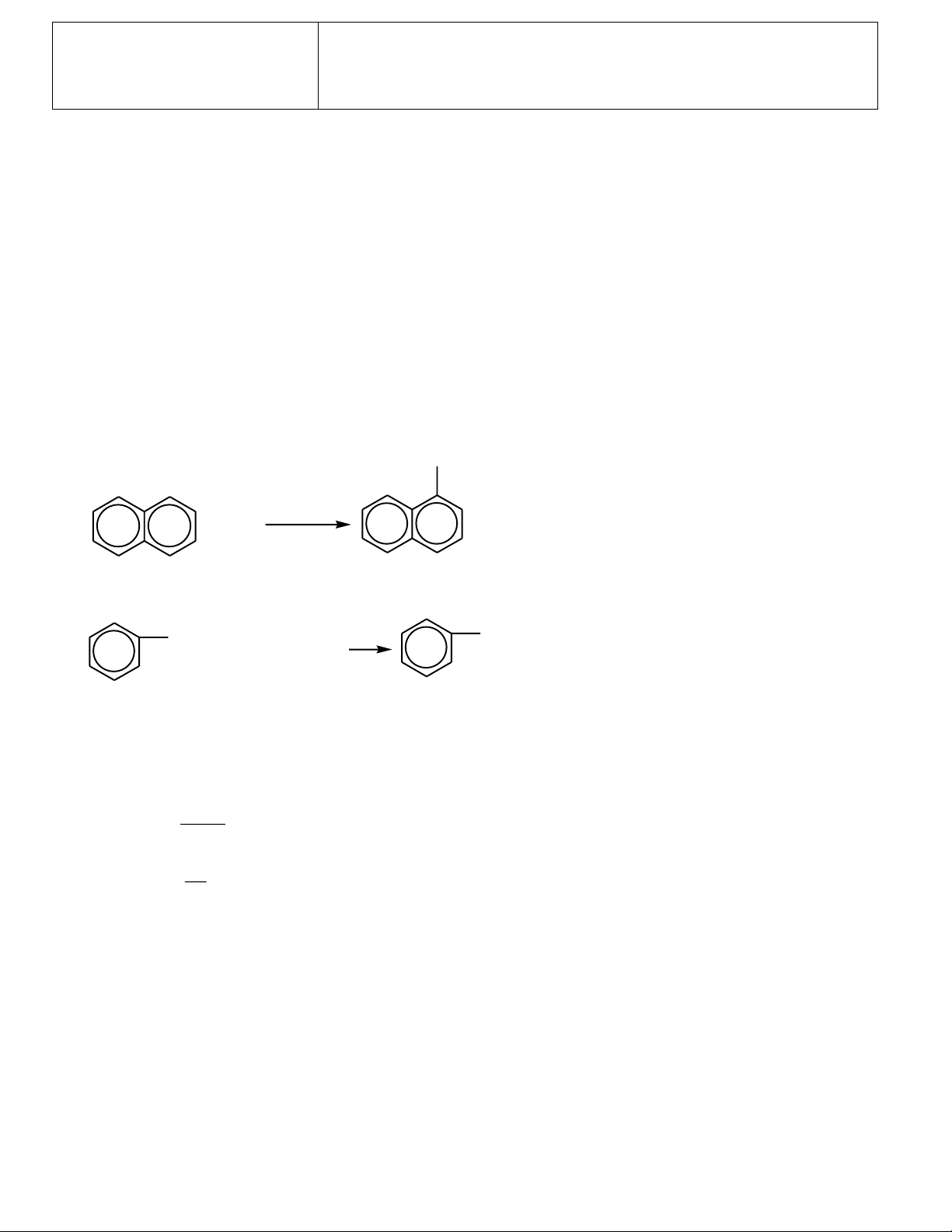
c) Na2S2O3 + H2SO4 (loãng) ⎯⎯ → d) PCl3 + H2O ⎯⎯ → e) Naphtalen + Br CH COOH ⎯⎯⎯⎯ → 2 3 f) CH 1 : 1 3-C≡CH + HBr (dư) ⎯⎯ → o g) C t ⎯⎯→ 2H5ONa + H2O ⎯⎯ → h) Etylbenzen + KMnO4 Bài 2 (1,75 điểm)
1. Hòa tan hết 31,89 gam hỗn hợp A gồm 2 kim loại Al và Mg trong lượng dư dung dịch HNO3 loãng, thu được
10,08 lít (đktc) hỗn hợp khí X (gồm NO và N2O) và dung dịch Y. Tỉ khối hơi của X so với khí hiđro là 59/3. Cô
cạn dung dịch Y thu được 220,11 gam muối khan. Tính phần trăm khối lượng mỗi kim loại trong hỗn hợp A.
2. Trong tự nhiên Bo có 2 đồng vị: 10B và 11B. Biết thành phần % về khối lượng của đồng vị 11B trong H3BO3
là 14,407%. Tính % số nguyên tử của mỗi đồng vị Bo trong tự nhiên. Bài 3 (1,5 điểm)
1. Viết tất cả các đồng phân cấu tạo ứng với công thức phân tử C3H6O.
2. Viết các phương trình hóa học thực hiện chuyển hóa sau (biết A, B, C, D là các sản phẩm chính): H SO ®Æ c o H SO ®Æ c, 170 C 2-brom-2-metylbutan ⎯⎯ KOH⎯ / anc ⎯ ol → A ⎯⎯ H O Cl , H O 2 ⎯ 4 ⎯ → B ⎯⎯ 2 → C ⎯⎯ 2 ⎯ 4 ⎯⎯→ A ⎯⎯2⎯ 2 → D Bài 4 (2,0 điểm)
1. Chất A có công thức phân tử là C7H8. Cho A tác dụng với AgNO3 trong dung dịch amoniac dư được chất
B kết tủa. Phân tử khối của B lớn hơn của A là 214. Viết các công thức cấu tạo có thể có của A.
2. Hỗn hợp khí X gồm 2 anken kế tiếp nhau trong dãy đồng đẳng. Đốt cháy hoàn toàn 5 lít hỗn hợp X cần
vừa đủ 18 lít khí oxi (các thể tích khí đo ở cùng điều kiện nhiệt độ, áp suất).
a) Xác định công thức phân tử của 2 anken.
b) Hiđrat hóa hoàn toàn một thể tích X với điều kiện thích hợp thu được hỗn hợp ancol Y, trong đó tỉ lệ về khối
lượng các ancol bậc một so với ancol bậc hai là 28:15. Xác định % khối lượng mỗi ancol trong hỗn hợp ancol Y. Bài 5 (2,5 điểm)
1. Cho phản ứng: C2H6 (k) + 3,5O2 (k) ⎯⎯ → 2CO2 (k) + 3H2O (l) (1)
Dựa vào 2 bảng số liệu sau: Chất C2H6 (k) O2 (k) CO2 (k) H2O (l) 0 ΔHs (kJ.mol-1) - 84,7 0 - 394 - 285,8 Liên kết C-H C-C O=O C=O H-O Elk (kJ.mol-1) 413,82 326,04 493,24 702,24 459,80
Nhiệt hóa hơi của nước là 44 kJ.mol-1
hãy tính hiệu ứng nhiệt của phản ứng (1) theo 2 cách.
2. Haber là một trong số các nhà hoá học có đóng góp quan trọng vào phản ứng tổng hợp NH3 từ khí H2 và N2.
Trong thí nghiệm 1 tại 472oC, Haber và cộng sự thu được [H2] = 0,1207M; [N2] = 0,0402M; [NH3] =
0,00272M khi hệ phản ứng đạt đến cân bằng. Trong thí nghiệm 2 tại 500oC, người ta thu được hỗn hợp cân
bằng có áp suất riêng phần của H2 là 0,733 atm; của N2 là 0,527 atm và của NH3 là 1,73.10-3 atm.
Phản ứng thuận: 3H2(k) + N2(k)
2NH3 (k) là phản ứng tỏa nhiệt hay thu nhiệt? Tại sao?
3. Hãy tính pH của dung dịch A gồm KCN 0,120M; NH3 0,150M và KOH 0,005M. Cho biết pKa của HCN là 9,35; của + NH4 là 9,24.
--------------- Hết ---------------
SỞ GD-ĐT QUẢNG BÌNH
KÌ THI CHỌN HỌC SINH GIỎI LỚP 11 THPT Ngày 27 - 3 – 2013 Môn: Hóa HƯỚNG DẪN CHẤM Bài 1 (2,25 điểm) 1. (1,0 điểm)
a) 3Cl2 + 6FeSO4 → 2Fe2(SO4)3 + 2FeCl3
b) 3C2H4 + 2KMnO4 + 4H2O → 3CH2OH-CH2OH + 2MnO2 + 2KOH (0,25 điểm) c) H2S + Br2 → S↓ + 2HBr
d) O3 + 2KI + H2O → O2 + I2 + 2KOH (0,25 điểm)
e) SO2 + Fe2(SO4)3 + 2H2O → 2FeSO4 + 2H2SO4 (0,25 điểm) o f) Ca 1200 C ⎯⎯⎯→ 3(PO4)2 + 3SiO2 + 5C 3CaSiO3 + 5CO + 2P (0,25 điểm) 2. (1,25 điểm) a) Fe2O3 + 6HNO3 (đặc) o t ⎯⎯→ 2Fe(NO3)3 + 3H2O b) Cl2O6 + 2NaOH ⎯⎯ → NaClO3 + NaClO4 + H2O (0,25 điểm)
c) Na2S2O3 + H2SO4 (loãng) ⎯⎯ → Na2SO4 + S↓ + SO2 + H2O d) PCl3 + 3H2O ⎯⎯ → H3PO3 + 3HCl (0,25 điểm) Br CH3COOH e) + Br + HBr 2 (0,25 điểm)
f) CH3-C≡CH + 2HBr (dư) ⎯⎯ → CH3-CBr2-CH3 g) C2H5ONa + H2O ⎯⎯ → C2H5OH + NaOH (0,25 điểm) CH to COOK 2CH3 h) + 4KMnO4 + K2CO3 + 4MnO2 + KOH + 2H2O (0,25 điểm) Bài 2 (1,75 điểm)
1. (1,25 điểm)
Đặt số mol của NO và N2O lần lượt là a và b, ta có: 10,08 a + b = = 0,45 22,4 a = 0,15 (0,25 điểm) 59 b = 0,3 30a + 44b = .2.0,45 = 17,7 3
Đặt số mol của Al và Mg lần lượt là x và y, ta có: 27x + 24y = 31,89 (1)
Khi cho hỗn hợp A tác dụng với dung dịch HNO3: Al → Al3+ + 3e x x 3x Mg → Mg2+ + 2e y y 2y N+5 + 3e → N+2 0,45 0,15 N+5 + 4e → N+1 (0,25 điểm) 2,4 0,6
Nếu sản phẩm khử chỉ có NO và N2O thì:
mmuối = 31,89 + 62(0,45 + 2,4) = 208,59 gam < 220,11 gam: Vô lí
có muối NH4NO3 tạo thành trong dung dịch Y. (0,25 điểm) N+5 + 8e → N-3 8z z
Ta có: 3x +2y = 0,45 + 2,4 + 8z hay 3x + 2y - 8z = 2,85 (2)
Mặc khác: 213x + 148y + 80z = 220,11 (3)
Giải hệ (1), (2), (3) ta được: x = 0,47; y = 0,8; z = 0,02 (0,25 điểm) Vậy: 0, 47.27.100% %Al = = 39,79% 31,89 %Mg = 100% - 39,79% = 60,21%. (0,25 điểm) 2. (0,5 điểm)
Gọi % số nguyên tử của đồng vị 11B là x % số nguyên tử của đồng vị 10B là (1-x).
Ta có: MB = 11x + 10(1-x) = x + 10 11x 14,407 Theo bài ra ta có: = (0,25 điểm) 3 + 16.3 + 10 + x 100
Giải phương trình trên được x = 0,81. Vậy, trong tự nhiên: %11B = 81% %10B = 100% - 81% = 19% (0,25 điểm) Bài 3 (1,5 điểm) 1. (0,75 điểm) CH2=CH-CH2OH CH2=CH-OCH3 (0,25 điểm) CH3-CH2-CHO CH3COCH3 (0,25 điểm) O O OH (0,25 điểm) 2. (0,75 điểm)
Các chất: A: (CH3)2C=CH-CH3, B: (CH3)2C(OSO3H)-CH2-CH3
C: (CH3)2C(OH)-CH2-CH3 và D: (CH3)2C(OH)-CHCl-CH3 (CH3)2C(Br)-CH2-CH3 + KOH ancol ⎯⎯⎯
→ (CH3)2C=CH-CH3 + KBr + H2O (1)
(CH3)2C=CH-CH3 + HOSO3H (đặc) ⎯⎯
→ (CH3)2C(OSO3H)-CH2-CH3 (2) (0,25 điểm)
(CH3)2C(OSO3H)-CH2-CH3 + H2O ⎯⎯
→ (CH3)2C(OH)-CH2-CH3 + H2SO4 (3) o (CH H SO ®Æ c, 170 C 2 4
3)2C(OH)-CH2-CH3 ⎯⎯⎯⎯⎯ → (CH3)2C=CH-CH3 + H2O (4) (0,25 điểm)
(CH3)2C=CH-CH3 + H2O + Cl2 ⎯⎯
→ (CH3)2C(OH)-CHCl-CH3 + HCl (5) (0,25 điểm) Bài 4 (2,0 điểm) 1. (0,75 điểm) Hợp chất A (C ) tác dụng với AgNO
, đó là hiđrocacbon có liên kết 7H8 3 trong dung dịch NH3
ba ở đầu mạch có dạng R(C≡CH)x R(C≡CH) ⎯⎯ → x + xAgNO3 + xNH3 R(C≡CAg)x + xNH4NO3 (0,25 điểm) R + 25x R + 132x
M – M = (R + 132x) - (R + 25x) = 107x = 214 x = 2 B A
Vậy A có dạng: HC≡C-C3H6-C≡CH (0,25 điểm)
Các công thức cấu tạo có thể có của A: CH C-CH2-CH2-CH2-C CH CH C-CH2-CH-C CH CH3 CH3 CH C-CH-C CH CH C-C-C CH CH2CH3 CH3 (0,25 điểm) 2. (1,25 điểm)
Đặt công thức chung của 2 anken là C H ( n là số cacbon trung bình của 2 anken) n 2n o t 2 C H + 3n O ⎯⎯ → 2n CO + 2n H O (1) n 2n 2 2 2 Ta có: 3n 18 = n = 2, 4 2 5
Anken duy nhất có số nguyên tử cacbon < 2,4 là C2H4 và anken kế tiếp là C3H6. (0,25 điểm)
CH2 = CH2 + HOH → CH3–CH2OH (2)
CH3CH = CH2 + HOH → CH3–CH(OH)–CH3 (3)
CH3CH = CH2 + HOH → CH3–CH2–CH2OH (4) 15 %i-C H OH = = 34,88% (0,25 điểm) 3 7 28+15
Gọi a, b lần lượt là số mol của C2H4 và C3H6.
Ta có: 2a + 3b = 2,4(a+b) a = 1,5b (0,25 điểm)
Theo các phản ứng (2), (3), (4): số mol H2O = số mol anken = 2,5b
Theo định luật bảo toàn khối lượng ta có:
Khối lượng hỗn hợp ancol Y = khối lượng hỗn hợp anken X + khối lượng nước
= 28.1,5b + 42b + 18.2,5b = 129b gam (0,25 điểm) 1,5b.46 %C H OH = = 53,49% 2 5 129b
%n-C H OH = 100% - 34,88% - 53,49% = 11,63% (0,25 điểm) 3 7 Bài 5 (2,5 điểm) 1. (0,5 điểm) Δ 0 H 0 0 0 0 p = 2 ΔH + 3 ΔH – ΔH – 3,5 ΔH s(CO2,k) s(H2O,l) s(C2H6,k) s(O2,k) Δ 0
Hp = 2(–394) + 3(–285,8) – (–84,7) – 3,5.0 = –1560,7 (kJ) (0,25 điểm) Mặt khác: Δ 0
Hp = 6EC-H + EC-C + 3,5EO=O – 4EC=O – 6 EO-H – ΔH 3 hh Δ 0
Hp = 6(413,82) + 326,04 + 3,5(493,24) – 4(702,24) – 6(459,8) – 3(44) = –1164,46 (kJ) (0,25 điểm) 2. (1,0 điểm) 2 2 Tại 472 [NH ] (0,00272) oC: 3 K = = = 0,105 (0,25 điểm) c 3 3 [H ] .[N ] (0,1207) .(0,0402) 2 2 n 2 − -5
→ K = K (RT) = 0,105[0,082.(472 + 273)] = 2,81.10 (0,25 điểm) p c 2 -3 2 p Tại 500 (1,73.10 ) oC: NH3 -5 K = = =1,44.10 < 2,81.10-5 (0,25 điểm) p 3 3 p .p (0,733) .(0,527) H2 N2
Nhiệt độ tăng, K giảm → phản ứng thuận là phản ứng tỏa nhiệt (theo nguyên lí của Lơ Satơlie). p (0,25 điểm) 3. (1,0 điểm) CN- + H2O ⎯⎯ → ⎯ ⎯ HCN + OH- Kb1 = 10- 4,65 (1) NH3 + H2O ⎯⎯ → ⎯ ⎯ + NH + OH- 4 Kb2 = 10- 4,76 (2) H2O ⎯⎯ → ⎯ ⎯ H+ + OH- KW = 10-14 (3) (0,25 điểm)
So sánh (1) → (3), tính pH theo ĐKP áp dụng cho (1) và (2): [OH-] = CKOH + [HCN] + [ + NH ] 4 - Đặt [OH K [CN ] K [NH ] -] = x → x = 5.10-3 + b1 + b2 3 x x
→ x2 - 5.10-3x - (Kb1[CN-] + Kb2[NH3]) = 0 (0,25 điểm)
Chấp nhận: [CN-] = CCN- = 0,12M ; [NH3] = C = 0,15M. NH3
→ Ta có: x2 - 5.10-3x - 5,29.10-6 = 0 → x = [OH-] = 5,9.10-3M = 10-2,23M → [H+] = 10-11,77M (0,25 điểm) 9 − ,35 9 − ,24 Kiểm tra: [CN 10 10 -] = 0,12 0,12 M; [NH3] = 0,15 0,15 M 9 − ,35 1 − 1,77 − − 10 +10 9,24 11,77 10 +10
Vậy cách giải gần đúng trên có thể chấp nhận được → pH = 11,77. (0,25 điểm) Lưu ý:
- Thí sinh có thể giải nhiều cách, nếu đúng vẫn được điểm tối đa tùy theo điểm của từng câu.
- Nếu thí sinh giải đúng trọn kết quả của một ý theo yêu cầu đề ra thì cho điểm trọn ý mà không cần
tính điểm từng bước nhỏ, nếu từng ý giải không hoàn chỉnh, có thể cho một phần của tổng điểm tối
đa dành cho ý đó, điểm chiết phải được tổ thống nhất; Điểm toàn bài chính xác đến 0,25 điểm.



