

























Preview text:
lOMoARcPSD| 36782889 MỤC LỤC
MỤC LỤC.....................................................................................................................
DANH MỤC HÌNH.......................................................................................................
DANH MỤC BẢNG......................................................................................................
LỜI MỞ ĐẦU ............................................................................................................... 1
CHƯƠNG 1: TỔNG QUAN VỀ NGUYÊN LIỆU .................................................... 1
1.1. Tổng quan về Dây gắm ...................................................................................... 1
1.1.1. Phân loại ....................................................................................................... 1
1.1.2. Mô tả thực vật ............................................................................................... 1
1.1.3. Phân bố ......................................................................................................... 2
1.1.4. Thành phần hóa học ..................................................................................... 3
1.1.5. Công dụng .................................................................................................... 6
1.1.6. Sản phẩm Dây gắm trên thị trường hiện nay ............................................... 7
1.2. Công trình nghiên cứu trong và ngoài nước ................................................. 10
1.2.1. Các nghiên cứu về Stilbene ........................................................................ 10
1.2.2. Các nghiên cứu về hoạt tính sinh hoc ........................................................ 12
1.2.3. Các nghiên cứu về trích ly .......................................................................... 13
1.3. Tính cấp thiết của đề tài .................................................................................. 14
CHƯƠNG 2: THỰC NGHIỆM ................................................................................ 14
2.1. Mục tiêu nghiên cứu ........................................................................................ 14
2.2. Nội dung nghiên cứu........................................................................................ 14
2.3. Hóa chất và thiết bị sử dụng ........................................................................... 15
2.3.1. Dụng cụ và thiết bị sử dụng ....................................................................... 15 lOMoARcPSD| 36782889
2.3.2. Hóa chất ...................................................................................................... 15
2.4. Nội dung thực hiện .......................................................................................... 17
2.4.1. Xử lý nguyên liệu ....................................................................................... 17
2.4.2. Chuẩn bị cao chiết ...................................................................................... 17
2.4.3. Khảo sát các yếu tố ảnh hưởng đến quá trình chiết ................................... 19
2.4.4. Khảo sát hoạt tính sinh học của cao chiết .................................................. 20
2.5. Phương pháp đánh giá .................................................................................... 20
2.5.1. Đo độ ẩm .................................................................................................... 20
2.5.2. Sơ bộ hóa thực vật ...................................................................................... 20
2.5.3. Định lượng polyphenol tổng bằng phương pháp Folin – Ciocalteau ......... 21
2.5.4. Định lượng flavonoid tổng bằng phương pháp Aluminum Chloride – AlCl3
.............................................................................................................................. 23
2.5.5. Khảo sát hoạt tính chống oxy hóa theo cơ chế DPPH ............................... 25
CHƯƠNG 3: KẾT QUẢ SƠ BỘ ............................................................................... 27
3.1. Xử lý nguyên liệu và đánh giá sơ bộ thành phần chính trong Dây gắm .... 27
3.1.1. Chuẩn bị nguyên liệu .................................................................................. 27
3.1.2. Kết quả sơ bộ hóa thực vật ......................................................................... 29
3.2. Hiệu suất thu cao tổng ..................................................................................... 30
CHƯƠNG 4. ĐỊNH HƯỚNG .................................................................................... 31
TÀI LIỆU THAM KHẢO ......................................................................................... 31 DANH MỤC HÌNH
Hình 1.1. Thân Dây gắm...............................................................................................2
Hình 1.2. Lá và trái Dây gắm........................................................................................3
Hình 1.3. Công thức cấu tạo của trans-resveratrol........................................................5 lOMoAR cPSD| 36782889
Hình 1.4. Công thức cấu tạo của resveratroloside.........................................................5
Hình 1.5. Công thức cấu tạo của isorhapontigenin-13-glucoside..................................5
Hình 1.6. Công thức cấu tạo của 5,7,2′-trihydroxy-5′-methoxyflavone.........................6
Hình 1.7. Công thức cấu tạo của 5,7,4′-trihydroxy-3′- methoxyflavanone....................6
Hình 1.8. Sản phẩm thương mại dạng khô....................................................................9
Hình 1.9. Sản phẩm thương mại dạng cao...................................................................10
Hình 1.10. Sản phẩm thương mại dạng viên...............................................................10
Hình 1.11. Cấu trúc hóa học của các dẫn xuất monome stilbene thông thường..........12
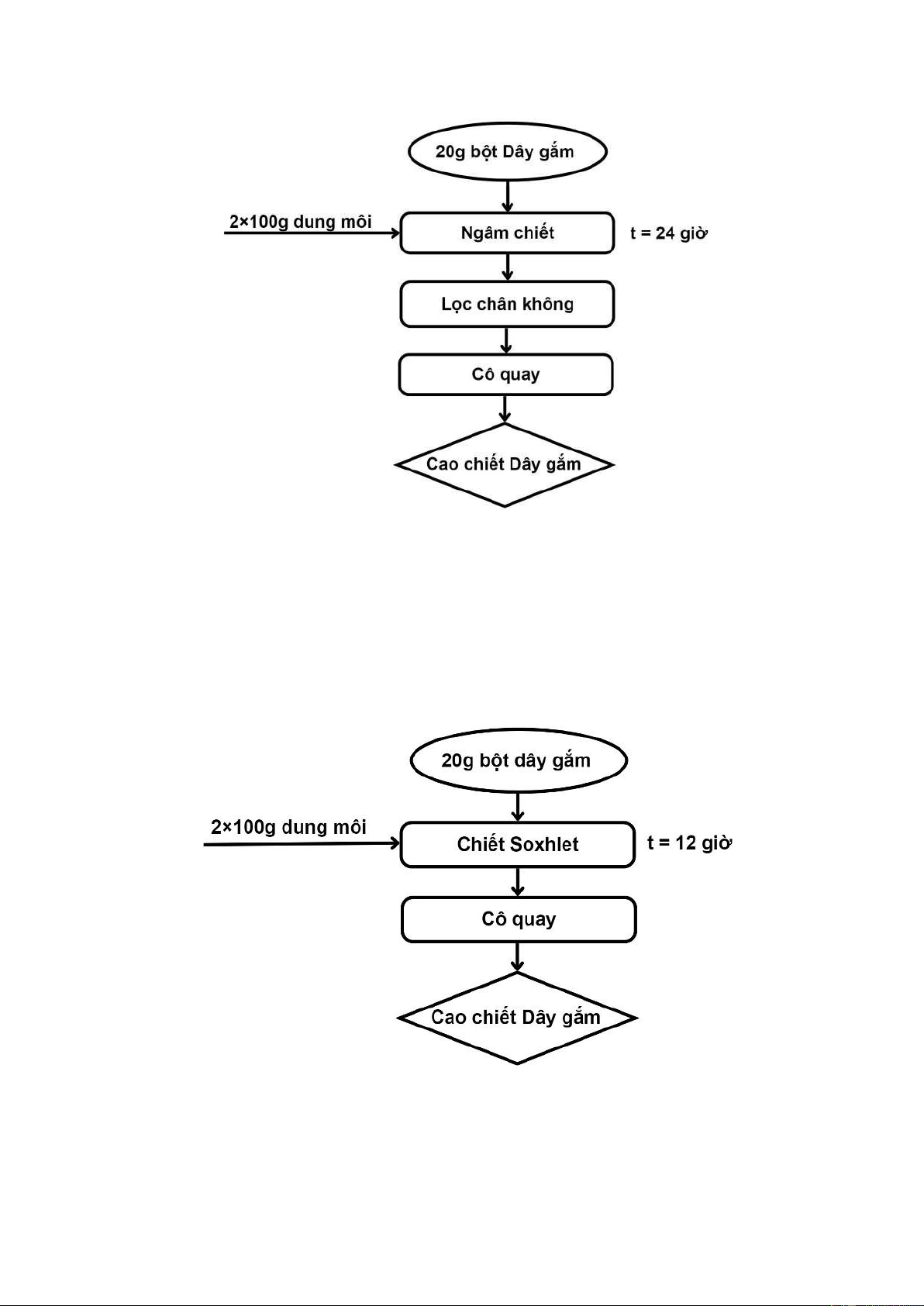
Hình 2.1. Sơ đồ quy trình chiết ngâm dầm Dây gắm 18
Hình 2.2. Sơ đồ quy trình chiết soxhlet Dây gắm........................................................18
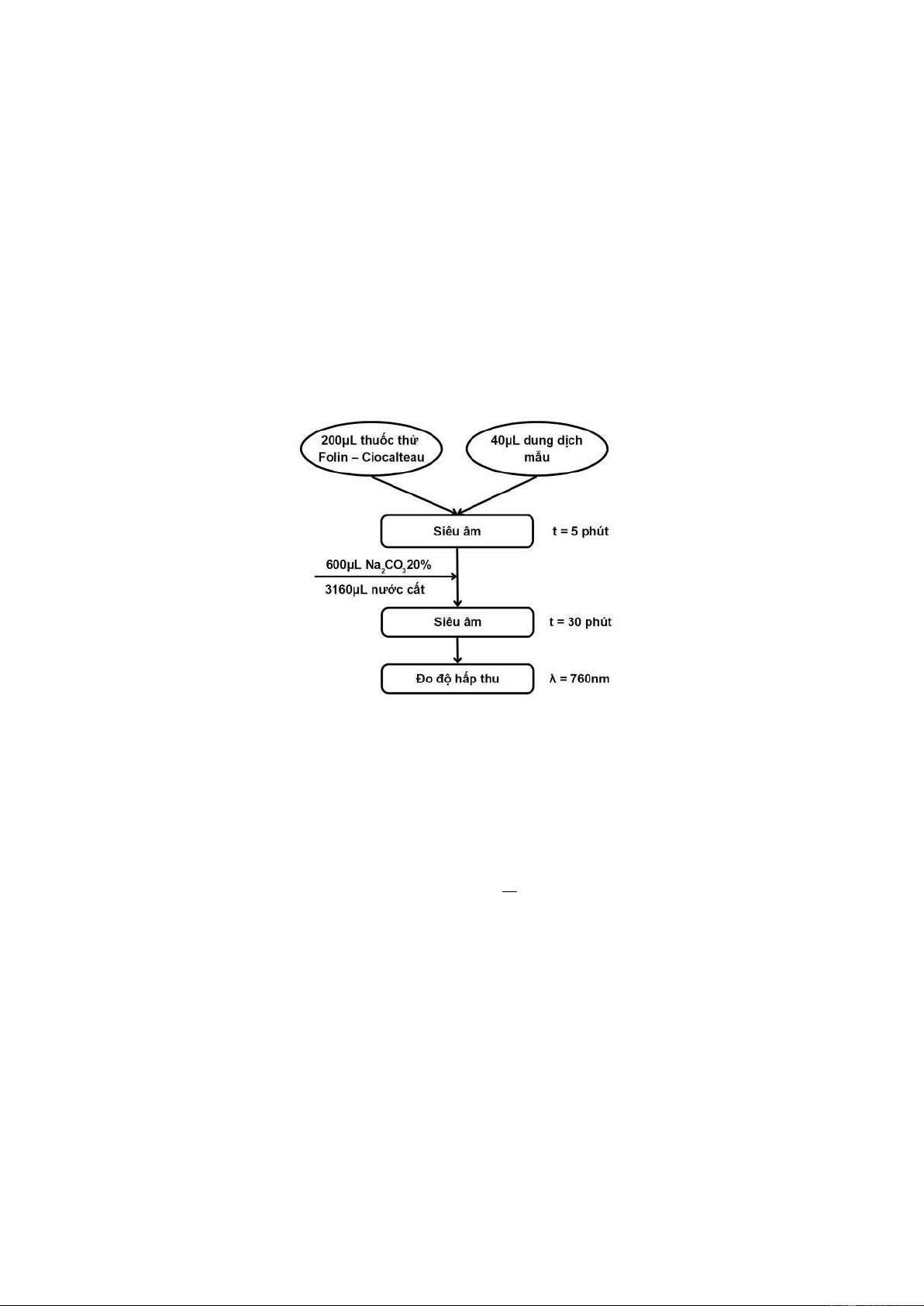
Hình 2.3. Quy trình định lượng polyphenol................................................................22
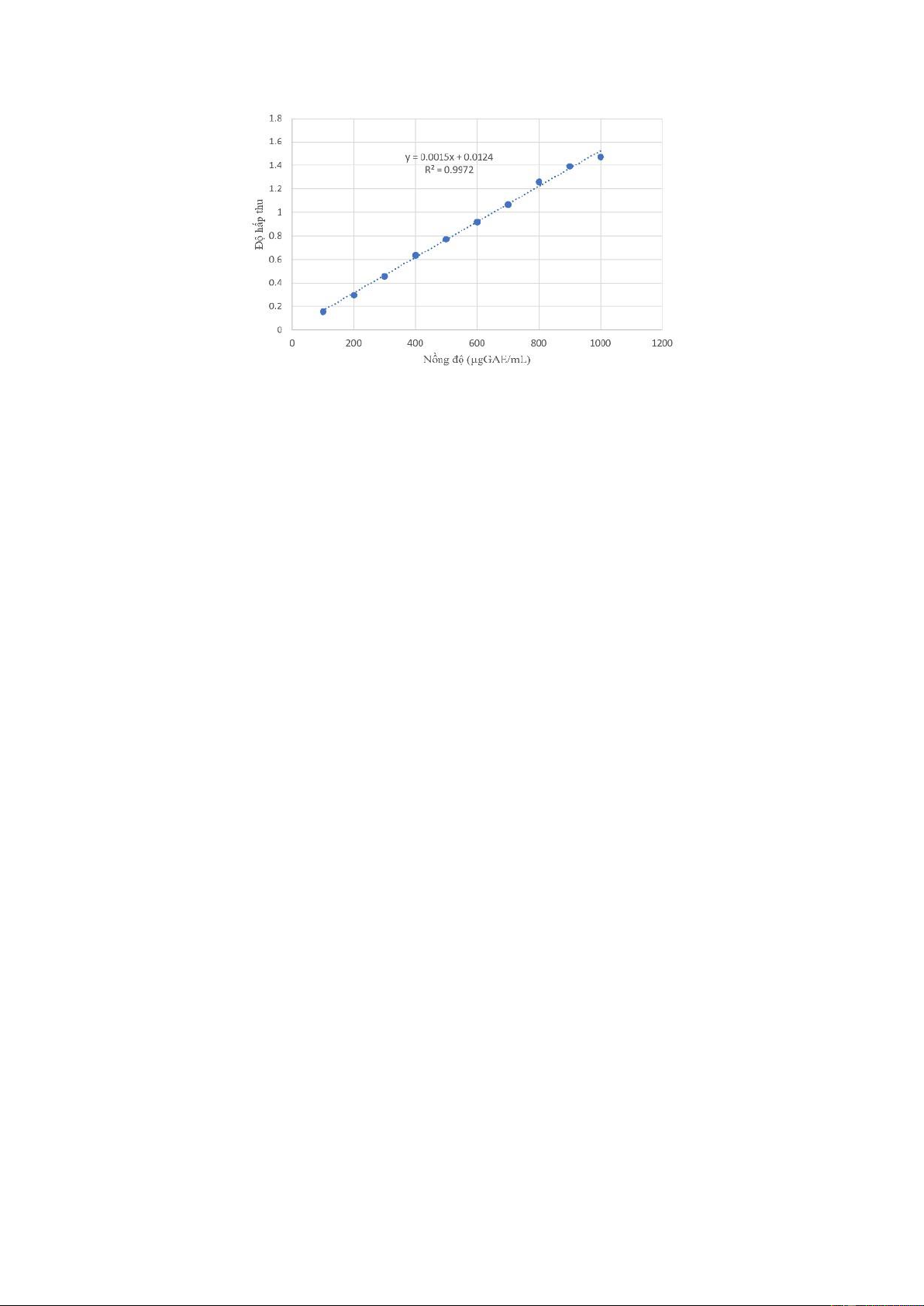
Hình 2.4. Đường chuẩn Gallic acid tại bước sóng 760nm...........................................23
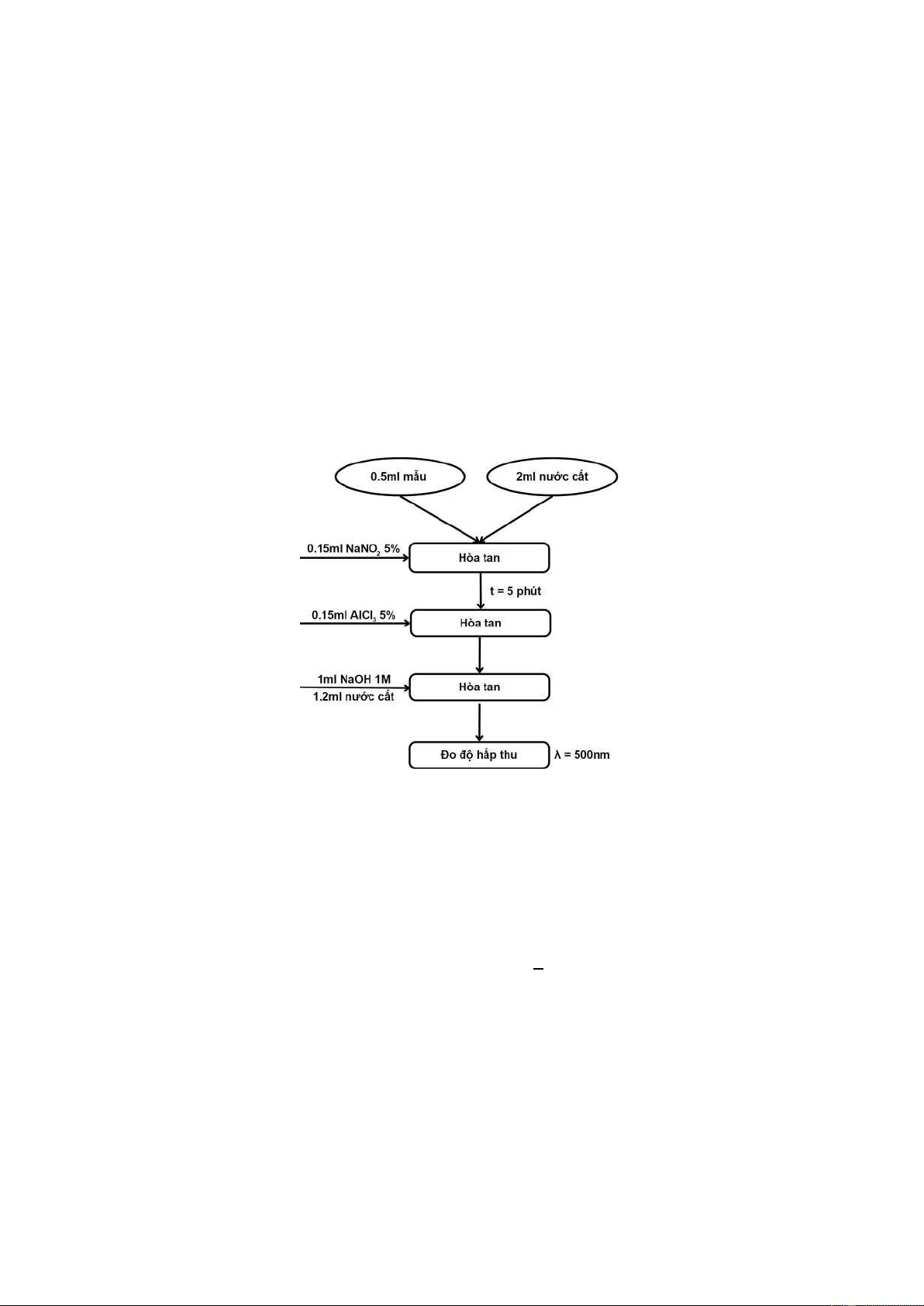
Hình 2.5. Quy trình định lượng flavonoid bằng phương pháp AlCl3...........................24
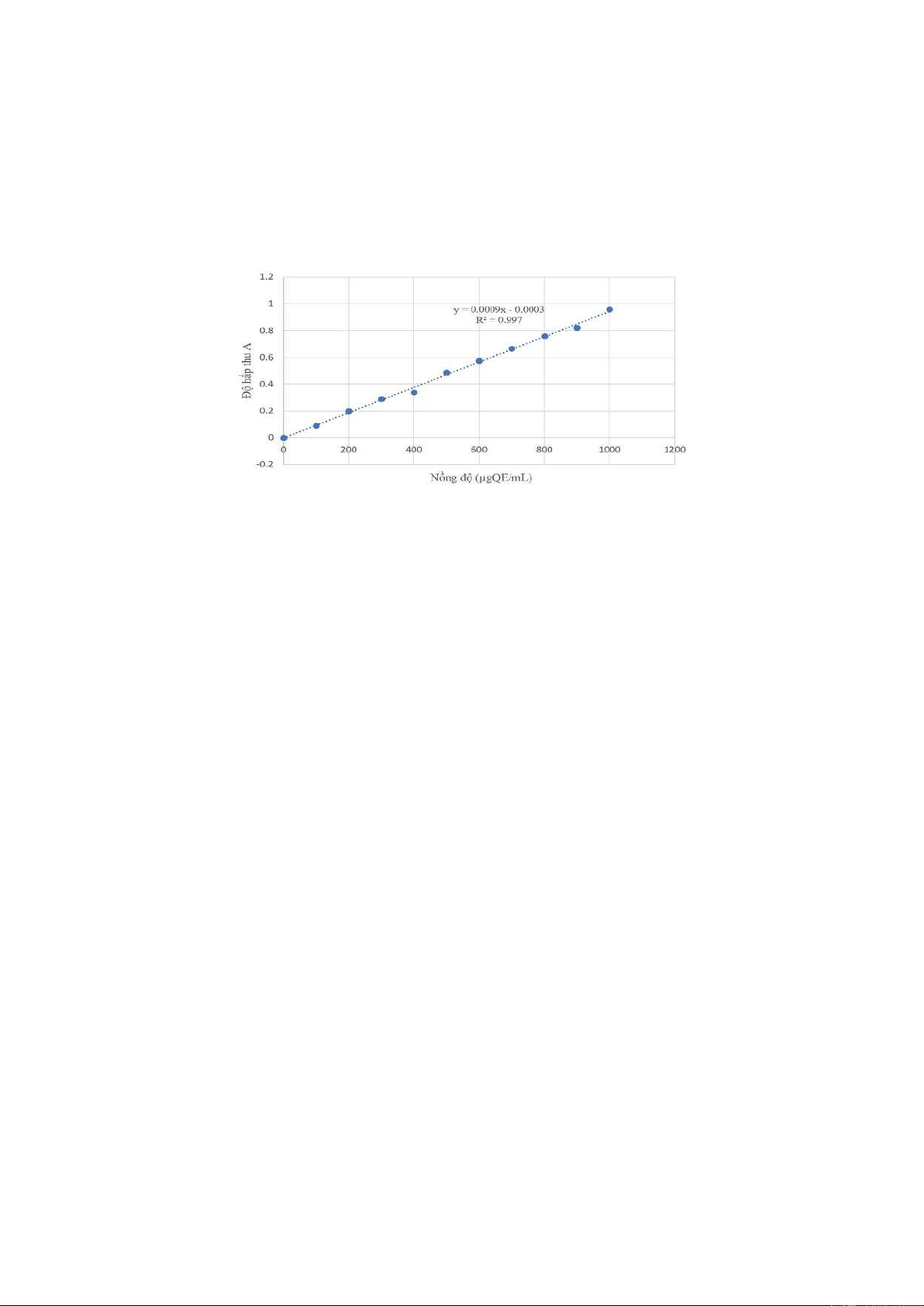
Hình 2.6. Đường chuẩn Quercetin tại bước sóng 500nm............................................25
Hình 2.7. Phản ứng bắt gốc tự do theo cơ chế DPPH..................................................26
Hình 2.8. Quy trình khảo sát hoạt tính bắt gốc tự do DPPH........................................27
Hình 3.1. Dây gắm khô
Hình 3.2. Bột Dây gắm DANH MỤC BẢNG
Hình 1.1. Thân Dây gắm
Hình 1.2. Lá và trái Dây gắm
Hình 1.3. Công thức cấu tạo của trans-resveratrol
Hình 1.4. Công thức cấu tạo của resveratroloside
Hình 1.5. Công thức cấu tạo của isorhapontigenin-13-glucoside lOMoAR cPSD| 36782889
Hình 1.6. Công thức cấu tạo của 5,7,2′-trihydroxy-5′-methoxyflavone
Hình 1.7. Công thức cấu tạo của 5,7,4′-trihydroxy-3′- methoxyflavanone
Hình 1.8. Sản phẩm thương mại dạng khô
Hình 1.9. Sản phẩm thương mại dạng cao
Hình 1.10. Sản phẩm thương mại dạng viên
Hình 1.11. Cấu trúc hóa học của các dẫn xuất monome stilbene thông thường
Bảng 2.1. Dụng cụ và thiết bị thí nghiệm....................................................................15
Bảng 2.2. Danh sách hóa chất được sử dụng...............................................................16
Bảng 3.1. Độ ẩm của bột dược liệu…………………………………………………… 29
Bảng 3.2. Kết quả sơ bộ hoá thực vật của cao chiết Dây gắm.....................................30
Bảng 3.3. Hiệu suất chiết cao tổng theo phương pháp ngâm dầm...............................31 lOMoARcPSD| 36782889 LỜI MỞ ĐẦU
Quá trình sản xuất và tích lũy quá mức các gốc tự do trong cơ thể là nguyên nhân
chính dẫn đến lão hóa và các bệnh thoái hóa như bệnh đái tháo đường, ung thư, xơ vữa
động mạch, bệnh tim mạch [1-2]... Ngoài ra, chất kháng oxy hóa tổng hợp (như
butylated hydroxyanisol và butylated hydroxytoluen) được sử dụng rộng rãi trong ngành
công nghiệp thực phẩm đã được chứng minh là có hại cho sức khỏe do độc tính tiềm
tàng và là các tác nhân gây ung thư [3]. Do đó, ngày càng có nhiều mối quan tâm đối
với việc tìm kiếm các hợp chất kháng oxy hóa có nguồn gốc tự nhiên như nhóm
polyphenol và flavonoid, là thành phần dinh dưỡng quan trọng nhất trong thực vật và
có khả năng kháng oxy hóa cao, có mặt trong tất cả các bộ phận của cây. Việc sử dụng
thuốc từ dược liệu thiên nhiên đang là xu hướng không chỉ ở Việt Nam mà còn trên thế
giới vì tính an toàn, hiệu quả, ít tác dụng phụ.
Hiện tại, các nghiên cứu trong nước về thành phần hóa học và hoạt tính sinh học
của cây gắm còn hạn chế. Chính vì vậy, trong nghiên cứu này, chúng tôi tiến hành
Nghiên cứu tách chiết và đánh giá hoạt tính sinh học của cao chiết từ Dây gắm (Gnetum
montanum Markgr.) giúp khẳng định hơn tiềm năng của loài cây này, làm phong phú
cho nguồn dược liệu trong nước và cung cấp số liệu cho nghiên cứu tiếp theo.
CHƯƠNG 1: TỔNG QUAN VỀ NGUYÊN LIỆU
1.1. Tổng quan về Dây gắm
1.1.1. Phân loại
Dây gắm có danh pháp khoa học là Gnetum montanum Markgr. là một loài thực
vật hạt trần trong giới Plantae, lớp Gnetopsida, bộ Gnetales, họ Gnetaceae, chi Gnetum,
loài G. montanum. Dây gắm, còn được biết đến với nhiều tên gọi khác nhau như Dây
mấu, Dây sót, Vương tôn, Gắm núi, Muồi, Dây gấm lót, Bắn thàn muối, Vàng múi nhây, K’lot [4]…
1.1.2. Mô tả thực vật
Dây gắm là loài dây leo trên các thân cây cổ thụ, độ dài khoảng từ 10 - 12m. Thân
to có tiết diện tròn hoặc bầu dục, có nếp nhăn dọc, ở mỗi đốt thân có sự phình lên. Lá lOMoARcPSD| 36782889
của cây là loại lá nguyên, tức là không có lá kèm bên ngoài, và chúng thường mọc đối
nhau trên cây. Phiến lá có hình trái xoan, dài và thuôn, với mặt trên thường mượt và bóng [5].
Hình 1.1. Thân Dây gắm
Hoa gắm có hai loại: hoa đực và hoa cái, chúng thường mọc ở cùng một vị trí trên
cây, tập trung lại để tạo thành một loại cụm hoa hình nón. Quả có cuống ngắn, khi chín
thường có màu vàng và chứa các hạt to [5].
Hình 1.2. Lá và trái Dây gắm
Dây gắm thường bắt đầu ra hoa vào mùa hè, từ tháng 6 đến tháng 8, và có quả vào
mùa thu và đông, từ tháng 10 đến tháng 12 [5].
1.1.3. Phân bố
Loài cây này phân bố rộng rãi ở các khu vực nhiệt đới và cận nhiệt đới trên toàn
thế giới, bao gồm châu Phi, châu Á và châu Mỹ Latinh. Nó thường được tìm thấy trong
các khu rừng mưa nhiệt đới và môi trường ẩm ướt. Dây gắm có thể thấy mọc hoang ở lOMoARcPSD| 36782889
rừng núi khắp Việt Nam, như tại các vùng như Sapa, Hà Giang, Tuyên Quang, và nhiều vùng khác [6].
1.1.4. Thành phần hóa học
Hiện nay, các loại thuốc từ nguồn gốc tự nhiên đang được chú ý đặc biệt trong
ngành chăm sóc sức khỏe. Các thầy thuốc y học cổ truyền cũng như các công trình
nghiên cứu khoa học từ chuyên gia đã nghiên cứu và chứng minh tác dụng của dược
liệu trong điều trị bệnh. Trong số những loại cây được nghiên cứu, Dây gắm này trở
thành một điểm nổi bật trong nghiên cứu y học và dược học. Nhiều nghiên cứu đã chỉ
ra rằng Dây gắm chứa nhiều thành phần quý giá có khả năng hỗ trợ điều trị nhiều tình
trạng sức khỏe khác nhau.
Một số nghiên cứu khảo sát sơ bộ thành phần hóa học của Dây gắm. Điển hình là
bài nghiên cứu của Lê Văn Minh và cộng sự đã khảo sát rằng Dây gắm chứa nhiều các
nhóm hợp chất triterpenoid, anthraquinon và antraglycosid. Tiếp theo đó là những hợp
chất flavonoid, saponin và các acid hữu cơ [7]. Nhóm nghiên cứu của N.Ahmat cũng
thực hiện sơ bộ hóa thực vật trên Gnetum gnemon, Gnetum latifolium. Kết quả cho thấy
lá và cành của Gnetum gnemon đều dương tính với thuốc thử nhận biết flavonoid,
terpene và tannin. Trong khi đó ở Gnetum latifolium, lá, trái, cành và thân dương tính
với flavonoid, terpene và tanninm; riêng cành và thân dương tính thêm với thuốc thử nhận biết alkaloid [8].
Đặc biệt, các hợp chất stilbenoid và flavonoid trong dây gắm nhận được sự chú ý
trong giới khoa học. Hoạt tính sinh học của stilbenoid và flavonoid thể hiện nhiều tính
chất kháng vi khuẩn, kháng khuẩn và khả năng chống viêm. Điều này mở ra cánh cửa
cho những ứng dụng tiềm năng trong việc điều trị nhiều bệnh lý, từ các vấn đề về xương
khớp đến các tình trạng viêm nhiễm. 1.1.4.1. Stilbene
Polyphenol là các hợp chất có nguồn gốc tự nhiên và tồn tại trong thực vật được
chứng minh là có khả năng chống oxy hóa vô cùng hiệu quả. Polyphenol có thể bảo vệ
cơ thể, giúp cơ thể chống lại nhiều loại bệnh khác nhau do gốc tự do gây ra. Đặc điểm
chung của chúng là trong phân tử có vòng thơm (vòng benzen) chứa một hay hai, ba...
hoặc nhiều nhóm hydroxyl (OH) gắn trực tiếp vào vòng benzen. Tùy thuộc vào số lượng lOMoARcPSD| 36782889
và vị trí tương hỗ của các nhóm OH với bộ khung hóa học mà các tính chất lý hoá học
hoặc hoạt tính sinh học thay đổi. Stilbenoid là các dẫn xuất của stilbene, là một họ
polyphenol đáng chú ý được tìm thấy trong chiết xuất Dây gắm. Điều đáng chú ý là có
khoảng 100 hợp chất stilbenoid được tìm thấy trên 15 loài thuộc chi Gnetum, dường
như đây là thành phần đặc trưng của chi [9-12], ba hợp chất nhóm stilbene trong chiết
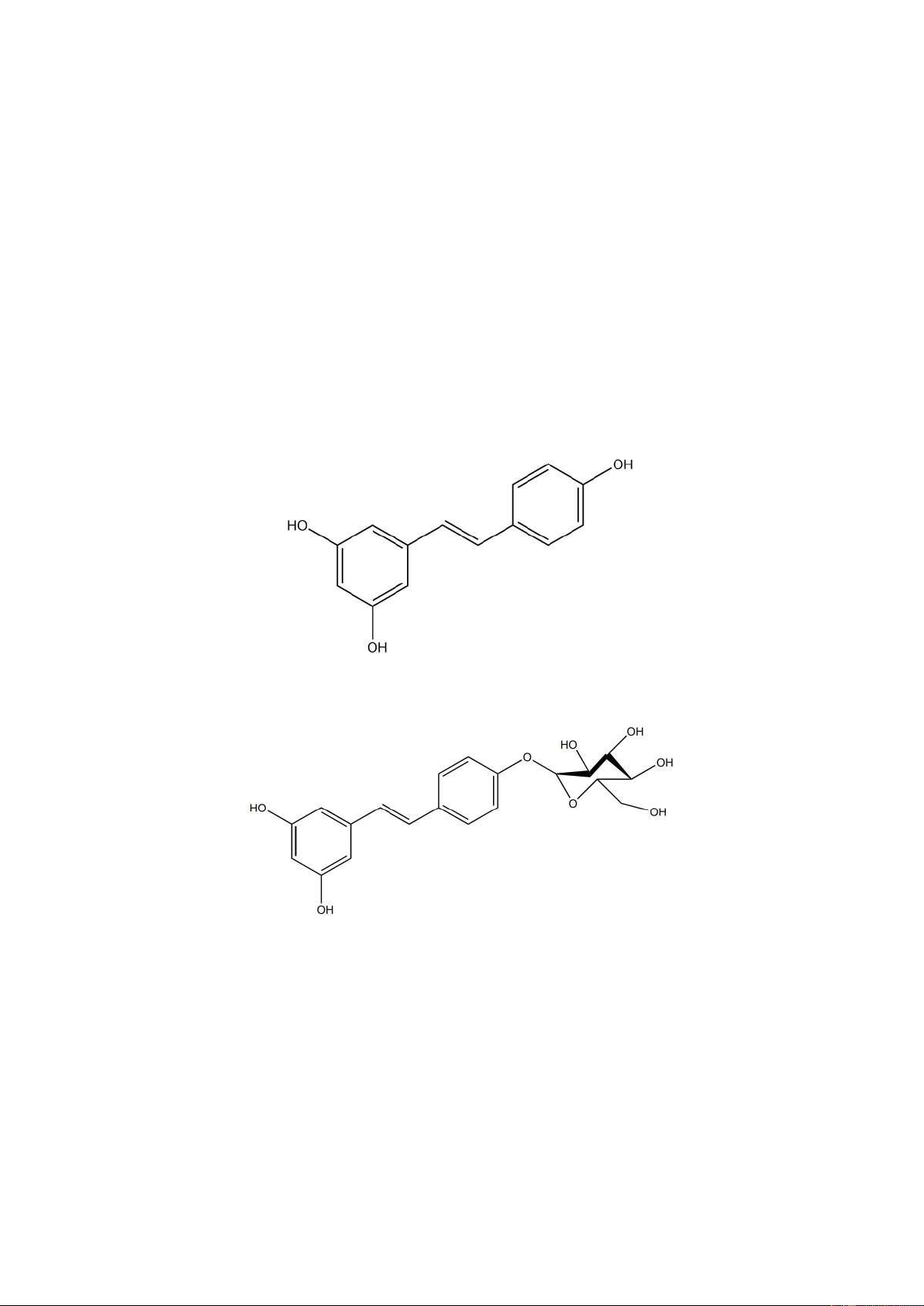
xuất Dây gắm được xác định cấu trúc là trans-resveratrol, resveratroloside và
isorhapontigenin-13-glucoside. Với các khả năng ức chế tế bào ung thư, kháng viêm và
quét gốc tự do mạnh của các stilbenoid nên các hợp chất này đã đóng vai trò quan trọng
trong lĩnh vực phát triển dược phẩm và thực phẩm chức năng [13].
Hình 1.3. Công thức cấu tạo của trans-resveratrol
Hình 1.4. Công thức cấu tạo của resveratroloside lOMoARcPSD| 36782889
Hình 1.5. Công thức cấu tạo của isorhapontigenin-13-glucoside 1.1.4.2. Flavonoid
Flavonoid là một trong những phân nhóm polyphenol được nghiên cứu nhiều nhất
do hoạt tính sinh học đa dạng và sự phân bố rộng rãi. Có thể chia các hợp chất flavonoid
ra thành 7 nhóm chính dựa trên sự khác nhau về cách sắp xếp của các nhóm hydroxyl,
methoxy, glycosidic và sự liên hợp giữa các vòng A và B, các nhóm bao gồm flavone,
flavonol, flavanone, flavanol, isoflavonoid, chalcone và catechin [14]. Có thể thấy, các
đánh giá về cấu trúc flavonoid từ chiết xuất Dây gắm đến nay vẫn còn hạn chế. Tuy
nhiên, hai hợp chất flavonoid đáng chú ý đã được tìm thấy trong chiết xuất Dây gắm
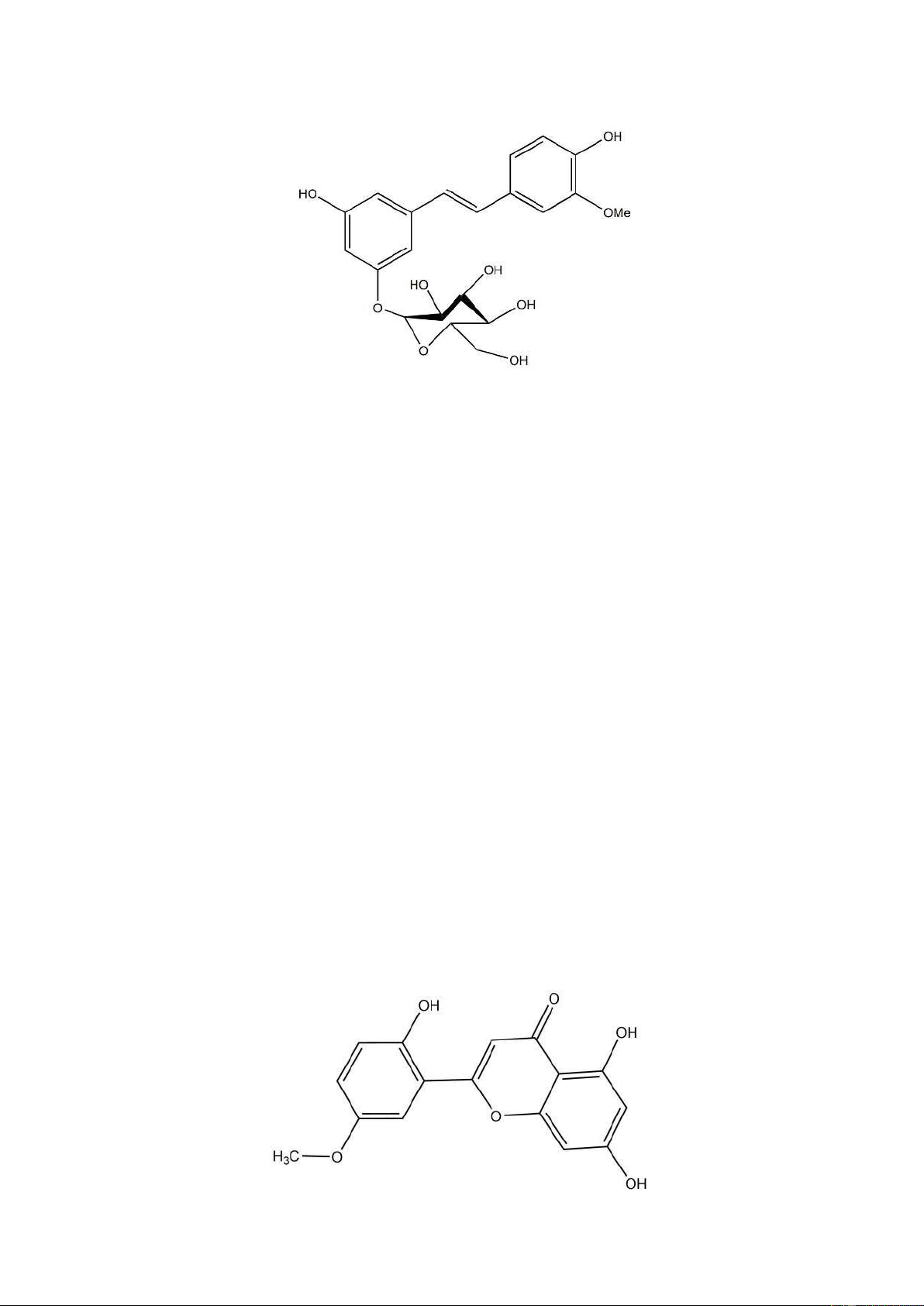
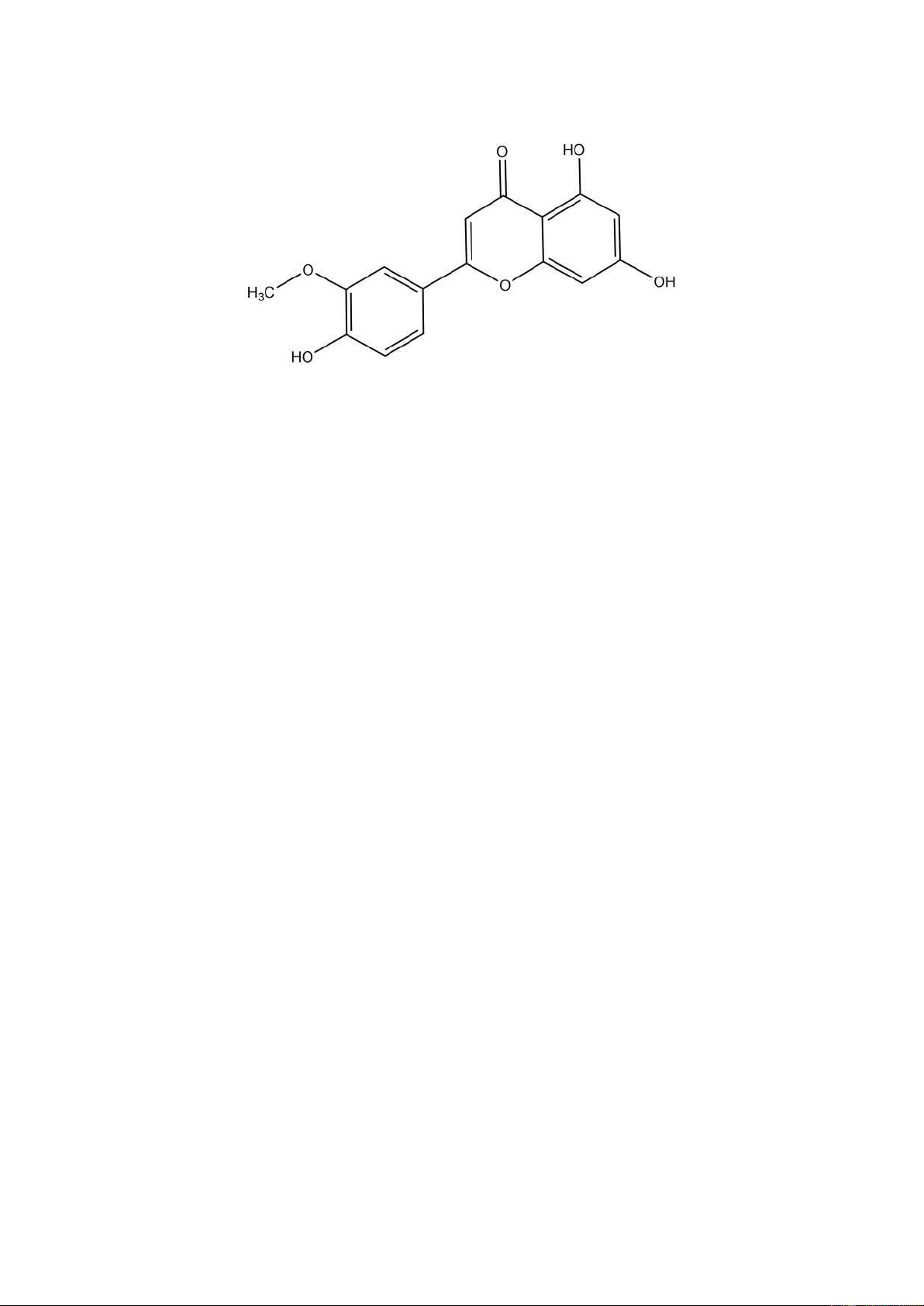
chùm to (Gnetum macrostachyum) là 5,7,2′-trihydroxy-5′methoxyflavone và 5,7,4′-
trihydroxy-3′- methoxyflavanone, đây là các hợp chất tự nhiên đã được sử dụng trong
các chế phẩm y học của Trung Quốc trong nhiều thế kỷ. Nó đã được chứng minh là có
kiểu nhiễu xạ tia X phù hợp với cấu trúc của kaempferide, một loại flavonoid được tìm
thấy trong thực vật. Hợp chất này đã được chứng minh là thuốc hạ huyết áp ở chuột
bằng cách giảm nồng độ axit α-linolenic và kiểm soát quá trình tổng hợp synthase kinase
3. Hợp chất này cũng thể hiện hoạt động chống oxy hóa bằng cách ức chế quá trình peroxid hóa lipid [15]. lOMoARcPSD| 36782889
Hình 1.6. Công thức cấu tạo của 5,7,2′-trihydroxy-5′-methoxyflavone
Hình 1.7. Công thức cấu tạo của 5,7,4′-trihydroxy-3′- methoxyflavanone
Ngày nay, dược liệu tự nhiên nhận được sự quan tâm rất lớn trong lĩnh vực chăm
sóc sức khỏe. Các thầy thuốc y học cổ truyền cũng như các công trình nghiên cứu khoa
học từ chuyên gia đã nghiên cứu và chứng minh tác dụng của dược liệu trong điều trị
bệnh. Ngoài ra, dược liệu còn chứa các thành phần giàu dinh dưỡng, giúp hồi phục sức
khỏe con người tốt hơn. Trong số những loại cây được nghiên cứu, Dây gắm là một
trong những dược liệu tiềm năng, đặc biệt trong việc điều trị các trường hợp bệnh Gout.
Các nghiên cứu khoa học đã tập trung vào thành phần hoạt chất trong Dây gắm, nhất là
một loại hợp chất gọi là stilbene, tuy nhiên các đánh giá về công dụng của flavonoid từ
chiết xuất Dây gắm đến nay vẫn còn hạn chế. Sự quan tâm này không chỉ giúp mở rộng
kiến thức về Dây gắm mà còn hứa hẹn mở ra những cơ hội mới trong lĩnh vực y học tự
nhiên và chăm sóc sức khỏe bằng cách tích hợp những giá trị của thiên nhiên vào quy trình điều trị.
1.1.5. Công dụng
Với những đặc tính độc đáo và có lợi cho sức khỏe, Dây gắm được sử dụng trong
điều trị nhiều bệnh lý, đặc biệt là những vấn đề liên quan đến xương khớp. Dây gắm
không chỉ hỗ trợ giảm đau và viêm khớp, mà còn giúp ổn định acid uric trong máu,
giảm triệu chứng của bệnh Gout [16].
Rễ của cây không chỉ được ứng dụng trong điều trị chứng kinh nguyệt không đều,
mà còn có khả năng xử lý độc tố từ rắn cắn hay thức ăn nhiễm độc [6]. Ngoài ra, cành
Dây gắm được coi là có khả năng giảm đau [17]. Dây gắm còn được sử dụng trong lĩnh
vực y học truyền thống để chế biến thuốc trị sốt rét và sốt. Không những thế, nó có khả lOMoARcPSD| 36782889
năng ức chế chứng viêm dây thần kinh thông qua thành phần resveratrol, và có tác dụng
chống lại vi khuẩn Pseudomonas Aeruginosa [18], hay còn được biết đến với tên gọi là trực khuẩn mủ xanh.
Theo quan điểm Đông y, Dây gắm không chỉ là một loại cây thuốc mà còn là một
dược liệu vô cùng hiệu quả. Nó được coi là giải pháp tự nhiên cho nhiều vấn đề sức
khỏe như khu phong, trừ thấp, thư cân hoạt huyết, giải độc, tiêu viêm và sát trùng. Sự
kết hợp của những đặc tính này giúp giảm triệu chứng sưng nhức, nóng ran ở các khớp,
và giảm đau nhức tại xương khớp. Với tất cả những ưu điểm này, Dây gắm đóng vai
trò quan trọng trong việc hỗ trợ sức khỏe tự nhiên của chúng ta.
Một số bài thuốc chữa bệnh từ Dây gắm:
• Điều trị sản hậu gầy mòn: Bài thuốc sử dụng một tổ hợp từ rễ gắm, đương quy,
bạch truật, bạch thược, mộc hương, và cam thảo. Sắc chung một lượng vừa đủ
của các hỗn hợp trên với nước đến khi cạn còn thể tích xác định. Dịch chiết này
chia thành 2 lần uống trong ngày [19].
• Trị vàng da, ăn kém, chóng mặt sau sinh: Sắc nước từ rễ gắm, ích mẫu, hương
phụ, ngải cứu, nhân trần, và nghệ đen. Dịch chiết được sử dụng hai lần mỗi ngày
trong 10 ngày liên tiếp [20].
1.1.6. Sản phẩm Dây gắm trên thị trường hiện nay
Dây gắm đã được ứng dụng rộng rãi trong lĩnh vực y học cổ truyền và đang ngày
càng thu hút sự chú ý trong việc chăm sóc sức khỏe hiện đại. Công dụng đa nhiệm của
Dây gắm đã tạo nên sự quan tâm đặc biệt, đặc biệt là trong việc hỗ trợ điều trị và giảm
đau cho những người mắc các vấn đề như Gout, thấp khớp, và sản hậu mòn. Ngoài khả
năng giảm acid uric, một yếu tố quan trọng gắn liền với các triệu chứng Gout, nó còn
giúp giảm đau và sưng ở cả hai nhóm bệnh nhân Gout mạn và Gout cấp, mang lại cảm
giác nhẹ nhàng và thoải mái.
Với sự đón nhận tích cực từ giới khoa học, nhiều sản phẩm Dây gắm trên thị
trường đã được phát triển, bao gồm cao gắm, gắm khô, và cao gắm dạng viên nén. Các
sản phẩm này không chỉ mang lại thuận lợi và linh hoạt trong sử dụng mà còn đảm bảo lOMoARcPSD| 36782889
sự chính xác và hiệu quả trong việc hỗ trợ sức khỏe tự nhiên và phòng ngừa các vấn đề bệnh lý.
1.1.6.1. Dây gắm khô
Dây gắm đã phơi khô là một sản phẩm được chế biến từ Dây gắm sau khi được
thu hoạch và qua quá trình rửa sạch, phơi khô. Với màu sắc tự nhiên nâu vàng, sản phẩm
mang đến hương thơm nhẹ và vị đắng chát đặc trưng.
Cách sử dụng đơn giản bằng cách ngâm Dây gắm khô trong nước ấm khoảng 30
phút, sau đó hãm như trà. Để tối ưu hóa hiệu quả, người sử dụng có thể kết hợp Dây
gắm khô với các loại thảo dược khác như lá chè xanh, hoa cúc, cam thảo, tận dụng tốt
những đặc tính dưỡng chất của mỗi thành phần.
Với ưu điểm về giá thành hợp lý và sự phong phú về hoạt chất có lợi cho sức khỏe
như flavonoid, saponin, tanin, dây gắm đã phơi khô là sự lựa chọn phổ biến. Tuy nhiên,
cần lưu ý đến thời gian hãm lâu và khó bảo quản, điều này có thể ảnh hưởng đến chất lượng của sản phẩm.
Hình 1.8. Sản phẩm thương mại dạng khô 1.1.6.2. Cao gắm
Cao gắm là một sản phẩm chất lượng được chế biến từ dây gắm tươi hoặc khô qua
phương pháp chiết xuất. Với màu nâu sậm, mùi thơm nhẹ và vị đắng đặc trưng, cao
chiết dây gắm cung cấp hàm lượng hoạt chất cao hơn so với dạy gắm khô, là một lựa
chọn hiệu quả để bổ sung dưỡng chất và duy trì sức khỏe. lOMoARcPSD| 36782889
Cao chiết Dây gắm được sử dụng rộng rãi thông qua các hình thức đường uống và
đường bôi. Khi uống, việc pha 2-3 thìa cao chiết dây gắm với nước ấm và uống 2-3
lần/ngày có thể đem lại hiệu quả tốt. Ngoài ra, việc kết hợp với các loại thảo dược khác
cũng là một cách để tăng cường tác dụng của sản phẩm. Ngoài ra, khi vùng da bị đau
nhức cũng có thể sử dụng cao chiết pha loãng với nước ấm để bôi lên da.
Sản phẩm cao chiết của HTX Nông
Sản phẩm cao chiết của công ty TNHH Dược Yên Bái
SX & TM Dược Liệu Hòa Bình
Hình 1.9. Sản phẩm thương mại dạng cao
1.1.6.3. Viên cao gắm
Để tối ưu hóa sự tiện lợi và tích hợp dễ dàng vào lối sống hàng ngày, cao gắm
được bào chế thành dạng viên nén. Việc này không chỉ giúp người dùng đo lường liều
lượng chính xác mà còn đảm bảo sự thuận tiện trong việc tích hợp vào chế độ dinh
dưỡng. Đồng thời, dạng viên nén giúp duy trì chất lượng và hiệu quả của cao gắm, mang
lại trải nghiệm sử dụng tối ưu cho người tiêu dùng.
Sản phẩm viên cao gắm Sản phẩm viên cao gắm Sản phẩm viên cao gắm của Công
ty CP Siêu Thị của Công ty TNHH của Công ty TNHH Sống Khoẻ thương mại Y Phúc thương mại IAC lOMoARcPSD| 36782889
Hình 1.10. Sản phẩm thương mại dạng viên
Nhờ vào tính đa dạng và hiệu quả của Dây gắm, các sản phẩm này không chỉ là
không chỉ mang lại thuận lợi và linh hoạt trong sử dụng mà còn đảm bảo sự chính xác
và hiệu quả trong việc hỗ trợ sức khỏe tự nhiên và phòng ngừa các vấn đề bệnh lý.
1.2. Công trình nghiên cứu trong và ngoài nước
Được biết đến là một loại thảo mộc truyền thống, Dây gắm đã đặc biệt được đánh
giá cao trong lĩnh vực y học cổ truyền và đang thu hút sự quan tâm của cộng đồng y học
hiện đại. Nghiên cứu khoa học về dây gắm, bao gồm hoạt tính sinh học, stilbene trong
dây gắm, và điều kiện chiết tách, đã làm phong phú thêm kiến thức về tính chất và ứng
dụng của loại thảo mộc này.
1.2.1. Các nghiên cứu về Stilbene
Stilbene đóng vai trò quan trọng trong lĩnh vực phát triển dược phẩm và thực phẩm
chức năng, vậy nên đã có nhiều thí nghiệm tập trung nghiên cứu về các hợp chất này,
các nghiên cứu này cho thấy stilbene trong tự nhiên thường xuất hiện ở dạng dẫn xuất.
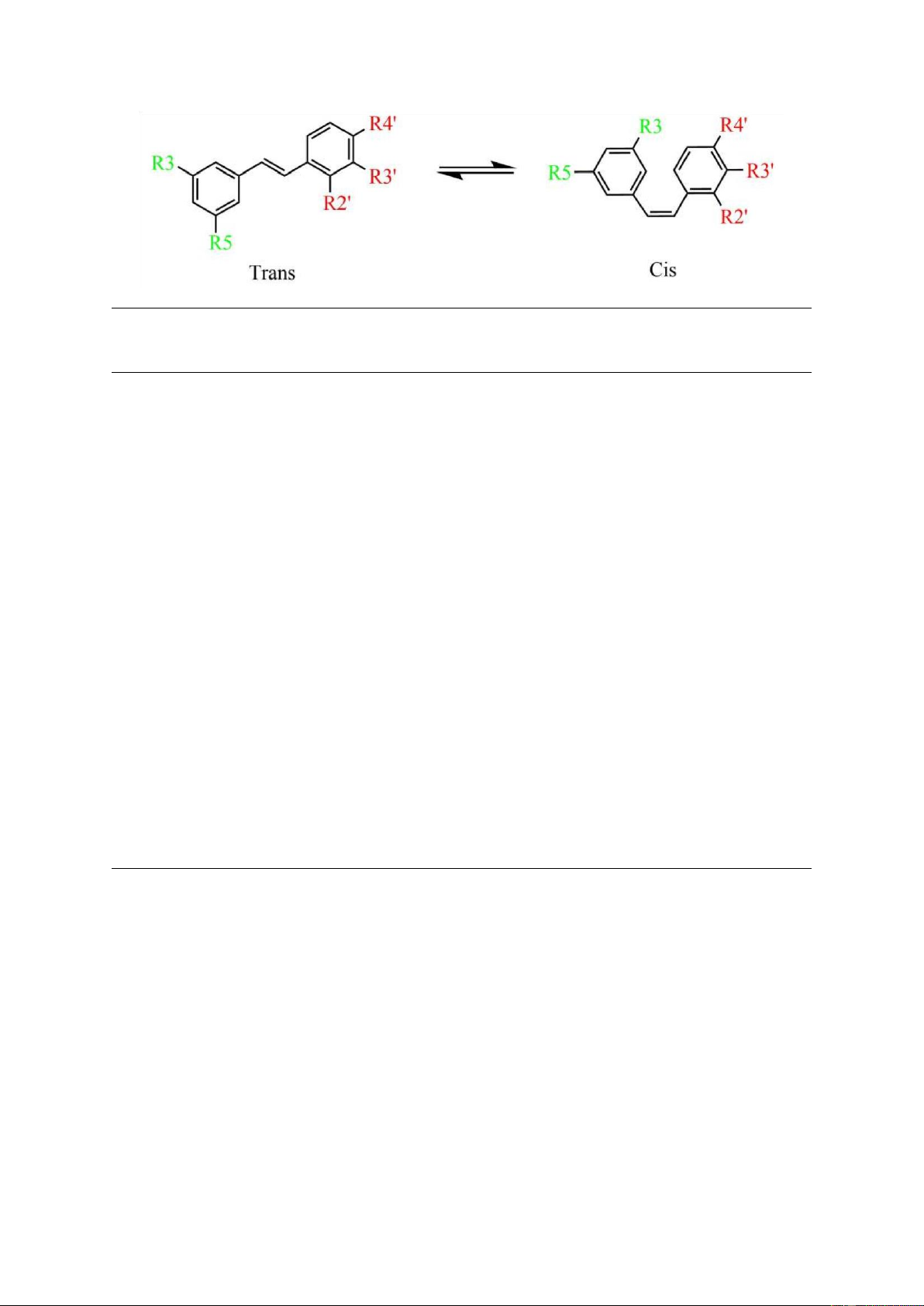
Tính đến nay, đã có hơn 400 hợp chất stilbene khác nhau đã được phát hiện và hầu hết
đều có nguồn gốc từ trans-resveratrol (3,5,4'- trihydroxy-trans-stilbene) (Hình 1.11).
Stilbenes đã được tìm thấy trong ít nhất 72 loài thực vật thuộc 31 chi và có 12 họ hàng
xa, bao gồm Pinaceae, Gnetaceae, Vitaceae, Moraceae [21]... Tuy nhiên, sự hiểu biết
về phân bố stilbene trong tự nhiên vẫn còn hạn chế do một phần liên quan đến sự phức
tạp của phân tích định lượng - định tính của stilbene, dẫn đến việc không có sẵn các tiêu
chuẩn và giới hạn phát hiện của các phương pháp phân tích. Hầu hết các nghiên cứu
được thực hiện cho đến nay đều tập trung vào các stilbene đơn giản, như là resveratrol,
piceid, pterostilbene và piceatannol (Hình 1.11) . lOMoARcPSD| 36782889 R 3 R 5 R 2 ’ R 3 ’ R 4 ’ Stilbene OH OH H H OH Resveratrol OCH3 OCH3 H H OH Pterostilbene OH OH OH H OH Oxyresveratrol OH OH H OH OH Piceatannol OH OH H H H Pinosylvin OH OCH3 H H H Pinosylvin monomethyl ether OCH3 OCH3 H H H Pinosylvin monomethyl ether OH OH H OCH3 OH Isorhapontigenin OGlu OH H OCH3 OH Isorhapontin OGlu OH H OH OH Astringin OGlu OH H H OH Piceid (polyadatin) OGlu OH OH H OGlu Mulberroside A
*(OGlu) là O-β-D-glucopyranoside
Hình 1.11. Cấu trúc hóa học của các dẫn xuất monome stilbene thông thường
Một số công trình nghiên cứu ngoài nước gần đây nghiên cứu các hợp chất stilbene
mới. Mao lin và cộng sự [22] đã xác định được bốn hợp chất mới thuộc nhóm stilbene
gọi là Gnetumontanin (A – D) và phân lập 16 hợp chất đã biết bằng kỹ thuật phổ NMR
2D, ngoài ra Gnetumontanin B cho thấy khả năng ức chế mạnh mẽ đối với TNF-α Tương
tự, Jun Zhou và các cộng sự đã phân lập ba hợp chất Gnetumelin (A-C) với 9 dẫn xuất
khác trong Dây gắm [23]. Vào năm 2017 cũng xuất hiện bài nghiên cứu về các hợp chất lOMoARcPSD| 36782889
gnetumonins A−C và (−)-gnetucleistol F thuộc nhóm stilbenophenylpropanoids trong
Dây gắm bởi Chang-Heng Tan và cộng sự [24].
Stilbene trong Dây gắm cũng nhận được sự quan tâm của giới nghiên cứu tại Việt
Nam. Vũ Thị Lan Phương và cộng sự đã sử dụng dùng phân đoạn chiết cao ethyl acetate
của thân Dây gắm để phân lập và xác định cấu trúc của ba hợp chất nhóm stilbene:
trans-resveratrol, resveratroloside và isorhapontigenin-13-glucoside [25]. Nhóm nghiên
cứu của Lê Thị Hồng Nhung, sử dụng các phân đoạn của cao chiết từ thân và lá của
Gnetum latifolium để phân lập và xác định cấu trúc của ba hợp chất stilbene, cụ thể là
Genetifolin E, (±)-bisisorhapotingenin A và Gnetifolin K [26]. Ngoài ra, hai hợp chất
isorhapontin và gnetifolin E được nhóm nghiên cứu của Nguyễn Bá Anh phân lập từ
Gnetum latifolium bằng phương pháp sắc ký cột và sắc ký lớp mỏng và cấu trúc được
xác định dựa trên dữ liệu phổ cộng hưởng từ hạt nhân một chiều và hai chiều [27].
Sự đa dạng của Dây gắm không chỉ giới hạn ở stilbene mà còn bao gồm nhiều hợp
chất khác như flavonoid, alkaloid, và các dạng chất chống oxy hóa khác. Tất cả những
thành phần này đang là đối tượng nghiên cứu chính để hiểu rõ hơn về tiềm năng và ứng
dụng trong lĩnh vực y học.
1.2.2. Các nghiên cứu về hoạt tính sinh hoc
Hoạt tính kháng oxy hóa: Kết quả nghiên cứu về hoạt tính kháng oxy hóa dựa trên
cơ chế bắt gốc tự do DPPH của nhóm Lê Văn Minh đã chỉ ra rằng các cao chiết từ Dây
gắm thể hiện khả năng chống oxy hóa tốt. Trong đó, cao nước đạt được hoạt tính mạnh
nhất, với giá trị IC50 là 16,68 µg/ml [7].
Hoạt tính kháng khuẩn: Một bài nghiên cứu khác sử dụng cao chiết (ethanol, ethyl
acetate và hexane) từ hạt và vỏ của Dây gắm để nghiên cứu hoạt tính kháng khuẩn. Kết
quả cho thấy, các cao chiết không thể ức chế sự phát triển của IPBCC 88.030, nhưng có
hiệu quả ức chế với ATCC 10876, ATCC 25953 và ATCC 13048 [28]. Nghiên cứu của
nhóm Lê Văn Minh đã chỉ ra rằng cao chiết n-butanol và cao nước thể hiện hoạt tính ức
chế đối với hai chủng vi khuẩn Pseudomonas aeruginosa và Escherichia coli. Trong
khi đó, cao n-hexan và cao toàn phần thể hiện khả năng ức chế chủng vi khuẩn
Staphylococus aureus, Pseudomonas aeruginosa và Escherichia coli. Đặc biệt, cao lOMoARcPSD| 36782889
ethyl acetat thể hiện hiệu suất ức chế tốt nhất khi đối mặt với cả bốn loại vi khuẩn
(Salmonella typhimurium và ba vi khuẩn trên) [7].
Hoạt tính chống tiểu đường: Kết quả nghiên cứu của nhóm Lê Văn Minh cho thấy
cao chiết từ Dây gắm có khả năng ức chế hoạt động của enzym α-amylase và
αglucosidase tốt hơn so với acarbose (một loại thuốc thường được sử dụng trong điều
trị tiểu đường). Trong đó, cao ethyl acetat thể hiện hoạt tính ức chế α-amylase tốt nhất,
với mức ức chế cao gấp 27 lần so với chứng. Cao toàn phần và cao nước cũng xuất sắc
trong việc ức chế α-glucosidase, với mức ức chế cao gấp 6 lần so với đối chứng [7].
Ngoài ra, vào năm 2021, một nghiên cứu tập trung vào đánh giá hoạt tính chống tiểu
đường của các phân đoạn và một flavonoid (-)-epicatechin từ cây Gnetum africanum
trên mô hình chuột bạch tiểu đường. Flavonoid này đã cho thấy khả năng giảm đáng kể
đường huyết ở chuột tiểu đường. So với glibenclamide, (-)-epicatechin có hiệu suất
giảm đường huyết cao hơn. Điều này làm sáng tỏ về tiềm năng của Gnetum africanum
trong hỗ trợ điều trị tiểu đường và làm mới kiến thức về thành phần chống tiểu đường của cây này [29].
Hoạt tính kháng viêm: Một nghiên cứu hoạt tính kháng viêm của cao chiết dây
Gắm đã sử dụng hai mô hình gây phù chân ở chuột (Carragenin và FCA). Cả ba mức
liều thử nghiệm (150mg/kg, 250mg/kg và 500mg/kg) đều cho thấy hiệu quả trong khả
năng giảm viêm cấp và viêm mạn [30].
1.2.3. Các nghiên cứu về trích ly
Vào năm 2019, Nguyễn Thị Hồng Lĩnh và công sự thực hiện một nghiên cứu về
sử dụng enzyme để nâng cao hiệu suất trích ly resveratrol từ Dây gắm. Theo đó, nhóm
nghiên cứu lựa chọn enzyme thích hợp, điều kiện thích hợp để trích ly resveratrol khi
có sử dụng enzyme (nồng độ enzyme, tỷ lệ nguyên liệu/dung môi, nhiệt độ, thời gian,
pH và tốc độ khuấy. Kết quả cho thấy, khi sử dụng enzyme cellulast ở nồng độ 0,2%
(w/w), nhiệt độ 50°C, thời gian 60 phút, trong môi trường pH 5,5, tỷ lệ nguyên liệu/dung
môi là 1/5 và tốc độ khuấy 150 vòng/phút thì hiệu suất trích ly resveratrol đã tăng từ 56,56% lên 84,43% [31]. lOMoARcPSD| 36782889
1.3. Tính cấp thiết của đề tài
Dựa trên quá trình nghiên cứu và tìm hiểu kỹ lưỡng, nhóm nhận thấy được các
công dụng từ các hợp chất đi từ nguồn nguyên liệu là Dây gắm, vì đây là một nguồn
nguyên liệu tự nhiên nên Dây gắm sẽ an toàn, hiệu quả cao và ít gây tác dụng phụ. Để
phát huy tối đa những lợi ích này, nhóm chú trọng nghiên cứu vào tách chiết các hợp
chất từ Dây gắm và đánh giá hoạt tính của chúng. Mục tiêu là xác định phương pháp
bào chế tối ưu, nhằm nâng cao hiệu quả sử dụng của loại dược liệu này. Chính vì vậy
trong nghiên cứu này, nhóm tiến hành Nghiên cứu tách chiết và đánh giá hoạt tính sinh
học của cao chiết từ Dây gắm (Gnetum montanum Markgr.) giúp khẳng định hơn tiềm
năng của loài cây này, làm phong phú cho nguồn dược liệu trong nước và cung cấp số
liệu cho nghiên cứu tiếp theo.
CHƯƠNG 2: THỰC NGHIỆM
2.1. Mục tiêu nghiên cứu
Mục tiêu chính của đồ án chuyên ngành này khai thác và vận dụng các hợp chất
quý từ cao gắm, đặc biệt là polyphenol và flavonoid. Đồ án này tập trung vào việc khảo
sát điều kiện trích ly để đạt được lượng cao chiết, polyphenol và flavonoid nhiều nhất .
Ngoài ra, đánh giá hoạt tính sinh học của Dây gắm cũng là một phần quan trọng của đồ
án này. Những kết quả thu được hy vọng sẽ góp phần vào việc nâng cao giá trị ứng dụng
của nguồn dược liệu này và đề xuất hướng sử dụng Dây gắm trong các sản phẩm có tính ứng dụng cao.
2.2. Nội dung nghiên cứu
Nội dung 1: Thu hái, xử lý và đánh giá dược liệu
Nội dung 2: Xây dựng quy trình trích ly cao chiết từ Dây gắm
Nội dung 3: Khảo sát các thành phần hóa học của cao chiết
Nội dung 4: Khảo sát hoạt tính sinh học của cao chiết lOMoARcPSD| 36782889
2.3. Hóa chất và thiết bị sử dụng
2.3.1. Dụng cụ và thiết bị sử dụng
Tất cả các thiết bị và dụng cụ thí nghiệm được cung cấp trong các phòng thí
nghiệm Hóa học Hữu cơ 209B2, 401B2 và 402B2, Trường Đại học Bách Khoa - Đại
học Quốc gia thành phố Hồ Chí Minh (HCMUT - VNU), các dụng cụ thiết bị được sử
dụng sẽ được liệt kê ở Bảng 2.1
Bảng 2.1. Dụng cụ và thiết bị thí nghiệm
Dụng cụ thí nghiệm
Thiết bị thí nghiệm Bình cầu
Cân phân tích SATORIUS QUINTIX125D-1S Bình định mức
Máy đo độ hấp thu Genesys 10S UV – Vis Bình chiết soxhlet
Máy đo độ ẩm SATORIUS MB45 Bình và phễu Büchner
Máy cô quay chân không RE 301A – W Micropipette
Bể siêu âm Elmasonic S100H Bếp đun bình cầu
Hệ thống lọc chân không Ống đong Tủ sấy Erlen Becher Sinh hàn ống bầu Vial 10mL
2.3.2. Hóa chất
Bảng 2.2. Danh sách hóa chất được sử dụng Hóa chất Công thức Nhà sản xuất Xuất xứ Methanol CH3OH Xilong Trung quốc Ethanol C2H5OH Chemsol Việt Nam Hydrochloric acid HCl Xilong Trung quốc lOMoARcPSD| 36782889 Hóa Sulfuric acid H2SO4 Xilong Trung quốc chất Magnesium Mg Xilong Trung quốc Sodium carbonate Na2CO3 Xilong Trung quốc Potassium iodide KI Xilong Trung quốc Bismuth nitrate Bi(NO3)3.5H2O Xilong Trung quốc Folin – Ciocalteu Merck Germany phenol Gallic acid C7H6O5 Xilong Trung quốc Guangdong Sodium hydroxide NaOH Trung quốc Guanghua Quercetin C15H10O7 Merck Đức
được sử dụng sẽ được liệt kê trong Bảng 2.2. lOMoARcPSD| 36782889 L (+) Ascorbic acid C6H8O6 Xilong Trung quốc Nitric acid HNO3 Xilong Trung quốc 2,2-diphenyl-1- DPPH Sigma Aldrich Hoa Kỳ picrylhydrazyl
2.4. Nội dung thực hiện
2.4.1. Xử lý nguyên liệu
Thân Dây gắm được thu hoạch trong rừng Thanh Hóa, Việt Nam. Thân được chặt
nhỏ ra từng khúc và được phơi khô tránh sáng cho đến khi đạt độ ẩm yêu cầu theo Dược
điển Việt Nam IV [32], sau đó mẫu được bảo quản ở một nơi khô ráo, mát mẻ, tránh
tiếp xúc trực tiếp ánh sáng mặt trời. Mẫu được bảo quản bằng túi zip cùng với bịch hút
ẩm silicagel để tránh hiện tượng hấp thụ lại độ ẩm.
Nguyên liệu sau khi sấy được mang đi xay thành bột. Trước khi đưa vào sử dụng
để chiết, bột dược liệu được đo độ ẩm theo phương pháp ở Mục 2.5.1 để kiểm tra, sau
đó bột dược liệu được lưu trữ trong các hủ đựng đã có sẳn túi hút ẩm, được bảo quản ở
nơi khô ráo, thoáng mát, không có ánh nắng trực tiếp tiếp xúc để tiến hành các bước tiếp theo.
2.4.2. Chuẩn bị cao chiết
Để chuẩn bị cao chiết, nhóm đã phát triển hai quy trình để tách chiết các hợp chất
từ Dây gắm: chiết ngâm dầm (không có sự hỗ trợ nhiệt độ) và chiết soxhlet (có sự hỗ trợ của nhiệt độ).
Trong quy trình chiết ngâm dầm, bột Dây gắm được ngâm trong dung môi cồn
theo tỉ lệ 1:10 (w/w). Quá trình chiết được thực hiện hai lần cho mỗi mẫu và thời gian
chiết mỗi lần kéo dài 24 giờ. Dung dịch chiết sau đó được cô quay dưới áp suất chân
không để tạo ra cao chiết. Mẫu cao chiết sau đó sẽ được lưu trữ trong tủ đông để bảo quản. lOMoARcPSD| 36782889
Hình 2.1. Sơ đồ quy trình chiết ngâm dầm Dây gắm
Tương tự, bột Dây gắm đã được chiết bằng Soxhlet theo tỉ lệ 1:10 (w/w). Quá trình
chiết mỗi lần kéo dài 12 giờ và dung dịch chiết được cô quay dưới áp suất chân không
để thu được cao chiết. Mẫu cao chiết sau đó được lưu trữ cũng trong tủ đông để bảo quản.
Hình 2.2. Sơ đồ quy trình chiết soxhlet Dây gắm
Hiệu suất cao chiết được tính theo công thức: lOMoARcPSD| 36782889 mcaokhô H(%)= ×100
mnguyênliệukhô Với
mcaokhô : Khối lượng cao khô sau quá trình chiết (g)
mnguyênliệukhô: Khối lượng nguyên liệu khô đem đi chiết (g)
2.4.3. Khảo sát các yếu tố ảnh hưởng đến quá trình chiết
Tách chiết là quá trình hòa tan chọn lọc một hay nhiều cấu tử có trong mẫu nguyên
liệu, một hợp chất sẽ hòa tan vào một dung môi khi cấu trúc hóa học của nó tương tự
với dung môi đó. Động lực của quá trình tách chiết là sự chênh lệch nồng độ của cấu tử
ở trong nguyên liệu và dung môi, nếu dùng ít dung môi có thể không chiết hết hợp chất
cần trích, nếu dùng nhiều dung môi có thể làm tăng tạp chất trong dịch trích. Do vậy,
xác định tỷ lệ nguyên liệu và dung môi phù hợp là rất quan trọng và cần thiết [33].
Dựa vào các nghiên cứu, dung dịch cồn là dung môi phổ biến trong việc hoà tan các
nhóm hoạt chất có trong Dây gắm [9]. Vì dậy chúng tôi thực hiện tách chiết Dây gắm
với các yếu tố như sau:
- Đối với quy trình chiết ngâm dầm, yếu tố cố định gồm: tỉ lệ nguyên liệu/dung môi
là 1:10, số lần chiết là 2 lần, thời gian mỗi lần chiết kéo dài 24 giờ. Yếu tố thay
đổi là nồng độ dung môi theo tỉ lệ: 70%, 80%, 90%, 96%.
- Đối với quy trình chiết Soxhlet, yếu tố cố định gồm: tỉ lệ nguyên liệu/dung môi
là 1:10, nhiệt độ 40oC, thời gian chiết kéo dài 24 giờ. Yếu tố thay đổi là nồng
độ dung môi theo tỉ lệ: 70%, 80%, 90%, 96%.
Dựa vào kết quả khảo sát hiệu suất chiết, hàm lượng flavonoid và polyphenol toàn
phần trong dịch chiết được định lượng bằng các phương pháp ở Mục 2.5.3 và Mục 2.5.4
để lựa chọn nồng độ dung môi chiết phù hợp cho các khảo sát tiếp theo. lOMoARcPSD| 36782889
2.4.4. Khảo sát hoạt tính sinh học của cao chiết
Sau khi tách chiết Dây gắm ở nồng độ dung môi phù hợp nhất, cao chiết sẽ được
đưa đi khảo sát các hoạt tính sinh học theo phương pháp ở Mục 2.5.5.
2.5. Phương pháp đánh giá
2.5.1. Đo độ ẩm
Độ ẩm của nguyên liệu được xác định bằng máy đo độ ẩm hiệu SATORIUS
MB45. Mẫu bột vật liệu và cao thô được trải đều lên đĩa nhôm với lượng nhất định (trên
0.100g). Máy tăng nhiệt độ lên 105°C cho đến khi khối lượng trên đĩa nhôm ổn định.
Kết thúc quá trình đo, màn hình hiển thị số đo độ ẩm. Độ ẩm của vật liệu và cao chiết
thô được tính theo công thức: W %= m0−mi ×100 m
0 Với m0: Khối lượng vật liệu ban đầu (g)
mi: Khối lượng vật liệu sau khi loại ẩm (g)
Các phép đo được lặp lại ba lần, và độ ẩm cuối cùng được xác định bằng cách lấy
giá trị trung bình của ba lần đo. Độ ẩm của nguyên liệu có thể thay đổi trong quá trình
bảo quản, nên mẫu vật được chia thành từng phần và trữ trong tủ kín, có hút ẩm.
2.5.2. Sơ bộ hóa thực vật
2.5.2.1. Kiểm tra polyphenol
2mL dịch chiết được khuấy với 2mL nước cất, sau đó thêm vài giọt dung dịch
FeCl . Màu sắc của hỗn hợp phản ánh số lượng và vị trí của nhóm OH trong phân tử, 3
thể hiện dưới dạng gam màu từ lục đến xanh, và có thể chuyển sang màu nâu đỏ tùy
thuộc vào sự có mặt của các nhóm OH [34]. lOMoARcPSD| 36782889
2.5.2.2. Kiểm tra flavonoid
Thêm một ít bột Mg vào dịch chiết rồi nhỏ từ từ HCl đậm đặc. Để yên từ 1 - 2
phút, nếu dung dịch có màu đỏ cam, đỏ thẫm hoặc đỏ tươi thì dung dịch có flavonoid [34].
2.5.2.3. Kiểm tra alkaloid
Dịch chiết được thử với hai loại thuốc thử: Dragendorff và Bouchardat. Nếu dương
tính với alkaloid, dịch chiết thử phản ứng Dragendorff tạo ra kết tủa màu cam, dịch chiết
thử phản ứng Bouchardat tạo ra kết tủa màu nâu [34].
2.5.3. Định lượng polyphenol tổng bằng phương pháp Folin – Ciocalteau
Phương pháp định lượng polyphenol tổng được tham khảo dựa Folin – Ciocalteau của Singleton (1999) [35]. 2.5.3.1. Nguyên tắc
Thuốc thử Folin-Ciocalteu bao gồm một hỗn hợp axit heteropoly, axit
phosphomolybdic và phosphotungstic, trong đó molybdenum và tungsten ở trạng thái
6+. Hỗn hợp này bị oxy hóa bởi các hợp chất polyphenol trong mẫu trong môi trường
kiềm, tạo thành sản phẩm có màu xanh lam (molybdenum), với hấp thụ tối đa ở bước sóng 760nm.
2.5.3.2. Phương pháp tiến hành a) Chuẩn bị
Dung dịch Na2CO3 20%. Dung dịch gallic acid 1mg/mL: hòa tan 10mg gallic acid
trong 1mL DMSO, sau đó định mức lên 10mL bằng nước cất. Từ dung dịch trên pha ra
các dung dịch có nồng độ sau bằng nước cất: 0; 100; 200; 400; 500; 600; 700; 800; 900 và 1000 (μg/mL). b) Lập đường chuẩn
Cho thuốc thử Folin - Ciocalteau (200μL) vào dung dịch gallic acid (40μL) với
các nồng độ khác nhau, đồng nhất bằng bể lắc siêu âm trong 5 phút ở nhiệt độ phòng.
Sau đó, thêm dung dịch Na2CO3 20% (600μL) và nước cất (3160μL) vào hỗn hợp, và
tiếp tục đồng nhất bằng bể lắc siêu âm trong 30 phút cũng ở nhiệt độ phòng. Độ hấp thu lOMoARcPSD| 36782889
của các mẫu ở bước sóng λ = 760nm và lặp lại thủ tục này 3 lần cho mỗi nồng độ, sau
đó lấy giá trị trung bình. c) Đo mẫu
Hòa tan 0,01g cao chiết trong 1mL DMSO, sau đó điều chỉnh thành các nồng độ
phù hợp để đảm bảo độ hấp thụ nằm trong khoảng tuyến tính của đường chuẩn gallic
acid. Thực hiện đo mẫu tương tự như quá trình thiết lập đường chuẩn gallic acid. Lặp
lại thí nghiệm 3 lần với mỗi nồng độ và tính giá trị trung bình.
Quy trình lập đường chuẩn và đo mẫu được tóm tắt như Hình 2.3.
Hình 2.3. Quy trình định lượng polyphenol d) Tính toán
Hàm lượng polyphenol được xác định theo công thức: V TPE=GAE . m
Với TPE : Hàm lượng polyphenol tính trên một gam cao chiết (mg GAE/g cao)
V : Thể tích mẫu (mL) m : Khối lượng mẫu (g)
GAE: Hàm lượng ước lượng của polyphenol suy ra từ đường chuẩn gallic acid (mg/mL)
Từ đó, ta dựng đồ thị đường chuẩn dựa trên độ hấp thụ của dung dịch axit gallic
tại các nồng độ khác nhau: lOMoARcPSD| 36782889
Hình 2.4. Đường chuẩn Gallic acid tại bước sóng 760nm
2.5.4. Định lượng flavonoid tổng bằng phương pháp Aluminum Chloride – AlCl3
Phương pháp định lượng flavonoid tổng được tham khảo dựa vào bài nghiên cứu
của K. Pyrzynska và cộng sự [36] và kèm theo một số tinh chỉnh trong quá trình. 2.5.4.1. Nguyên tắc
Dựa trên quá trình tạo phức giữa nhóm flavonoid và muối AlCl3 trong dung môi
CH OH, phản ứng này tạo ra phức chất có màu vàng, sau dung dịch chuyển thành màu 3
hồng đỏ sau khi thêm vào dung dịch NaOH. Để đo lường hàm lượng flavonoid trong
mẫu phân tích, độ hấp thụ của phức chất được đo ở bước sóng 500nm. Phương pháp
này sử dụng chất chuẩn quercetin để xây dựng đường chuẩn và xác định hàm lượng flavonoid trong mẫu.
2.5.4.2. Phương pháp tiến hành a) Chuẩn bị
Dung dịch NaNO2 5%: pha 10g dung dịch NaNO2 với 0,5g NaNO2 và 9,5g H2O.
Dung dịch AlCl3 10%: pha 10g dung dịch AlCl3 với 1,809g AlCl3.6H2O và 8,191g
H O. Dung dịch NaOH 1M: hòa tan 4g NaOH bằng nước cất, định mức lên thể tích 2 100mL.
Dung dịch quercetin 1000µg/mL: hòa tan 0,01g quercetin trong 10mL methanol.
Từ dung dịch trên pha ra các dung dịch có nồng độ sau bằng methanol: 0; 100; 200;
300; 400; 500; 600; 700; 800; 900; 1000 (µg/mL). lOMoARcPSD| 36782889
b) Lập đường chuẩn
Hòa tan 0,01g quercetin trong 1mL methanol. Từ dung dịch này, tiến hành pha
loãng để thu được các dung dịch có nồng độ sau bằng methanol: 0, 100, 200, 300, 400,
500, 600, 700, 800, 900, 1000 (µg/mL). Độ hấp thu của các mẫu ở bước sóng λ = 500nm
và lặp lại thủ tục này 3 lần cho mỗi nồng độ, sau đó lấy giá trị trung bình. c) Đo mẫu
Lấy 0,5mL mẫu test (pha trong CH OH), thêm vào 2mL nước cất, sau đó thêm 3
vào 0.15mL NaNO2 5%. Đợi 5 phút, cho tiếp 0.15 mL AlCl3 10%. 1 phút sau, cho 1mL
NaOH 1M và 1,2mL nước cất. Đem hỗn hợp đo độ hấp thu ở bước sóng 500nm.
Thao tác được lặp lại 3 lần
Hình 2.5. Quy trình định lượng flavonoid bằng phương pháp AlCl3 d) Tính toán
Hàm lượng flavonoid được tính toán bằng công thức. V
QUEmẫu=QUEchuẩn× m Với QUEmẫu :
Hàm lượng flavonoid tổng tính trên một gam cao chiết (mgQUE/g cao) QUE
: Hàm lượng ước lượng của polyphenol suy ra từ đường chuẩn gallic acid chuẩn (mg/mL) lOMoARcPSD| 36782889 m : Khối lượng mẫu (g) V : Thể tích mẫu (mL)
Từ đó, ta dựng đồ thị đường chuẩn dựa trên độ hấp thụ của dung dịch axit gallic
tại các nồng độ khác nhau:
Hình 2.6. Đường chuẩn Quercetin tại bước sóng 500nm
2.5.5. Khảo sát hoạt tính chống oxy hóa theo cơ chế DPPH 2.5.5.1. Nguyên tắc
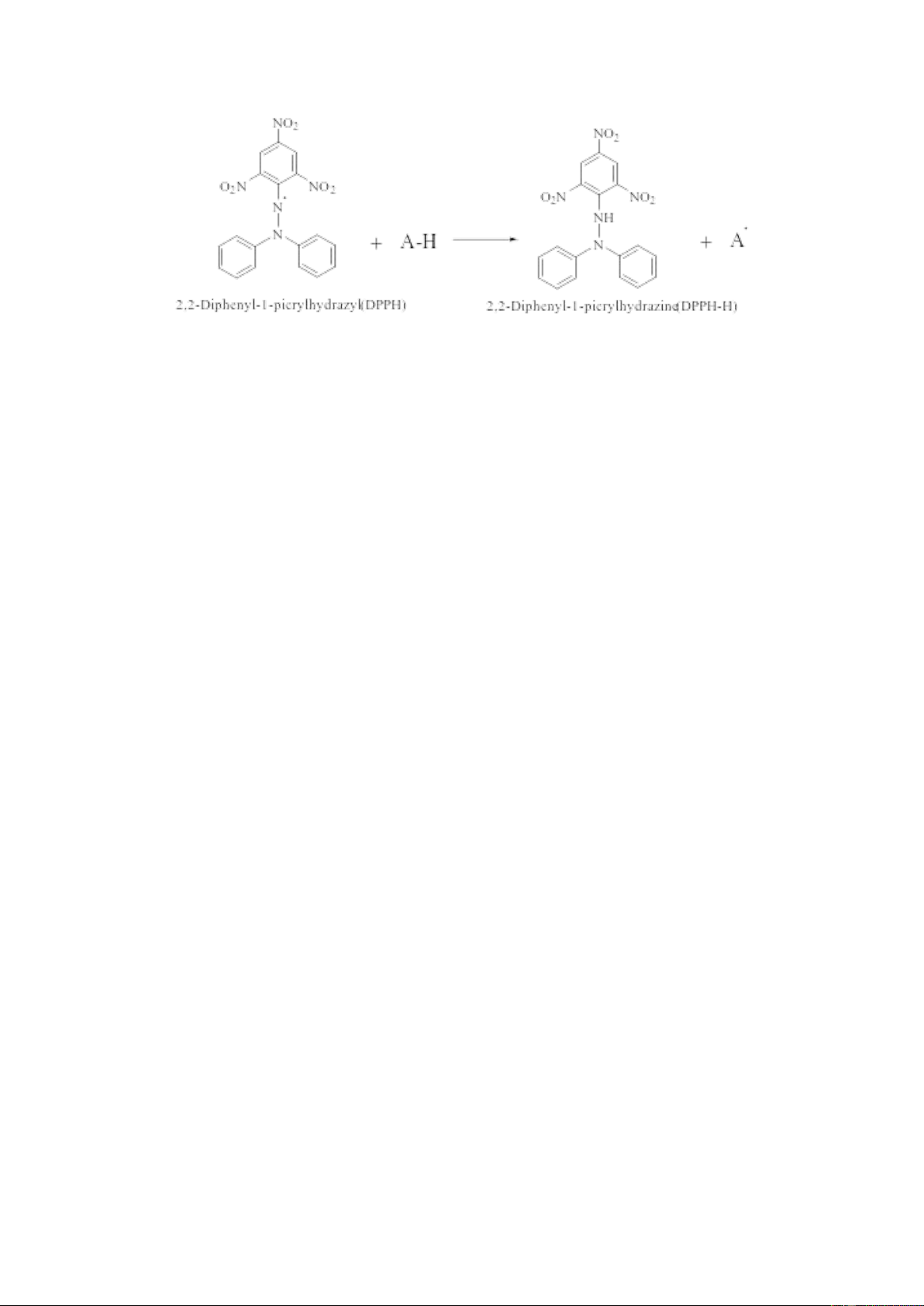
2,2-Diphenyl-1-picrylhydrazyl (DPPH) (Hình 2.6) là phân tử gốc tự do ổn định
nhờ các hiệu ứng liên hợp trên vòng benzene, đồng thời, cũng nhờ sự chuyển dịch
electron trong dãy liên hợp làm cho phân tử này có màu tím và có độ hấp thu cực đại
trong dung môi hữu cơ ở bước sóng 517nm [37]. Trong khảo sát hoạt tính chống oxy
hóa theo cơ chế DPPH, điện tích tự do trên nguyên tử nitrogen sẽ kết hợp với hydrogen
linh động của chất oxy hóa, hình thành cấu trúc DPPH-H dẫn đến sự chuyển màu từ tím
sang vàng của phân tử. Khả năng cho điện tử càng cao, hoạt tính chống oxy hóa của
chất oxy hóa càng mạnh, thì độ hấp thu quang ở bước sóng 517nm của hỗn hợp sau
phản ứng DPPH có giá trị càng giảm và ngược lại. Từ giá trị độ hấp thu sau phản ứng
của mẫu cao và mẫu trắng, có thể xác định được lượng gốc tự do DPPH đã bị trung hòa.
So sánh với kết quả thu được từ chất đối chiếu, từ đó đánh giá được hoạt tính chống oxy hóa của mẫu cao. lOMoARcPSD| 36782889
Hình 2.7. Phản ứng bắt gốc tự do theo cơ chế DPPH
2.5.5.2. Phương pháp tiến hành. a) Chuẩn bị:
Hòa tan cao trong MeOH 80% và pha thành nhiều nồng độ khác nhau bằng MeOH
80%. Tiến hành thí nghiệm ở các nồng độ trên nhằm rà soát sơ bộ khả năng kháng oxy
hóa và tìm khoảng nồng độ chứa giá trị IC50.
Hòa tan một lượng DPPH trong MeOH 80% sao cho độ hấp thu tại bước sóng
517nm của dung dịch là 0,7 ± 0,2.
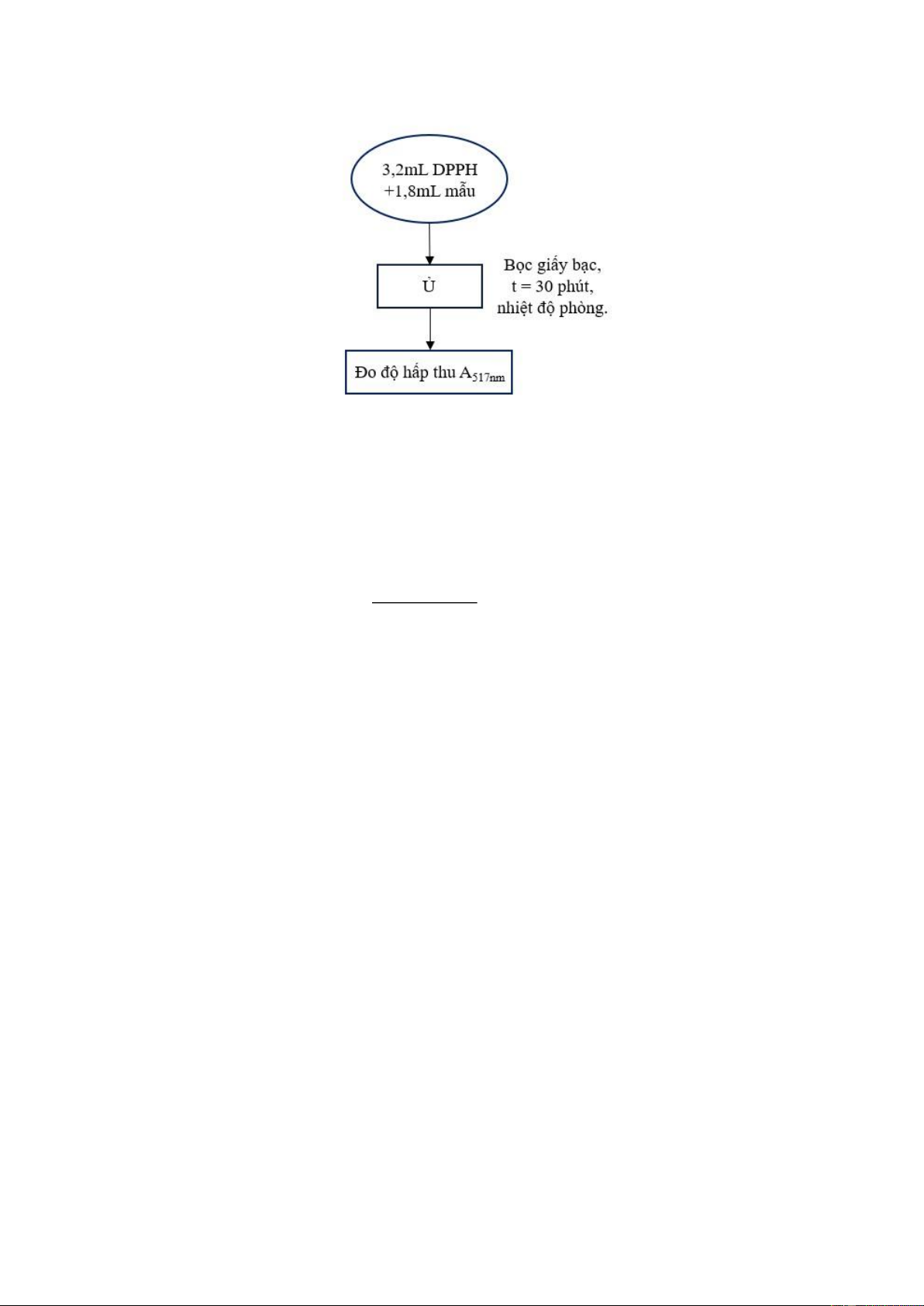
b) Quy trình khảo sát:
Cho 3,2 mL dung dịch DPPH (hòa tan trong methanol 80%, bọc kín tránh sáng
và sử dụng ngay khi pha) vào lọ thử nghiệm, sau đó bổ sung 1,8mL dung dịch mẫu.
Hỗn hợp được lắc đều, để trong bóng tối ở nhiệt độ phòng 30 phút và đo độ hấp thu ở
bước sóng λ = 517nm. Tiến hành tương tự với mẫu đối chứng âm, mẫu đối chứng dương
và trừ màu. Trong đó, mẫu đối chứng âm thay 1,8mL mẫu bằng 1,8mL MeOH 80%,
mẫu đối chứng dương thay 1,8mL mẫu bằn 1,8mL dung dịch L (+) – ascorbic acid ở
các nồng độ khác nhau nhằm xác định IC50 của chứng dương, mẫu trừ màu thay 3,2mL
dung dịch DPPH bằng 3,2mL MeOH 80%. lOMoARcPSD| 36782889
Hình 2.8. Quy trình khảo sát hoạt tính bắt gốc tự do DPPH d) Tính toán:
Công thức tính phần trăm bắt gốc tự do: I %=
Ab−(As−Ac).100 Ab
Trong đó: Ab: Độ hấp thu của mẫu đối chứng âm
As: Độ hấp thu của mẫu thử
Ac: Độ hấp thu của mẫu trừ màu
CHƯƠNG 3: KẾT QUẢ SƠ BỘ
3.1. Xử lý nguyên liệu và đánh giá sơ bộ thành phần chính trong Dây gắm
3.1.1. Chuẩn bị nguyên liệu
Dây gắm được thu hoạch vào khoảng tháng 9 năm 2023 tại Huyện Cẩm Thủy, tỉnh
Thanh Hóa, chỉ sử dụng phần thân để nghiên cứu. Nguyên liệu sau khi thu hoạch trải
qua quá trình rửa sạch để loại bỏ mọi tạp chất và đất cát, được xử lý bằng nước và sau
đó để ráo nước. Thân cây được chia nhỏ thành các miếng và được phơi khô ở nơi thoáng
mát, tránh ánh nắng trực tiếp. Quá trình phơi khô làm nguyên liệu trở nên cứng hơn,
giòn hơn, và màu sắc của vân chuyển từ trắng sang đen. Quá trình phơi khô đóng vai
trò quan trọng trong việc bản quản nguyên liệu, không chỉ giúp ngăn chặn sự phát triển
của vi khuẩn và nấm, mà còn bảo vệ chất dinh dưỡng có trong dược liệu, hạn chế sự lOMoARcPSD| 36782889
phân giải từ vi sinh vật và enzyme của cây. Khi đạt độ ẩm thích hợp khoảng 10%, mẫu
khô được chia thành nhiều phần để bảo quản, đặt ở nơi thoáng mát và tránh ánh nắng
trực tiếp. Để ngăn chặn hiện tượng hút ẩm ngược trở lại, các túi hút ẩm silicagel cũng
được thêm vào trong quá trình bảo quản, đảm bảo nguyên liệu được lưu trữ ổn định và duy trì chất lượng.
Hình 3.1. Dây gắm khô
Trước khi bắt đầu quá trình chiết xuất, nguyên liệu khô được xay nhuyễn thành
bột. Do kích thước của nguyên liệu có ảnh hưởng lớn đến quá trình chiết xuất các hoạt
chất. Việc nghiền thành bột nhằm tăng diện tích tiếp xúc giữa dung môi và vật liệu,
đồng thời giúp phá vỡ cấu trúc tế bào thực vật. Điều này tạo điều kiện thuận lợi để các
hoạt chất trong nguyên liệu có thể dễ dàng tan vào dung môi. Bột Dây gắm, sau quá
trình nghiền, sẽ có màu nâu và có sự hiện diện của các sợi. Vì quá trình ma sát trong
máy nghiền làm nhiệt độ bên trong máy tăng cao, có khả năng làm bốc hơi một phần
nước có trong dược liệu, đồng thời việc bột dược liệu tiếp xúc liên tục với môi trường
không khí khi tiến hành nghiền và khi thực hiện các thao tác chuyển mẫu cũng ảnh
hưởng đến độ ẩm của bột dược liệu, nên trước khi đưa vào chiết, các mẫu bột cần được
đo độ ẩm lại để đánh giá được chính xác. Việc xác định độ ẩm trong dược liệu ngoài
nhằm kiểm tra xem dược liệu có đạt yêu cầu bảo quản hay không, mà giá trị này cũng
cần thiết trong việc tính toán kết quả định lượng các chất trong dược liệu về sau. Các
mẫu bột được đo độ ẩm ba lần bằng máy đo độ ẩm Satorius MB45, kết quả được thể hiện ở Bảng 3.1. lOMoARcPSD| 36782889
Hình 3.2. Bột Dây gắm
Bảng 3.1. Độ ẩm của bột dược liệu Lần đo 1 2 3 Trung bình Bột Dây gắm 13,50% 14,69% 15,50% 14,57% ± 0,71
Độ ẩm bột (%) của bột Dây gắm là 14,57% ± 0,71, đạt với tiêu chuẩn Dược điển
IV, phủ hợp để tiến hành chiết cao tổng. Các mẫu cao chiết này được bảo quản đông ở
nhiệt độ -22oC để tránh sự tấn công của vi sinh vật và sự biến tính của các hợp chất có
trong mẫu cao, tạo điều kiện thích hợp để thực hiện các thí nghiệm khác.
3.1.2. Kết quả sơ bộ hóa thực vật
Sơ bộ hóa thực vật giúp xác định sự có mặt của các nhóm thành phần chứa trong
mẫu thực vật, từ đó dự đoán được hoạt tính của mẫu khảo sát và cung cấp cơ sở để phân
lập các hợp chất tự nhiên và thực hiện khảo sát chính xác hơn. Hoạt chất có thể được
tách ra khỏi nguyên liệu thực vật bằng các kỹ thuật chiết khác nhau như ngâm dầm,
ngâm chiết, truyền dung môi, sắc kí… với các loại dung môi từ kém phân cực đến phân
cực. Trong thí nghiệm này, đánh giá sơ bộ hóa thực vật được tiến hành trực tiếp với cao
chiết tổng của Dây gắm bằng phương pháp sử dụng các chất chỉ thị và dựa vào sự biểu
hiện (màu sắc, kết tủa, sự tách lớp). Các nhóm chất được lựa chọn để định tính bao gồm
alkaloid, flavonoid, polyphenol. Đây cũng là những nhóm chất đã được nhiều nghiên
cứu trước đây chứng minh sự hiện diện trong loài cây này.
Bảng 3.2. Kết quả sơ bộ hoá thực vật của cao chiết Dây gắm Kết Hoạt chất Thuốc thử Hiện tượng quả lOMoARcPSD| 36782889 Alkaloid + Bouchardat Tạo kết tủa màu nâu Gragendorff Tạo kết tủa màu cam Flavonoid Mg/HCl
Dung dịch có màu đỏ cam ++ Polyphenol FeCl3
Dung dịch ban đầu có màu ++
xanh, sau phản ứng chuyển thành nâu đỏ Ghi chú - : không có hoạt chất + : có hoạt chất ++ : nhiều hoạt chất
Từ kết quả Bảng 3.2, có thể nhận thấy trong cao chiết Dây gắm có chứa nhóm chất
flavonoid và polyphenol với hàm lượng đáng kể. Ngoài ra, nhóm chất alkaloid cũng có
mặt trong cao chiết với lượng khá ít. Kết quả nhận biết alkaloid, flavonoid và polyphenol
trong cao chiết Dây gắm của bài nghiên cứu của nhóm Ông Bỉnh Nguyên cũng thể hiện tương tự [7].
3.2. Hiệu suất thu cao tổng
Cao tổng thu được theo hai phương pháp chiết ngâm dầm được mô tả chi tiết ở
Mục 2.4.2. Số liệu thực nghiệm độ chiết ra được trình bày trong Bảng. 3.3. Công đoạn
khảo sát hiệu suất chiết của cao tổng nhằm đánh giá sự khác biệt về hiệu suất giữa các
nồng độ cồn chiết khác nhau. Kết quả từ khảo sát này sẽ giúp xác định nồng độ phù hợp
để tiếp tục các bước nghiên cứu tiếp theo.
Bảng 3.3. Hiệu suất chiết cao tổng theo phương pháp ngâm dầm
Nồng Khối lượng cao khô (g) Hiệu suất cao độ tổng (g) ethanol 96° 0,677074 3,38537 90° 0,80012 4,0006 80° 1,058616 5,29308 70° 1,322585 6,612925 lOMoARcPSD| 36782889
Kết quả Bảng 3.3. cho thấy hiệu suất thu cao tổng bằng phương pháp ngâm dầm
tăng khi giảm nồng độ cồn, có thể được giải thích bằng việc các dung môi khác nhau có
độ phân cực và hằng số điện phân khác nhau, ảnh hưởng đến ái lực liên kết với các hợp
chất trong quá trình chiết xuất. Cồn và hỗn hợp cồn/nước cũng như nước đều là những
dung môi có độ phân cực khác nhau, điều này có thể làm thay đổi khả năng lôi kéo các
nhóm chất khác nhau [38]. Cồn có độ phân cực thấp hơn so với nước, khi tăng nồng độ
cồn có thể làm giảm tính phân cực của dung dịch. Hiệu suất chiết cao nhất đạt được ở
nồng độ cồn 70°, cho thấy các thành phần hóa học trong Dây gắm có tính phân cực cao
hơn ở điều kiện này. Ngoài ra, nước đóng vai trò quan trọng như một chất trương nở
của mô thực vật, giúp tăng bề mặt tiếp xúc, trong khi đó cồn đóng vai trò làm phá vỡ
các liên kết giữa các chất hòa tan và mô thực vật [39].
CHƯƠNG 4. ĐỊNH HƯỚNG STT
Nội dung thực hiện
Thời gian dự kiến
Chiết bằng phương pháp Soxhlet với các nồng độ 1 cồn khác nhau. 1/2024-2/2024
Khảo sát hiệu suất chiết, hàm lượng flavonoid và
polyphenol toàn phần trong dịch chiết thu được từ 2
phương pháp chiết ngâm dầm và Soxhlet để lựa 2/2024-3/2024
chọn nồng độ cồn thích hợp cho các khảo sát tiếp theo.
Cao chiết với nồng độ cồn phù hợp được đánh giá 3
hoạt tính sinh học và định hướng ứng dụng vào thực 3/2024-4/2024 phẩm chức năng.
Căn cứ vào dữ liệu thực tế để hoàn thành đồ án tốt 4 nghiệp. 4/2024-5/2024
TÀI LIỆU THAM KHẢO 1.
Badhani, A., Rawat, S., Bhatt, I. D., & Rawal, R. S. (2015). Variation in
Chemical Constituents and Antioxidant Activity in Y ellow H imalayan (R ubus lOMoAR cPSD| 36782889
ellipticus S mith) and Hill Raspberry (R ubus niveus T hunb.). Journal of Food
Biochemistry, 39(6), 663-672. 2.
Badhani, B., Sharma, N., & Kakkar, R. (2015). Gallic acid: A versatile
antioxidant with promising therapeutic and industrial applications. Rsc
Advances, 5(35), 27540-27557. 3.
Leontowicz, M., Gorinstein, S., Leontowicz, H., Krzeminski, R., Lojek, A.,
Katrich, E., . . . Haruenkit, R. (2003). Apple and pear peel and pulp and their
influence on plasma lipids and antioxidant potentials in rats fed
cholesterolcontaining diets. Journal of Agricultural and Food Chemistry, 51(19), 57805785. 4.
Lợi, Đ. T. (2004). Những cây thuốc và vị thuốc Việt Nam (5 ed.): Nhà xuất bản Y học. 5.
Zhengyi Wu, P. H. R., Dekyuan Hong. (2005). Flora of China Volume 4:
Magnoliophyta: Caryophyllidae, Euphorbiaceae through Boraginaceae (Vol. 4): Science Press. 6.
Viện Dược liệu, B. Y. t., Đại học Y Hà Nội. (2012). Từ điển cây thuốc Việt Nam
(Vol. 2): Nhà xuất bản Y học. 7.
Ông Bỉnh Nguyên, N. Đ. K. Q., Lý Hải Triều, Bùi Thị Phương Quỳnh, Lê Văn
Minh. (2018). Khảo sát thành phần hoá học và hoạt tính sinh học của cao chiết
Dây gắm (Gnetum montanum Markgr.). Tạp chí Khoa học và Công nghệ - Đại
học Nguyễn Tất Thành, 4, 15-21. 8.
Ahmat, N., Kamarozaman, A., Johari, M., Abas, F., Mohamad, S., & Yunoh, S.
(2022). Screening of phytochemicals from the ethanolic extracts of Gnetum
gnemon, Gnetum latifolium and Cynometra malaccensis of Kuala Keniam,
Pahang. Paper presented at the IOP Conference Series: Earth and Environmental Science. 9.
Ali, Z., Tanaka, T., Iliya, I., Iinuma, M., Furusawa, M., Ito, T., . . . Darnaedi, D.
(2003). Phenolic Constituents of Gnetum k lossii. Journal of natural products, 66(4), 558-560. 10.
Wang, J., & Liang, J. (2006). Research progress on chemical constituents and
pharmacological effect of genus Gnetum. Strait Pharmaceutical J, 18, 15-20. 11.
SHI, S.-Q., & JIANG, Z.-P. (2011). Progress on Study of Gnetaceae Plants in
World. Journal of Plant Genetic Resources, 12(5), 694-699. 12.
Riviere, C., Pawlus, A. D., & Merillon, J.-M. (2012). Natural stilbenoids:
distribution in the plant kingdom and chemotaxonomic interest in Vitaceae.
Natural product reports, 29(11), 1317-1333. 13.
Fang, Y., Cao, Z., Hou, Q., Ma, C., Yao, C., Li, J., . . . Huang, C. (2013). Cyclin
d1 downregulation contributes to anticancer effect of isorhapontigenin on human
bladder cancer cells. Molecular cancer therapeutics, 12(8), 14921503. lOMoARcPSD| 36782889 14.
Panche, A. N., Diwan, A. D., & Chandra, S. R. (2016). Flavonoids: an overview.
Journal of nutritional science, 5, e47. 15.
Saisin, S., Tip-pyang, S., & Phuwapraisirisan, P. (2009). A new antioxidant
flavonoid from the lianas of Gnetum macrostachyum. Natural Product
Research, 23(16), 1472-1477. 16.
O’Croinin, C., Garcia Guerra, A., Doschak, M. R., Löbenberg, R., & Davies, N.
M. (2023). Therapeutic Potential and Predictive Pharmaceutical Modeling of
Stilbenes in Cannabis sativa. Pharmaceutics, 15(7), 1941. 17.
Lam, Đ. T. (2017). Nghiên cứu tính an toàn, tác dụng chống viêm, giảm đau của
cao xoa Bách Xà trên thực nghiệm và lâm sàng bệnh viêm khớp dạng thấp. In:
Luận án tiến sĩ y học. Trường ĐH Y Hà Nội. 18.
Lee, J.-H., Kim, Y.-G., Ryu, S. Y., Cho, M. H., & Lee, J. (2014). Resveratrol
oligomers inhibit biofilm formation of Escherichia coli O157: H7 and
Pseudomonas aeruginosa. Journal of natural products, 77(1), 168-172. 19.
Tú, N. T. T. (2015). Nghiên cứu tính an toàn và tác dụng của viên nang cứng
Hoàng Kinh trong điều trị viêm khớp dạng thấp. Luận án tốt nghiệp Tiến sĩ Y
học, Trường Đại Học Y Hà Nội. 20.
Anh Vũ, Đ. C. B. (2004). Mẹo lạ thuốc hay: Thanh Hóa. 21.
Valletta, A. (2023, 14 January 2021). Stilbene Biosynthesis. Retrieved from
https://encyclopedia.pub/entry/6318 22.
Li, X.-m., Lin, M., Wang, Y.-h., & Liu, X. (2004). Four new stilbenoids from
the lianas of Gnetum montanum f. megalocarpum. Planta medica, 70(02), 160165. 23.
Wang, L. Q., Zhao, Y. X., Hu, J. M., Jia, A. Q., & Zhou, J. (2008). Stilbene
Derivatives from Gnetum montanum MARKGR. f. megalocarpum MARKGR.
Helvetica Chimica Acta, 91(1), 159-164. 24.
Ma, Y.-Q., Zhai, Y.-M., Deng, Y., Guo, L., Wan, Y.-Q., & Tan, C.-H. (2017).
Stilbeno-phenylpropanoids from Gnetum montanum Markgr. Phytochemistry Letters, 21, 42-45. 25.
Phương, V. T. L. (2019). Nghiên cứu thành phần hoá học của cây gắm (Gnetum
Montanum Markgr). Tạp chí khoa học số, 34, 2019. 26.
Lê Thị Hồng Nhung, N. T. H., Nguyễn Thị Hoàng Anh, Ngô Anh Bằng. (2022).
Phân lập và xác định cấu trúc một số hợp chất stilbenoid từ loài gắm cọng
(Gnetum latifolium). Tạp chí Khoa học Công nghệ, 58. 27.
Nguyễn Bá Anh, T. D. Đ., Hoàng Việt Dũng, Nguyễn Xuân Nhiệm. (2014). Phân
lập và xác định cấu trúc 2 hợp chất stilbenoid từ loài dây gắm (Gnetum latifolium
Blume, họ Gnetaceae). Tập chí Dược Học, 54. 28.
Nexson, A. J., & Parhusip, A. (2011). Antimicrobial activity of melinjo seed and
peel extract (Gnetum gnemon) against selected pathogenic bacteria, Microbiol. Indonesia, 5, 103-112. lOMoAR cPSD| 36782889 29.
Udeh, N. E., Nnadi, C. O., Anaga, A. O., & Asuzu, I. U. (2021).
Bioactivityguided fractionation of a methanol leaf extract from Gnetum
africanum with potential anti-diabetic activity:(-)-Epicatechin as the active
principle. J. Res. Pharm, 25, 72-79. 30.
Nguyệt, N. T. Á., & Chung, N. T. (2023). The analgesic and anti-inflammatory
effects of soursop leaf ethanol extract of Gnetum montanum Markgr. in vivo.
Tạp chí Y Dược cổ truyền Việt Nam, 47(1), 44-51. 31.
Lĩnh, N. T. H. Đ., Nguyễn Mạnh Lê, Đỗ Thị Thủy Huyền, Đỗ Thị Thanh
Phương, Bùi Thị Hồng. (2019). Nghiên cứu ứng dụng enzyme để nâng cao hiệu
suất trích ly resveratrol từ dây gắm. Tạp chí Dinh dưỡng và Thực phẩm, 15(4), 45-52. 32.
Tế, B. Y. (2009). Dược điển Việt Nam IV (4 ed.): Bộ Y Tế. 33.
Mẫn, L. V. V., Quốc, Đ. L., Hiền, N. T., Nguyệt, T. N. M., & Trà, T. T. T. (2011).
Công nghệ chế biến thực phẩm (2 ed.): Đại học Quốc gia TP.HCM. 34.
Phụng, N. K. P. (2007). Phương pháp cô lập hợp chất hữu cơ. In. 35.
Singleton, V. L., Orthofer, R., & Lamuela-Raventós, R. M. (1999). Analysis of
total phenols and other oxidation substrates and antioxidants by means of
folinciocalteu reagent. In Methods in enzymology (Vol. 299, pp. 152-178): Elsevier. 36.
Pękal, A., & Pyrzynska, K. (2014). Evaluation of aluminium complexation
reaction for flavonoid content assay. Food Analytical Methods, 7, 1776-1782. 37.
Kedare, S. B., & Singh, R. (2011). Genesis and development of DPPH method
of antioxidant assay. Journal of food science and technology, 48, 412-422. 38.
Sultana, B., Anwar, F., & Ashraf, M. (2009). Effect of extraction
solvent/technique on the antioxidant activity of selected medicinal plant extracts.
Molecules, 14(6), 2167-2180. 39.
Şahin, S., & Şamlı, R. (2013). Optimization of olive leaf extract obtained by
ultrasound-assisted extraction with response surface methodology. Ultrasonics
sonochemistry, 20(1), 595-602.

