



Preview text:
SỞ GD &ĐT ……….. HƯỚNG DẪN CHẤM
TRƯỜNG THPT …….. KIỂM TRA HỌC KÌ 1 NĂM HỌC 2023 - 2024 -------------------- MÔN: HÓA
Thời gian làm bài: 45 I. TRẮC NGHIỆM Đề\câu 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 101 C D C C C B A D D C B C A C D 102 B C C B B C D B D C D C C A B 103 B D A B D B C A A B C B C C B 104 A C C D C C C D D B A C D A C 105 A C C B A A D D D D B D B D C 106 C C D B C C A B C C D B C D D 107 A C D A B C B C C C B B B D A 108 D C B A A B D B D C B B D C B II. TỰ LUẬN NỘI DUNG ĐIỂM STT
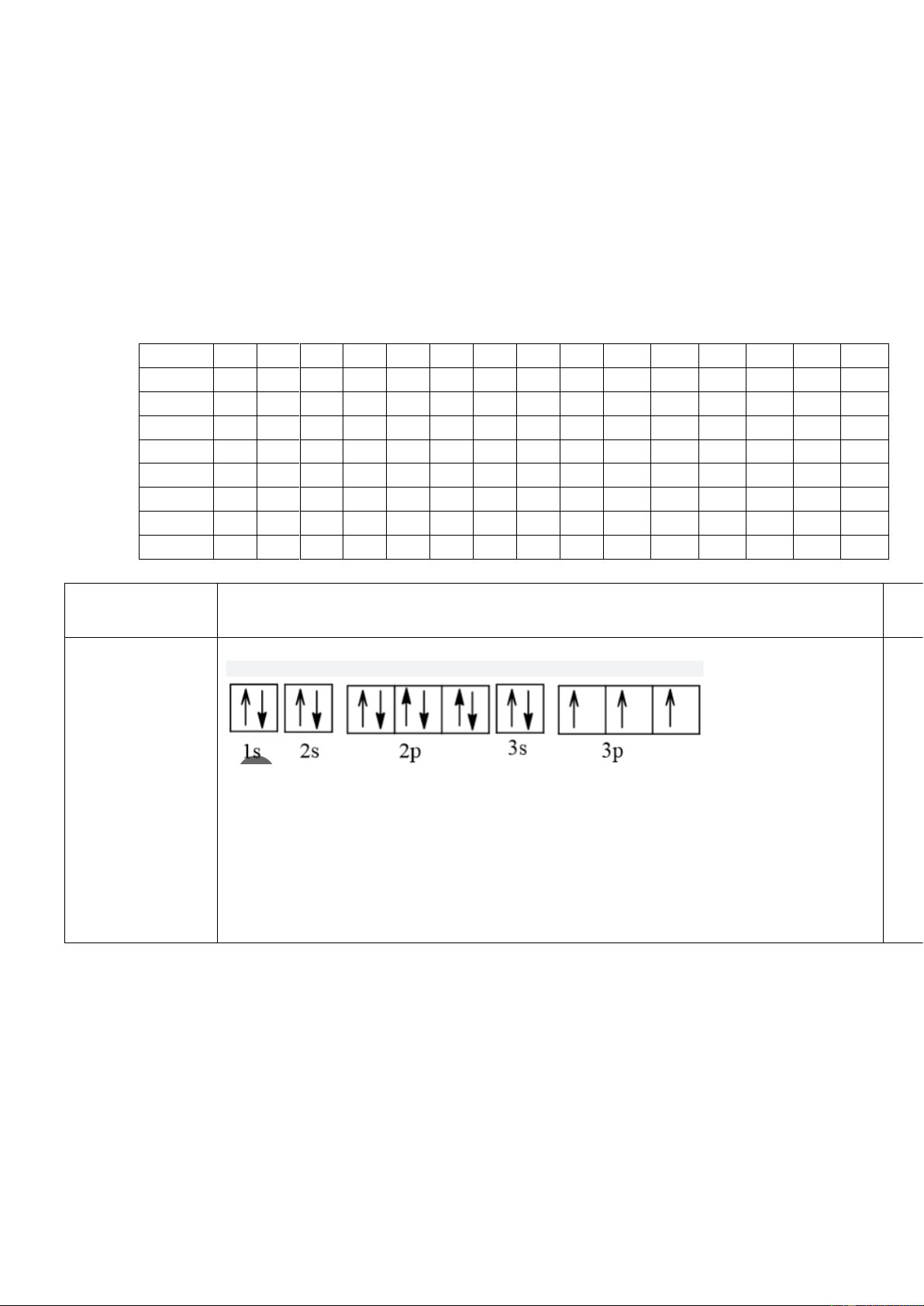
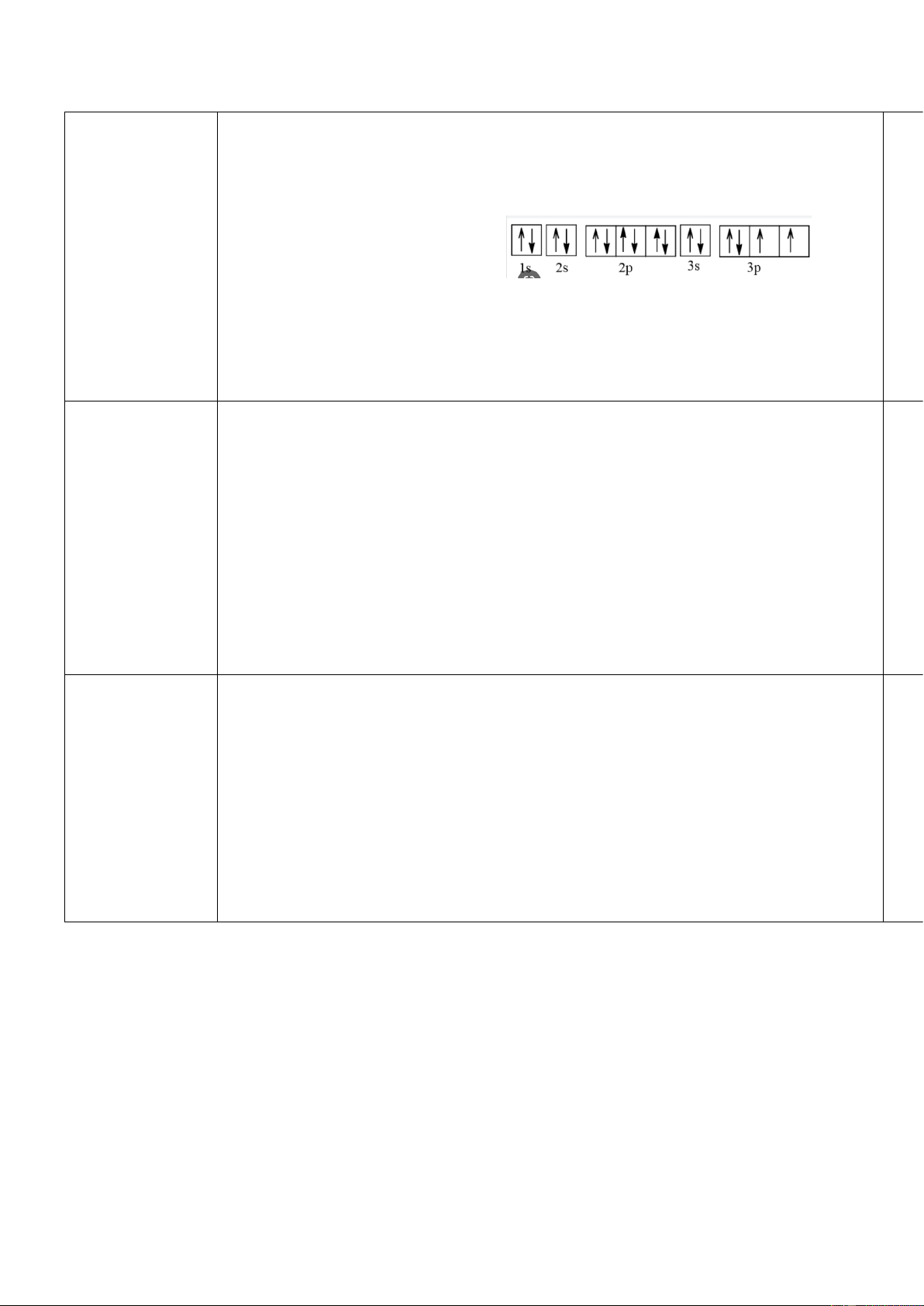
Câu 1. (1 điểm) a.Ở trạng thái cơ bản, X có 3 lớp electron và có 3 electron độc thân. Mã Đề: 101,103,105,107
Nên cấu hình electrong củ 0,5 a X: 1s22s22p63s23p3
b. Dự đoán tính chất X: phi kim 0,25
Giải thích: vì X có 5 electron ở lớp ngoài cùng. 0,25
Câu 1. (1 điểm) Mã Đề:
Ở trạng thái cơ bản, X có 3 lớp electron và có 2 electron độc thân trên phân lớp 102,104,106,108
p và không có orbital trống. Vậy suy ra:
1/Nên cấu hình electrong của X: 0,5 1s22s22p63s23p4
b. Dự đoán tính chất X: phi kim 0.25
Giải thích: vì X có 6 electron ở lớp ngoài cùng. 0.25
Câu 2. (1 điểm) Nguyên tử nguyên tố A có 3 lớp electron, lớp ngoài cùng của A có 6 electron. Mã Đề:
Hãy xác định vị trí của A trong bảng tuần hoàn hóa học (Ô, Nhóm, Chu kì).
101,103,105,107 Giải thích.
Nên cấu hình electrong của X: 1s22s22p63s23p4 0,25
Vị trí: Ô thứ 16 (STT Ô=Z=16); 0,25
chu kì 3 (vì STT Chu kì=số lớp lectron=3), 0,25
Nhóm VIA( vì STT Nhóm=số electron hóa trị= 6; nếu hs giải thích có 6 0,25
electron ở lớp ngoài cùng và thuộc nguyên tố p vẫn chấm đúng)
HS xác định đúng từng ý kèm giải thích được 0,25 điểm, nếu không giải thích 1
ý vẫn tính điểm tối đa, 2 ý trừ 0,25. Mã Đề:
Nguyên tử nguyên tố A có 3 lớp electron, lớp ngoài cùng của A có 3 electron.
102,104,106,108 Hãy xác định vị trí của A trong bảng tuần hoàn hóa học (Ô, Nhóm, Chu kì). Giải thích.
Nên cấu hình electrong của X: 1s22s22p63s23p1
Vị trí: Ô thứ 13 (STT Ô=Z=13); chu kì 3 (vì STT Chu kì=số lớp lectron=3),
Nhóm IIIA( vì STT Nhóm=số electron hóa trị= 3; nếu hs giải thích có 3
electron ở lớp ngoài cùng và thuộc nguyên tố p vẫn chấm đúng)
HS xác định đúng từng ý kèm giải thích được 0,25 điểm
Câu 3. (1 điểm) Nguyên tố Y là phi kim; Y thuộc nhóm IVA. Y tạo hợp chất với oxygen và Mã Đề:
trong công thức oxide cao nhất ; Y chiếm 27,3% về khối lượng. Xác định Y và
101,103,105,107 viết công thức hợp chất này.
Công thức oxide cao nhất : YO2
%Y= 27,3 suy ra %O= 100%-%Y= 72,7% Ta có: %Y/%O = MY/M0.2 0,25
Thay số vào và rút ra MY=12 0, 5
Vậy Y là nguyên tố Carbon (C)
Công thức hợp chất : CO2
HS giải cách khác vẫn ra MY=12 vẫn cho 0,75 điểm. 0,25 Mã Đề:
Nguyên tố Y là phi kim; Y tạo hợp chất với oxygen và có công thức oxide cao
102,104,106,108 nhất là YO
3. Hợp chất YO3; Y chiếm 40% về khối lượng. Xác định Y và viết
công thức hợp chất này.
Công thức oxide cao nhất : YO3
%Y= 27,3 suy ra %O= 100%-%Y= 72,7% Ta có: %Y/%O = MY/M0.3 0,25
Thay số vào và rút ra MY=32 0, 5
Vậy Y là nguyên tố Sulfur 0,25
Công thức hợp chất : SO3 0,25
HS giải cách khác vẫn ra MY=32 vẫn cho 0,75 điểm. Mã Đề:
Công thức hợp chất Cation Anion
Viết quá trình tạo thành 102,104,106,108 liên kế t ion MgCl2 Mg2+ Cl- Mg → Mg2+ + 2e 0,5 Cl + e → Cl−
Mg2+ + 2Cl− → MgCl2
HS viết đúng mỗi ý được 0,1 điểm; nếu cation và anion HS viết các quá trình hình thành ion Mg → Mg2+
+ 2e và Cl + e → Cl− thì vẫn chấm 0,1 điểm mỗi ý
nhưng viết quá trình tạo liên kết ion thiếu các bước thì trừ điểm, không tính các
quá trình này vào mục viết quá trình tạo liên kết ion.
b. Hãy biểu diễn sự hình thành các cặp electron chung trong phân tử CO 2. Từ đó
viết công thức Lewis. Giải thích ? Mã Đề: 0,5 101,103,105,107
Công thức hợp chất Cation Anion
Viết quá trình tạo thành liên kết ion CaF2 Ca2+ F- Ca → Ca2+ + 2e F + e → F− Ca2+ + 2F− → CaF2
b.Hãy biểu diễn sự hình thành các cặp electron chung trong phân tử NH3. Từ đó
viết công thức Lewis. Giải thích ?
Nitrogen (Z = 7): 1s22s22p3có 5 electron lớp ngoài cùng. Xu hướng cần có 3
electron để đạt được cấu hình electron bền vững của khí hiếm gần nhất là Ne: 1s22s22p6
Hydrogen (Z = 1): 1s1có 1 electron lớp ngoài cùng. Xu hướng cần có 1 electron 0,25
để đạt được cấu hình electron bền vững của khí hiếm gần nhất là He: 1s2
Do vậy, để hình thành liên kết trong phân tử NH3
mỗi nguyên tử H bỏ ra 1 electron góp chung với 1
electron N, 3 nguyên tử H cần 3 electron của N 0,5
góp chung tạo nên liên kết công hóa trị như sau: 0,25 Câu 5. (0,5
Một hợp chất B được tạo bởi hai ion X2+ và 2
YZ − ; Y,Z là các phi kim thuộc 3 điểm)
cùng chu kì , và trong mỗi nguyên tử Y, Z có số proton bằng số neutron. Tổng số electron của 2
YZ − bằng 32 hạt, hiệu số neutron của X và Y bằng 3 lần số 3
proton của Z. Khối lượng phân tử của B bằng 116u. 0,25 0,25




