



Preview text:
Giải KHTN Lớp 7 Bài 6: Hóa trị, công thức hóa học
Câu hỏi thảo luận KHTN 7 Bài 6 Cánh diều
Cho các miếng bìa ghi kí hiệu hóa học của các nguyên tố C, O, Cl, H như hình dưới đây. Mỗi
miếng bìa tượng trưng cho một nguyên tử. Hãy ghép các miếng bìa H với các miếng bìa khác sao cho phù hợp.
Hãy cho biết các nguyên tố C, O, Cl ghép được với tối đa bao nhiêu nguyên tử H. Dùng kí hiệu
hóa học và các chữ số để mô tả trong những miếng ghép thu được có bao nhiêu nguyên tử của mỗi nguyên tố. Trả lời:
Mỗi nguyên tử C có thể ghép tối đa với 4 nguyên tử H tạo thành hợp chất là CH4.
Mỗi nguyên tử O có thể ghép tối đa với 2 nguyên tử H tạo thành hợp chất là H2O
Mỗi nguyên tử Cl có thể ghép tối đa với 1 nguyên tử H tạo thành hợp chất HCl.
Trả lời câu hỏi thảo luận KHTN 7 Bài 6 Cánh diều Câu 1
Hãy quan sát hình 6.1, hãy so sánh hoá trị của nguyên tố và số electron mà nguyên tử của
nguyên tố đã góp chúng để tạo ra liên kết. Gợi ý trả lời
Mỗi nguyên tử H và Cl giống nhau về hoá trị (chúng đều có hoá trị I ) và giống nhau về số
electron góp chung để tạo ra liên kết ( mỗi nguyên tử H và Cl đều góp chung 1 electron để tạo
ra liên kết trong phân tử ) Câu 2
Cát được sử dụng nhiều trong xây dựng và là nguyên liệu chính để sản xuất thủy tinh. Silicon
oxide là thành phần chính của cát. Phân tử silicon oxide gồm 1 nguyên tử Si liên kết với 2
nguyên tử O. Dựa vào hóa trị của các nguyên tố trong bảng 6.1, hãy tính tích hóa trị và số
nguyên tử của mỗi nguyên tố trong phân tử silicon oxide. Nhận xét về tích đó. Gợi ý trả lời Nguyên tố Si O Hóa trị IV II Số nguyên tử 1 2
Tích hóa trị và số nguyên tử IV × 1 = II × 2
Nhận xét: Tích giữa hoá trị và số nguyên tử của nguyên nguyên tố Si bằng với tích giữa hoá trị
và số nguyên tử của nguyên nguyên tố O Câu 3
Cho công thức hóa học của một số chất như sau: a) N2 (nitrogen) b) NaCl (sodium chloride) c) MgSO4 (magnesium sulfate)
Xác định nguyên tố tạo thành mỗi chất và số nguyên tử của mỗi nguyên tố có trong phân tử. Gợi ý trả lời a) N2 (nitrogen):
+ N2 được tạo thành từ nguyên tố N.
+ Phân tử N2 có 2 nguyên tử N. b) NaCl (sodium chloride):
+ NaCl được tạo thành từ hai nguyên tố là Na và Cl.
+ Trong phân tử NaCl có 1 nguyên tử Na và 1 nguyên tử Cl. c) MgSO4 (magnesium sulfate):
+ MgSO4được tạo thành từ 3 nguyên tố là Mg, S và O.
+ Trong phân tử MgSO4 có 1 nguyên tử Mg, 1 nguyên tử S và 4 nguyên tử O. Câu 4
Có ý kiến cho rằng: Trong nước, số nguyên tử H gấp hai lần số nguyên tử O nên phần trăm
khối lượng của H trong nước gấp hai lần phần trăm khối lượng của O. Theo em, ý kiến trên có
đúng không? Hãy tính phần trăm khối lượng của H, O trong nước để chứng minh. Gợi ý trả lời
Tính phần trăm khối lượng của H, O trong H2O Ta có:
Khối lượng của nguyên tố H trong H2O là: mH = 2 × 1 = 2 (amu)
Khối lượng của nguyên tố O trong H2O là: mO = 1 × 16 = 16 (amu)
→ Khối lượng phân tử H2O là: 2 + 16 = 18 (amu)
Phần trăm về khối lượng của H trong H2O là:
Phần trăm về khối lượng của O trong H2O là:
Vậy ý kiến cho rằng: “Trong nước, số nguyên tử H gấp hai lần số nguyên tử O nên phần trăm
khối lượng của H trong nước gấp hai lần phần trăm khối lượng của O” là không chính xác.
Giải phần Luyện tập KHTN 7 Cánh diều Bài 6 Luyện tập 1
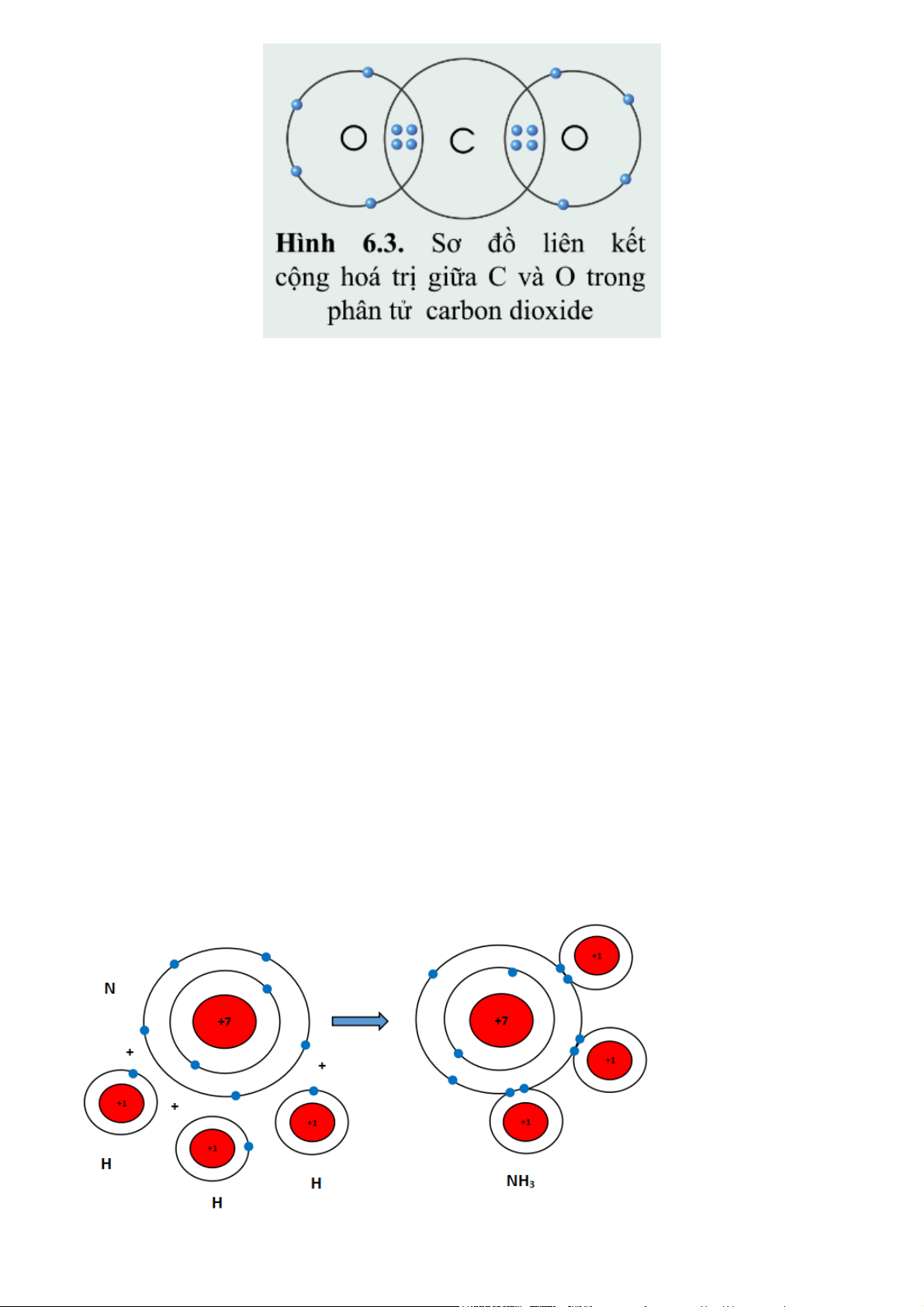
Quan sát hình 6.3 và xác định hóa trị của C và O trong khí carbonic Gợi ý đáp án Quan sát hình 6.3 ta thấy:
Nguyên tử O góp chung 2 electron
Nguyên tử C góp chung 4 electron
=> Nguyên tử C liên kết với 2 nguyên tử O bằng 4 cặp đôi electron
chung => C có hóa trị IV và O có hóa trị II. Luyện tập 2
Vẽ sơ đồ hình thành liên kết giữa nguyên tử N và ba nguyên tử H. Hãy cho biết liên kết đó
thuộc loại liên kết nào. Hóa trị của mỗi nguyên tố trong hợp chất được tạo thành là bao nhiêu? Gợi ý đáp án
+ Sơ đồ hình thành liên kết giữa nguyên tử N và ba nguyên tử H:
+ Liên kết giữa N và H được tạo thành bởi đôi electron dùng chung giữa hai nguyên tử
⇒ là liên kết cộng hóa trị.
+ Nguyên tử N góp 3 electron ⇒ N có hóa trị III.
+ Nguyên tử H góp chung 1 electron ⇒ H có hóa trị I. Luyện tập 3
Dựa vào hóa trị của các nguyên tố trong bảng 6.1 và quy tắc hóa trị, hãy cho biết mỗi nguyên
tử Mg có thể kết hợp được với bao nhiêu nguyên tử Cl. Gợi ý đáp án Nguyên tố Mg Cl Hóa trị II I Số nguyên tử 1 y
Tích hóa trị và số nguyên tử II × 1 = I × y
Từ tích hóa trị và số nguyên tử ta có: II × 1 = I × y ⇒ y = 2
Vậy mỗi nguyên tử Mg có thể kết hợp được với 2 nguyên tử Cl Luyện tập 4
Nguyên tố A có hóa trị III, nguyên tố B có hóa trị II. Hãy tính tỉ lệ nguyên tử của A và B trong
hợp chất tạo thành từ 2 nguyên tố đó. Gợi ý đáp án Nguyên tố A B Hóa trị III II Số nguyên tử x y
Tích hóa trị và số nguyên tử III × x = II × y Ta có: III × x = II × y
Vậy tỉ lệ nguyên tử của A và B trong hợp chất tạo thành từ hai nguyên tố đó là 2:3 Luyện tập 5
Viết công thức hóa học của các chất:
a) Sodium sulfide, biết trong phân tử có hai nguyên tử Na và một nguyên tử S.
b) Phosphoric acid, biết trong phân tử có ba nguyên tử H, một nguyên tử P và bốn nguyên tử O. Gợi ý đáp án a) Sodium sulfide: Na2S b) Phosphoric acid: H3PO4 Luyện tập 6
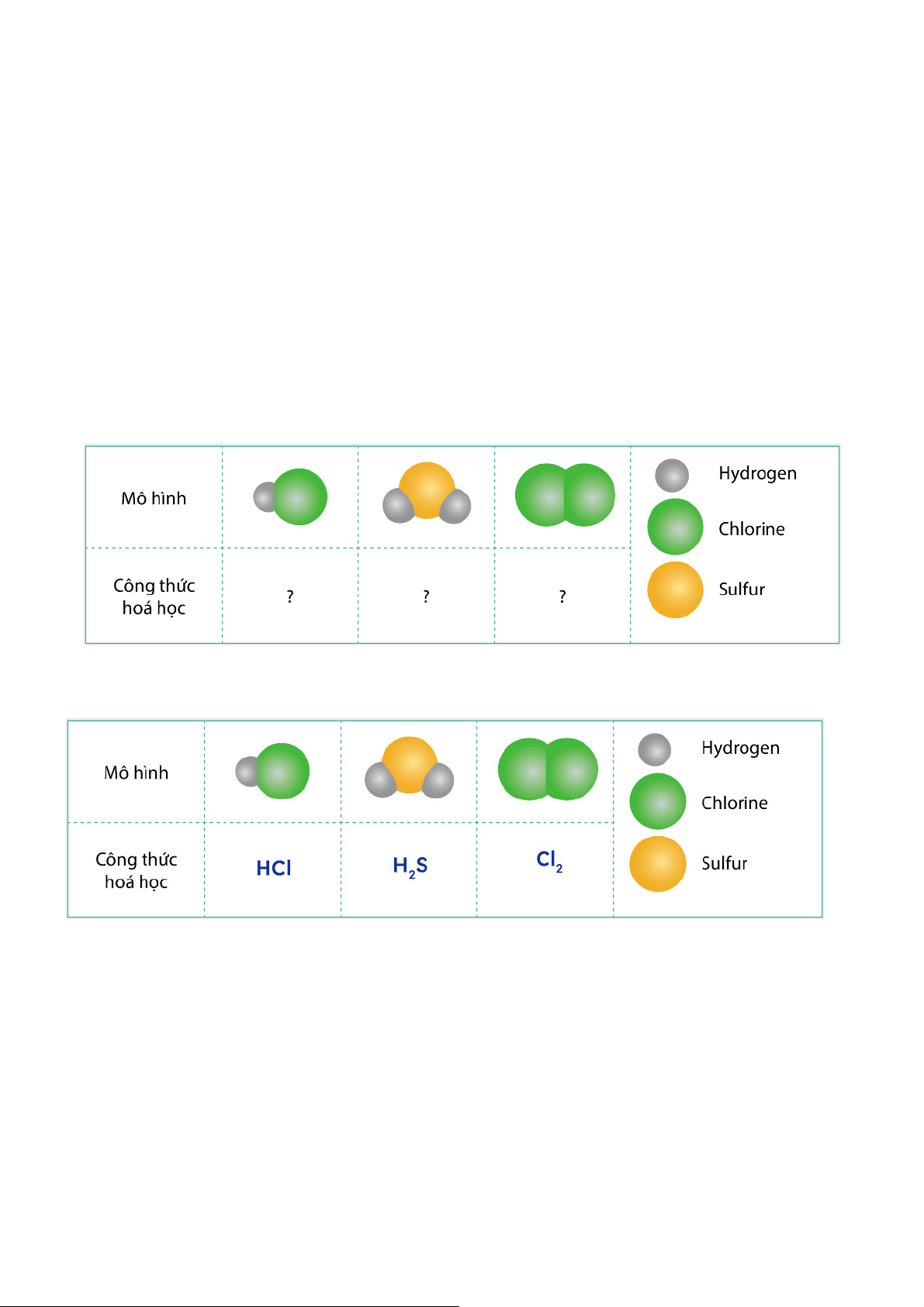
Viết công thức hóa học cho các chất được biểu diễn bằng những mô hình sau. Biết mỗi quả
cầu biểu diễn cho 1 nguyên tử Gợi ý đáp án Luyện tập 7
Đường glucose là nguồn cung cấp năng lượng quan trọng cho hoạt động sống của con người.
Đường glucose có công thức hóa học là C6H12O6. Hãy cho biết:
a) Glucose được tạo thành từ những nguyên tố nào?
b) Khối lượng mỗi nguyên tố trong 1 phân tử glucose là bao nhiêu?
c) Khối lượng phân tử glucose là bao nhiêu? Gợi ý đáp án
a) Glucose được tạo thành từ ba nguyên tố đó là C, H, O.
b) Trong một phân tử glucose có 6 nguyên tử C, 12 nguyên tử H, 6 nguyên tử O.
Trong một phân tử glucose:
Khối lượng C: 6 × 12 = 72 amu
Khối lương H: 12 × 1 = 12 amu
Khối lượng O: 6 × 16 = 96 amu
c) Khối lượng phân tử của glucose là: 72 + 12 + 96 = 180 amu. Luyện tập 8
Calcium carbonate là thành phần chính của đá vôi, có công thức hóa học là CaCO3. Tính phần
trăm khối lượng của mỗi nguyên tố trong hợp chất trên. Gợi ý đáp án
Tính phần trăm khối lượng của Ca, C, O trong CaCO3
Khối lượng của nguyên tố Ca trong CaCO3 là: 1 × 40 = 40 (amu)
Khối lượng của nguyên tố C trong CaCO3 là: 1 × 12 = 12 (amu)
Khối lượng của nguyên tố O trong CaCO3 là: 3 × 16 = 48 (amu)
→ Khối lượng phân tử CaCO3 là: = 40 + 12 + 48 = 100 amu
Phần trăm về khối lượng của Ca trong CaCO3 là:
Phần trăm về khối lượng của C trong CaCO3 là:
Phần trăm về khối lượng của O trong CaCO3 là: 100% - 40% - 12% = 48%




