











































































































































Preview text:
lOMoARcPSD|208 990 13
TRƯỜNG ĐẠI HỌC QUY NHƠN
KHOA KHOA HỌC TỰ NHIÊN ------ ------ HÓA HỮU CƠ TÀI LIỆU GIẢNG DẠY
NGÀNH CÔNG NGHỆ KỸ THUẬT HÓA HỌC Bình Định, 2021 0 lOMoARcPSD|208 990 13
Chương 1. ĐỒNG PHÂN TRONG HỢP CHẤT HỮU CƠ
Đồng phân là hiện tượng các chất có cùng công thức phân tử nhưng khác nhau
về công thức cấu trúc dẫn tới tính chất khác nhau. Có hai loại đồng phân: - Đồng phân cấu tạo - Đồng phân lập thể
1.1. Đồng phân cấu tạo - Đồng phân mạch C
- Đồng phân về vị trí nhóm chức CH3CH2CH2OH và CH3CH(OH)CH3
- Đồng phân về chức hóa học CH3CH2CHO và CH3COCH3
- Đồng phân do sự phân chia mạch C: các đồng phân này thường có cùng nhóm chức.
Những nhóm chức nằm xen kẽ trên mạch C ở những vị trí khác nhau. CH3CH2COOCH3 và CH3COOCH2CH3
- Đồng phân tautome (đồng phân hỗ biến): là 2 đồng phân nằm ở dạng cân bằng với
nhau, chúng chỉ khác nhau về vị trí của một nguyên tử hydrogen dẫn đến sự khác nhau
về vị trí của 1 liên kết đôi. ketone enol
1.2. Đồng phân lập thể
1.2.1. Đồng phân hình học
Đồng phân hình học là những đồng phân trong đó các chất khác nhau về vị trí
không gian của các nhóm thế so với liên kết đôi hoặc mặt phẳng vòng.
a. Điều kiện để tồn tại đồng phân hình học
- Trong phân tử phải chứa liên kết đôi hoặc vòng.
- Hai nhóm thế ở cùng 1 nguyên tử C mang nối đôi hoặc C trong vòng phải khác nhau.
b. Danh pháp của đồng phân hình học * Danh pháp cis-trans
Mạch chính nằm ở cùng một phía với nối đôi C=C hoặc với mặt phẳng vòng thì
gọi là đồng phân cis, còn khác phía gọi là đồng phân trans. Ví dụ: 1 lOMoARcPSD|208 990 13 * Danh pháp E-Z
Trường hợp abC = Ccd (a ≠ b ≠ c ≠ d)
So sánh độ hơn cấp của các nhóm a, b, c, d. Khi hai nhóm thế lớn ở 2C mang
nối đôi nằm cùng phía với nối đôi ta gọi là Z ngược lại khi hai nhóm thế lớn ở 2C
mang nối đôi nằm khác phía với nối đôi gọi là E. - So sánh độ hơn cấp:
+ Xét số thứ tự của các nguyên tử đính trực tiếp vào C mang nối đôi. Số thứ tự
lớn hơn thì nhóm thế lớn hơn.
Ví dụ: độ hơn cấp: Br > Cl > S > P > O > N > C > H
+ Khi các nguyên tử đính trực tiếp vào C như nhau thì xét đến nguyên tử liên kết kế tiếp.
Ví dụ: độ hơn cấp: - CH(CH3)2 > -CH2CH3 > -CH3 Vì
C(C, C, H) > C(C, H, H) > C(H, H, H)
+ Khi có liên kết bội thì phải tính luôn hệ số kép. Nếu C mang nối đôi hoặc nối
ba thì ta xem C đó liên kết với 2 hoặc 3 nguyên tử.
Ví dụ: độ hơn cấp: -CH=O > -CH2OH ; -C≡N > -CH2-NH2 vì C(O, O, H) > C(O, H, H) C(N, N, N) > C(N, H, H)
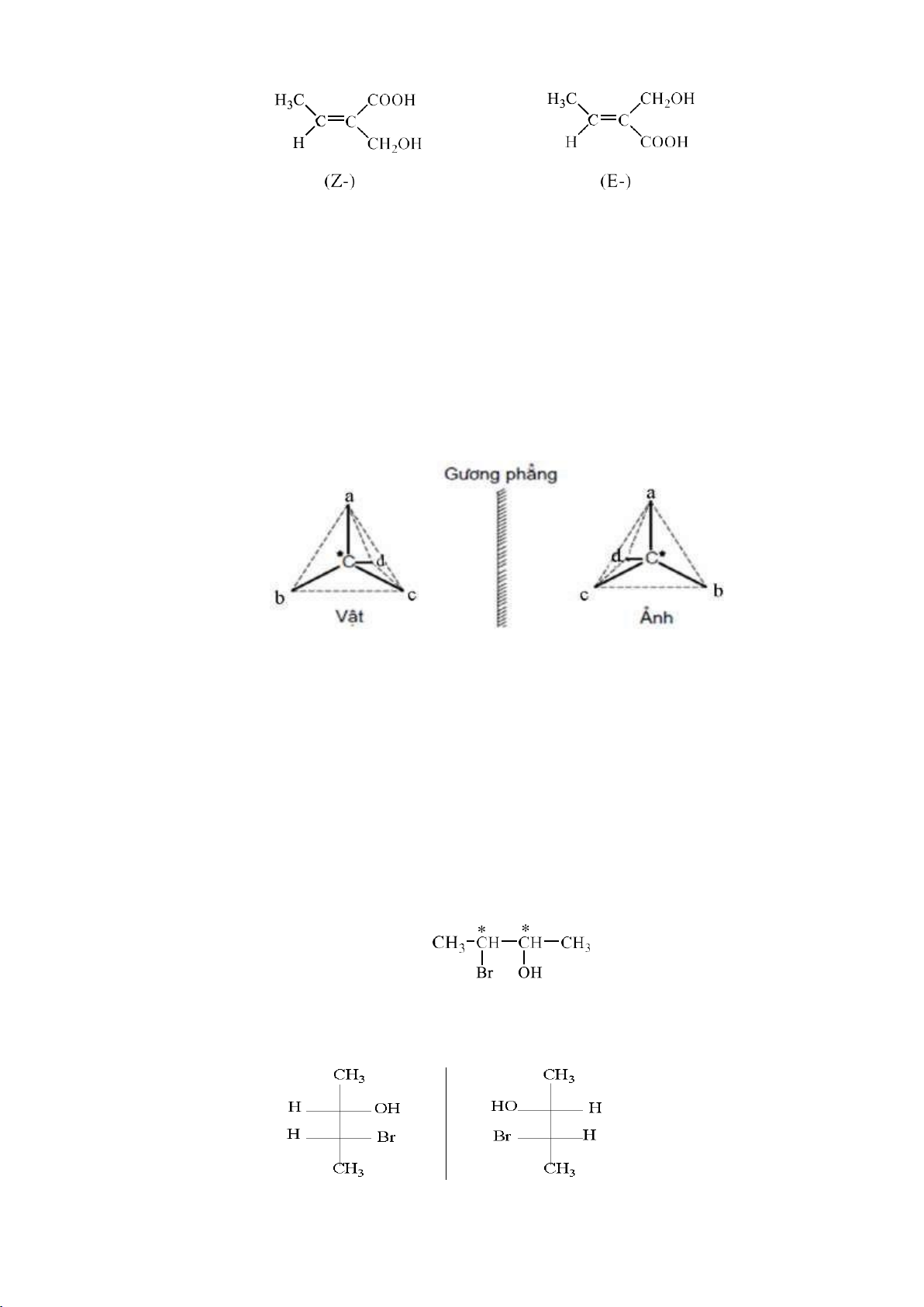
Ví dụ: Xác định cấu hình E, Z các hợp chất sau:
Độ hơn cấp: CH3 > H , COOH > CH2OH vì C (O,O,O) > C (O,H,H) nên 2 lOMoARcPSD|208 990 13
1.2.2. Đồng phân quang học a. Khái niệm
Đồng phân quang học là đồng phân lập thể trong đó các chất đồng phân có tính
chất vật lí và tính chất hóa học giống nhau nhưng khác nhau về tính quang hoạt.
Tính quang hoạt là khả năng của chất có thể làm quay mặt phẳng ánh sáng phân
cực. Một chất có tính quang hoạt thì sẽ tồn tại đồng phân quang học.
b. Điều kiện để tồn tại đồng phân quang học
- Điều kiện để tồn tại đồng phân quang học là trong phân tử phải có yếu tố bất đối. Ví dụ:
Hình 1.1. Mô hình vật và ảnh đối xứng qua gương phẳng
Hai mô hình đối xứng nhau qua gương không thể chồng khít lên nhau. Đó là
hình ảnh của hai đồng phân quang học, chúng được gọi là đôi đối quang hoặc đồng phân đối quang. * Công thức Fisher Trong phân tử có :
- nC bất đối khác nhau thì có số đồng phân quang học là: N=2n
- Số C bất đối giống nhau thì N < 2n
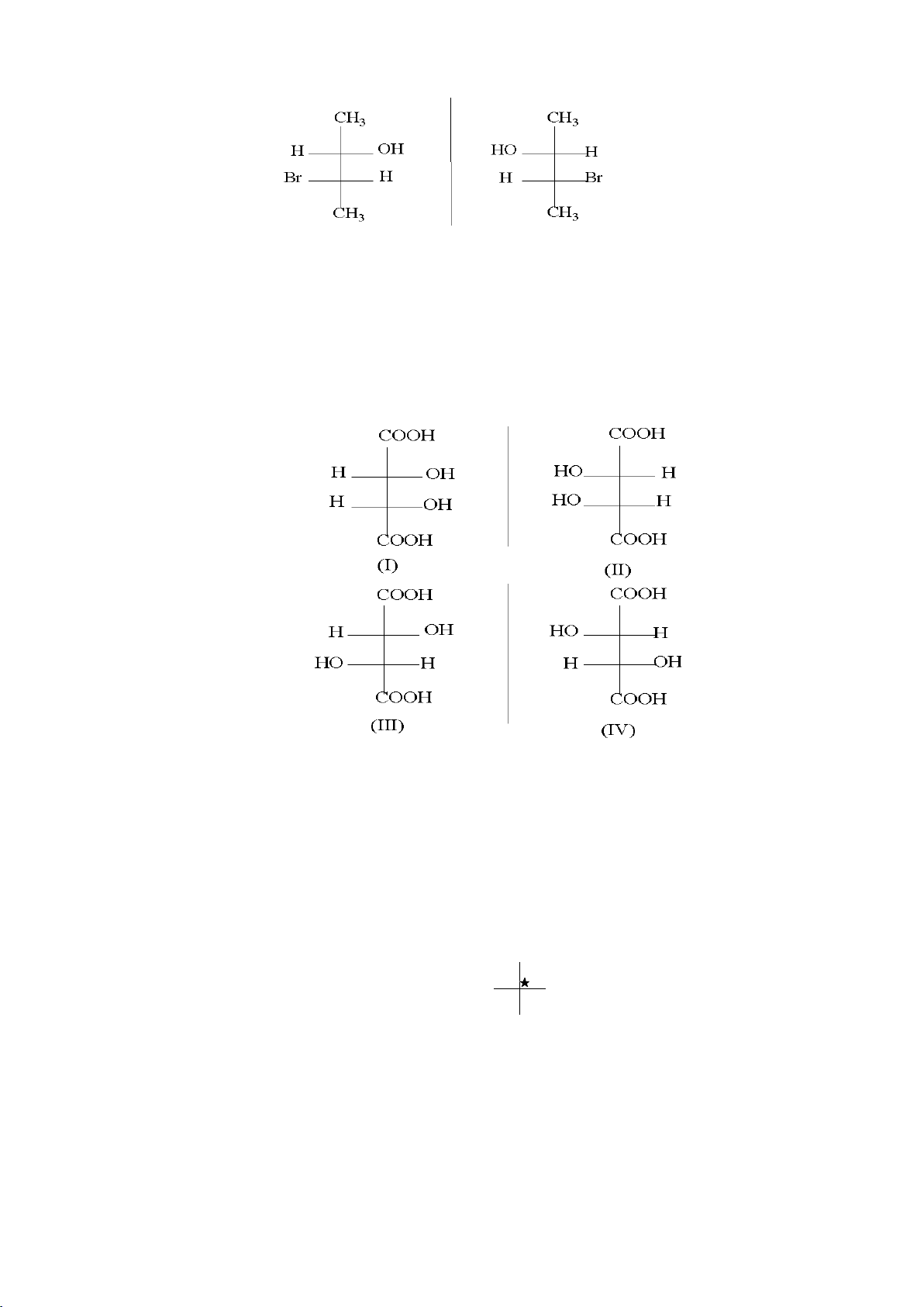
Ví dụ: Biểu diễn các đồng phân quang học của hợp chất sau: (I) (II) 3 lOMoARcPSD|208 990 13 (III) (IV)
I, II, III, IV: đồng phân quang học của nhau
I và II, III và IV: đôi đối quang
Khi phân tử có mặt phẳng đối xứng thì khi ta quay phân tử đó quanh mặt phẳng
đối xứng 1 góc 180o ta sẽ được 1 hình ảnh trùng với ảnh qua gương của nó. Ví dụ: I, II: đồng phân meso
I, II, III, IV: đồng phân quang học của nhau
Đồng phân meso: không có tính quang hoạt vì khi đặt mặt phẳng đối xứng qua
2 nguyên tử C bất đối thì tính quang hoạt của 2 phần đối xứng trong phân tử đã bị triệt
tiêu như 1 đôi đối quang
c. Danh pháp của đồng phân quang học - Danh pháp D, L R H X R'
Trong đó X là dị tố, một số trường hợp X là alkyl. R có số oxi hóa lớn hơn R’.
X nằm bên phải thì gọi D, ngược lại X nằm bên trái thì gọi là L. 4 lOMoARcPSD|208 990 13 CHO H OH CH2OH D- glyceraldehyde - Danh pháp R, S
Trước hết ta phải xác định độ hơn cấp của a, b, c, d. Giả sử a > b > c > d.
Đặt mắt quan sat hướng về phía nhóm thế nhỏ nhất, nếu 3 nhóm theo thứ tự a > b > c
quay theo cùng chiều kim đồng hồ thì là cấu hình R, ngược lại nếu a > b > c quay theo
ngược chiều kim đồng hồ thì là cấu hình S. a b S C d c
Khi nhìn trên công thức Fisher với nhóm thế nhỏ nhất nằm ở cạnh nằm ngang, 3
nhóm thế còn lại giảm dần theo cùng chiều kim đồng hồ ta có cấu hình S và ngược lại là R. Ví dụ:
1.2.3. Đồng phân cấu dạng a. Khái niệm
Đồng phân cấu dạng là những cấu trúc không gian sinh ra do sự quay của các
nguyên tử hoặc nhóm nguyên tử xung quanh liên kết C-C, ở mỗi mức độ dừng sẽ tồn
tại 1 cấu dạng và những cấu dạng đó được gọi là đồng phân cấu dạng của nhau.
b. Cấu dạng của các hợp chất mạch hở
- Công thức phối cảnh: Chiều liên kết C-C hướng theo đường chéo từ trái sang phải và
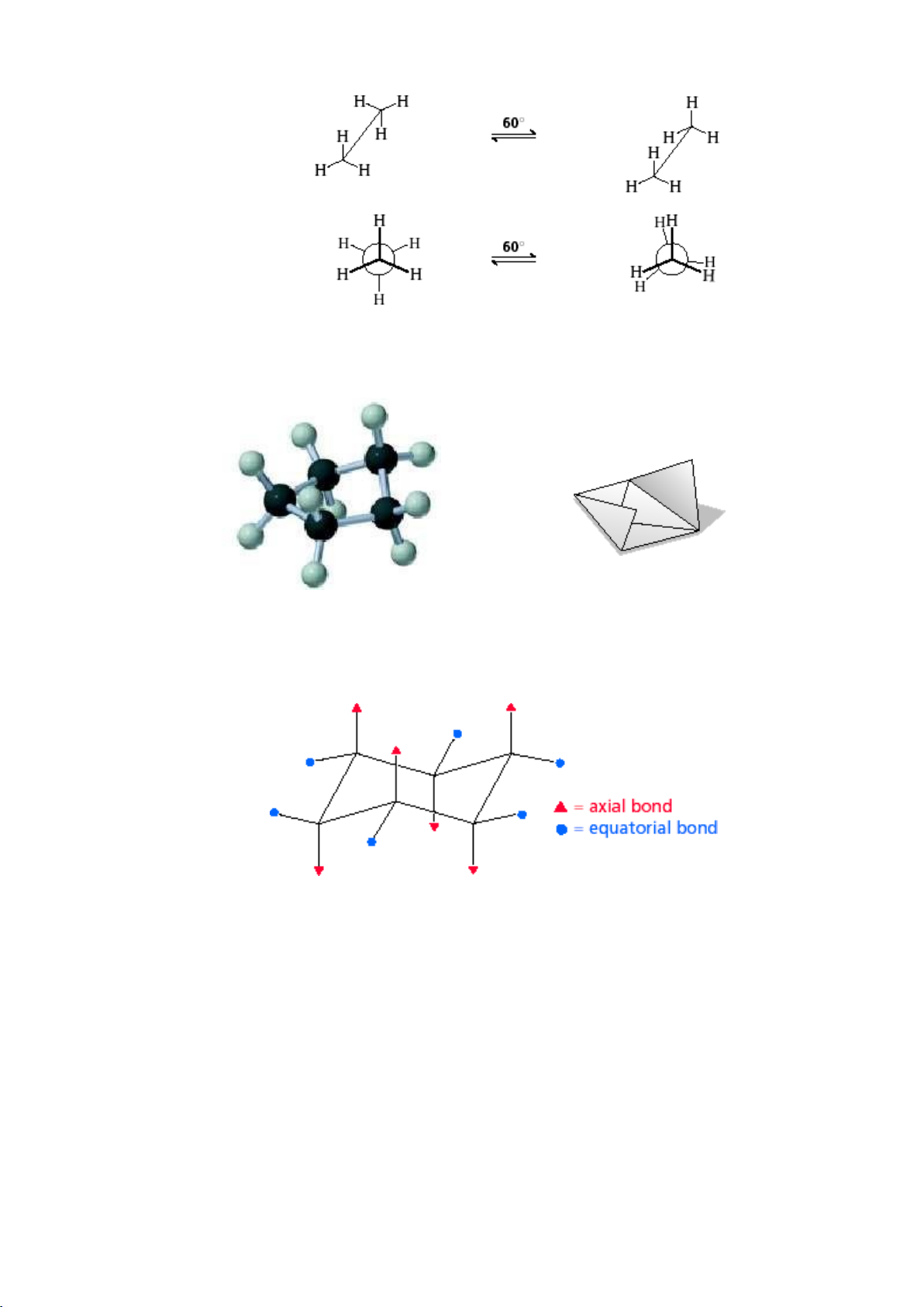
xa dần người quan sát, các nhóm thế ở dạng che khuất hoặc xen kẽ. - Công thức Newman:
Phân tử được nhìn dọc theo trục kiên kết C-C. Nguyên tử C bị che khuất hoàn
toàn và được biểu diễn bằng vòng tròn. Ví dụ: Phân tử C2H6 5 lOMoARcPSD|208 990 13
c. Cấu dạng của các hợp chất vòng - Vòng 5 cạnh
Hình 1.2. Mô hình phân tử cyclopentane - Vòng 6 cạnh
Hình 1.3. Cấu dạng của cyclohexane 6 lOMoARcPSD|208 990 13
Chương 2. LIÊN KẾT HÓA HỌC CÁC LOẠI HIỆU ỨNG TRONG HÓA HỮU CƠ
2.1. Liên kết hóa học trong hợp chất hữu cơ
2.1.1. Liên kết cộng hóa trị
2.1.1.1. Biểu diễn liên kết a. Công thức Lewis
Cấu trúc này dựa trên lý thuyết Lewis về liên kết: một nguyên tử có thể tạo
được một hay nhiều liên kết với các nguyên tử khác bằng cách góp chung electron cho
tới khi nào đạt được cấu hình electron tương tự khí hiếm gần đó.
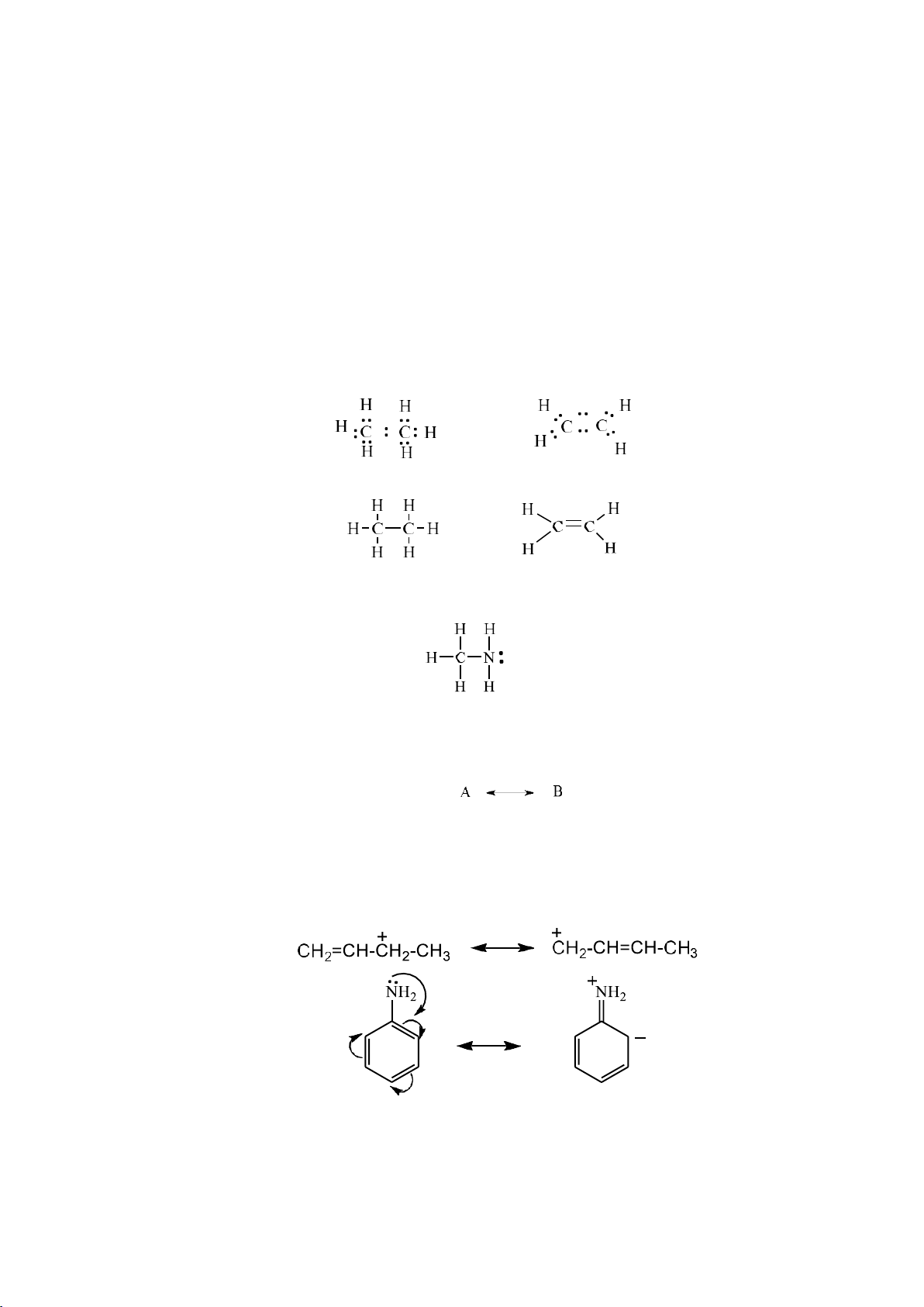
Mỗi cặp electron có thể được thay thế bằng một nét gạch:
Có những hợp chất có chứa cặp electron hóa trị không liên kết sẽ không dùng
chung giữa các nguyên tử.
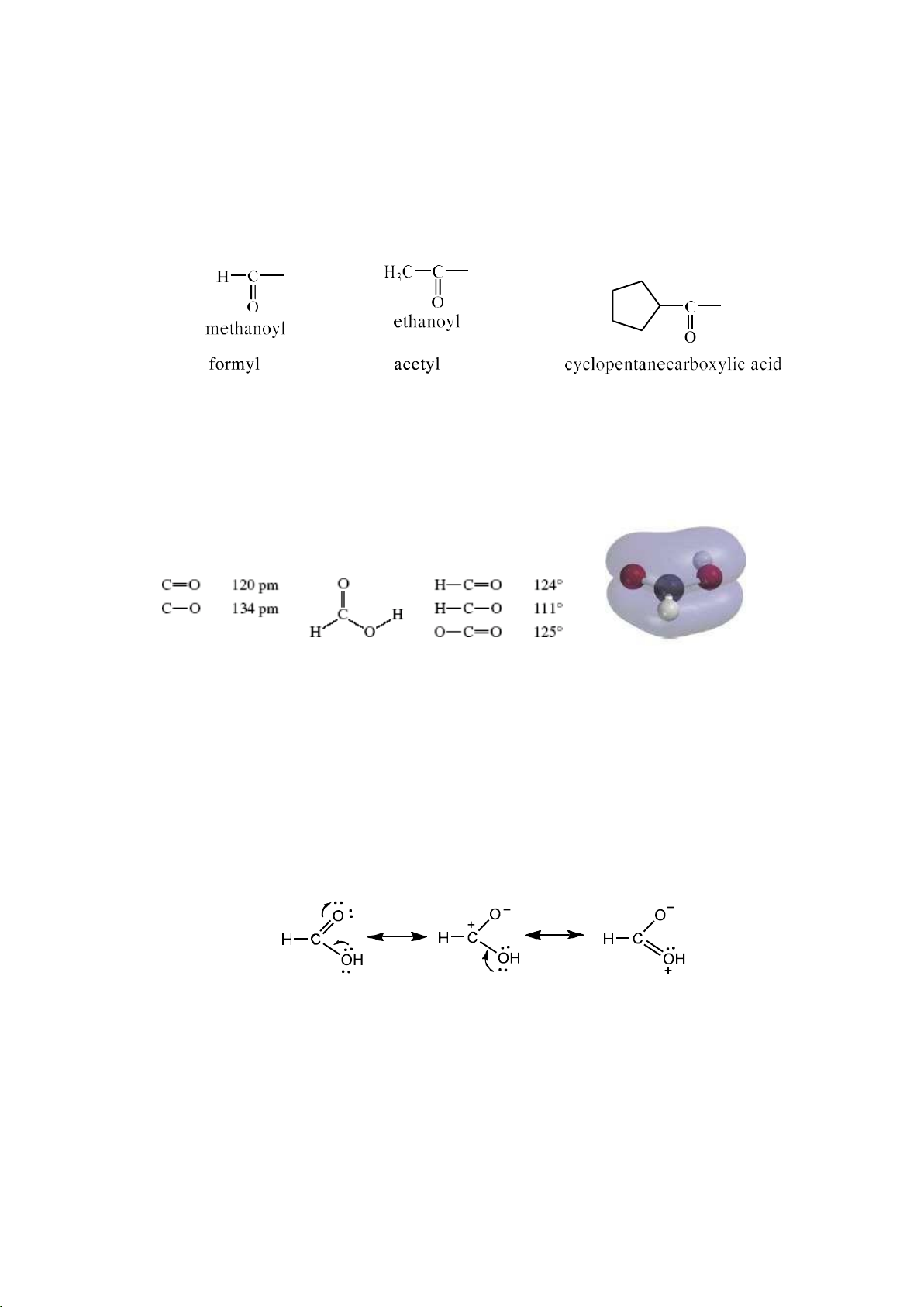
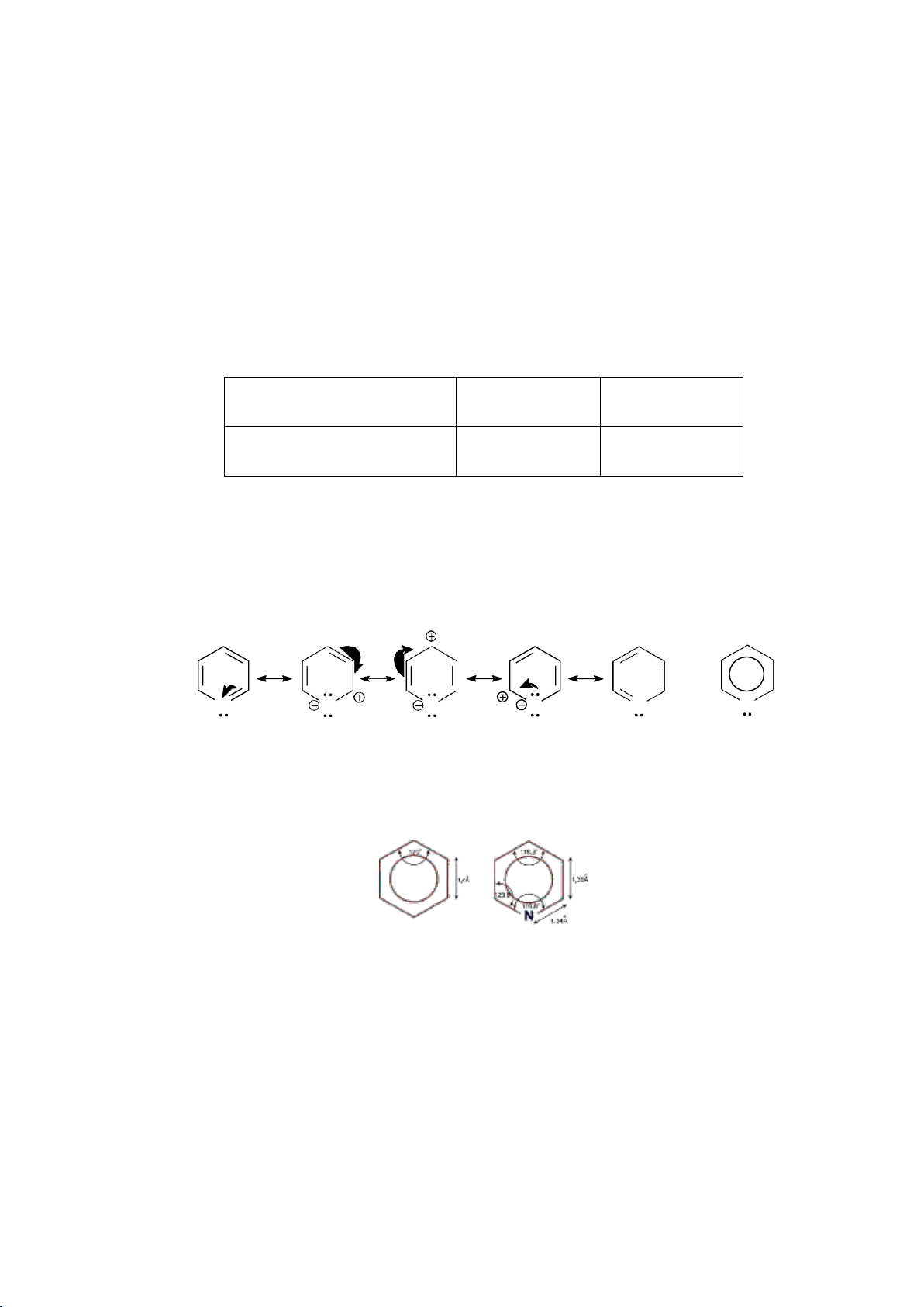
b. Công thức cộng hưởng
Công thức Lewis xem các eletron là cố định, tuy nhiên khi hai hay nhiều công
thức chỉ khác nhau về vị trí electron thì gọi là công thức cộng hưởng.
- Cách biểu diễn công thức cộng hưởng:
Bất kì một phân tử hay ion đều có công thức cộng hưởng và công thức cộng
hưởng không phải là công thức thực. Công thức này cho biết sự thay đổi vị trí electron
hay sự phân bố electron trong phân tử hoặc ion. Ví dụ:
2.1.1.2. Liên kết cộng hóa trị theo quan điểm hiện đại
a. Orbital nguyên tử 7 lOMoARcPSD|208 990 13
Orbital nguyên tử là khu vực không gian mang điện tích âm có các electron
chuyển động quanh hạt nhân, xác suất có mặt của electron trong khu vực này là lớn nhất.
Các orbital có hình dạng khác nhau và luôn có khuynh hướng xen phủ cực đại
với nhau khi tạo thành orbital liên kết để có độ bền lớn nhất.
Liên kết được hình thành sẽ có sự tổ hợp giữa các orbital tạo ra các orbital lai
hóa có khả năng xen phủ lớn hơn. Có các kiểu lai hóa sau: - Lai hóa sp
Khả năng xen phủ tương đối của orbital lai hóa sp: 1,93 - Lai hóa sp2
Khả năng xen phủ tương đối của orbital lai hóa sp2: 1,99 - Lai hóa sp3
Khả năng xen phủ tương đối của orbital lai hóa sp3: 2,00
Khả năng xen phủ: sp < sp2 < sp3 b. Orbital phân tử
Liên kết cộng hóa trị được hình thành bằng sự xen phủ của các orbital nguyên
tử tạo nên orbital phân tử chung cho tất cả các nguyên tử tham gia liên kết. * Liên kết σ:
- Sự hình thành liên kết σ:
Liên kết σ được hình thành do sự xen phủ của các orbital nguyên tử có trục liên
kết đối xứng là đường thẳng nối tâm 2 hạt nhân nguyên tử.
- Đặc điểm của liên kết σ:
+ Trục liên kết có tính chất đối xứng.
+ Các nguyên tử hoặc nhóm nguyên tử ở hai đầu liên kết có thể quay tự do mà
không mất đi sự xen phủ. 8 lOMoARcPSD|208 990 13
+ Năng lượng liên kết σ lớn liên kết bền. * Liên kết :
- Sự hình thành liên kết :
Liên kết được hình thành là do sự xen phủ của orbital p (thuần khiết) theo
trục song song với nhau, vùng xen phủ nằm ở hai bên trục nối tâm của hai hạt nhân
nguyên tử, hay nói cách khác trục liên kết sẽ vuông góc với trục nối tâm.
- Đặc điểm của liên kết :
+ Không có tính chất đối xứng.
+ Các nguyên tử hoặc nhóm nguyên tử ở hai đầu liên kết không thể quay tự do
vì khi quay tự do liên kết sẽ bị phá vỡ.
+ Năng lượng của liên kết nhỏ hơn năng lượng liên kết Liên kết dễ bị
phá vỡ hơn. Điều đó có thể giải thích được tính chất hóa học của các hợp chất hữu cơ
c. Lai hóa và sự hình thành liên kết đơn, liên kết đôi, liên kết ba, hệ liên hợp
- Liên kết đơn: Trong phân tử chỉ có sự hình thành liên kết đơn, nguyên tử C ở trạng thái lai hóa sp3.
- Liên kết đôi: Trong phân tử có chứa liên kết đôi, nguyên tử C mang nối đôi ở trạng thái lai hóa sp2.
- Liên kết ba: Trong phân có chứa liên kết ba, nguyên tử C mang nối ba ở trạng thái lai hóa sp.
- Hệ liên hợp :Trong phân có chứa hệ liên hợp, nguyên tử C tham gia hệ liên hợp ở trạng thái lai hóa sp2
2.1.2. Liên kết hydrogen a. Khái niệm
Liên kết hydrogen là liên kết được hình thành giữa 1 nguên tử H đã tham gia
liên kết cộng hóa trị với một nguyên tử khác cũng đã tham gia liên kết cộng hóa trị và còn chứa cặp e tự do.
b. Điều kiện hình thành 9 lOMoARcPSD|208 990 13
Liên kết hydrogen X-H…Y được hình thành khi:
- Liên kết cộng hóa trị X-H phải phân cực mạnh, H giàu mật độ điện tích dương
- Y giàu mật độ điện tích âm, có cặp e tự do và có độ âm điện lớn (Y thường là: halogen, O, N). c. Đặc điểm
- Liên kết hydrogen có bản chất của tương tác tĩnh điện. Đây là loại liên kết yếu (E=5-7 KCal/mol). d. Phân loại
Có 2 loại là liên kết hydrogen nội phân tử và liên kết hydrogen liên phân tử.
Liên kết hydrogen nội phân tử bền hơn liên kết hydrogen liên phân tử, khi đã tạo liên
kết hydrogen nội phân tử thì không tạo được hydrogen liên phân tử.
e. Tính chất của các chất có hình thành liên kết hydrogen
- Nhiệt độ sôi, nhiệt độ nóng chảy tăng.
- Khả năng hòa tan tăng khi hình thành được liên kết hydrogen giữa chất tan và dung môi.
2.2. Các loại hiệu ứng trong phân tử hợp chất hữu cơ
2.2.1. Hiệu ứng cảm ứng (I) 2.2.1.1. Khái niệm
Hiệu ứng cảm ứng là hiệu ứng gây ra do sự dịch chuyển mật độ electron dọc theo
mạch liên kết σ do sự phân cực của một liên kết nào đó. 2.2.1.2. Phân loại Có 2 loại:
- Hiệu ứng cảm ứng dương (+I): là hiệu ứng gây ra bởi các nhóm thế đẩy electron, thường là nhóm alkyl.
- Hiệu ứng cảm ứng âm (-I): là hiệu ứng gây ra bởi các nhóm thế hút electron. Đó
thường là các nhóm chứa liên kết không no hay các nhóm mà nguyên tử của nó còn
chứa các cặp electron tự do.
Ví dụ: Halogen, -OH, -NH2, -NR2, -COOH, -CHO, -NO2...
2.2.1.3. Đặc điểm hiệu ứng cảm ứng
- Có khả năng lan truyền dọc theo mạch liên kết σ.
- Lực cảm ứng giảm dần khi lan truyền trên mạch C và không phụ thuộc vào sự áng ngữ không gian. 2.2.1.4. Quy luật
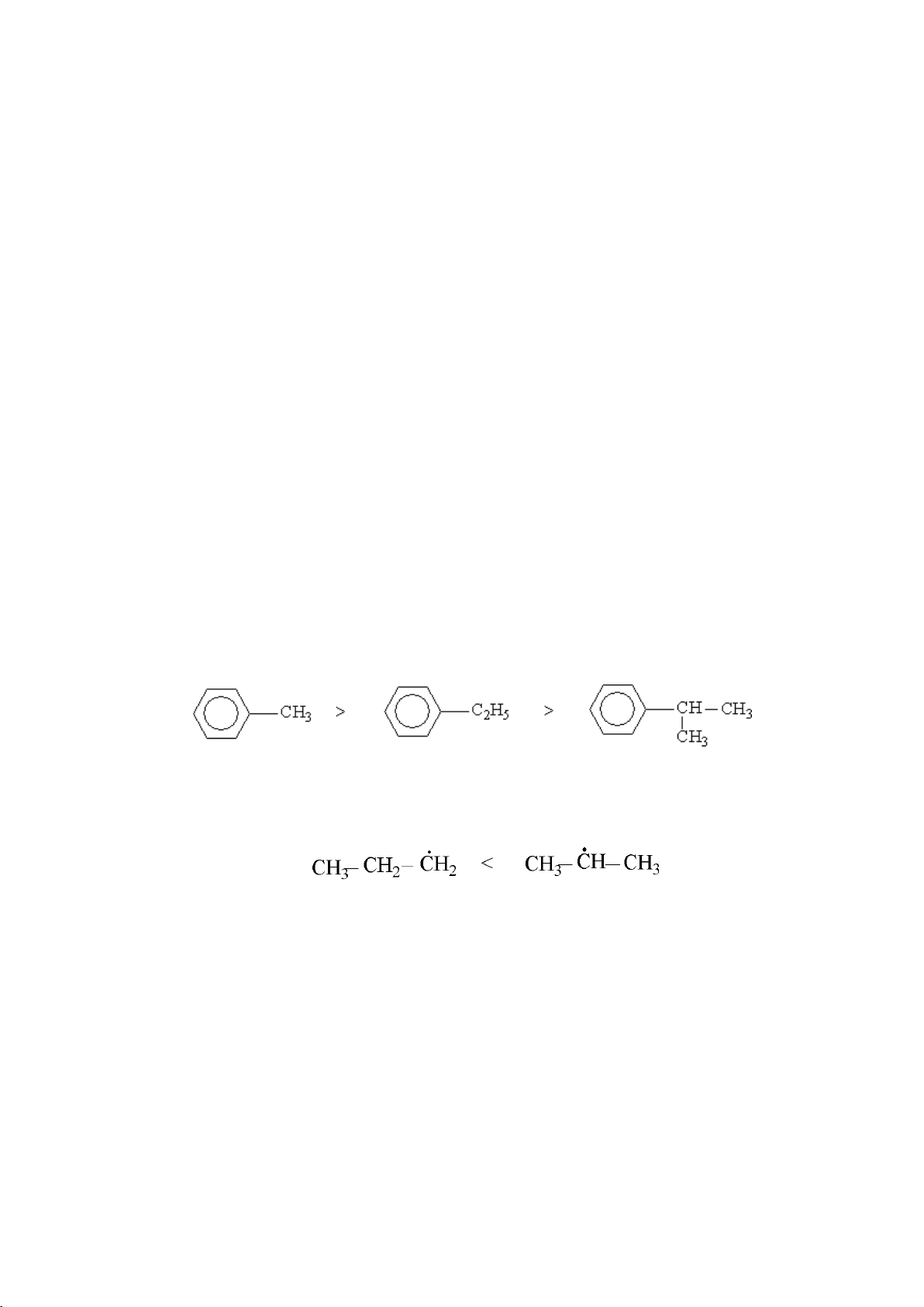
- Gốc hydrocarbon no có hiệu ứng +I, lực +I càng lớn khi độ phân nhánh càng cao.
- Gốc hydrocarbon không no có hiệu ứng –I, lực –I càng lớn khi độ chưa no càng cao.
- Các phi kim có hiệu ứng –I, hiệu ứng –I càng cao khi nguyên tố tương ứng càng ở
bên phải trong chu kỳ và càng ở trên trong một phân nhóm.
- Các nhóm mang điện tích dương có hiệu ứng –I, các nhóm mang điện tích âm có
hiệu ứng +I. Điện tích càng lớn thì lực của hiệu ứng càng lớn. 10 lOMoARcPSD|208 990 13
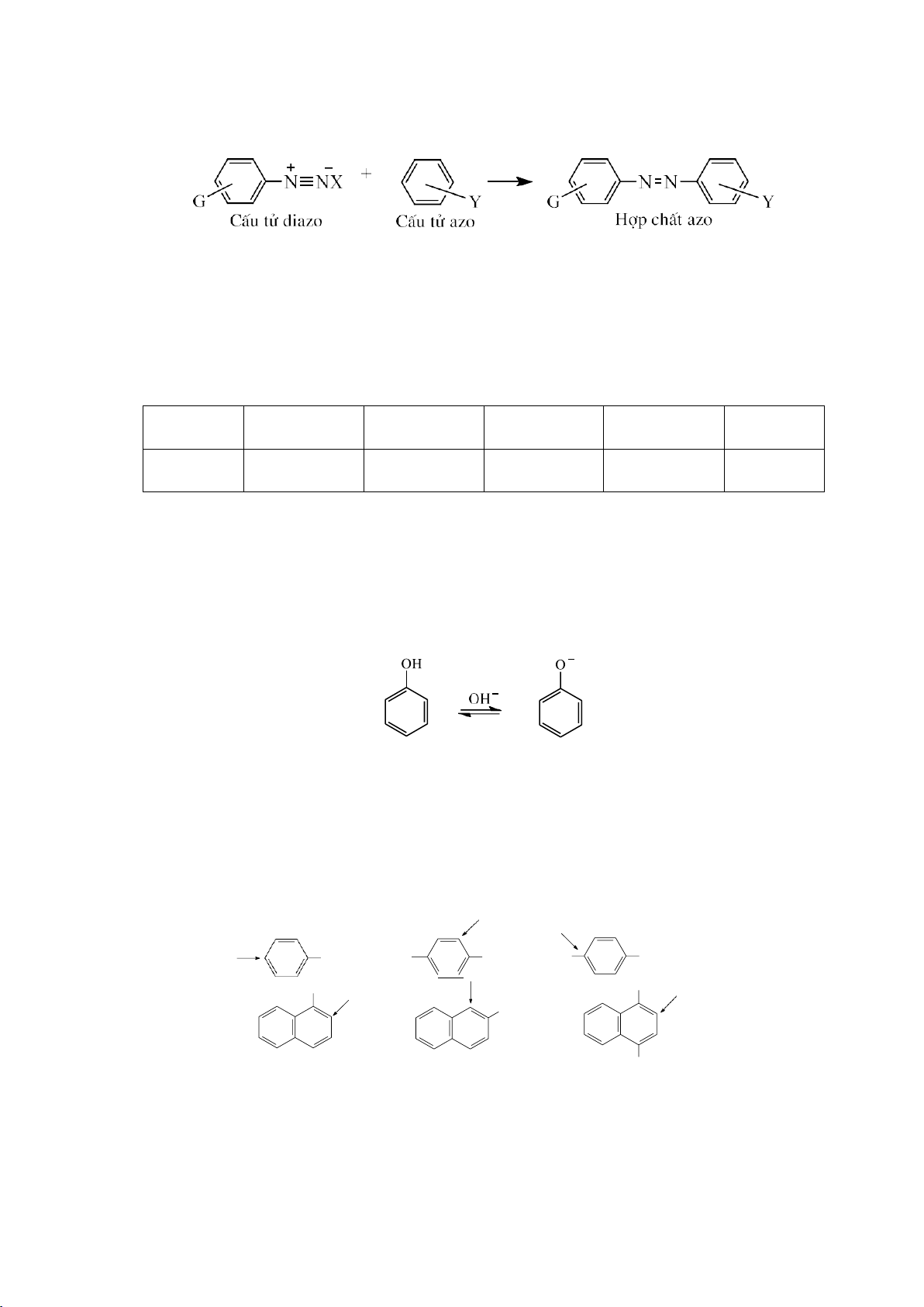
2.2.2. Hiệu ứng liên hợp (C) 2.2.2.1. Hệ liên hợp
Hệ liên hợp có 2 loại :
- Hệ gồm các liên kết π luân phiên cách đều nhau bởi một liên kết đơn, đó là hệ π-π.
- Hệ trong đó có liên kết bội ở cách orbital p một liên kết đơn, hệ đó gọi là p-π, obitan
p đó có thể là của C hoặc của nguyên tử khác chứa electron hoặc obitan trống. Ví dụ: 2.2.2.2. Khái niệm
Hiệu ứng liên hợp là hiệu ứng gây ra do sự phân cực lan truyền của các electron
trong hệ liên hợp khi có sự dịch chuyển electron π hoặc p nào đó của hệ, nói một cách
đơn giản nhất là sự dịch chuyển electron đối với hệ liên hợp. 2.2.2.3. Phân loại
Hiệu ứng liên hợp có 2 loại:
Hiệu ứng liên hợp dương (+C): +C gây ra bởi các nhóm thế đẩy electron, thường
xuất hiện trên hệ liên hợp p- π. Ví dụ:
Hiệu ứng liên hợp âm (-C): -C gây ra bởi các nhóm thế hút electron, thường xuất hiện trên hệ π-π Ví dụ: O CH2=CH C H
2.2.2.4. Đặc điểm của hiệu ứng liên hợp
- Hiệu ứng liên hợp ít bị biến đổi khi kéo dài mạch liên hợp.
- Hiệu ứng liên hợp chỉ xuất hiện trên hệ liên hợp phẳng, tức là hệ liên hợp chứa các orital giải tỏa.
2.2.2.5. Quy luật hiệu ứng liên hợp
a. Hiệu ứng liên hợp dương:
Các nhóm gây hiệu ứng +C nói chung đều có nguyên tử chứa cặp electron dư (-OH,
-NH2, -OR, -NR2, Halogen). Các nhóm thế này ngoài hiệu ứng +C còn có –I ở những mức
độ khác nhau và mỗi nhóm đều thể hiện hiệu ứng tổng quát của hai hiệu ứng trên. * Quy luật:
- Nhóm mang điện tích âm có hiệu ứng +C lớn hơn các nhóm không mang điện. 11 lOMoARcPSD|208 990 13
- Hiệu ứng +C giảm dần khi số thứ tự của nguyên tử tăng trong một chu kỳ hoặc một phân nhóm.
b. Hiệu ứng liên hợp âm:
- Hiệu ứng liên hợp âm –C thường xuất hiện trên hệ π-π ( -C=C-C=Z ) * Quy luật:
- Z càng ở bên phải chu kỳ thì hiệu ứng –C càng tăng
- Nhóm mang điện tích dương sẽ có hiệu ứng –C lớn hơn so với nhóm không mang điện.
- Z càng tham gia vào liên kết bội thì hiệu ứng -C càng cao
*Lưu ý: Những nhóm có hiệu ứng liên hợp có dấu không xác định
Một số nhóm sẽ có hiệu ứng +C hay –C tùy thuộc vào nhóm liên kết với chúng, đó thường là các nhóm
CH2=CH- : vinyl và nhóm C6H5- : phenyl
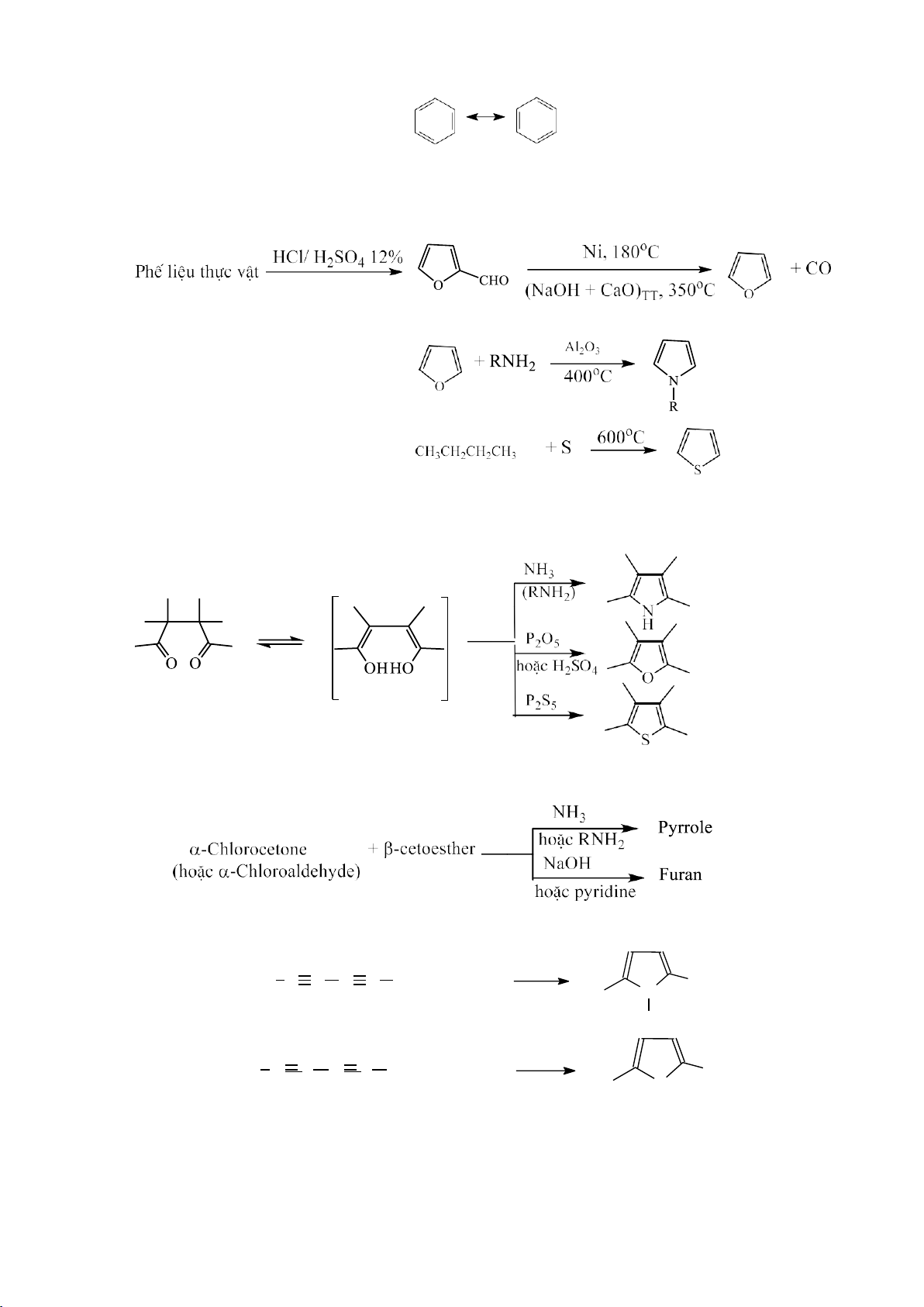
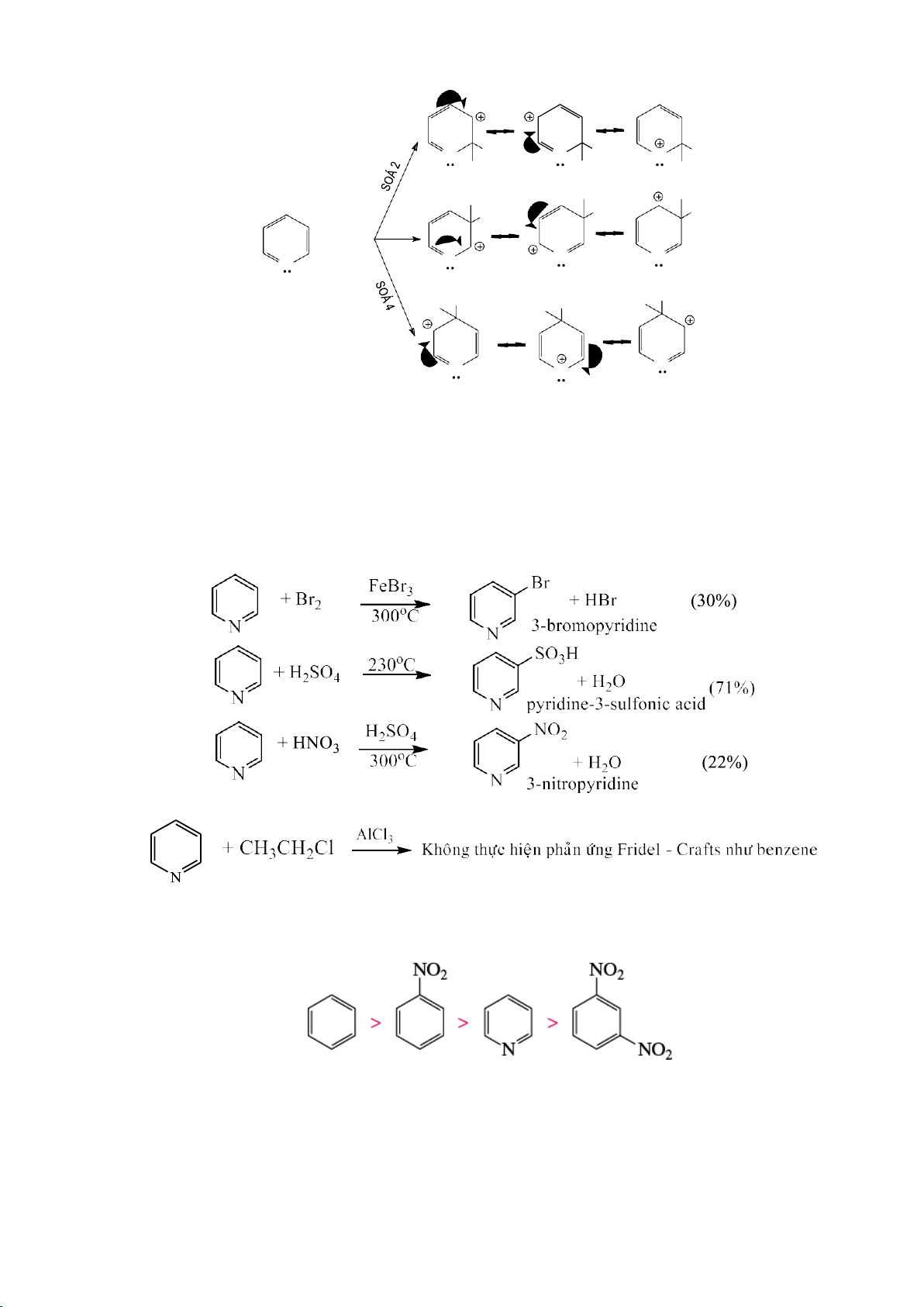
2.2.3. Hiệu ứng siêu liên hợp (H) 2.2.3.1. Khái niệm
Hiệu ứng siêu liên hợp là hiệu ứng xuất hiện khi trong phân tử có các liên kết σ
C-H (hoặc C-F) ở vị trí liên hợp với liên kết bội, hoặc với nguyên tử chứa orbital p. 2.2.3.2. Phân loại
- Hiệu ứng siêu liên hợp dương (+H) gây ra do các liên kết σ C-H đẩy e về liên kết bội hoặc orbital p.
- Hiệu ứng siêu liên hợp âm (-H) gây ra do các liên kết σ C-F hút e từ liên kết bội. Ví dụ: +H : 3 σC-H 2 σC-H 1 σC-H
Hiệu ứng siêu liên hợp thường dùng để giải thích độ bền các cation, anion. Khi
số liên kết σ C-H ở vị trí liên hợp với obitan p hoặc π càng lớn thì cấu tử đó càng bền. 12 lOMoARcPSD|208 990 13
Chương 3. PHẢN ỨNG HỮU CƠ
3.1. Phân loại phản ứng
3.1.1. Phân loại dựa vào chiều hướng phản ứng
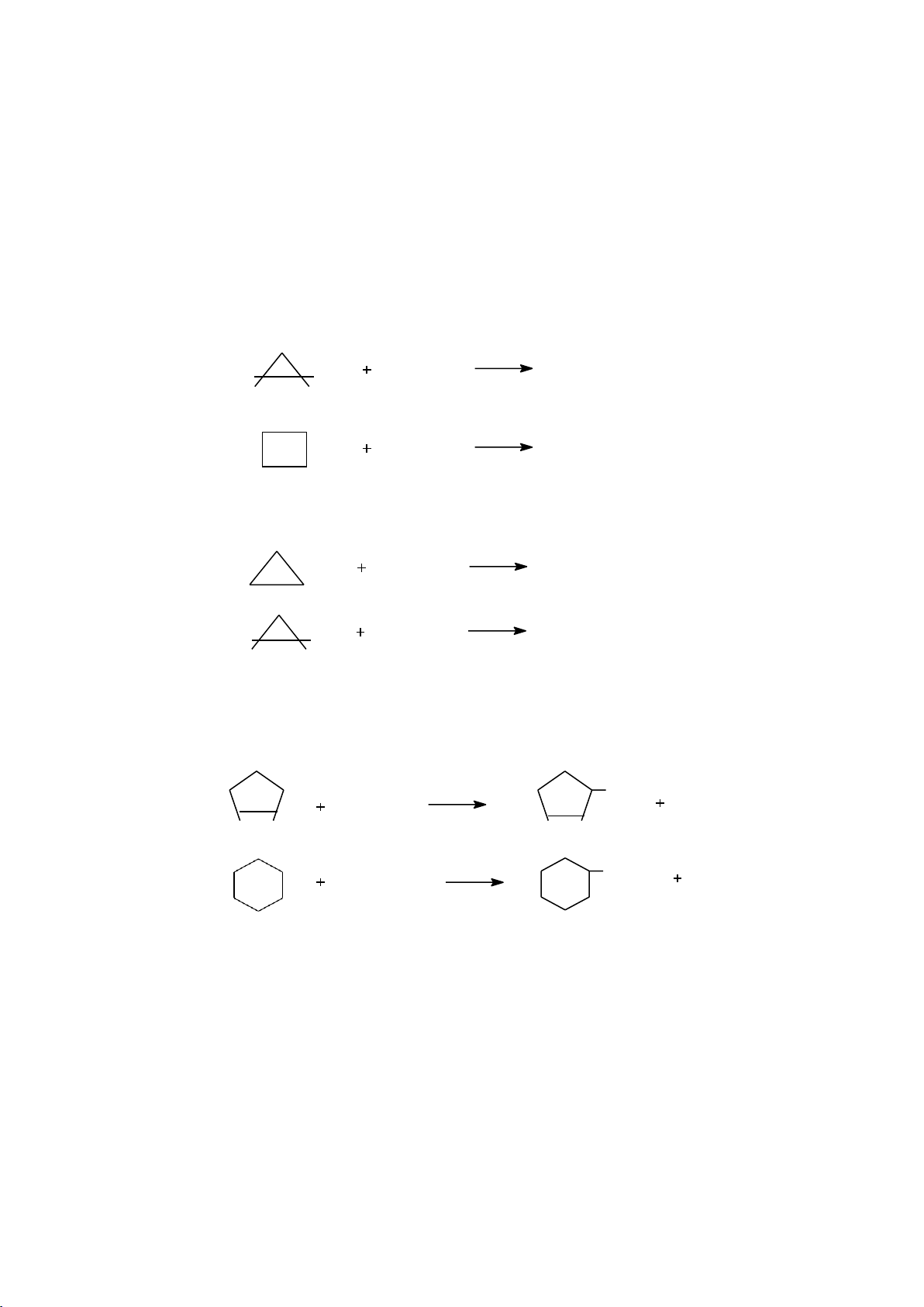
- Phản ứng thế (S): là phản ứng trong đó một nguyên tử hay nhóm nguyên tử được
thay thế bằng một nguyên tử hay nhóm nguyên tử khác. Ví dụ:
- Phản ứng cộng (A): là phản ứng có sự kết hợp của hai hay nhiều phân tử nhỏ tạo ra
phân tử mới mà không có sự tách loại bớt nguyên tử hoặc nhóm nguyên tử nào. Trong
trường hợp các phân tử nhỏ giống nhau thì gọi là phản ứng trùng hợp. Ví dụ:
- Phản ứng tách (E): là phản ứng trong đó một phân tử bị loại đi một số nguyên tử để
tạo ra một phân tử mới có chứa liên kết không no. Ví dụ:
- Phản ứng phân hủy: là phản ứng trong đó phân tử chất phản ứng bị phá hủy tạo ra
những chất khác nhỏ hơn. Ví dụ:
- Phản ứng đồng phân hóa: là phản ứng trong đó có sự thay đổi vị trí liên kết hoặc vị
trí nguyên tử trong phân tử mà không làm thay đổi công thức phân tử. Ví dụ:
3.1.2. Phân loại dựa vào cách phân cắt liên kết - Phản ứng đồng ly Ví dụ: - Phản ứng dị ly Ví dụ: 13 lOMoARcPSD|208 990 13
3.2. Tác nhân phản ứng hữu cơ X-Y + Z → X-Z + Y Chất phản ứng tác nhân
- Tác nhân gốc tự do: được hình thành trong các phản ứng có chất xúc tác, chất khơi
mào, điều kiện chiếu sáng hoặc nhiệt độ. Ví dụ: gốc tự do Cl.
- Tác nhân electrophile: Z gọi là tác nhân electrophile (E+): là những tác nhân mang điện
tích dương như cation hoặc phân tử trung hòa trong đó có chứa nguyên tử thiếu electron. Ví dụ: Br+, H + 3O+, NO2 , SO3…
- Tác nhân nucleophile: Z gọi là tác nhân nucleophile (Nu-) là những anion hay nhóm
mang điện tích âm hoặc những phân tử trung hòa chứa nguyên tử dư electron (còn cặp electron). - - -
Ví dụ : CN , Br , OH , H2O, ROH, NH3, RNH2, ....
3.3. Cơ chế phản ứng hữu cơ
- Cơ chế phản ứng là con đường chi tiết mà phản ứng diễn ra từ chất đầu đến chất cuối
qua các giai đoạn và trạng thái trung gian với tất cả các yếu tố bên trong và điều kiện
bên ngoài có ảnh hưởng đến chiều hướng phản ứng.
- Các tiểu phân trung gian trong phản ứng: + Gốc carbo tự do Gốc carbo tự do + Carbocation Carbocation + Carbanion Carbanion
3.3.1. Cơ chế phản ứng cộng
3.3.1.1. Cơ chế phản ứng cộng electrophile (AE)
Phản ứng xảy ra qua hai giai đoạn, giai đoạn chậm quyết định tốc độ phản ứng
là giai đoạn tác nhân electrophile tấn công vào liên kết kép carbon-carbon và hình 14 lOMoARcPSD|208 990 13
thành tiểu phân trung gian là một carbocation. Carbocation không bền nên dễ dàng kết
hợp nhanh với tác nhân giàu electron để tạo sản phẩm. Cơ chế tổng quát: + - châm C C + X Y X- C - C - + Y- X- C - C - + Y- nhanh X- C - C - Y (hay dung môi) - XY là Hal , Hal- Hal + , H-Hal , H’ OSO H, H-OH, Hal- OH… 2 3 Ví dụ: + CH CH 3 CH = CH CH3 + HBr CH3 CH CH CH3 3CHCH2CH3 + Br- - + H Br CH3CHCH2CH3 + Br- CH3CHCH2CH3 CH3CHCH2CH3 - Br Br
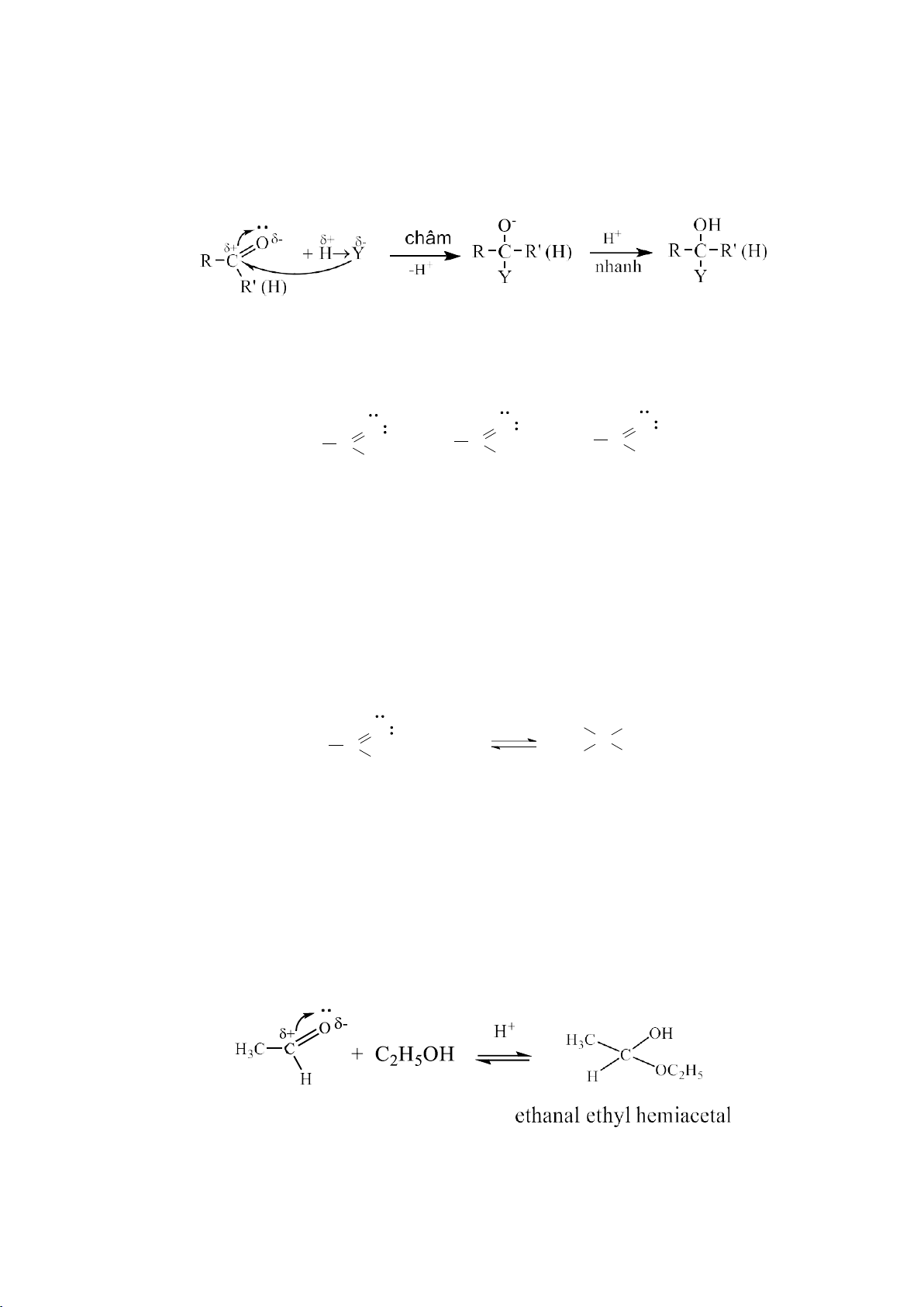
3.3.1.2. Cơ chế phản ứng cộng nucleophile (AN) Cơ chế tổng quát :
HY là H-OH, H-CN, HOR, HSO3Na…
XY hay gặp là R-MgX, HC≡CNa … Ví dụ:
3.3.2. Cơ chế phản ứng thế
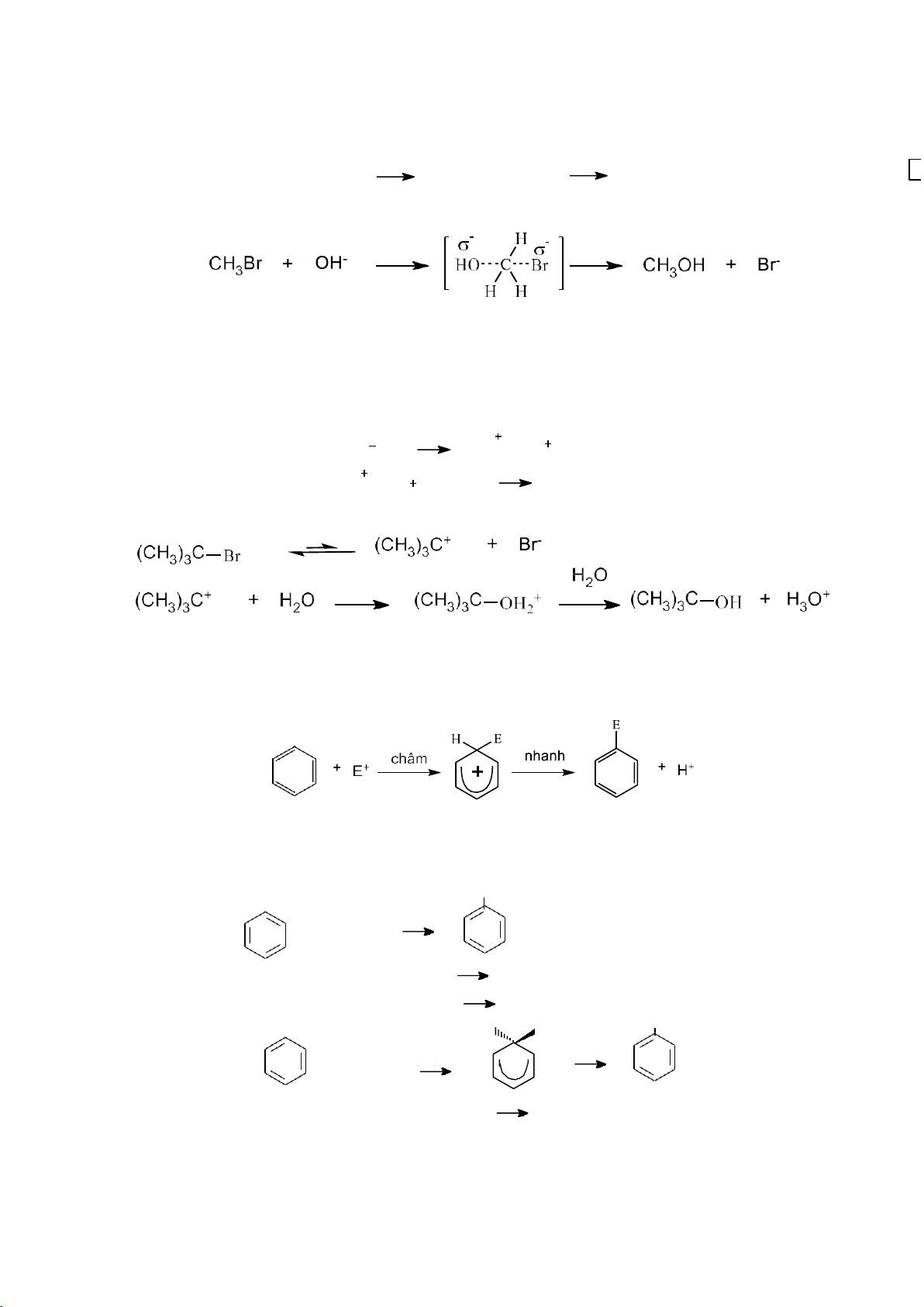
3.3.2.1. Cơ chế phản ứng thế nucleophile (SN) Cơ chế tổng quát: R- X + Y- R- Y + X- X : Halogen, OH, OR
Y : OH- ,OR-, Hal-, RCOO- , CN-, ... H2O, NH3, RNH2, ...
a. Cơ chế phản ứng thế lưỡng phân tử (SN2) 15 lOMoARcPSD|208 990 13
Phản ứng gồm một giai đoạn đi qua trạng thái chuyển tiếp trước khi tạo thành sản phẩm - - Y- + R-X Y...R ...X Y-R + X- Ví dụ:
b. Cơ chế phản ứng thế đơn phân tử (SN1)
Phản ứng gồm hai giai đoạn, giai đoạn chậm hình thành carbocation,
carbocation không bền sẽ kết hợp nhanh với bất cứ tác nhân nucleophile nào xung
quanh để tạo sản phẩm . châm - R X R X - R Y nhanh RY Ví dụ:
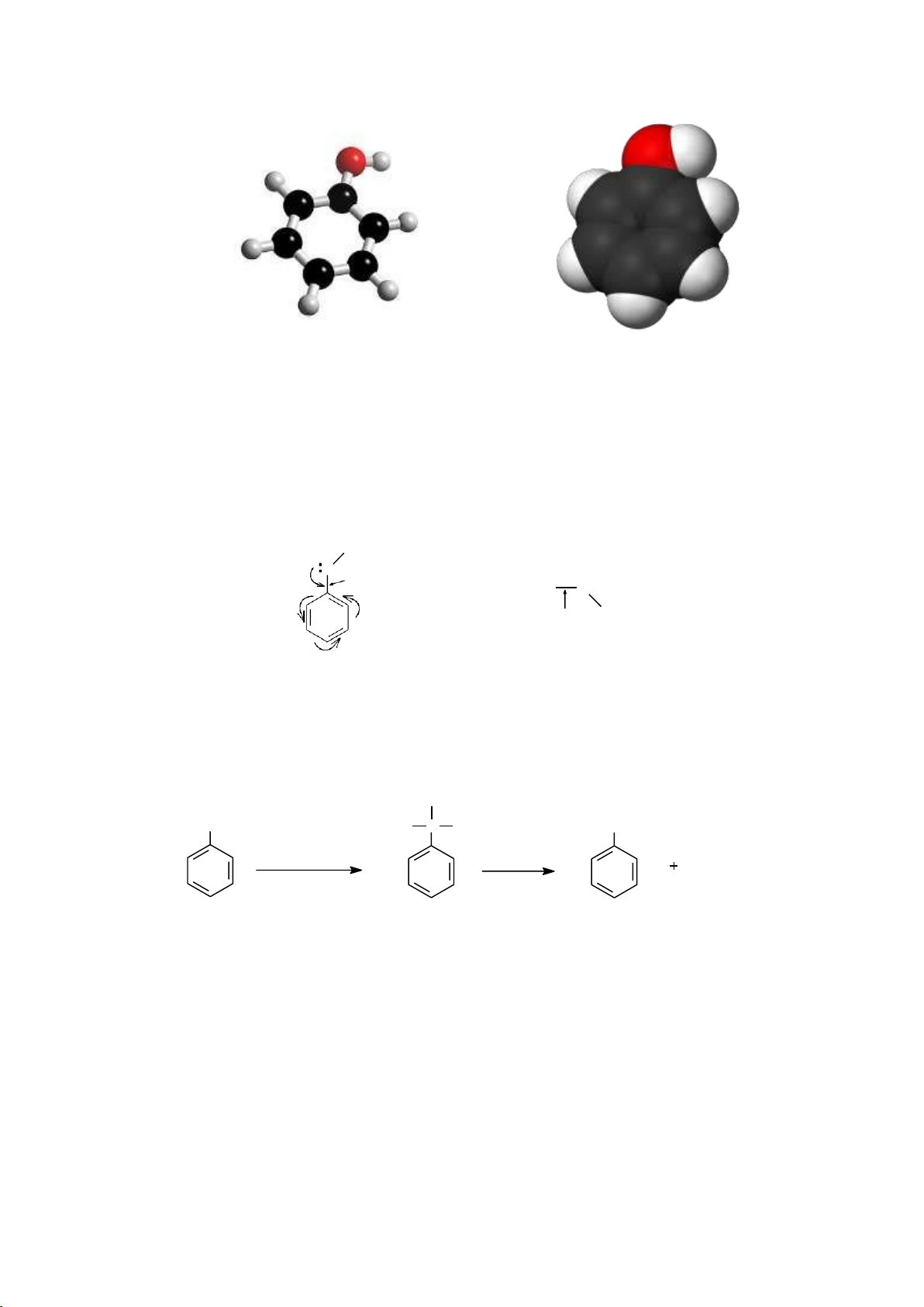
3.3.2.2. Cơ chế phản ứng thế electrophile vào vòng benzene (SEAr)
Cơ chế phản ứng: tác nhân electrophile tấn công vào vòng benzene ở giai đoạn
chậm hình thành phức δ và nguyên tử hydrogen tách ra ở giai đoạn nhanh. E+ có thể là Br+, NO + 2 , R+…. Ví dụ: Cl Fe + Cl HCl 2 + Cô cheá: Fe + Cl2 FeCl3 + - FeCl + Cl FeCl 3 4 H E Cl + chậm nhanh + + Cl chaäm + + H - H+ + FeC 4 l FeCl3 + HCl 16 lOMoARcPSD|208 990 13
3.3.3. Cơ chế phản ứng tách (E) Cơ chế tổng quát:
X là nhóm có chứa nguyên tử có độ âm điện lớn
a. Cơ chế tách lưỡng phân tử (E2)
Cơ chế phản ứng E2 là phản ứng một giai đoạn qua trạng thái chuyển tiếp - .... - - - Y + H C C X Y .... H .... C C .... X YH + C = C + X trang thái chuyên tiêp X : Cl , Br, I , OSO2Ar… Y : OH- , OR-, NR3 Ví dụ: H Br H Br H H C C C C C2H5OH H C C H H H H 2O Br H H H H H H HO OH
b. Cơ chế tách đơn phân tử (E1)
Cơ chế phản ứng E1 là phản ứng đơn phân tử qua hai giai đoạn, hình thành
carbocation ở giai đoạn chậm, X: Cl , Br , I , … Ví dụ: CH3 C2H5OH CH CH C O C H 3 2 2 5 H+ CH CH C(CH ) C CH 2H5OH CH CH C(CH ) 3 3 2 3 2 25oC 3 2 3 2 (66%) CH Br 3 CH3CH C(CH3)2 CH3CH2C CH H+ 2 (27%) (7%) 17 lOMoARcPSD|208 990 13 CÂU HỎI ÔN TẬP
1. Phân biệt các khái niệm sau: cấu tạo hóa học, cấu trúc hóa học của phân tử, đồng
phân cấu tạo, đồng phân lập thể.
2. Điều kiện để hợp chất hữu cơ tồn tại đồng phân hình học, đồng phân quang học.
3. Hãy xác định cấu hình (Z, E), (R,S) của các hợp chất sau: H Cl Cl CH3 C=C C=C F Br H CH2OH COOH CHO CHO HO H H OH HO H H OH CH3 CH2OH CH2OH
4. Phân biệt các khái niệm: đồng phân đối quang, đồng phân đia, hợp chất meso.
5. Xác định các đồng phân quang học của hợp chất: CH3CH(OH)CH(OH)CH3.
6. Trình bày các kiểu xen phủ và các kiểu lai hóa thường gặp trong Hóa hữu cơ.
7. So sánh và giải thích sự khác nhau về nhiệt độ sôi của các chất sau: OH OH OH OH OH OH (1) (2) (3) 7. Cho 2 hợp chất sau: HO C C O CH O CH 3 OH 3
Hãy so sánh nhiệt độ sôi và độ tan trong dung môi không phân cực của 2 chất trên.
8. Sắp xếp và giải thích trật tự biến đổi độ bền của các cation, anion và gốc cacbo tự do sau: - - - -
a. CH3CH2COO , CH3CHBrCOO , CH3CHFCOO , CH3CHClCOO 18 lOMoARcPSD|208 990 13 + +NH + + NH3 3 NH NH 3 3 b. CH3 NO2 CH3 . . . c. (C6H5)3C C6H5CH2 (C6H5)2C H 19 lOMoARcPSD|208 990 13
Chương 4. HYDROCARBON NO
Hydrocarbon no là những hợp chất chỉ chứa C và H, trong đó C ở trạng thái lai
hóa sp3 tức trong phân tử chỉ tồn tại các liên kết đơn. Hydrocarbon no bao gồm: - Dạng mạch hở: alkane
- Dạng mạch vòng: cycloalkane 4.1. Alkane
4.1.1. Danh pháp, đồng phân, cấu trúc 4.1.1.1. Danh pháp * Nguyên tắc:
- Chọn mạch chính là mạch dài nhất có chứa nhiều nhánh nhất.
- Đánh số mạch chính từ phía gần nhánh hơn sao cho số chỉ vị trí của nhánh nhỏ nhất
- Gọi tên nhánh theo thứ tự bảng chữ cái.
- Nếu có nhiều nhánh giống nhau thì trước tên gọi thêm các tiền tố: di, tri…
Tên alkane: số chỉ vị trí nhánh + tên mạch nhánh + tên mạch chính Ví dụ:
* Tên gốc: Các nhóm hóa trị một được hình thành bằng cách loại bớt một nguyên tử H
ra khỏi phân tử alkane và được gọi chung là alkyl. Có hai cách gọi tên:
- Đổi hậu tố -ane của alkane thành –yl.
- Thêm hậu tố -yl vào tên của alkane kèm theo chỉ số chỉ vị trí cho hóa trị tự do.
Ví dụ: CH3-CH2-CH2-CH2-CH3 : pentane →
CH3-CH2-CH2-CH2-CH2- : pentyl hoặc pentan-1-yl 4.1.1.2. Đồng phân
Alkane có các loại đồng phân:
- Đồng phân cấu tạo: xuất hiện khi n = 4 trở lên
- Đồng phân lập thể: khi trong phân tử alkane có C* sẽ xuất hiện đồng phân quang học, khi đó n ≥ 7. 4.1.1.3. Cấu trúc
- Alkane tồn tại dạng đường gấp khúc: 20 lOMoARcPSD|208 990 13 butane
2-methylhexane 3-methyl-4-propylheptane 6-ethyl-2,3-dimethylnonane
Hình 4.1. Mô hình phân tử của decane
4.1.2. Phương pháp điều chế
4.1.2.1. Giữ nguyên mạch carbon a. Khử Bectolo CnH2n+1OH + HI CnH2n+1I + H2O CnH2n+1I + HI CnH2n+2 + I2
Phản ứng xảy ra với sự có mặt của P đỏ ở 2000C 2P + 3I2 2PI3 PI3 + H2O H3PO3 + HI
Sự có mặt của P đỏ để tạo HI – chính là tác nhân khử alcohol về alkane
b. Phản ứng hydrogen hóa alkyne, alkene (xúc tác Pd, Ni) Xúc tác Pd, Ni. Ví dụ:
4.1.2.2. Phương pháp tăng mạch carbon a. Tổng hợp Wurtz ether khan 2 R X 2 Na R R 2 NaX 21 lOMoARcPSD|208 990 13 2 C2H5Br 2 Na ether khan C 2H5 C2H5 2 NaBr b. Tổng hợp Kolbe
Điện phân dung dịch muối sodium của carboxylic acid: 2RCOONa + 2H2O R-R + 2CO2 + 2NaOH + H2
c. Phương pháp Corey-House R2CuLi + R’X R-R’ + RCu + LiX
- Lithium dialkylcuprate có thể điều chế: RX +2Li → RLi + LiX 2Rli + CuI → R2CuLi + LiI
- Phương pháp này có thể điều chế cả hydrocarbon không no khi đi từ R’X không no.
4.1.2.3. Phương pháp giảm mạch carbon RCOONa + NaOH r CaOr RH + Na2CO3 toC
Vai trò của CaO là tạo ra sự xốp vì đây là phản ứng điều chế các alkane có số C
nhỏ ở trạng thái khí nên để dễ thoát khí, đồng thời cũng giảm sự ăn mòn thủy tinh.
4.1.3. Tính chất vật lý
- Bốn chất đầu tiên trong dãy đồng đẳng là chất khí, alkane cố số nguyên tử C từ
C5 - C19 là chất lỏng, từ C20 là chất rắn.
- Đối với alkane không phân nhánh khi số nguyên tử C tăng thì nhiệt độ sôi của alkane tăng.
- Nhiệt độ sôi của alkane phân nhánh thấp hơn so với n-alkane.
- Nhiệt độ nóng chảy của alkane tăng dần trong dãy đồng đẳng. - Alkane nhẹ hơn nước.
- Alkane không tan trong nước, tan trong ether, dẫn xuất halogen và các hydrocarbon khác.
4.1.4. Tính chất hóa học
4.1.4.1. Các phản ứng ở liên kết C-H
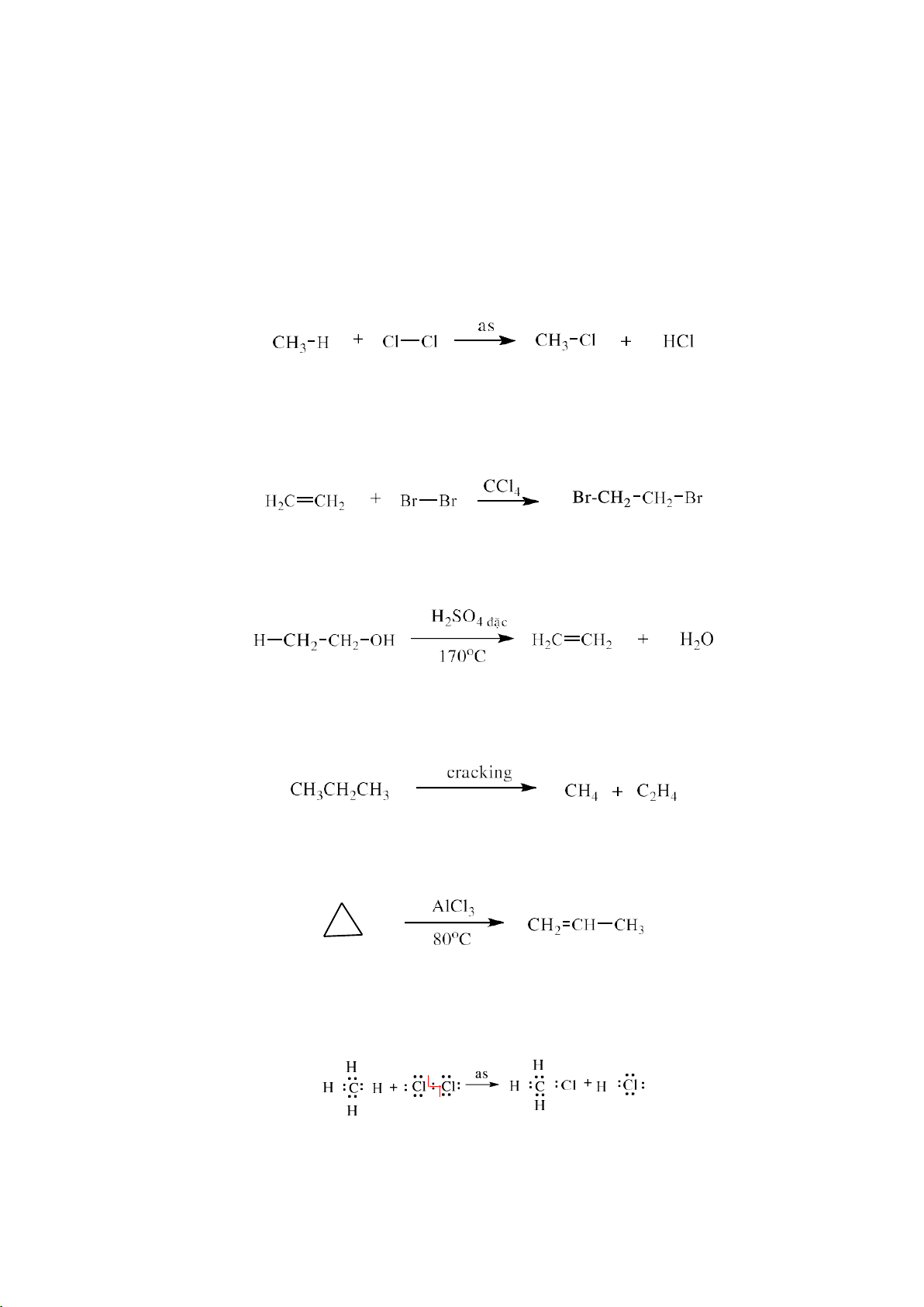
a. Phản ứng halogen hóa (thế hydrogen bằng halogen)
Sơ đồ phản ứng halogen hóa: RH X2 a 's ' RX HX Với R: CnH2n +1
Trong trường hợp này, tác nhân halogen hoá thường dùng là X2 (Cl2, Br2).
* Khả năng phản ứng của các chất trong quá trình halogen hóa alkane:
- Đối với các halogen: Khả năng phản ứng: F2 >> Cl2 > Br2 > I2
Khả năng phản ứng của Cl2 cao hơn Br2 nhưng với Br2 phản ứng chọn lọc hơn. 22 lOMoARcPSD|208 990 13 CH3 CH3 CH2Cl CH + HCl 3 CH + Cl2 CH3 CCl CH3 CH CH3 CH3 CH3
Br2 chỉ tạo sản phẩm thế duy nhất vào carbon bậc 3 (khả năng thế H ở carbon
bậc 3 > bậc 2 > bậc 1).
- Đối với các alkane: Khi trong phân tử alkane có chứa C có bậc khác nhau thì sản
phẩm thế halogen ưu tiên vào C có bậc cao hơn.
Đó là do sự khác nhau về Elk và độ bền của các gốc tự do trung gian. Độ bền các gốc tự do:
b. Phản ứng nitro hóa
Ở nhiệt độ thường, alkane không phản ứng với HNO3 đặc nhưng khi đun nóng
ở nhiệt độ cao, alkane bị oxi hoá tạo carboxylic acid (đun trong H2SO4). Để thực hiện
phản ứng nitro hoá alkane thường dùng HNO3 loãng (12-20%) nhiệt độ từ 100-140oC, áp suất không cao lắm. 110-120oC R H + HNO 3 l R NO2 + H2O Ví dụ: NO2 CH3 HNO CH 3 13% 3 CH CH2 CH2 CH CH3 CH3 C (CH2)2 CH (83%) 110oC CH3 CH3 CH3 CH3
c. Phản ứng sulfo hóa
Cũng như đối với HNO3, các alkane không phản ứng với H2SO4 đặc ở nhiệt độ
thường. Các alkane có mạch từ 6-8 C khi đun nóng với H2SO4 bốc khói (chứa 15%
SO3) sẽ bị sulfo hoá trực tiếp tạo alkanesulfo acid. tos CnH2n+2 + H2SO4 CnH2n+1SO3H + H2O
Trong công nghiệp, hydrocarbon no thường được sulfo hóa bằng hỗn hợp
(SO2 + O2) hoặc hỗn hợp (SO2 + Cl2).
- Dùng hỗn hợp SO2 và O2 o t CnH2n+2 + SO2 + O2 CnH2n+1SO3H
Nhiệt độ phản ứng: 20-30oC; SO2 và O2 được đưa vào với tỉ lệ đẳng phân tử
đồng thời để phản ứng xảy ra cần phải chiếu sáng bằng đèn tử ngoại. 23 lOMoARcPSD|208 990 13 - Dùng hỗn hợp SO 2 và Cl2 to CnH2n+2 + SO2 + Cl2 CnH2n+1SO2Cl + HCl Alkanesulfochloride
Tỉ lệ hydrocarbon : hỗn hợp khí là 3:1, tỉ lệ SO2 : Cl2 đưa vào là 2:1. Nhiệt độ
phản ứng: 20 - 30oC. Xúc tác bằng peoxide hoặc chiếu sáng bằng đèn tử ngoại.
d. Phản ứng dehydrogen hóa - Alkane mạch ngắn xt, t0C CnH2n+2 CnH2n + H2 Xúc tác: Cr2O3; Cu; Pt, Nhiệt độ: 300-4000C Ví dụ: CH3–CH2–CH2 –CH3 CH3-CH = CH-CH3 + H2
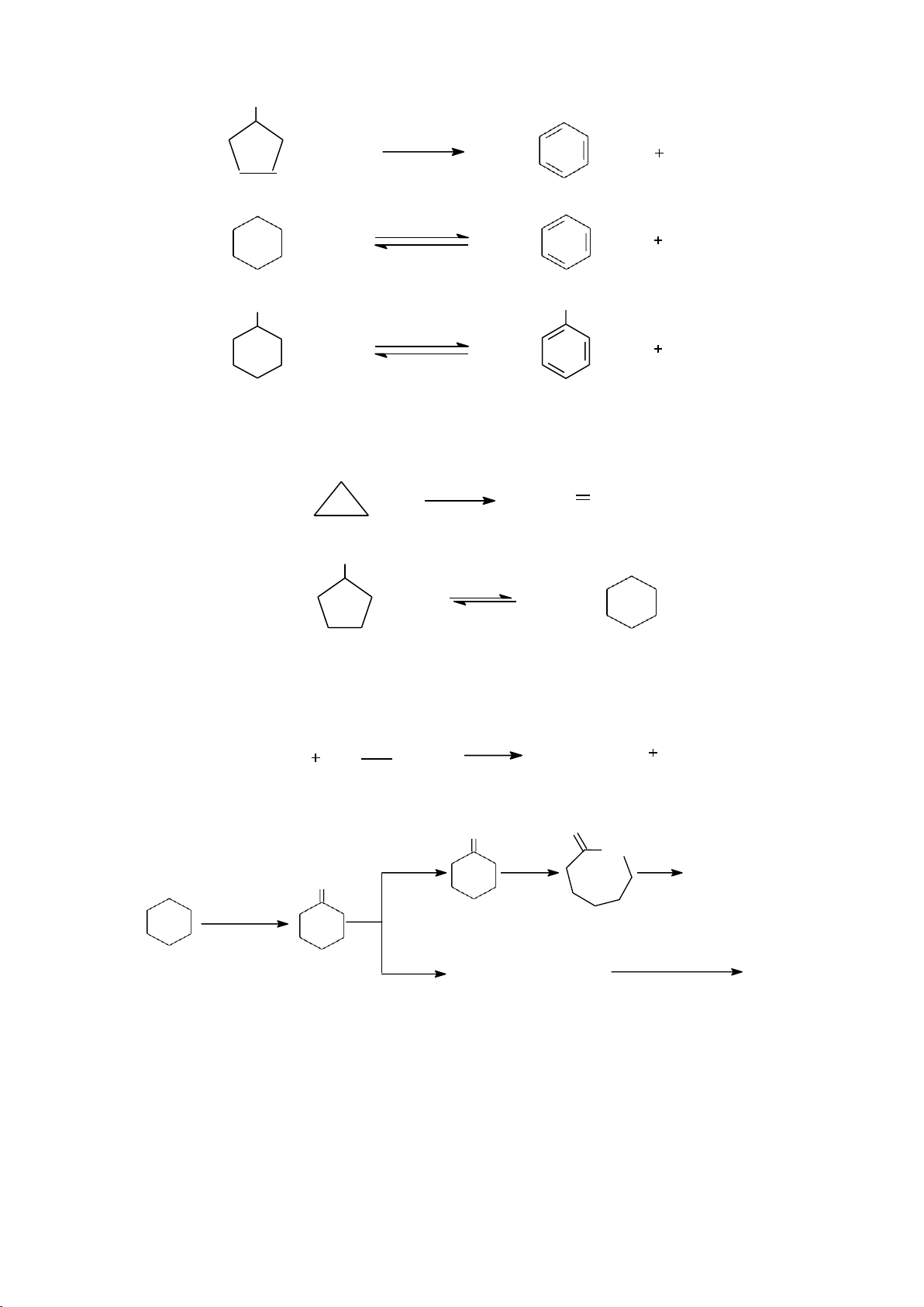
- Đối với những alkane có mạch chính chứa 5-7 nguyên tử carbon, trong quá trình tách
H còn xảy ra theo hướng đóng vòng tạo thành cycloalkane và xa hơn là sự thơm hóa tạo arene. xt, t0C CH3CH2CH2CH2CH3 + H2 xt, t0C CH3CH2CH2CH2CH2CH3 + H2 xt, t0C + H2
4.1.4.2. Phản ứng ở liên kết C-C
a. Phản ứng cracking
Khi đun nóng alkane ở nhiệt độ cao hoặc có mặt chất xúc tác sẽ xảy ra phản
ứng phá vỡ liên kết C-C tạo ra hỗn hợp sản phẩm gồm alkene và alkane có mạch
carbon ngắn. Phản ứng đó được gọi là phản ứng cracking. Sơ đồ: C to nH2n+2 CmH2m+2 + CpH2p (n = m+p) CH4 + C4H8 CH cracking 3CH2CH2CH2CH3 C2H + C3H8 4 C2H6 + C3H6
Sự hình thành nhiều sản phẩm khác nhau là do Elk giữa các C có bậc khác nhau không
chênh lệch nhiều nên mọi liên kết C-C đều có thể bị bẻ gãy với xác suất gần như nhau. 24 lOMoARcPSD|208 990 13 Elk: CI - CI = 367 KJ/mol CI - CII = 342 KJ/mol CI - CIII = 351 KJ/mol
Tùy thuộc vào điều kiện thực nghiệm, phản ứng cracking được chia thành 2 loại:
+ Cracking nhiệt: quá trình xảy ra nhờ tác dụng đơn thuần của nhiệt độ (500 – 7000C)
ở áp suất thường hoặc cao. Sản phẩm là các alkane, alkene không phân nhánh. Vì thế
xăng thu được từ quá trình cracking nhiệt có chỉ số octane thấp. Phản ứng xảy ra theo cơ chế gốc.
+ Cracking xúc tác: quá trình xảy ra với sự có mặt của chất xúc tác ở nhiệt độ thấp
hơn (450 – 5000C ). Xúc tác thường dùng là aluminosilicate thiên nhiên hoặc tổng hợp
đã được tẩm acid. Sản phẩm chứa nhiều alkane, alkene phân nhánh và một lượng đáng
kể cycloalkane và arene. Vì thế xăng thu được từ quá trình này có chỉ số octane cao.
b. Phản ứng oxi hóa
- Oxi hóa hoàn toàn (phản ứng cháy)
Ở nhiệt độ cao và đủ oxygen, alkane cháy hoàn toàn sinh ra H2O, CO2 và tỏa nhiệt mạnh: Cn H2n + 2 + O2 to n CO2 + (n+1) H2O - Oxi hóa không hoàn toàn
Những hợp chất hydrocarbon no thường bền vững đối với các tác nhân oxi hoá
mạnh như KMnO4, chromic acid ở nhiệt độ thường.
Khi sử dụng tác nhân oxi hoá là dung dịch sulfochromic (Cr2 7 O 2- + H2SO4) ở
nhiệt độ cao, hydrocarbon no sẽ bị chuyển thành sản phẩm có mạch carbon ngắn hơn
do sự phá vỡ liên kết C-C và tạo ra carboxylic acid: CH3 CH2 OH CHO COOH CH2 CH OH CO COOH
Đối với các alkane cao, phản ứng được ứng dụng để điều chế xà phòng: (R, R’ = 25-30 C)
Nhiệt độ phản ứng: 100-1500C; xúc tác: muối cobalt hoặc manganese acetate.
Sau đó tiến hành trung hòa các acid béo cao bằng dung dịch NaOH.
4.1.5. Ứng dụng
Chất tiêu biểu là methane được ứng dụng làm nhiên liệu và nguyên liệu
- Làm nhiên liệu : methane cháy cho ngọn lửa màu xanh nhạt và tỏa nhiệt lớn (8560KCal/m3). 25 lOMoARcPSD|208 990 13
- Làm nguyên liệu: Ở nhiệt độ cao có mặt xúc tác hoặc áp suất lớn, các hydrocarbon có
số nguyên tử carbon nhỏ sẽ bị oxi hoá bởi oxygen không khí tạo nhiều sản phẩm quan trọng khác. o 150 C CH o 3OH 400 C o 600-700 C CH HCHO 4 + O2 NO V2O5 HCHO 300oC 4.2. Cycloalkane
4.2.1. Danh pháp, đồng phân, cấu trúc 4.2.1.1. Danh pháp
a. Danh pháp monocycloalkane
Tên của monocycloalkane không phân nhánh xuất phát từ tên của alkane tương
ứng có thêm tiền tố cyclo (viết liền).
cyclopropane cyclobutane cyclopentane cyclohexane
Tên của monocycloalkane phân nhánh: chọn mạch vòng làm chính và đánh số
chỉ vị trí các nguyên tử C của vòng sao cho các chỉ số chỉ vị trí là nhỏ nhất, tên mạch
nhánh đọc theo thứ tự vần chữ cái. CH2CH2CH3 CH CH 3CHCH3 3 2 1 CH CH 3 2 3 4 6 5 propylcyclohexane isopropylcyclohexane 1-ethyl-2-methylcyclohexane
b. Cycloalkane chứa hai vòng
* Cycloalkane hai vòng có một đỉnh chung (spiran)
Spiro + số chỉ số lượng C riêng ở mỗi vòng + tên alkane ứng với tổng số C tạo vòng
(ghi từ số nhỏ đến số lớn)
Mạch carbon được đánh số bắt đầu từ nguyên tử carbon gần với C chung hết
vòng nhỏ đến vòng lớn. spiro[3.3]heptane spiro[4.5]decane
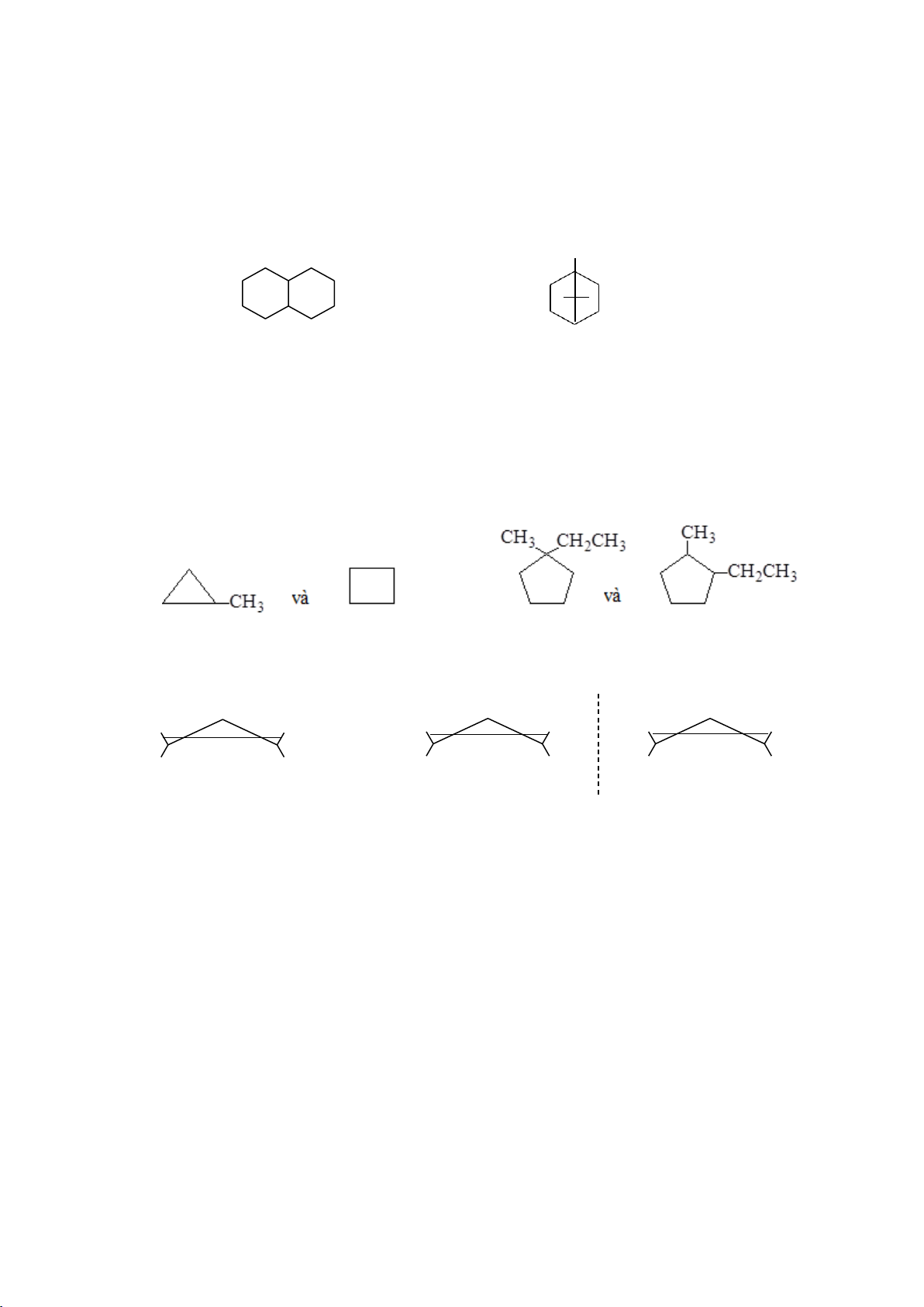
* Cycloalkane hai vòng có chung nhau cầu nối (bicycloalkane) 26 lOMoARcPSD|208 990 13
Bicyclo + các chữ số chỉ số lượng C ở mỗi cầu nối + tên alkane ứng với tổng số carbon tạo vòng
(ghi từ số lớn đến số nhỏ )
Mạch carbon được đánh số từ một nguyên tử carbon đầu cầu đến các nguyên tử
C của cầu nối dài nhất, tiếp theo đến các cầu nối ngắn hơn, sao cho chỉ số các nhánh nhỏ nhất. CH3 1 6 7 2 5 3 4 bicyclo[4.4.0]decane
1,7,7-trimethylbicyclo[2.2.1]heptane (decalin) (camphane) 4.2.1.2. Đồng phân
a.. Đồng phân cấu tạo
Có nhiều loại, bao gồm đồng phân về mạch vòng, đồng phân về mạch nhánh,
đồng phân về vị trí của nhánh,…
b. Đồng phân lập thể
Ở cycloalkane có thể có đồng phân hình học và đồng phân quang học. H H H CH CH 3 3 H CH3 CH3 CH3 H H CH3 cis-1,2-dimethylcyclopropane
trans-1,2-dimethylcyclopropane (không quang hoạt) (cặp quang hoạt)
4.2.1.3. Đặc điểm cấu trúc
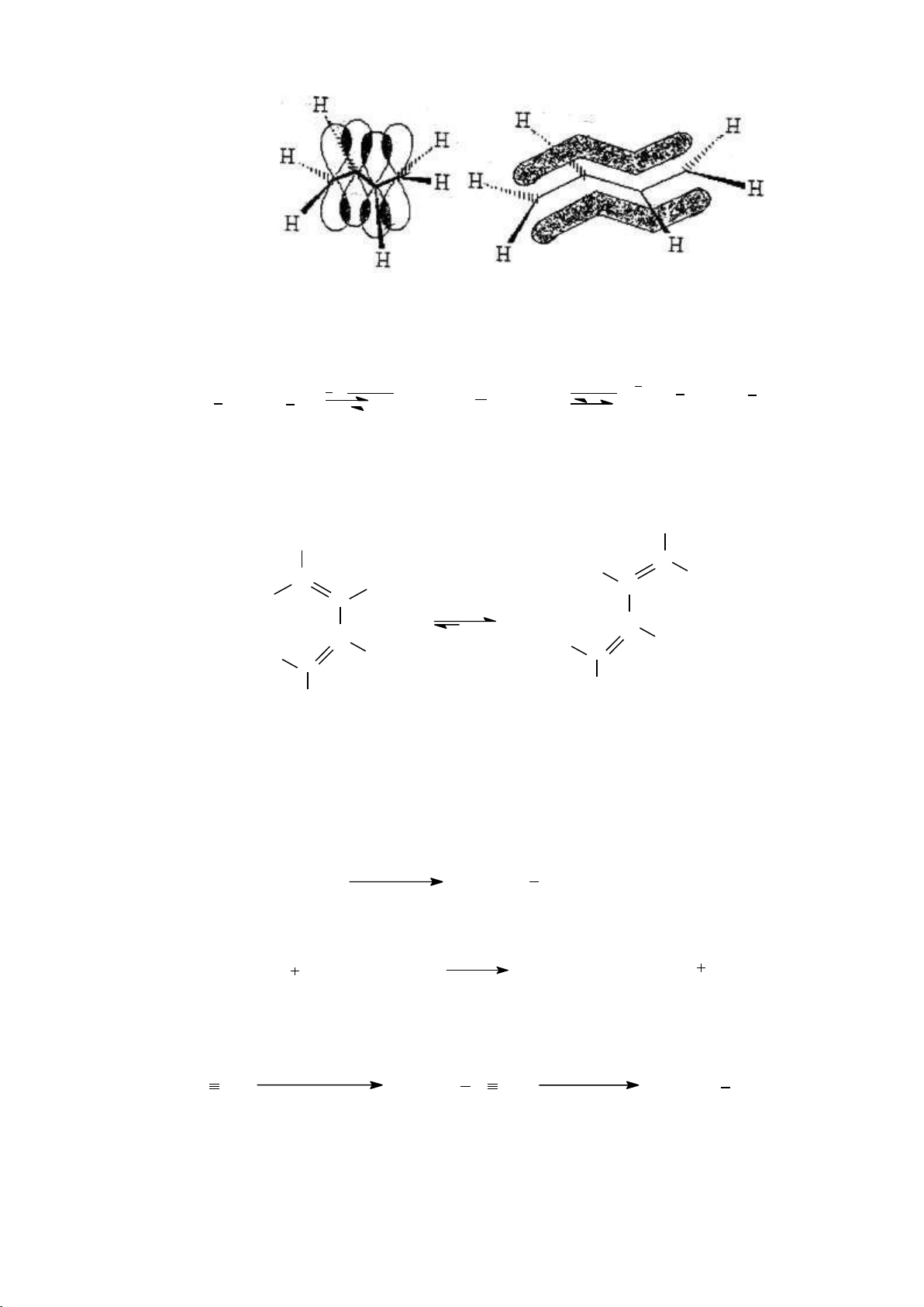
Độ bền của vòng phụ thuộc vào sức căng Bayer và sức căng Pitzer. a. Cyclopropane
Ba nguyên tử carbon của phân tử cyclopropane cùng nằm trên một mặt phẳng
và tạo thành một tam giác đều, góc CCC = 60o. Ba nguyên tử carbon đều ở trạng thái
lai hóa sp3. Sự xen phủ xảy ra bên ngoài trục C-C.
Sự xen phủ như vậy là kém hiệu quả và tạo ra liên kết không bình thường mà
cong như hình quả chuối. Vì thế liên kết này trở nên kém bền, gần giống như liên kết . 27 lOMoARcPSD|208 990 13
Hình 4.3. Mô hình phân tử
Hình 4.4. Sự xen phủ xảy ra trên trục C-C (a) cyclopropane
và bên ngoài trục C-C (b)
Hình 4.5. Sự xen phủ các orbital lai hóa của carbon trong vòng cyclopropane
Cả 6 liên kết C-H đều ở các cấu dạng che khuất hoàn toàn làm xuất hiện lực đẩy
tĩnh điện giữa các orbital C-H che khuất nhau.
Hai yếu tố trên làm cho cyclopropane trở nên kém bền và kém bền nhất trong các
cycloalkane, ΔHo = +53,4 kJ/mol. ht b. Cyclohexane
Cyclohexane có thể tồn tại dạng ghế, dạng thuyền, dạng bán ghế và dạng xoắn.
Tuy nhiên dạng ghế là cấu dạng bền nhất của cyclohexane. Ở dạng ghế, tất cả các góc
CCC, CCH, HCH đều thỏa mãn góc lai hóa sp3, tất cả 12 nguyên tử H đều ở cấu dạng xen kẽ hoàn toàn.
Vì thế, dạng ghế là dạng tối ưu về mặt năng lượng đối với cyclohexane. Ở nhiệt
độ thường, các dạng chuyển đổi lẫn nhau không ngừng, dạng ghế chiếm trên 99%
tổng số các dạng có mặt trong hỗn hợp cân bằng. (a) (b) (c)
Hình 4.6. Dạng ghế (a), công thức Newman (b) và mô hình phân tử cyclohexane (c)
4.2.2. Phương pháp điều chế 4.2.2.1. Trong công nghiệp 28 lOMoARcPSD|208 990 13
Cycloalkane có trong dầu mỏ (từ 30 - 60%) dưới dạng vòng 5 hoặc 6 cạnh với
các mạch nhánh từ một đến hàng chục nguyên tử carbon, ngoài ra còn có các
polycycloalkane 2, 3, 4 hoặc 5 vòng. Chúng được gọi chung là hydrocarbon naphtenic
hay naphtene. Khi chưng cất dầu mỏ, người ta thu được nhiều cycloalkane vòng 5, 6
cạnh ở phân đoạn sôi 60-90oC. Từ phân đoạn này, chưng cất tiếp theo có thể thu được
cyclohexane, methylcyclopentane…dùng trong công nghiệp.
4.2.2.2. Trong phòng thí nghiệm
a. Đóng vòng dẫn xuất dihalogen bằng Na, Zn
Phản ứng cho hiệu suất tốt khi n =5, 6; hiệu suất thấp khi n = 3, 4; rất thấp khi n > 6. b. Khử ketone vòng Zn/Hg , HCl (CH2)n C O (CH2)n + 1
Để điều chế vòng 3 cạnh có thể đi từ alkene và diazomethane. Vòng thu được
có cấu hình giống cấu hình của alkene ban đầu. N C C CH N N Cu + N + 2 2 2 C C toC CH2 Ví dụ: CH 3 CH3 CH + CH N H3C 3 C=C 2 2 H H H H
4.2.3. Tính chất vật lý
Nhiệt độ sôi, nhiệt độ nóng chảy của cycloalkane biến đổi theo quy luật, nhìn
chung tăng theo số nguyên tử carbon trong phân tử. Nhiệt độ sôi và nhất là nhiệt độ
nóng chảy của chúng cao hơn nhiều so với alkane tương ứng có cùng số nguyên tử carbon.
Các cycloalkane nói chung đều nhẹ hơn nước, đều nặng hơn các alkane có cùng số nguyên tử carbon.
Tính tan của cycloalkane tương tự tính tan của alkane. Cycloalkane thuộc loại
ưa dầu mỡ và kị nước. 29 lOMoARcPSD|208 990 13
4.2.4. Tính chất hóa học
Tính chất hóa học của các monocycloalkane phụ thuộc vào độ lớn của vòng.
Các vòng nhỏ (cyclopropane, cyclobutane) thể hiện tính chưa no: dễ tham gia phản
ứng cộng mở vòng. Trong khi đó các vòng lớn (cyclopentane, cyclohexane) có tính
chất tương tự alkane: dễ tham gia phản ứng thế.
4.2.4.1. Phản ứng cộng mở vòng
Cyclopropane và cyclobutane có thể cộng hydrogen tạo thành alkane trong điều
kiện có mặt chất xúc tác và đun nóng mạnh hơn so với ethylene; cyclopentane và
cyclohexane không tham gia phản ứng này. Ni H2 CH 80oC 3CH2CH3 Ni H2 CH 120oC 3CH2CH2CH3
Tương tự như vậy, cyclopropane có thể tham gia phản ứng cộng Br2, HBr,
H2SO4,…nhưng cyclobutane, cyclopentane và cyclohexane thì không phản ứng. CCl4 Br2 BrCH2CH2CH2Br Ni HX CH3CH2CH2X 120oC (X: I, Br, Cl, HSO4) 4.2.4.2. Phản ứng thế
Các cycloalkane có vòng năm cạnh hoặc vòng lớn hơn dễ tham gia các phản ứng thế: as Br Br2 HBr to 450oC HNO NO2 3 H2O
4.2.4.3. Phản ứng nhiệt phân
Ở nhiệt độ cao (> 500oC) và có mặt xúc tác (Pt, Ni…), cycloalkane bị tách
hydrogen thành hydrocarbon thơm.
a. Phản ứng dehydrogen hóa 30 lOMoARcPSD|208 990 13 CH3 Pt/SiO2 3 H 450oC 2 > 500oC 3 H2 < 500oC CH CH 3 3 > 500oC 3 H2 < 500oC
b. Phản ứng đồng phân hóa
Khi có aluminium chloride hoặc bromide xúc tác, cyclopropane bị đồng phân
hóa thành propene, các cycloalkane khác đồng phân hóa thành vòng 6 cạnh bền hơn: AlCl3 CH2 CHCH3 80oC CH3 AlCl3 (25%) (75%)
4.2.4.4. Phản ứng oxi hóa
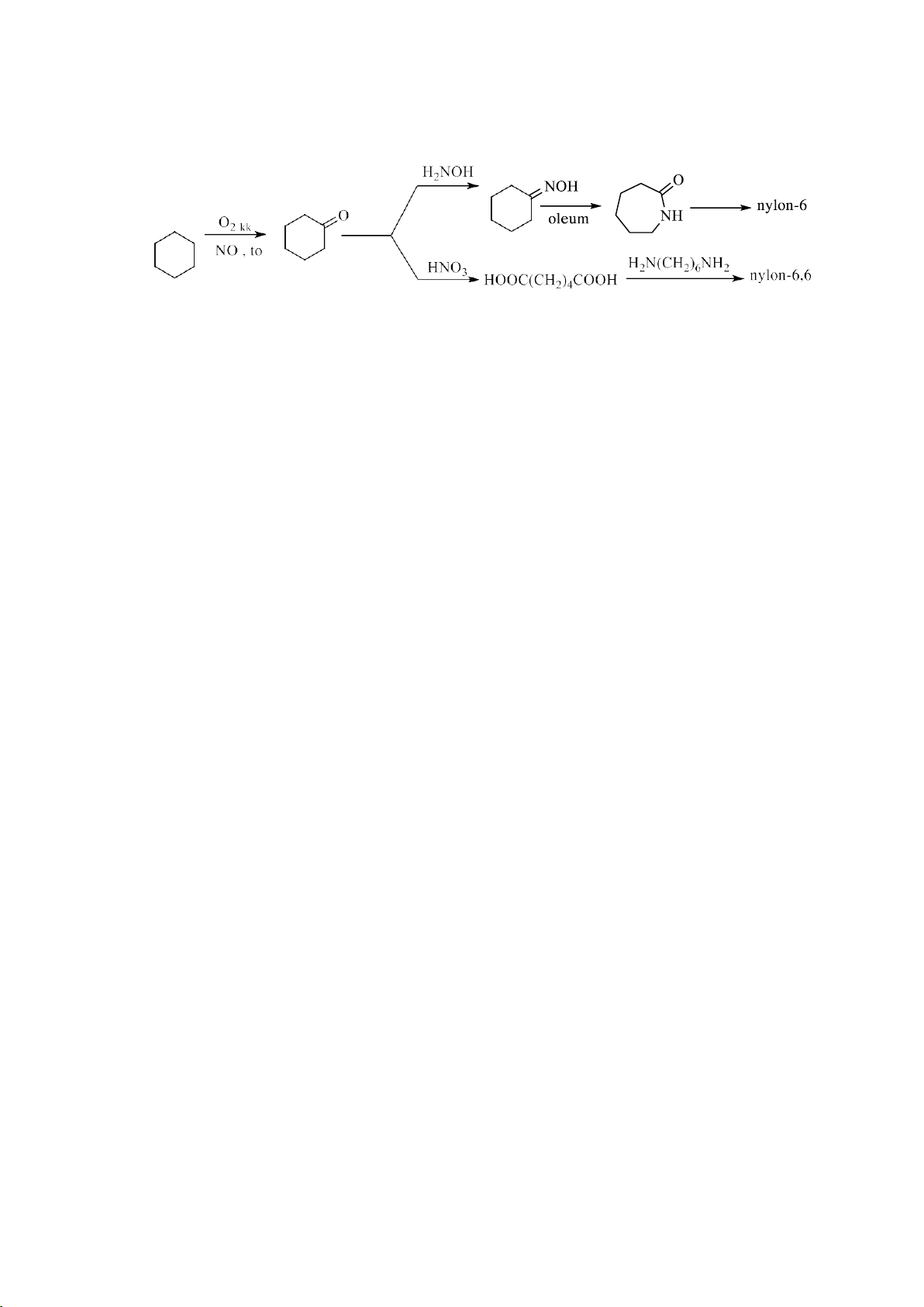
- Phản ứng oxi hóa hoàn toàn 3n to CnH2n O n CO2 n H2O 2 2
- Phản ứng oxi hóa không hoàn toàn O NOH NH H2NOH oleum Nylon-6 O O2 kk NO , toC HNO3 H HOOC(CH 2N(CH2)6NH2 Nylon-6,6 2 4 ) COOH
4.2.5. Ứng dụng
Hydrocarbon naphthenic là thành phần rất quan trọng trong nhiên liệu cho động
cơ và dầu nhờn. Các monocycloalkane với mạch nhánh ngắn có chỉ số octane cao hơn
n-alkane nên làm tăng chất lượng của xăng. Các monocycloalkane với mạch nhánh dài
(khó bị đông đặc hơn) giữ được tính linh động của nhiên liệu ở nhiệt độ thấp. Chúng
có độ nhớt cao và ít bị thay dổi theo nhiệt độ, vì vậy được dùng để sản xuất dầu nhờn. 31 lOMoARcPSD|208 990 13
Cycloalkane có trong dầu mỏ là nguồn nguyên liệu quan trọng trong công
nghiệp tổng hợp hữu cơ. Chẳng hạn, cyclohexane tách từ phân đoạn sôi 60-90oC được
dùng làm nguyên liệu để sản xuất nylon-6 và nylon-6,6.
Cyclohexane và đồng đẳng được dùng để sản xuất benzene, toluene. Ngoài ra,
cyclohexane còn được làm dung môi cho những chất ít phân cực. CÂU HỎI ÔN TẬP
1. So sánh và giải thích sự khác nhau về nhiệt độ sôi của n-pentane và isopentane.
2. Xác định và sắp xếp theo lượng giảm dần các sản phẩm thế mono khi cho Cl2 tác
dụng với hợp chất CH3CH2CH(CH3)CH2CH2CH3.
3. So sánh ưu điểm của phương pháp oxi hóa alkane bằng hỗn hợp (SO2 + O2) và hỗn hợp (SO2 + Cl2).
4. Từ CH4 và các chất cần thiết viết các phương trình phản ứng điều chế n-pentane.
5. So sánh tính chất hóa học của alkane và cycloalkane.
6. Những yếu tố nào ảnh hưởng đến độ bền của cycloalkane?
7. Xác định sản phẩm chính khi cho methylcyclopropane tác dụng với HBr đặc.
8. Từ CH4 và các chất cần thiết viết các phương trình phản ứng điều chế dimethylpropane. 32 lOMoARcPSD|208 990 13
Chương 5. HYĐROCARBON KHÔNG NO
Hydrocarbon không no là những hydrocarbon trong phân tử có chứa liên kết hoặc liên kết
hoặc chứa đồng thời cả 2 liên kết đó.
Hydrocarbon không no bao gồm:
- Dạng mạch hở: alkene, alkyne, alkadiene
- Dạng mạch vòng: cycloalkene… 5.1. Alkene
5.1.1. Danh pháp, đồng phân, cấu trúc 5.1.1.1. Danh pháp
* Nguyên tắc:
- Chọn mạch chính là mạch dài nhất có chứa liên kết đôi
- Đánh số C ở mạch chính bắt đầu từ phía gần nối đôi
- Gọi tên nhánh (gọi trước tên mạch chính) theo thứ tự bảng chữ cái.
- Nếu có nhiều nhánh giống nhau thì trước tên gọi thêm các tiền tố: di, tri… Tên alkene: phần nền +
số chỉ vị trí của nối đôi + ene (chỉ tên mạch chính) CH2=CH-CH2-CH3 but-1-ene CH3 C=CH CH2 CH3 CH3 2-methylpent-2-ene
- Đối với các đồng phân hình học thì gọi cis-, trans- hoặc Z, E trước tên gọi. 5.1.1.2. Đồng phân
Alkene có các loại đồng phân:
- Đồng phân cấu tạo: xuất hiện khi n = 4 trở lên
+ Đồng phân về mạch C.
+ Đồng phân về vị trí liên kết đôi
+ Đồng phân nhóm chức: alkene và các cycloalkane có cùng số nguyên tử C - Đồng phân lập thể:
+ Đồng phân hình học: cis-, trans- hoặc Z, E
+ Đồng phân quang học: Khi trong phân tử alkene có C* sẽ xuất hiện đồng phân
quang học, khi đó n ≥ 6. C C
5.1.1.3. Đặc điểm cấu trúc của liên kết đôi C C - Liên kết
được tạo nên bởi 2 nguyên tử carbon ở trạng thái lai hóa sp2. 33 lOMoARcPSD|208 990 13 H H C C H H
Hình 5.1. Các obital của nguyên tử C và H hình thành phân tử C2H4
Mỗi nguyên tử Csp2 dùng hai orbital lai hóa để xen phủ trục với hai obitan s của
nguyên tử H (trong trường hợp là phân tử C2H4) hoặc với hai orbital của hai nguyên tử
khác liên kết trực tiếp với nó tạo thành liên kết . Orbital lai hóa còn lại sẽ xen phủ
trục với orbital lai hóa của nguyên tử Csp2 kia tạo liên kết giữa C-C.
Mỗi nguyên tử carbon còn một obitan 2p không lai hóa có trục song song nhau,
chúng xen phủ bên với nhau tạo thành liên kết . Như vậy, liên kết giữa hai carbon ở
ethylene được đảm bảo bởi một liên kết và một liên kết . H H C C H H
Hình 5.2. Năm liên kết trong
Hình 5.3. Một liên kết trong phân tử C2H4 phân tử C2H4
Như vậy, tất cả các nguyên tử liên kết trực tiếp với 2 nguyên tử C mang nối đôi
đều nằm trên cùng một mặt phẳng với 2 nguyên tử C đó và mặy phẳng đó được gọi là
mặt phẳng phân tử. Các góc hoá trị HCˆH và HCˆC đều ở 1200.
Orbital nằm ở hai phía đối xứng nhau qua mặt phẳng phân tử. Mặt phẳng chứa
orbital gọi là mặt phẳng vuông góc với mặt phẳng phân tử . C C mp C C mp phân tử
Hình 5.4. Obital nằm ở hai phía đối
Hình 5.5. Mặt phẳng vuông góc với mặt
xứng qua mp phân tử
phẳng phân tử 34 lOMoARcPSD|208 990 13
Như vậy, trong phân tử C2H4 có 5 liên kết (4 liên kết C-H và 1 liên kết C- C) và 1 liên kết . H H 121,70 H H 116,60 C C 1,330A0 C C H H H H
Hình 5.6. Mô hình phân tử C2H4
Hình 5.7. Độ dài liên kết và góc liên kết
trong phân tử ethylene
5.1.2. Phương pháp điều chế 5.1.2.1. Từ alcohol
Pha lỏng: dùng H2SO4 đặc hoặc H3PO4, nhiệt độ: 100 - 1700C.
Pha khí: dùng Al2O3 nhiệt độ: 300 - 4000C. 5.1.2.2. Từ alkyl halide KOH/ancol RCH=CHR RCHCH2R NaNH X 2 RCH=CHR
5.1.2.3. Từ dẫn xuất dihalogen RCHXCHXR + Zn RCH=CHR + ZnX2 5.1.2.4. Khử hóa alkyne CnH2n-2 + H2 CnH2n -Xúc tác:
+ Pd/CaCO3 được phản hoạt hóa bằng Pb(CH3COO)2
+ Pd/C được tẩm quinoline, pyridine + Pd/silicagel.
Sản phẩm tạo thành là cis-alkene.
- Để thu được trans-alkene thì khử bằng Na/NH3 lỏng. 35 lOMoARcPSD|208 990 13
5.1.3. Tính chất vật lý
- Ba chất đầu tiên trong dãy đồng đẳng là chất khí, alkene có thành phần trung bình là
chất lỏng, alkene có thành phần cao hơn là chất rắn
- Nhiệt độ sôi của alkene tương đương với nhiệt độ sôi của alkane có cùng số nguyên tử C.
- Tỉ khối của alkene lớn hơn alkane tương ứng.
- Alkene không tan trong nước, tan tốt trong các dung môi không phân cực hoặc ít phân cực.
5.1.4. Tính chất hoá học
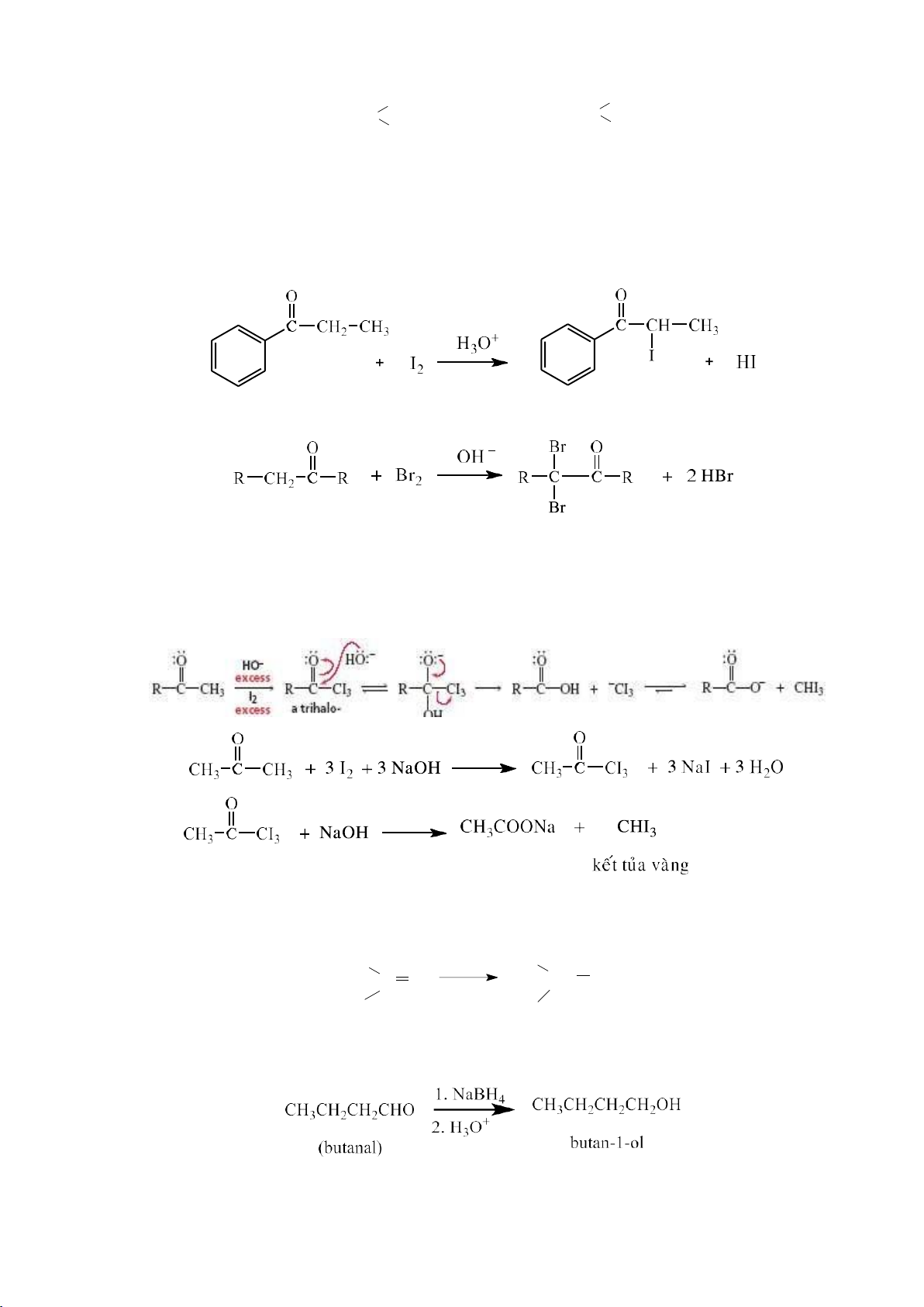
5.1.4.1. Phản ứng cộng electrophile (AE)
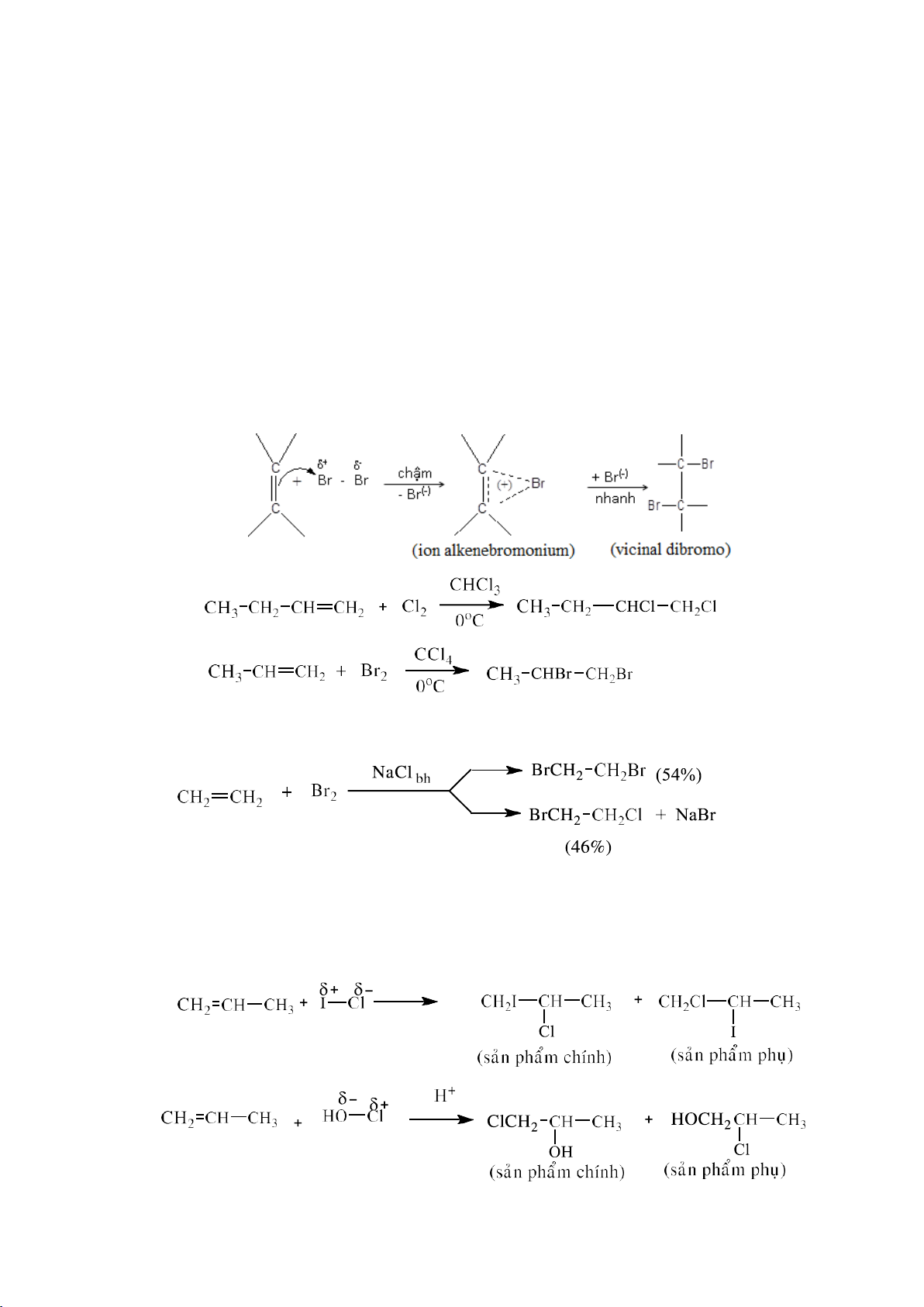
a. Cộng halogen (Cl2 , Br2)
Khi tiến hành trong dung môi phân cực (HOH, CH3OH) hoặc có mặt các anion
khác (trong NaCl) còn tạo các sản phẩm cộng khác
Các quy tắc định hướng trong quá trình cộng alkene bất đối xứng với tác nhân bất
đối xứng: qui tắc Markovnikov, qui tắc Zasep – Wayne.
Phản ứng cộng liên haologen, phản ứng cộng HClO, …cũng xảy ra theo cơ chế cộng electrophile. 36 lOMoARcPSD|208 990 13
b. Phản ứng cộng HA A - + chaäm A C=C C C + HA C C A nhanh H H
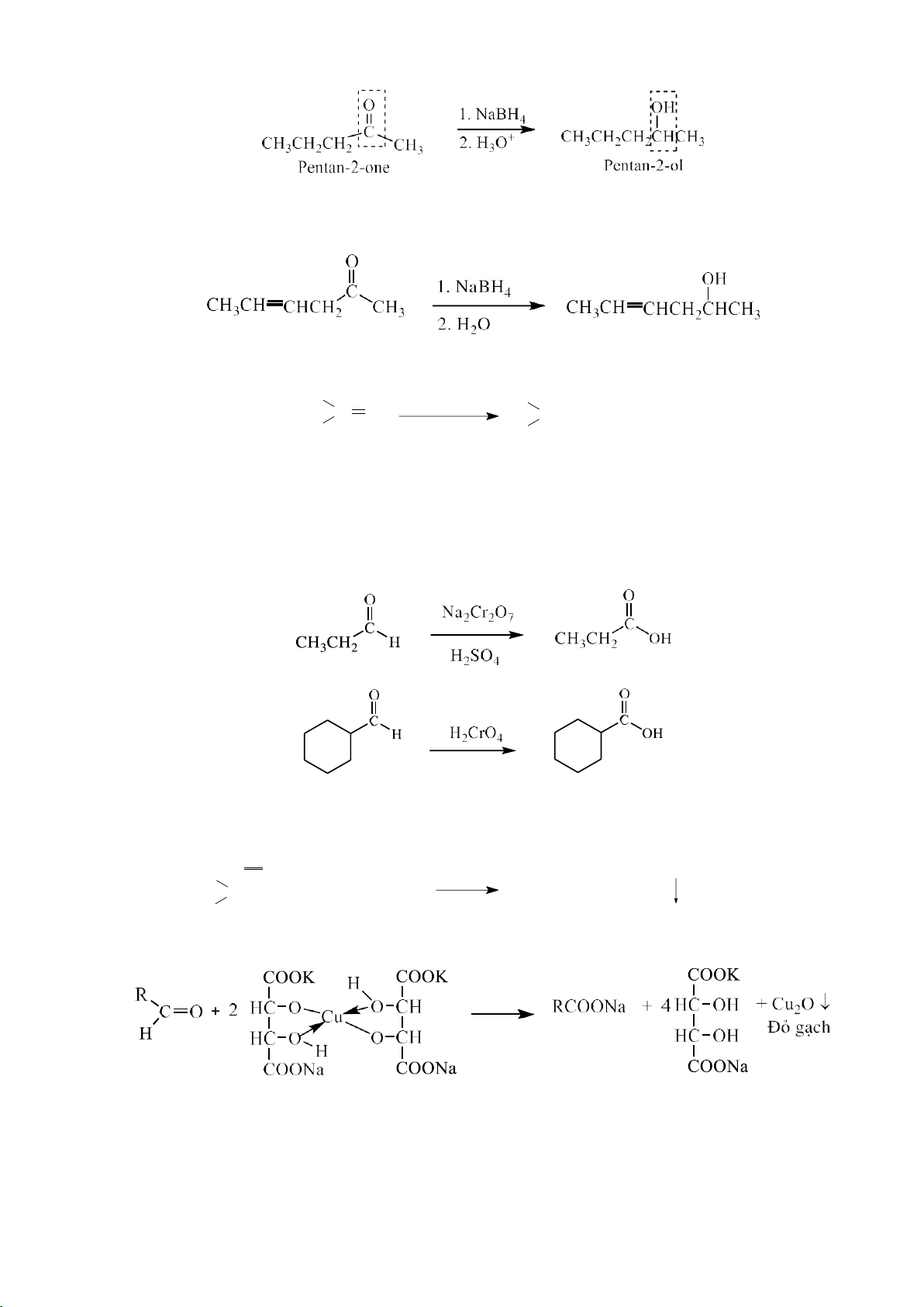
c. Phản ứng cộng H2O (có mặt H2SO4 loãng làm xúc tác ) + + H H 2O + H 3O OH + H + - O + H2O H 2 C C 3O + C=C C C + - H H H + H CH3CH2CH=CH2 + H2O CH3CH2CHCH3 OH
Muốn nhận được alcohol mà nhóm –OH đính vào carbon bậc cao hơn, có thể thực hiện: Hg(OCOCH 3)2 NaBH4 , OH RCH CH2 R CH CH2 R CH CH3 OH HgOCOCH3 OH (99%)
Muốn nhận được alcohol mà nhóm –OH đính vào carbon bậc thấp, có thể thực hiện: 37 lOMoARcPSD|208 990 13 2RCH=CH2 R CH CH2 + HBH2 R CH CH2 R CH2 CH2 R(CH2CH2)3B H ... BH2 BH2 H2O2/OH- RCH2CH2OH
5.1.4.2. Phản ứng cộng gốc
Khi cộng HBr vào alkene với sự có mặt của peoxide, phản ứng xảy ra theo hướng
ngược với quy tắc Markovnikov.
5.1.4.3. Phản ứng khử hóa H H xt C H CH + H2 C C H H
Xúc tác thuờng dùng: Ni, Pt, Pd,…
5.1.4.4. Phản ứng oxi hóa
Tùy thuộc vào việc sử dụng tác nhân oxi hoá, môi trường phản ứng và chất xúc
tác mà sản phẩm của quá trình sẽ khác nhau.
a. Oxi hóa bảo toàn liên kết đôi
Tác nhân oxi hóa: oxygene không khí, xúc tác Cu2O, nhiệt độ trên 300oC. Cu CH 2O 3 CH=CH2 + O2 CH2=CH CHO 370oC
b. Oxi hóa phá vỡ liên kết đôi - Tạo -oxide:
Tác nhân oxi hóa: oxygene không khí, xúc tác: Ag, Pt, Pd, nhiệt độ: 200-300oC. Ag CH2=CH2 + O2 CH2 CH2 270-290oC O CH CH 3 CH CH2 RCO3H 3 CH CH2 RCOOH O - Tạo aldehyde và ketone
Tác nhân: oxygen không khí, PdCl2, CuCl2
CH2=CH2 + PdCl2 + H2O CH3CHO + Pd +HCl 38 lOMoARcPSD|208 990 13 Hoặc có thể viết: CH =CH + 1/2O PdCl2, CuCl2 CH CHO 2 2 2 3 H2O
Các đồng đẳng tiếp theo tạo sản phẩm ketone - Tạo diol
Khi dùng tác nhân oxi hoá là KMnO4, trong môi trường trung tính hoặc môi
trường base ở nhiệt độ thấp sẽ xảy ra sự gắn kết của hai nhóm -OH vào hai carbon
mang nối đôi (quá trình này còn gọi là quá trình dihydroxy hoá). CH3 CH= KMnO4 CH CH CH C H CH C H 2 5 OH- 3 2 5 OH OH
- Tạo carboxylic acid, ketone, aldehyde
Khi tiến hành oxi hóa bằng KMnO4, K2Cr2O7 trong môi trường acid, sản phẩm
tạo thành sẽ là hỗn hợp acid, hỗn hợp ketone hoặc hỗn hợp gồm acid và ketone. Điều
đó phụ thuộc vào cấu tạo của alkene. CH3 CH=CH CH KMnO CH 4 CH COOH + CH CH COOH 2 3 + 3 3 2 H CH 3 C2H5 KMnO4 C H C C H 2 5 2 5 CH C C 3 C CH3 + + CH3 C2H5 H O O CH 3 CH3 C=CH KMnO CH 4 3 C=O + CH3COOH CH3 H+ CH3
Ngoài ra tùy thuộc vào cấu tạo của alkene mà có thể nhận được aldehyde,
ketone hoặc carboxylic acid khi oxi hóa alkene bằng ozone rồi phân hủy ozonide tạo thành.
Dựa vào các sản phẩm ozone phân có thể suy ra cấu tạo của alkene ban đầu.
5.1.4.5. Phản ứng trùng hợp a. Trùng hợp gốc peoxide , to + n CH2 CH2 CH2 CH2 n polyethylene, PE 39 lOMoARcPSD|208 990 13 peoxide , to n CH CH 2 CH 2 CH n Cl Cl poly(vinyl chloride), PVC b. Trùng hợp ion BF3 , AlCl3 n CH CH 2 CH 2 CH n CH3 CH3 polypropylene 5.1.4.6. Phản ứng thế
Trong những điều kiện thực nghiệm xác định, phản ứng của halogen với alkene
không tạo dẫn xuất dihalogen theo phản ứng cộng mà cho sản phẩm thế kiểu allyl và vinyl. - Thế allyl: CH CH CH2 Cl2 CH CH CH HCl Cl
Phản ứng xảy ra dễ dàng đối với alkene phân nhánh. toC CH CH C CH2 3 HCl 3 C CH2 Cl2 CH CH 3 2Cl
Các alkene không phân nhánh, thế ở điều kiện khó khăn hơn:
Khi thực hiện phản ứng thế bromine có thể sử dụng tác nhân là N-bromosuccinimide (NBS). - Thế vinyl:
5.1.5. Ứng dụng
Những alkene có nhiều ứng dụng rộng rãi là ethylene, propylene và các
butylene. Các lĩnh vực ứng dụng chủ yếu là:
a. Tổng hợp polymer
- Nhờ phản ứng trùng hợp, ethylene và propylene được dùng để tổng hợp polyethylene
(PE) và polypropylene (PP) là những chất dẻo dùng chế tạo các bình chứa, các màng
mỏng; isobytylene dùng để tổng hợp polyisobutylene dùng làm keo dán.
- Người ta còn chuyển hóa alkene thành các monomer như vinyl chloride CH2=CHCl,
vinyl acetate CH2=CH-OCOCH3, styrene C6H5CH=CH2, ... để sản xuất poly(vinyl 40 lOMoARcPSD|208 990 13
chloride), poly (vinyl acetate), polystyrene,... là những nguyên liệu làm tơ sợi và chất dẻo,...
- Nhờ phản ứng dehydrogen, butene được dùng để sản xuất buta-1,3-diene, từ đó sản xuất cao su tổng hợp.
b. Tổng hợp các hóa chất hữu cơ
- Nhờ phản ứng cộng và một số phản ứng khác, từ ethylene tổng hợp ethanol (dùng
làm nguyên liệu tổng hợp hữu cơ, dung môi, nhiên liệu,...), 1,2-dichloroethane (dùng
làm dung môi và nguyên liệu tổng hợp hữu cơ), ...
- Nhờ phản ứng oxi hóa, từ ethylene tổng hợp acetic aldehyde (để sản xuất acetic
acid), ethylene oxide (để tổng hợp hữu cơ), acrylonitrile (monomer),...
- Propylene dùng trong tổng hợp isopropanol, acetone, propylene oxide, ...
Ngoài những ứng dụng trên, ethylene còn được dùng làm chất kích thích để trái cây mau chín. 5.2. Alkyne
5.2.1. Danh pháp, đồng phân, cấu trúc 5.2.1.1. Danh pháp * Nguyên tắc:
- Chọn mạch chính là mạch dài nhất có chứa liên kết ba.
- Đánh số C ở mạch chính bắt đầu từ phía gần nối ba.
- Gọi tên nhánh (gọi trước tên mạch chính) theo thứ tự bảng chữ cái.
- Nếu có nhiều nhánh giống nhau thì trước tên gọi thêm các tiền tố: di, tri,… Tên alkyne: phần nền +
số chỉ vị trí của nối ba + yne (chỉ tên mạch chính) CH3 C C CH2 CH3 pent-2-yne HC C CH CH3 3-methylbut-1-yne CH3 5.2.1.2. Đồng phân
- Đồng phân cấu tạo: xuất hiện khi n = 4 trở lên.
+ Đồng phân về mạch C.
+ Đồng phân về vị trí liên kết ba
+ Đồng phân nhóm chức: alkyne và các alkadiene có cùng số nguyên tử C
- Đồng phân lập thể: Khi trong phân tử alkyne có C* sẽ xuất hiện đồng phân quang học, khi đó n ≥ 6.
5.2.1.3. Đặc điểm cấu trúc của liên kết –C C– - Liên kết–C
C– được tạo bởi 2 nguyên tử carbon ở trạng thái lai hóa sp. 41 lOMoARcPSD|208 990 13
Mỗi nguyên tử Csp dùng một orbital lai hóa để xen phủ trục với orbital s của
nguyên tử H (trong trường hợp phân tử C2H2) hoặc với orbital của nguyên tử khác liên
kết trực tiếp với nó để tạo thành liên kết σ. Orbital lai hóa còn lại sẽ xen phủ trục với
orbital lai hóa của nguyên tử Csp kia tạo liên kết σ C-C.
Hình 5.8. Ba liên kết trong phân tử C2H2
Ở mỗi nguyên tử carbon còn 2 orbital 2p không lai hóa có trục vuông góc với
nhau và vuông góc với trục liên kết. Hai orbital 2p ở 2 C có trục song song với nhau sẽ
xen phủ bên với nhau tạo thành liên kết . Sự hình thành liên kết tạo nên 2 mặt
phẳng thẳng góc với nhau và giao tuyến của 2 mặt phẳng là đường thẳng nối tâm của 2 nguyên tử C. H C C H
Hình 5.9. Hai liên kết trong
Hình 5.10. Hai mặt phẳng π vuông góc phân tử C với 2H2 nhau
Các orbital phân bố cả 4 phía của trục liên kết C-C, mật độ e- ở liên kết ba
được phân bố đối xứng tỏa tròn xung quanh trục liên kết.
Hình 5.11. Sự phân bố mật độ e - trong phân tử C2H2
Như vậy, trong phân tử C2H2 có 3 liên kết (2 liên kết C-H, một liên kết C-C) và 2 liên kết . 42 lOMoARcPSD|208 990 13
Hình 5.12. Liên kết và 2 liên kết trong phân tử C2H2
- Kích thước của orbital sp < sp 2< sp3 sự khác nhau về độ âm điện của nguyên
tử C → sự khác nhau về khả năng xen phủ tương đối của các orbital lai hóa:
Điều này làm cho mật độ e- ở liên kết –C C – tập trung chủ yếu ở khoảng
giữa 2 hạt nhân của 2 nguyên tử C.
Bảng 5.1. Độ âm điện của nguyên tử carbon lai hóa và khả năng xen phủ của orbital Trạng thái lai hóa
Độ âm điện của
Khả năng xen phủ tương đối của nguyên tử C nguyên tử C của obital sp 2,75 1,93 sp2 2,69 1,99 sp3 2,50 2,0
- Bậc liên kết của nguyên tử C trong liên kết ba lớn hơn trong liên kết đôi và đơn nên độ
dài của các liên kết trong alkyne ngắn hơn năng lượng liên kết có sự khác nhau.
Bảng 5.2. Độ dài và năng lượng của một số loại liên kết trong phân tử hydrocarbon Liên kết dC-H(A0) dC-C(A0) E liên kết C-C (Kcal/mol) H-Csp3- Csp3 1,09 1,54 82,6 H-Csp2- Csp2 1,076 1,34 145,8 H-Csp- Csp 1,06 1,2 199,6
Từ độ dài liên kết và góc liên kết, mô hình phân tử được xây dựng
Hình 5.13. Sự phân bố điện tích trong phân tử C2H2 (màu đỏ: điện tích âm, màu xanh:
điện tích dương
5.2.2. Phương pháp điều chế
5.2.2.1. Từ dẫn xuất dihalogen 43 lOMoARcPSD|208 990 13 RCHXCHXR’ RC CR’ + 2HX
- Tách bằng KOH/C2H5OH hoặc NaNH2. CH3CH2-CCl2-C2H5 + 2NaNH2 CH3 -C C- C2H5 + 2NaCl + 2NH3 - Tách bằng Zn. R-CX2-CX2-R’ + 2Zn R -C C- R’ + 2ZnX2 Ví dụ: CH3 -CCl2-CCl2-C2H5 + 2 Zn CH3 -C C- C2H5 + 2ZnCl2 5.2.2.2. Đi từ C2H2 Na RX HC CH CH CNa HC CR
5.2.3. Tính chất vật lý
- Ba chất đầu tiên trong dãy đồng đẳng là chất khí không màu, các alkyne cao hơn là
chất lỏng hoặc chất rắn.
- Nhiệt độ sôi, nhiệt độ nóng chảy và tỉ khối của alkyne lớn hơn không nhiều so với
alkane và alkene tương ứng.
- Alkyne không tan trong nước, tan tốt trong các dung môi không phân cực hoặc ít phân cực.
5.2.4. Tính chất hóa học
5.2.4.1. Phản ứng cộng electrophile (AE)
a. Cộng halogen (Cl2, Br2) X X X X2 X2 C C C C C C X X X CCl4 C2H5 C C C2H5 + Br2 C2H5 CBr CBr C2H5 -20 0 C C H C C C H + 2Br CCl4 C2H5 CBr2 CBr C 2H5 2 5 2 5 2 2 200 C
b. Phản ứng cộng HX , , , R HX HX C C R RCH CX R RCH2 CX2 R Hay 44 lOMoARcPSD|208 990 13
c. Phản ứng cộng H 2O HgSO4 CH2 C H O CH C C C + 2 H2SO4 OH O Ví dụ: HgSO4 H + H O CH2 CH OH CH3CHO H C C 2 H2SO4
Khi cộng H2O vào các đồng đẳng của acetylene, phản ứng tuân theo quy tắc
Markovnikov tạo sản phẩm chính là ketone. Ví dụ: CH C C H + H O HgSO4 C CH CH COCH CH 3 2 3 2 3 3 H SO 2 4 OH
5.2.4.2. Phản ứng cộng gốc
Khi cộng HBr vào alkyne với sự có mặt của peroxide, phản ứng xảy ra theo
hướng ngược với quy tắc Markovnikov. R2O2 R C C H + HBr R CH CHBr
5.2.4.3. Phản ứng khử hóa
a. Hydrogen hóa xúc tác xt C C + H2 CH CH ( 1 ) H H xt C H CH + H2 C C ( 2 ) H H - Xúc tác: Ni, Pt, Pd
- Để dừng lại ở giai đoạn (1) dùng xúc tác:
+ Pd/CaCO3 được phản hoạt hóa bằng Pb(CH3COO)2
+ Pd/C được tẩm quinoline, pyridin + Pd/silicagel.
alkene tạo thành có cấu hình cis.
b. Khử hóa bằng Na/NH3 lỏng
- Sản phẩm tạo thành là alkene có cấu hình trans 45 lOMoARcPSD|208 990 13
5.2.4.3. Phản ứng oxi hóa
a. Oxi hóa với tác nhân là O3/CCl4 O O , O , , 3 R C C R R C C R H2O RCOOH + RCOOH O
b. Oxi hóa với tác nhân KMnO4 - Trong môi trường acid: , KMnO , 4 R C C R RCOOH + RCOOH H + - Trong môi trường base : , KMnO , 4 R C C R RCOONa + RCOONa NaOH
- Trong môi trường trung tính : t 0 , , KMnO RCOOH + RCOOH R C C R 4 o H , 2O 0 C R C C R pH = 7, 5 O O
5.2.4.5. Phản ứng oligomer hóa
a. Tạo mạch thẳng Cu2Cl2, NH4Cl C C + C C C C C C 2 H C C H Cu2Cl2, NH4Cl C H2 CH C C H Cu, O2((vet) n H C C H ( CH CH )n 0 200 -250 C b. Tạo mạch vòng - Cyclotrimer hóa: C 3 H C C H o 600 - 800 C
Xúc tác thích hợp nhất cho quá trình này là Ni[P(C6H5)3]2(CO)2, nhiệt độ từ
60-700C, hiệu suất của quá trình đạt 80%. 46 lOMoARcPSD|208 990 13 CH3 H2SO4 3 CH3 C C H CH3 CH3 - Cyclotetramer hóa:
Phản ứng xảy ra dưới tác dụng của xúc tác nickel cyanide hoặc phức nickel (II) xt , 20 at 4 H C C H 0 60 - 70 C
5.2.4.6. Phản ứng ở liên kết Csp- H
Sự phân cực của liên kết C δ-
H δ+ dẫn đến momen lưỡng cực của liên kết
này tăng lên làm tăng khả năng tách H+, mặt khác Csp lớn làm ổn định anion hình
thành R-CC- cũng bền vững hơn .
- So sánh tính acid của alkyne với alkene và alkane:
Khả năng bứt H+ ở liên kết Csp-H > Csp2-H > Csp3-H do Csp là lớn nhất và
anion R-CC- cũng bền vững nhất
Như vậy, alkyne có nối ba đầu mạch có tính acid lớn hơn alkene và alkane.
Bảng 5.3. Giá trị hằng số Ka của một số hợp chất Hợp chất H2O C2H5OH C2H2 NH3 C2H4 C2H6 Ka 10-14 10-18 10-22 10-35 10-40 < 10-40
a. Phản ứng với kim loại kiềm và base Na R C CNa 1 + / 2 H2 R C C H NaNH2 - R C C Na+ + NH3 NH3 l
b. Phản ứng với phức của kim loại Cu, Ag Ag(NH3)2 OH R C C Ag + NH3 + H2O R C C H Cu(NH3)2 OH R C C Cu + NH3 + H2O
c. Phản ứng với hợp chất cơ kim R C C H + C2H5MgBr R C C MgBr + C2H6 47 lOMoARcPSD|208 990 13
5.2.4.7. Phản ứng cộng nucleophile RONa/ROH C C CH C OR RONa ROH H C C H RO CH CH RO CH CH2 RO
5.2.5. Ứng dụng
Các ứng dụng quan trọng của alkyne hầu như đều thuộc về ứng dụng của
acetylene, mà ba lĩnh vực chính là:
a. Dùng làm nhiên liệu
- Khí acetylene cháy trong oxygene, nhiệt độ ngọn lửa có thể đạt tới 3000oC. Vì thế
acetylene được dùng làm nhiên liệu cho đèn xì để hàn và cắt kim loại.
- Acetylene cháy trong không khí cho ngọn lửa sáng chói. Vì thế, trước kia người ta
dùng calcium carbide kĩ thuật nạp vào bình thép có van cho nước nhỏ xuống từ từ, rồi
đốt khí acetylene sinh ra để thắp sáng. Calcium carbide kĩ thuật có chứa nhiều tạp chất,
có màu đen nước được gọi là đất đèn.
b. Làm nguyên liệu cho công nghiệp tổng hợp hữu cơ
- Nhờ các phản ứng cộng HCl, HCN, CH3COOH,... acetylene được dùng để tổng hợp
nhiều monomer để sản xuất chất dẻo và tơ sợi hóa học như vinyl chloride CH2=CHCl,
acrilonitrile CH2=CHCN, vinyl acetate CH2=CHOCOCH3,...
- Nhờ phản ứng dimer hóa tạo thành vinylacetylene, rồi cộng HCl người ta thu được
chloroprene CH=CCl-CH=CH2 dùng để sản xuất cao su chloroprene. Từ acetylene có
thể điều chế isoprene nhờ phản ứng với acetone, từ đó sản xuất cao su isoprene.
- Nhờ phản ứng cộng nước, từ acetylene điều chế được acetaldehyde CH3CHO từ đó
điều chế ra được acetic acid, ethanol, ethyl acetate,...
c. Tổng hợp các hợp chất có hoạt tính sinh học
- Alkyne được dùng để tổng hợp pheromone và một số hoạt chất tương tự hormon
dùng trong y dược. Pheromone được dùng làm chất dẫn dụ côn trùng. 5.3. Alkadiene
Những hydrocarbon chứa nhiều nối đôi trong phân tử được gọi chung là
polyene. Alkadiene là hydrocarbon mạch hở có chứa 2 liên kết đôi trong phân tử với
công thức phân tử tổng quát: CnH2n-2 với n ≥ 3.
Có thể chia alkadiene làm 3 loại:
- Alkadiene có nối đôi cách biệt: CH2=CH-CH2-CH2-CH=CH2
- Alkadiene có nối đôi liền kề (được gọi là allene): CH2=C=CH2
- Alkadiene có nối đôi liên hợp: CH2=CH-CH=CH2
Trong đó quan trọng nhất là các diene liên hợp, đặc biệt là buta-1,3-diene. 48 lOMoARcPSD|208 990 13
5.3.1. Danh pháp, đồng phân, cấu trúc 5.3.1.1. Danh pháp * Nguyên tắc:
- Chọn mạch chính là mạch dài nhất có chứa các liên kết đôi
- Đánh số sao cho các số chỉ vị trí các liên kết đôi là nhỏ nhất.
- Gọi tên nhánh (gọi trước tên mạch chính) theo thứ tự bảng chữ cái.
- Nếu có nhiều nhánh giống nhau thì trước tên gọi thêm các tiền tố: di, tri,… Tên gọi: phần nền
+ a + các số chỉ vị trí của nối đôi + diene (chỉ tên mạch chính) CH2=CH CH=CH2 CH2=C CH=CH2 CH3 buta-1,3-diene
2-methylbuta-1,3-diene (isoprene) 5.3.1.2. Đồng phân
- Đối với các alkadiene liên hợp tồn tại dạng s-cis và s-trans.
5.3.1.3. Đặc điểm cấu trúc
* Cấu trúc của phân tử buta-1,3-diene :
- Trong phân tử buta-1,3-diene, các nguyên tử C mang nối đôi đều ở trạng thái lai hóa sp2. 1 2 3 4 CH2=CH CH=CH2
- Sự hình thành liên kết σ:
Nguyên tử Csp2 số 1và 4 dùng hai orbital lai hóa để xen phủ trục với 2 orbital s
của 2 nguyên tử H để tạo thành liên kết σ C-H. Obitan lai hóa còn lại sẽ xen phủ trục
với orbital lai hóa của nguyên tử Csp2 bên cạnh tạo liên kết σ C-C. Nguyên tử Csp2 số
2 và 3 dùng một orbital lai hóa để xen phủ trục với orbital s của 1 nguyên tử H để tạo
thành liên kết σ C-H. Hai orbital lai hóa còn lại sẽ xen phủ trục với 2 orbital lai hóa
của 2 nguyên tử Csp2 bên cạnh liên kết σ C-C.
Những nguyên tử Csp2 và tất cả các nguyên tử liên kết với chúng đều nằm trên
cùng một mặt phẳng gọi là mặt phẳng phân tử.
- Sự hình thành liên kết :
Ở mỗi nguyên tử carbon còn 1 obitan 2p không lai hóa. Các obitan 2p ở 4
nguyên tử C có trục song song với nhau sẽ xen phủ bên với nhau tạo thành liên kết .
Các orbital p đó không chỉ xen phủ với nhau từng đôi một để tạo ra các liên kết riêng
rẽ mà còn xen phủ liên tiếp với nhau tạo thành orbital chung cho toàn hệ liên hợp.
Sự liên hợp làm cho hệ bền hơn và làm cho liên kết C2-C3 (147 pm) ngắn hơn
liên kết đơn bình thường, còn các liên kết đôi C=C dài hơn so với khi nó ở biệt lập.
Trên thực tế, liên kết C2-C3 không phải hoàn toàn là liên kết σ mà nó có mật độ
electron nhất định nên có đặc tính yếu của liên kết đôi. 49 lOMoARcPSD|208 990 13
Hình 5.14. Sự xen phủ của các obital p tạo thành obital π chung cho toàn phân tử buta-1,3-diene
- Cấu trúc cộng hưởng: +CH CH=CH CH CH =CH CH=CH + CH CH=CH CH 2 2 2 2 2 2
Vì liên kết C2-C3 có đặc tính của liên kết đôi nên sự quay tự do của các nhóm
thế ở 2 đầu bị hạn chế. Do đó, về mặt lập thể buta-1,3-diene tồn tại 2 dạng chỉ khác
nhau về vị trí của 2 nhóm chưa no đối với liên kết đơn C2-C3. H H C H C H C H H C C C H H H H C C H H s-cis-buta-1,3-diene s-trans-buta-1,3-diene
5.3.2. Phương pháp điều chế 5.3.2.1. Từ ethanol - Phương pháp Lebedeep ZnO/Al 2O3 2 CH3CH2OH CH + H 2=CH CH=CH2 + 2 H2O 2 400-500oC
- Phương pháp Ostromulenski C Al2O3 2H5OH CH3CHO CH2=CHCH=CH2 H2O 300-400o 5.3.2.2. Từ acetylene CuCl 2 , NH4Cl H2 2 HC CH CH2=CH C CH CH2=CH CH=CH2 Pd , CaCO3
5.3.2.3. Tách nước từ diol hoặc tách HX từ dẫn xuất dihalogen 50 lOMoARcPSD|208 990 13 CH2CH2CH2CH2 CH2=CHCH=CH2 H2O OH OH
5.3.2.4. Từ các hydrocarbon có cùng số nguyên tử C Cr2O3/Al2O3
CH3CH2CH2CH3 + CH2=CHCH2CH3 + CH3CH=CHCH3 CH2=CH CH=CH2 + H2 0 650 C
5.3.3. Tính chất vật lý
Sự biến đổi các tính chất vật lý thông thường của alkadiene cũng tuân theo
những quy luật như đối với alkane và alkene.
5.3.4. Tính chất hóa học
5.3.4.1. Phản ứng cộng electrophile
Alkadiene có thể tham gia phản ứng cộng electrophile với HX, X2 (X là halogen).
a. Cộng hydrogen halide 1,2 CH3CH CH=CH2 CH 2=CH CH=CH2 + HBr Br 1,4 CH3 CH=CH CH2 Br Thành phần sản phẩm: sản phẩm cộng 1,2 sản phẩm cộng 1,4 Ở -800C 80% 20% Ở 400C 20% 80% b. Cộng halogen 1,2 CH2 CH CH=CH2 CH 2=CH CH=CH2 + Br2 Br Br 1,4 CH2 CH=CH CH2 Br Br
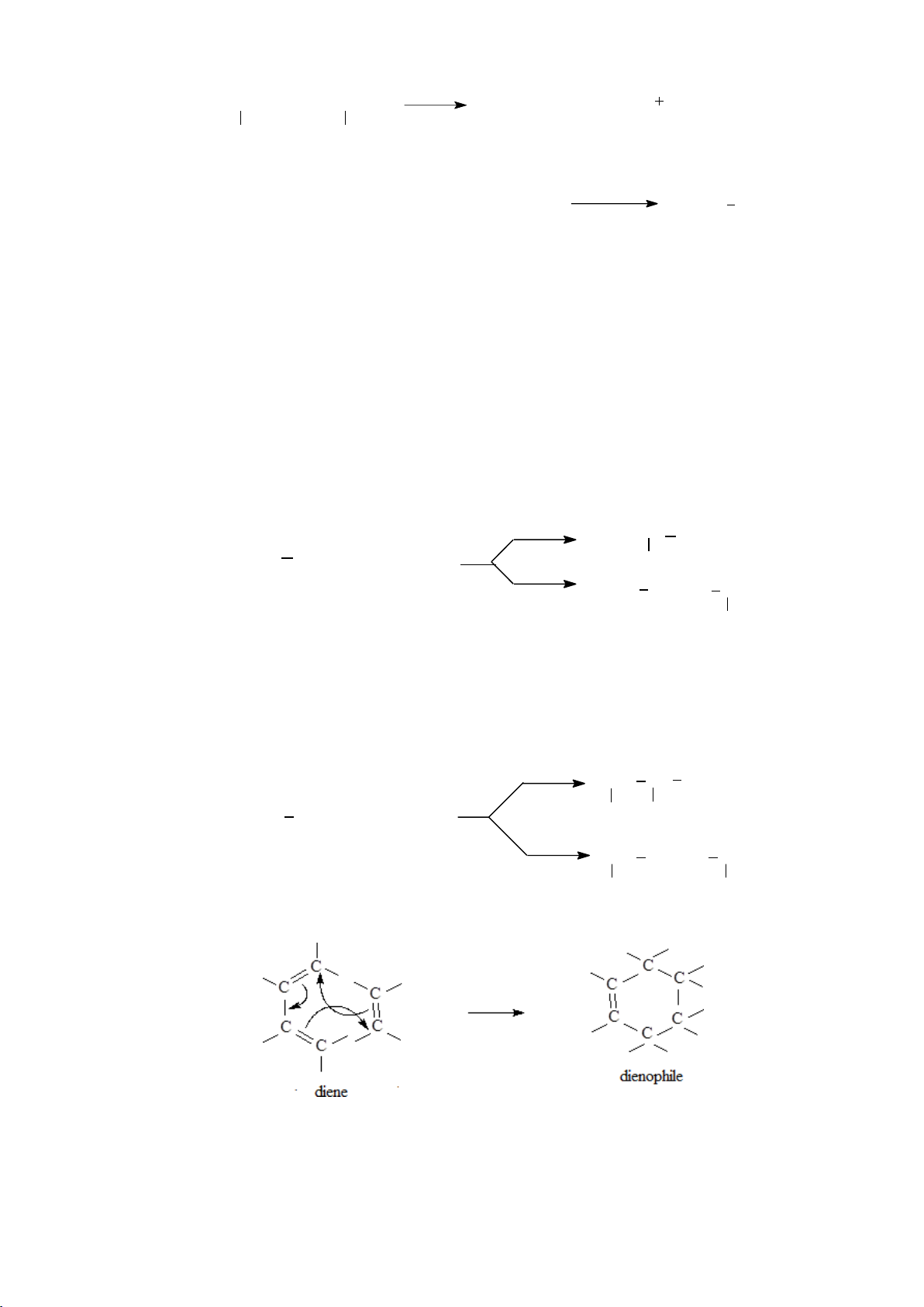
5.3.4.2. Phản ứng cộng đóng vòng [4+2] (phản ứng Diels Alder)
Hợp phần dienophile thường chứa nhóm thế hút electron gắn trực tiếp vào C không no. Ví dụ: 51 lOMoARcPSD|208 990 13 H C H CH CHO H H H CHO 2 C CH C C + C C CH2 C H H CH2 H H H C H
5.3.4.3. Phản ứng oxi hóa và khử hóa
a. Phản ứng oxi hóa
Alkadiene cũng bị oxi hóa bởi các tác nhân: KMnO4, O3…Tùy thuộc vào môi
trường phản ứng mà sản phẩm tạo thành có sự khác nhau. Phản ứng xảy ra tương tự alkene.
b. Phản ứng khử hóa - Hydrogen hóa xúc tác Ni CH2=CH CH=CH2 + 2 H2 CH3CH2CH2CH3 t 0 CH =CH CH=CH CH3CH=CHCH3 2 2 + H Ni 2 t 0 CH2=CHCH2CH3
- Khử hóa bằng kim loại hòa tan H3C H CH2=CH CH=CH2 Na/NH3 l C=C - 33 0C H CH 3 Có thể dùng: Na-Hg/C2H5OH
5.3.4.4. Phản ứng trùng hợp
Buta-1,3-diene có thể tham gia phản ứng trùng hợp tạo ra nhiều loại cao su quan trọng. - Cao su buna H H C=C nCH =CH C TiCl4, Al(C2H5)3 CH H=CH 2 2 CH 2 2 n - Cao su buna-S nCH2=CH CH=CH2 + nCH2=CH CH2 CH=CH CH2 CH2 CH C 6H5 C6H5 n
Ứng dụng : được dùng để sản xuất xăm, lốp ôtô. - Cao su buna–N 52 lOMoARcPSD|208 990 13 nCH2=CH CH=CH2 + nCH2=CH CH2 CH=CH CH2 CH CH2 CN CN n
Ứng dụng: được dùng để sản xuất bao tay bền với xăng, đệm tiếp xúc với dầu và dung môi.
5.3.5. Ứng dụng
- Trong dãy polyene thì các diene liên hợp có ứng dụng quan trọng hơn cả. Diene liên
hợp như butadiene, isoprene, ... được dùng để điều chế cao su tổng hợp.
- Trong thiên nhiên, các hydrocarbon loại polyene và các dẫn xuất của chúng rất phổ
biến ở giới thực vật. Ví dụ các terpenoid thường dùng làm các chất hương liệu hoặc dược liệu quý. CÂU HỎI ÔN TẬP
1. Bốn alkene A, B, C, D dều có cùng công thức phân tử C6H12. Khi cho chúng tác
dụng với O3, rồi khử sản phẩm ozonide sinh ra thì thấy A và B chỉ cho sản phẩm hữu
cơ duy nhất là CH3CH2CHO, C chỉ cho sản phẩm duy nhất là CH3COCH3, còn D cho
hỗn hợp cả hai sản phẩm trên. Xác định công thức cấu trúc của A, B, C và D, biết rằng
A có nhiệt độ nóng chảy cao hơn B.
2. Hợp chất hữu cơ X có công thức phân tử là C10H16. Khi ozone phân X thu được chất Y có cấu tạo như sau: CH3 CO CH2 CH CH CH2 CHO C CH3 CH3
a. Xác định công thức cấu tạo của X.
b. Hydrogen hóa X với xúc tác kim loại tạo ra hỗn hợp sản phẩm Z gồm các đồng phân
có công thức phân tử là C10H20. Viết công thức cấu tạo các chất trong Z.
3. Xác định công thức cấu tạo của các chất trong sơ đồ phản ứng sau, với các chất
trong sơ đồ là sản phẩm chính: 53 lOMoARcPSD|208 990 13 I A 1. Hg(OCOCH3)2 Br2 , CCl4 B 2. NaBH 4 , OH H2 , Ni HBr H 1.BH3 2. H C 2O2 , OH CH OOCH 3 3 H2O , H+ C6H5CO3H G Br2 , H2O D E
4. Xác định sản phẩm của các phản ứng sau: a. KMnO4 H2O b. 1. O3 2. Zn , CH3COOH c. 1. O3 2. H2O , H2O2 d. K2Cr2O7 , H2SO4 OH CH3 HBr e. CH3OOCH3
5. Hoàn thành các phản ứng cộng hợp đóng vòng Diels Alder sau: 54 lOMoARcPSD|208 990 13 to a. CH COC CCOCH 3 3 CH 3 O O b. O to CH3 O to c. Cl O d. to CH2 CH CHO O O o e. O t
6. Từ các chất đã cho ban đầu, các chất hữu cơ chứa không quá 3 nguyên tử carbon và
các chất vô cơ cần thiết, viết các phương trình phản ứng điều chế: a. Br b. CH CH c. CH CH 3CH2CH CH2 3C CCH3 d.
7. Xác định công thức cấu tạo của các chất trong sơ đồ phản ứng sau, với các chất
trong sơ đồ là sản phẩm chính: 55 lOMoARcPSD|208 990 13 H A H AgNO 2 B 3 , NH3 Pd , PbCO3 Br2 , CCl4 H propyne G 2O HBr HgSO C 4 , H2SO4 , to HBr , CH3OOCH3 NaNH2 , NH3 l D E
8. Hai hydrocarbon X và Y có cùng công thức phân tử là C6H10 và cùng làm mất màu
nước bromine. X tác dụng với AgNO3 trong dung dịch ammonia tạo kết tủa vàng, tác
dụng với dung dịch KMnO4 trong môi trường acid cho khí carbon dioxide và
trimethylacetic acid. Y không phản ứng AgNO3 trong dung dịch ammonia . Khi ozone
phân Y thì thu được acetic acid và isobutyric acid. Xác định công thức cấu tạo của X,
Y và viết các phương trình phản ứng xảy ra. 56 lOMoARcPSD|208 990 13
CHƯƠNG 6: HYĐROCARBON THƠM
* Đặc điểm cấu trúc của hợp chất thơm
- Vòng có cấu trúc phẳng.
- Có hệ liên hợp khép kín với (4n + 2) electron , trong đó n có thể là 0, 1, 2, 3…(gọi
là quy tắc Huckel hay quy tắc 4n + 2). * Tính thơm
Tính bền của vòng kết hợp với khuynh hướng dễ tham gia các phản ứng thế
electrophile, khó tham gia phản ứng cộng và oxi hóa.
6.1. Benzene và các chất đồng đẳng
6.1.1. Danh pháp, đồng phân, cấu trúc 6.1.1.1. Danh pháp
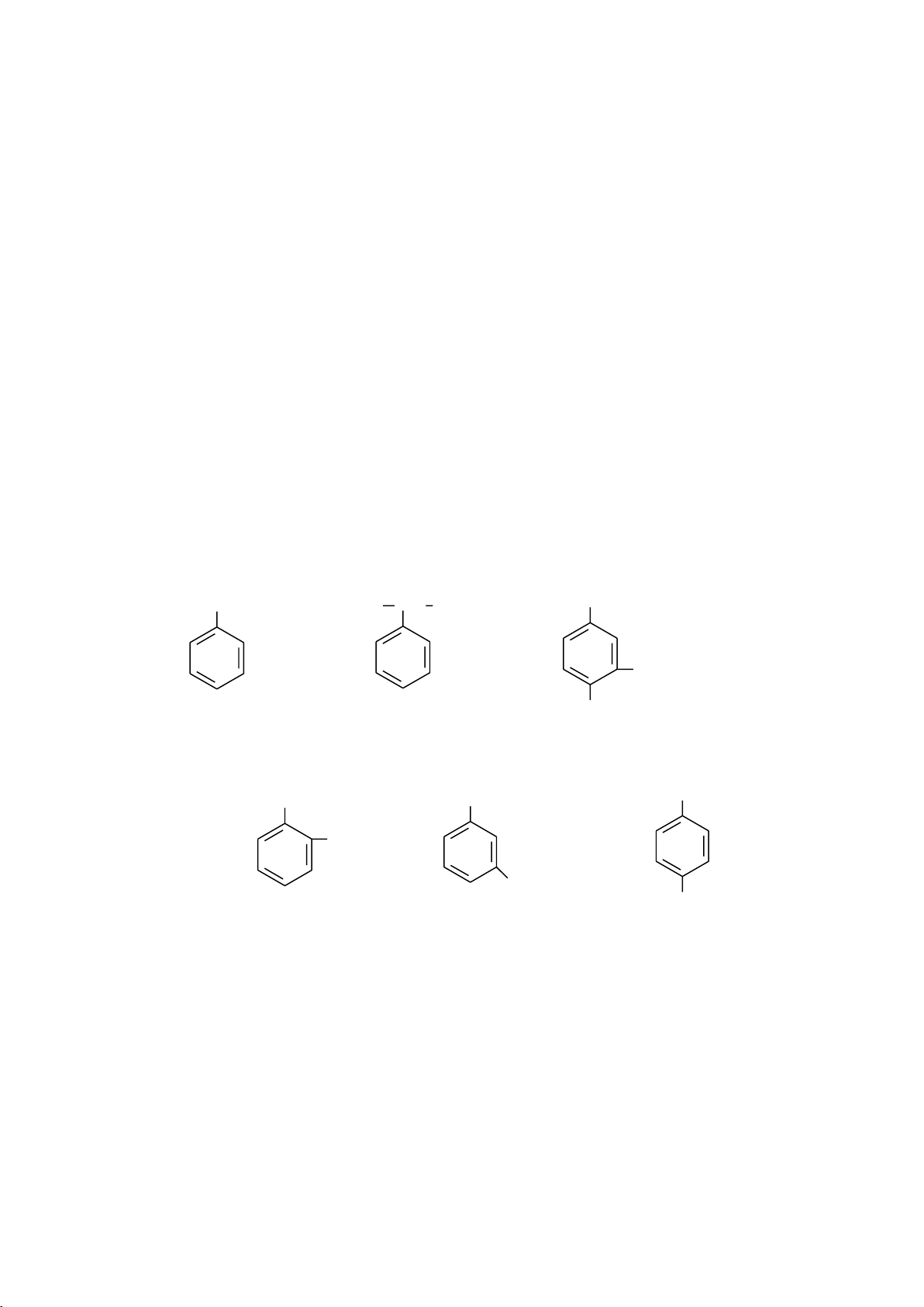
a. Tên các đồng đẳng của benzene
- Tên thay thế: tên gốc alkyl + benzene
- Tên thông thường: một số đồng đẳng của benzene có tên thông thường. CH3 CH3 CH CH3 CH2CH2CH2CH3 CH3 C2H5 methylbenzene isopropylbenzene
4- butyl-1-ethyl-2-methylbenzene (toluene) (cumene) CH3 CH 3 CH3 CH 3 CH3 CH3 1,2-dimethylbenzene 1,3-dimethylbenzene 1,4-dimethylbenzene o-dimethylbenzene m-dimethylbenzene p-dimethylbenzene o-xylene m-xylene p-xylene b. Tên gốc C6H5- C6H5CH2- CH3C6H4- phenyl benzyl (o-, m-, p-)tolyl 6.1.1.2. Đồng phân
- Đồng phân về mạch carbon. 57 lOMoARcPSD|208 990 13 CH2CH2CH3 CH3 CH CH3
- Đồng phân về vị trí của các nhóm thế. C C 2H5 C 2H5 2H 5 C 2H5 C 2H5 C 2H5
6.1.1.3. Cấu trúc phân tử benzene
a. Công thức cổ điển
Công thức cấu tạo của benzene được Kekule đề ra lần đầu tiên vào năm 1865.
Đó là vòng sáu cạnh, có ba liên kết đôi và ba liên kết đơn xen kẽ nhau, gọi là công thức Kekule:
Với công thức này không giải thích được đầy đủ tính chất của benzene.
b. Theo quan điểm hiện đại
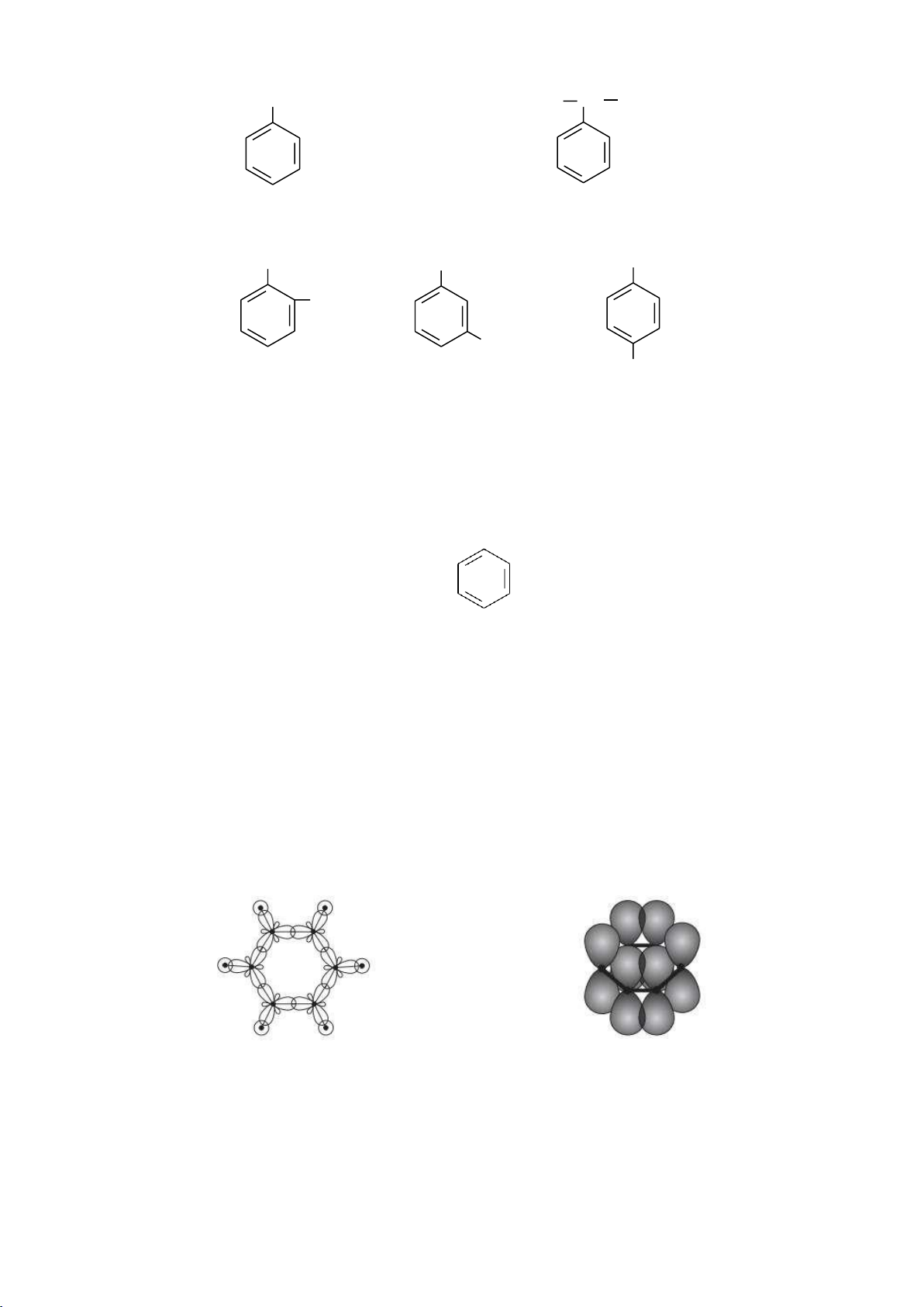
Theo thụyết orbital phân tử, benzene là một phân tử phẳng, sáu nguyên tử
carbon và sáu nguyên tử hydrogen đều nằm trên một mặt phẳng. Mỗi nguyên tử
carbon ở trạng thái lai hóa sp2, ba orbital lai hóa tạo ba liên kết với hai nguyên tử
carbon bên cạnh và với một nguyên tử hydrogen. Orbital p còn lại của mỗi nguyên tử
carbon xen phủ bên với hai orbital p của hai nguyên tử carbon bên cạnh tạo liên kết .
Như vậy, những electron p này được phân bố đều trong vòng benzene làm cho liên kết
bền vững và phân tử ổn định.
Hình 6.1. Sự hình thành các liên kết
Hình 6.2. Sự hình thành các liên kết
trong phân tử benzene
trong phân tử benzene
Để biểu diễn công thức cấu tạo của benzene, ta có thể dùng 1 trong 3 công thức sau: 58 lOMoARcPSD|208 990 13 (1) (2) (3)
6.1.2. Phương pháp điều chế
6.1.2.1. Benzene và đồng đẳng được thu từ quá trình chưng cất than đá và chưng cất dầu mỏ.
6.1.2.2. Từ acetylene, hexane, cyclohexane Ni (C 3 CH CH 6H5)3P (CO) 2 2 C H to, P 6 6 CH (CH ) CH Al2O3, Cr2O3 C H 4 H2 3 2 4 3 to 6 6 Al2O3, MoO3 3 H to 2
6.1.2.3. Tổng hợp theo phương pháp Friedel - Crafts AlCl3 C H RX C H R HX 6 6 6 5
6.1.2.4. Tổng hợp theo phương pháp Wurtz -Fittig C6H5X 2 Na RX C6H5R 2 NaX
6.1.3. Tính chất vật lý
Benzene và đồng đẳng thường ở trạng thái lỏng, không tan trong nước nhưng
tan trong các hydrocarbon khác và trong nhiều dung môi hữu cơ.
Nhiệt độ sôi của các benzene và đồng đẳng tăng dần theo phân tử khối, còn
nhiệt độ nóng chảy thường phụ thuộc nhiều vào tính đối xứng của phân tử.
6.1.4. Tính chất hóa học
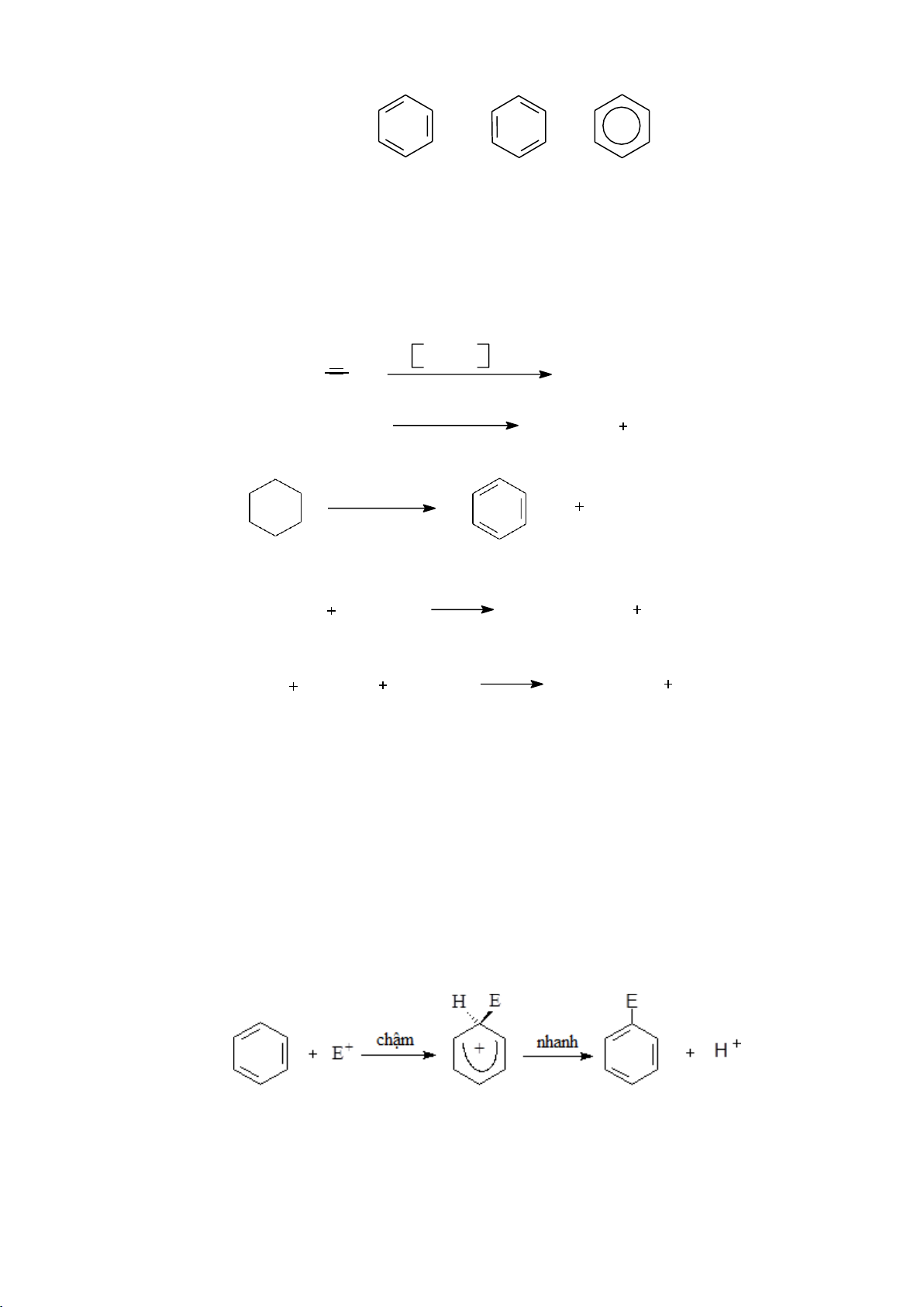
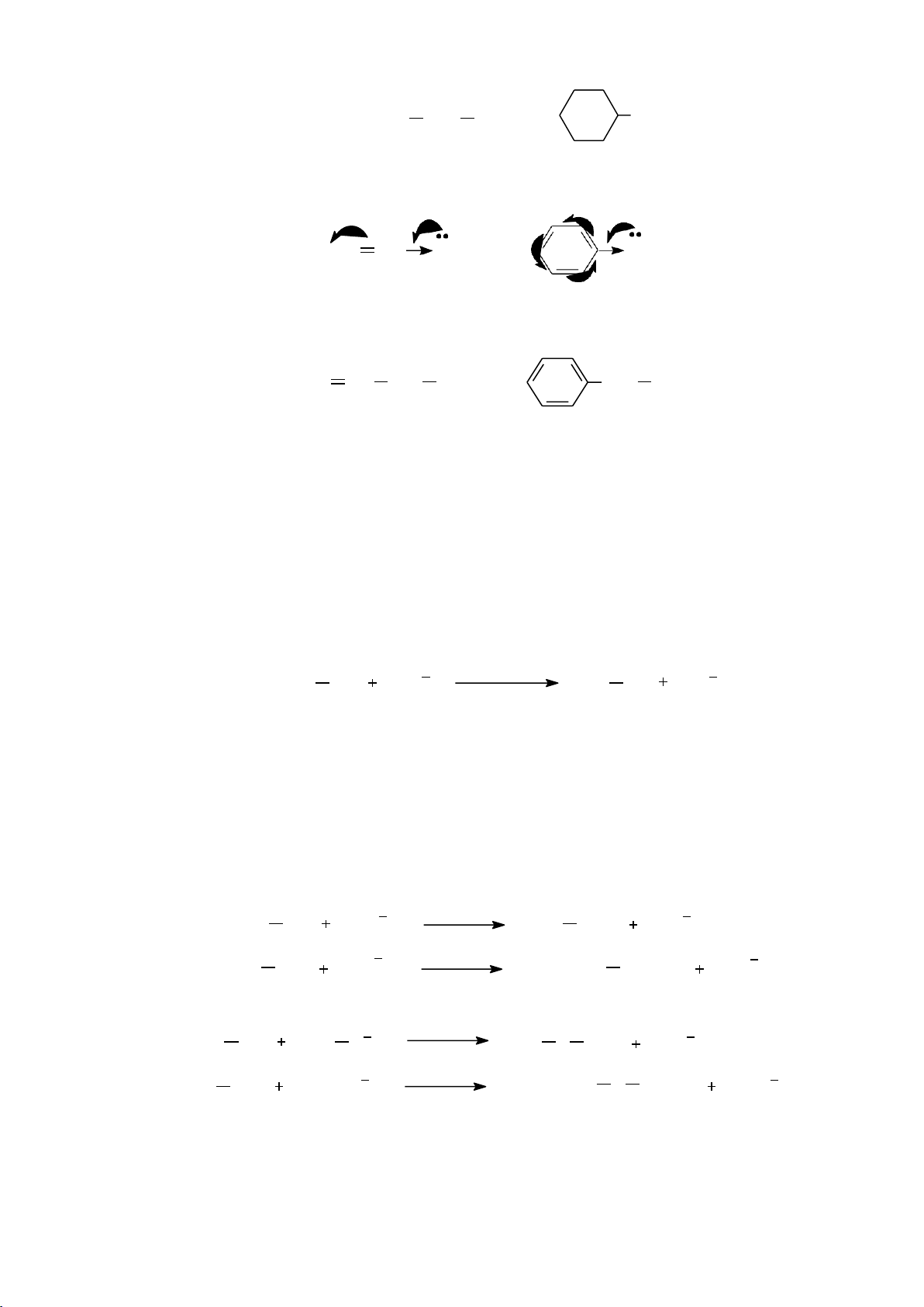
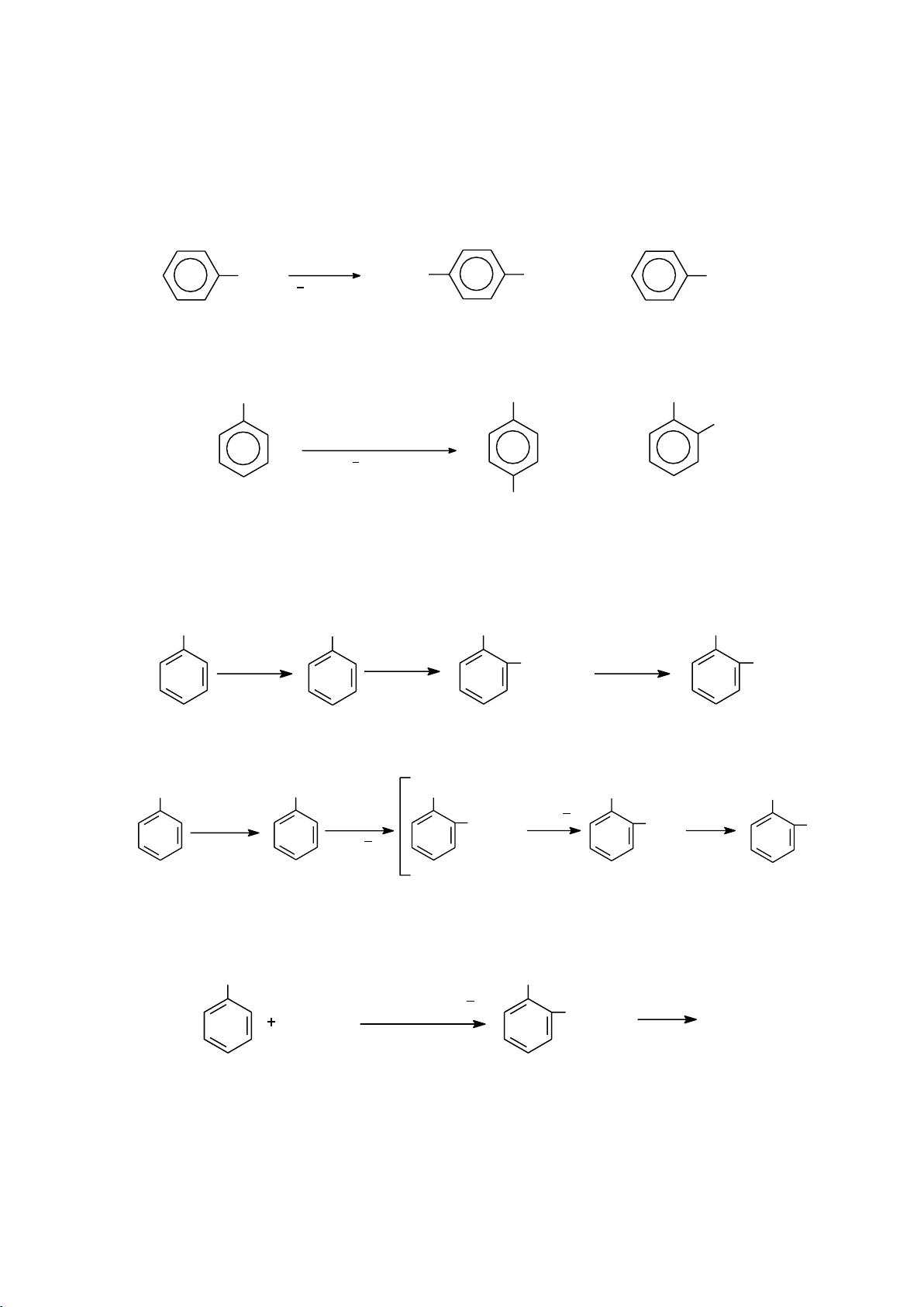
6.1.4.1. Phản ứng thế electrophile vào nhân thơm (SEAr) a. Cơ chế chung Phức
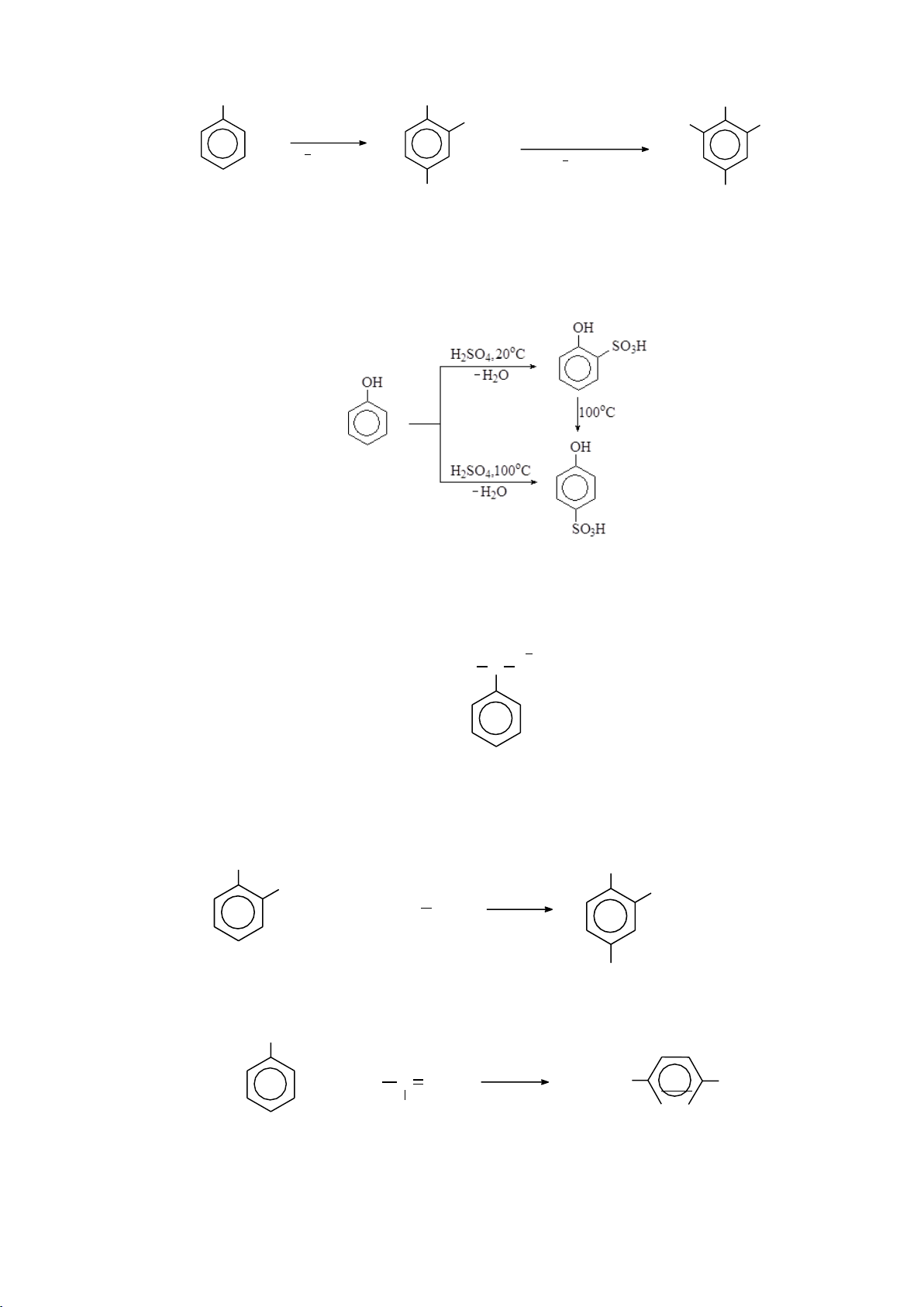
b. Một số phản ứng thế electrophile 59 lOMoARcPSD|208 990 13 - Phản ứng halogen hóa - Phản ứng nitro hóa NO2 H HNO 2SO4 3 H2O - Phản ứng sulfo hóa SO3H H2SO4 H2O - Phản ứng alkyl hóa
Các tác nhân alkyl hóa: RX/AlCl3, ROH/H+, alkene/H+ R AlCl3 RX HX R H+ ROH H2O R CH CH 3 H+ RCH CH 2 - Phản ứng acyl hóa
Các tác nhân acyl hóa: RCOCl, (RCO)2O. 60 lOMoARcPSD|208 990 13 COR AlCl3 RCOCl HCl COR AlCl3 (RCO) RCOOH 2 O
c. Quy luật thế ở dẫn xuất một lần thế
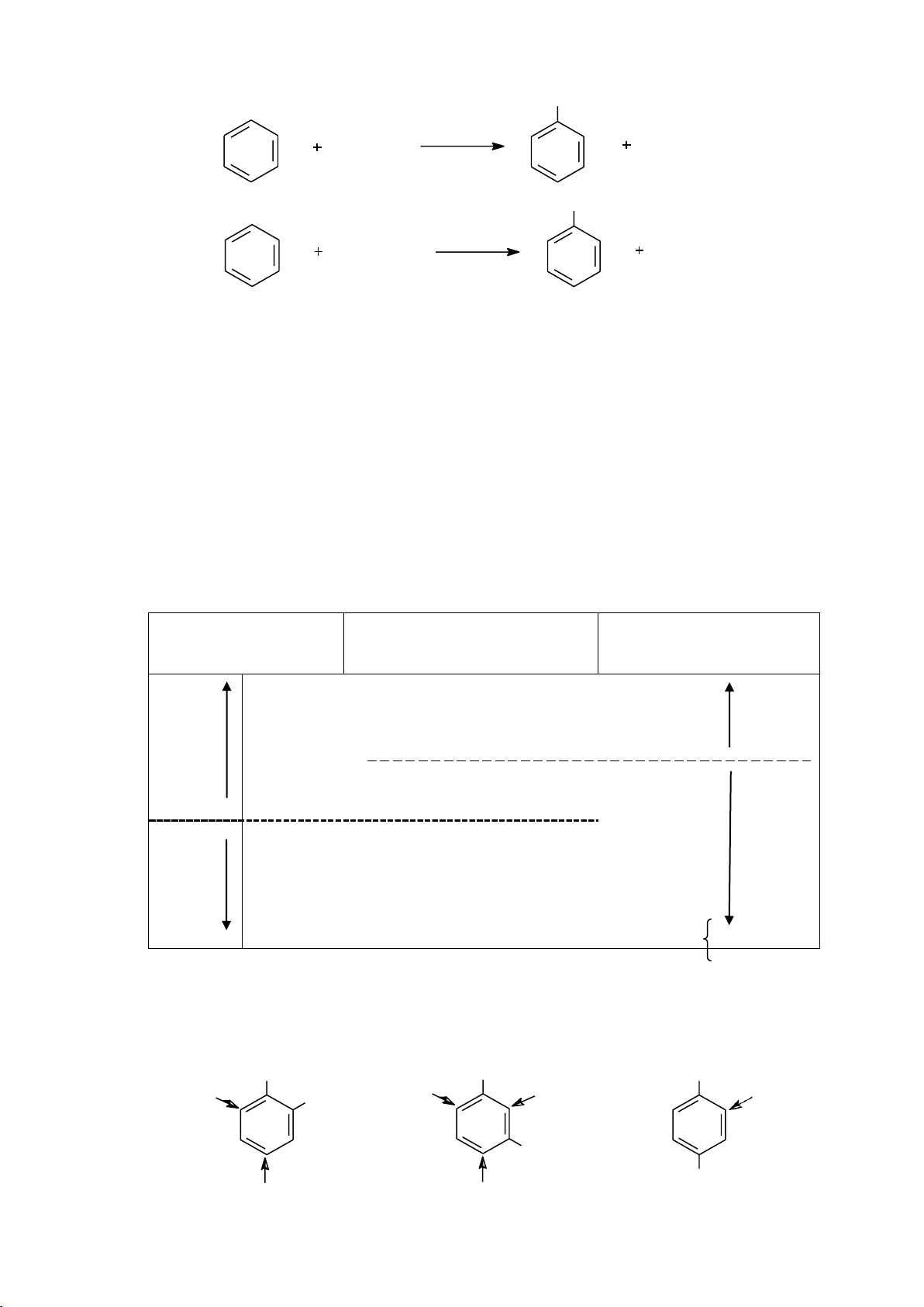
Mỗi một nhóm thế có mặt trong vòng đều ảnh hưởng đến phản ứng thế electrophil về hai mặt:
+ Khả năng phản ứng của vòng đối với tác nhân E+. Khả năng này được đánh giá
bằng tốc độ phản ứng tương đối (k) so với benzene (k = 1). Nhóm thế làm cho k >1 được
gọi là nhóm hoạt hóa, nhóm thế làm cho k <1 được gọi là nhóm phản hoạt hóa.
+ Sự định hướng cho tác nhân nhân E+ tấn công. Theo sự định hướng ta phân
biệt: nhóm định hướng ortho và para, nhóm định hướng meta. Mức độ định hướng
được đánh giá bằng tỷ lệ % sản phẩm.
Bảng 6.1. Ảnh hưởng của nhóm thế đến hướng và khả năng thế electrophile Ảnh hưởng đến Nhóm thế
Ảnh hưởng đến khả
hướng của phản ứng năng phản ứng Định mạnh { -NH2, -NHR, -NR2, -OH } mạnh Hoạt hướng trung bình { -OR, -NHCOR } trung bình hóa o, p -R, -C6H5 } yếu yếu -Br, -Cl, -F } yếu Phản { -CHO, -COR, -COOH trung bình hoạt Định yếu { -SO3H, -CN hóa hướng
trung bình { -NO2, -N+R3, -S+R2 } mạnh m mạnh
d. Qui luật thế ở dẫn xuất hai lần thế
- Nếu hai nhóm thế đều là những nhóm hoạt hóa thì nhóm hoạt hóa mạnh hơn sẽ
chiếm ưu thế trong sự định hướng. OCH OCH 3 3 OCH3 (ít) CH3 CH3 CH3 61 lOMoARcPSD|208 990 13
- Nếu một nhóm thế là nhóm hoạt hóa, còn nhóm thứ hai là phản hoạt hóa thì nhóm
hoạt hóa sẽ ưu tiên trong sự định hướng. CH CH3 3 CH3 (ít) NO2 NO2 NO2
- Nếu hai nhóm thế ở vị trí meta đối với nhau, khả năng phản ứng của vị trí ở giữa hai
nhóm thế đó đều rất thấp (do hiệu ứng không gian). CH Br 59% 3 9% 62% 1% Cl Cl 32% 37% 6.1.4.2. Phản ứng cộng
Phản ứng cộng vào vòng benzene có thể xảy ra, song tương đối khó khăn. a. Cộng hydrogen Ni 3 H2 150oC, 10atm b. Cộng chlorine Cl Cl as Cl 3 Cl2 50oC Cl Cl Cl hexachlorocyclohexane
Sản phẩm này có tám đồng phân lập thể trong đó chỉ có đồng phân là có hoạt tính trừ sâu rất cao.
6.1.4.3. Phản ứng oxi hóa
a. Oxi hóa hoàn toàn to C H 3n - 3 O n CO (n - 3) H O n 2n - 6 2 2 2 2
b. Oxi hóa không hoàn toàn
Khác với alkene và cycloalkene, benzene không tác dụng với dung dịch
KMnO4 loãng. Tuy vậy, ở nhiệt độ cao và có mặt chất xúc tác V2O5, benzene bị oxi
hóa bởi oxygene không khí. 62 lOMoARcPSD|208 990 13 O 9 V2O5 O 2 H O CO O 2 2 2 2 400 - 450oC O 1. 3O3 3 HCO CHO 2. Zn, CH3COOH
6.1.4.4. Các phản ứng ở mạch nhánh của alkylbenzene
a. Halogen hóa mạch nhánh
Khi chiếu sáng hoặc (và) đun nóng, chlorine và bromine có thể thế H ở nhánh
alkyl một cách dễ dàng, nhất là ở vị trí . CH CH as CHBrCH HBr Br 2 3 2 3 110oC 350oC CH CH Cl CHClCH HCl 2 3 2 3 ( saûn phaåm chính)
Nếu dùng N-bromosuccinimide phản ứng thế bromine cũng xảy ra ở vị trí .
b. Oxi hóa thành acid thơm KMnO 4 , H2O H3O+ C6H5CH3 C C 100oC 6H5COOK 6H5COOH C H CH CH K2Cr2O7 , H2SO4 C H COOH 6 5 2 3 to 6 5
Phản ứng oxi hóa H bậc ba bởi oxygen tạo ra hydrpeoxide được dùng để sản xuất phenol và acetone. O2 , Na2CO3 H2SO4 C6H5 C(CH3)2 C C 85oC 6H5 C(CH3)2 H 6H5OH CH3COCH3 2 O H OOH
6.1.5. Ứng dụng
6.1.5.1. Ứng dụng của benzene
a. Tổng hợp monomer
- Nhờ phản ứng thế và phản ứng tách hydrogen, từ benzene và ethylene điều chế
styrene C6H5CH=CH2 dùng để sản xuất chất dẻo polystyrene và cao su buna-S.
- Nhờ phản ứng cộng hydrogen thành cyclohexane và một loạt phản ứng tiếp theo, từ
benzene tổng hợp caprolactam để sản xuất tơ capron (nylon-6) và adipic acid để sản xuất tơ nylon-6,6.
b. Tổng hợp thuốc trừ sâu 63 lOMoARcPSD|208 990 13
- Nhờ phản ứng cộng chlorine, từ benzene điều chế thuốc trừ sâu C6H6Cl6 (666). Nhờ
phản ứng chlorine hóa thành chlorobenzene C6H5Cl rồi cho ngưng tụ với chloral
CCl3CHO, điều chế được thuốc trừ sâu DDT mà tên hệ thống là 1,1,1-trichloro-2,2- bis(4-chlorophenyl)ethane.
c. Tổng hợp phẩm nhuộm, dược phẩm, chất giặt rửa tổng hợp
- Nhờ phản ứng nitro hóa, rồi khử nhóm nitro và một số phản ứng tiếp theo, từ
benzene tổng hợp một nhóm rất nhiều phẩm nhuộm quan trọng gọi là phẩm nhuộm azo
và tổng hợp một số dược phẩm.
- Nhờ phản ứng alkyl hóa tạo thành alkylbenzene có mạch dài 10-14 carbon rồi sulfo
hóa vòng thơm và trung hòa sẽ được chất giặt rửa tổng hợp loại RC6H4SO3Na. d. Dung môi
- Một lượng đáng kể benzene được dùng làm dung môi cho chất hữu cơ như chất vô cơ.
6.1.5.2. Ứng dụng của toluene
a. Dùng làm dung môi
b. Nguồn nguyên liệu quan trọng cho tổng hợp hữu cơ
- Toluene là nguồn nguyên liệu để tổng hợp chất nổ TNT (2,4,6-trinitrotoluene),
benzoic acid C6H5COOH, saccharine (đường hóa học),… 6.2. Các aren khác
6.2.1. Hydrocarbon thơm có mạch nhánh không no
Hydrocarbon thơm có mạch nhánh không no, đơn giản và quan trọng nhất là
styrene (vinylbenzene, phenylethylene).
6.2.1.1. Phản ứng của styrene a. Cộng hydrogen H2 , Ni H2 , Ni CH CH CH 2 CH 25oC , 2-3 atm 2CH3 100oC , 100 atm 2CH3
b. Cộng các tác nhân khác C6H5CH CH2 HA C6H5 CH CH3 A ( HA: HOH, HHal, H2SO4...) C6H5CH CH2 X2 C6H5CHXCH2X ( X 2: Br2, Cl2) c. Trùng hợp 64 lOMoARcPSD|208 990 13 (C6H5COO)2 n CH CH2 CH CH2 C6H5 C6H5 n polystyrene d. Oxi hóa KMnO4 , H2SO4 C6H5CH CH2 C6H5COOH CO2 C6H5CO3H C H CH CH C H CH CH 6 5 2 6 5 2 O styrene oxide
6.2.1.2. Phương pháp điều chế styrene
Phương pháp cơ bản là dựa vào các phản ứng tách, bao gồm tách hydrogen của
ethylbenzene (xúc tác Cr2O3 / Al2O3 , 600oC), tách HX từ dẫn xuất halogen
C6H5CHXCH3 hoặc C6H5CH2CH2X ( KOH / C2H5OH) và tách nước từ alcohol
C6H5CHOHCH3 hoặc C6H5CH2CH2OH (xúc tác H+, to).
6.2.2. Hydrocarbon thơm chứa nhiều vòng benzene riêng rẽ 6.2.2.1. Biphenyl
Biphenyl là chất rắn có mùi thơm đặc trưng. Khi ở trạng thái tinh thể, phân tử
biphenyl đồng phẳng, tức là hai vòng benzene nằm trên một mặt phẳng và có sự liên
hợp bình thường. Ở trạng thái hơi, các mặt phẳng của hai vòng tạo với nhau một góc
= 45o, do đó sự liên hợp giữa hai vòng bị vi phạm một phần. Góc lệch sẽ tăng lên
nếu trong phân tử có nhóm thế ở vị trí 2 và 2. 3' 2' 2 3 1' 1 4' 4 5' 6' 6 5
Hình 6.3. Các mặt phẳng vòng trong phân tử biphenyl
Về tính chất hóa học, biphenyl có nhiều nét tương tự benzene. Các phản ứng
halogen hóa, sulfo hóa, … xảy ra ưu tiên ở vị trí 4 và 4, sau đó đến các vị trí 2 và 2. O2N HNO3 HNO3 O N NO O N NO 2 2 2 2 NO2 65 lOMoARcPSD|208 990 13
Biphenyl được điều chế từ C6H5Br và Na (sinh ra C6H5C6H5 và NaBr) , từ
C6H5I và Cu (sinh ra C6H5C6H5 và CuI2) hoặc nhiệt phân benzene ở 700oC (sinh ra C6H5C6H5 và H2). 6.2.2.2. Diphenylmethane
Diphenylmethane là chất rắn có mùi hoa cam, dễ tham gia các phản ứng ở
nhóm -CH2- linh động, song cũng có phản ứng ở vòng benzene. to H2 CH2 CH2 diphenylmethane fluorene ( to = 115oC) nc KMnO4 C6H5CH2C6H5 C6H5COC6H5 benzophenone
Biphenyl được điều chế từ benzene và benzyl chloride (xúc tác AlCl3). 6.2.2.3. Triphenylmethane
Triphenylmethane (C6H5)3CH là chất rắn không màu. Do ảnh hưởng của ba gốc
phenyl, nguyên tử hydrogen trong nhóm C-H có tính acid (pK a 33) . NH3 l (C H ) C H NaNH (C H ) C Na+ NH 6 5 3 2 6 5 3 3
Nhóm C-H của triphenylmethane còn dễ dàng tham gia các phản ứng oxi hóa
thành alcohol và halogen hóa thành dẫn xuất halogen. Những sản phẩm này có thể
chuyển hóa lẫn nhau một cách dễ dàng. H2O Cl (C H ) 2 [O] H ) C OH C Cl (C (C 6H5)3C H 6 5 3 6 5 3 HCl
Triphenylmethane được điều chế từ benzene và chloroform bằng phản ứng Friedel - Crafts. AlCl 3 3 C6H6 CHCl3 (C6H5)3CH 3 HCl
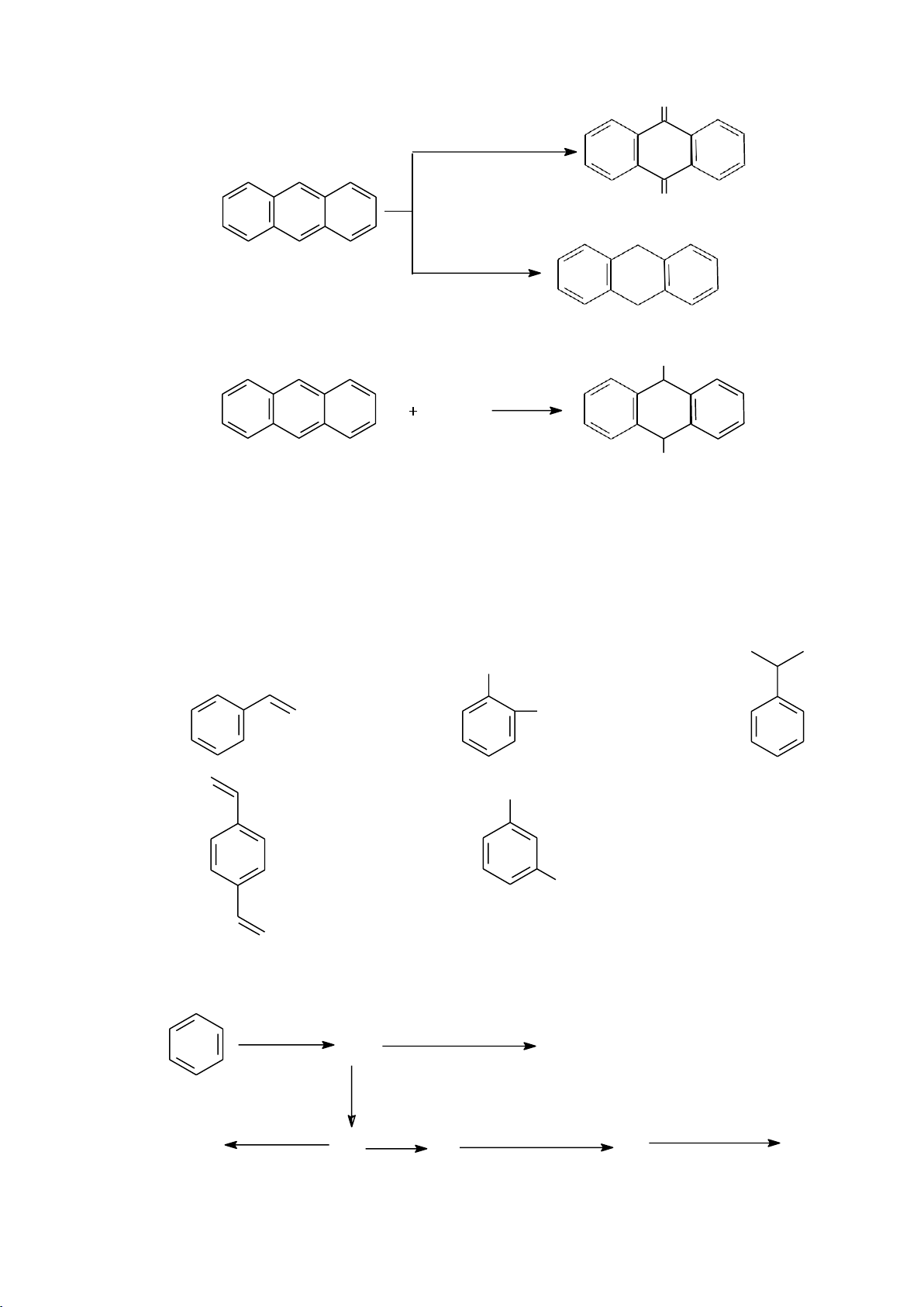
6.2.3. Hydrocarbon thơm chứa nhiều vòng benzene ngưng tụ 6.2.3.1. Naphthalene 8 1 7 2 6 3 5 4 66 lOMoARcPSD|208 990 13
1, 4, 5, 8 còn gọi là vị trí
2, 3, 6, 7 còn gọi là vị trí
Naphthalene có cấu trúc của một hợp chất thơm. Nó có cấu tạo vòng phẳng, có
hệ liên hợp khép kín với 10 e .
Các công thức cộng hưởng của naphthalene: hay
a. Phản ứng thế electrophile
Phản ứng thế xảy ra ưu tiên ở vị trí 1 hay . NO2 HNO3 , H2SO4 Br Br2 CH 3COOH, H2O COCH3 CH3COCl, C6H5NO2 COCH3 AlCl3 (75%) (25%) SO3H H2SO4 60oC H 2SO4 SO3H 150oC
b. Phản ứng oxi hóa
Naphthalene dễ bị oxi hóa hơn benzene. K2Cr2O7 , H2SO4 COOH COOH O O2 , V2O5 O 450oC O 67 lOMoARcPSD|208 990 13
Nếu trong vòng phân tử naphthalene có nhóm thế thì vòng nào được hoạt hóa hơn sẽ bị oxi hóa. NO NO 2 2 K2Cr2O7 , H2SO4 COOH COOH NH2 K2Cr2O7 , H2SO4 COOH COOH c. Phản ứng khử
Cũng như benzene, sự khử naphthalene chỉ xảy ra trong những điều kiện nghiêm ngặt. H2 , Ni to decaline Na , C5H11OH to tetralin
6.2.3.2. Anthracene và phenanthrene 6 5 7 8 9 1 4 7 2 3 8 6 3 2 9 5 10 4 1 10 anthracene phenanthrene
Anthracene và phenanthrene có tính chất hóa học tương tự nhau. Chúng đều dễ
tham gia các phản ứng oxi hóa, khử và cộng bromine hoặc chlorine ở các vị trí 9, 10
và thế bromine ở vị trí số 9. 68 lOMoARcPSD|208 990 13 O K2Cr2O7 , H2SO4 O Na , C2H5OH Cl as Cl2 Cl CÂU HỎI ÔN TẬP
1. Gọi tên các hợp chất sau theo hệ danh pháp IUPAC và theo tên gọi thông thường nếu có: CH3 CH3 a. b. c. CH3 d. e. C2H5
2. Hoàn thành sơ đồ phản ứng sau, biết các chất phản ứng với nhau theo tỷ lệ mol là 1:1. CH3COCl HNO3 , H2SO4 A B AlCl3 Zn / Hg , HCl KMnO Br KOH , C 2 2H5OH HBr D 4 C E G H to as CH3OOCH3 69 lOMoARcPSD|208 990 13
3. Bằng phương pháp hóa học, hãy phân biệt các chất lỏng: styrene, toluene, phenylacetylene và benzene.
4. Có ba hydrocarbon thơm A (C8H10), B (C9H12) và C (C9H12). Khi nitro hóa ở nhân
thơm, A cho hai dẫn xuất mononitro, B chỉ cho một dẫn xuất mononitro, C cho bốn dẫn xuất mononitro.
a. Xác định công thức cấu tạo của A, B, C và gọi tên chúng.
b. Đun nóng mỗi hydrocarbon trên với một lượng dư dung dịch KMnO4 đậm đặc. Viết
công thức cấu tạo của sản phẩm.
5. Xác định sản phẩm của mỗi phản ứng sau: to a. CH COC CCOCH 3 3 CH 3 O O b. O to CH3 O to c. Cl O d. to CH2 CH CHO O O o e. O t
6. Từ benzene, các chất hữu cơ chứa không quá 3 nguyên tử carbon và các chất vô cơ
cần thiết, viết các phương trình phản ứng điều chế: 70 lOMoARcPSD|208 990 13 COCH3 CH2CH2CH3 Br a. b. c. NO2 Br Br C 2H5 COOH CH3 d. b. NO g. 2 Br NO2 Br C(CH3)3
7. Xác định sản phẩm của các phản ứng sau: HNO3 , H2SO4 a. naphthalene (1:1) H2 , Ni b. naphthalene to , P H2SO4 , to c. anthracene (1:1) K2Cr2O7, H2SO4 d. phenanthrene Na , C e. phenanthrene 2H5OH 71 lOMoARcPSD|208 990 13
Chương 7. NGUỒN HYDROCARBON TRONG THIÊN NHIÊN
Nguồn hydrocarbon trong thiên nhiên chủ yếu là khí thiên nhiên, dầu mỏ, nhựa than đá.
7.1. Khí thiên nhiên và khí mỏ dầu
7.1.1. Trạng thái thiên nhiên
Khí thiên nhiên có ở các mỏ riêng biệt với áp suất rất lớn, khoảng 200 atm. Khí
cũng có ở phần trên các mỏ dầu tạo thành các mũ khí, những mũ khí này rất linh động để
điều hòa, ổn định áp suất trong mỏ dầu. Khi khai thác dầu, khí phun ra, cho nên người ta
còn gọi là khí đồng hành. Ngay trong dầu lửa cũng có một lượng nhỏ khí hòa tan.
Khí thiên nhiên còn hòa tan trong nước ngầm với trữ lượng rất lớn ở khắp nơi trên trái
đất. Người ta ước tính trữ lượng khí trong khí quyển ngầm còn lớn gấp ba bốn lần trữ
lượng dầu lửa và khí mỏ.
Ngoài các mỏ, trong thủy quyển ngầm, khí thiên nhiên còn chứa ở các chỗ
trống trong các mỏ than, đặc biệt giữa các vỉa than.
Khí thiên nhiên có ngay cả dưới đáy ao hồ. Người ta gọi là khí bùn ao.
Như vậy, khí thiên nhiên có ở trong lòng đất, trong thủy quyển ngầm, trong vũ trụ với
trữ lượng khổng lồ. Khí thiên nhiên ở trong lòng đất dưới dạng mỏ khí và dầu mỏ
được nghiên cứu nhiều và đã đưa vào sử dụng
7.1.2. Thành phần
- Khí thiên nhiên là những khí thoát ra từ các mỏ khí. Thành phần chủ yếu là methane
từ 90 -99%, còn lại là các đồng đẳng của methane, CO2, N2, đôi khi có H2S. Những loại
khí thiên nhiên nào có chứa nhiếu nitrogene thường lại có kèm theo helium và agon.
- Khí đồng hành hay khí mỏ dầu là những khí hòa tan trong trong dầu và thoát ra cùng
với dầu từ các mỏ dầu khai thác. Thành phần khí mỏ dầu khác với khí thiên nhiên ở
chỗ hàm lượng ethane, propane, butane và các hydrocarbon nặng chiếm một số lớn.
- Khí ngưng tụ là những khí thoát ra từ những mỏ khí ngưng tụ, khác với khí thiên
nhiên, ngoài methane còn có đồng đẳng của nó cho đến C5 và trên nữa với một lượng
khá lớn. Những hydrocarbon này khi thoát ra ngoài do áp suất giảm, chúng sẽ ngưng
tụ và có thành phần như khí thiên nhiên. Sự tạo thành các mỏ khí ngưng tụ chủ yếu
xảy ra trong các điều kiện áp suất cao và nằm sâu trong lòng đất (lúc này một số
hydrocarbon như ethane, propane sẽ chuyển sang trạng thái lỏng, trong điều kiện đó
những hydrocarbon lỏng của dầu mỏ sẽ hòa với khí đã bị nén lỏng đó và tạo nên các mỏ khí ngưng tụ).
7.1.3. Ứng dụng của khí thiên nhiên
Hiện nay khí thiên nhiên phần chủ yếu được dùng làm nhiên liệu. Khí khai thác
được dẫn trực tiếp bằng đường ống đến các trung tâm công nghiệp, hoặc để sử dụng 72 lOMoARcPSD|208 990 13
như là khí đốt chính được phân phối tới người sử dụng gia đình và công nghiệp. Nó có
giá trị nhiệt năng gần gấp đôi khí than. Các hydrocarbon trong khí tự nhiên có thể
được hoá lỏng dưới áp suất và được tách bằng cất nhiệt độ thấp.
Khí thiên nhiên công nghiệp không chỉ được sử dụng làm nhiên liệu cho công
nghiệp và sinh hoạt mà còn là chất đầu cho việc điều chế acetylene, hydrocyanide,
muội than, hydrogen cho khí tổng hợp, … Hydrosulfide tách từ khí thiên nhiên (người
ta tách các hợp phần acid bằng rửa khí thiên nhiên với ethanolamine) là nguồn quan
trọng để sản xuất sulfur, ngoài ra nó còn được chuyển thành sulfuric acid. Các
hydrocarbon tách được từ khí tự nhiên được sử dụng để điều chế gasoline, làm nhiên
nguyên liệu (propane lỏng dùng làm khí đốt, các butane dùng để chế butadiene cho cao
su tổng hợp ). Không khí và khí thiên nhiên được dùng sản xuất ammonia, urea, nitric acid và methanol. 7.2. Dầu mỏ
7.2.1. Tính chất vật lý, trạng thái thiên nhiên
Dầu mỏ là chất lỏng sánh, có mùi đặc trưng, nhẹ hơn nước và không tan trong
nước, có màu sẫm từ nâu đến đen. Dầu mỏ khai thác ở vùng thềm lục địa phía nam
nước ta là chất ở thể sánh đặc (vì chứa nhiều paraffin cao) và có màu nâu đen.
Trong thiên nhiên, dầu mỏ ở sâu trong lòng đất, thấm vào các lớp nham thạch
xốp trong một vùng rộng được bao bọc bởi một lớp nham thạch không thấm dầu và
khí, tạo nên ‘túi dầu’. ‘Túi dầu’ thường gồm ba lớp : lớp trên cùng là khí mỏ dầu, lớp
giữa là dầu lỏng có hòa tan khí, còn lớp dưới cùng là nước mặn.
Trữ lượng dầu mỏ trên thế giới theo nhiều nguồn dự báo dao động trong khoảng
550-600 tỉ tấn. Nguồn dầu mỏ chủ yếu (khoảng 70%) nằm ở Cận Đông (Ả rập Xê út,
Irắc, Cô Oét, Iran, Abu Đabi) và Liên Xô trước đây (vùng Uran-Vonga, Cápca, Siberi,
Cátpiên). Phần còn lại nằm rải rác ở nhiều nơi, như Bắc Mĩ (Tếchdát, Pensinvania,
Califonia, Alátka), Nam Mĩ (Venezuela, Acgentina, Brazin, Mehico, Peru), vùng Viễn
Đông (Trung Quốc, Ấn độ, Mã Lai, Indonesia, Việt Nam), châu Phi (Libi, Nigieria, Ai Cập, Xahara).
Ở Việt Nam, các mỏ dầu tập trung ở phía nam (Cửu Long, Nam Côn Sơn, Thổ Chu,…).
7.2.2. Sơ lược về nguồn gốc dầu mỏ và quá trình hình thành, phát triển ngành dầu khí
7.2.2.1. Nguồn gốc dầu mỏ
Có hai thuyết về dầu mỏ : thuyết nguồn gốc vô cơ và thuyết nguồn gốc hữu cơ.
Thuyết nguồn gốc vô cơ cho rằng dầu mỏ sinh ra do tác dụng trực tiếp giữa carbon
và hydrogen từ thời kì mới hình thành trái đất, hoặc do nước tác dụng với carbide kim loại
, nhất là carbide ferric. Tuy nhiên trong vỏ trái đất không thấy có carbide kim loại. Mặt
khác, trong dầu mỏ có vết tích của các chất nguồn gốc động vật và thực vật. Vì vậy thuyết
nguồn gốc vô cơ về dầu mỏ không được xác nhận. 73 lOMoARcPSD|208 990 13
Thuyết nguồn gốc hữu cơ cho rằng dầu mỏ được tạo thành từ những lượng khổng
lồ xác động vật và thực vật đã bị vùi sâu trong lòng đất từ thời xa xưa. Ở những điều kiện
về nhiệt độ và áp suất thích hợp, cùng với sự có mặt của các vi khuẩn yếm khí và các chất
xúc tác thiên nhiên, các hợp chất hữu cơ có trong xác động vật và thực vật bị chuyển hóa
từ từ sinh ra các hydrocarbon tạo nên dầu mỏ.
Phù hợp với thuyết nguồn gốc hữu cơ, người ta đã phát hiện thấy trong dầu mỏ có
những vết tích của chlorophyll…(có nguồn gốc thực vật), hemoglobin, hormone…(nguồn
gốc động vật). Mặt khác, bằng phương pháp phân hủy và chưng cất dưới áp suất cao
nhiều chất có nguồn gốc động vật và thực vật (mỡ cá, acid béo,…), người ta đã thu được
những hỗn hợp lỏng tương tự như dầu mỏ.
Vì những lẽ trên, thuyết nguồn gốc hữu cơ về dầu mỏ có sức thuyết phục cao hơn.
Khai thác dầu mỏ : hiếm khi ta gặp các túi dầu mỏ tập trung, đa phần dầu mỏ nằm xen
giữa các lớp đất đá (gọi là các vỉa dầu) dưới áp suất cao. Ta chỉ cần khoan lỗ để đưa dầu thô
nâu tối có lẫn cát và nước lên bề mặt. Nếu áp suất không đủ hoặc nó đã bị giảm, dầu được
bơm lên bề mặt. Cách khai thác này chỉ có thể rút dầu ra khỏi các vỉa dầu được khoảng 35%.
Ngày nay trên toàn thế giới đang tiến hành nghiên cứu mạnh mẽ nhằm tăng hiệu quả rút dầu
ra khỏi các vỉa dầu, như sử dụng chất hoạt động bề mặt, dung môi polymer, nạp CO2, đun
nóng nội vỉa (phương pháp nhiệt).
7.2.2.2. Quá trình hình thành, phát triển ngành dầu khí
Loài người đã biết dầu mỏ và khí đốt từ hàng nghìn năm trước đây, song mãi tới
thế kỷ XVIII mới bắt đầu biết chưng cất dầu mỏ và tới năm 1859 mới thực hiện được lỗ
khoan sâu gần 23 m. Từ đó đến nay, trong vòng hơn một thế kỷ, ngành công nghiệp dầu
mỏ đã hình thành và phát triển vượt bậc với tốc độ ngày càng nhanh.
Ở giai đoạn đầu của sự phát triển ngành công nghiệp dầu mỏ (1860-1885) dầu mỏ
chỉ được dùng để thắp sáng và đun nấu ; các sản phẩm khác của quá trình chưng cất dầu
mỏ hầu như bị bỏ phí. Trong những năm cuối của thế kỷ XIX (1885-1990) dầu bôi trơn có
nguồn gốc thực vật đã được thay thế rất nhanh bằng dầu nhờn lấy từ dầu mỏ. Bước sang
thế kỷ XX, ngay từ thập kỉ đầu tiên nhu cầu ngày càng tăng về xăng (để đáp ứng sự tăng
nhanh về số lượng ô tô) đã đòi hỏi phải thăm dò và khai thác những mỏ dầu mới. Tuy vậy
kỹ thuật chưng cất liên tục và cracking nhiệt chỉ được phát triển trong khoảng 1914-1930,
tiếp theo từ 1930 đến 1940 là kĩ thuật riforming nhiệt. Từ khoảng năm 1940 đến nay liên
tục phát triển các kĩ thuật hiện đại về chưng cất dầu mỏ, về cracking xúc tác, riforming
xúc tác,…nhờ đó phát triển ngành hóa học dầu mỏ.
Hiện nay công nghiệp dầu mỏ đã đạt đến đỉnh cao. Dầu mỏ có ứng dụng ở khắp
nơi, trong mọi ngành, không chỉ dưới dạng nhiên liệu mà còn trong các lĩnh vực khác như
nông nghiệp, y học, vệ sinh, xây dựng,… tức là hầu như trong mọi lĩnh vực ăn, mặc, ở,
lao động và sinh hoạt của con người. Sử dụng dầu mỏ trên toàn thế giới hiện nay ước
tính chừng 10-10,5 triệu tấn/ngày (3,8 tỉ tấn/năm). Khai thác dầu trên thế giới tăng khá
nhanh (cứ 10 năm tăng gấp rưỡi). 74 lOMoARcPSD|208 990 13
7.2.3. Thành phần dầu mỏ
Dầu mỏ thô là hỗn hợp phức tạp mà trước hết là các hydrocarbon gồm ba loại :
alkane, cycloalkane và arene. Tất cả các loại dầu mỏ, không có ngoại lệ, đều có chứa
các hydrocarbon của ba loại, nhưng tỉ lệ của chúng có thể thay đổi nhiều trong mỗi
trường hợp riêng biệt. Thí dụ, dầu mỏ Pensinvania gồm lượng lớn các alkane, trong
khi đó dầu mỏ từ Liên Xô trước đây và Rumani lại chứa tới 80% cycloalkane. Vì
những sự khác nhau này người ta phân biệt giữa dầu mỏ dựa trên cơ sở alkane và dầu
mỏ trên cơ sở cycloalkane. Loại dầu mỏ đầu chỉ chứa một lượng nhỏ arene, loại sau
chứa khá hơn. Một loại dầu mỏ thứ ba ít gặp là loại dầu mỏ arene. Thí dụ dầu mỏ
Inđônêxia (đảo Bonêô) lượng arene chiếm tới 40%. Hiện tượng ta gặp loại dầu mỏ
thuần túy là xăng hoặc gần như chỉ có bitum và sáp khoáng được giải thích do có sự
thẩm lọt dầu mỏ qua các lớp quặng dầu (sơ cấp và thứ cấp). Dưới ảnh hưởng của nước
hoặc áp suất, đặc biệt là sự vận động kiến tạo của vỏ quả đất, dầu mỏ có thể di chuyển
và được tích tụ lại trong những khe rãnh, hố ngầm. Khi thẩm lọt qua các lớp đất thành
phần nhẹ, linh động tràn đi. Các hydrocarbon có phân tử khối cao (nói chung thành
phần nặng) bị giữ lại bởi các chất khoáng hấp phụ. Chẳng hạn như ở Galixi (Balan)
người ta đã phát hiện ra các mỏ chỉ có atphan hoặc chỉ chứa ozokerit (sáp khoáng).
Dưới đây là các thành phần của dầu mỏ: 7.2.3.1. Các hydrocarbon a. Alkane
Hiện nay người ta đã nhận biết được một số lớn các alkane có trong dầu mỏ cho
đến C50, trong số đó tất cả các đồng phân của butane, pentane, hexane và một phần lớn
các đồng phân C7 - C9 đã được tách ra dưới dạng tinh khiết. Về thành phần tương đối
của các đồng phân qua phân tích sắc kí khí, người ta nhận thấy rằng trong các phân
đoạn có điểm sôi thấp thì alkane không nhánh chiếm tỉ lệ cao hơn các alkane đồng
phân có nhánh tương ứng và ở các phân đoạn có điểm sôi trung bình và cao
alkane mạch không nhánh chiếm tỉ lệ chủ yếu. b. Cycloalkane
Các cycloalkane chung nhất là cyclopentane, cyclohexane và các dẫn xuất alkyl
của chúng. Ngoài ra trong các phân đoạn có điểm sôi cao trên 2000C còn phát hiện
được các polycycloalkane. Hiện nay, người ta đã tách ra được dưới dạng tinh khiết
cyclopentane, cyclohexane, những dẫn xuất mono-, di- và trimethyl và dẫn xuất
monoethyl của chúng. Thí dụ : CH CH 3 3 CH3 CH3
1,1-trimethylcyclopentane 1,3-trimethylcyclopentane ( to ( to = 90,9oC) s = 87,5oC) s 75 lOMoARcPSD|208 990 13 CH3 C2H5 CH3 CH3 benzene
1,2,4-trimethylcyclohexane ethylcyclohexane o o ( to = 131,8oC) ( t s = 141,2 C) s c. Hydrocarbon thơm
Trong số các hydrocarbon thơm người ta đã tách được benzene và các đồng
đẳng của nó (toluene, các xylene, trimethyl- và tetramethylbenzene, ethylbenzene,
propylbenzene). Ở các phân đoạn sôi cao trên 2000C còn chứa cả naphthalene và đồng
đẳng của nó (mono-, di- và triphenylnaphthalene), tetralin, decalin, indane và phenanthrene.
7.2.3.2. Các hợp chất không phải hydrocarbon
Trong dầu mỏ ngoài các hydrocarbon còn có một lượng nhỏ các hợp chất hữu cơ khác.
a. Các hợp chất chứa oxygen
Các hợp chất chứa oxygen trong dầu mỏ chủ yếu là các hợp chất có tính acid
(carboxylic acid, phenol) có thể tới 3%. Khi xử lí dầu mỏ bằng base và sau đó acid hóa
dung dịch base này ta thu được chất nhựa đen nhớt gọi là “naphthenic acid” gồm một
lượng nhỏ acid béo như (CH3)2CH(CH2)3COOH, n-C15H31COOH và một lượng khá
hơn là các cycloalkylcarboxylic acid mà chủ yếu là các dẫn xuất của cyclopentane và cyclohexane, thí dụ như COOH CH2COOH cyclopentanecarboxylic acid cyclopentylacetic acid CH2COOH CH3 COOH CH 3 CH CH 3 3
3-methylcyclopentylacetic acid camphoric acid 76 lOMoARcPSD|208 990 13 COOH COOH CH3 cyclohexanecarboxylic acid
4-methylcyclohexanecarboxylic acid COOH CH3 CH3 CH3
2,2,6-trimethylcyclohexanecarboxylic acid
Ngoài ra còn có cả acid đa vòng và phenol
b. Các hợp chất chứa sulfur
Các hợp chất chứa sulfur trong dầu mỏ có thể từ 0,1 đến 10%, bao gồm các
mercaptan, sulfur, disulfur, thiophene và các dị vòng sulfur khác, thí dụ như các hợp chất sau: (CH3)2CHCH2 SH CH3 S C2H5 S S Isobutylmercaptan Etylmethylsulfur Thiophene Pentamethylene sulfur
c. Các hợp chất chứa nitrogen
Các hợp chất chứa nitrogen trong dầu mỏ có một lượng nhỏ không đáng kể như
pyridine, quinoline và các dẫn xuất của nó, thí dụ như : 2,3,8-trimethylquinoline;
2,4,8-trimethylquinoline; 2,4-dimethyl-8-sec-butylquinoline.
Ngoài ra trong dầu mỏ còn có lượng vết các hợp chất chưa kim loại, chủ yếu là
các hợp chất của nickel và vanadium.
7.2.4. Chưng cất dầu mỏ
Dầu thô mới lấy từ dưới mỏ lên cần được xử lý sơ bộ (loại bỏ nước, loại bỏ
muối, phá nhũ tương,..), sau đó đem chế biến bằng phương pháp vật lý, cụ thể là đem
chưng cất phân đoạn để tách ra thành một số phân đoạn khác nhau về nhiệt độ sôi.
Sau khi chưng cất phân đoạn, một số phần được chế biến bằng các phương pháp hóa
học như cracking, riforming,..
7.2.4.1. Các phân đoạn thu được khi chưng cất dầu mỏ
Trong công nghiệp, dầu mỏ được chưng cất ở áp suất thường trong những tháp
cất liên tục, nhờ vậy có thể tách được những phân đoạn dầu có khoảng nhiệt độ sôi
khác nhau. Mỗi phân đoạn có khoảng nhiệt độ sôi rộng có thể được tách ra thành
những phân đoạn nhỏ hơn, có khoảng nhiệt độ sôi hẹp hơn cũng nhờ phương pháp chưng cất. 77 lOMoARcPSD|208 990 13
Bảng 7.1. Các sản phẩm dầu mỏ khi chưng cất Các sản phẩm Nhiệt độ sôi Số nguyên (oC) tử carbon Khí dầu mỏ dưới 20 C1 - C4 Ether dầu hỏa 20 - 60 C5 - C6 Xăng 40 - 250 C5 - C14 Dầu hỏa 170 - 270 C10 - C15 Dầu diesel 220 - 360 C12 - C20 Masut, cặn masut từ 360 trở lên C20 - C60
Những phân đoạn tách được có thể được sử dụng trực tiếp để chế biến thành
các sản phẩm tương ứng: phân đoạn xăng được sử dụng sản xuất xăng ô tô hoặc máy
bay, phân đoạn dầu hỏa để sản xuất nhiên liệu cho động cơ phản lực hoặc dầu hỏa dân
dụng, phân đoạn diesel sản xuất nhiên liệu diesel, phân đoạn masut để sản xuất các
loại dầu nhờn. Phần cặn masut (500oC) còn lại chiếm khoảng 30 - 45% dầu thô để sản xuất paraffin, atphin.
7.2.4.2. Phân đoạn xăng. Chỉ số octane
Đối với động cơ đốt trong sử dụng xăng làm nhiên liệu để tăng hiệu quả động cơ
trong khi nhiên liệu lại tiêu thụ ít, thì hỗn hợp nhiên liệu và không khí phải chịu được
nén tới một mức độ nào đó rồi mới xẩy ra sự kích nổ. Một sự nén cực đại có thể có được
với một động cơ nào đó mà không để xẩy ra sự kích nổ là tùy thuộc ở cấu trúc của các
hydrocarbon có trong nhiên liệu. Nhiên liệu càng có tính kháng kích nổ cao thì sự nén
ấy đạt được càng cao.
Tính chất kháng kích nổ của xăng được đặc trưng bằng một chỉ số gọi là ‘‘chỉ số
octane’’. Người ta thấy chất 2,2,4-trimethylpentane (còn gọi là isooctane) CH3 CH3 C CH2 CH CH3 CH3 CH3
có tính kháng kích nổ vào loại tốt nhất (nó chỉ nổ khi nào sự nén lên đến cực đại). Vì
thế, người ta dùng isooctane làm chuẩn và qui ước cho nó có chỉ số octane = 100.
Ngược lại, heptane là chất có tính kháng nổ rất tồi (hơi bị nén đã nổ), vì vậy người ta qui
ước cho nó có chỉ số octane = 0. Do đó một hỗn hợp của isooctane và heptane sẽ có chỉ
số octane từ 0 đến 100 tùy thuộc vào tỉ lệ phần trăm của isooctane có trong hỗn hợp ấy.
Dựa vào đó, một thứ xăng có chỉ số octane 90 thì có nghĩa là xăng ấy có đặc điểm kích
nổ như một hỗn hợp gồm 90% isooctane và 10% heptane. Yêu cầu của xăng chạy ô tô
phải có chỉ số octane 80-95, còn xăng máy bay không được dưới 100.
Qua nghiên cứu người ta rút ra được các nhận xét sau : 78 lOMoARcPSD|208 990 13
- Các alkane không nhánh có chỉ số octane rất thấp (n-pentane 62, n-hexane 26, n-
heptane 0, n-octane –17). Chúng là nhiên liệu động cơ tồi.
- Các alkane mạch càng phân nhánh thì chỉ số octane càng cao (2,3-dimethylhexane
79; 2,2,3-trimethylbutane 112; 2,2,3,3-tetramethylpentane 125)
- Cycloalkane có chỉ số octane cao hơn các alkane tương ứng (cyclohexane 78).
- Alkene, nhất là alkene có nối đôi trong mạch làm tăng chỉ số octane lên rất nhiều so
với n-alkane tương ứng (1-heptene 54, 2-heptene 70, 3-heptene 84)
- Các hydrocarbon thơm có chỉ số octane rất cao (benzene 102, p-xylene 100, 1-
methyl-4-isopropylbenzene 100).
Xăng chưng cất trực tiếp từ dầu thô có chỉ số octane không vượt quá 50-60 do có
chứa rất nhiều alkane không nhánh. Để sử dụng có hiệu quả người ta phải sử dụng phụ
gia kháng kích nổ như lead tetraetyl, Pb(C2H5)4, để tăng chỉ số octane (thường thêm 0,2
đến 0,8 ml/l xăng hoặc cao hơn để đạt được chỉ số octane 90-100). Tuy nhiên, lead và
các nitrogen oxide (NOx) thải ra gây ô nhiễm môi trường (độc), nên ngày nay không
được sử dụng nữa. Để khắc phục, người ta sản xuất loại xăng không lead (thay phụ gia
kháng kích nổ khác không độc) hoặc khuynh hướng chung là sản xuất các loại xăng có
chỉ số octane cao ngay từ đầu, xong giá thành cao hơn.
7.2.4.3. Phân đoạn dầu diesel. Chỉ số cetane
Phân đoạn dầu diesel được dùng làm nhiên liệu cho động cơ diesel. Nhiệt độ tự
bốc cháy của nhiên liệu này càng thấp và thời gian chậm bốc cháy càng ngắn thì động
cơ làm việc càng tốt. Vì vậy tiêu chuẩn chất lượng của dầu diesel khác tiêu chuẩn của
xăng. n-cetane (hexadecane) có công thức cấu tạo CH3(CH2)14CH3 là nhiên liệu lí
tưởng cho động cơ diesel, nó tự cháy nổ mạnh ngay khi bị nén với không khí. Cho nên
để đánh giá chất lượng dầu diesel người ta dùng chỉ số cetane. Người ta quy ước n-
cetane có chỉ số cetane là 100, còn 1-methylnapthalene là nhiên liệu rất kém được quy
ước có chỉ số cetane là 0. Một hỗn hợp gồm n-cetane và 1-methylnaphthalene có chỉ
số cetane từ 0 đến 100 tùy theo tỉ lệ % của cetane trong hỗn hợp đó. Như vậy một
nhiên liệu có chỉ số cetane là 80 chẳng hạn, có chất lượng tương đương chất lượng của
một hỗn hợp gồm 80% n-cetane và 20% 1-methylnaphthalene.
7.2.5. Chế biến hóa học các phân đoạn dầu mỏ
Mục đích của chế biến thứ cấp dầu mỏ là để nâng cao chất lượng và các
tínhchất kháng kích nổ của xăng cũng như để tăng tỉ lệ xăng và các dầu đốt nhẹ nhằm
đáp ứng cho các nhu cầu sử dụng đòi hỏi.
Thuộc vào số các quá trình chế biến thứ cấp là cracking, reforming và các quá
trình hóa học khác (trùng hợp hoá, alkyl hoá và đồng phân hoá). 7.2.5.1. Cracking - Cracking nhiệt
Quá trình này dùng nhiệt bẻ gẫy các phân đoạn dầu mỏ sôi trên 2000C và các
cặn cất để cung cấp hỗn hợp các hydrocarbon sôi thấp. Cracking nhiệt được tiến hành
ở khoảng 400-5000C dưới các áp suất khác nhau từ 1 atm (pha khí) đến 85 atm (pha 79 lOMoARcPSD|208 990 13
lỏng). Hiệu suất xăng thu được từ 25-60% theo khối lượng và có tính kháng kích nổ tương đối tốt.
Cracking nhiệt là quá trình gốc. Nó không chỉ phân cắt các alkane có phân tử
khối cao thành alkane có phân tử khối thấp, mà còn dehydrogen hóa tạo ra các alkene.
Các alkene có từ hai đến bốn carbon rất cần cho công nghiệp hóa dầu. - Cracking xúc tác
Đây là một trong những quá trình chủ yếu để chế biến dầu. Nó có ưu thế hơn
cracking nhiệt, có thể cho hiệu suất xăng lên tới 80%. Nguyên liệu cho cracking xúc
tác là phân đoạn sôi giữa và gasoline chân không. Xúc tác thường dùng là nhôm
silicate tổng hợp (zeolit) và quá trình cracking được tiến hành trong pha khí ở khoảng
5000C và dưới áp suất tương đối thấp (2 at). Xăng thu được chứa những lượng khá các
alkene, isoalkane và arene và có chỉ số octane cao hơn 90.
Trong tất cả các quá trình cracking xúc tác, sau một thời gian xúc tác bị mất hoạt
tính do sự kết đọng không thể tránh được của cốc trên nó. Vì vậy xúc tác phải thay mới
thường xuyên. Với lí do này tốt nhất nên sử dụng băng chuyền hoặc dòng chảy xúc tác hơn là xúc tác tĩnh. - Hydrocracking
Trong quá trình này cracking xúc tác đi kèm với sự hydrogen hóa. Kết quả là
làm tăng hiệu suất các hydrocarbon no và quan trọng hơn cả là các hợp chất chứa
sulfur bị chuyển hoá thành các hydrcarbon no và các hydrosulfur (loại bỏ được sulfur trong xăng). 7.2.5.2. Refocming
Refocming có nghĩa là cải biến lại. Đây là quá trình cơ bản của chế biến dầu để
thu được hydrocarbon thơm (benzene, toluene, xylene). Qua quá trình reforming xăng
có chỉ số octane thấp được chuyển thành xăng có chỉ số octane cao. Trong quá trình
này người ta cho gasoline cất trực tiếp có nhiệt độ sôi 75-2000 C (xăng nặng) nhiễm
ngắn lên xúc tác ở nhiệt độ trên 5000C dưới áp suất cao (15-70 at) trong sự có mặt của
hydrogen. Trong những điều kiện này các phản ứng chủ yếu xảy ra như sau :
dehydrogen hóa đóng vòng các alkane thành arene, chuyển hóa các alkylcyclopentane
thành các dẫn xuất cyclohexane rồi dehydrogen hóa thành các arene.
Xúc tác thường dùng là xúc tác platinum, trong đó lượng platinum 0,3-0,7 %
được mang trên aluminium oxide (Pt/Al2O3) hoặc tốt sử dụng xúc tác hai kim loại
(Re/Pt/Al2O3), thêm Re để tăng thời gian sử dụng của xúc tác.
Quá trình reforming xúc tác có thể làm tăng chỉ số octane của xăng từ 50 lên
80-90, đồng thời các hợp chất chứa sulfur đều được khử hóa đến hydrosulfur, và đây
cũng là nguồn cung cấp các hydrocarbon thơm cho công nghiệp hóa dầu.
7.2.5.3. Các phương pháp điều chế nhiên liệu kháng kích nổ cao khác
Sự chưng cất đơn giản dầu thô thu các sản phẩm có thành phần rất khác nhau và
không phải tất cả các phân đoạn có thể chuyển hoá được bằng cracking và reforming
thành xăng có chỉ số octane cao cũng như hiệu suất cao. Mặt khác, vì sự nén cao hơn 80 lOMoARcPSD|208 990 13
và tốc độ quay tăng lên của các động cơ chạy xăng đòi hỏi những nhiên liệu có chất
lượng hoàn hảo. Điều đó dẫn đến sự phát triển những quá trình chế biến dầu xa hơn. - Trùng hợp hóa
Các khí nhận được từ các quá trình cracking chứa một lượng khá các alkane
(propene, các butene) được sử dụng như là các chất trung gian để chế các nhiên liệu lỏng.
Các alkene trùng hợp hóa dưới tác dụng của nhiệt (ở 5000C, 120 at) hoặc trong sự có mặt
của sulfuric acid (hoặc phosphoric acid) xúc tác cho xăng polymer. Thí dụ, một quá trình
công nghiệp bao gồm việc cho isobutene (nhận được từ phân đoạn C4 của sản phẩm
cracking) đi vào sulfuric acid 70% ở 30 0C và t-butylsulfate tạo thành được đun nóng một
thời gian ngắn dưới áp suất ở 1000 C. Quá trình này cung cấp một hỗn hợp gồm hai
isooctene đồng phân cùng một lượng nhỏ tri (isobutene) được tách bằng cất với hiệu suất
75% và được hydrogen hóa xúc tác thành isooctane kĩ thuật có chỉ số octane giữa 92 và
97 (~ 95) có thể sử dụng làm một thành phần của xăng máy bay : CH3 CH3 2 CH3C CH2 CH3 C CH2 C CH2 + CH3 C CH C CH3 CH3 CH3 CH3 CH3 CH3 Isobutene 2,4,4-trimethylpent-1-ene 2,4,4-trimethylpent-2-ene 80% 20% CH3 CH3 C CH2 CH CH3 CH3 CH3 isooctane - Alkyl hóa
Trong quá trình này isoalkane (chủ yếu là isobutane) phản ứng với các alkene
(chủ yếu là propene, isobutene) trong sự có mặt của BF3, hoặc H2SO4 98% hoặc HF
khan làm xúc tác cho các isoalkane cao. Trong công nghiệp, sự alkyl được tiến hành
giữa -100C đến 350C dùng H2SO4 hoặc HF làm xúc tác. Thí dụ, khi alkyl hóa
isobutane bằng propene thu được ba sản phẩm với những lượng khác nhau sau :
Sự alkyl hóa không chỉ giới hạn đối với các isoalkane. Trong sự có mặt của
aluminium chloride làm xúc tác, các alkane không nhánh (trừ methane và ethane) cũng
có thể được alkyl hóa bởi các alkene. - Đồng phân hoá 81 lOMoARcPSD|208 990 13
Bằng phương pháp này các alkane không nhánh có thể chuyển hoá thành các
isoalkane, sử dụng acid Lewis làm xúc tác. Sự chuyển vị phân tử xảy ra và alkane
không nhánh được đồng phân hóa. Thí dụ, trong sự có mặt của aluminium chloride ở
250C butane đi vào một cân bằng với isobutane : CH3 AlCl3 CH3 CH2 CH2 CH3 CH3 CH CH3 n-butane (20%) isobutane (80%)
Vì chỉ số octane tăng theo sự phân nhánh trong alkane, sự đồng phân hóa phân
đoạn cất đầu của dầu mỏ sẽ dẫn đến làm cải thiện đáng kể chỉ số octane của nó. 7.3. Than mỏ
Công nghiệp năng lượng và hóa học dựa trên nguồn nguyên liệu là than (than
đá, than nâu) đã lùi dần từ 50 năm lại đây để nhường chỗ cho dầu mỏ mang lại hiệu
quả và kinh tế hơn. Tuy nhiên, than vẫn là một nguồn nhiên nguyên liệu tự nhiên
phong phú hữu ích (cân bằng năng lượng trên thế giới hiện nay dầu mỏ và khí thiên
nhiên chiếm 65%, than đá 23%, còn lại là điện hạt nhân, thủy điện và những nguồn năng lượng khác 12%).
7.3.1. Phân loại than Than mỏ gồm các loại:
- Than antraxit hay than gầy là loại than già nhất về mặt địa chất, chứa trên 90% C.
Khi cháy, than antraxit tỏa nhiều nhiệt nên được dùng làm nhiên liệu.
- Than béo hay than mỡ trẻ hơn than antraxit, chỉ chứa 70 - 90% C. Khi cháy, than béo
cho nhiều khói và tỏa nhiệt kém than antraxit. Than béo là nguồn quan trọng về
hydrocarbon thơm và các hợp chất hữu cơ khác.
- Than nâu chỉ chứa 65 - 70% C, có màu nâu, hơi mềm hơn than béo và than antraxit.
Trên bề mặt than nâu vẫn còn một số dấu tích về cấu tạo của gỗ.
- Than bùn là loại than trẻ nhất trong các loại than mỏ, chứa 55 - 66% C, có màu nâu
nhạt, xốp và chứa một lượng lớn nước. Thành phần nguyên tố của than bùn gần giống
thành phần nguyên tố của gỗ.
Trong công nghiệp , người ta chưng cất than béo trong lò cốc (sản xuất than
cốc). Lò này có nhiều ngăn dài và hẹp chứa than béo, được nung bằng nhiên liệu khí
tới nhiệt độ khoảng 1000oC. Các sản phẩm khí và hơi thoát ra ngoài sau khi đã làm
lạnh gồm có: khí lò cốc, nhựa than mỏ và dung dịch ammonia trong nước. Từ khí lò
cốc và nhựa than mỏ người ta tách ra được nhiều sản phẩm hữu cơ, còn từ dung dịch
ammonia sau khi trung hòa sẽ thu được muối ammonia dùng làm phân đạm.
7.3.2. Các sản phẩm từ nhựa than đá
Nhựa than đá là một chất lỏng đặc sánh có màu đen với mùi đặc trưng thu được
từ sự cất khan than đá (than mỡ) ở nhiệt độ cao khoảng 10000C và vắng mặt không khí 82 lOMoARcPSD|208 990 13
(gọi là quá trình cốc hóa than đá). Nó là hỗn hợp gồm các chất trung tính (các
hydrocarbon thơm là chủ yếu), acid và base. Cho đến nay đã phát hiện khoảng 350 hợp chất có trong than đá.
Bước đầu tiên trong việc xử lí công nghiệp nhựa than đá chưng cất phân đoạn.
Sản phẩm chưng cất than đá có thể phân thành năm phân đoạn sau:
1) 80-1700C, dầu nhẹ (1-2%) gồm chủ yếu benzene, toluene, ba xylene đồng
phân, cũng như một vài trimethylbenzene (mesitylene, pseudocumene, hemimellitene)
durene và các tetramethylbenzene khác và cả styrene, cyclopentadiene,
dicyclopentadiene, indene, hyndrindene và các hydrocarbon khác. Các chất này có thể
được phân tách bằng cách chưng phân đoạn tiếp (trong phần này còn có các base
pyridine, methylpyridine, aniline, thiophene).
2) 170-2150C, dầu trung bình (2-3%) chứa chủ yếu naphthalene (trong phần này
còn có phenol, các cresol, xylenol khác nhau, toluidine, quinoline và các isoquinoline).
3) 215-2400C, dầu naphthalene (8-10%) chứa chủ yếu naphthalene, alkyl
naphthalene, acenaphthene, fluorene. Phần lớn naphthalene hoá rắn và tách ra (trong
phần này còn có phenol, các cresol, các xylenol, dibenzofuran, indol, quinoline và isoquinoline).
4) 230-2900C, dầu rửa (8-10%), dầu này chứa cùng các chất có trong 3) và có
biphenyl. Dầu này dùng để rửa benzene ra khỏi các khí lò than cốc.
5) 270-3500C, dầu anthracene. Ở lạnh dầu này hoá rắn, từ đó có thể phân tách
được anthracene, phenanthrene, fluorene. Ngoài ra còn có carbazol, acridine và phenanthridine.
Chất hắc ín còn lại (~ 55%) có nhiệt độ hoá mềm 60-750C. Nó là một hỗn hợp
rất phức tạp cấu tạo phần lớn bởi các arene đa vòng (pirene, chrysene, fluoantrene)
cùng với lượng nhỏ các hợp chất có phân tử khối cao tựa bồ hóng và các đồng đẳng của carbazol.
7.3.3. Sự chuyển hóa than đá thành nhiên liệu lỏng
Nhiên liệu lỏng (xăng, diesel) được sản xuất từ than đá hoặc than nâu theo các phương pháp sau:
7.3.3.1. Hydrogen hóa than đá (phương pháp Bergius)
Phương pháp này dựa vào việc gắn hydrogen vào than để tạo ra nhiên liệu. Quá
trình hydrogen hóa được tiến hành như sau : trộn bột than đá với dầu nặng (dầu nặng
thu được từ chính quá trình này) thành một hỗn hợp nhão, thêm vào hỗn hợp 5% ferric
oxide và một số xúc tác hoạt động hơn như tin, lead v.v…(việc thêm ferric oxide còn
nhằm mục đích để loại hết sulfur trong than). Đưa vào phản ứng một lượng vừa đủ
hydrogen ở 200 at và đun nóng tới 450-4900C. Tách hỗn hợp sản phẩm bằng cất phân
đoạn thu được xăng (đến 2000C), gasolin (2000C - 3000C) và dầu nặng. Phân đoạn
xăng gồm 74% alkane, 22% hydrocarbon thơm, 4% olefin và có chỉ số octane từ 75-
80. Theo phương pháp này từ 1,5-2 tấn than điều chế được một tấn xăng.
7.3.3.2. Khử hóa khí than ướt (phương pháp Fischer - Tropsch) 83 lOMoARcPSD|208 990 13
Khí than ướt là một hỗn hợp carcbon monoxide và hydrogen được điều chế
bằng cách cho hơi nước tác dụng với than ở nhiệt độ cao : C + H2O CO + H2 `
Quá trình chuyển hóa khí than ướt thành hydrocarbon có thể xảy ra theo sơ đồ tổng quát sau : n CO + 2n H2 CnH2n + n H2O n CO + (2n + 1) H2 CnH2n + 2 + n H2O
Quá trình tổng hợp bắt đầu bằng việc bổ sung hydrogen vào khí than ướt cho
đạt tỉ lệ H2 : CO là 2 : 1, loại hết sulfur bằng cho hỗn hợp khí đi qua ferric oxide, rồi
cho qua xúc tác cobalt ở 2000C. Từ 1m3 khí có thể điều chế được 130-140g
hydrocarbon (hiệu suất ~ 65%), phần lớn hydrocarbon này có điểm sôi của xăng. Tuy
nhiên, do các hydrocarbon mạch thẳng không nhánh chiếm ưu thế nên chỉ số octane
thấp (khoảng 40), cần chế biến thứ cấp như reforming, đồng phân hoá hoặc thêm phụ
gia kháng kích nổ. Phân đoạn có nhiệt độ sôi cao hơn có chỉ số cetane 85 là một loại nhiên liệu điezen tốt.
7.3.3.3. Bán cốc hóa than (cốc hóa than ở nhiệt độ thấp)
Cốc hóa than nâu ở khoảng 6000C dẫn đến tạo thành nhựa than, dầu nhẹ (xăng),
dầu trung bình, khí than (carbon monoxide và nitrogen), phân đoạn nước và cốc còn lại.
Cốc hóa than đá ở khoảng 450-6000C thu được cốc, nhựa than đá, dầu bôi trơn
và phân đoạn xăng. Chế biến thứ cấp và hydrogen hóa sẽ cho xăng và dầu điezen chất lượng cao.
7.3.3.4. Hydrogen hóa nhiệt độ thấp
Nhựa than thu được từ cốc hóa than nâu được hydrogen hóa trong pha lỏng có
mặt chất xúc tác WS2/Al2O3 theo quá trình từng bước ở 3500C và 300at cung cấp dầu
diesel, dầu bôi trơn, xăng, paraffin lỏng và rắn.
7.3.3.5. Tách hydrogen ở áp suất cao
Dầu nhẹ giàu hydrogen thu được từ nhựa than nâu được tách hydrogen trên chất
xúc tác MoO3/Al2O3, hoặc thời gian gần đây là Pt/Al2O3 ở khoảng 5000C dưới áp suất
riêng phần của hydrogen 25-35 at. Không chỉ các cycloalkane bị tách hydrogen mà cả
các n-alkane cũng tách hydrogen đóng vòng cho các arene. Xăng thu được có thể đạt
chỉ số octane~90 nếu tetraetyl lead được thêm vào nó. CÂU HỎI ÔN TẬP
1. Cho biết các nguồn hydrocarbon thiên nhiên quan trọng trên thế giới?
2. Nêu thành phần và ứng dụng của khí thiên nhiên. 84 lOMoARcPSD|208 990 13
3. Phân biệt khí thiên nhiên và khí đồng hành.
4. Cho biết nguồn gốc và quá trình hình thành dầu mỏ; nêu thành phần của dầu mỏ.
5. Giải thích vì sao dầu mỏ không có nhiệt độ sôi nhất định?
6. Phân biệt các khái niệm: a. Cracking và reforming.
b. Chỉ số octane và chỉ số cetane.
7. Nhựa than đá là gì? Cho biết thành phần các phân đoạn của quá trình chưng cất nhựa than đá.
8. a. Chưng cất nhựa than đá thu được một hỗn hợp gồm naphthalene, phenol và
pyridine. Trình bày phương pháp hóa học để tách riêng từng chất.
b. Từ nhựa than đá người ta tách được ba đồng phân của xylene. Ba đồng phân này
có nhiệt độ sôi rất gần nhau. Trình bày phương pháp hóa học để nhận biết từng đồng phân đó.
9. Viết các phương trình phản ứng điều chế acetic acid từ mỗi chất sau: a. Methane b. Ethane c. Butane 85 lOMoARcPSD|208 990 13
Chương 8. DẪN XUẤT HALOGEN. HỢP CHẤT CƠ KIM
8.1. Dẫn xuất halogen
Khi thay thế một hay nhiều nguyên tử hydrogen trong phân tử hydrocarbon
bằng các nguyên tử halogen (Hal: F, Cl, Br, I) ta được các dẫn xuất halogen.
Dựa vào đặc điểm cấu tạo của phân tử, có thể chia dẫn xuất halogen thành nhiều loại khác nhau:
- Theo cấu tạo của gốc hydrocarbon, ta có: dẫn xuất halogen no (CH3
CH2Cl), dẫn xuất halogen không no (CH2=CH-Cl), dẫn xuất halogen thơm (C6H5-Cl).
- Theo bản chất của các nguyên tử halogen, ta có 4 loại dẫn xuất halogen tương ứng:
dẫn xuất fluoro, dẫn xuất chloro, dẫn xuất bromo và dẫn xuất iodo.
- Theo số lượng halogen trong phân tử, ta có dẫn xuất monohalogen (CH3Br), dẫn xuất
dihalogen (ClCH2CH2Cl), dẫn xuất trihalogen (CHCl3)...
- Theo bậc của nguyên tử carbon liên kết với nguyên tử halogen, ta có dẫn xuất
halogen bậc 1 (CH3Cl), dẫn xuất halogen bậc 2 (CH3-CHBr- CH3) và dẫn xuất halogen bậc 3 ((CH3)3C-Cl).
8.1.1. Danh pháp và đồng phân 8.1.1.1. Danh pháp a. Tên gốc - chức
tên gốc hydrocarbon + halide Ví dụ: CH3CH2Br C6H5CH2Cl ethyl bromide benzyl chloride
b. Tên thông thường
Một số tên thông thường khác của các dẫn xuất halogen cũng được IUPAC lưu dùng như: CHCl3 : chloroform CHBr3 : bromoform CHI3 : iodoform CHF3 : fluoroform
CCl4 : carbon tetrachloride, v.v... c. Tên thay thế
Tên của dẫn xuất halogen bao gồm tiền tố halogen cộng với tên hydrcarbon
(hydride nền) kèm theo số chỉ vị trí (locant) của nguyên tử halogen. 86 lOMoARcPSD|208 990 13 CH3 CH CH3 Cl 2-chloropropane
- Khi đánh số, halogen trong mạch phải có chỉ số nhỏ nhất. CH3 CHCH2CH2C(CH3)3 Cl 2-chloro-5,5-dimethyhexane
- Trong alkenyl halide hay alkynyl halide, phải ưu tiên liên kết bội rồi mới đến nguyên tử halogen. Cl CH3 CH3 C CH2CH2C CH Br 3-chlorocyclohex-1-ene 5-bromo-5-methylhex-1-yne
- Trong dẫn xuất halogen, có nhiều loại halogen khác nhau thì sắp xếp theo trình tự chữ cái: I F Cl C I Br Br 1-bromo-4-iodobenzene bromochlorofluoroiodomethane 8.1.1.2. Đồng phân
a. Đồng phân cấu tạo
- Đồng phân về vị trí nguyên tử halogen. CH3CH2CH2CH2CH2Cl CH3CH2CH2CHClCH3 CH3CH2CHClCH2CH3 1-chloropentane 2-chloropentane 3-chloropentane
- Đồng phân mạch carbon. CH3CH2CH2CH2 Cl (CH3)2CHCH2 Cl 1-chlorobutane 1-chloro-2-methylpropane
- Đồng phân về vị trí liên kết bội. CH2 CCH2Br CH3CH CHBr 3-bromoprop-1-ene 1-bromoprop-1-ene
b. Đồng phân hình học và đồng phân quang học 87 lOMoARcPSD|208 990 13 - Đồng phân hình học Br Br Br Br
(Z) hoaëc cis-1,2-dibromocyclopropane
(E) hoaëc trans-1,2-dibromocyclopropane - Đồng phân quang học Cl Cl C C H CH2CH3 CH3CH2 H CH3 CH3 (R)-2-chlorobutane (S)-2-chlorobutane Br Br Br Br
(Z) hoaëc cis-1,2-dibromocyclopropane
(E) hoaëc trans-1,2-dibromocyclopropane
8.1.2. Phương pháp điều chế
8.1.2.1. Thế nguyên tử hydrogen của hydrocarbon
a. Thế nguyên tử hydrogen của alkane và cycloalkane có vòng trung bình
Phản ứng thế xảy ra với halogen là chlorine hoặc bromine trong điều kiện chiếu
sáng và theo cơ chế thế gốc. Cl Cl2 CH3CHCH2CH3 ClCH CH as 2CHCH2CH3 3CCH2CH3 CH3 CH3 CH3 Cl CH3CHCHCH3 CH3CH2CH2Cl CH CH 3 3
Một số vòng loại trung bình sẽ bị thế nguyên tử hydrogen bằng halogen. Cl as Cl2 HCl as Cl Cl2 HCl 88 lOMoARcPSD|208 990 13
b. Thế nguyên tử hydrogen của alkene
- Thế nguyên tử hydrogen của alkene
Phản ứng chỉ xảy ra với alkene thấp và với chlorine ở nhiệt độ cao. Phản ứng
xảy ra theo cơ chế thế gốc. 500oC CH2 CH2 Cl2 CH2 CHCl HCl 400 - 500oC CH2 CHCH3 Cl2 CH2 CHCH2Cl HCl
Trong trường hợp bromine hóa vị trí allyl của alkene dùng N-bromsuccinimide (NBS) . O O CCl4 CH NBr 2 CHCH3 CH to 2 CHCH2Br NH O O
c. Thế nguyên tử hydrogen ở nhánh, ở nhân thơm của arene
Tác nhân phản ứng có thể dùng Cl2 hay Br2 , không dùng F2 và I2.
- Nếu có ánh sáng, thì phản ứng halogen hóa xảy ra ở nhánh của arene theo cơ chế thế gốc: CH2CH3 CHClCH3 as Cl 2 HCl
Cũng có thể dùng N-bromsuccinimide (NBS) với sự có mặt của peroxide để thế ở nhánh của arene: CH3 CH2Br NBS, CCl4 Cl 2 (C6H5COO)2
- Nếu dùng các xúc tác là acid Lewis (AlCl3, BF3, SnCl4, ZnCl2, FeCl3… ) trong phản
ứng halogen hóa arene, thì các halogen sẽ thế các nguyên tử hydrogen ở nhân.
Trong phản ứng halogen hóa arene, ví dụ phản ứng bromine hóa benzene, có thể
dùng một số kim loại và phi kim (như Fe, I2) làm xúc tác, thì quá trình cũng xảy ra như trên. Cl AlCl3 Cl HCl 2
8.1.2.2. Cộng HHal và X2 vào các hợp chất chưa no và hợp chất no 89 lOMoARcPSD|208 990 13
Để tạo dẫn xuất monohalogen ta dùng các tác nhân phản ứng là HX (HCl, HBr,
HBr, HI). Để điều chế dẫn xuất dihalogen ta dùng tác nhân phản ứng là X2 (Br2, Cl2)
hoặc X-X’ (ICl, IBr, BrCl…). a. Cộng vào alkene
Khi dùng tác nhân HX (HCl, HBr, HBr, HI) tác dụng với alkene không đồng
bậc, phản ứng xảy ra theo cơ chế AE và tuân theo quy tắc Markovnikov. Riêng HBr,
khi có mặt oxygen hay peroxide phản ứng xảy ra trái với quy tắc Markovnikov, gọi là
hiệu ứng Kharat theo cơ chế AR. Cl CH3CH CH2 HCl CH3CHCH3 Br CH3CHCH3 CH 3CH CH2 HBr (RO)2 CH3CH2CH2Br b. Cộng vào alkyne
Phản ứng cộng hợp HX vào alkyne diễn ra qua hai giai đoạn nhưng giai đoạn 2 khó hơn giai đoạn 1. CCl4 Br CH CH Br BrCH CHBr 2 Br CH C HBr 2 CCl4 2 2
Khi cộng HBr vào alkyne không đồng bậc có mặt peroxide hay oxygen, phản
ứng xảy ra theo cơ chế gốc, trái quy tắc Markovnikov. (RO)2 CH3C CH HBr CH 60oC 3CH CHBr
c. Cộng vào alkadiene liên hợp
Alkadiene liên hợp, phản ứng cộng có thể xảy ra theo hướng 1,2 hoặc 1,4. CH2 CH CH CH2 HBr CH3CH CHCH2Br CH2 CHCHBrCH3
d. Cộng vào cyclopropane
Có thể dùng HX để cộng mở vòng tạo dẫn xuất monohalogen mạch hở hoặc
dùng Br2 để tạo thành dẫn xuất 1,3-dibromo mạch hở. HBr CH3CH2CH2Br CCl4 Br2 BrCH2CH2CH2Br 8.1.2.3. Đi từ alcohol 90 lOMoARcPSD|208 990 13
Muốn điều chế dẫn xuất halogen từ alcohol, người ta có thể sử dụng nhiều tác
nhân halogen hóa khác nhau, như : HX (HCl, HBr, HI) ; PX3 ( PBr3, PI3); PCl5; SOCl2; SOBr2; COCl2 và POCl3. CH3CH2OH HBr CH3CH2Br H2O ROH PCl5 RCl POCl3 HCl ROH COCl2 RCl CO2 HCl ROH SOCl2 RCl SO2 HCl
8.1.2.4. Đi từ muối diazonium thơm
a. Điều chế dẫn xuất fluoro thơm. Phản ứng Schiemann
Khi cho thêm dung dịch đậm đặc của sodium tetrafluoroborate NaBF4 hay
potassium tetrafluoroborate KBF4 vào dung dịch muối diazonium, sau đó đun nóng sẽ
thu được dẫn xuất fluoro thơm: KBF to 4 C C 6H5 2 N + Cl C6H5 2 N + BF4 6H5F BF3 N2 KCl
b. Điều chế các dẫn xuất chloride, bromide thơm: ArX - Phản ứng Sandmeyer
Khi cho muối diazonium tác dụng với muối copper (I) (CuCl hay Cu2Cl2, CuBr
hay Cu2Br2) trong điều kiện đun nóng ta sẽ thu được dẫn xuất chloride hay bromide thơm: NaNO2 , HCl Cu ArNH 2Cl2 2 ArN + Cl ArCl 2 o 0 - 5oC t - Phản ứng Gattermann
Cũng phản ứng ở trên, nếu dùng đồng kim loại xúc tác thì phản ứng được gọi là phản ứng Gattermann. CH3 CH3 Cu N + Br 2 Br N2
Các phản ứng trên được ứng dụng rộng rãi trong tổng hợp hữu cơ.
c. Điều chế các dẫn xuất iodide thơm
Khi đun nóng dung dịch muối diazonium và KI trên nồi cách thủy, ta có thể
điều chế được iodoarene. 91 lOMoARcPSD|208 990 13 KI C H N + Cl C H I KCl N2 6 5 2 to 6 5
8.1.2.5. Các phương pháp khác
a. Từ muối của carboxylic acid
Phản ứng Hunsdiecker: khi các muối bạc hay muối thorium của carboxylic acid
được xử lí với bromine thì nhóm carboxyl chuyển thành carbon dioxide (CO2) và alkyl
hay aryl bromide được tạo ra: CCl4 (CH3)3CCH2COOAg Br AgBr CO 2 (CH3)3CCH2Br 2
b. Đi từ hợp chất cơ kim C2H5MgBr I2 C2H5I MgBrI
8.1.3. Tính chất vật lý
Tính chất vật lý của dẫn xuất halogen phụ thuộc vào thành phần và cấu tạo của gốc
hydrocarbon cũng như bản chất và số lượng các nguyên tử halogen có mặt trong phân tử.
- Các alkyl halide thấp (CH3Cl, CH3Br, C2H5Cl…) là chất khí. Methyl iodide, ethyl
bromide và phần lớn các alkyl halide khác là những chất lỏng. Các dẫn xuất halogen
thơm, các dẫn xuất di và polyhalogen là những chất lỏng. Một số p-dihalogen thơm và
các dẫn xuất thế halogen nhiều lần là những chất rắn.
- Các dẫn xuất halogen có nhiệt độ sôi cao hơn hydrocarbon tương ứng, ví dụ nhiệt độ
sôi của pentane là 36OC nhưng của bromopentane là 129,7oC.
- Các dẫn xuất halogen có cùng khung carbon thì nhiệt độ sôi và khối lượng riêng tăng
dần từ dẫn xuất fluoro đến dẫn xuất iodo.
- Các dẫn xuất halogen có cùng số nguyên tử carbon và chứa cùng một halogen thì
nhiệt độ sôi giảm dần từ bậc I đến bậc III.
- Các dẫn xuất halogen hầu như không tan hay ít tan trong nước nhưng lại tan dễ dàng
trong các dung môi hữu cơ, như C6H6, C6H5CH3, C6H4(CH3)2, (CH3)2O. Một số dẫn
xuất halogen là những dung môi hữu cơ rất thông dụng, như CHCl3, CCl4…
8.1.4. Tính chất hóa học
Khả năng phản ứng của dẫn xuất halogen phụ thuộc chủ yếu vào 2 yếu tố sau:
+ Bản chất halogen: khả năng phản ứng giảm dần RI > RBr > RCl > RF
+ Đặc điểm của gốc hydrocarbon
- Trường hợp 1: dẫn xuất halogen có khả năng phản ứng trung bình, đó là alkyl halide và cycloalkyl halide. 92 lOMoARcPSD|208 990 13 CH3 CH2 Cl ; Cl
- Trường hợp 2: dẫn xuất halogen có khả năng phản ứng thấp, đó là các vinyl halide và aryl halide. CH2 CH Cl ; Cl
- Trường hợp 3: dẫn xuất halogen có khả năng phản ứng cao, đó là các allyl halide và benzyl halide. CH2 CH CH2 Cl ; CH2 Cl
Những phản ứng đặc trưng của dẫn xuất halogen đó là phản ứng thế
nucleophile, phản ứng tách hydrohalide và phản ứng với kim loại. Ngoài ra, các dẫn
xuất halogen còn tham gia phản ứng ở gốc hydrocarbon (thế ở nhân thơm, cộng vào gốc chưa no,…). 8.1.4.1. Phản ứng thế a. Khái quát
Phản ứng thế nguyên tử halogen (Cl, Br, I) trong các dẫn xuất halogen (RCl, -
RBr, RI) với tác nhân nucleophile Y xảy ra theo sơ đồ sau: R X Y R Y X - - Tác nhân nucleophile Y có thể là những anion như OH , .. - -
C H O , CN ,…hoặc là những phân tử trung hòa có cặp electron tự do như H , 2 5 2 O .. .. ..
C2H5 OH , N H3 , CH3 N H2, …
b. Một số phản ứng thế nucleophile quan trọng của dẫn xuất halogen
- Thủy phân bằng kiềm (điều chế alcohol) H2O R X OH R OH X CH CH Br H2O CH CH OH X OH 3 2 3 2
- Tổng hợp Uyliemxơn (điều chế ether) R X R' O R O R' X CH3CH2 Br C6H5O CH3CH2 O C6H5 Br - Tổng hợp ester: 93 lOMoARcPSD|208 990 13 R X R' COO R' COOR X CH3 Br CH3COOAg CH3COOAg AgBr
- Tổng hợp Kolbe (điều chế nitrile): R X CN R CN X C6H5CH2 Cl KCN C6H5CH2 CN KCl
- Tổng hợp Finkenstein (trao đổi halogen): R X I R I X CH3CH2 Br KI C6H5CH2 I KBr
- Alkyl hóa theo Hopman (tổng hợp amine): R X R X R X R X RNH R NH R N R NX NH 3 2 2 3 4 NH4Cl
c. Phản ứng thế nguyên tử halogen ở vòng thơm
Các aryl halide tham gia cả hai cơ chế SN1 và SN2 đều khó khăn. Loại hợp chất này
chỉ phản ứng trong điều kiện rất khắc nghiệt (nhiệt độ, áp suất cao) theo một cơ chế
khác với SN ở trên. Đó là cơ chế aryne (tách, cộng). Cl OH 350oC, 200 atm H2O HCl arin (benzyne)
Nếu các aryl halide có thêm những nhóm hút electron mạnh như NO2, CN,
COOH, CHO... thì phản ứng xảy ra dễ dàng hơn nhiều. Cl OH O O 2N NO2 H NO 2O 2N 2 20oC NO2 NO2 8.1.4.2. Phản ứng tách
Khi đun nóng dẫn xuất halogen với base trong dung môi ethanol xảy ra phản
ứng tách hydrogen halide để tạo thành hydrocarbon không no. C2H5OH CH3CH2Br NaOH CH2 CH2 NaBr H2O toC
Base được sử dụng trong phản ứng tách bao gồm: 94 lOMoARcPSD|208 990 13
HO , RO , CH3COO , NH2 , R2N , R3N
Các phản ứng tách thường kèm theo các phản ứng thế. C2H5ONa, C2H5OH CH3CH2Br CH CH 55oC 2 CH2 3CH2OCH2CH3 (10%) (90%) C2H5ONa, C2H5OH (CH3)3CBr (CH 55oC 3)2C CH2 (100%)
Tiến hành phản ứng tách có thể đi từ nguyên liệu đầu là vic-dihalogen, có thể dùng kim loại Mg thay Zn. BrCH CH Br ete Zn CH CH MgBr 2 2 2 2 2
Phản ứng tách cũng có thể đi từ gem-dihalogen: 2 KOH / ancol RCH2CHBr2 RC CH 2 HBr
hoặc có thể đi từ tetrahalogen: X X R C C R' 2 Zn RC CR' 2 ZnX2 X X
* Hướng của phản ứng tách: hướng chính của phản ứng tách tuân theo quy tắc Zaisev,
nội dung như sau: trong phản ứng tách nucleophile, halogen ưu tiên bị tách ra cùng với
hydrogen ở carbon- có bậc tương đối cao hơn, tạo ra alkene có nhiều nhóm thế hơn. CH3CH CHCH3 C2H5ONa (81%) CH3CH2CHCH3 C2H5OH Br CH3CH2CH CH2 (19%) CH3 CH3CH CCH3 CH3 C2H5ONa (70%) CH3CH2CCH3 C CH Br 2H5OH 3 CH3CH2C CH2 (30%)
Hai phản ứng tách và thế thường xảy ra song song và cạnh tranh nhau, và chúng
thường khác nhau về năng lượng hoạt hóa. 95 lOMoARcPSD|208 990 13
Năng lượng hoạt hóa của phản ứng tách lớn hơn phản ứng thế, nên khi tăng
nhiệt độ tốc độ phản ứng tách lớn hơn tốc độ phản ứng thế, tức tỉ lệ E/S tăng. 140oC CH CH OCH CH 3 2 2 3 S H 2SO4 CH 3CH2OH CH3CH2OSO3H H 2O 180oC CH2 CH2 E C2H5OH CH CHCH C H ONa (CH ) CHOCH CH CH CH 3 3 2 5 55oC 3 2 3 3 2 Br (21%) (79%)
8.1.4.3. Phản ứng với kim loại
Dẫn xuất halogen phản ứng với kim loại trong môi trường ether khan sẽ cho
hợp chất cơ nguyên tố.
- Với Mg: phản ứng có ý nghĩa quan trọng nhất. ether khan CH CH Br Mg CH CH MgBr 3 2 3 2 ether khan C H Br Mg C H MgBr 6 5 6 5
Các dẫn xuất dihalogen tác dụng với magiesium cho nhiều sản phẩm khác nhau: ether khan BrCH CH Br Mg CH CH MgBr 2 2 2 2 2 ether khan BrCH CH CH Br Mg MgBr 2 2 2 2 ether khan BrCH CH CH CH Br Mg BrMg(CH2)4MgBr 2 2 2 2 - Các dẫn xuất X(CH2)nX
với n≥ 4 đều cho các sản phẩm tương tự như 1,4-dibromobutane.
- Với Na: dẫn xuất halogen phản ứng với sodium theo phản ứng Wurtz ether khan 2 CH3CH2Br 2 Na CH3CH2CH2CH3 2 NaBr
8.2. Hợp chất cơ kim
- Hợp chất cơ kim là những hợp chất hữu cơ có chứa liên kết carbon-kim loại.
+ Kim loại ở đây là kim loại kiềm (Li, K, Na…), kim loại kiềm thổ (Ca, Mg…)
và các kim loại chuyển tiếp (Ti, V, Cr, Mn, Fe, Co, Ni, Nb, Mo, Ru, Pd, W, Os, Pt…).
+ Các gốc hydrocarbon liên kết với kim loại là alkyl, alkenyl, alkynyl, aryl…
- Hợp chất cơ kim có hai loại:
+ Hợp chất cơ kim hoàn toàn, như C6H5Na, Na-C≡C-Na 96 lOMoARcPSD|208 990 13
+ Hợp chất cơ kim hỗn tạp, như CH3CH2CdCl; C6H5MgCl,…
Quan trọng nhất trong các hợp chất cơ kim là hợp chất cơ magiesium (thuốc thử Grignard) .
8.2.1. Danh pháp và cấu trúc 8.2.1.1. Danh pháp
a. Hợp chất cơ kim hoàn toàn
Tên của hợp chất cơ kim hoàn toàn là tổ hợp tên gốc hydrocarbon và tên kim loại. (C2H5)3Mg C6H5Na triethyl magiesium phenyl sodium
b. Hợp chất cơ - kim hỗn tạp
Tên của hợp chất cơ kim hỗn tạp được gọi theo tên của muối. CH3MgBr CH3HgCl methyl magiesium bromide methyl mercury chloride
8.2.1.2. Cấu trúc của hợp chất cơ kim
Cấu tạo của hợp chất cơ kim như sau: C Y
Tùy thuộc vào độ âm điện của nguyên tố Y mà hợp chất cơ kim có thể có những cấu tạo sau: C Y hay C Y (I) (II)
Trường hợp (I) là liên kết ion, trường hợp (II) là liên kết cộng hóa trị. Các hợp
chất cơ kim loại là kim loại kiềm, kiềm thổ thì thường có cấu tạo ion. Chúng ít tan
trong các dung môi hữu cơ và dễ phản ứng với nuớc, không khí, …
Hợp chất có liên kết giữa carbon và kim loại là liên kết ion. HC C Na+ (C6H5)3C C Na+
Ví dụ: Hợp chất có liên kết giữa carbon và kim loại là liên kết cộng hóa trị. (CH3)3SnCl, (CH3CH2)4Pb…
Hợp chất cơ magiesium có một số dạng cân bằng giữa liên kết cộng hóa trị, liên
kết ion và liên kết phức. Hợp chất cơ magiesium có thể ở dạng monomer RMgHal,
dạng dimer [RMgHal]2 và dạng polymer [RMgHal]n. Các dạng cân bằng và chuyển hóa như sau: 97 lOMoARcPSD|208 990 13 2 RMgX RMg+ RMgX2 R2Mg MgX2 (alkyl magiesium halide) (X: Cl, Br, I) R X X Mg Mg R Mg Mg R R X X
Hợp chất cơ magiesium là loại hợp chất cơ kim quan trọng trong tổng hợp hữu cơ.
8.2.2. Phương pháp điều chế
8.2.2.1. Tác dụng của kim loại với dẫn xuất halogen
Cho kim loại tác dụng với dẫn xuất halogen là phuơng pháp phổ biến để điều
chế các hợp chất cơ kim. Phản ứng cần thực hiện trong môi trường ether khan và trong
khí quyển nitrogen hoặc helium hoặc argon. ether khan C2H5Br Mg C2H5MgBr
8.2.2.2. Tác dụng của hợp chất cơ kim với muối của kim loại khác
Phương pháp này dùng để tổng hợp các hợp chất cơ kim khó điều chế trực
tiếp hoặc cho hiệu suất thấp. C2H5MgCl HgCl2 C2H5HgCl MgCl2 3 C6H5MgBr AsCl3 (C6H5)3As 3 MgClBr
8.2.2.3. Thế kim loại trong hợp chất cơ kim bằng kim loại khác
Phương pháp này dùng để tổng hợp các hợp chất cơ kim có khả năng phản
ứng cao từ những hợp chất có khả năng phản ứng kém hơn. (CH3)2Hg 2 Na 2 CH3Na Hg (CH3)2Hg Mg (CH3)2Mg Hg
8.2.2.4. Trao đổi halogen với kim loại RX R'Li RLi R'X Cl Br CH3CH2CH2CH2Li Cl Li CH3CH2CH2CH2Br
Phản ứng này được sử dụng khi không dùng được phương pháp trực tiếp điều
chế hợp chất cơ kim từ dẫn xuất halogen và kim loại.
8.2.2.5. Tác dụng của hợp chất cơ kim với hydrocarbon có nguyên tử hydrogen linh động 98 lOMoARcPSD|208 990 13
Phản ứng này rất thuận lợi để điều chế các hydrocarbon chưa no, có mạch dài
hơn. Các hydrocarbon có “tính acid” như alk-1-yne hoặc cyclopentadiene dễ phản ứng
với hợp chất cơ kim. Đó là sự tương tác giữa một acid mạnh với muối của acid yếu. C2H5MgBr CH3C CH CH3C CMgBr C2H6
8.2.3. Tính chất hóa học
Vì liên kết giữa nguyên tử carbon - magiesium phân cực mạnh, nên hợp chất cơ
magiesium có khả năng phản ứng cao. 8.2.3.1. Phản ứng thế
a. Phản ứng với các hợp chất có hydrogen linh động
Hợp chất cơ magiesium dễ tham gia phản ứng với những hợp chất có nguyên tử
hydrogen linh động như acid, nước, alcohol, amine bậc I và bậc II, amide, mercaptan,
ammonia,…Sản phẩm của phản ứng là hydrocarbon và muối của magiesium. A RMgX HA RH Mg X Ví dụ: CH3MgBr H OH CH4 MgBrOH CH3MgBr H OCH2CH3 CH4 MgBr(OCH2CH3) CH3MgBr H NHCH2CH3 CH4 MgBr(NHCH2CH3)
b. Phản ứng với halogen, dẫn xuất halogen, dẫn xuất alkoxy và muối của kim loại
- Với halogen: sản phẩm là dẫn xuất halogen. RMgX I2 RI I Mg X (CH3)3CCH2MgCl I2 (CH3)3CCH2I I Mg Cl
- Với dẫn xuất halogen: sản phẩm là hydrocarbon. RMgX R'X RR' MgX2 CH3MgBr (CH3)3CCl (CH3)4C MgBrCl CH3CH2MgBr CH2 CHCH2Br CH3CH2CH2CH CH2 MgBr2
- Với dẫn xuất alkoxy: phản ứng của hợp chất cơ magiesium với ethyl orthofomate cho
acetal của aldehyde, sau đó thủy phân cho aldehyde. 99 lOMoARcPSD|208 990 13 OC OC 2H5 2H5 CH3CH2MgCl H C OC2H5 CH3CH2CH C2H5OMgBr OC OC 2H5 2H5 H2O CH 2 C 3CH2CHO 2H5OH
- Với muối của kim loại. 2 RMgX MX2 R M R 2 MgX2
Phản ứng xảy ra với Mg dương điện hơn kim loại M như Cu, Hg, Cd, Si, Sn, Zn… 4 RMgCl SnCl4 R4Sn 4 MgCl2 hoặc 2 RMgCl SnCl4 R2SnCl2 2 MgCl2 8.2.3.2. Phản ứng cộng
Hợp chất cơ - magiesium dễ dàng cộng hợp vào các hợp chất có liên kết bội -
phân cực như hợp chất có nhóm >Cδ+=Oδ-, -Cδ+≡Nδ-,v.v…Tác nhân nucleophile R
của thuốc thử Grignard RMgX sẽ tấn công vào carbon mang điện tích dương.
a. Phản ứng với oxygen, sulfur, carbon dioxide và epoxide,…
Hợp chất cơ magiesium phản ứng với oxygen, sulfur, carbon dioxide và epoxide
sẽ tạo ra các liên kết mới là C-O, C-S, C-C. ether H2O, H+ R MgX O C O R C OMgX R C OH HO Mg X O O
Hợp chất cơ magiesium tác dụng với các epoxide theo cơ chế SN2 và khi thủy phân cho alcohol. O H2O RMgX RCH CH OMgX RCH CH OH 2 2 2 2 ether
b. Phản ứng với hợp chất carbonyl, dẫn xuát của carboxylic acid và hợp chất nitrile
- Hợp chất carbonyl và hợp chất cơ magiesium phản ứng với nhau theo cơ chế AN, sau
đó thủy phân sản phẩm trong môi trường acid cho alcohol. H2O, H+ R MgX C O R C OMgX R C OH HO Mg X
+ Với HCHO: tạo sản phẩm alcohol bậc nhất. 100 lOMoARcPSD|208 990 13
+ Với các aldehyde: tạo sản phẩm alcohol bậc hai. 1. ether C6H5 CH C6H5MgBr CH3CH2CHO 2. H O,H+ CH2 CH3 2 OH
+ Với ketone: tạo sản phẩm alcohol bậc ba. 1. ether (CH CH 3)2C 3C CMgBr CH3 C CH3 2. NH Cl,H O C C CH3 4 2 O OH
- Hợp chất cơ magiesium phản ứng với các dẫn xuất của carboxylic acid. R C Z O
+ Phản ứng của hợp chất cơ magiesium với dẫn xuất của carboxylic acid (với
Z là OR’, OCOR, Cl, Br) sau khi thủy phân thu được alcohol bậc ba. Riêng các dẫn
xuất của formic acid như HCOOR, (HCO)2O và HCOCl, thì cho alcohol bậc hai. Phản ứng tổng quát: R' ' ' R' R MgX R MgX R C Z R C Z R C R' R C OMgX ether XMgZ ether O OMgX O R' R' H2O, H+ R C OH HO Mg X R' OMgBr CH3CH2COOCH3 CH 3MgBr ether CH3CH2 C CH CH 3 OCH 3CH2 C CH3 OCH 3 3 Mg O CH3MgBr CH CH 3 H 3 2O,H+ CH CH C CH 3CH2 C CH3 3CH2 3 OH OMgBr OH 1. ether 2 C CH 6H5MgBr 3CH2COCl 2. NH Cl,H O CH3CH2 C C6H5 4 2 C6H5 101 lOMoARcPSD|208 990 13
+ Phản ứng của hợp chất cơ magiesium với hợp chất nitrile: phản ứng của hợp
chất cơ magiesium với hợp chất nitrile sau khi thủy phân cho sản phẩm ketone. R' R' R'MgX H2O H2O RC N R C N Mg X R C NH R C R' XMgOH NH3 O CÂU HỎI ÔN TẬP
1. Cho công thức phân tử C5H11Cl, hãy:
a. Viết cấu trúc và gọi tên các đồng phân của hợp chất trên.
b. Chỉ rõ bậc của các dẫn xuất halogen ở câu a.
2. Hoàn thành các phản ứng sau: KOH/C2H5OH a. (CH3)2CHCH2CHCH3 Cl b. CH3CH=CHCHCH3 + HCl CH3 as c. CHCH2CH3 + Br2 CH 3 d. CHCH AlCl3 2CH3 + Br2 CH3
3. Xác định sản phẩm chính của phản ứng sau: CH3 + HBr
4. Từ C2H4 và một số chất cần thiết, viết các phương trình phản ứng điều chế n-
butylmagiesiumbromide và 1,4-dibromobut-2-ene.
5. Hãy viết các phương trình phản ứng để chuyển hóa:1-methylcyclohexanol thành 1-bromo-2-methylcyclohexane.
6. Hoàn thành dãy chuyển hóa sau: 102 lOMoARcPSD|208 990 13 (1) CH (4) 3CH2OH A (2) B (3) C CH3CH2CHMgCl CH3
7. Tám hợp chất hữu cơ A, B, C, D, E, G, H, I có cùng công thức phân tử là C4H7Br.
Đun nóng A hoặc B với dung dịch NaOH đều thu được butanal. Đun nóng C hoặc D
với dung dịch NaOH đều thu được butan-2-one. Phản ứng tương tự của E và G cho cùng một alcohol.
Xác định công thức cấu tạo của 8 hợp chất trên, biết rằng: A bền hơn B, C bền
hơn D, E bền hơn G và trong mỗi phân tử của H và I đều chứa các nguyên tử carbon bất đối. 103 lOMoARcPSD|208 990 13
Chương 9. CÁC HỢP CHẤT ALCOHOL – PHENOL 9.1. Monoalcohol
Monoalcohol là những hợp chất hữu cơ có một nhóm hydroxy liên kết với
nguyên tử carbon no trong phân tử.
Nếu gốc hydrocarbon là một gốc no, alcohol tương ứng được gọi là alcohol no:
CH3CH2OH. Nếu gốc hydrocarbon không no, ta có alcohol không no: CH2=CH-
CH2OH, còn nếu gốc hydrocarbon thơm ta có alcohol thơm: C6H5CH2OH.
Nhóm OH đính với nguyên tử carbon bậc 1, bậc 2 hay bậc 3 ta có alcohol bậc 1,
alcohol bậc 2 và alcohol bậc 3. CH3CH2CH2CH2OH CH3CH2CH(OH)CH3 (CH3)3COH alcohol bậc 1 alcohol bậc 2 alcohol bậc 3
9.1.1. Danh pháp, đồng phân 9.1.1.1. Danh pháp
a. Danh pháp thay thế
Tên của alcohol là tổ hợp của hidride nền chứa mạch chính với hậu tố -ol, kèm
theo chỉ số chỉ vị trí của nhóm OH nếu cần thiết. C2H5OH CH3-CH2-CH2-OH ethanol propan-1-ol
Mạch chính trong phân tử alcohol là mạch dài nhất chứa nhóm hydroxy
(alcohol no) và chứa liên kết kép (alcohol không no). Đánh số trên mạch chính được
bắt đầu từ phía gần nhóm OH hơn. C6H5-CH2CH2OH 2-phenylethanol
b. Danh pháp loại chức
Tên của alcohol là tổ hợp của tên của gốc hydrocarbon tương ứng với từ "alcohol” : CH3OH CH3CHOHCH3 CH2=CH-CH2OH methyl alcohol isopropyl alcohol allyl alcohol
c. Danh pháp thông thường
Tên thường hay tên riêng đựơc IUPAC lưu dùng đối với một số alcohol thiên nhiên. 104 lOMoARcPSD|208 990 13 CH3 OH CH H3C CH3 menthol d. Tên nhóm RO-
Tên nhóm RO- (hình thành bằng cách tách nguyên tử H của nhóm OH) là tổ
hợp của gốc R và hậu tố oxy-. CH3O- C2H5O- (CH3)2CHO- methoxy- ethoxy- isopropoxy- C6H5CH2O- CH3(CH2)2CH2O- benzyloxy- butoxy- 9.1.1.2. Đồng phân
a. Đồng phân cấu tạo
- Đồng phân về vị trí nhóm -OH CH3CH2CH2CH2OH CH3CH(OH)CH2CH3 butan-1-ol butan-2-ol
- Đồng phân về mạch carbon CH3CH2CH2CH2OH (CH3)2CHCH2OH butan-1-ol 2-methylpropan-1-ol
- Đồng phân về vị trí liên kết bội CH2=CH-CH2CH2OH CH3CH=CH-CH2OH but-3-en-1-ol but-2-en-1-ol
b. Đồng phân lập thể
- Đồng phân hình học CH CH 3 H 3 CH2OH C C C C H CH2OH H H (E)-but-2-en-1-ol (Z)-but-2-en-1-ol
- Đồng phân quang học 105 lOMoARcPSD|208 990 13 CH3 CH3 H OH HO H C2H5 C2H5 (S)-butan-2-ol (R)-butan-2-ol
9.1.2. Phương pháp điều chế
9.1.2.1. Cộng nước vào alkene
a. Cộng nước trực tiếp H3PO4, 300oC CH2 CH2 H2O CH 80 atm 3CH2OH
b. Cộng nước gián tiếp (dùng H2SO4 đặc) CH CH H SO CH CH OSO H H2O C H OH H SO 2 2 2 4 3 2 3 2 5 2 4 100oC
9.1.2.2. Hydrogen boron hóa - oxi hóa alkene (tạo alcohol bậc thấp) 1. BH3 RCH CH2 RCH2CH2OH 2. H2O2, NaOH
9.1.2.3. Oxygen mercury hóa - khử alkene 1. Hg(CH3COO)2, H2O RCH CH2 RCH(OH)CH3 2. NaBH4
9.1.2.4. Khử aldehyde, ketone, carboxylic acid và dẫn xuất
a. Khử aldehyde và ketone
Chất khử có thể dùng rất đa dạng: H2/Pt (Ni), nhưng tốt hơn là LiAlH4 và
NaBH4 vì tác nhân này khử chọn lọc, không đụng chạm đến liên kết bội. 1. NaBH4 CH3CH2CH2CHO CH3CH2CH2CH2OH 2. H3O+ butan-1-ol (85%) C H COC H 1. NaBH4 C H CH(OH)C H 6 11 6 11 6 11 6 11 2. H3O+ dicyclohexylmethanol (88%)
b. Khử acid và dẫn xuất - Khử acid
Acid bị khử bởi LiAlH4 tạo ra alcohol với hiệu suất khá cao, liên kết đôi trong acid vẫn giữ nguyên. 106 lOMoARcPSD|208 990 13 CH (CH ) CH 1. LiAlH4 CH (CH ) CH CH(CH ) CH OH CH(CH ) COOH 3 2 7 2 7 3 2 7 2 7 2 2. H3O+ Octadec-9-en-1-ol (87%) - Khử ester 1. LiAlH4 CH3CH2CH CHCOOCH3 CH3CH2CH CHCH2OH CH3OH 2. H3O+ pent-2-en-1-ol
9.1.2.5. Thủy phân dẫn xuất halogen H RX 2O/OH ROH HX
9.1.2.6. Từ hợp chất cơ magiesium
- Với HCHO: tạo sản phẩm alcohol bậc 1
- Với các aldehyde khác: tạo sản phẩm alcohol bậc 2 1. ether C H CH C 6 5 6H5MgBr CH3CH2CHO 2. H O,H+ CH2 CH3 2 OH
- Với ketone: tạo sản phẩm alcohol bậc 3 CH C CMgBr CH C 1.ether (CH ) C C C CH CH 3 3 3 3 2 3 2. NH4Cl,H2O O OH
- Với các dẫn xuất của carboxylic acid cho alcohol bậc 3
Phản ứng của hợp chất cơ magiesium với dẫn xuất của carboxylic acid (với Z là
OR’, OCOR, Cl, Br) sau khi thủy phân thu được alcohol bậc 3. R' ' ' R' R MgX R MgX R C Z R C Z R C R' R C OMgX ether XMgZ ether O OMgX O R' R' H2O, H+ R C OH HO Mg X R'
9.1.3. Tính chất vật lý
- Trạng thái tự nhiên: các alcohol có số nguyên tử carbon từ C1 → C11 là chất lỏng, từ
C12 trở đi là chất rắn. 107 lOMoARcPSD|208 990 13
- Nhiệt độ nóng chảy, nhiệt độ sôi tăng theo sự tăng dần phân tử khối của alcohol. Các
đồng phân mạch nhánh có nhiệt độ nóng chảy và nhiệt độ sôi thấp thấp hơn các đồng
phân mạch thẳng. Alcohol có nhiệt độ sôi và nhiệt độ nóng chảy cao hơn alkane tương ứng.
- Độ tan trong nước của các alcohol giảm dần theo sự tăng số nguyên tử carbon. Thực
chất chỉ có ba chất đầu của dãy đồng đẳng tan vô hạn trong nước.
9.1.4. Tính chất hóa học
Trong phân tử alcohol ROH có các liên kết phân cực theo kiểu: C O,
O H nên alcohol dễ tham gia phản ứng phân cắt dị li làm đứt liên kết O−H hoặc liên kết C−O.
9.1.4.1. Phản ứng phân cắt liên kết O−H a. Tính acid yếu
Alcohol là những acid rất yếu, yếu hơn H2O.Vì do sự phân cực của liên kết
O H nên H này linh động, tuy nhiên độ linh động của nó kém hơn H trong liên kết O H của H2O.
Khi −OH gắn với C có bậc càng cao thì tính acid càng giảm. Tính acid: CH3 CH CH < CH 3 C OH < 3 CH OH 3 CH2 OH CH3 CH3
Giải thích: Khi bậc C càng tăng thì hiệu ứng +I của gốc alkyl tăng làm giảm độ phân
cực của liên kết O−H và giảm độ bền của anion alcoholate tạo thành.
Ancol tác dụng được với kim loại kiềm 1 CH3CH2OH + Na CH3CH2ONa + H2 2
Các alcoholate kim loại kiềm là những hợp chất ion có tính base mạnh. Tính base biến thiên theo dãy:
OH– < CH3O– < C2H5O– < (CH3)3CO–
Các alcoholate rất dễ bị thủy phân: CH3CH2ONa + H2O CH3CH2OH + NaOH
b. Phản ứng tạo thành ether C2H5OH + CH3I C2H5OCH3 + HI
Phản ứng trên xảy ra chậm, thường chuyển alcohol về alcoholate rồi thực hiện phản ứng: C2H5ONa + CH3I C2H5OCH3 + NaI 108 lOMoARcPSD|208 990 13
Ether còn được tạo thành từ phản ứng tách nước giữa 2 phân tử alcohol H2SO4 2C2H5OH C2H5OC2H5 + H2O 140oC
c. Phản ứng tạo ester với acid hữu cơ H2SO4 ROH + R'COOH R'COOR + H2O to Cơ chế: + O + + ROH HOR R C + H+ R' C OH R' C OH OH OH OH OR + + R' C OR R' C OR R' C OH2 H+ H2O O OH OH
Có thể thay acid bằng dẫn xuất acid (acyl chloride hoặc anhydride acid), khi đó
khả năng phản ứng cao hơn. C2H5OH + CH3 C Cl CH3COOC2H5 + HCl O
9.1.4.2. Phản ứng phân cắt liên kết C−OH
a. Tác dụng với acid vô cơ mạnh
Alcohol phản ứng với acid vô cơ mạnh (ở dạng đậm đặc như: HI, HBr, HCl,
H2SO4…) tạo thành ester vô cơ. KBr + H 2SO4 R OH + H Br R Br + H2O Alkyl bromide R OH + H2SO4 R OSO3H + H2O
Các phản ứng trên có thể xảy ra theo cơ chế SN1 (đối với alcohol bậc 1) hoặc SN2
(thường với alcohol bậc 2, bậc 3) (CH3)3C OH + HBr (CH3)3C Br + H2O
Xét khả năng phản ứng của alcohol, ta có trình tự:
alcohol bậc 3 > alcohol bậc 2 > alcohol bậc 1
Vì theo trình tự đó, năng lượng liên kết C−O tăng và độ bền carbocation sinh ra giảm. 109 lOMoARcPSD|208 990 13
Xét khả năng phản ứng của HX, ta có trình tự: HI > HBr > HCl vì tính acid
của HX và tính Nu– của X– giảm.
- Dung dịch ZnCl2 trong chlorhydric acid đậm đặc được gọi là thuốc thử Lucas. Khi
cho thuốc thử này vào alcohol có các hiện tượng như sau:
+ Alcohol bậc 3 phản ứng ngay ở nhiệt độ thường và có sự tách lớp nhanh.
+ Alcohol bậc 2 phản ứng chậm ở nhiệt độ thường, lúc đầu chỉ làm dung dịch
hơi đục, đun nóng thì có hiện tượng tách lớp.
+ Alcohol bậc 1 không phản ứng ở nhiệt độ thường, phải đun nóng một thời
gian phản ứng mới xảy ra.
b. Tác dụng với hợp chất phosphorus halide và thionyl chloride 3ROH + PBr3 3RBr + H3PO3 ROH + SOCl2 RCl + SO2 + HCl
Người ta ít dùng PCl3 để điều chế alkyl halide từ alcohol vì PCl3 chỉ phản ứng
được với alcohol bậc 3, với alcohol bậc 2 chủ yếu xảy ra phản ứng loại nước tạo
alkene, còn với alcohol bậc 1 tạo thành ester của phosphorus acid P(OR)3.
c. Phản ứng tách nước
Quy tắc Zaisev: trong phản ứng tách nước từ alcohol, nhóm OH bị tách ra ưu tiên
cùng với nguyên tử Hβ bậc cao hơn, tạo thành alkene có mức độ thế cao ở nối đôi.
Xúc tác có thể dùng là Al2O3 nung nóng hoặc H2SO4 đặc hoặc H3PO4 đặc. Al CH 2O3 3CH2OH CH2 CH2 + H2O 400oC
Trong trường hợp dùng H2SO4 đặc, nhiệt độ phản ứng cần phải tăng từ alcohol
bậc 3 đến alcohol bậc 1 H2SO4 (CH3)3C OH (CH3)2C CH2 + H2O 60oC H 2SO4 (CH3)2CH OH CH3CH CH2 + H2O 100oC H2SO4 CH3CH2OH CH 180oC 2 CH2 + H2O
Khả năng tách nước của các alcohol như sau: alcohol bậc 1 < alcohol bậc 2 < ancol bậc 3.
9.1.4.3. Phản ứng oxi hóa a. Tách hydogen Cu R CH2 OH RCHO + H2 300oC 110 lOMoARcPSD|208 990 13 Cu R CH R' R C R' + H2 300oC OH O
b. Phản ứng oxi hóa không hoàn toàn
Tác nhân oxi hóa thường dùng là: K2Cr2O7/ H2SO4, KMnO4/ H2SO4 [O] [O] RCH2OH RCHO RCOOH R CH R' [O] R C R' OH O
Đối với alcohol bậc 1, muốn dừng ở aldehyde cần chưng cất aldehyde ra khỏi
hỗn hợp phản ứng và kiểm tra nghiêm ngặt nhiệt độ, thời gian phản ứng hoặc dùng tác
nhân: oxygen không khí với xúc tác Cu, CrO3/H2SO4 hoặc PCC.
Để dừng lại sản phẩm ketone thì dùng tác nhân: oxygen không khí với xúc tác
Cu; CrO3/H2SO4; SO3/pyridine/DMSO.
Alcohol bậc 3 không thể bị oxi hóa bởi KMnO4 trong môi trường base, trong môi
trường acid alcohol bậc 3 bị tách nước tạo alkene và alkene bị oxi hóa. 9.2. Polyalcohol
Khi thay thế hai hay nhiều nguyên tử hydrogen no ở Csp3 trong phân tử
hydrocarbon bằng những nhóm hydroxy ta thu được polyalcohol, bao gồm các diol, triol, …
HOCH2-CH2OH HOCH2-CH2-CH2OH HOCH2-CHOH-CH2OH
Nếu các nhóm hydroxy ở những carbon liền kề nhau thì hợp chất tương ứng
thuộc loại vic-polyol như vic-diol, vic-triol…
Nếu một nguyên tử carbon liên kết đồng thời nhiều nhóm hydroxy thì hợp chất
tương ứng thuộc loại gem-diol hay gem-triol. Các hợp chất này không bền, chỉ tồn tại
trong dung dịch, khi phân lập chúng sẽ bị tách nước.
9.2.1. Danh pháp
9.2.1.1. Danh pháp thay thế
Danh pháp thay thế của polyol được hình thành tương tự tên của mononalcohol
chỉ cần thêm tiền tố chỉ độ bội như di-, tri-, tetra-, …vào trước hậu tố -ol. HOCH2-CH2OH CH3-CHOH-CH2OH HOCH2-CHOH-CH2OH ethane-1,2-diol propane-1,2-diol propane-1,2,3-triol 9.2.1.2. Danh pháp thường
Danh pháp của một số polyalcohol được IUPAC lưu dùng . 111 lOMoARcPSD|208 990 13 HOCH2-CH2OH CH3-CHOH-CH2OH HOCH2-CHOH-CH2OH ethylene glycol propylene glycol glycerol
9.2.2. Phương pháp điều chế
9.2.2.1. Thủy phân ethylene oxide O H+ H2O HOCH2CH2OH 2 HCl
9.2.2.2. Thủy phân dẫn xuất 1,2-dihalogen Na 2CO3 ClCH HOCH 2CH2Cl 2 H2O 2CH2OH 2 HCl
9.2.2.3. Khử ester của dicarboxylic acid (phương pháp Bouveault – Blanc) Na, C2H5OH ROOC(CH ) COOR HOCH (CH ) CH OH 2 ROH 2 n 2 2 n 2 9.2.2.4. Ngưng tụ pinacol [H] 2 (CH3)2CO (CH3)2COH COH(CH3)2 Pinacol 9.2.2.5. Oxi hóa alkene 3 CH2 CH2 2 KMnO4 4 H2O 3 HOCH2CH2OH 2 KMnO4 2 MnO2
Ngoài ra, đối với glycerol có thể điều chế bằng cách thủy phân dầu mỡ động thực vật.
9.2.3. Tính chất vật lí
Các alkadiol là những chất lỏng sánh, tan nhiều trong nước, có nhiệt độ sôi cao
và tỉ khối lớn hơn monoalcohol. Các alkadiol có nhiệt độ đóng băng thấp nên được
dùng làm chất chống đông.
9.2.4. Tính chất hóa học
Các vic-polyalcohol mà tiêu biểu là ethylene glycol và glicerol có những tính
chất hóa học đặc trưng của alcohol với sự tham gia của một, hai, ba, ... nhóm OH.
Ngoài ra, các hợp chất này còn có nhừn tính chất riêng với sự tham gia đồng thời của hai nhóm OH kề nhau.
9.2.4.1. Phản ứng thế ở nhóm -OH
a. Phản ứng với kim loại kiềm và phản ứng tạo phức
Polyalcohol có tính acid yếu (nhưng mạnh hơn monoalcohol vì ảnh hưởng hiệu
ứng cảm ứng âm của nhóm hydroxy bên cạnh).
- Polyalcohol tác dụng với sodium. Phản ứng xảy ra với sự tham gia của một, hai hay
ba nhóm OH tùy theo điều kiện phản ứng. 112 lOMoARcPSD|208 990 13 CH2OH Na CH2ONa Na CH2ONa CH2OH 50oC CH2OH 160oC CH2ONa ethylene glycol monosodium glycolate disodium glycolate
- Polyalcohol phản ứng tạo phức với Cu(OH)2 và với B(OH)3. H CH CH O CH 2OH 2 O 2 2 Cu(OH) Cu 2 H 2 2O CH CH CH2 2OH 2 O O H
Phức chất của copper (II) với ethylene glycol tan trong nuớc cho dung dịch màu
xanh đậm. Phản ứng này dùng để nhận biết 1,2-diol. CH2OH CH2 O O CH B 2 2 CHOH B(OH) O CH H+ 3 CH O 3 H2O CH2OH CH2OH HOCH2
b. Phản ứng với acid tạo ester vô cơ và hữu cơ
Polyalcohol tác dụng với HCl và HBr, đầu tiên cho sản phẩm chứa nhóm
hydroxy và chlorine gọi là chlorohydrin, sau đó ở điều kiện khắc nghiệt hơn các nhóm
-OH còn lại bị thay thế tiếp. CH2OH HCl CH2Cl HCl, 200oC CH2Cl CH2OH H2O CH2OH H2O CH2Cl
Glycerol phản ứng với HCl có thể tạo ra hai chlorohydrin, trong đó đồng phân
nhiều hơn đồng phân . HOCH2CHOHCH2OH HCl ClCH2CHOHCH2OH HOCH2CHClCH2OH -monochlorohydrin -monochlorohydrin CH2OH CH2ONO2 H CHOH 3 HNO 2SO4 CHONO 3 2 3 H2O CH OH 20oC CH ONO 2 2 2 gliceryl trinitrate
Polyalcohol tác dụng với carboxylic acid và nhất là chloride acid tạo monoester hoặc polyester. to n HOOC COOH n HOCH CH OH 2 2 CO COOCH2CH2O 2n H2O n 113 lOMoARcPSD|208 990 13 poly(ethylene terephthalate)
9.2.4.2. Phản ứng tách nước
Đối với pinacol, tách nước kèm theo chuyển vị tạo pinacolone. CH3CH3 H+ CH3 CH3 C CH CH3 C C CH3 C 3 OHOH CH3O pinacol pinacolone
9.2.4.3. Phản ứng oxi hóa
Các vic-polyalcohol có thể bị oxi hóa bởi HIO4 hoặc Pb(CH3COO)4 làm đứt
liên kết C(OH)-C(OH) như kiểu ozone phân C=C. CH3 CH3CH CCH3 HIO4 CH3CHO CH3COCH3 HIO3 H2O OH OH 9.3. Phenol
Phenol là hợp chất hữu cơ có một hay nhiều nhóm hydroxy liên kết trực tiếp với
carbon của vòng thơm. Chất tiêu biểu là C6H5OH có tên là phenol.
9.3.1. Danh pháp, cấu trúc 9.3.1.1. Danh pháp
a. Danh pháp thay thế
Tên của các phenol xuất phát từ tên của hidride nền là hydrocarbon thơm, có
hậu tố -ol cùng với tiền tố chỉ độ bội và chỉ vị trí của nhóm OH, nếu cần thiết. OH OH OH OH OH benzene-1,3-diol benzene-1,2,4-triol
b. Danh pháp thường 114 lOMoARcPSD|208 990 13 OH OH CH3 phenol(benzenol)
o-, m-, p-crezol (các methylphenol) OH OH OH OH OH OH pyrocatechol resorcinol hydroquinone (benzene-1,2-diol) (benzene-1,3-diol) (benzene-1,4-diol)
9.3.1.2. Đặc điểm cấu trúc của phenol
Phenol là phân tử có cấu tạo phẳng, tất cả các nguyên tử trong phân tử phenol
đều nằm trong mặt phẳng, với góc liên kết COH = 1090, gần bằng góc tứ diện và
không khác nhiều so với góc COH của methanol. CH3 O O H H
Sáu nguyên tử carbon trong phân tử phenol đều ở trạng thái lai hóa sp2 (tương tự
như benzene), trong đó, 5 nguyên tử cacbon có 3 orbital lai hóa tạo 3 liên kết với 2
carbon bên cạnh và một orbital s của hydrogen, còn 1 nguyên tử carbon còn lại có 3
orbital lai hóa tạo 3 liên kết với 2 nguyên tử carbon bên cạnh và một với orbital của
nguyên tử oxygen tạo nhóm –OH.
Ngoài ra, mỗi nguyên tử carbon còn đóng góp 1 electron p không lai hóa vào hệ
6 electron giải tỏa trên toàn phân tử. H H C C H C C O H C C H H
Hình 9.1. Sự hình thành các liên kết trong phân tử phenol 115 lOMoARcPSD|208 990 13
Hình 9.2. Mô hình quả cầu que nối
Hình 9.3. Mô hình đặc của phân tử
phenol của phân tử phenol
Do oxi còn cặp electron p tương tác với hệ electron của nhân thơm làm xuất
hiện hiệu ứng liên hợp p- . Sự liên hợp +C của OH làm tăng sự phân cực của liên kết
OH, đồng thời làm cho liên kết C-O ngắn lại nên khó phân cực. H O o 1,36A CH3 O o 1,42A H
9.3.2. Phương pháp điều chế
9.3.2.1. Điều chế phenol trong công nghiệp a. Oxi hóa cumene
Cumene phản ứng với oxygen không khí ở nhiệt độ cao sẽ tạo thành phenol OOH CH(CH3)2 CH3 C CH3 OH O 2 H3O+ CH3COCH3 75oC 100oC cumene cumene hydroperoxide phenol acetone
b. Tách chiết từ nhựa than mỏ
Chưng cất nhựa than mỏ, phân đoạn có chứa nhiều phenol là dầu trung sôi ở
170 - 2300C. Người ta chế hóa dầu trung bằng dung dịch NaOH để chuyển phenol
thành dạng phenolate tan trong nước, sau đó dùng CO2 để đẩy phenol ra.
c. Thủy phân dẫn xuất halogen
Trong công nghiệp, ngoài những phương pháp điều chế phenol như trên, còn có
thể điều chế bằng cách thủy phân chlorobenzene bằng dung dịch NaOH đậm đặc, ở áp
suất cao và nhiệt độ cao. 116 lOMoARcPSD|208 990 13 NaOH, H2O H3O+ C6H5Cl C H ONa 6 5 C6H5OH 370oC, 300 atm
d. Đun nóng chảy muối sodium benzenesulfonate NaOH H3O+ C6H5SO3H C6H5ONa C6H5OH 300oC
9.3.2.2. Điều chế phenol trong phòng thí nghiệm
Phương pháp điều chế phenol trong phòng thí nghiệm hay đựơc dùng nhất là đi
từ aniline tạo muối diazonium, sau đó thực hiện phản ứng với hơi nước. Phản ứng đạt hiệu suất khá cao. NH2 N2HSO4 OH NaNO 2, H2SO4 H2O 5oC to NO NO 2 2 NO2 m-nitroaniline m-nitrophenol (86%)
9.3.3. Tính chất vật lý
Các phenol là những chất rắn ở nhiệt độ thường, trừ m- resorcinol.
Phenol đơn giản nhất là C6H5OH nóng chảy ở 430C, sôi ở 1820C. Phenol để
ngoài không khí bị chảy rữa do tạo thành hydrate nóng chảy ở 180C.
Do có nhóm -OH nên phenol có thể tạo liên kết hydrogen giữa các phân tử và
tạo liên kết hydrogen với nước, vì vậy phenol có nhiệt độ nóng chảy và nhiệt độ sôi
cao hơn dẫn xuất aryl halide có phân tử khối tương đương.
Tuy tạo đựơc liên kết hydrogen với nước, song đa số phenol tan ít trong nước,
C6H5OH ở nhiệt độ phòng có độ tan trong nước là ~ 9,95 g/100g H2O. Khi đun nóng
đến 700C thì độ tan đạt tới vô hạn.
Các đồng phân meta và para của nitrophenol có nhiệt độ sôi và nhiệt độ nóng
chảy cao hơn đồng phân ortho. Vì đồng phân meta và para có khả năng tạo liên kết
hydrogen liên kết phân tử, còn đồng phân ortho có liên kết hydrogen nội phân tử.
9.3.4. Tính chất hóa học
Trong phân tử phenol có hiệu ứng +C của nhóm –OH nên phản ứng làm đứt dị li
liên kết O−H ở phenol xảy ra dễ dàng hơn so với alcohol, trái lại các phản ứng làm đứt
liên kết C−O lại khó khăn hơn. Nếu so với benzene thì những phản ứng thế với tác
nhân electrophile xảy ra dễ dàng hơn và ưu tiên tại các vị trí ortho và para. O H 117 lOMoARcPSD|208 990 13
9.3.4.1. Các phản ứng thế nguyên tử H của nhóm -OH và thế nhóm -OH a. Tính acid
Phenol (pKa=10) có tính acid mạnh hơn so với alcohol và tác dụng được không
những với Na mà cả với NaOH. 1 C6H5OH + Na C6H5ONa + H 2 2 C6H5OH + NaOH C6H5ONa + H2O
Tuy nhiên, dung dịch phenol trong nước là một acid rất yếu, không làm đổi màu
quỳ tím và yếu hơn carbonic acid (pKa1=6,4; pKa2=10,3). C6H5ONa + CO2 + H2O C6H5OH + NaHCO3
Đối với dẫn xuất của phenol, tính acid phụ thuộc vào nhóm thế trong vòng benzene:
- Nếu nhóm thế hút electron (−NO2, −X , −CHO, −COOH,…) sẽ làm tăng độ phân
cực của liên kết O−H, và tăng độ ổn định của anion → làm tăng tính acid.
- Nếu các nhóm thế đẩy electron (−CH3, −C2H5,…) thì ngược lại, làm giảm tính acid.
b. Phản ứng tạo ether o t C6H5ONa + CH3I C6H5OCH3 + NaI o t 2C6H5ONa + (CH3)2SO4 2C6H5OCH3 + Na2SO4
c. Phản ứng tạo ester
Khác với alcohol, phenol khó cho phản ứng ester hóa với carboxylic acid. Muốn
điều chế ester của phenol, phải cho phenol tác dụng với anhydride acid hoặc acyl
halide trong dung dịch kiềm hoặc pyridine. NaOH C6H5ONa + (RCO)2O C6H5OCOR + RCOONa NaOH C6H5ONa + RCOCl C6H5OCOR + NaCl
d. Phản tạo thành halide
Phenol không tác dụng với HX trừ khi trong phân tử có nhóm hút electron mạnh.
Với PCl5, phenol có phản ứng nhưng hiệu suất rất thấp, còn với PCl3 thì cho sản phẩm
chủ yếu là ester của phosphorus acid mà không tạo ra C6H5Cl. 3C6H5OH + PCl3 P(OC6H5)3 + 3HCl OH Cl O 2N NO2 O2N NO2 + PCl5 + POCl3 + HCl NO2 NO2 118 lOMoARcPSD|208 990 13
e. Phản ứng với FeCl 3 6C6H5OH + FeCl [Fe(C 6H+ + 3Cl- 3 6H5O)6]3- + màu tím
Phản ứng này dùng để nhận biết các phenol: cresol cho màu xanh lơ, các phenol khác cho màu xanh ve.
9.3.4.2. Phản ứng ở vòng benzene trong phenol
a. Phản ứng halogen hóa
Phenol dễ dàng tham gia phản ứng thế với dung dịch bromine trong nước ngay ở nhiệt độ phòng. OH OH O Br Br Br Br 3 Br Br 2 2 HBr HBr Br Br Br
2,4,6-tribromophenol 2,4,4,6-tetrabromocyclohexadienone (kết tủa trắng) (kết tủa vàng)
Nếu phản ứng tiến hành trong dung môi hữu cơ kém phân cực như CHCl3, CCl4,
CS2,… thì sản phẩm tạo thành là monobromophenol. OH OH OH Br CS2,0oC + Br + 2 HBr Br
b. Phản ứng nitro hóa
Phản ứng nitro hóa phenol xảy ra trong điều kiện nhẹ nhàng hơn nitro hóa
benzene, phản ứng xảy ra ngay ở nhiệt độ phòng với HNO3 loãng tạo ra sản phẩm o- và p-nitrophenol. OH OH OH NO HNO 2 3 20%, 25oC + H2O NO2 30 - 40% 15%
Nếu dùng HNO3 đặc thì phenol rất dễ bị oxi hóa nên để thu được picric acid cần
phải sulfo hóa trước bằng H2SO4 đặc, sau đó cho tác dụng với hỗn hợp HNO3 đặc và H2SO4 đặc. 119 lOMoARcPSD|208 990 13 OH OH OH SO O NO H 3H 2N 2 2SO4 ñ HNO3 + H2SO4 H2O H2O SO3H NO2
c. Phản ứng sulfo hóa
Phản ứng sulfo hóa phenol tiến hành dễ dàng, sản phẩm là đồng phân o- hay p- tùy thuộc vào nhiệt độ.
d. Phản ứng alkyl hóa
Để alkyl hóa phenol người ta không dùng RX /AlCl3 vì có sự tạo phức nên khó
tương tác với tác nhân electrophile: + H O AlCl3
Phản ứng alkyl hóa phenol thường được thực hiện bằng alkene, alcohol khi có mặt H+. Ví dụ: OH OH CH3 H CH3 3PO4 + (CH3)3C OH + H2O 60oC C(CH3)3 4-tert-butyl-2-methylphenol OH H2SO4 + CH (CH 3 C CH2 3)3C OH 100oC CH 3 p-tert-butylphenol 120 lOMoARcPSD|208 990 13
p-tert-butylphenol là chất có giá trị cao trong công nghiệp sơn và vecni, từ đây
người ta có thể tạo polyme tan trong dầu bằng cách ngưng tụ với formaldehyde.
e. Phản ứng acyl hóa
Tác nhân acyl hóa như chloride acid hoặc anhydride acid có phản ứng với
phenol tại vòng thơm (C-acyl hóa) hoặc tại nhóm hydroxy (O-acyl hóa). RCOCl OH RCO OH hoaëc OCOR HCl
Với sự có mặt của AlCl3 ta sẽ thu được sản phẩm là C-acyl hóa vì sản phẩm O-
acyl hóa sẽ chuyển vị Fries tạo ra sản phẩm C-acyl hóa. OH OH OH CH COCl, AlCl , to COCH3 3 3 + HCl COCH3 74% 16%
g. Các phản ứng thế khác - Phản ứng Kolbe OH ONa OH OH NaOH CO2 COONa H+ COOH 150oC
- Phản ứng Reimer - Tiemann OH ONa ONa ONa OH NaOH CHCl3 CHCl OH H+ 2 CHO CHO OH
- Phản ứng với formaldehyde OH OH H+ hoac OH to CH2 OH HCHO polime
9.3.4.3. Các phản ứng oxi hóa và khử hóa
a. Phản ứng oxi hóa
C6H5OH bị oxi hóa chậm bởi oxygen không khí tạo hỗn hợp sản phẩm, trong đó
có benzoquinone - một diketone vòng không no liên hợp. 121 lOMoARcPSD|208 990 13
Hydroquinone dễ bị oxi hóa bởi Ag+ tạo thành benzoquinone: OH O 2 Ag+ 2 OH 2 Ag 2 H2O OH O
Phản ứng này được dùng trong kĩ thuật ảnh.
b. Phản ứng hydrogen hóa Ni C6HOH 3 H2 C6H11OH to CÂU HỎI ÔN TẬP
1. Từ chất cho trước, các hydrocarbon có không quá 2 nguyên tử C và chất vô cơ cần
thiết, viết các phương trình điều chế các chất sau (ghi rõ điều kiện phản ứng): 14 14 a. CH3OH CH3 CH CH2OH 14CH 3 b.
C2H5MgCl C2H5-C≡C-CH2OCH3
2. Hãy viết các phương trình phản ứng để chuyển hóa: 2-methylcyclohexanol thành 1- methylcyclohexanol.
3. M là một hợp chất hữu cơ có công thức phân tử là C7H8O. M phản ứng nhanh với
dung dịch Br2 cho N(C7H5OBr3). Hãy xác định công thức cấu tạo của M, N và viết
phương trình phản ứng xảy ra nếu:
a. M phản ứng được với NaOH, không phản ứng được với NaHCO3.
b. M không phản ứng được với NaOH, không phản ứng được với NaHCO3.
4. Khi đun nóng 2-methylbutane-2,3-diol trong H2SO4 đặc thì thu được hai hợp chất A,
P có cùng công thức phân tử C5H10O. Cho A, B tác dụng với dung dịch AgNO3/NH3
thì chỉ có A cho kết tủa. Hãy xác định công thức cấu tạo của A, B và viết phương trình phản ứng xảy ra.
5. Khi cho phenol tác dụng với dung dịch Br2/H2O thì nhanh chóng thu được 2,4,6-
tribromophenol nhưng khi cho phenol tác dụng với dung dịch Br2/ClCH2CH2Cl (ở
00C) lại thu được chủ yếu p-bromophenol (chiếm 93%). Hãy giải thích kết quả thu được.
6. Hai hợp chất hữu cơ A và B có cùng công thức phân tử là C7H6O2. A, B đều tạo
phức màu khi tác dụng với dung dịch FeCl3 và phản ứng với dung dịch AgNO3/NH3 122 lOMoARcPSD|208 990 13
cho kết tủa đặc trưng. A, B không phản ứng được với HCl khan. Khi thực hiện quá
trình monobromine hóa, A cho hai sản phẩm thế còn B chỉ cho một sản phẩm.
a. Hãy xác định công thức cấu tạo của A, B.
b. Viết các phương trình phản ứng xảy ra. 123 lOMoARcPSD|208 990 13
Chương 10. CÁC HỢP CHẤT CARBONYL
- Aldehyde và ketone là hai loại hợp chất hữu cơ có chứa nhóm carbonyl:
- Aldehyde và ketone được gọi là hợp chất carbonyl hay hợp chất oxo. - Công thức chung:
- Tùy theo đặc điểm của gốc hydrocarbon R, R’ mà ta có các loại aldehyde, ketone
mạch hở no và chưa no; aldehyde và ketone mạch vòng no, chưa no và thơm.
10.1. Danh pháp, cấu trúc
10.1.1. Danh pháp 10.1.1.1. Aldehyde
a. Tên thông thường
Các aldehyde mà acid tương ứng có tên thông thường thì có thể gọi tên theo cách sau:
- Thay từ acid bằng aldehyde
- Bỏ từ acid và thay đuôi “ic” bằng “aldehyde” Ví dụ: HCHO
aldehyde formic (formaldehyde) CH3CHO
aldehyde acetic ( acetaldehyde) CH3CH2CHO
aldehyde propionic ( propionaldehyde) C6H5CHO
aldehyde benzoic (benzaldehyde) CH2=CHCHO
aldehyde acrylic (acrylaldehyde) C6H5CH=CHCHO
aldehyde cinnamic (cinnamaldehyde) b. Tên thay thế
Tên hydrocarbon tương ứng + al (tính luôn cả C của nhóm -CHO)
- Đánh số bắt đầu từ nhóm -CHO 124 lOMoARcPSD|208 990 13
- Trong trường hợp nhóm -CHO gắn trực tiếp vào vòng thì thêm hậu tố carbaldehyde
vào tên của hydrocarbon tương ứng (không tính C của -CHO) 10.1.1.2. Ketone a. Tên loại chức
Tên hai gốc hydrocarbon + ketone b. Tên thay thế
Tên của hydrocarbon tương ứng (kể cả C của nhóm C=O) + đuôi one và chỉ số chỉ vị trí nhóm C=O. Ví dụ :
c. Tên thông thường
Một số tên thông thường của ketone được IUPAC lưu dùng:
10.1.2. Cấu trúc nhóm carbonyl
Nhóm C=O và các nguyên tử nối trực tiếp với nó nằm trên một mặt phẳng, các
góc liên kết liên quan đến nhóm C=O đều gần bằng 120o.
Cấu trúc của nhóm carbonyl Phân tử formaldehyde 125 lOMoARcPSD|208 990 13
Trong các phân tử aldehyde, ketone nguyên tử C của nhóm carbonyl và nguyên
tử oxygen đều ở trạng thái lai hóa sp2. Hai nguyên tử C và O nối với nhau bằng 1 liên
kết và 1 liên kết . Ngoài ra ở nguyên tử oxygen còn có 2 cặp electron chưa sử dụng
nằm trên 2 obital lai hóa sp2.
10.2. Phương pháp điều chế
10.2.1. Từ alkene 10.2.1.1. Ozone phân alkene Ví dụ:
10.2.1.2. Hydroformyl hóa alkene
Đun nóng alkene với hỗn hợp CO và H2 có xúc tác Cobalt octacarbonyl [Co(CO)4]2
10.2.2. Từ alkyne Ví dụ :
10.2.3. Từ benzene AlCl + 3 3 (CH CO 2 ) O CO 3 CH + 3 CH COOH
10.2.4. Từ alcohol 126 lOMoARcPSD|208 990 13 C CrO3 6H5CHCH2CH2CH2CH3 C6H5CCH2CH2CH2CH3 CH3COOH/H2O OH O 1-phenylpentan-1-ol 1-phenylpentanone (93%) hoặc từ diol:
10.2.5. Từ carboxylic acid và muối của chúng
10.2.5.1. Khử acid và dẫn xuất của chúng a. Carboxylic acid khöû oxi hoùa RCOOH RCH2OH RCHO Ví dụ : 1. LiAlH PDC 4 COOH COOH CHO 2. H CH 2O 2Cl2 83%
b. Dẫn xuất của acid (phương pháp Rozenmun) Pd(S) C C 6H5CH2COCl + H2 6H5CH2CHO + HCl 125oC, toluene
10.2.5.2. Nhiệt phân muối calcium của acid
Khi cất khan muối calcium của carboxylic acid ta thu được hợp chất carbonyl.
- Điều chế ketone có hai gốc R giống nhau: to (RCOO) Ca RCOR + CaCO 2 3
- Điều chế ketone có hai gốc R khác nhau: O O R C C R' O O Ca + Ca 2RCOR' + 2CaCO3 O O R C C R' O O
Có thêm sản phẩm phụ RCOR và R’COR’ - Điều chế aldehyde: O O R C C H O O Ca + Ca 2RCHO + 2CaCO3 O O R C C H O O 127 lOMoARcPSD|208 990 13 Có sản phẩm phụ RCOR
10.2.5.3. Nhiệt phân carboxylic acid
Cho hơi alcohol đi qua xúc tác (CaCO3, MnO2, ThO2…) ở nhiệt độ 300 - 400oC ThO 2CH 2 CH 3COOH 3COCH3 + CO2 + H2O CH2CH2COOH xt O + CO2 +H2O CH to 2CH2COOH
10.2.6. Từ hợp chất cơ magiesium
10.2.6.1. Điều chế aldehyde O R OMgBr H RMgBr + H C C 2O OC RCHO + C2H5OH + MgBrOH 2H5 H OC2H5
10.2.6.2. Điều chế ketone - + + - R R 2H RMgBr + R'C N C N MgBr 2O C O + MgBrOH + NH3 R' R' - - + - R + + O R OMgBr C C O + MgBrCl RMgBr + R' C Cl R' Cl R'
10.2.7. Điều chế aldehyde, ketone thơm 10.2.7.1. Aldehyde thơm
- Phương pháp Gattermann-Koch
Cho arene tác dụng với CO và HCl có mặt của AlCl3 và Cu2Cl2 sẽ thu được aldehyde thơm. AlCl3 + CO + HCl CHO Cu2Cl2
- Đối với phenol và ether người ta dùng phương pháp Gattermann thay CO bằng HCN (hoặc NaCN) 128 lOMoARcPSD|208 990 13 10.2.7.2. Ketone thơm
- Phương pháp Friedel-Craff
10.3. Tính chất vật lý
Formaldehyde, aldehyde acetic ở nhiệt độ thường là chất khí, các aldehyde trung
bình là chất lỏng. Các ketone cũng là những chất lỏng, ketone cao là chất rắn.
Các aldehyde và ketone có nhiệt độ sôi và nhiệt độ nóng chảy thấp hơn các alcohol tương ứng. Ví dụ : tos tos CH3CH2CH2OH 97,2 CH3CH2CHO 49 CH3CHOHCH3 82 CH3COCH3 56
Độ tan trong nước: các chất đầu dãy như formaldehyde, acetaldehyde, acetone tan
vô hạn trong nước, còn các đồng đẳng cao hơn chỉ tan ít hoặc không tan .
Mùi của aldehyde và ketone thường khác nhau: aldehyde có mùi xốc, ketone có mùi thơm dễ chịu.
10.4. Tính chất hóa học
10.4.1. Mối liên hệ giữa cấu trúc và tính chất hóa học
Cδ+ là trung tâm tấn công của tác nhân Nu (phản ứng đặc trưng là AN),
Do sự phân cực của nhóm carbonyl (C=O), nguyên tử Cα càng tăng
thêm điện tích dương và liên kết Cα-H phân cực hơn (phản ứng enol
hóa và các phản ứng thế nguyên tử Hα). Ngoài ra còn có các phản ứng
oxi hóa, phản ứng khử, trùng hợp.
10.4.2. Phản ứng cộng nucleophile
10.4.2.1. Cơ chế phản ứng 129 lOMoARcPSD|208 990 13
Trong đó HY là H-OH, H-CN, HOR, H-SO3Na… XY hay gặp là R-MgX, …
* Cơ chế : gồm 2 giai đoạn
10.4.2.2. Khả năng phản ứng AN
- Phản ứng xảy ra dễ dàng khi điện tích dương ở nguyên tử C-carbonyl phải lớn và
không bị cản trở không gian, vì thế khả năng phản ứng AN của O O O H C > R C > R C H H R
- Do các gốc R có hiệu ứng +I làm giảm điện tích dương ở C-carbonyl và đồng thời
gây cản trở không gian. Ngược lại những nhóm hút electron như -CH2Cl, -CCl3, -CF3,
-NO2… làm tăng khả năng phản ứng .
10.4.2.3. Các phản ứng cộng nucleophile
a. Phản ứng cộng nước
H2O là tác nhân Nu yếu nên chỉ cộng được với HCHO hoặc những aldehyde và
ketone có nhóm hút electron mạnh như chloral CCl3CHO, glyoxal HOC-CHO… O R OH R C + H C 2O H H OH
Formaldehyde bị hydrate hóa gần như hoàn toàn, nghĩa là trong nước nó tồn tại
chủ yếu dưới dạng hydrate (nên rất bền trong khi CH3CHO, C6H5CHO dễ tự oxi hóa).
Dung dịch 40% HCHO trong nước gọi là formalin.
Phản ứng phải dùng chất xúc tác acid, base.
b. Phản ứng cộng alcohol
- Alcohol có thể cộng vào nhóm carbonyl của aldehyde tạo sản phẩm là hemiacetal, là
chất ít bền tương tự hydrate.
- Khi đun nóng với lượng dư alcohol, có mặt HCl semiacetal tác dụng với 1 phân tử
alcohol nữa tạo ra acetal, là chất bền vững có tính chất tương tự ether. 130 lOMoARcPSD|208 990 13
- Các chất tương tự acetal của ketone gọi là cetal. Thông thường không điều chế cetal
bằng cách cho alcohol tác dụng trực tiếp với ketone mà phải dùng ester của acid orthoformic. c. Cộng HCN
Phải dùng xúc tác là base, nếu không phản ứng không xảy ra hoặc xảy ra chậm,
do base làm tăng nồng độ CN-.
Phản ứng này được dùng để điều chế α-hydroxycarboxylic acid.
d. Phản ứng cộng hợp chất cơ kim
- Phản ứng này được ứng dụng nhiều trong tổng hợp hữu cơ như:
+ Tác dụng với hợp chất cơ magiesium, sản phẩm tạo ra là alcohol các bậc.
+ Tác dụng với sodium acetylide (hoặc RC≡CH/NaNH2)
e. Phản ứng với sodium bisulfite
Aldehyde và methyl ketone tác dụng với NaHSO3 (dung dịch đậm đặc trong
nước) tạo thành sản phẩm cộng bisulfite ở dạng tinh thể. Các ketone có các gốc alkyl
kồng kềnh về mặt không gian không tham gia phản ứng này. 131 lOMoARcPSD|208 990 13
Hợp chất cộng bisulfite dễ bị thủy phân trong môi trường acid cũng như base
thành hợp chất carbonyl ban đầu, chính vì thế phản ứng này dùng để tách hợp chất
carbonyl ra khỏi hỗn hợp các chất khác không tham gia phản ứng này.
10.4.3. Phản ứng với dẫn xuất của ammonia - Cơ chế chung: R R R R + - R' C R' C NH G NH G C N G C O + H -H 2N G 2 2O R' R' OH O-
10.4.3.1. Phản ứng với amine bậc 1
- Aldehyde, ketone phản ứng với amine bậc 1 tạo sản phẩm là base Schiff hay imine. N-benzylidenmethylamine
10.4.3.2. Phản ứng với hydroxylamine aldehyde + H2NOH → aldoxime ketone + H2NOH → ketoxime Ví dụ:
CH3(CH2)5CHO + H2NOH → CH3(CH2)5CH=NOH + H2O
10.4.3.3. Phản ứng với hydrazine và dẫn xuất của hydrazine
- Aldehyde, ketone phản ứng với hydrazine cho sản phẩm là hydrazone. 132 lOMoARcPSD|208 990 13
- Đặc biệt phenylhydrazone là chất rắn kết tinh, dễ bị thủy phân trong môi trường acid
tạo hợp chất carbonyl ban đầu vì thế người ta thường dùng 2,4-dinitrophenyl hydrazine
để nhận biết hợp chất carbonyl.
- Hydrazone có thể chuyển hóa thành hydrocarbon no nhờ phản ứng khử Wolff- Kishner:
10.4.3.4. Phản ứng với semicarbazide
- Aldehyde, ketone phản ứng với semicarbazide tạo sản phẩm là semicarbazone.
- Aldehyde, ketone phản ứng với amine bậc hai tạo sản phẩm là enamine.
10.4.4. Phản ứng với hợp chất có nhóm methylene linh động
Các hợp chất có nhóm methylene linh động đã được hoạt hóa bởi các nhóm hút
electron như -CHO, -COOH, -CN, -NO2,… có thể tác dụng với aldehyde, ketone tạo ra
sản phẩm theo ba hướng: 1. C O + H2C C CH OH
Phản ứng (1) gọi là phản ứng aldol hóa. 2. C O + H2C C C + H2O
Phản ứng (2) gọi là phản ứng croton hóa, thực chất là phản ứng aldol hóa rồi tách nước. 133 lOMoARcPSD|208 990 13
Phản ứng (3) gọi là phản ứng Michael.
Các phản ứng này được xúc tác bằng H+ (HCl, H2SO4) hoặc OH- (NaHCO3, NaOH, K2CO3).
* Phản ứng giữa hai aldehyde:
Nếu là phản ứng của hai aldehyde khác nhau thì cho hỗn hợp của 4 sản phẩm .
* Phản ứng giữa aldehyde và ketone:
* Phản ứng giữa hai ketone:
Các ketone khó tham gia phản ứng vì nhóm carbonyl trong ketone kém hoạt
động mà còn vì bị án ngữ không gian bởi hai gốc hydrocarbon. OH CH3 OH- CH C - CH - C CH CH C = CH C CH 2 C O 3 2 3 3 3 CH3 - CH3 O H2O CH3 O
* Phản ứng giữa aldehyde với dẫn xuất của carboxylic acid: + Phản ứng Perkin :
Khi đun nóng aldehyde có nguyên tử Hα với anhydride acid có muối sodium
của acid tương ứng làm xúc tác thì sẽ tạo acid không no. CHO CH=CH-COOH + (CH CH 3CO)2O 3COONa
CHO + (CH CH CO) O CH3CH2COONa CH=C-COOH 3 2 2 CH3 + Phản ứng Knuvenagen:
Aldehyde thơm cũng như aldehyde dãy béo khi có mặt xúc tác base đều có thể
ngưng tụ với malonic acid hoặc các chất có chứa nhóm methylene linh động.
Hoặc ngưng tụ với ethyl malonate CH2(COOC2H5)2, ethyl cyanoacetate
NCCH2COOC2H5… tạo ra các sản phẩm sau: 134 lOMoARcPSD|208 990 13 COOC2H5 C H CH = C CN C H CH= C 6 5 6 5 COOC H COOC2H5 2 5
10.4.5. Phản ứng thế ở Hα
Do sự phân cực mạnh của nhóm carbonyl, nguyên tử H ở vị trí α đối với nhóm
carbonyl trở nên linh động và dễ bị chlorine, bromine hóa và thậm chí iodine hóa ở vị
trí này. Phản ứng có thể dùng xúc tác acid hoặc base.
Khi dùng dư halogen ta có thể thế được hết các nguyên tử Hα.
Trường hợp halogen hóa trong môi trường kiềm hợp chất RCOCH3 (với R là H,
alkyl, aryl) cho ngay dẫn xuất trihalogen, dẫn xuất này trong môi trường OH- sẽ tạo ra
iodoform CHI3 là chất kết tủa màu vàng. Vì vậy phản ứng này dùng để nhận biết hợp chất có nhóm CH3CO- .
10.4.6. Phản ứng khử
10.4.6.1. Phản ứng khử thành alcohol R H R 2 CH OH O C R' Ni(Pd, Pt) R'
Người ta còn dùng chất khử quan trọng khác là lithium aluminium hydride
LiAlH4, hoặc sodium borohydride NaBH4. 135 lOMoARcPSD|208 990 13
Các liên kết đôi, ba của C-C không phản ứng với ion hydride, nghĩa là liên kết kép được giữ nguyên.
10.4.6.2. Phản ứng khử thành hydrocarbon R Zn/Hg,HCld R C O CH2 + H2O R R
10.4.7. Phản ứng oxi hóa * Aldehyde:
Aldehyde có thể dễ dàng bị oxi hóa bởi các chất oxi hóa mạnh như K2Cr2O7, KMnO4.
hoặc các chất oxi hóa yếu như thuốc thử Tollens (phức [Ag(NH3)2]OH) , thuốc thử
Fehling (phức của Cu2+ với ion tactrate). R + [Ag(NH ) ]OH to C O 3 2 RCOONH4 + Ag + NH H 3
Các phản ứng này dùng để nhận biết aldehyde. Thuốc thử Tollens dùng cho
aldehyde béo và thơm. Thuốc thử Fehling chỉ dùng cho aldehyde béo. *Ketone: 136 lOMoARcPSD|208 990 13
Ketone chỉ bị oxi hóa khi đun nóng với chất oxi hóa mạnh. Khi đó mạch carbon
của phân tử bị đứt ra ở hai bên nhóm carbonyl tạo ra hỗn hợp các carboxylic acid. CH [O] 3CH2CH2CH2C CH2CH3 CH3CH2CH2COOH + CH3CH2COOH O +CH3CH2CH2CH2COOH + CH3COOH HNO O 3 HOOC(CH2)4COOH
10.4.8. Phản ứng định tính aldehyde
Ngoài phản ứng oxi hóa bằng thuốc thử Tollens, thuốc thử Fehling còn dùng
phản ứng với fuchsin sulfurous acid (thuốc thử Schiff), phản ứng cho màu hồng đặc
trưng để nhận biết aldehyde.
Fuchsin có màu hồng, có công thức cấu tạo: H 2N C NH + 2 Cl- H2N CH3
Khi cộng hai phân tử SO2 Fuchsin sẽ tạo hợp chất không màu gọi là fuchsin sulfurous acid. OH O H R CH S HN 2N C NH-OSOH 2RCHO OO C NH +Cl- 2 HCl R CH S H HN 2N SO SO 3H 3H OH O + H2 O CH CH3 3
10.4.9. Phản ứng trùng hợp
Thường chỉ có một số rất ít aldehyde đơn giản đầu dãy mới tham gia loại phản
ứng này, chủ yếu là phản ứng oligome hóa tức là trùng hợp một số ít phân tử monomer
Tùy theo điều kiện phản ứng sẽ tạo ra sản phẩm mạch vòng hay mạch thẳng.
- Ở trạng thái khí, HCHO trùng hợp thành polymer mạch vòng: H2C=O O CH O 2 O O CH2 O trioxymethylene (trioxane)
- Ở trạng thái dung dịch 40% (fomalin), trùng hợp thành polymer mạch hở 137 lOMoARcPSD|208 990 13 nH2C=O ( CH2 O )n n=10 100 polyoxymethylene
- Acetaldehyde khi có mặt của acid cũng oligomer hóa thành trimer gọi là
paraldehyde, nếu thực hiện dưới 0oC sẽ tạo ra tetramer gọi là methaldehyde, dùng làm
chất đốt rắn mang tên “cồn khô”. paraldehyde metaldehyde
Khi đun với vài giọt sulfuric acid, cả hai sản phẩm trùng hợp trên sẽ bị giải
trùng hợp tạo thành acetaldehyde. CÂU HỎI ÔN TẬP
1. Nêu các cách gọi tên của aldehyde, ketone theo danh pháp IUPAC.
2. Nêu đặc điểm cấu tạo của nhóm carbonyl, trên cơ sở đặc điểm cấu tạo hãy nêu các
phản ứng chính của loại hợp chất này.
3. Hãy vẽ cấu trúc của các chất sau : a. hex-4-enal e. butyraldehyde b. 3-methylxichlorohexanone
f. 2-ethylxichloropentancarbaldehyde c. pentan-2,4-dione g. 4-methyl-5-oxohexanal d. 4-bromoheptan-3-one
h. benzenee-1,3-dicarbaldehyde
4. Cho biết sản phẩm của các phản ứng sau : 138 lOMoARcPSD|208 990 13 CH3CH2CH (OCH2CH3) +H2O C(NNH2) (OCH2CH3) CH2CH3+H2O
5. Hãy viết sản phẩm chính cho các phản ứng sau :
6. Sắp xếp các chất trong dãy sau theo thứ tự giảm dần khả năng hydrate hóa:
7. Từ chất cho trước hãy cung cấp những tác nhân cần thiết để điều chế chất sau: OH HO
8. Hãy điền những tác nhân cần thiết để thực hiện chuyển hóa sau : 139 lOMoARcPSD|208 990 13
9. Viết sản phẩm aldol hóa của các phản ứng sau : 140 lOMoARcPSD|208 990 13
Chương 11. CÁC HỢP CHẤT CARBOXYLIC ACID VÀ DẪN XUẤT 11.1. Carboxylic acid
Carboxylic acid là những hợp chất hữu cơ có nhóm carboxyl COOH liên kết
với gốc hydrocarbon hoặc với nguyên tử hydro (trường hợp formic acid).
* Tùy theo bản chất của gốc hydrocarbon ta chia acid ra làm các loại khác nhau:
- Carboxylic acid béo có gốc R là H hoặc gốc hydrocarbon no hoặc không no. Ví dụ :
HCOOH, CH3COOH : acid no đơn chức, công thức chung CnH2n+1COOH. CH2=CH-COOH
: acid không no đơn chức, CnH2n-1COOH. - Carboxylic acid thơm.
+ Carboxylic acid béo, thơm, đơn chức có công thức chung CnH2n-7COOH với (n6) . Ví dụ : C6H5COOH + Carboxylic acid vòng Ví duï: COOH
* Tùy theo số lượng nhóm -COOH trong phân tử, ta có acid đơn chức
(monocarboxylic acid), acid đa chức hay polycarboxylic acid (dicarboxylic acid, tricarboxylic acid,...)
11.1.1. Danh pháp
11.1.1.1. Danh pháp thông thường
- Một số tên thông thường của acid no: HCOOH : formic acid CH3COOH : acetic acid CH3CH2COOH : propionic acid CH3CH2CH2COOH : butyric acid CH3(CH2)4COOH : caproic acid 141 lOMoARcPSD|208 990 13
- Một số tên thông thường của acid không no và acid thơm: o-toluic acid α-naphthoic acid terephthalic acid cinamic acid
Ngoài ra một số acid khác được coi là acid thế của acetic acid như:
Methylacetic acid trimethylacetic acid phenylacetic acid vinylacetic acid
11.1.1.2. Danh pháp thay thế
- Các monocarboxylic acid và dicarboxylic acid mạch hở đọc như sau:
Tên của hydride nền (tính cả C của nhóm -COOH) + oic hoặc dioic acid
- Polycarboxylic acid chứa 3 nhóm –COOH nối với mạch hở và carboxylic acid
chứa 1 nhóm –COOH liên kết với mạch vòng có tên gọi :
Tên hydride nền (không tính C của nhóm -COOH) + carboxylic, dicarboxylic, tricarboxylic,... + acid 11.1.1.3. Tên gốc acyl
- Khi nhóm -COOH mất đi -OH ta có gốc acyl, tên gọi gốc acyl như sau : 142 lOMoARcPSD|208 990 13
Bỏ chữ acid và thay đuôi “ic” bằng “yl” “oic” bằng “oyl”
“carboxylic” bằng “carboxyl”
(chỉ trừ trường hợp ngoại lệ ở cinamic acid, steric acid, acrylic acid)
11.1.2. Cấu trúc phân tử của hợp chất carboxyl
Cấu trúc đặc trưng của nhóm carboxyl rõ ràng nhất trong phân tử formic acid.
Phân tử formic acid nằm trên mặt phẳng, với một liên kết C-O ngắn hơn liên kết kia,
và các góc liên quan đến C-carboxyl đều gần 120o
Liên kết C-O (trong alcohol) = 1,41Ao điều đó chứng tỏ có sự liên hợp mới làm liên kết ngắn lại.
Đặc điểm cấu trúc này chứng tỏ nguyên tử C ở trạng thái lai hóa sp2 và liên kết
đôi C=O gồm một liên kết và liên kết gần giống như aldehyde, ketone.
Thêm vào đó, sự lai hóa sp2 của nguyên tử O trong nhóm hydroxyl cho phép
cặp electron không chia không định vị bằng cách xen phủ với hệ thống của nhóm
carbonyl, do đó acid có các dạng cộng hưởng sau:
Như vậy cả C và các nguyên tử O đều ở trạng thái lai hóa sp2.
11.1.3. Phương pháp điều chế
11.1.3.1. Oxi hóa các hợp chất hữu cơ a. Oxi hóa alkane
- Alkane bị oxi hóa bằng oxi không khí với chất xúc tác là muối manganese ở 100oC. 143 lOMoARcPSD|208 990 13 [O] [O] [O] R- CH3 RCH2OH RCHO RCOOH
- Alkane mạch dài (30C) bị oxi hóa bẻ gãy mạch tạo ra các acid có mạch ngắn hơn. [O] RCH2CH2R' RCOOH + R'COOH b. Oxi hóa alkene [O] RCH = CH R' RCOOH + R'COOH
c. Oxi hóa hydrocarbon thơm
d. Oxi hóa cycloalkane e. Oxi hóa alcohol [O] [O] R- CH RCOOH 2OH RCHO
11.1.3.2. Phản ứng thủy phân
a. Thủy phân các dẫn xuất gem-trihalogen R- CCl3 + 3 NaOH RCOOH + 3 NaCl + H2O
b. Thủy phân các nitrile H RCN 3O+ R'COOH
c. Thủy phân các dẫn xuất của carboxylic acid 1. NaOH RCOOR' + H 2O RCOOH + R'OH 2. H3O+
11.1.3.3. Tổng hợp carboxylic acid từ ester malonate, cyanoacetate và acetoacetate t o CH (COOC H ) C2H5ONa R-CH(COOC H ) .H3O+ R-CH(COOH) R-CH COOH 2 2 5 2 2 5 2 2 2 RX
11.1.4. Tính chất vật lý
- Carboxylic acid là những chất lỏng hoặc chất rắn ở điều kiện thường, tương tự alcohol.
- Acid có nhiệt độ nóng chảy và nhiệt độ sôi cao hơn các chất có phân tử khối và hình dạng tương đương. 144 lOMoARcPSD|208 990 13 O OH O OH to soâi (1at): 31oC 80oC 99oC 141oC
- Các acid no mạch thẳng có nhiệt độ nóng chảy cao hơn acid có liên kết đôi đặc biệt ở dạng cis. Ví dụ : Acid stearic (C17H35COOH) : 72oC
Acid cis-9-octadecanoic (oleic) : 16 oC
Acid cis,cis-9,12-octadecadienoic(linoleic) : -5 oC
- Các diacid có nhiệt độ nóng chảy cao hơn do có hai nhóm -COOH nên tạo được nhiều liên kết hydrogen. Ví dụ : to nc HOOC(CH2)4COOH 153oC CH3(CH2)4COOH -4 oC
- Độ tan của cacboxylic acid như sau:
+ Các acid đầu dãy (dưới 4C) tan vô hạn trong nước do tạo được liên kết hydrogen với
nước. Khi chiều dài mạch C tăng thì độ tan giảm cho đến acid 10C hầu như không tan trong nước.
+ Acid tan tốt trong alcohol hơn trong nước do alcohol ít phân cực hơn nước và đặc
biệt alcohol có gốc R gần như gốc R của acid.
+ Hầu hết các acid tan trong dung môi tương đối không phân cực như CHCl3 do nó
tiếp tục tồn tại dạng dimer, liên kết hydrogen của dimer vòng không bị phá vỡ.
11.1.5. Tính chất hóa học
11.1.5.1. Mối liên hệ giữa cấu trúc và tính chất hóa học
- Do có sự liên hợp giữa cặp electron của nguyên tử O trong nhóm hydroxyl nên :
+ Liên kết OH phân cực dễ dàng (tính acid tăng).
+ Điện tích dương của C-carbonyl giảm hơn so với aldehyde, ketone.
- Các phản ứng hóa học của acid có thể xảy ra theo nhiều hướng khác nhau tùy theo
liên kết bị đứt trong phản ứng: 145 lOMoARcPSD|208 990 13
Do sự liên hợp trong nhóm -COOH nên các phản ứng theo hướng (1) dễ hơn
alcohol, trái lại các phản ứng theo hướng (2) lại khó hơn alcohol và hướng (3) khó hơn
aldehyde, ketone. Khả năng phản ứng theo hướng (4) phụ thuộc nhiều vào cấu trúc của
gốc R, ngược lại phản ứng theo hướng (5) lại phụ thuộc vào đặc điểm cấu tạo của R và của cả nhóm -COOH.
11.1.5.2. Phản ứng cắt liên kết O-H RCOOH + H2O RCOO- + H3O+
Tất cả những yếu tố làm tăng độ phân cực của liên kết O-H và tăng độ bền của
anion carboxylate đều làm tăng tính acid.
* Nếu so với alcohol thì tính acid của carboxylic acid mạnh hơn nhiều do sự liên hợp
của nhóm -OH làm cho liên kết -O-H phân cực, hơn nữa anion carboxylate bền hơn anion alcoholate. Ví dụ : pKa pKa CH3OH 16 CH3CH2OH 18 HCOOH 3,75 CH3COOH 4,76 O O- - R C R C R O O- O
Có sự giải tỏa điện tích âm trên
gốc R đẩy electron làm tăng điện hai nguyên tử oxygen điện tích âm.
* Tính acid của các carboxylic acid phụ thuộc vào bản chất của gốc hydrocarbon liên kết với nhóm carbonyl.
+ Nếu trong gốc R có nhóm hút electron (-I,-C): làm tăng tính acid.
+ Nếu trong gốc R có nhóm đẩy electron (+I, +C) : làm giảm tính acid.
Do tính acid như trên nên carboxylic acid tham gia phản ứng với một số kim
loại, oxide kim loại và với kiềm: RCOOH + Na RCOONa + 1/2H2 2RCOOH + MgO (RCOO)2Mg + H2O RCOOH + NaOH RCOONa+ H2O 2RCOOH + CaCO3 (RCOO)2Ca + H2O + CO2 RCOOH + R'MgX RCOOMgX + R'H
11.1.5.3. Phản ứng cắt liên kết C-OH
- Tác dụng với PCl5, PCl3, SOCl2, COCl2 146 lOMoARcPSD|208 990 13 RCOOH + SOCl2 RCOCl + SO2 + HCl
- Tác dụng với alcohol tạo ester H+ RCOOH + ROH RCOOR + H2O - Tạo anhydride acid O O O P R C + 2O5 H C R R C + 2O OH HO O OCOR
11.1.5.4. Phản ứng ở gốc hydrocarbon
a. Phản ứng thế ở gốc hydrocarbon no
Tương tự aldehyde, ketone các nguyên tử Hα trong acid cũng linh động do ảnh
hưởng của nhóm -COOH hút electron.
Phản ứng halogen hóa gốc alkyl của acid có thể xảy ra theo cơ chế ion hay cơ
chế gốc tùy theo điều kiện phản ứng .
+ Nếu phản ứng xảy ra có ánh sáng, nhiệt độ thì phản ứng xảy ra theo cơ chế gốc.
+ Nếu cho acid tác dụng với bromine trong điều kiện có mặt của P hoặc I2, Fe… thì
phản ứng thế xảy theo cơ chế ion và thế vào Hα.
b. Phản ứng cộng vào gốc hydrocarbon không no
c. Phản ứng thế vào gốc thơm 147 lOMoARcPSD|208 990 13
Nhóm -COOH là nhóm thế loại 2 nên khi phản ứng thế vào nhân thơm sẽ thế vào vị trí meta.
11.1.5.5. Phản ứng oxi hóa - khử
a. Phản ứng oxi hóa
Trừ acid HCOOH còn các acid khác khó bị oxi hóa. Vì vậy khi tham phản ứng
oxi hóa thì tác nhân oxi hóa sẽ tham gia phản ứng với nguyên tử Cα để tạo thành các nhóm oxo. SeO2 2 RCH 2 CH COOH RCH2 C COOH + Se + H2O O
Trong các quá trình sinh học, sự oxi hóa nhờ xúc tác men xảy ra ở vị trí β. b. Phản ứng khử
Carboxylic acid là chất khó bị khử nhất, các tác nhân khử bình thường không
khử được chỉ có LiAlH4 là khử được.
11.1.5.6. Phản ứng decarboxyl hóa và dehydrate hóa
Khi trong phân tử carboxylic acid có nhóm hút electron như -NO2, -CN,
CH3CO-,...dưới tác dụng của nhiệt thường xảy ra phản ứng decarboxyl hóa dễ hơn.
Khi phân tử không có nhóm hút electron, muốn cắt liên kết C-COOH phải dùng muối của nó:
Ví dụ: chuyển thành muối silver, sau đó tác dụng với bromine. 148 lOMoARcPSD|208 990 13 Ví dụ: CH CaO 3COONa + NaOH CH4 + Na2CO3 to - Phương pháp Piria: Sau đó cải tiến :
2CH3COOH ThO2 hoac MnO CH3COCH3 + CO2 + H2O to
- Khi phân tử có hai nhóm -COOH, xảy ra các phản ứng decarboxyl hóa như sau:
+ 1,2 và 1,3-dicarboxylic acid :
+ 1,4 và 1,5-dicarboxylic acid dehydrate hóa khi đun nóng tạo anhydride acid:
+ 1,6 và 1,7-dicarboxylic acid bị đề carboxyl hóa tạo ketone vòng.
11.1.6. Một số ứng dụng của carboxylic acid
- Formic acid được dùng trong công nghiệp dệt, da, thực phẩm và trong tổng hợp hữu cơ.
- Acetic acid là nguyên liệu để tổng hợp polymer như poly(vinyl acetate), cellulose
acetate,…; nông dược như chất diệt cỏ sodium monochloroacetate, các chất kích thích 149 lOMoARcPSD|208 990 13
tăng trưởng thực vật, làm rụng lá cây như 2,4-D và 2,4,5-T,…; dược phẩm như
aspirine,..; chất cầm màu trong công nghiệp nhuộm như aluminium acetate, ferric
acetate,… và một số hóa chất hay dùng trong công nghiệp và đời sống như acetone,
ethyl acetate, isoamyl acetate,…
Dung dịch acetic acid 3-6% thu được khi cho lên men các dung dịch đường
hoặc ethyl alcohol,…được dùng làm giấm ăn,…
- Benzoic acid được dùng trong tổng hợp phẩm nhuộm. Nhờ tính sát trùng, nó được
dùng trong y học và công nghiệp thực phẩm. Một số dẫn xuất trichloro của benzoic
acid được dùng làm chất diệt cỏ trong nông nghiệp.
- Acrylic acid, methacrylic acid được dùng trong tổng hợp polymer.
- Lauric acid, palmitic acid, stearic acid và oleic acid có trong thành phần dầu mỡ động
vật và thực vật dưới dạng triester của glycerol. Muối sodium của chúng được dùng làm
xà phòng. Các palmitic acid và stearic acid được trộn với paraffin để làm nến.
- Oxalic acid có tính khử. Phản ứng oxi hóa oxalic acid thành CO2 nhờ tác dụng của
KMnO4 được dùng trong hóa phân tích.
- Diethyl malonate được dùng trong tổng hợp hữu cơ.
11.2. Dẫn xuất của carboxylic acid
11.2.1. Khái niệm, phân loại và danh pháp
11.2.1.1. Khái niệm và phân loại
Khi thay thế nhóm -OH ở nhóm carboxyl của carboxylic acid bằng những nhóm
thế khác nhau ta được những dẫn xuất ở nhóm chức của carboxylic acid.
Tùy theo bản chất của Y có thể là nguyên tử hay nhóm nguyên tử, ta phân biệt: 11.2.1.2. Danh pháp
a. Acyl halide (acid halide) Tên gốc acyl + halide 150 lOMoARcPSD|208 990 13 COCl Ví dụ: CH3CH2COCl propionyl chloride cyclohexanecarbonyl chloride propanoyl chloride b. Anhydride acid
Xuất phát từ tên acid tương ứng chỉ thay chữ “acid” bằng chữ “anhydride”. Ví dụ: (CH3CH2CO)2O CH3CH2CO-O-COCH3 propionic anhydride acetic propionic anhydride propanoic anhydride ethanoic propanoic anhydride c. Ester
Tên ester tương tự tên của muối, chỉ thay tên cation bằng tên của gốc hydrocarbon R’. Tên muối : tên của cation + anion
Anion hình thành bằng cách bỏ chữ acid và đổi đuôi ic thành ate hoặc
carboxylic thành carboxylate. formic acid → formate butanoic acid → butanoate benzoic acid → benzoate butyric acid → butyrate
cyclohexane carboxylic acid → cyclohexane carboxylate
Ví dụ: CH3CH2COOC2H5: ethyl propionate (ethyl propanoate)
CH3COOC6H5: phenyl acetate (phenyl ethanoate) COOCH3 COOC H COOCH3 2 5 o-dimethylphtalate ethyl cyclohexane carboxylate d. Amide O O O R C R C R C NH NR 2 NHR 2 Amide Amide thế 1 lần Amide thế 2 lần Amide bậc 1 Amide bậc 2 Amide bậc 3
Tên của amide gọi theo tên của acid tương ứng, bỏ từ “acid” và thay đuôi ic
bằng amide hoặc thay carboxylic bằng carboxylamide. 151 lOMoARcPSD|208 990 13 CH3CH2CONH2 propionamide propanamide e. Nitrile
Có 2 cách gọi tên nitrile :
- Bỏ từ acid và thay đuôi oic bằng nitrile hoặc ic bằng onitrile hoặc thay đuôi
carboxylic bằng carbonitrile CN Ví dụ: CH3CH2CN CH3CH2CH2CN Propionnitrile butyronitrile cyclohexanecarbonitrile Propanenitrile butanenitrile - Tên gốc alkyl + cyanide
Ví dụ: CH3CN : methyl cyanide (tên thường acetonitrile)
11.2.2. Tính chất hóa học
Cơ chế phản ứng SN2(CO) hay phản ứng acyl hóa: R Nu H Nu H Nu R C O C C C O + YH Y R R O O Nu YH Y
Khả năng phản ứng SN2(CO) : RCOCl > (RCO)2O > RCOOR > RCONH2 11.2.2.1. Acyl halide
a. Phản ứng SN2(CO)
Khả năng phản ứng : RCOF > RCOCl > RCOBr > RCOI. Do F có độ âm điện
lớn hơn các halogen khác; F có kích thước nhỏ không gây án ngữ không gian như các
Hal khác nên tác nhân Nu dễ tấn công hơn RCOONa (RCO)2O + NaCl RCOOH (RCO)2O + HCl RCOCl + HOH RCOOH + HCl R'OH RCOOR' + HCl ArOH RCOOAr + HCl NH3 RCONH2 + HCl RNH RCONHR + HCl 2 R2NH RCONR2 + HCl 152 lOMoARcPSD|208 990 13 b. Phản ứng khử
c. Phản ứng acyl hóa Friedel Craff
d. Phản ứng với hợp chất cơ magiesium: cho alcohol bậc 3 11.2.2.2. Anhydride acid
a. Phản ứng SN2(CO) HOH 2RCOOH R'OH RCOOR' + RCOOH (RCO) NH3 RCONH 2O + 2 + RCOOH RNH2 RCONHR + RCOOH R2NH RCONR2 + RCOOH b. Phản ứng khử LiAlH (RCO 4 2RCH 2 ) O 2OH c. Phản ứng Perkin
Anhydride acid tác dụng với aldehyde không có Hα, có mặt của muối sodium
của acid tương ứng (xem phần aldehyde).
d. Phản ứng Friedel-Craff 11.2.2.3. Ester
a. Phản ứng SN2(CO) HOH RCOOH + R'OH R''OH RCOOR'' + R'OH RCOOR' + NH3 RCONH2 + R'OH RNH2 RCONHR + R'OH R2NH RCONR2 + R'OH NH -NH RCONHNH2 + R'OH 2 2
Các phản ứng đều cần có chất xúc tác H+ hoặc OH-.
- Cơ chế phản ứng thủy phân ester:
+ Nếu dùng xúc tác H+ là phản ứng thuận nghịch và là phản ứng nghịch của phản ứng ester hóa.
+ Nếu dùng xúc tác OH- là phản ứng một chiều. 153 lOMoARcPSD|208 990 13 b. Phản ứng khử
Ester không những có thể bị khử bằng LiAlH4 như acid mà còn bị khử bởi Na trong alcohol .
c. Phản ứng với hợp chất cơ magiesium
Ester phản ứng với hợp chất cơ magiesium cho alcohol bậc 3 11.2.2.4. Amide
a. Phản ứng SN2(CO)
b. Phản ứng với HNO 2 O O + N + HNO R C 2 + H2O R C 2 NH OH 2
c. Phản ứng với alkyl halide
Do sự liên hợp của N cao nên nguyên tử H của nhóm -NH2 linh động hơn và có
thể tham gia một số phản ứng thế nguyên tử H.
d. Phản ứng thoái phân Hofmann O R C + Br2 + 3NaOH RNH2 + 2NaBr + Na2CO3 + H2O NH2 e. Phản ứng khử 154 lOMoARcPSD|208 990 13
g. Phản ứng tách nước 11.2.2.5. Nitrile
a. Phản ứng thủy phân b. Phản ứng khử
c. Phản ứng với hợp chất cơ magiesium
Nitrile phản ứng với hợp chất cơ magiesium cho sản phẩm là ketone.
CÂU HỎI VÀ BÀI TẬP
1. Viết sản phẩm chính của các phản ứng sau : C(O)Cl +SO2+HCl O (O ) 155 lOMoARcPSD|208 990 13 COO H C(O)OH
2. Xác định tác nhân cho các chuyển hóa sau, mỗi chuyển hóa có thể có hơn một phản ứng :
3. Viết sản phẩm của các phản ứng ngưng tụ sau :
4. Hãy điền tác nhân cho các quá trình chuyển hóa sau : 156 lOMoARcPSD|208 990 13
Chương 12. CÁC HỢP CHẤT AMINE VÀ MUỐI DIAZONIUM 12.1. Amine
Amine là dẫn xuất của amoniac khi ta thay thế nguyên tử H bằng các gốc hydrocarbon
Phân loại amine, theo nhiều cách:
- Phân loại theo bậc của amine:
+ Nếu thay 1 nguyên tử H bằng gốc hydrocarbon ta có amine bậc 1: RNH2
+ Nếu thay 2 nguyên tử H bằng gốc hydrocarbon ta có amine bậc 2: R2NH
+ Nếu thay 3 nguyên tử H bằng gốc hydrocarbon ta có amine bậc 3: R3N
- Phân loại theo đặc điểm cấu tạo của gốc hydrocarbon, ta có amine no, không no và thơm.
12.1.1. Danh pháp 12.1.1.1. Tên gốc chức
Tên gốc hydrocarbon + amine (hoặc azan)
12.1.1.2. Tên thông thường 12.1.1.3. Tên thay thế
Tên của hydrocarbon + amine
Chọn mạch chính là mạch có chứa nhóm amine và là mạch dài nhất, đánh số chỉ
sao cho vị trí nhóm amine là nhỏ nhất.
- Amine thơm: thường được gọi tên theo aniline. 157 lOMoARcPSD|208 990 13
- Muối của amine: thường được gọi bằng cách thay thế từ amine bằng từ ammonium.
12.1.2. Cấu trúc
Cấu trúc của CH3NH2 giống NH3, cả C và N đều ở trạng thái lai hóa sp3 và nối
với nhau bằng các liên kết , cặp electron không chia của N nằm trên orbital lai hóa sp3.
Hình 12.1. Mô hình phân tử CH3NH2
12.1.3. Phương pháp điều chế
12.1.3.1. Từ dẫn xuất halogen tác dụng với NH3 NH RX RX 3 RNH RX 2 R R 2NH 3N RX R4N+X- -HX -HX -HX
Phương pháp này thường tạo ra hỗn hợp các sản phẩm amine bậc 1,2,3 và muối ammonium bậc 4. C2H5Cl + NH3 C2H5NH3Cl- C2H5NH2 + HCl C2H5NH2 + C2H5Cl (C2H5)2NH + HCl (C (C 2H5)2NH + C2H5Cl (C2H5)2NH Cl- 2H5)3N + HCl C2H5
Nếu điều chế amine thơm, phản ứng khó khăn hơn, cần điều kiện nhiệt độ, áp
suất cao và thường xảy ra khi có nhóm hút electron mạnh. 158 lOMoARcPSD|208 990 13 Cl NH NHCH 2 Cl 3 NO2 2CH NH NO2 3 2 + 2NH3 + NH4Cl NO NO2 2
12.1.3.2. Khử hợp chất có chứa N
a. Khử hợp chất nitro
Đây là phương pháp quan trọng để điều chế amine thơm. NO NO 2 NH2 2 NH2 Fe(Sn)/HCl Fe(Sn)/HCl NO2 NH2
Để khử một nhóm -NO2 người ta dùng chất khử (NH4)2S, tuy nhiên không xác
định được nhóm -NO2 nào bị khử.
b. Khử hợp chất nitrile
Có thể dùng chất khử là H2, xúc tác kim loại hoặc LiAlH4. R C N H 2/Ni RCH2NH2 hoac LiAlH4
c. Khử hợp chất amide
d. Khử hợp chất oxime R H CH=N OH 2/Ni RCH2NH2 + H2O 159 lOMoARcPSD|208 990 13
e. Khử hợp chất isonitrile H R N C 2/Ni RNHCH3
12.1.3.3. Phương pháp thoái phân Hofmann O R Br C 2/NaOH RNH + Na CO 2 2 3 NH2
Phương pháp thoái phân Hofmann điều chế amine có số nguyên tử C giảm bớt một.
12.1.3.4. Phương pháp khử amine hóa hợp chất carbonyl
Những aldehyde, ketone có thể dùng để điều chế amine bậc 1 bằng cách cho tác
dụng với hydrogen và NH3 có xúc tác Ni . RCH=O + NH3 + H2 Ni RCH2NH2 R Ni R CH NH C O + NH 2 3 + H2 R R
12.1.3.5. Tổng hợp Gabriel
Để điều chế amine béo bậc một không lẫn các amine các bậc khác. phthalimide N-potassium phthalimide O O COOH RX H2O NK N R + RNH2 -KX H+(OH-) COOH O O
12.1.4. Tính chất vật lý
CH3NH2, C2H5NH2 là chất khí ở điều kiện thường, có mùi giống NH3, các
amine cao có mùi tanh của cá. Amine thơm nói chung rất độc có thể thấm qua da, rất
dễ bị oxi hóa bởi oxygen không khí.
Amine có điểm sôi cao hơn các hợp chất không phân cực có cùng phân tử
lượng nhưng có nhiệt độ sôi thấp hơn alcohol hoặc acid do liên kết hydrogen của
amine yếu hơn liên kết hydrogen của alcohol và acid.
Amine bậc 3 có nhiệt độ sôi thấp hơn amine bậc 2 và bậc 1 tương ứng vì không có liên kết hydrogen. 160 lOMoARcPSD|208 990 13 ts ts (CH CH 3)3N 3 3NHCH2CH3 37 CH CH3CH2CH2NH2 48 3OCH2CH3 8 CH3CH2CH2OH 97
Amine các bậc đều có khả năng tạo được liên kết hydrogen với nước nên một
số amine thấp C1- C6 tan được trong nước. Amine tan trong dung môi ít phân cực hơn như ether, benzene.
12.1.5. Tính chất hóa học 12.1.5.1. Tính base
- Tương tự NH3, amine có tính base do nguyên tử N còn có cặp electron không chia.
Thế nhưng so với alcohol và ether thì amine có tính base mạnh hơn. Vì độ âm điện của
N nhỏ hơn O nên nó ít giữ chặt cặp electron do đó cặp electron linh động hơn. RNH2 + H2O RNH3 + H3O+
Mọi yếu tố làm tăng mật độ electron ở nguyên tử N và giải tỏa điện tích dương
ở cation alkyl ammonium đều làm cho tính base của amine tăng.
Các amine béo có tính base mạnh hơn ammonia và các amine thơm lại có tính
base nhỏ hơn ammonia và nhỏ hơn amine béo. CH3NH2 NH3 NH 2 pKb 3,38 4,75 9,42 - C
Đối với các amine béo, trong dung môi phân cực (như nước) thì tính base của
amine béo > NH3, amine bậc 2 > amine bậc 1 và bậc 3.
Nếu trong những dung môi không có khả năng solvate hóa như trong
chlorobenzene thì tính base của amine bậc 3 > bậc 2 > bậc 1. Ví dụ :
Trong nước : (C4H9)2NH > C4H9NH2 > (C4H9)3N
Trong benzene: (C4H9)3N > (C4H9)2NH > C4H9NH2
Đối với amine thơm có nhóm thế thì tính base còn phụ thuộc vào bản chất và vị
trí của nhóm thế trong vòng benzene.
+ Nhóm đẩy electron: tính base tăng.
+ Nhóm hút electron : tính base giảm. CH3 NH2 > NH2 > O2N NH2 pKb : 8.88 9,42 12,98 161 lOMoARcPSD|208 990 13
12.1.5.2. Phản ứng alkyl hóa
Tác dụng với RX tạo amine có bậc cao hơn. RX RNH R R3N RX R4N+X- 2 RX 2NH -HX -HX Ví dụ : (C2H5)2NH + C6H5CH2Cl (C2H5)2N CH2C6H5 + HCl
12.1.5.3. Phản ứng acyl hóa
Khi tác dụng với carboxylic acid, anhydride acid, acyl chloride… nguyên tử H
liên kết với N có thể bị acyl hóa. RCOCl R3N + ArSO khoâng phaûn öùng 2Cl
- Phản ứng này có hai ứng dụng :
+ Bảo vệ nhóm -NH2, -NH- trong các phản ứng oxi hóa, nitro hóa, halogen hóa….
+ Tách biệt hỗn hợp amine các bậc.
12.1.5.4. Phản ứng với aldehyde, ketone
- Amine bậc 1 phản ứng aldehyde, ketone cho imine (base Schiff)
- Amine bậc 2 phản ứng aldehyde, ketone cho enamine 162 lOMoARcPSD|208 990 13
12.1.5.5. Phản ứng với HNO2 a. Amine béo bậc 1 HX RNH2 + HO N=O R N NX +2H2O R N NX + H2O ROH + N2 + HX
Muối diazonium béo kém bền dễ phân ly thành carbocation và phân tử N2: R N N R+ + N2
Carbocation không bền sẽ tác dụng với tác nhân nucleophile theo phản ứng thế,
hoặc tách proton tạo ra alkene, hoặc chuyển vị thành carbocation bền hơn. b. Amine thơm bậc 1
Amine thơm bậc 1 phản ứng với HNO2 ở nhiệt độ thấp tạo muối diazonium
thơm bền, bị thủy phân khi đun nóng. HX ArNH Ar 2 + HO N=O N NX +2H2O 0-5oC Ar N NX + H2O to ArOH + N2 + HX
c. Amine béo và thơm bậc hai R2NH + HO N=O R2N N=O + H2O nitrosamine (màu vàng)
Nitrosamine là chất lỏng như dầu, không tan trong nước, là những chất rất độc
và là một trong những chất gây bệnh ung thư ở người. 163 lOMoARcPSD|208 990 13
Khi đun nóng nitrosamine thơm dễ tham gia phản ứng chuyển vị thành p(o)- nitroamine thơm. NHCH O=N NCH 3 3 HO N=O to CH 3NH N=O -H2O d. Amine bậc ba
Amine bậc ba nói chung không phản ứng với HNO2 trừ trường hợp amine
thơm tham gia phản ứng nitroso hóa ở nhân. CH3NCH3 HO N=O (CH 3)2N N=O -H2O
12.1.5.6. Phản ứng tạo carbylamine
Đây là phản ứng đặc trưng để nhận biết amine bậc 1. Các amine bậc 1 có thể
phản ứng với CHCl3 trong kiềm, alcohol tạo ra isonitrile (có mùi tanh cá mè rất đặc trưng, rất độc). isonitrile
Phản ứng phải thực hiện trong môi trường OH- vì hợp chất isonitrile chỉ bền
trong môi trường OH-. Trong môi trường H+ :
12.1.5.7. Phản ứng với hợp chất cơ magiesium
Dùng để phân biệt amine bậc 1 và amine bậc 2 dựa vào thể tích khí methane thoát ra. RNH2 + 2CH3MgCl RN(MgI)2 + CH4 R2NH + 2CH3MgCl R2NMgI + CH4
12.1.5.8. Phản ứng oxi hóa
Amine rất dễ bị oxi hóa ngay khi tiếp xúc với không khí, vì thế amine phải
được bảo quản ở dạng muối và các loại dược phẩm có chứa nhóm amine cũng được chuyển qua dạng muối. 164 lOMoARcPSD|208 990 13 Amine bậc 1 hydroxylamine hợp chất nitroso hợp chất nitro
12.1.5.9. Phản ứng thế vào nhân benzene của amine thơm
Nhóm NH2 làm tăng mật độ electron ở nhân thơm đặc biệt là vị trí o, p nên
amine thơm dễ tham gia phản ứng thế elctrophile.
a. Phản ứng halogen hóa
Dung dịch bromine tác dụng với aniline tạo kết tủa trắng không tan trong nước. NH2 NH2 Br Br + 3Br2 + 3HBr Br
Muốn điều chế monohalogen người ta phải giảm bớt sự hoạt hóa của nhóm
-NH2 bằng cách acyl hóa chúng. NH NH 2 NH2 2 NHCOCH3 NHCOCH3 NHCOCH3 Br Br CH Br 3COCl 2 H2O + + OH- Br Br
b. Phản ứng nitro hóa
Nhóm -NH2 dễ bị oxi hóa bởi HNO3 (làm dung dịch có màu tối) nên trước khi
nitro hóa cần phải bảo vệ nó bằng phản ứng acyl hóa. NH NH 2 2 NHCOCH3 NHCOCH3 CH H 3COCl HNO 2O 3 hoac -H2O OH- (CH3CO)2O NO NO2 2
Tuy nhiên amine thơm bậc 3 có thể nitro hóa được bởi HNO3 trong acetic acid,
là tác nhân oxi hóa nhẹ hơn HNO3/H2SO4.
c. Phản ứng sulfo hóa
Khi đun aniline với acid H2SO4 đặc ở 180oC thu được sulfanilic acid, nếu nhiệt
độ thấp hơn khoảng 60oC thì thu được sản phẩm là o-aminobenzenesulfonic acid. 165 lOMoARcPSD|208 990 13 NH SO3H NH2 60oC SO3H 180oC 180oC H N SO H 2 3 sulfanilic acid
Muốn điều chế m-nitroaniline : NH NH 2 NH3HSO4 NH3HSO4 2 H2SO4d HNO3 H2O 180oC -H2O OH- NO2 NO2
d. Phản ứng alkyl hóa và acyl hóa
Aniline và N-aniline thế không thực hiện phản ứng alkyl hóa và acyl hóa được,
do trong điều kiện phản ứng có mặt của Lewis acid, cặp electron của N sẽ tạo phức và
trở thành nhóm phản hoạt hóa. 12.2. Muối diazonium Ar N N X
X- : Cl, Br, HSO4 , NO3 , BF4…
- Tên gọi: thêm đuôi diazonium theo sau tên của hợp chất thơm sau cùng là tên halide. 166 lOMoARcPSD|208 990 13
12.2.1. Điều chế C H NH + HNO + HCl 0-5oC C H N NCl- H O 6 5 2 2 6 5 2 Cơ chế:
Nếu trong nhân benzene chứa nhóm thế có hiệu ứng –C, -I như -NO2, -CN
…thì tính base của amine giảm nên phản ứng khó khăn. Ngược lại có các nhóm đẩy
electron có +C > -I như -OCH3, -N(CH3)2,…làm tăng tính base nên phản ứng diazo hóa dễ hơn.
12.2.2. Tính chất hóa học
12.2.2.1. Phản ứng loại bỏ nhóm N
a. Phản ứng chuyển Ar N + 2 thành ArOH, ArI, ArOR - Phản ứng tạo ArOH
Ion arendiazonium trong nước bị thủy phân chậm ở lạnh và nhanh khi đun
nóng. Sản phẩm trung gian là cation Ar+ . Ar N N -N Ar+ H2O Ar OH2 2 -H+ ArOH
Trong phản ứng này cần dùng H2SO4 thay cho HCl vì Cl- có thể tác dụng với
Ar+ tạo thành ArCl do đó làm giảm hiệu suất ArOH. Anion HSO - 4 sinh ra từ H2SO4
không tác dụng với Ar+ được vì tính Nu kém H2O. - Phản ứng tạo ArOR
Nếu đun nóng muối diazonium với alcohol thì thu được ether : 167 lOMoARcPSD|208 990 13 Ar N N Ar+ C2H5OH Ar OC2H5 -N -H+ Ar-OC2H5 2 H - Phản ứng tạo ArI KI tác dụng với ArN + 2
tạo thành ArI, giai đoạn tạo muối diazonium vẫn có thể
dùng NaNO2 trong HCl do tính Nu của I- lớn hơn Cl-. NH2 N NCl- I 0-5oC NaNO KI, 25OC 2 (75%) HCl -N2 NO2
b. Phản ứng chuyển ArN + 2
thành ArBr, ArCl, ArCN
Phản ứng này được xúc tác bởi muối copper (I) và được gọi chung là phản ứng Sandmeyer.
Ví dụ: Từ p-ethylaniline điều chế p-chloroethylbenzene.
Ví dụ : Từ toluene tổng hợp p-methylbenzoic acid. CH CH 3 CH3 CH3 CH3 3 CH3 H HNO NaNO2 CuCN 2O 3 Sn H2SO4 HCl HCl NO2 NH2 N NCl- CN COOH
c. Phản ứng chuyển ArN + 2 thành ArNO2, ArF
- Phản ứng tạo ArF
Một trong những muối arendiazonium bền vững có thể phân lập được là muối
fluoroborate. Khi nung khan muối này sẽ thu được dẫn xuất fluoro. 168 lOMoARcPSD|208 990 13 - Phản ứng tạo ArNO2
Muối arendiazonium fluoroborate có thể tác dụng với NaNO2 trong nước với
xúc tác bột Cu để tạo ra hợp chất nitro. NO NO 2 NO 2 NaNO 2 2 NaNO2 bôt Cu HBF4 NH2 0oC N NB 4 F - NO2
d. Phản ứng chuyển ArN + 2 thành ArH
- Phản ứng này dùng chất khử là hypophosphorous acid (H3PO2)
Ví dụ: Từ aniline tổng hợp 1,3,5-tribromobenzene
e. Phản ứng chuyển Ar+ N2 thành Ar-Ar’
Muối diazonium (được điều chế bằng phương pháp bình thường) có thể tác
dụng với aren (benzene, toluene, xylen…) trong dung dịch base (được khuấy mạnh)
sinh ra diaryl Ar-Ar’ (phản ứng Gombe).
12.2.2.2. Phản ứng không giải phóng N
Ion arendiazonium là tác nhân electrophile không mạnh. Vì điện tích dương ở
nguyên tử N được giải tỏa bởi nhân benzene. Ion arendiazonium có thể phản ứng với 169 lOMoARcPSD|208 990 13
hợp chất thơm giàu mật độ electron như amine thơm, phenol,…theo cơ chế thế electrophile.
Phản ứng ghép azo xảy ra dễ dàng khi trong cấu tử azo có Y là những nhóm đẩy
electron mạnh như -O-, -NR2, -NH2, -OH… và cấu tử diazo có nhóm hút electron như -SO3H, -NO2, ...
Tốc độ tương đối của phản ứng ghép azo phụ thuộc vào nhóm thế X trong p-X-C + 6H4N2 : X H NO2 Br CH3 OCH3 k 1 1300 13 0,4 0,01
a. Phản ứng ghép với phenol
Phản ứng ghép với phenol xảy ra ở pH tối ưu là 9-10 (môi trường OH- yếu)
Vì cation diazonium có tính electrophile yếu nên nó không phản ứng với phenol
tự do mà chỉ phản ứng vơi anion phenolat . ghép chậm ghép nhanh
Nếu môi trường base mạnh hơn (pH=11,9), thì muối diazonium tồn tại ở dạng diazoate Ar-N=N-O-.
Vì hiệu ứng không gian loại 1 là chính hướng tấn công của ion diazonium là vị trí p: OH CH3 OH HO3S OH (CH3O) (COOH) OH OH OH R
b. Phản ứng ghép với amine
Phản ứng ghép với amine thơm có pH tối ưu là 5-9. Vì:
+ Nếu môi trường acid mạnh: 170 lOMoARcPSD|208 990 13 NH2 3 NH + tham gia H+
phaûn hoaït hoùa nhaân thôm vaø phaûn öùng
khoâng tham gia phaûn öùng
+ Nếu môi trường base mạnh : OH- ArN2 Ar N N O- Tham gia phản ứng ghép
diazoate không tham gia phản ứng ghép
Hướng tấn công của một số amine thơm: NR2 NHR NH2 Ví dụ: C C 6H5N2Cl- N(CH 6H5 N=N N(CH3)3 3)3 -HCl
Nếu dùng amine thơm bậc 1 thì phản ứng xảy ra ở nguyên tử N: C 6H5N2Cl- NH C 2 6H5 N=N NH -HCl 1,3-diphenyltriazene (hay diazoaminobenzene) : 83%
Khi có dư C6H5NH2 và trong môi trường acid đun nóng, diazoamineobenzene
sẽ chuyển vị thành p-amionazobenzene: C6H5NH + C6H5 N=N NH 3 p-NH2 C6H4 N=N
Ứng dụng : phản ứng này được dùng nhiều trong tổng hợp hợp chất màu và phẩm nhuộm azo.
CÂU HỎI VÀ BÀI TẬP
1. Amine có công thức phân tử C6H15N, khi tác dụng với HNO2 sẽ tách ra N2 và
alcohol C6H14O. Thuỷ phân sản phẩm ozonide của alkene tạo thành do loại nước của
alcohol trên thu được acetaldehyde và ethyl methyl ketone. Xác định công thức cấu tạo
của amine trên và viết các phương trình phản ứng minh hoạ.
2. Hoàn thành các sơ đồ phản ứng sau: HNO [H] 2 PCl5 KCN a/ CH3 CH NH2 A B C D CH 3 171 lOMoARcPSD|208 990 13 KCN Na CHCl3 [H] b/ CH3 CH CH B C D 2Br A ancol KOH CH3 CH HNO HNO thuý ph©n c/ 3COCl 3 3 C6H5NH2 A B C D H2SO4 H2SO4
3. Viết phương trình phản ứng tạo thành chấu màu azo từ các chất sau dùng làm hợp phần diazo và azo: Hợp phần diazo Hợp phần azo Aniline N,N–dimethylaniline p–Toluidin Phenol Sulfanilic acid Aniline Sulfanilic acid β–Naphtol
4. So sánh tính base của các chất trong các dãy sau và giải thích:
a/ n–C4H9NH2; (C2H5)2NH; C2H5NHCH3; CH3CONHCH2CH3
b/ C6H5NH2; C2H5NHCH3; C2H5NHC6H5; CH3NH2.
c/ C6H5NH2; p–ClC6H4NH2; p–O2NC6H4NH2; p–H2NC6H4NH2
5. Từ benzene hoặc toluene, hãy lập sơ đồ điều chế các chất sau qua giai đoạn tạo muối diazoni: a/ m–florochlorobenzene b/ 1,3,5–tribromoobenzene c/ isophtalic acid d/ m–toluidine 172 lOMoARcPSD|208 990 13
Chương 13. CÁC HỢP CHẤT DỊ VÒNG THƠM NĂM, SÁU CẠNH CHỨA MỘT DỊ TỐ
Hợp chất dị vòng là những hợp chất mạch vòng mà trong vòng đó, ngoài carbon
ra còn có nguyên tử của các nguyên tố khác như O, S, N,… gọi là dị tố.
13.1. Hợp chất dị vòng năm cạnh chứa một dị tố
13.1.1 Cấu trúc phân tử và đặc tính thơm 13.1.1.1. Cấu trúc
Thực nghiệm về cấu trúc hợp chất dị vòng như sau:
- Độ dài các liên kết C-C trong dị vòng khoảng 1,35-1,44 Ao, đều dài hơn liên kết C=C
(1,34 Ao) và ngắn hơn liên kết C-C (1,54 Ao).
- Độ dài các liên kết C-Z (Z: dị tố) trong các dị vòng trên đều ngắn hơn độ dài các liên
kết C-Z tương ứng trong các hợp chất mạch hở. Liên kết Hợp chất Độ dài liên kết (Ao) C-N Pyrrole 1,42 Amine 1,47 C-O Furan 1,41 Ether 1,43 C-S Thiophene 1,74 Thioether 1,83
Từ các dữ kiện thực nghiệm trên cho thấy các dị vòng 5 cạnh pyrrole, furan,
thiophene phải có cấu trúc liên hợp.
Các hợp chất dị vòng furan, pyrrole, thiophene có cấu trúc vòng phẳng, các
nguyên tử C và dị tố đếu ở trạng thái lai hóa sp2 .
- Cấu trúc của pyrrole: mỗi nguyên tử C dùng 3 orbital lai hóa sp2 để tạo liên kết với
hai nguyên tử C bên cạnh (hoặc 1 nguyên tử C và một nguyên tử dị tố) và với nguyên
tử H. Dị tố N dùng 3 orbital lai hóa để tạo 2 liên kết với hai C bên cạnh và với
nguyên tử H. Như vậy mỗi nguyên tử C còn 1 orbital p chưa lai hóa chứa 1 electron và
trên dị tố N còn có hai electron tự do trên orbital p. Năm orbital này xen phủ với nhau
tạo nên orbital phân tử như hai đám mây electron nằm ở phía trên và phía dưới mặt
phẳng vòng. Orbital phân tử này là hệ liên hợp khép kín có 6 electron, thỏa mãn quy tắc Huckel (4n+2). 173 lOMoARcPSD|208 990 13
- Đối với furan và thiophene: ở nguyên tử O và S ngoài cặp electron tham gia hệ liên
hợp thơm còn có 1 cặp elctron nữa không tham gia vào hệ electron thơm mà nằm trên
orbital lai hóa sp2, nghĩa là nằm trên mặt phẳng của vòng.
- Công thức cộng hưởng của các dị vòng 5 cạnh: Z Z Z Z Z (I) (II) (III) (IV) (V)
(I) mang sự đóng góp cơ bản vì không có sự phân chia điện tích.
(III) và (V) quan trọng hơn (II) và (IV) vì có sự phân chia điện tích nhỏ hơn
(hai điện tích trái dấu ở gần nhau). 13.1.1.2. Tính thơm
- Độ thơm của dị vòng phụ thuộc vào cặp electron không chia xẻ mà dị tố đóng góp
vào hệ electron của vòng.
- Do nguyên tử oxygen có độ âm điện lớn hơn nitrogen nên cặp electron của oxygen
trong furan tham gia liên hợp thơm yếu hơn, khó khăn hơn so với cặp electron của
nitrogen trong pyrrole. Do đó furan có tính thơm nhỏ hơn pyrrole.
- Thiophene có tính thơm rõ rệt hơn furan và pyrrole do nguyên tử S có độ âm điện bé
nhất và cũng khác với O và N chỉ dùng các orbital 2s và 2p còn S đã sử dụng orbital ở
phân mức 3 để tham gia liên kết và tham gia liên hợp.
→ tính thơm: thiophene > pyrrole > furan
Điều này không chỉ được chứng minh bởi đặc tính hóa học mà còn được thể
hiện ở năng lượng ổn định (năng lượng thơm) của chúng: Hợp chất : Furan Pyrrole Thiophene
Năng lượng ổn định (kJ/mol) : 92,4 109,2 130,2
- Tính thơm của các dị vòng nhỏ hơn benzene do benzene có thể biểu diễn ở 2 dạng
cộng hưởng mà không có sự phân chia điện tích. 174 lOMoARcPSD|208 990 13
13.1.2. Phương pháp điều chế
13.1.2.1. Điều chế trong công nghiệp
13.1.2.2. Phương pháp tổng hợp chung
- Tổng hợp theo Paal- Knorr
- Tổng hợp pyrrole theo Hantzsch và tổng hợp furan theo Feist- Benary - Đi từ 1,3-diyne R1 C C C C R2 + R3NH CuCl 2 2 R R1 N R3 R1 C C C C R2 + R3NH H 2 2S R2 kieàm R1 S 175 lOMoARcPSD|208 990 13
13.1.3. Tính chất hóa học
13.1.3.1. Phản ứng thế electrophile
a. Khả năng phản ứng
Trong cả ba dị vòng đều có sự dư thừa electron π và có sự phân bố bất đối xứng
điện tích làm cho trên các nguyên tử carbon của dị vòng tích điện âm lớn hơn trên
nguyên tử carbon trong vòng benzene. Đó chính là nguyên nhân gây nên khả năng
phản ứng SE cao của các dị vòng.
Mật độ electron π (qr ) của các dị vòng và benzene như sau :
Ta thấy rằng mật độ electron π trong 3 dị vòng đều lớn hơn 1 nên khả năng
phản ứng phải lớn hơn benzene. b. Cơ chế
Phản ứng thế electrophile vào furan, pyrrole và thiophene tương tự phản ứng
thế electrophile vào vòng benzene. + E+ H E + H+ Z Z E Z phức σ c. Hướng thế
Phản ứng thế xảy ra ưu tiên ở vị trí số 2 (vị trí α).
Giải thích dựa vào độ bền của phức σ:
Phức σ ở vị trí 2 bền hơn do điện tích dương được giải tỏa rộng hơn.
d. Một số phản ứng thế electrophile
Các chất tham gia phản ứng với pyrrole và furan phải không có acid vô cơ
mạnh, vì trong điều kiện có acid chúng rất dễ bị polymer hóa thành nhựa. 176 lOMoARcPSD|208 990 13
Đối với furan cũng có những phản ứng tương tự trên: nitro hóa, sulfo hóa,
formyl hóa. Riêng phản ứng acyl hóa cần có mặt Lewis acid BF3 và phản ứng bromo
hóa trong điều kiện có CH3COOH ở 0oC và sản phẩm thế chỉ xảy ra ở vị trí α.
Đối với thiophene : tham gia phản ứng nitro hóa, sulfo hóa và bromo hóa.
+ Phản ứng nitro hóa : có thể dùng HNO3 như benzene.
+ Phản ứng sulfo hóa : tác nhân là H2SO4 95% ở nhiệt độ phòng.
+ Phản ứng halogen hóa : tác dụng với chlorine, bromine rất nhanh chóng và tạo thành
hỗn hợp monohalogen và polyhalogen.
+ Phản ứng ghép và formyl hóa: không xảy ra. 13.1.3.2. Phản ứng khử
- Nếu dùng tác nhân LiAlH4 thì không khử được.
- Nếu dùng Zn/H+ hoặc Na/C2H5OH thì khử được dị vòng 5 cạnh nhưng không hoàn toàn.
- Nếu dùng H2/xúc tác kim loại thì phản ứng khử hoàn toàn. 177 lOMoARcPSD|208 990 13
13.1.3.3. Phản ứng thể hiện tính acid - base a. Tính acid
Furan và thiophene thể hiện tính acid rất yếu, chỉ có thể tác dụng với những base cực mạnh.
Pyrrole có tính acid rõ rệt hơn nhưng vẫn yếu (Ka = 10-15). Vì vậy pyrrole có thể
phản ứng với KOH, NaH và hợp chất cơ magiesium: b.Tính base
Tính base của pyrrole và furan rất yếu. Trong nước chúng tạo ra các ion kém ổn
định so với dạng phân tử. Sự proton hóa đều xảy ra ở vị trí số 2 trong vòng :
Thiophene không có tính base 178 lOMoARcPSD|208 990 13
13.2. Hợp chất dị vòng thơm 6 cạnh chứa 1 dị tố- pyridine
Pyridine hay còn gọi azabenzene hay azin.
Pyridine được Anderson tìm ra vào năm 1849, nhưng mãi đến 20 năm sau mới
xác định được công thức cấu tạo. 4 3 hay hay 2 N N 1
(các số: 1, 2, 3, 4 hay , , là cách đánh vị trí các nguyên tử trong vòng)
Pyridine trong tự nhiên được tìm thấy ở dạng dẫn xuất của nó như: nicotine
trong lá cây thuốc lá, hạt cây thầu dầu; pyridoxine hay vitamine B6; nicotinamide hay
vitamine PP; là hợp phần trong cấu tạo của các hợp chất alkaloid;
Pyridine và dẫn xuất của nó rất quan trọng trong ngành công nghiệp hóa sinh và
là những hợp chất không thể thiếu được trong quá trình chuyển hóa của cơ thể người và động vật.
Pyridine là chất lỏng, không màu, có mùi đặc trưng và khó chịu, rất độc.
13.2.1. Đặc điểm cấu trúc của pyridine
Mô hình phân tử pyridine nhìn ngang và nhìn dọc
Tổng mật độ điện tích của pyridine
Pyridine có cấu trúc giống benzene, trong vòng phẳng gồm 5 nguyên tử carbon
và 1 nguyên tử nitrogen. Các nguyên tử này đều ở trang thái lai hóa sp2. 179 lOMoARcPSD|208 990 13
Các orbital lai hóa này tham gia xen phủ trục với nhau và với năm nguyên tử
hydrogen hình thành các liên kết , trong đó duy chỉ có nitrogen có một orbital lai hóa
chứa cặp electron chưa tham gia liên kết. Mỗi nguyên tử carbon còn 1 orbital p thuần
khiết xen phủ bên với nhau hình thành hệ liên hợp kép kín chứa 6 e giải tỏa trên toàn bộ phân tử.
Mô hình orbital liên kết có năng lượng thấp nhất của phân tử pyridine.
Độ dài các liên kết carbon – carbon và carbon – nitrogen trong phân tử pyridine
nằm trung gian giữa độ dài liên kết C-C trong alkane và liên kết C=C trong alkene; liên
kết C-N và liên kết C=N; với số liệu cụ thể sau: C=C (pyridine): 1,39Å C-C : 1,54Å C=C: 1,34Å
C=N (pyridine) : 1,34Å C-N : 1,47Å C=N: 1,28Å
Như vậy pyridine có cấu trúc vòng phẳng, có hệ liên hợp kép kín với 6 e nên
pyridine là hợp chất thơm. Tuy nhiên do trong vòng có 1 dị tố nitrogen nên pyridine có
những khác biệt về độ dài các liên kết, góc liên kết và về tính đối xứng so với benzene.
Các công thức cộng hưởng của pyridine: : N N N N N N
Khác với nhân benzene là vòng lục giác đều, thì pyridine do trong vòng có chứa
một dị tố nitrogen có độ âm điên lớn hơn. Do đó pyridine có vòng lục giác không đều
ở tất cả các liên kết C=C, C=N. benzene pyridine
Độ dài các liên kết và góc liên kết của benzene và pyridine
Mặt khác mật độ electron và điện tích riêng phần trên các nguyên tử trong vòng
cũng không hoàn toàn giống nhau. Mật độ electron phân bố trên các nguyên tử carbon
trong pyridine nhỏ hơn so với nhân benzene do nitrogen có độ âm điện hơn. Dẫn đến
khả năng phản ứng SE vào nhân thơm khó hơn so với benzene. Ngược lại khả năng
phản ứng SN vào nhân pyridine lại dễ xảy ra hơn so với nhân benzene. 180 lOMoARcPSD|208 990 13 0,96 +0,05 -0,004 1,01 0,89 +0,077 N N -0,805
Sự phân bố e trên C
Sự phân bố điện tích = 2,22D
Qua đó cho thấy pyridine là một chất thơm bền vững, có phản ứng thế
electrophile khó khăn hơn benzene và có xảy ra phản ứng thế nucleophile cũng rất khó
khăn. Ngoài ra, trong phân tử pyridine có nguyên tử nitrogen còn cặp e chưa tham gia
liên kết, không tham gia vào hệ liên hợp nhân thơm do đó có tính định chỗ lớn, nên có
tính chất của một base và có thể tham gia vào các phản ứng với các tác nhân electrophile khác. Nu - E+ N
13.2.2. Tính chất hóa học
13.2.2.1. Phản ứng ở nguyên tử nitrogen a. Tính base
Pyridine có thể tạo muối kết tinh bền vững với đa số các protonic acid. pyridine, pKb = 8,8
ion pyridine, pKa = 5,16
Do đó pyridine thường được dùng làm dung môi có tính base để trung hòa các
acid tạo ra trong quá trình phản ứng ảnh hưởng đến hiệu suất phản ứng, hoặc để ổn
định các anion kém bền như: BF - - 4 , BCl4 , ...
Cặp electron ở nguyên tử nitrogen lai hóa sp2 nên có tính base yếu, yếu hơn so
với NH3.(Kb(pyridine)=2,3.10-9; Kb(NH3) =4.10-5).
Tính base của nhân pyridine thay đổi khi gắn các nhóm thế khác nhau vào
vòng. Nói chung, khi gắn nhóm thế đẩy e thì tính base tăng, ngược lại tính base giảm. Thí dụ 181 lOMoARcPSD|208 990 13 < < N Cl N N CH3 pKa : 0,7 5,2 5,97
b. Tác dụng với các tác nhân electrophile khác
Pyridine có thể tác dụng với nhiều tác nhân electrophile cho muối pyridine do
có cặp en cuả nguyên tử nitrogen.
13.2.2.2. Phản ứng thế electrophile vào nhân thơm (SE)
Phản ứng thế electrophile trên các nguyên tử carbon của pyridine khó khăn hơn
so với benzene do những nguyên nhân đã phân tích ở trên còn có nguyên nhân khác là
các tác nhân electrophile tấn công vào nitrogen chuyển thành muối làm cho khả năng
phản ứng giảm đi rất nhiều 1012 1018 lần so với benzene. Do đó phản ứng xảy ra trong
điều kiện khắt nghiệt với hiệu suất thấp.
Phản ứng tổng quát theo sơ đồ sau:
Sự định hướng nhóm thế electrophile vào nhân pyridine được giải thích dựa vào
sự bền vững của phức thể hiện qua các công thức cộng hưởng sau: 182 lOMoARcPSD|208 990 13 N H N H N H E E E E E E H H H SOÁ + E+ 3 N N N N H E H E H E N N N
Từ các công thức cộng hưởng cho thấy các tác nhân electrophile chủ yếu tấn
công vào vị trí carbon số 3 hơn vị trí số 2 và 4 do điện tích dương nằm trên nguyên tử
nitrogen có độ âm điện lớn kém bền.
Một số phản ứng thí dụ:
Khả năng phản ứng thế electrophile như sau:
Pyridine có khả năng phản ứng thế electrophile vào nhân kém hơn benzene, do
đó khả năng phản ứng thế nucleophile vào nhân thơm sẽ mạnh hơn so với benzene. 183 lOMoARcPSD|208 990 13
13.2.2.3. Phản ứng thế nuleophile vào nhân thơm (SN)
Tác nhân nuleophile tấn công vào nhân thơm pyridine chủ yếu vào vị trí số 2
(đôi khi vào vị trí số 4). Điều này cũng được giải thích thông qua công thức cộng
hưởng của phức , tức dựa vào tính ổn định sản phẩm trung gian của trạng thái chuyển
tiếp, do điện tích âm nằm trên nguyên tử nitrogen bền hơn khi tấn công vào vị trí số 2 (hoặc 4). N H N H N H N u N u Nu Nu Nu Nu H H H + Nu- SOÁ 3 N N N N H Nu H Nu H Nu N N N
Sơ đồ phản ứng tổng quát:
Một số phản ứng thí dụ: 184 lOMoARcPSD|208 990 13
13.2.2.4. Phản ứng thế gốc vào nhân thơm pyridine (SR)
Tùy vào điều kiện và tác nhân mà các gốc tự do có thể tấn công vào các vị trí
khác nhau của vòng pyridine. C 6H5 (C 6H5COO)2,to N Br Br2, 500oC N - HBr N Ni-Raney, to N N CH3 CH3 (CH3COO)2, to + + N CH3 N N 6% 3% 3% 13.2.2.5. Phản ứng khác
a. Phản ứng oxi hóa b. Phản ứng khử 185 lOMoARcPSD|208 990 13
c. Phản ứng ở nhóm thế
Nitrogen của nhân pyridine hút electron nên các -hydrogen của các nhóm
alkyl ở vị trí số 2 và số 4 của vòng có tính acid như -hydrogen của aldehyde, ketone.
Vì vậy -hydrogen của các nhóm alkyl thế này có thể bị tách ra khi có mặt base
và tạo ra anion với vai trò là tác nhân nucleophile. 186 lOMoARcPSD|208 990 13 CÂU HỎI ÔN TẬP
1. Viết sản phẩm chính cho các phản ứng sau và gọi tên các sản phẩm tạo thành:
2. Viết công thức cấu tạo và gọi tên sản phẩm chính tạo thành khi thực hiện phản ứng
mononitro hóa các hợp chất sau. a/ N-tert-butylpyrrole d/ Pyridine-N-oxide
b/ 2-methoxy-5-methylthiophene e/ Isoquinoline c/ 3-nitrofuran f/ Benzofuran
3. Viết cơ chế cho phản ứng : COOC2H5 R1 R1 O R3 N R3 O R2NH2 + R2 R3 COOC2H5 COOC Cl 2H5 R1 N R2
4. a. Từ furfural cùng các chất vô cơ, hữu cơ (không quá 2C) cần thiết. Viết phương
trình phản ứng điều chế 2-methoxyfuran.
b. Từ propane-1,3-diol tổng hợp pyrrolidine.
5. Xác định cấu tạo của các chất (sản phẩm chính) có trong sơ đồ sau:
6. Sắp xếp các hợp chất sau theo chiều tăng dần tính acid và giải thích : 187 lOMoARcPSD|208 990 13 188 lOMoARcPSD|208 990 13
TÀI LIỆU THAM KHẢO
[1]. Hoàng Trọng Yêm (chủ biên), Trịnh Thanh Đoan, Nguyễn Đăng Quang, Dương
Văn Tuệ (1999), Hóa học hữu cơ - tập 1, Nxb Khoa học và Kỹ thuật.
[2]. Hoàng Trọng Yêm (chủ biên), Nguyễn Thị Thanh, Dương Văn Tuệ, Vũ Đào
Thắng, Hồ Công Xinh (1999), Hóa học hữu cơ - tập 2, Nxb Khoa học và Kỹ thuật.
[3]. Nguyễn Đình Bạch (2002), Những vấn đề Hóa học hữu cơ, Nxb Khoa học và Kỹ thuật.
[4]. Đặng Như Tại, Ngô Thị Thuận (1982), Tổng hợp hóa học hữu cơ, Tập 1, Nxb Khoa học và Kỹ thuật.
[5]. Trần Quốc Sơn (2003), Một số phản ứng của hợp chất hữu cơ, Nxb Giáo dục.
[6]. Nguyễn Hữu Đĩnh (chủ biên), Đỗ Đình Rãng (2003), Hóa học hữu cơ 1, Nxb Giáo dục.
[7]. Đỗ Đình Rãng (chủ biên), Đặng Đình Bạch, NguyễnThị Thanh Phong (2005),
Hóa học hữu cơ 2, Nxb Giáo dục.
[8]. L.G.Wada (2012), Organic Chemistry, Mc Graw Hill.
[9]. Francis A.Caray (2004), Organic Chemistry, Mc Graw Hill. 189 lOMoARcPSD|208 990 13 MỤC LỤC
Chương 1. ĐỒNG PHÂN TRONG HỢP CHẤT HỮU CƠ ......................................... 1
1.1. Đồng phân cấu tạo ............................................................................................. 1
1.2. Đồng phân lập thể .............................................................................................. 1
1.2.1. Đồng phân hình học..................................................................................... 1
1.2.2. Đồng phân quang học .................................................................................. 3
1.2.3. Đồng phân cấu dạng .................................................................................... 5
Chương 2. LIÊN KẾT HÓA HỌC CÁC LOẠI HIỆU ỨNG TRONG HÓA HỮU CƠ 7
2.1. Liên kết hóa học trong hợp chất hữu cơ ............................................................. 7
2.1.1. Liên kết cộng hóa trị .................................................................................... 7
2.1.2. Liên kết hydrogen ........................................................................................ 9
2.2. Các loại hiệu ứng trong phân tử hợp chất hữu cơ ............................................. 10
2.2.1. Hiệu ứng cảm ứng (I) ................................................................................ 10
2.2.2. Hiệu ứng liên hợp (C) ................................................................................ 11
2.2.3. Hiệu ứng siêu liên hợp (H) ........................................................................ 12
Chương 3. PHẢN ỨNG HỮU CƠ ............................................................................. 13
3.1. Phân loại phản ứng .......................................................................................... 13
3.1.1. Phân loại dựa vào chiều hướng phản ứng ................................................... 13
3.1.2. Phân loại dựa vào cách phân cắt liên kết .................................................... 13
3.2. Tác nhân phản ứng hữu cơ ............................................................................... 14
3.3. Cơ chế phản ứng hữu cơ .................................................................................. 14
3.3.1. Cơ chế phản ứng cộng ............................................................................... 14
3.3.2. Cơ chế phản ứng thế .................................................................................. 15
3.3.3. Cơ chế phản ứng tách (E) ......................................................................... 17
CÂU HỎI ÔN TẬP ................................................................................................... 18
Chương 4. HYDROCARBON NO ............................................................................ 20
4.1. Alkane ............................................................................................................. 20
4.1.1. Danh pháp, đồng phân, cấu trúc ................................................................. 20
4.1.2. Phương pháp điều chế................................................................................ 21
4.1.3. Tính chất vật lý .......................................................................................... 22
4.1.4. Tính chất hóa học ...................................................................................... 22
4.1.5. Ứng dụng .................................................................................................. 25
4.2. Cycloalkane ..................................................................................................... 26
4.2.1. Danh pháp, đồng phân, cấu trúc ................................................................. 26
4.2.2. Phương pháp điều chế................................................................................ 28 190
4.2.3. Tính chất vật lý .......................................................................................... 29 lOMoARcPSD|208 990 13
4.2.4. Tính chất hóa học ...................................................................................... 30
4.2.5. Ứng dụng .................................................................................................. 31
CÂU HỎI ÔN TẬP ................................................................................................... 32
Chương 5. HYĐROCARBON KHÔNG NO ........................................................... 33
5.1. Alkene ............................................................................................................. 33
5.1.1. Danh pháp, đồng phân, cấu trúc ................................................................. 33
5.1.2. Phương pháp điều chế................................................................................ 35
5.1.3. Tính chất vật lý .......................................................................................... 36
5.1.4. Tính chất hoá học ...................................................................................... 36
5.1.5. Ứng dụng .................................................................................................. 40
5.2. Alkyne ............................................................................................................. 41
5.2.1. Danh pháp, đồng phân, cấu trúc ................................................................. 41
5.2.2. Phương pháp điều chế................................................................................ 43
5.2.3. Tính chất vật lý .......................................................................................... 44
5.2.4. Tính chất hóa học ...................................................................................... 44
5.2.5. Ứng dụng .................................................................................................. 48
5.3. Alkadiene ........................................................................................................ 48
5.3.1. Danh pháp, đồng phân, cấu trúc ................................................................. 49
5.3.2. Phương pháp điều chế................................................................................ 50
5.3.3. Tính chất vật lý .......................................................................................... 51
5.3.4. Tính chất hóa học ...................................................................................... 51
5.3.5. Ứng dụng .................................................................................................. 53
CÂU HỎI ÔN TẬP ................................................................................................... 53
CHƯƠNG 6: HYĐROCARBON THƠM .................................................................. 57
6.1. Benzene và các chất đồng đẳng....................................................................... 57
6.1.1. Danh pháp, đồng phân, cấu trúc ................................................................. 57
6.1.2. Phương pháp điều chế................................................................................ 59
6.1.3. Tính chất vật lý .......................................................................................... 59
6.1.4. Tính chất hóa học ...................................................................................... 59
6.1.5. Ứng dụng .................................................................................................. 63
6.2. Các aren khác .................................................................................................. 64
6.2.1. Hydrocarbon thơm có mạch nhánh không no ............................................. 64
6.2.2. Hydrocarbon thơm chứa nhiều vòng benzene riêng rẽ................................ 65
6.2.3. Hydrocarbon thơm chứa nhiều vòng benzene ngưng tụ .............................. 66
6.2.3.2. Anthracene và phenanthrene ................................................................... 68
CÂU HỎI ÔN TẬP ................................................................................................... 69 191
Chương 7. NGUỒN HYDROCARBON TRONG THIÊN NHIÊN ............................ 72 lOMoARcPSD|208 990 13
7.1. Khí thiên nhiên và khí mỏ dầu ......................................................................... 72
7.1.1. Trạng thái thiên nhiên ................................................................................ 72
7.1.2. Thành phần ................................................................................................ 72
7.1.3. Ứng dụng của khí thiên nhiên .................................................................... 72
7.2. Dầu mỏ ............................................................................................................ 73
7.2.1. Tính chất vật lý, trạng thái thiên nhiên ....................................................... 73
7.2.2. Sơ lược về nguồn gốc dầu mỏ và quá trình hình thành, phát triển ngành dầu khí 73
7.2.3. Thành phần dầu mỏ ................................................................................... 75
7.2.4. Chưng cất dầu mỏ ...................................................................................... 77
7.2.5. Chế biến hóa học các phân đoạn dầu mỏ .................................................... 79
7.3. Than mỏ .......................................................................................................... 82
7.3.1. Phân loại than ............................................................................................ 82
7.3.2. Các sản phẩm từ nhựa than đá .................................................................. 82
7.3.3. Sự chuyển hóa than đá thành nhiên liệu lỏng ............................................. 83
CÂU HỎI ÔN TẬP ................................................................................................... 84
Chương 8. DẪN XUẤT HALOGEN. HỢP CHẤT CƠ KIM ..................................... 86
8.1. Dẫn xuất halogen ............................................................................................. 86
8.1.1. Danh pháp và đồng phân ........................................................................... 86
8.1.2. Phương pháp điều chế................................................................................ 88
8.1.3. Tính chất vật lý .......................................................................................... 92
8.1.4. Tính chất hóa học ...................................................................................... 92
8.2. Hợp chất cơ kim ............................................................................................. 96
8.2.1. Danh pháp và cấu trúc ............................................................................... 97
8.2.2. Phương pháp điều chế................................................................................ 98
8.2.3. Tính chất hóa học ...................................................................................... 99
CÂU HỎI ÔN TẬP ................................................................................................. 102
Chương 9. CÁC HỢP CHẤT ALCOHOL - PHENOL ............................................. 104
9.1. Monoalcohol.................................................................................................. 104
9.1.1. Danh pháp, đồng phân ............................................................................. 104
9.1.2. Phương pháp điều chế.............................................................................. 106
9.1.3. Tính chất vật lý ........................................................................................ 107
9.1.4. Tính chất hóa học .................................................................................... 108
9.2. Polyalcohol .................................................................................................... 111
9.2.1. Danh pháp ............................................................................................... 111
9.2.2. Phương pháp điều chế.............................................................................. 112 192
9.2.3. Tính chất vật lí......................................................................................... 112 lOMoARcPSD|208 990 13
9.2.4. Tính chất hóa học .................................................................................... 112
9.3. Phenol ........................................................................................................... 114
9.3.1. Danh pháp, cấu trúc ................................................................................. 114
9.3.2. Phương pháp điều chế.............................................................................. 116
9.3.3. Tính chất vật lý ........................................................................................ 117
9.3.4. Tính chất hóa học .................................................................................... 117
CÂU HỎI ÔN TẬP ................................................................................................. 122
Chương 10. CÁC HỢP CHẤT CARBONYL.......................................................... 124
10.1. Danh pháp, cấu trúc ..................................................................................... 124
10.1.1. Danh pháp ............................................................................................. 124
10.1.2. Cấu trúc nhóm carbonyl ......................................................................... 125
10.2. Phương pháp điều chế .................................................................................. 126
10.2.1. Từ alkene ............................................................................................... 126
10.2.2. Từ alkyne .............................................................................................. 126
10.2.3. Từ benzene ............................................................................................ 126
10.2.4. Từ alcohol ............................................................................................. 126
10.2.5. Từ carboxylic acid và muối của chúng .................................................. 127
10.2.6. Từ hợp chất cơ magiesium ..................................................................... 128
10.2.7. Điều chế aldehyde, ketone thơm ........................................................... 128
10.3. Tính chất vật lý ............................................................................................ 129
10.4. Tính chất hóa học ........................................................................................ 129
10.4.1. Mối liên hệ giữa cấu trúc và tính chất hóa học ....................................... 129
10.4.2. Phản ứng cộng nucleophile .................................................................... 129
10.4.3. Phản ứng với dẫn xuất của ammonia ...................................................... 132
10.4.4. Phản ứng với hợp chất có nhóm methylene linh động ............................ 133
10.4.5. Phản ứng thế ở Hα ................................................................................. 135
10.4.6. Phản ứng khử......................................................................................... 135
10.4.7. Phản ứng oxi hóa ................................................................................... 136
10.4.8. Phản ứng định tính aldehyde .................................................................. 137
10.4.9. Phản ứng trùng hợp .............................................................................. 137
CÂU HỎI ÔN TẬP ................................................................................................. 138
11.1. Carboxylic acid ............................................................................................ 141
11.1.1. Danh pháp ............................................................................................. 141
11.1.2. Cấu trúc phân tử của hợp chất carboxyl ................................................. 143
11.1.3. Phương pháp điều chế ............................................................................ 143
11.1.4. Tính chất vật lý ...................................................................................... 144 193
11.1.5. Tính chất hóa học .................................................................................. 145 lOMoARcPSD|208 990 13
11.1.6. Một số ứng dụng của carboxylic acid ..................................................... 149
11.2. Dẫn xuất của carboxylic acid ....................................................................... 150
11.2.1. Khái niệm, phân loại và danh pháp ....................................................... 150
11.2.2. Tính chất hóa học ................................................................................. 152
CÂU HỎI VÀ BÀI TẬP .......................................................................................... 155
Chương 12. CÁC HỢP CHẤT AMINE VÀ MUỐI DIAZONIUM .......................... 157
12.1. Amine ......................................................................................................... 157
12.1.1. Danh pháp ............................................................................................. 157
12.1.2. Cấu trúc ................................................................................................. 158
12.1.3. Phương pháp điều chế ............................................................................ 158
12.1.4. Tính chất vật lý ...................................................................................... 160
12.1.5. Tính chất hóa học .................................................................................. 161
12.2. Muối diazonium ........................................................................................... 166
12.2.1. Điều chế ................................................................................................ 167
12.2.2. Tính chất hóa học .................................................................................. 167
CÂU HỎI VÀ BÀI TẬP .......................................................................................... 171
Chương 13. CÁC HỢP CHẤT DỊ VÒNG THƠM NĂM, SÁU CẠNH CHỨA MỘT
DỊ TỐ ...................................................................................................................... 173
13.1. Hợp chất dị vòng năm cạnh chứa một dị tố ................................................... 173
13.1.1 Cấu trúc phân tử và đặc tính thơm .......................................................... 173
13.1.2. Phương pháp điều chế ............................................................................ 175
13.1.3. Tính chất hóa học .................................................................................. 176
13.2. Hợp chất dị vòng thơm 6 cạnh chứa 1 dị tố- pyridine ................................... 179
13.2.1. Đặc điểm cấu trúc của pyridine ............................................................... 179
13.2.2. Tính chất hóa học .................................................................................. 181
CÂU HỎI ÔN TẬP ................................................................................................. 187
TÀI LIỆU THAM KHẢO ....................................................................................... 189 194
Document Outline
- Chương 1. ĐỒNG PHÂN TRONG HỢP CHẤT HỮU CƠ
- 1.1. Đồng phân cấu tạo
- 1.2. Đồng phân lập thể
- 1.2.1. Đồng phân hình học
- 1.2.2. Đồng phân quang học
- 1.2.3. Đồng phân cấu dạng
- Chương 2. LIÊN KẾT HÓA HỌC CÁC LOẠI HIỆU ỨNG TRONG HÓA HỮU CƠ
- 2.1. Liên kết hóa học trong hợp chất hữu cơ
- 2.1.1. Liên kết cộng hóa trị
- 2.1.2. Liên kết hydrogen
- 2.2. Các loại hiệu ứng trong phân tử hợp chất hữu cơ
- 2.2.1. Hiệu ứng cảm ứng (I)
- 2.2.2. Hiệu ứng liên hợp (C)
- H
- 2.2.3. Hiệu ứng siêu liên hợp (H)
- 2.1. Liên kết hóa học trong hợp chất hữu cơ
- Chương 3. PHẢN ỨNG HỮU CƠ
- 3.1. Phân loại phản ứng
- 3.1.1. Phân loại dựa vào chiều hướng phản ứng
- 3.1.2. Phân loại dựa vào cách phân cắt liên kết
- 3.2. Tác nhân phản ứng hữu cơ
- 3.3. Cơ chế phản ứng hữu cơ
- 3.3.1. Cơ chế phản ứng cộng
- 3.3.2. Cơ chế phản ứng thế
- H2O, NH3, RNH2, ...
- 3.3.3. Cơ chế phản ứng tách (E)
- 3.1. Phân loại phản ứng
- CÂU HỎI ÔN TẬP
- .
- . (1)
- Chương 4. HYDROCARBON NO
- 4.1. Alkane
- 4.1.1. Danh pháp, đồng phân, cấu trúc
- 4.1.2. Phương pháp điều chế
- 4.1.3. Tính chất vật lý
- 4.1.4. Tính chất hóa học
- 4.1.5. Ứng dụng
- 4.2. Cycloalkane
- 4.2.1. Danh pháp, đồng phân, cấu trúc
- 4.2.2. Phương pháp điều chế
- 4.2.3. Tính chất vật lý
- 4.2.4. Tính chất hóa học
- 4.2.5. Ứng dụng
- 4.1. Alkane
- CÂU HỎI ÔN TẬP (1)
- Chương 5. HYĐROCARBON KHÔNG NO
- 5.1. Alkene
- 5.1.1. Danh pháp, đồng phân, cấu trúc
- Hình 5.1. Các obital của nguyên tử C và H hình thành phân tử C2H4
- 5.1. Alkene
- H
- H (1)
- H (2)
- 5.1.2. Phương pháp điều chế
- 5.1.3. Tính chất vật lý
- 5.1.4. Tính chất hoá học
- 5.1.5. Ứng dụng
- 5.2. Alkyne
- 5.2.1. Danh pháp, đồng phân, cấu trúc
- Hình 5.11. Sự phân bố mật độ e - trong phân tử C2H2
- Hình 5.12. Liên kết và 2 liên kết trong phân tử C2H2
- 5.2.2. Phương pháp điều chế
- 5.2.3. Tính chất vật lý
- 5.2.4. Tính chất hóa học
- Hợp chất Ka
- 5.2.4.7. Phản ứng cộng nucleophile
- 5.2.5. Ứng dụng
- 5.3. Alkadiene
- 5.3.1. Danh pháp, đồng phân, cấu trúc
- Hình 5.14. Sự xen phủ của các obital p tạo thành obital π chung cho toàn phân tử buta-1,3-diene
- 5.3.2. Phương pháp điều chế
- 5.3.4. Tính chất hóa học
- 5.3.5. Ứng dụng
- CÂU HỎI ÔN TẬP
- O
- O (1)
- CHƯƠNG 6: HYĐROCARBON THƠM
- 6.1. Benzene và các chất đồng đẳng
- 6.1.1. Danh pháp, đồng phân, cấu trúc
- Hình 6.1. Sự hình thành các liên kết
- Hình 6.2. Sự hình thành các liên kết
- 6.1.2. Phương pháp điều chế
- 6.1.3. Tính chất vật lý
- 6.1.4. Tính chất hóa học
- Bảng 6.1. Ảnh hưởng của nhóm thế đến hướng và khả năng thế electrophile
- 6.1.5. Ứng dụng
- 6.2. Các aren khác
- 6.2.1. Hydrocarbon thơm có mạch nhánh không no
- 6.2.2. Hydrocarbon thơm chứa nhiều vòng benzene riêng rẽ
- 6.2.3. Hydrocarbon thơm chứa nhiều vòng benzene ngưng tụ
- 6.1. Benzene và các chất đồng đẳng
- CÂU HỎI ÔN TẬP (1)
- Chương 7. NGUỒN HYDROCARBON TRONG THIÊN NHIÊN
- 7.1. Khí thiên nhiên và khí mỏ dầu
- 7.1.1. Trạng thái thiên nhiên
- 7.1.2. Thành phần
- 7.1.3. Ứng dụng của khí thiên nhiên
- 7.2. Dầu mỏ
- 7.2.1. Tính chất vật lý, trạng thái thiên nhiên
- 7.2.2. Sơ lược về nguồn gốc dầu mỏ và quá trình hình thành, phát triển ngành dầu khí
- 7.2.3. Thành phần dầu mỏ
- 7.2.4. Chưng cất dầu mỏ
- Bảng 7.1. Các sản phẩm dầu mỏ khi chưng cất
- 7.2.5. Chế biến hóa học các phân đoạn dầu mỏ
- 7.3. Than mỏ
- 7.3.1. Phân loại than
- 7.3.2. Các sản phẩm từ nhựa than đá
- 7.3.3. Sự chuyển hóa than đá thành nhiên liệu lỏng
- 7.1. Khí thiên nhiên và khí mỏ dầu
- CÂU HỎI ÔN TẬP (2)
- Chương 8. DẪN XUẤT HALOGEN. HỢP CHẤT CƠ KIM
- 8.1. Dẫn xuất halogen
- 8.1.1. Danh pháp và đồng phân
- 8.1.2. Phương pháp điều chế
- 8.1.3. Tính chất vật lý
- 8.1.4. Tính chất hóa học
- 8.2. Hợp chất cơ kim
- 8.2.1. Danh pháp và cấu trúc
- 8.2.2. Phương pháp điều chế
- 8.2.3. Tính chất hóa học
- 8.1. Dẫn xuất halogen
- CÂU HỎI ÔN TẬP (3)
- Chương 9. CÁC HỢP CHẤT ALCOHOL – PHENOL
- 9.1. Monoalcohol
- 9.1.1. Danh pháp, đồng phân
- 9.1.2. Phương pháp điều chế
- 9.1.3. Tính chất vật lý
- 9.1.4. Tính chất hóa học
- 9.2. Polyalcohol
- 9.2.1. Danh pháp
- 9.2.2. Phương pháp điều chế
- 9.2.3. Tính chất vật lí
- 9.2.4. Tính chất hóa học
- 9.3. Phenol
- 9.3.1. Danh pháp, cấu trúc
- 9.3.2. Phương pháp điều chế
- 9.3.3. Tính chất vật lý
- 9.3.4. Tính chất hóa học
- 9.1. Monoalcohol
- CÂU HỎI ÔN TẬP (4)
- Chương 10. CÁC HỢP CHẤT CARBONYL
- 10.1. Danh pháp, cấu trúc
- 10.1.1. Danh pháp
- 10.1.2. Cấu trúc nhóm carbonyl
- 10.2. Phương pháp điều chế
- 10.2.1. Từ alkene
- 10.2.2. Từ alkyne
- 10.2.3. Từ benzene
- 10.2.4. Từ alcohol
- 10.2.5. Từ carboxylic acid và muối của chúng
- 83%
- 10.2.6. Từ hợp chất cơ magiesium
- 10.2.7. Điều chế aldehyde, ketone thơm
- 10.3. Tính chất vật lý
- 10.4. Tính chất hóa học
- 10.4.1. Mối liên hệ giữa cấu trúc và tính chất hóa học
- 10.4.2. Phản ứng cộng nucleophile
- 10.4.3. Phản ứng với dẫn xuất của ammonia
- 10.4.4. Phản ứng với hợp chất có nhóm methylene linh động
- 10.4.5. Phản ứng thế ở Hα
- 10.4.6. Phản ứng khử
- 10.4.7. Phản ứng oxi hóa
- *Ketone:
- 10.4.8. Phản ứng định tính aldehyde
- 10.4.9. Phản ứng trùng hợp
- 10.1. Danh pháp, cấu trúc
- CÂU HỎI ÔN TẬP (5)
- Chương 11. CÁC HỢP CHẤT CARBOXYLIC ACID VÀ DẪN XUẤT
- 11.1. Carboxylic acid
- 11.1.1. Danh pháp
- 11.1.2. Cấu trúc phân tử của hợp chất carboxyl
- 11.1.3. Phương pháp điều chế
- a. Thủy phân các dẫn xuất gem-trihalogen
- 11.1.4. Tính chất vật lý
- 11.1.5. Tính chất hóa học
- a. Phản ứng thế ở gốc hydrocarbon no
- 11.1.6. Một số ứng dụng của carboxylic acid
- 11.2. Dẫn xuất của carboxylic acid
- 11.2.1. Khái niệm, phân loại và danh pháp
- 11.2.2. Tính chất hóa học
- a. Phản ứng SN2(CO)
- 11.1. Carboxylic acid
- CÂU HỎI VÀ BÀI TẬP
- Chương 12. CÁC HỢP CHẤT AMINE VÀ MUỐI DIAZONIUM
- 12.1. Amine
- 12.1.1. Danh pháp
- 12.1.2. Cấu trúc
- Hình 12.1. Mô hình phân tử CH3NH2
- 12.1.3. Phương pháp điều chế
- 12.1.4. Tính chất vật lý
- 12.1.5. Tính chất hóa học
- 12.2. Muối diazonium
- 12.2.1. Điều chế
- 12.2.2. Tính chất hóa học
- 12.1. Amine
- CÂU HỎI VÀ BÀI TẬP (1)
- Chương 13. CÁC HỢP CHẤT DỊ VÒNG THƠM NĂM, SÁU CẠNH CHỨA MỘT DỊ TỐ
- 13.1. Hợp chất dị vòng năm cạnh chứa một dị tố
- 13.1.1 Cấu trúc phân tử và đặc tính thơm
- 13.1.2. Phương pháp điều chế
- 13.1.3. Tính chất hóa học
- 13.2. Hợp chất dị vòng thơm 6 cạnh chứa 1 dị tố- pyridine
- hay
- hay (1)
- 13.2.1. Đặc điểm cấu trúc của pyridine
- Tổng mật độ điện tích của pyridine
- 13.2.2. Tính chất hóa học
- 13.1. Hợp chất dị vòng năm cạnh chứa một dị tố
- CÂU HỎI ÔN TẬP (6)
- TÀI LIỆU THAM KHẢO
- MỤC LỤC




