














Preview text:
BÀI 1: TÍNH CHẤT VÀ CẤU TẠO BÊN TRONG CỦA VẬT LIỆU
1.1 TÍNH CHẤT CỦA VẬT LIỆU
1.1.1 Khái niệm chung
Tính chất của vật liệu bao gồm cơ, lý, hóa tính, tính công nghệ và tính ứng dụng
a. Tính chất vật lý bao gồm
+ Tính chất điện: là khả năng dẫn điện và cách điện. Có thể phân làm 3 loại: loại dẫn
điện (nhôm, đồng..) - bán dẫn - cách điện (gốm, sứ..)
+ Tính chất nhiệt: là khả năng ở nhiệt độ cao mà các tính chất (lý, hóa, cơ ) ít thay
đổi , và khả năng truyền nhiệt. Tính chất này có một ý nghĩa quan trọng trong việc chọn
vật liệu làm việc ở nhiệt độ cao cần thoát nhiệt tốt, cần giữ được độ bền, độ cứng tránh biến dạng và hư hỏng.
+ Tính chất từ: là biểu hiện hút hoặc đẩy vật khác
+ Tính chất quang: là khả năng vật liệu phát quang (làm đèn huỳnh quang) hoặc dẫn
quang (trong pin mặt trời.)
b. Tính chất hóa học
Là khả năng chống ăn mòn hóa học, và điện hóa của vật liệu
a. Ăn mòn hóa học:Ăn mòn trong môi trường khí có các chất xâm thực O , S ,Cl ... 2 2 2
Cơ chế ăn mòn hóa học
Ví dụ Fe ở trong môi trường H SO . Nó sẽ xảy ra tác dụng hóa học tạo thành Fe SO 2 4 3 4
và H O Sun phát sắt sẽ liên kết không bền với Fe nên sẽ bị tách rời ra khỏi sắt 2
b. Ăn mòn điện hóa: Ăn mòn trong nước ( nước mưa, nước biển..) trong đất, khí
quyển ẩm, trong a xít, bazơ
Cơ chế ăn mòn điện hóa
Kim loại có thế điện cực. Ví dụ Mg Al Zn Cr Fe Ni Sn Pb H Cu Ag -0,37 -1,67 -0,76 -0,74 -0,49 -0,25 -0,14 -0,13 0 +0,34 +0.80
Môi trường a xít, ba zơ cũng có thế điện cực
- Môi trường a xít không hòa tan ô xy: E 059 , 0 pH mt
- Môi trường a xít hòa tan ô xy: E , 1 V 23 mt
- Môi trường kiềm, nước ngọt không hòa tan ô xy: E , 1 23 059 , 0 pH mt
c. Tính công nghệ Được thể hiện qua:
+ Tính cắt gọt: là khả năng cắt gọt kim loại dễ hay khó ( tốc độ cắt, chiều sâu cắt, lực
cắt, khả năng gãy phoi..). Nó phụ thuộc vào độ cứng của vật liệu, vật liệu cứng quá khó
cắt và chóng mòn dao, nếu dẻo quá dễ dính phoi
+ Tính hàn: là khả năng tạo liên kết cục bộ khi nung nóng đến trạng thái chảy, dẻo.
Tính hàn tốt là có thể hàn bằng nhiều phương pháp hàn khác nhau, có năng suất cao và
chất lượng mối hàn tốt 1
+ Tính rèn: là khả năng biến dạng của vật liệu khi có lực tác dụng, nó phụ thuộc vào
độ dẻo, độ dai của vật liệu
+ Tính đúc: là khả năng nóng chảy của vật liệu, điền đầy khuôn, tính co ngót của vật liệu
+ Tính nhiệt luyện: là khả năng thay đổi cơ tính của vật liệu qua nhiệt luyện
d. Tính chất cơ học
Là khả năng vật liệu chống lại các tác dụng cơ học khi có tác dụng của các lực bên
ngoài, nó bao gồm: độ bền, độ cứng, độ bền mỏi, độ dẻo, độ dai va đập…
1.1.2 Các tính chất cơ học của vật liệu
Đây là một tiêu chuẩn quan trọng, nó cho biết khả năng gia công và làm việc của chi
tiết bằng kim loại, đánh gía tuổi thọ của chi tiết, từ đó ta chọn vật liệu cho thích hợp a. Độ bền
+ Độ bền là khả năng vật liệu chịu được tải trọng cơ học mà không bị phá hủy
Khi tác dụng lực , chi tiết bị biến dạng. Ở một mức nào đó, liên kết giữa các mặt
phẳng nguyên tử bị phá vỡ, vật liệu bị tách ra thành hai hay nhiều phần đó là sự phá hủy.
Phá hủy thường xảy ra ở nơi tập trung ứng suất và bao giờ cũng gắn liền với quá trình
hình thành và phát triển vết nứt
Phá hủy là dạng hỏng không thể khắc phục được, nó luôn gây tổn thất về kinh tế và
nguy hiểm cho con người. Vì vậy khi thiết kế và chế tạo chỉ tiêu bền phải đặt lên hàng đầu
+ Để xác định độ bền người ta lấy mẫu thử cho kéo, nén và căn cứ vào giới hạn chịu
lực của mẫu thử bị hỏng để xác định P - Giới hạn đàn hồi: dh dh S0 P - Giới hạn chảy: ch ch S0 P - Giới hạn bền: b b S0 trong đó :
- P , P , P : là lực kéo lớn nhất ứng với giai đoạn đàn hồi, chảy, phá hủy của vật liệu dh ch b
- , , : là giới hạn ứng với giai đoạn đàn hồi, chảy, phá hủy của vật liệu dh ch b
- S : là diện tích của tiết diện mẫu ban đầu 0
+ Ý nghĩa: Nhờ chỉ tiêu độ bền ta có thể đánh giá
- Khả năng chịu tải trọng tĩnh của vật liệu: nếu 2 chi tiết cùng kich thước nhưng làm
bằng vật liệu khác nhau sẽ có độ bền khác nhau, tuổi thọ khác nhau.
- Vật liệu có độ bền cao thì chịu được tải trọng cao hơn, hoặc kích thước sẽ nhỏ gọn hơn.
+ Để tăng độ bền của chi tiết ta phải chọn vật liệu có độ bền cao như thép hợp kim,
ngoài ra ta có thể dùng các phương pháp nhiệt luyện hoặc tô và thấm 2 b. Độ dẻo:
+ Độ dẻo là khả năng vật liệu thay đổi hình dáng, kích thước mà không bị phá hủy
khi chịu lực bên ngoài, đồng thời vẫn giữ được sự biến dạng đó khi thôi lực tác dụng bên ngoài
+ Được thể hiện qua 2 chỉ tiêu là:
- Độ dãn dài tương đối khi kéo đứt: là khả năng vật liệu thay đổi chiều dài khi bị kéo đứt. Ký hiệu l l 1 0 l0
- Độ co thắt tiết diện tương đối là khả năng vật liệu thay đổi tiết diện khi bị kéo đứt. Ký hiệu S S 0 1 S0
Trong đó: l , S là chiều dài, diện tích mặt cắt ngang của mẫu ban đầu 0 0
l , S là chiều dài, diện tích mặt cắt nganu khi kéo đứt của mẫu 1 1 + Ý nghĩa :
- Đánh giá khả năng biến dẻo khi chịu gia công áp lực. Vật liệu có độ dẻo cao khả
năng tạo hình bằng các phương pháp gia công áp lực như cán, kéo, rèn, dập càng tốt.
Được dùng cho làm dây điện, ống đồng, hoặc các tấm mỏng
- Tuy nhiên vật liệu càng dẻo thì độ bền, độ cứng
thấp nên không dùng cho các chi tiết chịu lực, và độ dẻo
lớn sẽ khó gia công cắt gọt vì khó tách phoi
c. Độ dai va đập
Độ dai va đập là khả năng vật liệu chịu được tải
trọng va đập mà không bị phá hủy
Để xác định độ dai va đập người ta cho tiến hành
trên máy thử va đập. Nó được đánh giá bằng chỉ tiêu độ
dai va đập - là công để phá hủy cho một đơn vị diện tích cắt ngang mẫu A a k k 2 J / cm S
Để các chi tiết chịu tải va đập không bị phá hủy (vỡ, mẻ, sứt, và mài mòn) cần chọn
vật liệu có độ dai va đập lớn như thép Cr, thép Mn, tránh dùng các loại dòn như gang
Các biện pháp nâng cao độ dai :
a. Làm cho hạt nhỏ mịn, hạt tròn, hạt đa cạnh có độ dai tốt hơn hạt hình tấm hoặc hình kim
b. Hóa bền bề mặt bằng cách tôi bề mặt, hóa nhiệt luyện vừa tăng độ cứng, độ bền
đồng thời tăng độ dai
d. Độ bền mỏi
Là khả năng chống lại sự phá hủy dưới tác dụng của tải trọng thay đổi theo chu kỳ
Khi chi tiết làm việc nó không bị hư hỏng ngay mà nó bị tróc bề mặt, rạn chân chim.,
sau đó vết nứt sẽ ăn sâu dàn và dẫn đến gãy, vỡ. Để bảo đảm độ bền mỏi cần tính toán
chọn vật liệu thích hợp và xác định kích thước để chi tiết làm việc có tuổi thọ theo ý muốn:3 năm, 10 năm.. 3
Để tăng tuổi thọ người ta làm cứng, nhẵn bề mặt, lăn bi, tôi, hóa nhiệt luyện bề mặt,
tránh những tiết diện thay đổi đột ngột, không có rãnh, lỗ, … e. Độ cứng
Là khả năng chống lại biến dạng dẻo cục bộ khi có một vật khác cứng hơn nó tác
dụng lên bề mặt của nó
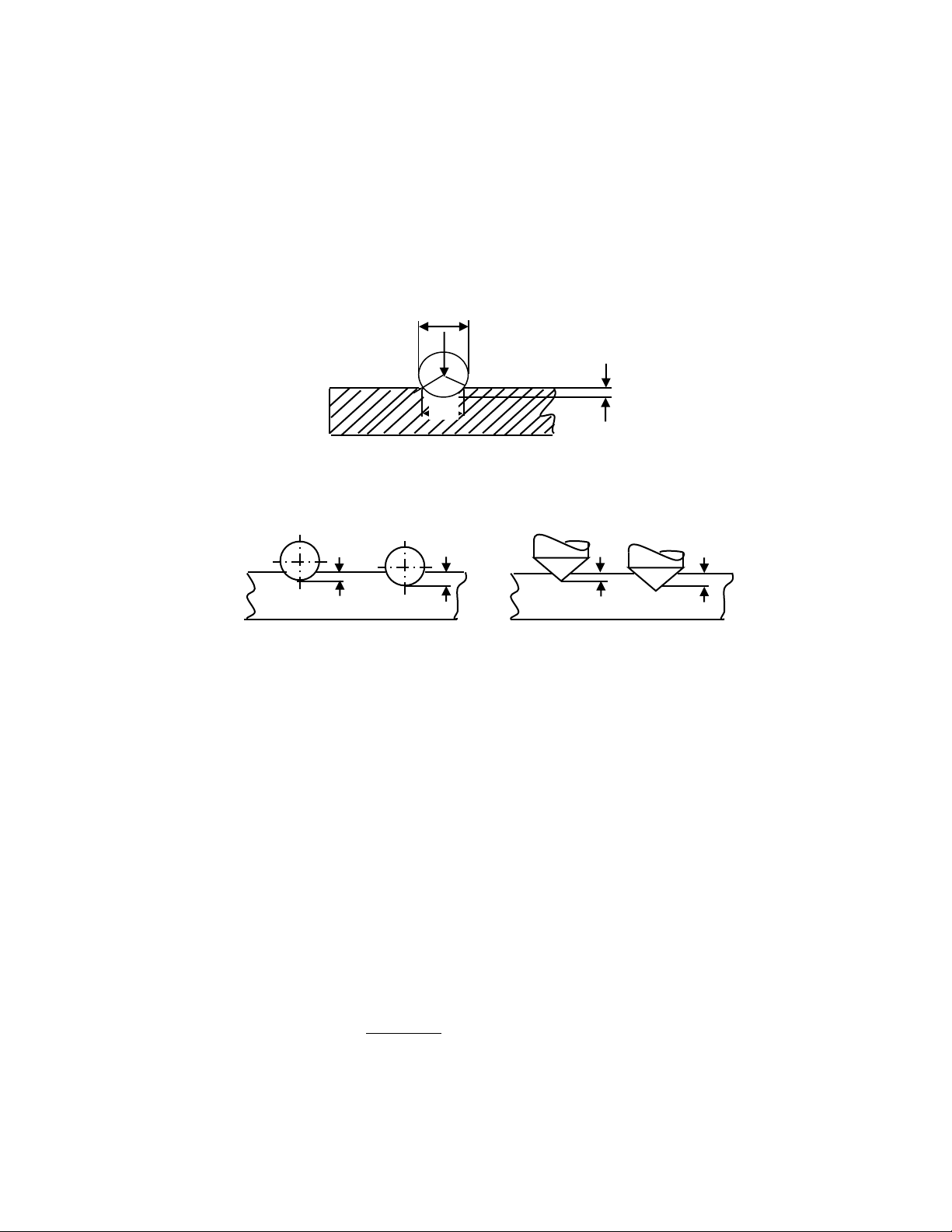
Muốn xác định độ cứng người ta tiến hành trên máy đo. Cho mũi thử bằng viên bi
thép hoặc kim cương tác dụng vào bề mặt kim loại dưới tác dụng một lực nhất định sau
đó đo đường kính vết lõm hay độ lún sâu của viên bi. Nếu độ lún càng sâu thì độ cứng càng kém . D P h d Đ ộ cứ ng Brinen h h h h 1 2 1 2 a b . . )
Với vật liệu có độ cứng trung bình (250-450HB) ngư )
ời ta dùng máy đo Brinen có mũi
đo là viên bi bằng thép nên gọi là độ cứng Brinen (HB ). Còn vật liệu có độ cứng cao
(50-64HRC) hoặc rất cao (64-84HRC) người ta dùng máy đo Rocvel có mũi đo đầu nhọn
bằng kim cương nên gọi là độ cứng Rocvel (HRC ).
Để nâng cao khả năng chống mài mòn (xi lanh ), khả năng cắt gọt (dao tiện), khuôn
dập nguội, và khả năng mài bóng người ta chọn vật liệu có độ cứng cao. Tuy nhiên độ
cứng cao sẽ khó gia công cắt gọt, và dễ bị phá hủy dòn (dễ nứt, gãy, vỡ…) Để khắc phục
điều này trước khi gia công người ta tiến hành ủ để vật liệu mềm đi dễ cắt gọt, sau đó tôi
cứng, ram bề mặt khi đó chi tiết sẽ có độ bền, độ dai bên trong lớn và độ cứng bề mặt cao
f. Quan hệ giữa các đặc trưng cơ tính trong vật liệu
+ Thông thường độ cứng của vật liệu tăng thì độ bền tăng
a. đối với thép cán 34 , 0 HB b
b. đối với thép đúc 3 , 0 , 0 4HB b 60
c. đối với gang HB b 6
+ Độ cứng tăng thì độ dẻo, độ dai va đập giảm, vật liệu dễ dòn nứt, gãy
+ Để chi tiết làm việc tốt thường đòi hỏi cơ tính tổng hợp tốt có nghĩa là độ bền, độ
cứng, độ dẻo và độ dai tốt 4
+ Tính đàn hồi của vật liệu là nó phải có độ cứng và độ bền cao, độ dẻo, độ dai va đập không quá thấp.
1.2 CẤU TRÚC CỦA VẬT LIỆU
1.2.1 Cấu tạo và liên kết nguyên tử
a. Khái niệm cơ bản về cấu tạo nguyên tử
Nguyên tử là một hệ thống bao gồm hạt nhâ n và các điện tử (electron ) mang điện
âm chuyển động xung quanh. Hạt nhân nguyên tử cấu tạo từ những proton và nơ tron.
Hạt nơtron khô ng mang đ iệ n, còn proton mang điện dương, có điện tích bằng điện tích
của điện tử. Ở trạng thái bình thường nguyên tử trung hòa điện vì số lượng proton bằng
số điện tử. Só đó được đặc trưng bằng số thứ tự nguyên tử (Z ) trong bảng tuần hoàn
Menđêlêep. Vì khối lượng của proton và notron lớn hơn rất nhiều so với điện tử
(khoảng 1830 lần) cho nên khối lượng nguyên tử được xác định bằng khối lượng hạt nhân của nó
Các điện tử được phân bố theo các lớp K,L,M,N Mỗi lớp lại có các phân lớp (s, p, d...),
Ví dụ : Cu có Z = 29 phân bố điện tử như sau: 1s22s22p6 3s23p63d104s1 qua đó
biế t được số electron ngoài cùng (ở đây là 1, hóa trị 1).
Các kim loại chuyển tiếp: Fe có Z = 26: 2 2 6 2 6 10 1
1s 2s 2 p 3s 3p 3d 4s
b. Các dạng liên kết nguyên tử trong chất rắn
Cấu trúc và tính chất của tinh thể phụ thuộc vào lực giữ cho cho các ion, nguyên tử
hay phân tử tồn tại ở các vị trí xác định trong mạng lưới tinh thể
Theo đặc điểm liên kết có thể phân thành: phân tử, đồng hóa trị, kim loại hoặc ion.
Tuy nhiên trong thực tế vật liệu thường có nhiều liên kết cùng tác động Tinh thể Ar CH Kim cương SiC LiF NaCl Fe Na 4 Năng lượng 7,5 10 750 1180 1000 750 390 110 kJ/mol Kiểu liên kết Phân tử Đồng hóa trị ion Kim loại
a. Liên kết phân tử (liên kết Van dec Van)
Liên kết này sinh ra do tương tác những điện tử ngoài cùng của các nguyên tử, trên
những khoảng cách lớn khi các mây điện tử chưa tiếp xúc với nhau. Nó xuất hiện ở bất cứ
phân tử nào (ion, nguyên tử, phân tử )
b. Liên kết đồng hóa trị
Là liên kết của hai (hoặc nhiều) nguyên tử góp chung nhau một số electron hóa trị để
có đủ tám electron ở lớp ngoài cùng. Có thể lấy ba ví dụ như sau (hình 1.1). Clo có Z = 17 ( 2 1s - 2 6 2s 2 p - 2 5
3s 3 p ), có 7e ở lớp ngoài cùng, 2 nguyên tử Cl mỗi
nguyên tử góp chung 1 electron để lớp ngoài cùng 8e Giecmani Ge có z = 32( 2 1s - 2 6 2s 2 p - 2 6 10
3s 3 p 3d - 2 2
4s 4 p ) có 4e lớp ngoài cùng ( 2 2
4s 4 p ) góp chung (hình 1.1b). 5
Liên kết đồng hóa trị có đặc điểm:
- Liên kết có tính địn hướng, nghĩa là xác xuất tồn tại các điện tử tham gia liên kết lớn
nhất theo phương nối tâm các nguyên tử
- Cường độ liên kết phụ thuộc rất mạnh vào đặc tính liên kết giữa các điện tử hóa trị
với hạt nhân. Ví dụ các bon ở dạng thù hình kim cương có liên kết đồng hóa trị rất
mạnh vì 4 điện tử hóa trị ( trong tổng số 6 điện tử ) liên kết hầu như trực tiếp với hạt
nhân, trong khi đó Sn thể hiện tính liên kết rất yếu vì 4 điện tử hóa trị (trong tổng số
50 điện tử) nằm ở xa hạt nhân, do đó lực liên kết với hạt nhân rất yếu. Vì vậy kim
cương có nhiệt độ nóng chảy trên 0
3550 C , còn Sn nóng chảy ở 0 270 C
- Liên kết đồng hóa trị có thể xảy ra giữa các nguyên tử cùng loại (của một nguyên tố
hóa học trong các nhóm từ IVA đến VIIA). Đó là liên kết đồng hóa trị đồng cực, ví
dụ trong phân tử Cl hoặc các tinh thể kim cương, silic liên kết đồng hóa trị giữa các 2
nguyên tử khác loại (các nguyên tố hóa học nhóm IIIA với VA hoặc nhóm IIA với
IVA) ví dụ GaAs gọi là liên kết đồng hóa trị dị cực c. Liê n kết ion
Đây là liên kết mạnh, các nguyên tử cho bớt điện tử lớp ngoài cùng, trở thành ion
dương (cation) hoặc nhận thêm điện tử để điền đầy lớp ngoài cùng, trở thành ion âm
(anion). Ví dụ Lì nguyên tử li cho một điện tử để trở thành
Li , còn F nhận 1e để trở thành
F Kết quả tạo thành hợp chất LiF. Liên kết ion thường tạo thành giữa các nguyên
tố có nhiều điện tử hóa trị (nhóm VIB, VIIB) với các nguyên tử có ít ít điện tử hóa trị
(nhóm IB, IIB). Các oxyt kim loại Al O , MgO ,CaO , Fe O , NiO có liên kết chủ yếu là 2 3 3 4 liên kết ion
Cũng giống liên kết đồng hóa trị, liên kết ion càng
mạnh (bền vững) khi các nguyên tử càng ít điện tử, tức
là các điện tử cho hoặc nhận nằm gần hạt nhân. Ví dụ
hyddro (H) tạo với F, Cl, Br các hợp chất HF, HCl, HBr,
bằng năng lượng liên kết ion tương ứng là 5,81/4,44
/3,75/3,06 eV/mol. Cần lưu ý rằng liên kết ion là liên kết không định hướng
d. Liên kết kim loại
Liên kết kim loại thường được tạo nên từ những nguyên
tử có ít điện tử hóa trị. Trong liên kết kim loại các nguyên tử nhường bớt điện tử trở thành
ion dương, còn các điện tử trở thành điện tử tự do. Các điện tử này không bị chi phối bởi
một nguyên tử nào. Giữa các ion dương với nhau và các điện tử tồn tại lực đẩy. Giữa ion
dương và điện tử tồn tại lực hút. Sự cân bằng giữa các lực này là cơ sở của sự liên kết,
đây là dạng liên kết quan trọng của kim loại. Các ion dương, tạo thành một mạng xác
định, đặt trong không gian điện tử tự do chung ( mây điện tử tự do) Đó là hình ảnh liên
kết kim loại. Nhờ mối liên kết này mà kim loại có tính dẻo cao
1.2.2 Vật rắn tinh thể và vật rắn vô định hình
Trong thiên nhiên tồn tại hai dạng vật rắn khác nhau về tính chất là tinh thể và vô định hình 6
Các vật tinh thể ở trạng thái rắn, khi nung đến nhiệt độ nhất định thì chúng chuyển
thành trạng thái lỏng, khi làm nguội xảy ra quá trình ngược lại. Việc chuyển từ trạng thái
này sang trạng thái khác xảy ra ở một nhiệt độ nhất định gọi là nhiệt độ nóng chảy
Các vật vô định hình khi nung nóng bị mềm ra trong một khoảng nhiệt độ và sau đó
chuyển thành trạng thái lỏng, tức là không có điểm nhiệt độ nóng chảy xác định
Trạng thái tinh thể của chất rắn ổn định hơn trạng thái vô định hình
Các vật tinh thể được đặc trưng bởi sự sắp xếp có trật tự trong không gian của các hạt
(các ion, nguyên tử, phân tử) tạo nên tinh thể
Tính chất của tinh thể phụ thuộc vào cấu tạo điện tử của các nguyên tử, sự phân bố
trong không gian của các hạt cơ bản, thành phần hóa học, kích thước và hình dáng tinh thể
Vật rắn được cấu tạo từ các nguyên tử, phân tử, chúng được liên kết với nhau theo
một trật tự nhất định (vật rắn tinh thể) hoặc không theo một trật tự qui luật nào (vật rắn vô định hình)
+ Vật rắn vô định hình: như than đá, thủy tinh nhựa hữu cơ. Khi gãy vỡ thì mặt gãy sẽ nhẵn nhụi
+ Vật rắn tinh thể : Như Pirit FeS hình hộp, Hêmatit FeO hình tấm…thường là 3 2
những vật kim loại. bao giờ chúng cũng có hình dáng nhất định, mặt gãy, vỡ có dạng sần sùi như có hạt
1.2.3 Cấu tạo kim loại nguyên chất
Mỗi một kim loại nguyên chất có một kiểu mạng tinh thể nhất định nên có nó cũng có tính chất riêng
a. Khái niệm mạng tinh thể + Mạng tinh thể: Trong vật rắn các
nguyên tử, phân tử được
xắp xếp ở các vị trí nhất định theo các mô hình
không gian khác nhau gọi là mạng tinh thể + Ô cơ sở
Nếu vẽ hết cấu trúc của các phân tử trong vật rắn thì sẽ rất lớn và phức tạp, nên người
ta chỉ cần tìm những khối hình học đặc trưng, có kích thước nhỏ nhất, có đầy đủ sự xắp
xếp theo qui luật trong toàn bộ mạng tinh thể gọi là khối cơ sở. Và mạng tinh thể chỉ cần
biểu diễn ô cơ sở trong đó các nguyên tử nằm ở các đỉnh là đủ. + Thông số mạng
Là kích thước cơ bản của mạng tinh thể từ đó tính ra khoảng cách giữa hai nguyên tử
trong mạng. khoảng cách này rất nhỏ nên tính bằng Angstrong ( A0 8 1 10 cm ). Nếu
khoảng cách này càng nhỏ thì vật liệu càng bền vững
b. Các loại mạng tinh thể thường gặp 7
+ Mạng tinh thể lập phương thể
tâm: là mạng tinh thể có ô cơ sở là hình
lập phương, trong đó các nguyên tử
nằm ở đỉnh và tâm khối. Được kí hiệu.
Các kim loại có mạng này như Cr, W,V,Mo
+ Mạng tinh thể lập phương diện
tâm: là mạng tinh thể có ô cơ sở là hình
lập phương, trong đó các nguyên tử
nằm ở đỉnh và tâm mặt. Được lí hiệu.
Các kim loại có mạng này như Cu, Ni, Al, Pb,
+ Mạng tinh thể sáu phương xếp
chặt: là mạng tinh thể có ô cơ sở là
hình lục lăng, trong đó các nguyên tử
nằm ở đỉnh, tâm mặt đáy và tâm của ba
lăng trụ tam giác cách đều nhau mặt.
Các kim loại có mạng này như Mg, Zn
c. Mật độ nguyên tử và lỗ hổng của mạng tinh thể
Mật độ nguyên tử trong mạng tinh thể
Do ta coi các nguyên tử kim loại là hình cầu nên dù chúng sắp xếp sít chặt bao nhiêu
đi nữa giữa chúng với nhau cũng còn có các khoảng trống nhất định. Vì vậy phải đưa ra
vấn đề mật độ của nguyên tử trong mạng tinh thể .
Mật độ nguyên tử trong mạng tinh thể là phần thể tích (diện tích) có nguyên tử
chiếm chỗ tính ra phần trăm . * Mật độ khối . n v M % 100 V V Trong đó :
n - số ngyên tử có trong khối cơ sở
v - thể tích của một nguyên tử
V - thể tích khối cơ sở * Mật độ mặt . n s M % 100 S S Trong đó :
ns - số nguyên tứ có trong mặt đang xét
s - diện tích của một nguyên tử
S - diện tích mặt đang xét 8
Lỗ hổng trong mạng tinh thể
Do nguyên tử có dạng hình cầu nên giữa chúng luôn có các lỗ hổng .Có hai loại lỗ
hổng: lỗ hổng trong khối tám mặt và lỗ hổng trong khối bốn mặt. Các kiểu mạng khác
nhau có số lỗ hổng khác nhau và kích thước của chúng cũng khác nhau . Các lỗ hổng này
quyết định sự hòa tan của các nguyên tử khác vào mạng của chúng.
Mạng lập phương tâm khối :
- Loại thứ nhất: nằm trong khối tám mặt tạo bởi sáu nguyên tử và có tâm nằm ở giữa
các cạnh và trung tâm các mặt bên, kích thước của no là 0,154d . Tất cả có sáu lỗ hổng như vậy .
- Loại thứ hai: nằm trong khối bốn mặt , có tâm nằm ở 1/4 đoạn thẳng nối điểm giữa
các mặt bên, kích thước là 0,221d và có tất cả 12 lỗ hổng. Mạng lập phương tâm khối có
nhiều lỗ hổng hơn nhưng kích thước các lỗ hổng nhỏ hơn .
Mạng lập phương tâm mặt
- Loại thứ nhất: nằm trong khối tám mặt có tâm nằm ở trung tâm khối cơ sở và đỉnh
ở điểm giữa các mặt bên, kích thước 0,41d. Có tất cả bốn lỗ hổng như vậy .
- Loại thứ hai : nằm trong khối bốn mặt, tâm nằm ở khoảng 1/4 các đường chéo khối
111 , kích thước 0,225d , có tất cả tám lỗ hổng như vậy. Mạng lập phương tâm mặt có số
lỗ hổng ít hơn nhưng kích thước lớn hơn .
d. Tính thù hình của kim loại
+ Định nghĩa: Không phải một kim loại chỉ có một kiểu mạng cố định mà ở các
khoảng nhiệt độ khác nhau chúng sẽ có các kiểu mạng khác nhau + Đặc tính thù hình
Các dạng thù hình( kiểu mạng) khác nhau được ký hiệu
bằng các chữ cái Hy Lạp , , , 9
Khi kim loại có chuyển biến thù hình thì nó có sự thay đổi và thể tích bên trong và thay đổi tính chất
+ Ví dụ: Nội dung này cần học thuộc
Sắt (Fe ) nguyên chất ở nhiệt độ bình thường nó có kiểu mạng (lập phương tâm khối) 0 a 88 , 2
A . Khi nung nóng đến nhiệt độ 0
911 nó sẽ chuyển sang kiểu mạng ( lập 1 phương diện tâm) 0 a 64 , 3 A rồi đến 0
1397 nó chuyển sang (lập phương tâm khối) 2 0 a , 2 48A và đến 0
1539 thì nó chuyển sang thể lỏng ( không có cấu trúc ổn định). 3 10
Chương 2: HỢP KIM VÀ GIẢN ĐỒ Fe- C
2.1 CẤU TRÚC TINH THỂ CỦA HỢP KIM
2.1.1 Khái niệm về hợp kim
a. Định nghĩa: Hợp kim là
- Vật thể có tính kim loại (sáng, dẻo, dẫn nhiệt, và điện ).
- Có nhiều nguyên tố trong đó chủ yếu phải là nguyên tố kim loại, nguyên tố còn lại
là nguyên tố hợp kim hóa
+ Kim loại nguyên chất có tính dẻo cao, nhưng độ bền, độ cứng thấp. Hợp kim có độ
bền, độ cứng, độ dẻp, độ dai tương đối cao nên được sử dụng phổ biến hơn
b. Các dạng cấu tạo của hợp kim
Ở dạng lỏng các nguyên tố hòa tan với nhau tạo dung dịch lỏng
Khi nguội nó có tổ chức pha như sau:
+ Hợp kim tổ chức một pha (một kiểu mạng tinh thể) gồm có: Dung dịch rắn và hợp chất hóa học
+ Hợp kim tổ chức hai pha (hai kiểu mạng tinh thể) gồm hỗn hợp cơ học
2.1.2 Dung dịch rắn
a. Khái niệm và phân loại
Khi hai hay nhiều nguyên tố trong hợp kim có khả năng hòa tan với nhau ở trạng thái
rắn và tạo một thể đồng nhất có tính chất giống nhau trong toàn bộ thể tích của hợp kim
Cũng giống như dung dịch lỏng, trong dung dịch rắn ta không phân biệt được một
cách cơ học các nguyên tử của các cấu tử, các nguyên tử của chúng phân bố xen vào nhau trong mạng tinh thể.
Trong dung dịch rắn nguyên tố có lượng chứa nhiều hơn gọi là nguyên tố dung môi,
nguyên tố còn lại gọi là nguyên tố hòa tan
Kiểu mạng của dung dịch rắn là kiểu mạng của nguyên tố dung môi. Ví dụ dung dịch rắn Ferit Fe
C có mạng tinh thể lập phương thể tâm có a 88 , 2 KX , 1
Dung dịch rắn được chia ra làm hai loại : dung dịch rắn thay thế và dung dịch rắn xen kẽ.
b. Dung dịch rắn thay thế
Là loại dung dịch rắn mà trong đó nguyên tử của cấu tử hòa tan thay thế vào vị trí
trên nút mạng của cấu tử dung môi (nguyên tố chủ). Như vậy kiểu mạng và số nguyên tử
trong khối cơ sở đúng như của cấu tử dung môi. Tuy nhiên sự thay thế này ít nhiều đều
gây ra sự xô lệch mạng, vì không thể có hai loai nguyên tử của hai cấu tử có kích thước
hoàn toàn giống nhau. Do vậy sự thay thế chỉ xảy ra với các cấu tử có kích thước nguyên
tử khác nhau ít (với kim loại sự sai khác này không quá 15%). Tùy thuộc vào mức độ hòa
tan người ta còn chia ra dung dịch rắn hòa tan vô hạn và có hạn.
Dung dịch rắn thay thế hòa tan vô hạn
Điều kiện để hai cấu tử hòa tan vô hạn vào nhau
- Có cùng kiểu mạng tinh thể
- Đường kính nguyên tử khác nhau ít, nhỏ hơn 8%. Nếu sai khác nhau nhiều từ 8- 11
15% chỉ có thể hòa tan có hạn, lớn hơn 15% không thể hòa tan vào nhau.
- Nồng độ điện tử không vượt quá một giá trị xác định với mỗi loại dung dịch rắn (số
lượng điện tử hóa trị tính cho một nguyên tử), tức là các nguyên tố phải có cùng hóa trị.
- Các tính chất vật lý và hóa học gần giống nhau (cấu tạo lớp vỏ điện tử, tính âm điện,
nhiệt độ chảy...) Nói chung các nguyên tố cùng trong một nhóm của bảng hệ thống
tuần hoàn thỏa mãn điều kiện này. Các cặp nguyên tố hình thành dung dịch rắn vô hạn
chỉ có thể là nguyên tố kim loại. Cần chú ý rằng đây chỉ là điều kiện cần của dung dịch rắn vô hạn.
Dung dịch rắn thay thế hòa tan có hạn
Các cặp cấu tử không thỏa mãn bốn điều kiện trên chúng chỉ hòa tan vào nhau theo
một tỉ lệ nhất định tạo thành dung dịch rắn hòa tan có hạn
c. Dung dịch rắn xen kẽ
Là loại dung dịch rắn trong đó nguyên tử hòa tan nằm xen giữa các nguyên tử của
kim loại dung môi, chúng chui vào lỗ hổng trong mạng dung môi. Như vậy ta thấy rằng
só nguyên tử trong khối cơ sở tăng lên. Do kích thước các lỗ hổng trong mạng tinh thể rất
nhỏ nên các nguyên tử hòa tan phải có kích thước rất nhỏ. Đó chính là các nguyên tử C,
N, H, B... với dung môi Fe. Đương nhiên là dung dịch rắn xen kẽ chỉ có loại hòa tan có hạn.
d. Các đặc tính của dung dịch rắn
a - Mạng tinh thể của dung dịch rắn là kiểu mạng của kim loại dung môi, thường có
các kiểu mạng đơn giản và sít chặt. Đây là yếu tố cơ bản quyết định các tính chất cơ, lý
hóa ... Về cơ bản nó vẫn giữ được các tính chất của kim loại dung môi.
b - Liên kết vẫn là liên kết kim loại. Do vậy dung dịch rắn vẫn giữ được tính dẻo
giống như kim loại nguyên chất, tuy có kém hơn (trừ hệ hợp kim Cu-Zn, với 30%Zn hợp
kim này còn dẻo hơn cả kẽm)
c - Thành phần hóa học thay đổi trong phạm vi nhất định mà không làm thay đổi kiểu mạng.
d - Tính chất biến đổi nhiều : độ dẻo, độ dai, hệ số nhiệt độ điện trở giảm, điện trở,
độ bền, độ cứng tăng lên...
Do các đặc tính trên nên dung dịch rắn là cơ sở của các hợp kim kết cấu dùng trong
cơ khí. Trong các hợp kim này pha cơ bản là dung dịch rắn, nó chiếm xấp xỉ 90%, có trường hợp đến 100%.
2.1.3 Hợp chất hóa học
Các hợp chất hóa học tồn tại trong hợp kim thường gọi là pha trung gian vì trên giản
đồ pha nó nằm ở vị trí giữa và trung gian của các dung dịch rắn ở hai đầu mút. Ví dụ Xê
men tít trong thép: Fe C 3
Các hợp chất hóa học thường có các đặc điểm sau :
- Có mạng tinh thể phức tạp và khác hẳn mạng nguyên tố thành phần
- Luôn luôn có một tỷ lệ chính xác giữa các nguyên tố và được biểu diễn bởi công
thức hóa học nhất định. Ví dụ trong hợp kim sắt - cacbon: Fe C tỉ lệ 6,67% C, Fe 3 2C với 9,68% C; FeC với 17,67% C. 12
- Tính chất khác hẳn các nguyên tố thành phần, độ cứng cao, tính dòn lớn. Chúng có
vai trò rất lớn trong việc nâng cao tính chống mài mòn và chịu nhiệt của hợp kim.
- Có nhiệt độ nóng chảy rất cao thường lớn hơn 0
3000 C , khi hình thành là phản ứng tỏa nhiệt.
2.1.4 Hỗn hợp cơ học
+ Định nghĩa: Khi hai hay nhiều pha trong hợp kim không có khả năng hòa tan và
tác dụng hóa học với nhau ở trạng thái rắn thì tác dụng cơ học với nhau để tạo thành hỗn
hợp cơ học của hợp kim + Cấu tạo
Hỗn hợp cơ học có các dạng sau: *
Do 2 kim loại nguyên chất tạo nên, như Au-Pb *
Do 2 dung dịch rắn tạo nên. Ví dụ như Fe-C có các bon % 5 , 0 ở nhiệt độ 0 800 có
cấu tạo bên trong là hỗn hợp cơ học gồm Fe C Fe C *
Do 1 dung dịch rắn với 1 hợp chất hóa học. Ví dụ như Fe-C có Các bon % 5 , 0 ở
nhiệt độ thường có cấu tạo bên trong là hỗn hợp cơ học Peclit gồm Fe C Fe C 3 *
Do 1 kim loại nguyên chất với 1 dung dịch rắn hoặc kim loại nguyên chất với hợp chất hóa học
Hai dạng điển hình của hỗn hợp cơ học là cùng tinh hoặc cùng tích
- Cùng tích là hỗn hợp cơ học được tạo thành từ dung dịch rắn
- Cùng tinh là hỗn hợp cơ học được tạo thành từ trạng thái lỏng nên có kích thước
tinh thể lớn hơn cùng tích
2.2 GIẢN ĐỒ TRẠNG THÁI Fe – C
Thép và gang là các vật liệu chủ yếu sử dụng trong ngành cơ khí. Cở sở để nghiên
cứu và nhiệt luyện chúng là giản đồ pha Fe -C. Vì vậy ta cần phải nghiên cứu kỹ càng giản đồ này.
2.2.1 Khái niệm về giản đồ trạng thái
a. Định nghĩa
Là biểu đồ biểu thị trạng thái tổ chức của hệ hợp kim đã cho trên hệ trục nhiệt độ và thành phần hóa học
b. Công dụng của giản đồ trạng thái
+ Cho biết cấu tạo bên trong của hợp kim với thành phần xác định khác nhau thông
qua giản đồ trạng thái này để biết được cơ tính của chúng, do đó biết cách sử dụng hợp lý
vật liệu làm bằng hợp kim đó
+ Qua giản đồ xác định được chế độ nhiệt cho các công nghệ luyện kim và đúc
2.2.2. Giản đồ trạng thái a. Các bon và sắt * Các bon
Các bon là nguyên tố á kim thuộc nhóm IV trong bảng hệ thống tuần hoàn và có thể ở
2 dạng thù hình: Graphit và kim cương. Trong điều kiện bình thường, graphit là dạng ổn 13
định, còn kim cương không ổn định. Trong hợp kim Fe-C, các bon nguyên chất chỉ tồn tại
ở dạng graphit, mà không tồn tại ở dạng kim cương. * Sắt
Sắt là nguyên tố kim loại thuộc nhóm VII trong bảng hệ thống tuần hoàn. Sắt có chứa
khá nhiều trong vỏ quả đất, khoảng 5% trọng lượng. Cũng giống như các nguyên tố khác,
nó không thể ở dưới dạng tuyệt đối tinh khiết, mà trong sắt có chứa khoảng (0,1-0,2)%
tạp chất bao gồm hàng chục các nguyên tố khác.
Các chỉ tiêu cơ tính của sắt như sau:
+ Giới hạn bền kéo 250 N/mm2 + Giới hạn chảy 120 N/mm2 + Độ giản dài 50% + Độ cứng, HB 85
+ Độ dai va đập, ak 300 KJ/m2
So với nhiều kim loại khác như: Al, Cu, thì sắt có độ bền, độ cứng cao hơn, nhưng
vẫn còn thấp so với yêu cầu chế tạo cơ khí. Vì vậy trong chế tạo cơ khí không sử dụng sắt
nguyên chất, mà người ta sử dụng hợp kim của sắt.
Sắt có hai kiểu mạng tinh thể tồn tại trong 3 khoảng nhiệt độ:
+ Mạng lập phương thể tâm tồn tại trong 2 khoảng nhiệt độ: Dưới 9110C được gọi là
F và trong khoảng (1392-1539)0C được gọi là Fe. Trọng lượng riêng của Fe là 7,68 g/cm3.
+ Mạng lập phương diện tâm tồn tại trong khoảng nhiệt độ (911-1392)0C được gọi là
Fe. Trọng lượng riêng của Fe là (8-8,1) g/cm3.
* Tương tác giữa sắt với các bon
Sắt và các bon tương tác với nhau theo 2 cách: Sắt hoà tan các bon để tạo thành dung
dịch rắn và sắt kết hợp với các bon tạo thành hợp chất hoá học.
Các dung dịch của sắt hoà tan các bon
Các bon hoà tan vào sắt để tạo nên các dung dịch rắn. Tuy nhiên lượng hoà tan của
các bon vào sắt khác nhau:
+ Trong Fe lượng các bon hoà tan lớn nhất là 0,02% ở 7270C
+ Trong Fe lượng các bon hoà tan là 0,1% ở 14990C
+ Trong Fe lượng hoà tan của các bon là 2% trọng lượng C
Hợp chất hoá học của sắt với các bon
Khi lượng hòa tan của cacbon vào sắt vượt quá giới
hạn của dung dịch rắn thì sẽ tạo nên các hợp chất hóa học
: Fe3C vớI 6,67% C; Fe2C với 9,68% C; FeC với 17,67%
C. Nhưng do các hợp kim của sắt với các bon chỉ dùng với
hàm lượng các bon nhỏ hơn 5%, nên chỉ gặp hợp chất hoá
học Fe3C (Xêmentít). Xêmentít có kiểu mạng trục thoi 14
phức tạp, nhiệt độ nóng chảy khoảng 0
1250 C và có độ cứng khoảng 800HB
b. Giản đồ trạng thái Fe-C Dạng giản đồ
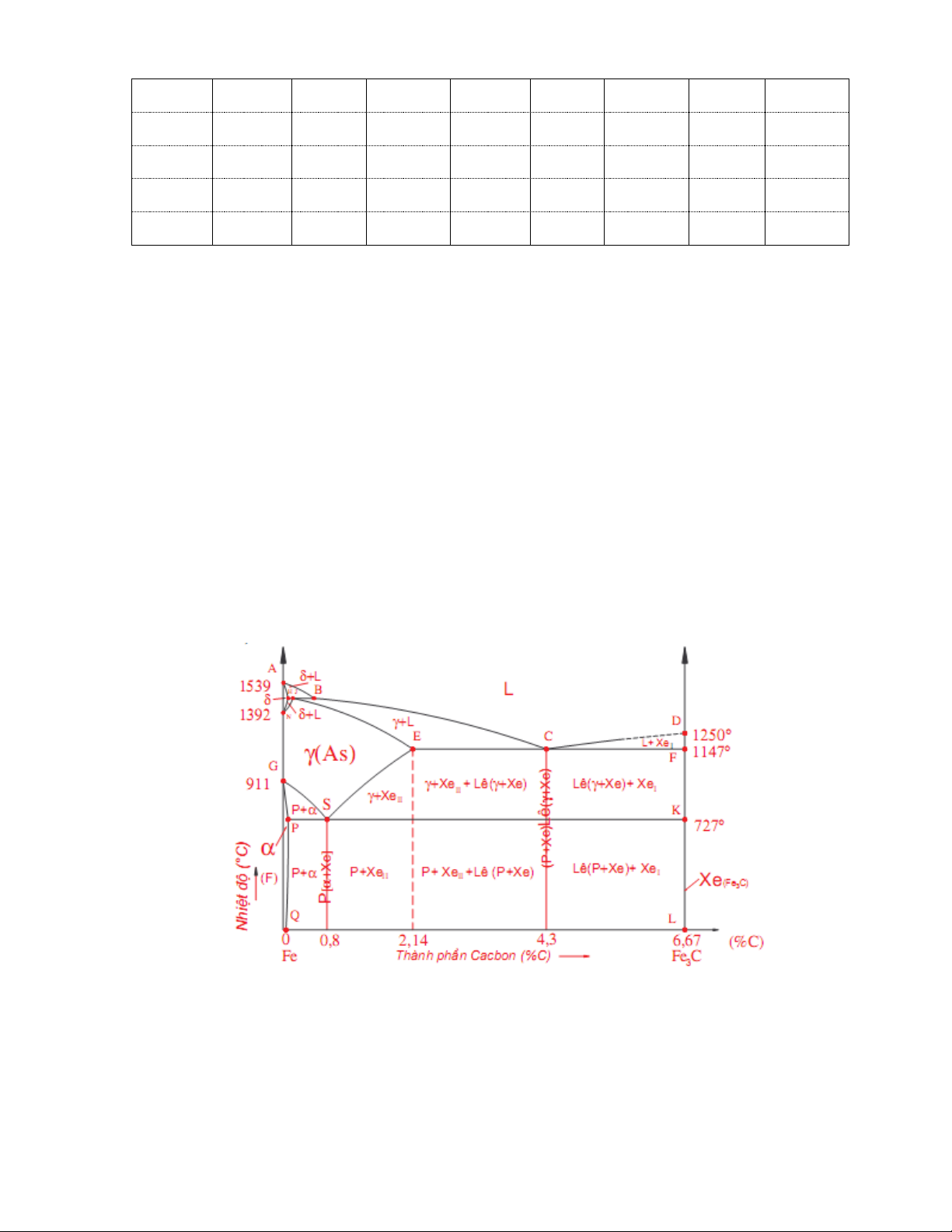
Giản đồ trạng thái Fe-C mô tả trạng thái của hợp kim tương ứng với các giá trị của
hàm lượng các bon và nhiệt độ của hợp kim.
Trục tung trên giản đồ biểu thị nhiệt độ của hợp kim (00C), trục hoành biểu thị hàm
lượng các bon trong hợp kim (%).
Các đường trên giản đồ -
Đường ABCD là đường lỏng: Ở phía trên đường này là vùng tồn tại của hợp kim lỏng. -
Đường AHJECF là đường đặc: Ở phía dưới đường này là vùng tồn tại của hợp kim ở thể rắn. -
Đường GS ( A ) đánh dấu sự chuyển biến của ferit (F) thành khi nung nóng và 3
chuyển biến thành F khi làm nguội. -
Đường SE ( A ) đánh dấu sự chuyển biến của Xe thành khi nung nóng và cm II
chuyển biến thành Xe khi làm nguội. II -
Đường PSK ( A ) tương ứng với nhiệt độ 7270C. 1
Các điểm tới hạn 0 - A 1250 1147
là điểm (tức nhiệt độ) chuyển biến từ của Xêmentit, cao hơn 0 C
nhiệt độ này Xê mất tính sắt từ, dưới nhiệt độ này có tính sắt từ yếu. 0 - A 727
là điểm chuyển biến cùng tích của [F+Xe] khi làm nguội và 1 C [F+Xe] khi nung nóng. 0 - A 768
là điểm chuyển biến từ của ferit, cao hơn nhiệt độ này ferit mất tính sắt 2 C
từ, dưới nhiệt độ này có tính sắt từ. 0 - A 727 911
là điểm chuyển biến: Bắt đầu tiết ra F từ khi làm nguội và kết 3 C
thúc hoà tan của F vào khi nung nóng. 0 - A 727 1147
là điểm chuyển biến: Bắt đầu tiết ra Xe từ khi làm nguội, cm C II
kết thúc Xe hoà tan vào khi nung nóng, ứng với đường ES. II 0 - A 1392 1499
là điểm chuyển biến và , ứng với đường NJ. 4 C
Các toạ độ (nhiệt độ và hàm lượng cácbon) của các điểm trên giản đồ trạng thái như ở bảng 1.
Bảng 1: Toạ độ các điểm trên giản đồ trạng thái Fe-C Điểm Nh.độ %C Điểm Nh.độ %C Điểm Nh.độ %C (0C) (0C) (0C) 15 A 1539 0 E 1147 2,14 P 727 0,02 B 1499 0,51 C 1147 4,3 S 727 0,8 H 1499 0,1 F 1147 6,67 K 727 6,67 J 1499 0,16 D 1250 6,67 Q 0 0,006 N 1392 0 G 911 0 L 0 6,67
2.2.3 Các tổ chức pha
a. Các tổ chức một pha + Hợp kim lỏng
Là dung dịch của các bon trong sắt, tồn taị ở phía trên đường ABCD.
Trong kim loại lỏng các nguyên tử không sắp xếp hỗn loạn như ở trạng thái khí.
Song cũng không sắp xếp trật tự như ở trạng thái rắn. Nếu xem xét biểu hiện bên ngoài thì
kim loại lỏng gần với kim loại rắn hơn so với trạng thái khí.
Cấu tạo của kim loại lỏng có những đăc điểm sau : -
Liên kết vẫn là liên kết kim loại như ở trạng thái rắn nhưng yếu hơn . -
Các nguyên tử luôn có xu hướng sắp xếp trật tự, tức là mỗi nguyên tử luôn giữ
khoảng cách nhất định với các nguyên tử bên cạnh và luôn có một số nguyên tử nhất định
bao quanh chuyển động nhiệt của nguyên tử ở trạng thái lỏng rất lớn, do đó xu hướng sắp
xếp có trật tự luôn bị phá hủy và thay bằng sự sắp xếp có trật tự mới. -
Trong kim loai lỏng có điện tử tự do.
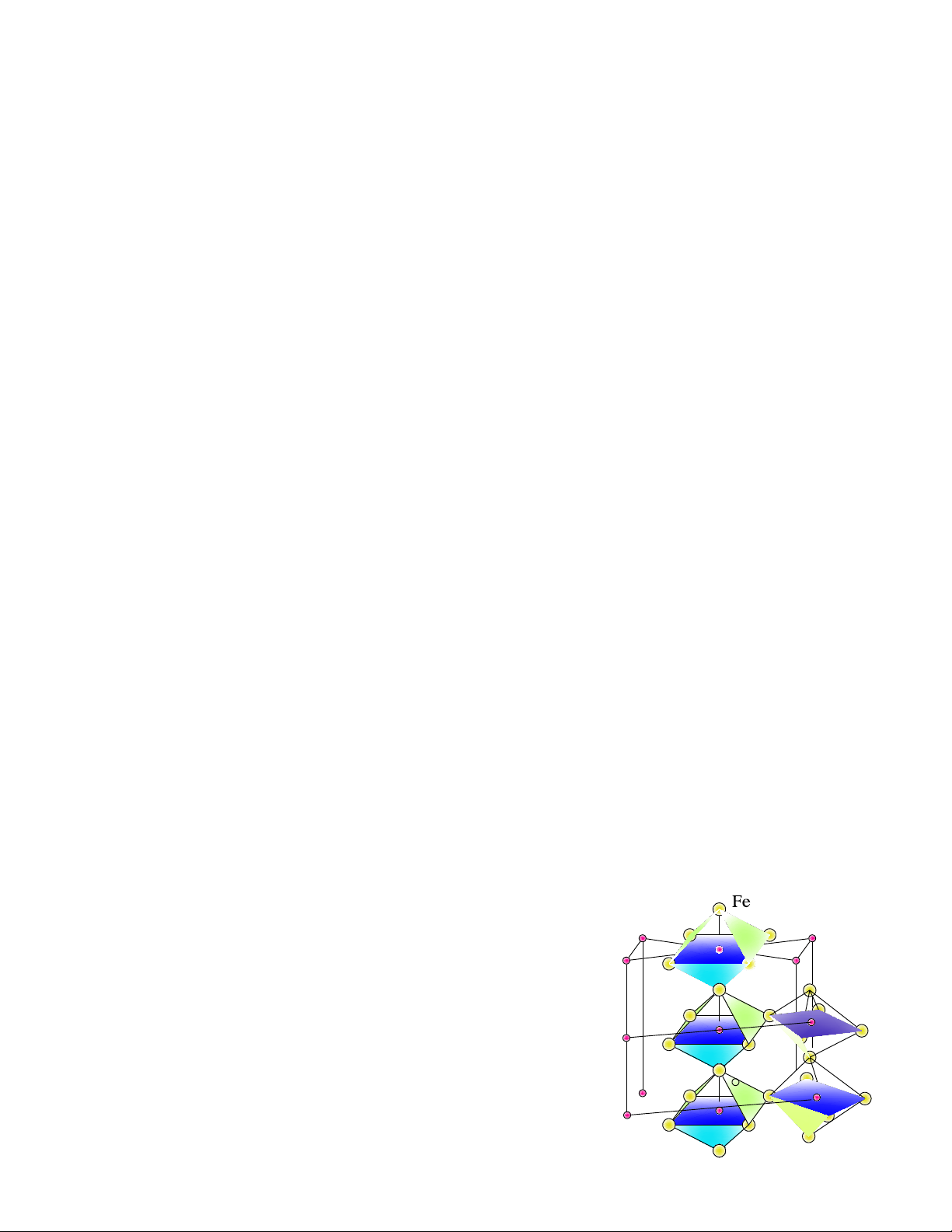
+ Xêmentit (kí hiệu là Xê)
Xêmentit là hợp chất hoá học của sắt với các bon. Công thức hoá học là Fe3C.
Trong giản đồ trạng thái Fe-C có 3 dạng Xê:
- Xêmentit thứ nhất XeI là loại kết tinh từ pha lỏng, nó được tạo thành trong các hợp
kim chứa nhiều hơn 4,3% C ở trong khoảng nhiệt độ cao (1250-1147)0C.Tổ chức rất thô và to 16
- Xêmentit thứ hai XêII được tiết ra từ dung dịch rắn ở trong khoảng nhiệt độ
(1147-727)0C theo đường ES khi độ hòa tan giới hạn của các bon trong pha này giảm từ
2,14% xuống còn 0,8%. XêII có trong hợp kim với C % 8 , 0
. Do tạo ra từ pha rắn ở
nhiệt độ không cao lắm nên có tổ chức hạt nhỏ.
- Xêmentit thứ ba XêIII được tiết ra từ dung dịch rắn ferit ở khoảng nhiệt độ thấp
hơn 7270C (theo đường PQ) khi độ hòa tan giới hạn của cascbon trong ferit giảm từ 0,02
đến 0,006%.. Do XêIII có với lượng rất ít và khó phát hiện nên ta có thể bỏ qua
- Các dạng Xê trên không khác nhau về bản chất, mà chỉ khác nhau về điều kiện tạo
thành. Xêmentit rất cứng và giòn.
+ Ferit (kí hiệu là F)
Ferit là dung dịch rắn xen kẽ của các bon trong Fe, có mạng
tinh thể lập phương thể tâm, kích thước lỗ hổng 0 d 64 , 0 A ,
trong khi đó kích thước nguyên tử cacbon 0 d 54 , 1 A nên về
nguyên tắc cascbon không thể hòa tan trong sát được nhưng thực
tế nó có thể hòa tan 0,02%C ở 0
727 C và 0,006% ở nhiệt độ
thường, người ta cho rằng cacbon chui vào nơi có sai lệch mạng
nhiều nhất. Trên giản đồ trạng thái Fe-C, ferit nằm ở trong khu vực
GPQ. có thể coi ferit trong hợp kim là sắt nguyên chất. Ferit rất
dẻo và dai, nhưng khi các nguyên tố khác (đặc biệt là Mn, Si) hoà
tan vào nó thì độ cứng tăng lên, còn độ dẻo, độ dai giảm đi đáng kể.
+ Austenit (kí hiệu là hoặc As)- là tên của nhà Bác học người Anh Robert Austen
Austenit là dung dịch rắn xen kẽ của các bon trong Fe có mạng tinh thể lập phương
diện tâm. Cũng giống như ferit kích thước lỗ hổng 0 d 02 , 1
A . Khả năng hoà tan của các
bon của Fe khá lớn, đến 2,14% ở 11470C. Trong hợp kim Fe-C thông thường, Austenit
có thể hoà tan Si và các nguyên tố kim loại như: Cr, Ni, Mn, W, v.v… Trên giản đồ trạng
thái Fe-C, As nằm ở trong khu vực NJESG, do vậy nó không tồn taị ở nhiệt độ thường.
Cũng giống như Ferit, As rất dẻo và dai. Khi các nguyên tố khác hoà tan vào trong As sẽ
làm tăng độ cứng, giảm độ dẻo, độ dai.
b. Các tổ chức hai pha
+ Ở trạng thái lỏng và rắn gồm 1
pha lỏng và 1 pha rắn
+ Khi C = 0,8% có hỗn hợp cơ học
cùng tích gọi là Peclit gồm 2 pha
Xe được hình thành từ dung
dịch rắn ở nhiệt độ 0 727 . Nó có
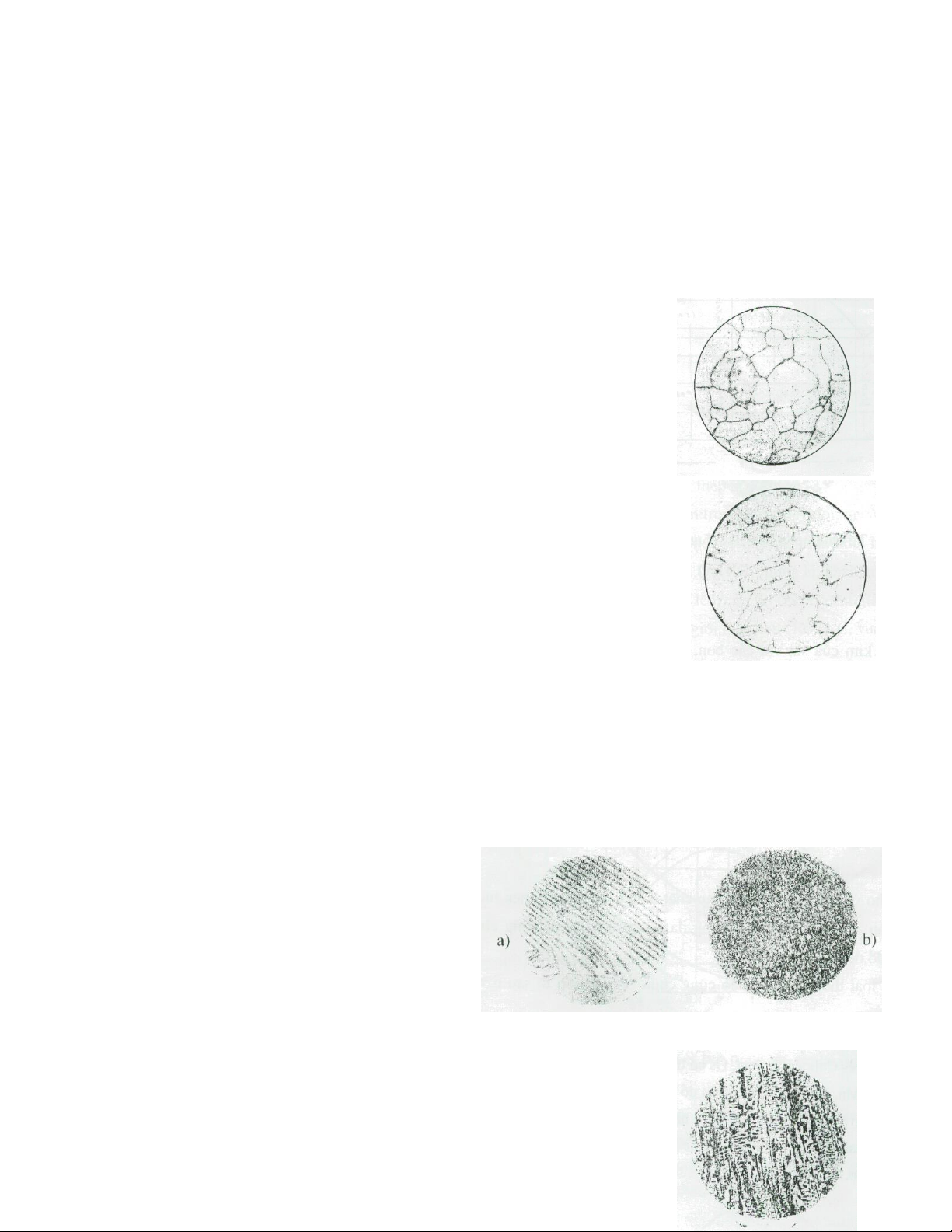
88% và 12% Xe, 200- 220HB. Nó tồn tại ở 2 dạng : Peclit tấm và peclit hạt Peclit tấm Fe % 88 F % 12 Xe 0, % 8 C % 0 C 6, % 67 C 0, % 8 C 17
+ Khi C = 4,3% ở nhiệt độ 0
1147 C ta có hỗn hợp Lêđêburit gồm Xe, Ở 0 0
t 727 . Lêđêburit có tổ chức (P + Xe) hay Xe, gồm 36% và 64% Xe, nên
độ cứng cao khoảng 500- 600HB c. Gang và thép + Khi C % 17 , 2
thì hợp kim đó ta gọi là thép, còn C % 17 , 2 ta gọi là gang
+ Thép: Theo tổ chức trên giản đồ có 3 loại thép:
- Thép trước cùng tích có tổ chức: P khi C % 8 , 0
- Thép cùng tích có tổ chức: P Xe khi C % 8 , 0
- Thép sau cùng tích có tổ chức: P Xe khi C % 8 , 0 II
+ Gang: Theo tổ chức trên giản đồ có 3 loại gang:
- Gang trắng trước cùng tinh có tổ chức: Lê P Xe khi C % 3 , 4 II
- Gang trắng cùng tinh có tổ chức:
Lê P Xe khi C % 3 , 4
- Gang trắng sau cùng tích có tổ chức: Lê Xe khi C % 3 , 4 I 18
BÀI 3 NHIỆT LUYỆN VÀ HÓA NHIỆT LUYỆN 3.1 NHIỆT LUYỆN
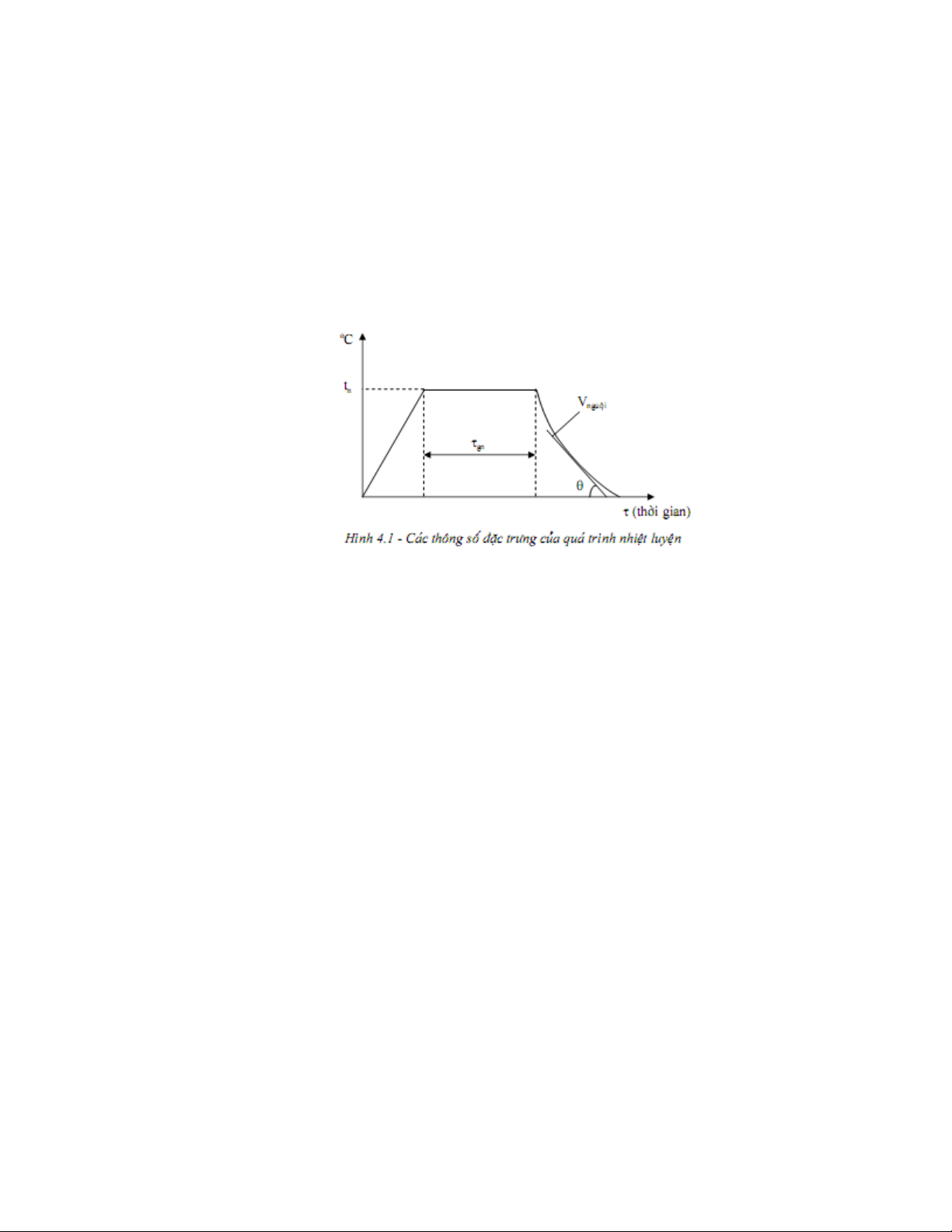
3.1.1 Khái niệm chung a. Định nghĩa
Nhiệt luyện là một quá trình bao gồm nung nóng hợp kim đến một nhiệt độ nhất định,
giữ nhiệt ở đó một thời gian cần thiết, sau đó làm nguội với tốc độ khác nhau nhằm mục
đích làm thay đổi tổ chức do đó thay đổi tính chất (đặc biệt cơ tính) của hợp kim theo ý muốn
Cơ sở của nhiệt luyện hợp kim là giản đồ trạng thái hợp kim đó.
b. Đặc điểm của nhiệt luyện :
+ Không nung nóng đến chảy lỏng hay chảy lỏng bộ phận, trong quá trình nhiệt luyện
kim loại vẫn ở trạng thái rắn.
+ Trong quá trình nhiệt luyện hình dáng và kích thước chi tiết không thay đổi (chính xác
là có thay đổi nhưng không đáng kể).
+ Nhiệt luyện chỉ làm thay đổi tổ chức tế vi bên trong, do đó dẫn đến thay đổi cơ tính cho chi tiết.
3.1.2 Tác dụng của nhiệt luyện
a. Nâng cao cơ tính của vật liệu
Làm tăng độ bền, độ cứng, tính chống mài mòn của chi tiết mà vẫn giữ được độ dẻo,
độ dai do đó chi tiết chịu được tải trọng lớn hơn nếu cùng kích thước hoặc giảm kích
thước mà vẫn giữ nguyên tải trọng. ngoài ra còn làm tăng tuổi thọ và độ tin cậy của vật liệu
Như vậy nhiệt luyện được xem là yếu tố quyết định chất lượng sản phẩm cơ khí
b. Cải thiện tính công nghệ
Các công nghệ cơ khí liên quan đến nhiệt độ như hàn, hoặc biến dạng như cán, rèn…
đều làm thay đổi tổ chức kim loại. Chi tiết có thể bị biến cứng hoặc giòn, gây khó khăn
cho các công nghệ gia công sau đó. Vì vậy ta phải áp dụng công nghệ nhiệt luyện như ủ,
thường hóa để tăng độ dẻo, dai. Cũng có trường hợp kim loại có độ dẻo quá cao khó cắt
gọt cần tăng độ cứng bằng nhiệt luyện. Như vậy nhiệt luyện làm tăng năng suất trong chế
tạo, thường gọi là nhiệt luyện trung gian 19
c. Chuẩn bị tổ chức cho các nguyên công cơ và nhiệt luyện tiếp theo
Một số chi tiết máy đặc biệt có yêu cầu riêng về tổ chức như dao cắt, vòng bi…péclit
phải ở dạng phân bố đều. Hoặc trước khi tôi cao tần cần có tổ chức nhỏ mịn, phân bố đều.
Các tổ chức như vậy còn làm giảm khả năng sinh ra phế phẩm khi nhiệt luyện
3.1.3 Sơ lược về nhiệt luyện thép
Trong thực tế có nhứng phương pháp nhiệt luyện chủ yếu sau đây :
Ủ: là phương pháp nung nóng đến nhiệt độ xác định, giữ nhiệt và làm nguội chậm để
nhận được tổ chức gần với trạng thái cân bằng có độ cứng, độ bền thấp nhất, độ dẻo cao nhất.
Thường hóa: là phương pháp nung nóng đến tổ chức hoàn toàn austenit, giữ nhiệt và
làm nguội ngoài không khí tĩnh để nhận được tổ chức gần với trạng thái cân bằng.
Tôi: là phương pháp nung nóng đến cao hơn nhiệt độ tới hạn, làm xuất hiện tổ chức
austenit giữ nhiệt và làm nguội nhanh để nhận được tổ chức không cân bằng có độ cứng cao nhất.
Ram: là phương pháp nung nóng thép đã tôi đến thấp hơn nhiệt độ tới hạn, giữ nhiệt
và làm nguội để điều chỉnh các chỉ tiêu cơ tính (độ bền, độ cứng...) đạt yêu cầu làm việc.
Hóa nhiệt luyện: là phương pháp bão hòa vào bề mặt chi tiết các nguyên tố đã cho ở
nhiệt độ xác định để làm biến đổi thành phần hóa hoc, tổc chức và cơ tính.
Cơ nhiệt luyện: là phương pháp kết hợp quá trình hóa bền bằng nhiệt luyện và biến
dạng dẻo đồng thời trong một nguyên công. Do đó nhận được hóa bề mạnh hơn rất
nhiều khi nhiệt luyện đơn thuần.
3.1.4 Phân loại nhiệt luyện thép
Người ta phân các phương pháp nhiệt luyện chủ yếu của thép ra làm hai nhóm lớn :
nhiệt luyện sơ bộ và nhiệt luyện kết thúc.
Nhiệt luyện sơ bộ : là các phương pháp nhiệt luyện tiến hành trước khi gia công cơ
khí, khi chi tiết là bán thành phẩm. Thuộc nhóm này có ủ và thường hóa.
Nhiệt luyện kết thúc : là các phương pháp nhiệt luyện được thực hiện sau khi gia
công cơ khí, khi chi tiết đã là thành phẩm. Sau khi nhiệt luyện xong không còn gia
công cơ khí tiếp theo nữa. (nếu có chỉ là mài tinh). Thuộc nhóm này có : tôi và ram.
Đối với thép các bon thấp thì ủ và thường hóa là nhiệt luyện kết thúc.
3.2 CÁC TỔ CHỨC ĐẠT ĐƯỢCKHI NUNG NÓNG VÀ LÀM NGUỘI THÉP
3.2.1 Chuyển biến khi nung nóng thép hay chuyển biến tạo ôstenit 20




