
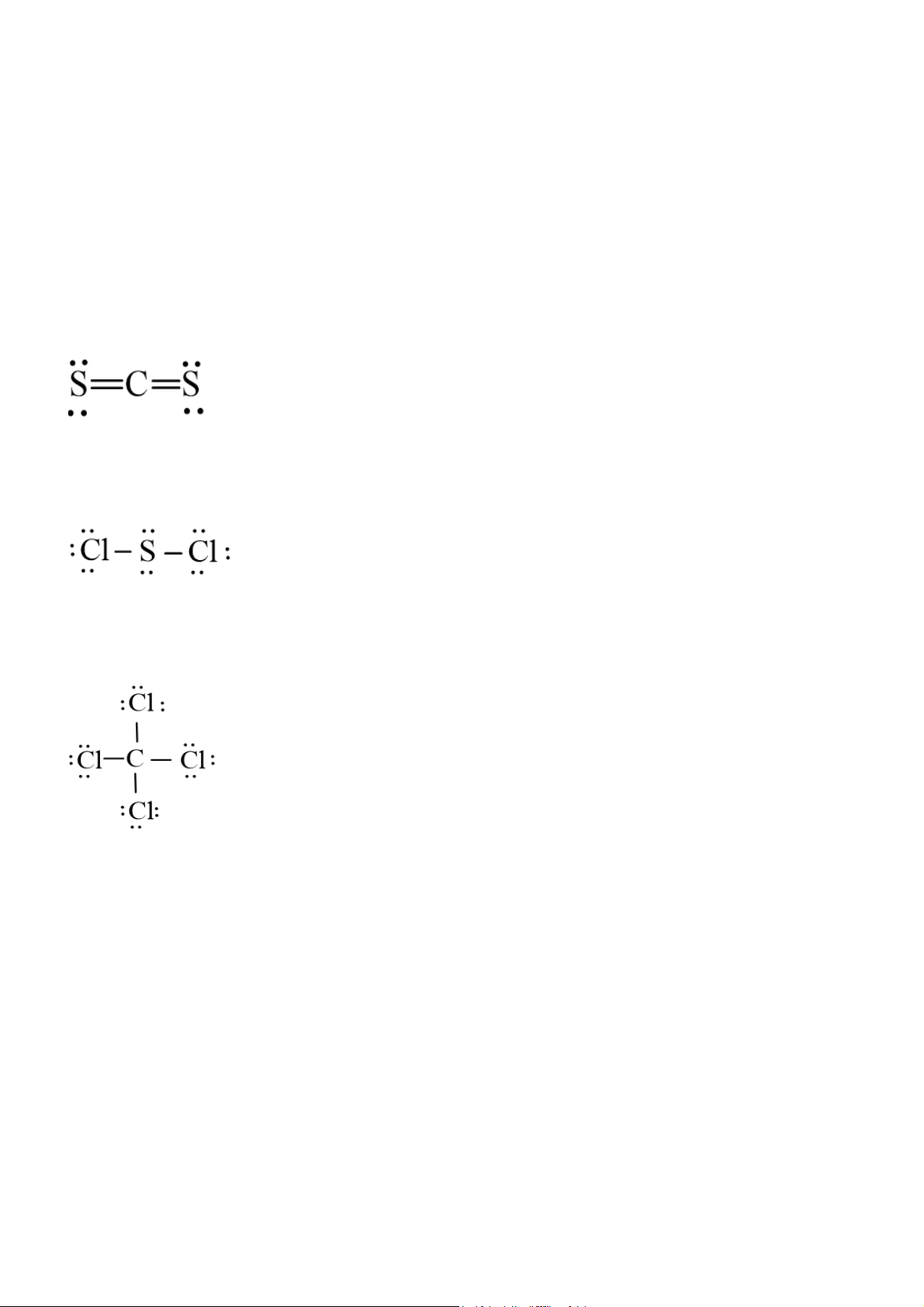
Preview text:
Giải bài tập SGK Hóa 10 trang 64 Bài 1
Trong phân tử iodine (I 2 ), mỗi nguyên tử iodine đã góp một electron để tạo cặp electron
chung. Nhờ đó, mỗi nguyên tử iodine đã đạt cấu hình electron bền vững của khí hiếm nào dưới đây? A. Xe B. Ne C. Ar D. Kr Gợi ý đáp án Đáp án A Bài 2
Hydrogen sulfide (H 2 S) và phosphine (PH 3 ) đều là những chất có mùi khó ngửi và rất độc.
Trình bày sự tạo thành liên kết cộng hóa trị trong phân tử các chất trên.
- Sự tạo thành liên kết cộng hóa trị trong phân tử H2S:
+ Nguyên tử S có cấu hình electron là: 1s22s22p63s23p4 cần 2 electron để đạt được cấu hình
bền vững giống khí hiếm.
+ Nguyên tử H có cấu hình electron là: 1s1 cần thêm 1 electron để đạt được cấu hình giống khí hiếm.
+ Khi hình thành phân tử H2S, mỗi nguyên tử H sẽ góp chung 1 electron với nguyên tử S để
tạo thành 2 cặp electron dùng chung.
- Sự tạo thành liên kết cộng hóa trị trong phân tử PH3:
+ Nguyên tử P có cấu hình electron là: 1s22s22p63s23p3 cần thêm 3 electron để đạt cấu hình
electron bền vững giống khí hiếm.
+ Nguyên tử H có cấu hình electron là: 1s1 cần thêm 1 electron để đạt được cấu hình electron
bền vững giống khí hiếm.
+ Khi hình thành phân tử PH3, mỗi nguyên tử H sẽ góp chung 1 electron với nguyên tử P để
tạo thành 3 cặp electron dùng chung. Bài 3
Viết công thức Lewis của các phân tử CS2 , SCl2 và CCl4 . Gợi ý đáp án
Phân tử CS2: Mỗi nguyên tử S sẽ góp chung 2 electron mới nguyên tử C tạo thành 4 cặp electron dùng chung:
Phân tử SCl2: Mỗi nguyên tử Cl sẽ góp chung 1 electron với nguyên tử S để tạo thành 2 cặp electron dùng chung.
Phân tử CCl4: Mỗi nguyên tử Cl sẽ góp 1 electron với nguyên tử C để tạo thành 4 cặp electron dùng chung. Bài 4
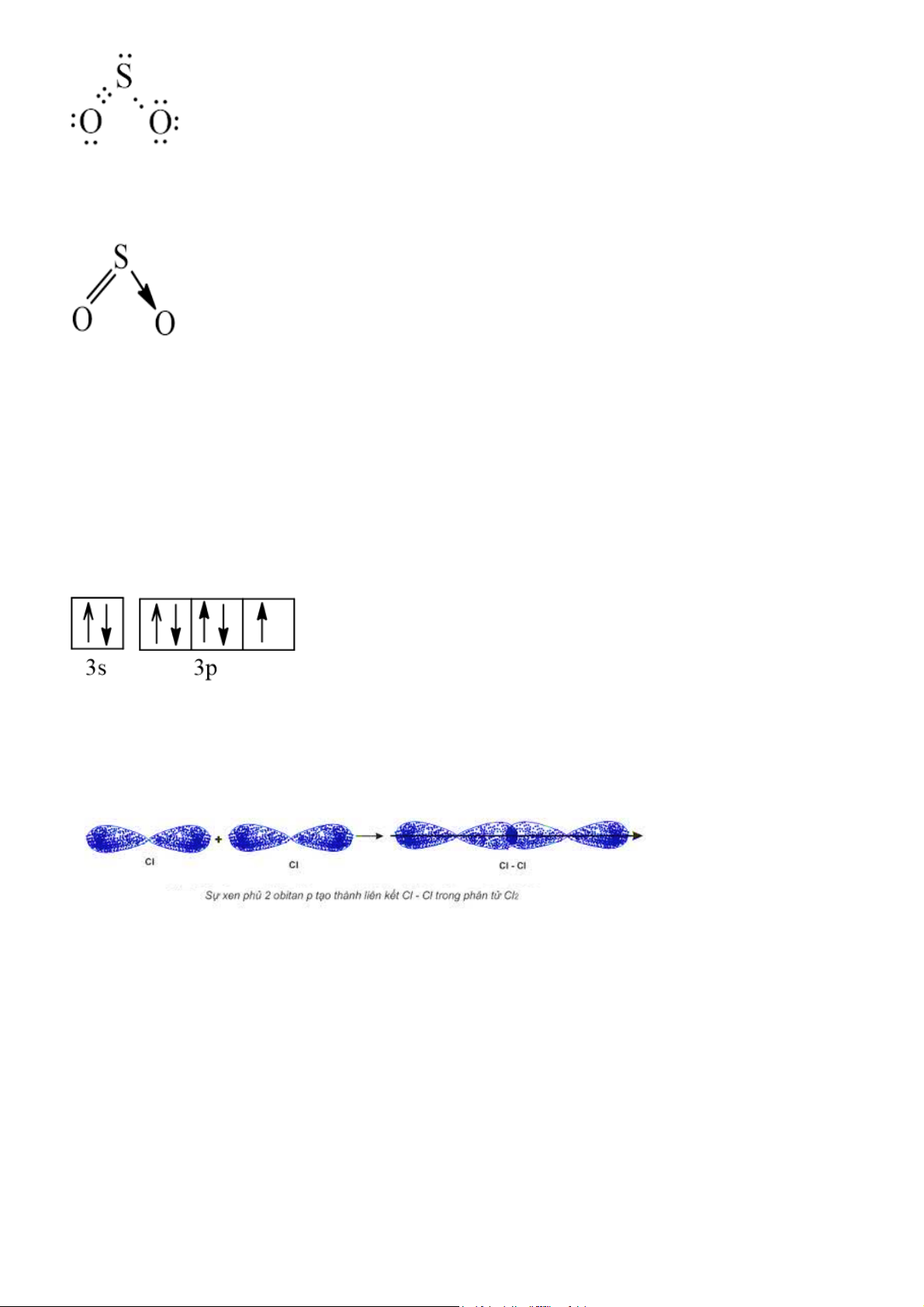
Trình bày sự hình thành liên kết cho – nhận trong phân tử sulfur dioxide (SO2). Gợi ý đáp án
+ O và S đều có 6 electron ở lớp ngoài cùng, đều cần nhận thêm 2 electron để đạt được cấu
hình bền vững của khí hiếm.
+ Khi hình thành phân tử SO2, một nguyên tử O góp chung 2 electron với nguyên tử S để tạo
thành 2 cặp electron dùng chung. Nguyên tử O còn lại chưa được liên kết, trong khi đó nguyên
tử S vẫn còn 2 đôi electron chưa tham gia liên kết, do đó nguyên tử S sẽ cho nguyên tử O
chưa tham gia liên kết 1 cặp electron để dùng chung. + Công thức electron: Công thức cấu tạo: Bài 5
Mô tả sự tạo thành liên kết trong phân tử chlorine bằng sự xen phủ của các AO. Gợi ý đáp án
Cấu hình electron lớp ngoài cùng của nguyên tử chlorine được biểu diễn trên các orbital như sau:
Sự hình thành liên kết giữa hai nguyên tử chlorine là do sự xen phủ trục giữa hai AO p chứa
electron độc thân của mỗi nguyên tử chlorine. Li ên kết được tạo thành giữa hai nguyên tử chlorine là liên kết σ. Bài 6
Sự xen phủ giữa hai orbital p trong trường hợp nào sẽ tạo thành liên kết σ? Trong trường hợp
nào sẽ tạo thành liên kết π? Cho ví dụ Gợi ý đáp án
Khi các nguyên tử liên kết với nhau, các AO phải được sắp xếp ở vị trí phù hợp. Chẳng hạn khi
hình thành phân tử giữa hai nguyên tử, vị trí của các AO như sau:
Khi đó, hai AO pz nằm dọc trên cùng một trục nên chỉ có thể xen phủ trục với nhau (chỉ tạo thành liên kết σ).
Còn hai AO px (hoặc hai AO py) là song song nên chỉ có thể xen phủ bên với nhau (tạo thành liên kết π). Bài 7
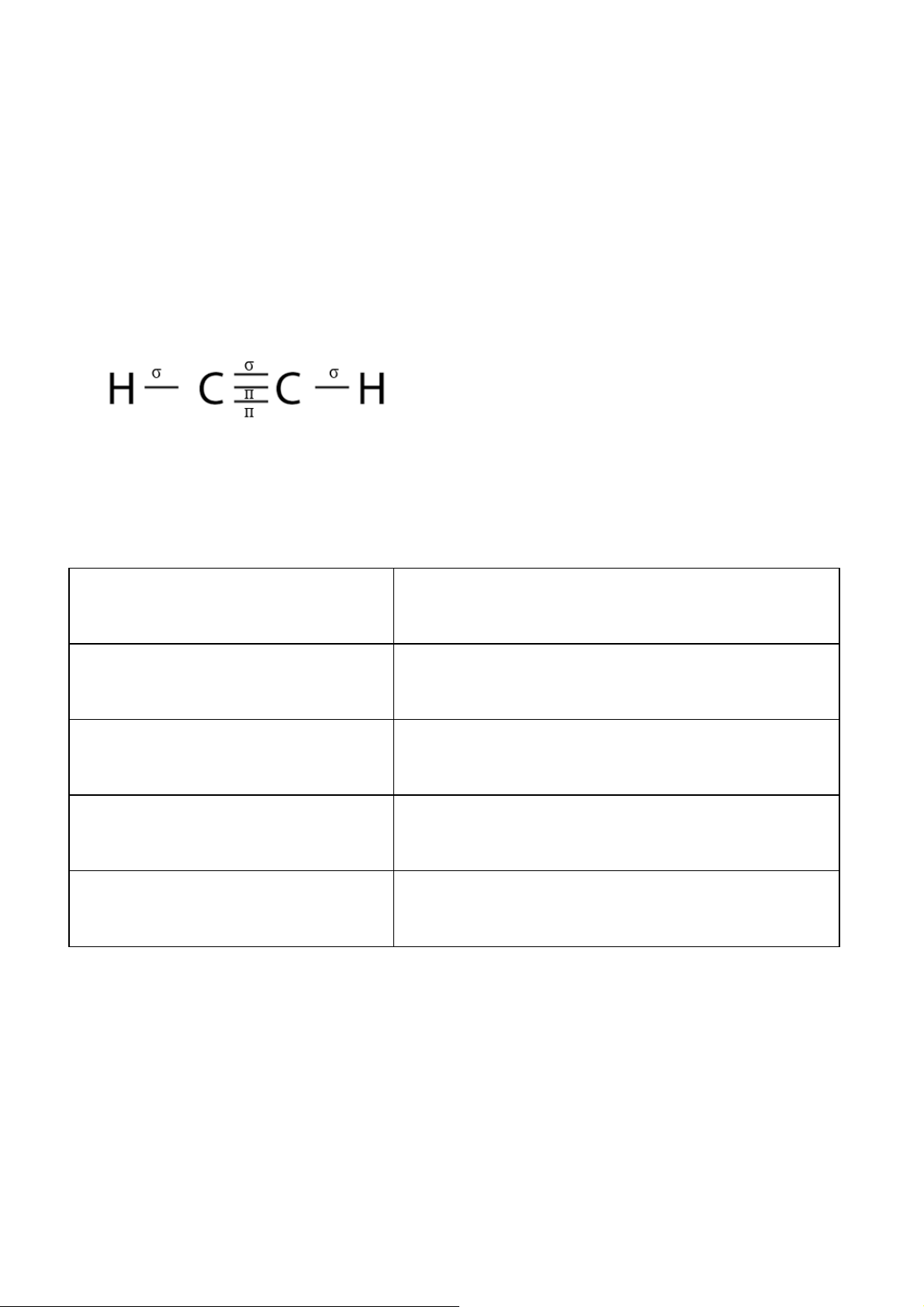
Cho biết số liên kết σ và liên kết π trong phân tử acetylene (C2H2). Gợi ý đáp án
Phân tử C2H2 gồm 3 liên kết σ và 2 liên kết π. Cụ thể: Bài 8
Năng lượng liên kết của các hydrogen halide được liệt kê trong bảng sau: Hydrogen halide
Năng lượng liên kết (kJ/mol) HF 565 HCl 427 HBr 363 HI 295
Sắp xếp theo chiều tăng dần độ bền liên kết trong các phân tử HF, HCl, HBr và HI Gợi ý đáp án
Năng lượng liên kết là thước đo độ bền liên kết. Năng lượng liên kết càng lớn thì liên kết càng bền.
⇒ Sắp xếp theo chiều tăng dần độ bền liên kết: HI < HBr < HCl < HF.



