



Preview text:
Ion đa nguyên tử là gì? Chất nào dưới đây chứa ion đa nguyên tử?
1. Ion đa nguyên tử là gì? 1.1. Ion là gì?
Ion hay điện tích là một nguyên tử hay nhóm nguyên tử bị mất hay nhận
được thêm một hay nhiều elctron. Một ion mang điện tích âm, khi nó thu
được một hay nhiều electron được gọi là anion hay điện tích âm. Và một ion
mang điện tích dương khi nó mất đi một hay nhiều electron được gọi là cation
hay điện tích dương. Quá trình tạo ra các ion hay điện tích được gọi là ion hóa.
Kim loại có xu hướng tạo ra các cation ( mất đi election ) trong khi đó phi kim
lại có xu hướng tạo ra anion. 1.2. Ion đa nguyên tử
Một ion đa nguyên tử còn gọi là ion phân tử là một nhóm hai nguyên tử hoặc
phức chất ( không nhất thiết khác nhau ) trở lên liên kết cộng hóa trị với nhau,
có thể được coi là một đơn vị duy nhất và có điện tích khác không, tức nó
không trung hòa về điện.
Trong quá khứ, một số người gọi ion đa nguyên tử là gốc tự do . Trong thuật
ngữ hiện đại, từ gốc để chỉ các gốc tự do khác nhau, là những nguyên tử,
phân tử hoặc ion có electron độc thân mà không nhất thiết mang điện.
2. Tên gọi các ion đa nguyên tử
Có hai quy tắc có thể dùng để nhớ tên gọi của các anion đa nguyên tử
Đầu tiên khi tiền tố bi- được đặt trước tên, một nguyên tử hydro được thêm
vào công thức ion và điện tích của nó tăng lên 1. Một cách khác là sử dụng từ
hydro trong tên gọi: anion HCO3 tạo từ H+ và CO3 ( 2- )
Hầu hết các ion đa nguyên tử thường gặp đều là các anion oxi, base liên hợp
của axit oxi ( axit được tạo từ các oxit của các nguyên tố phi kim )
Ví dụ: anion sunfat SO4 ( 2- ) xuất phát từ H2SO4 có thể được coi là SO3 + H2O
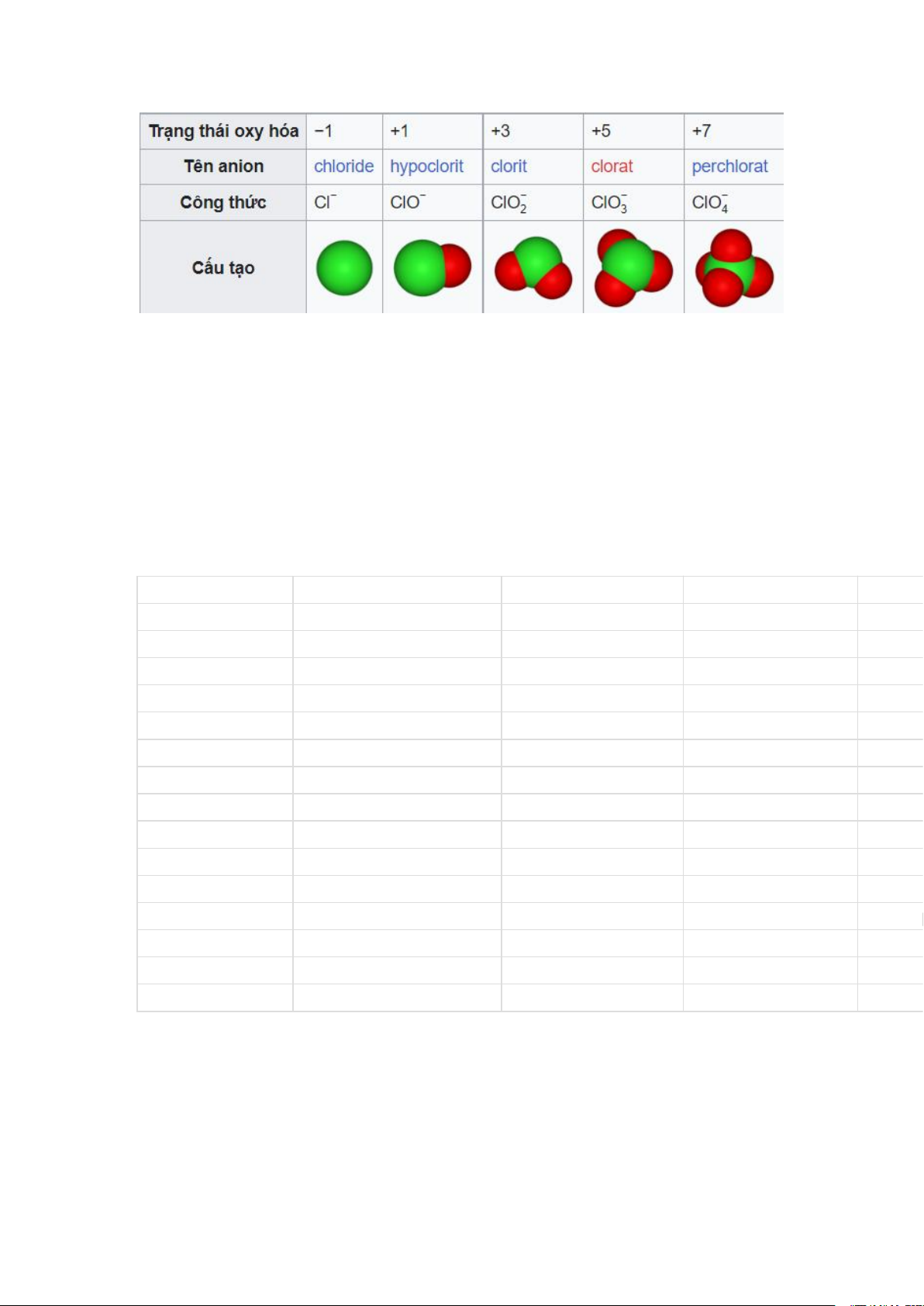
Quy tắc số hai là xét số nguyên tử oxi trong ion. Xét họ anion oxi của clo:
Đầu tiên coi đuôi - ate là tên của base, thêm tiền tố pe - là thêm một oxi. Đổi
hậu tố - at thành - it làm giảm một oxi và giữ hậu tố - it và thêm tiền tố hypo -
giảm thêm một oxi. Trong tất cả các trường hợp, điện tích của ion không đổi.
Cách đặt tên này đúng cho nhiều họ anion oxi dựa trên một ion gốc cho họ đó.
Hậu tố - it có ít hơn một oxi so với đuôi - at nhưng những anion - at khác
nhaucos thể có số nguyên tử oxi khác nhau.
Hai quy tắc trên không đúng cho tất cả các ion đa nguyên tử nhưng chúng
đúng cho hầu hết các anion thường gặp.
Bảng sau đưa ra ví dụ về một số họ anion phổ biến bromide hypobromit bromit bromat pebromat Br - BrO - BrO2 - BrO3 - BrO4 - iodide hypoiotit iotit iotat prioat I - IO - IO2 - IO3 - IO4 - sulfide hyposunfit sunfit sunfat pesunfat S ( 2- ) S2O2 ( 2- ) SO3 ( 2-) SO4 ( 2- ) SO5 ( 2- ) selenide hyposelenide selenide selenat Se ( 2- ) Se2O2 ( 2- ) SeO3 ( 2- ) SeO4 ( 2- ) telurua hypotelurit telurit telurat Te ( 2- ) TeO2 ( 2- ) TeO3 ( 2- ) TeO4 ( 2- ) nitride hyponitrit nitrit nitrat N ( 3- ) N2O2 ( 2- ) NO2 ( - ) NO3 ( - ) phosphua hypophosphit phosphit phosphat pephosphat P ( 3- ) H2PO2 ( - ) PO3 ( 3- ) PO4 ( 3- ) PO5 ( 3- ) arenua hypoasenit arsenit arsenat As ( 3- ) AsO2 ( 3- ) AsO3 ( 3- ) AsO4 ( 3- )
3. Chất nào dưới đây chứa ion đa nguyên tử
- Sự tạo thành ion: Nguyên tử luôn trung hòa về điện, nhưng khi nguyên tử
nhường hay nhận thêm electron thì nó trở thành phân tử mang điện gọi là ion.
- Một ion đa nguyên tử còn gọi là một nhóm hai nguyên tử hoặc phức chất
( không nhất thiết khác nhau ) trở lên liên kết cộng hóa trị với nhau, có thể
được coi là một đơn vị duy nhất và có điện tích khác không, tức nó khôn trung hòa về điện.
- Ion đa nguyên tử thường được xét trong hóa trị axit - base và sự hình thành
muối. Thông thường một ion đa nguyên tử có thể được coi là một axit hay
base liên hợp của một phân tử.
Ví dụ base liên hợp của axit sulfuric là ion đa nguyên tử hydro sunfat, loại bỏ
đi một ion hydro cho ta một anion sunfat.
- Trong các phản ứng hóa học, để đạt được cấu hình bền của khí hiếm,
nguyên tử lkim loại có khuynh hướng nhường electron lớp ngoài cùng cho
nguyên tử các nguyên tố khác để trở thành phân tử mang điện dương hay
gọi là ion dương hay cation.
- Trong các phản ứng hóa học, để đạt được cấu hình bền của khí hiếm,
nguyên tử phi kim có khuynh hướng nhận thêm electron của nguyên tử các
ngyên tố khác để trở thành phần tử mang điện âm gọi là ion âm hay anion.
- Tính chất chung của hợp chất ion:
Tinh thể ion rất bền vững vì lực hút tĩnh điện giữa các ion ngược dấu trong tinh thể lớn.
Các hợp chất ion đều khá rắn, khó nóng chảy, khó bay hơi.
Các hợp chất ion thường tan nhiều trong nước.
4. Sự khác biệt giữa nguyên tố đa hóa trị và ion đa nguyên tử
Sự khác biệt chính giữa nguyên tố đa hóa trị và ion đa nguyên tử là các
nguyên tố đa hóa trị có nhiều hơn một hóa trị trong khi các ion đa nguyên tử
có nhiều hơn một nguyên tử liên kết cộng hóa trị với nhau. Đa hóa trị có
nghĩa là nó được sử dụng nhiều hơn một điện tử để hình thành liên kết hóa
học trong khi đa nguyên tử có nghĩa là nó được sử dụng nhiều hơn một
nguyên tử để tạo thành ion. 5. Bài tập áp dụng
Câu 1: Liên kết ion được tạo thành giữa
A. hai nguyên tử kim loại B. hai nguyên tử phi kim
C. một nguyên tử kim loại mạnh và một nguyên tử phi kim mạnh
D. một nguyên tử kim loại yếu và một nguyên tử phi kim yếu.
Câu 2: Trong tinh thế NaCl, nguyên tố Na và Cl ở dạng ion và có số electrong lần lượt là A. 10 và 8 B. 12 và 16 C. 10 và 10 D. 11 và 17
Câu 3: Liên kết trong phân tử chất nào sau đây mang nhiều tính chất của liên kết ion nhất? A. LiCl B.NaCl C. KCl D. CsCl
Câu 4: Các chất trong dãy nào sau đây có liên kết ion? A. KBr, CS2, MgS B. KBr, MgO, K2O C. H2O, K2O, CO2 D. CH4, HBr, CO2
Câu 5: Nguyên tử của nguyên tố X có cấu hình electron 1s s p 3s 3p 4s ,
Nguyên tử của nguyên tố Y có cấu hình 1s s p . Liên kết hóa học giữa
nguyên tử X và nguyên tử Y thuộc loại liên kết A. kim loại B.cộng hóa trị C. ion D. cho - nhận
Câu 6: X, Y là những nguyên tố có điện tích hạt nhân lần lượt là 9, 19.
Cấu hình electron lớp ngoài cùng của nguyên tử X, Y và liên kết trong
hợp chất tạo thành từ X và Y là:
A. 2s 2p , 4s và liên kết cộng hóa trị
B. 2s 2p , 3s 3p và liên kết cộng hóa trị
C. 3s 3p , 4s và liên kết ion
D. 2s 2p , 4s và liên kết ion
Câu 7: Hầu hết các hợp chất ion
A. có nhiệt độ nóng chảy và nhiệt độ sôi cao
B. dễ hòa tan trong các nội dung môi hữu cơ
C. ở trạng thái nóng chảy không dẫn điện
D. tan trong nước thành dung dịch không điện ly
Câu 8: Bản chất của liên kết ion và lực hút tĩnh điện giữa A. 2 ion
B. 2 ion mang điện trái dấu
C. các hạt mang điện trái dấu
D. hạt nhân và các electron hóa trị
Câu 9: Chỉ ra nội dung sai khi nói về ion:
A. ion là phần tử mang điện
B. ion âm gọi là cation, ion dương gọi là anion
C. ion có thể chia thành ion đơn nguyên tử và ion đa nguyên tử
D. ion được hình thành khi nguyên tử nhường hay nhận electron
Câu 10: Liên kết hóa học giữa các ion được goi là:
A. liên kết anion - cation B. liên kết ion hóa C. liên kết tính điện D. liên kết ion
Document Outline
- Ion đa nguyên tử là gì? Chất nào dưới đây chứa ion
- 1. Ion đa nguyên tử là gì?
- 1.1. Ion là gì?
- 1.2. Ion đa nguyên tử
- 2. Tên gọi các ion đa nguyên tử
- 3. Chất nào dưới đây chứa ion đa nguyên tử
- 4. Sự khác biệt giữa nguyên tố đa hóa trị và ion đ
- 5. Bài tập áp dụng
- 1. Ion đa nguyên tử là gì?


