
Preview text:
Mẫu 1a
(Mẫu này dành cho tổ chuyên môn) SỞ GDĐT
KẾ HOẠCH GIÁO DỤC MÔN HỌC - NĂM HỌC 2020-2021
TRƯỜNG THPT TỔ: HÓA HỌC MÔN: HÓA HỌC KHỐI: 12 I. Thông tin: 1. Tổ trưởng: 2. Tổ Phó:
II. Kế hoạch cụ thể: HỌC KỲ I
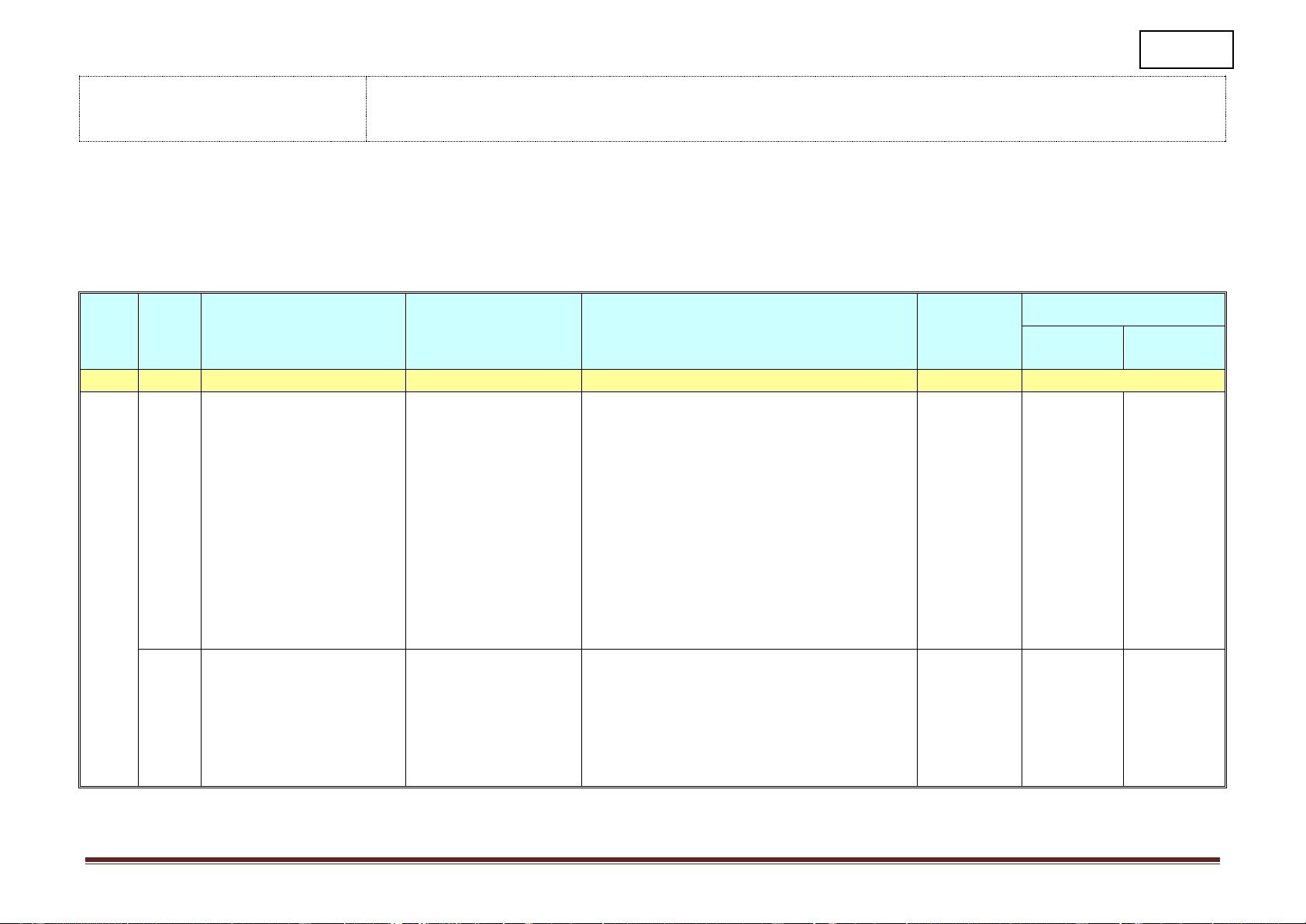
Từ tuần 1 đến tuần 18 (thực học) Hình thức Nội dung/Mạ Ghi chú Tuần ch kiến Tiết
Tên chủ đề/Bài học
Yêu cầu cần đạt tổ chức dạy thức Nội dung Hướng dẫn học điều chỉnh thực hiện (1) (2) (3) (4) (5) (6) (7)
I.Lý thuyết cần nhớ
-Nêu được khái niệm, đặc điểm cấu tạo phân Dạy học tại (ancol, andehit, axit
tử, danh pháp (gốc -chức), phương pháp điều lớp kết hợp cacboxylic)
chế của một số hợp chất tiêu biểu (hc no,không với hướng 1.Khái niệm, danh
no,thơm, ancol, andehit, axitcacboxylic). dẫn hs tự pháp
-Trình bày được tính chất hóa học và viết các học ở nhà 3. Tính chất hóa học
phương trình hoá học minh hoạ tính chất hoá bằng phiếu 1 Ôn tập đầu năm 4. điều chế
học của hợp chất norìn chức. hướng dẫn II.Bài tập.
-Làm bt về m, % m chất trong hỗn hợp phản học tập 1.Tính mchất trong
ứng, xác định CTPT HCHC. 1 phản ứng, %m trong hỗn hợp. 2.Xác định CTPT. 1. Khái niệm, danh
-Nêu được khái niệm, đặc điểm cấu tạo phân Dạy học tại Mục IV. Không dạy pháp
tử, danh pháp (gốc -chức) của este, tính chất lớp/phòng Điều chế cách điều
2. Tính chất vật lí, ứng vật lí, phương pháp điều chế bằng phản ứng học bộ môn chế este từ 2 Bài 1. Este dụng
este hoá và ứng dụng của một số este tiêu biểu. kết hợp với axetilen và 3. Tính chất hóa học
-Trình bày được tính chất hóa học và viết các hướng dẫn axit 4. Điều chế
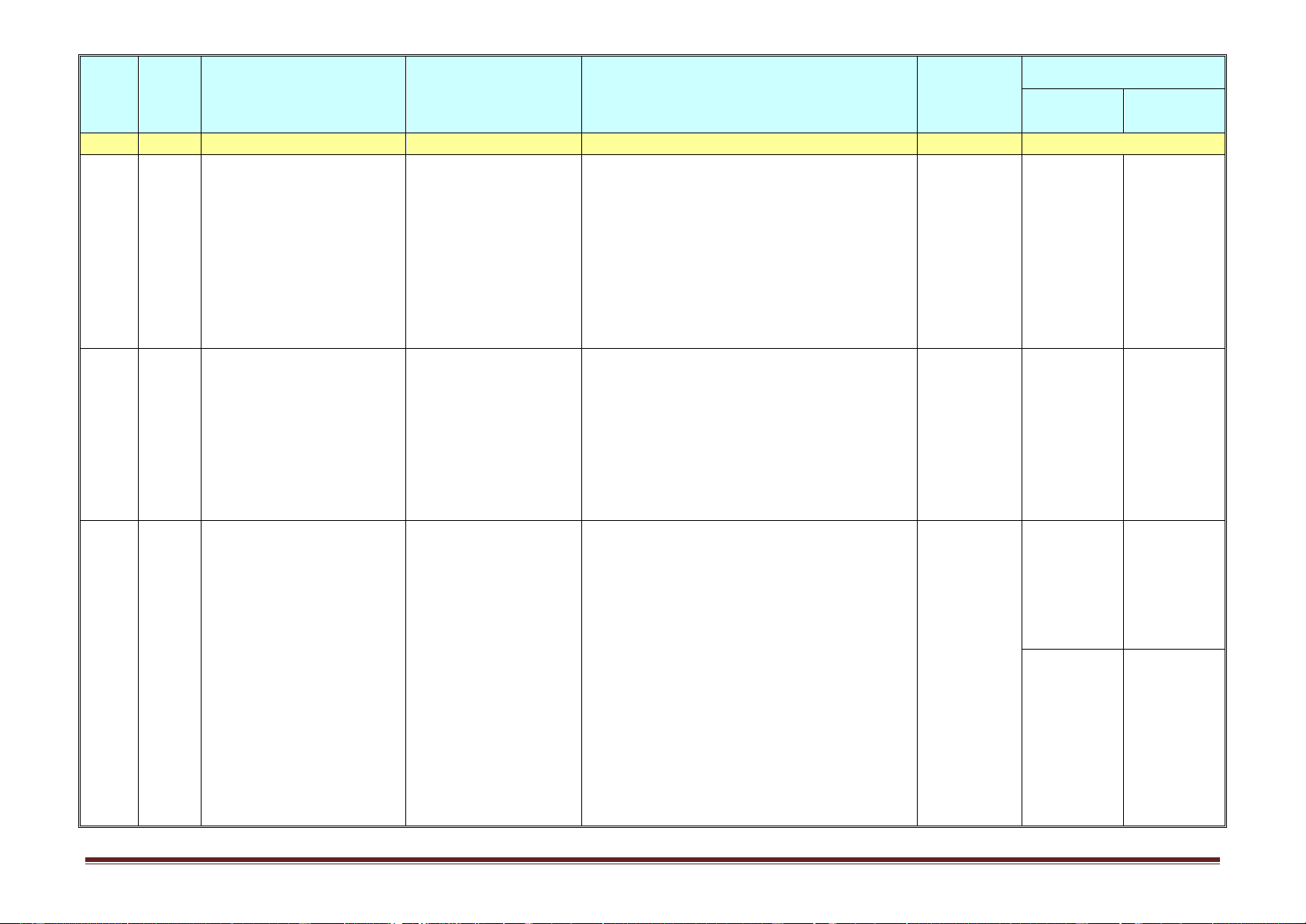
phương trình hoá học minh hoạ tính chất hoá HS tự học ở Trang 1 Hình thức Nội dung/Mạ Ghi chú Tuần ch kiến Tiết
Tên chủ đề/Bài học
Yêu cầu cần đạt tổ chức dạy thức Nội dung Hướng dẫn học điều chỉnh thực hiện (1) (2) (3) (4) (5) (6) (7)
học của este no, đơn chức. nhà bằng Mục V. Tự học có
-Giải thích được este không tan trong nước và Phiếu hướng Ứng dụng hướng dẫn
có nhiệt độ sôi thấp hơn axit đồng phân. dẫn học tập
-Viết được công thức cấu tạo của este có tối 2 3 đa 4 nguyên tử cacbon.
-Phân biệt được este với các chất khác như
ancol, axit,.. bằng phương pháp hoá học.
-Tính khối lượng các chất trong phản ứng xà phòng hoá.
I.Kiến thức cần nhớ
-Nêu được khái niệm, đặc điểm cấu tạo phân Dạy học tại 1.CTCT-Danh pháp
tử, danh pháp (gốc -chức) của este, lớp kết hợp 2.Tính chất hóa học
-Trình bày được tính chất hóa học và viết các với hướng 3. Điều chế
phương trình hoá học minh hoạ tính chất hoá dẫn HS tự 2 4 Luyện tập: Este II.Bài tập vận dụng
học của este no, đơn chức. học ở nhà 1.Tính m,%m chất
-Tính khối lượng các chất trong phản ứng xà bằng Phiếu trong phản ứng phòng hoá. XĐ CTPT hướng dẫn 2.Xác định CTPT học tập I. Khái niệm lipit
-Nêu được khái niệm lipit, chất béo, tính chất Dạy học tại Mục II.4. Tự học có II. Chất béo
vật lí, ứng dụng của chất béo. lớp/phòng Ứng dụng hướng dẫn -Khái niệm
+ Cách chuyển hoá chất béo lỏng thành chất học bộ -Tính chất vật lí
béo rắn, phản ứng oxi hoá chất béo bởi oxi môn/phòng -Tính chất hóa học không khí. thí nghiệm -Ứng dụng
-Trình bày được tính chất hoá học (tính chất kết hợp với
chung của este và phản ứng hiđro hoá chất béo hướng dẫn Bài tập 4, 5 Không yêu 3 5 Bài 2. Lipit
lỏng) và viết được các phương trình hoá học HS tự học ở cầu học sinh
minh hoạ tính chất hoá học của chất béo. nhà bằng làm
-Phân biệt được dầu ăn và mỡ bôi trơn về Phiếu hướng thành phần hoá học. dẫn học tập
-Biết cách sử dụng, bảo quản được một số
chất béo an toàn, hiệu quả.
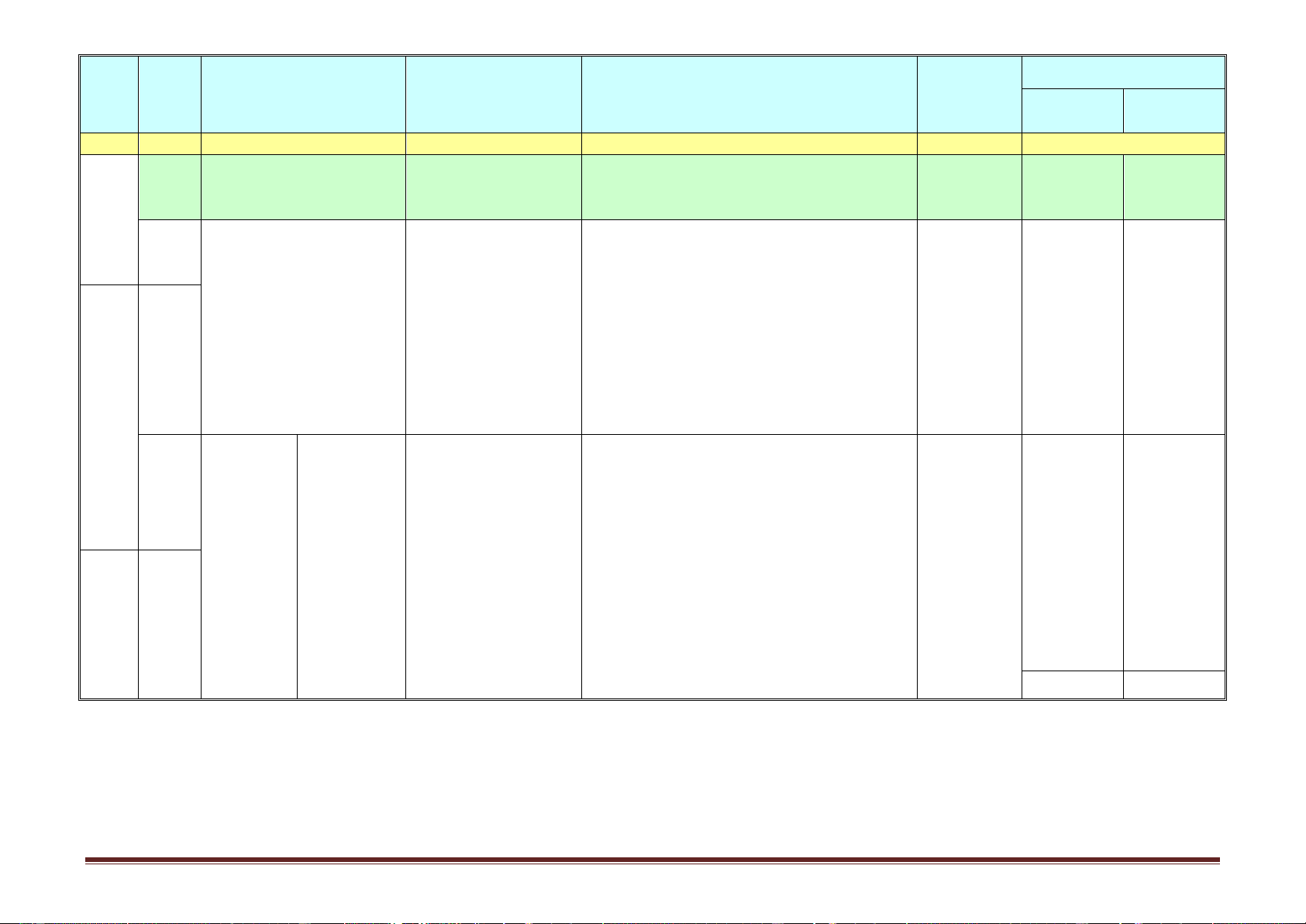
-Tính khối lượng chất béo trong phản ứng. Trang 2 Hình thức Nội dung/Mạ Ghi chú Tuần ch kiến Tiết
Tên chủ đề/Bài học
Yêu cầu cần đạt tổ chức dạy thức Nội dung Hướng dẫn học điều chỉnh thực hiện (1) (2) (3) (4) (5) (6) (7)
Bài 3. Khái niệm về xà Khuyến
phòng và chất giặt rửa Cả bài khích học tổng hợp sinh tự đọc Tiết 6.
-Nêu được khái niệm, đặc điểm cấu tạo phân Dạy học tại
I. Kiến thức cần nhớ
tử, danh pháp (gốc -chức) của este, lớp kết hợp 6
Bài 4. Luyện tập: Este và -CTCT, danh pháp
-Trình bày được tính chất hóa học và viết các với hướng chất béo -Tính chất hóa học,
phương trình hoá học minh hoạ tính chất hoá dẫn HS tự điều chế
học của este no, đơn chức. Xà phòng hóa chất học ở nhà Tiết 7. béo. bằng Phiếu 7
II. Bài tập vận dụng
-Tính khối lượng các chất trong phản ứng xà hướng dẫn -Tính m, %m phòng hoá. học tập -Xác định CTPT,
-Xác định CTPT, CTCT CTCT 4 Bài 5.
Tiết 8. HĐ trải nghiệm
-Nêu được khái niệm, phân loại cacbohiđrat,
Dạy học tại -Phần tính -Tự học có Glucozơ kết nối + Hình thành
công thức phân tử, đặc điểm cấu tạo, tính chất lớp/phòng chất vật lí, hướng dẫn 8 Chủ đề 1: Bài 6. kiến thức về
vật lí (trạng thái, màu, mùi, nhiệt độ nóng học bộ trạng thái tự CACBO- Saccarozơ,
tính chất vật lí, trạng
chảy, độ tan), ứng dụng của glucozơ, môn/phòng nhiên, ứng HIĐRAT tinh bột và
thái tự nhiên, điều chế, saccarozơ, tinh bột và xenlulozơ. thí nghiệm dụng của xenlulozơ ứng dụng.
-Viết được công thức cấu tạo dạng mạch hở kết hợp với glucozơ, Bài 7: Luyện của glucozơ, fructozơ. hướng dẫn saccarozơ, tập cấu tạo
Tiết 9. Hình thành kiến
-Trình bày được tính chất hóa học và viết HS tự học ở tinh bột và và tính chất
thức về cấu tạo phân tử được các PTHH chứng minh tính chất hoá học nhà bằng xenlulozơ 5 9 của và tính chất hóa học
của glucozơ, fructozơ, saccarozơ, tinh bột và Phiếu hướng cacbohiđrat
xenlulozơ (tính chất ancol đa chức của dẫn học tập
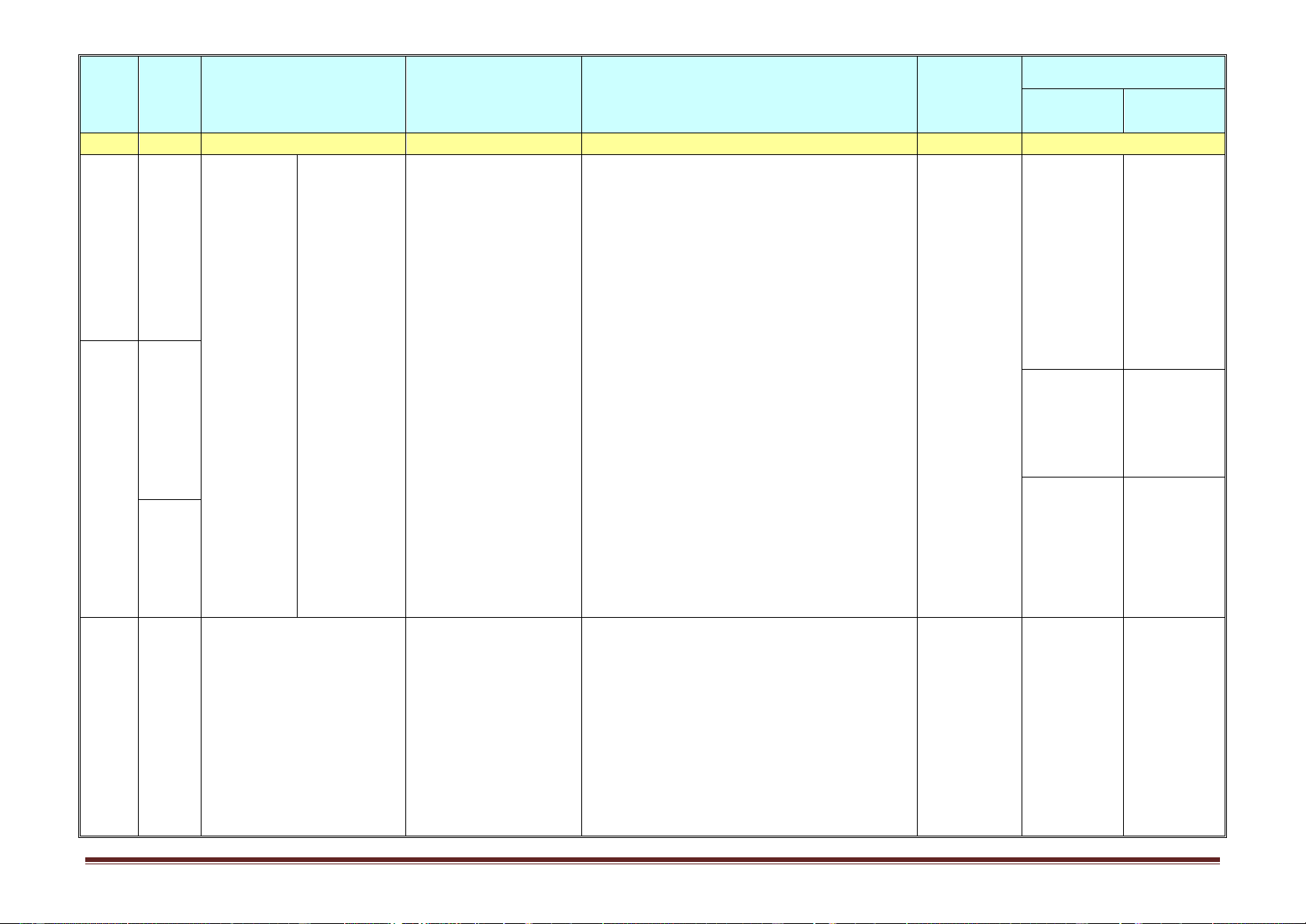
glucozơ, fructozơ, saccarozơ; tính chất anđehit Trang 3 Hình thức Nội dung/Mạ Ghi chú Tuần ch kiến Tiết
Tên chủ đề/Bài học
Yêu cầu cần đạt tổ chức dạy thức Nội dung Hướng dẫn học điều chỉnh thực hiện (1) (2) (3) (4) (5) (6) (7)
đơn chức, lên men rượu của glucozơ; phản ứng Bài 5: -Mục Không dạy
Tiết 10. Hình thành
thủy phân saccarozơ, tinh bột và xenlulozơ; III. 2.b. Oxi phản ứng
kiến thức về tính chất
phản ứng màu với iot của tinh bột; phản ứng hóa glucozơ oxi hóa hóa học (tt)
với axit nitric của xenlulozơ) bằng glucozơ, 10
-Dự đoán được tính chất hóa học dựa vào cấu Cu(OH)2 fructozơ tạo phân tử. -Mục V. bằng
-Phân biệt các dung dịch : saccarozơ, Fructozơ Cu(OH)2
glucozơ, glixerol bằng phương pháp hoá học. trong môi
-Tinh khối lượng glucozơ thu được từ phản trường kiềm Tiết 11.Hình thành
ứng thuỷ phân các chất theo hiệu suất.
kiến thức về Tính chất Mục I.4.a. Khuyến hóa học (tt) + HĐ Sơ đồ sản khích học 11 luyện tập. xuất đường sinh tự đọc từ cây mía (Bài 6) 6 Bài tập 1 Không yêu
Tiết 12. HĐ luyện tập (Bài 7) cầu học sinh (tt) + Tìm tòi mở rộng làm 12 Kiểm tra 15 phút lần 1 1. Làm thí nghiệm.
-Thực hiện được các thí nghiệm Dạy học tại Thí nghiệm Không tiến
Bài 8. Thực hành: Điều -Điều chế etyl axetat
-Sử dụng dụng cụ hoá chất để tiến hành an phòng thí 3 hành phần
chế, tính chất hóa học của -Phản ứng xà phòng
toàn, thành công các thí nghiệm trên. nghiệm đun nóng este và cacbohiđrat hoá chất béo
-Quan sát, nêu hiện tượng thí nghiệm, giải ống nghiệm -Phản ứng của glucozơ
thích và viết các phương trình hoá học, rút ra 7 13 với Cu(OH)2 nhận xét. Đánh giá
-Phản ứng của hồ tinh
-Viết tường trình thí nghiệm. lấy điểm bột với iot. thường 2. Viết tường trình xuyên Trang 4 Hình thức Nội dung/Mạ Ghi chú Tuần ch kiến Tiết
Tên chủ đề/Bài học
Yêu cầu cần đạt tổ chức dạy thức Nội dung Hướng dẫn học điều chỉnh thực hiện (1) (2) (3) (4) (5) (6) (7) Tiết 14.
-Nêu được khái niệm, phân loại, cách gọi tên Dạy học tại Mục III.2.a) Không yêu
1. Khái niệm, phân loại (theo danh pháp thay thế và gốc -chức), đặc lớp/phòng
Thí nghiệm cầu học sinh Bài 9. Amin và danh pháp
điểm cấu tạo phân tử , tính chất vật lí (trạng học bộ 1 giải thích 14 2. Tính chất vật lí
thái, màu, mùi, độ tan) của amin. môn/phòng tính bazơ
-Trình bày được tính chất hóa học điển hình thí nghiệm
của amin là tính bazơ, anilin có phản ứng thế
với brom trong nước và viết được các PTHH Bài tập 4 Không yêu
minh họa tính chất. Phân biệt anilin và phenol cầu học sinh
bằng phương pháp hoá học. làm Tiết 15.
-Viết được công thức cấu tạo của các amin
3. Cấu tạo phân tử và
đơn chức, xác định được bậc của amin theo tính chất hóa học công thức cấu tạo. 15
-Quan sát mô hình, thí nghiệm,. . rút ra được
nhận xét về cấu tạo và tính chất. 8
-Dự đoán được tính chất hóa học của amin và
anilin. -Xác định công thức phân tử theo số liệu đã cho. Tiết 16.
-Nêu được định nghĩa, đặc điểm cấu tạo phân Dạy học tại 1. Khái niệm
tử, ứng dụng quan trọng của amino axit. lớp/phòng 16 Bài 10. Amino axit 2. Cấu tạo phân tử
-Trình bày được tính chất hóa học của amino học bộ 3. Ứng dụng
axit (tính lưỡng tính; phản ứng este hoá; phản môn/phòng
ứng trùng ngưng của và -amino axit). thí nghiệm
-Viết được các PTHH chứng minh tính chất của amino axit.
-Dự đoán được tính lưỡng tính của amino axit,
Tiết 17. Tính chất hóa
kiểm tra dự đoán và kết luận. 9 17 học + Luyện tập
-Phân biệt dung dịch amino axit với dung dịch
chất hữu cơ khác bằng phương pháp hoá học. Trang 5 Hình thức Nội dung/Mạ Ghi chú Tuần ch kiến Tiết
Tên chủ đề/Bài học
Yêu cầu cần đạt tổ chức dạy thức Nội dung Hướng dẫn học điều chỉnh thực hiện (1) (2) (3) (4) (5) (6) (7) Tiết 18.
-Nêu được định nghĩa, đặc điểm cấu tạo phân Dạy học tại Mục III. Không dạy
Bài 11. Peptit và protein I. Peptit
tử, tính chất hoá học của peptit (phản ứng thuỷ lớp/phòng Khái niệm 18 1. Khái niệm
phân), khái niệm, đặc điểm cấu tạo, tính chất học bộ về enzim và 2. Tính chất hóa học
của protein (sự đông tụ; phản ứng thuỷ phân, môn/phòng axit nucleic
phản ứng màu của protein với Cu(OH)2). Vai thí nghiệm Thí nghiệm Tích hợp Tiết 19.
trò của protein đối với sự sống.
1, 2 (bài 16) khi dạy học II. Protein
-Viết được các PTHH minh họa tính chất hóa bài 11 1. Khái niệm
học của peptit và protein. 19 2. Cấu tạo phân tử
-Phân biệt dung dịch protein với chất lỏng 3. Tính chất khác.
1. Kiến thức cần nhớ Dạy học tại
Bài 12. Luyện tập : Cấu 2. Bài tập vận dụng lớp kết hợp 10
tạo và tính chất của amin, với hướng amino axit và protein dẫn HS tự 20 học ở nhà bằng Phiếu hướng dẫn học tập Tiết 21.
-Khái niệm, CT chung, đặc điểm cấu tạo, tính Dạy học tại
Ôn tập kiểm tra giữa học
I. Kiến thức cần nhớ
chất, ứng dụng điều chế, viết các phản ứng xảy lớp kết hợp kì 1 1. Khái niệm
ra. So sánh cấu tạo tính chất của các chất (este- với hướng 2. Cấu tạo phân tử
chất béo, amin, aminoaxit, peptit, protein.) dẫn HS tự 3. Tính chất
-Tổng hợp các phản ứng giống nhau, khác học ở nhà 4.Ứng dụng-Điều chế
nhau, đặc biệt… của các chất bằng Phiếu 21, hướng dẫn 11 22 Tiết 22.
-Bài tập theo 4 mức độ nhận thức học tập II.Bài tập Phân dạng bài tập -Theo tính chất các chất -Theo bản chất hóa học -Theo thuật toán. Trang 6 Hình thức Nội dung/Mạ Ghi chú Tuần ch kiến Tiết
Tên chủ đề/Bài học
Yêu cầu cần đạt tổ chức dạy thức Nội dung Hướng dẫn học điều chỉnh thực hiện (1) (2) (3) (4) (5) (6) (7) I. Lý thuyết
-Theo ma trận, bảng đặc tả của SGD Trường tổ 1. Khái niệm chức 2. Cấu tạo phân tử 3. Tính chất
Kiểm tra giữa học kì 1 4.Ứng dụng-Điều chế II.Bài tập Phân dạng bài tập -Theo tính chất các chất -Theo bản chất hóa học 1. Khái niệm
-Nêu được khái niệm, đặc điểm cấu tạo, tính Dạy học tại -Mục I. Tự học có
Bài 13. Đại cương về 2. Đặc điểm cấu trúc
chất vật lí ( trạng thái, nhiệt độ nóng chảy, cơ lớp kết hợp Khái niệm hướng dẫn polime 3. Tính chất vật lí
tính), ứng dụng, một số phương pháp tổng hợp với hướng -Mục III. 5. Phương pháp điều
polime (trùng hợp, trùng ngưng). dẫn HS tự Tính chất chế
-Viết được công thức cấu tạo của polime từ học ở nhà vật lí 23 6. Ứng dụng monome và ngược lạI. bằng Phiếu -Mục VI.
-Viết được các PTHH tổng hợp một số polime hướng dẫn Ứng dụng 12 thông dụng. học tập Mục IV.
-Phân biệt được polime thiên nhiên với polime Tính chất Không dạy
tổng hợp hoặc nhân tạo. hóa học Tiết 24.
-Nêu được khái niệm, thành phần chính, sản Dạy học tại -Phần nhựa 24
Bài 14. Vật liệu polime 1. Chất dẻo
xuất và ứng dụng của chất dẻo, vật liệu lớp kết hợp Rezol, Rezit compozit, tơ, cao su. với hướng -Mục IV. Không dạy Tiết 25.
-Viết các PTHH cụ thể điều chế một số chất dẫn HS tự Keo dán 2. Tơ dẻo, tơ, cao su. học ở nhà tổng hợp 3. Cao su
-Sử dụng và bảo quản được một số vật liệu bằng Phiếu 13 25 polime trong đời sống. hướng dẫn Thí nghiệm Tích hợp học tập 3 (bài 16) khi dạy bài 14 Trang 7 Hình thức Nội dung/Mạ Ghi chú Tuần ch kiến Tiết
Tên chủ đề/Bài học
Yêu cầu cần đạt tổ chức dạy thức Nội dung Hướng dẫn học điều chỉnh thực hiện (1) (2) (3) (4) (5) (6) (7)
Bài 15. Luyện tập polime
1. Kiến thức cần nhớ
-Khái niệm, đặc điểm cấu tạo, tính chất vật ứng Dạy học tại Kiểm tra
và vật liệu polime -Khái niệm, cấu tạo
dụng, một số phương pháp tổng hợp polime lớp kết hợp 15 phút -Phân loại
(trùng hợp, trùng ngưng). với hướng lần 2 -Tính chất
-Viết được công thức cấu tạo của polime từ dẫn HS tự 26 -Điều chế monome và ngược lạI. học ở nhà -Ứng dụng
-Viết được các PTHH tổng hợp một số polime bằng Phiếu 2. Bài tập vận dụng thông dụng. hướng dẫn -Tính m, H
-Phân biệt được polime thiên nhiên với polime học tập
tổng hợp hoặc nhân tạo. 1. Làm thí nghiệm.
-Thực hiện được các thí nghiệm: Thí nghiệm Tích hợp TN 1: Sự đông tụ của
-Sử dụng dụng cụ hoá chất để tiến hành an 1, 2 khi dạy học Pr khi đun nóng
toàn, thành công các thí nghiệm trên. bài 11 TN 2: Phản ứng màu
-Quan sát, nêu hiện tượng thí nghiệm, giải Tích hợp biure
thích và viết các phương trình hoá học, rút ra
Thí nghiệm khi dạy học
Bài 16. Thực hành một số tính TN 3: Tính chất của 1 nhận xét. 3 bài 14
chất của protein và vật liệu polime vài polime khi đun
-Viết tường trình thí nghiệm. nóng Thí nghiệm Không làm TN 4: Phản ứng của 1 4
vài vật liệu polime với kiềm 2. Viết tường trình
Bài 17. Vị trí của kim loại 1. Vị trí của kim loại
-Nêu được vị trí của kim loại trong BTH, đặc Dạy học tại Mục 2.a; Không dạy
trong bảng tuần hoàn và trong BTH
điểm cấu hình lớp electron ngoài cùng của lớp/phòng 2.b; 2.c (các
cấu tạo của kim loại
2. Cấu tạo của kim loại nguyên tử kim loại, liên kết kim loạI. học bộ môn kiểu mạng 27
-So sánh bản chất của liên kết kim loại với liên tinh thể kim
kết ion và cộng hoá trị. loại) 14
Bài 18. Tính chất của kim Tiết 28.
-Nêu được tính chất vật lí chung (ánh kim, dẻo, Dạy học tại
loại – Dãy điện hóa của 1. Tính chất vật lí
dẫn điện và dẫn nhiệt tốt), tính chất hoá học lớp/phòng 28 kim loại
chung là tính khử (khử phi kim, ion H+ trong học bộ
nước, dung dịch axit , ion kim loại trong dung môn/phòng
dịch muối), quy luật sắp xếp trong dãy điện thí nghiệm Trang 8 Hình thức Nội dung/Mạ Ghi chú Tuần ch kiến Tiết
Tên chủ đề/Bài học
Yêu cầu cần đạt tổ chức dạy thức Nội dung Hướng dẫn học điều chỉnh thực hiện (1) (2) (3) (4) (5) (6) (7) Tiết 29.
hóa các kim loại (các nguyên tử được sắp xếp 2. Tính chất hóa học
theo chiểu giảm dần tính khử, các ion kim loại 29
được sắp xếp theo chiểu tăng dần tính oxi hoá) và ý nghĩa của nó. 15 Tiết 30
-Dự đoán được chiều phản ứng oxi hóa -khử 3. Dãy điện hóa của
dựa vào dãy điện hoá. kim loại
-Viết được các PTHH phản ứng oxi hoá -khử 30
chứng minh tính chất của kim loại.
-Tính % khối lượng kim loại trong hỗn hợp.
Bài 22. Luyện tập: Tính
1. Kiến thức cần nhớ
-Tính chất vật lí chung của KL. Dạy học tại
chất của kim loại -Tính chất vật lí
-Dự đoán được chiều phản ứng oxi hóa -khử lớp -Tính chất hóa học
dựa vào dãy điện hoá . 31 -Dãy điện hóa của KL
-Viết được các PTHH phản ứng oxi hoá -khử 2. Bài tập vận dụng
chứng minh tính chất của kim loại. 16
-Tính % khối lượng kim loại trong hỗn hợp.
Ôn tập kiểm tra cuối kỳ 1 I.Hóa hữu cơ
Theo ma trận, bảng đặc tả của SGD Dạy học tại -Khái niệm, CT chung lớp kết hợp 32 -Danh pháp với hướng -Tính chất dẫn HS tự -Ứng dụng-điều chế học ở nhà II.Hóa vô cơ bằng Phiếu -Cấu tạo nguyên tử, hướng dẫn đơnchất học tập 33, 17 -Tính chất lý-hóa 34 -Ăn mòn KL, chống AMKL -Ứng dụng điều chế Tổng hợp các bài ôn
Theo ma trận, bảng đặc tả của SGD Lịch SGD 18
Kiểm tra cuối kì 1 tập Trường thực hiện Trang 9 HỌC KỲ II
Từ tuần 19 đến tuần 35 (thực học) Tuần Ghi chú (7) (1) Hình thức Tiết
Tên chủ đề /Bài học Yêu cầu cần đạt Nội dung/Mạ ch kiến thức (4) tổ chức Nội dung (2) (3) (5) dạy học (6) Hướng dẫn thực điều chỉnh hiện Bài 19. Hợp kim
Tiết 35. HỢP KIM
- Nêu được khái niệm hợp kim, tính chất Dạy học tại Cả bài 19 Tự học có hướng 35
I – KHÁI NIỆM :
(dẫn nhiệt, dẫn điện, nhiệt độ nóng lớp kết hợp dẫn II – TÍNH CHẤT
chảy.. ), ứng dụng của một số hợp kim với hướng III – ỨNG DỤNG (thép không gỉ, đuyara). dẫn HS tự
Các nội dung Tích hợp khi dạy 19
- Sử dụng có hiệu quả một số đồ dùng học ở nhà luyện tập bài 20. Sự ăn mòn 36 Bài 20. Sự ăn mòn
Tiết 36.SỰ ĂN MÒN KIM LOẠI
bằng hợp kim dựa vào những đặc tính bằng Phiếu thuộc phần kim loại kim loại, luyện tập 1 - KHÁI NIỆM của chúng. hướng dẫn sự ăn mòn
2 - HAI DẠNG ĂN MÒN KIM
- Xác định % kim loại trong hợp kim. học tập kim loại (bài LOẠI
- Nêu được các khái niệm: ăn mòn kim 23)
1. Sự ăn mòn hoá học
loại, ăn mòn hoá học, ăn mòn điện
2. Ăn mòn điện hoá:
hoá,điều kiện xảy ra sự ăn mòn kim loại.
a – khái niệm ăn mòn điện hoá
- Trình bày được các biện pháp bảo vệ
b – Điều kiện ăn mòn điện hoá
kim loại khỏi bị ăn mòn. 37
c- Ăn mòn điện hóa học hợp kim - Phân biệt được ăn mòn hoá học và ăn
của sắt (gang, thép) trong không mòn điện hoá ở một số hiện tượng thực khí ẩm tế. : 20
- Sử dụng và bảo quản hợp lí một số đồ
3 - CHỐNG ĂN MÒN KIM LOẠI
dùng bằng kim loại và hợp kim dựa vào
1 - Phương pháp bảo vệ bề mặt
những đặc tính của chúng.
2 - Phương pháp điện hoá
Tiết 37. luyện tập
Tiết 38. ĐIỀU CHẾ KIM LOẠI
- Nêu được nguyên tắc chung và các Dạy học tại
Các nội dung Tích hợp khi dạy 38
I – NGUYÊN TẮC ĐIỀU CHẾ KIM
phương pháp điều chế kim loại (điện lớp kết hợp luyện tập bài 21. Điều chế
Bài 21. Điều chế kim LOẠI
phân, nhiệt luyện, dùng kim loại mạnh với hướng thuộc phần kim loại loại, luyện tập
II - PHƯƠNG PHÁP ĐIỀU CHẾ KIM
khử ion kim loại yếu hơn). dẫn HS tự điều chế kim LOẠI
- Lựa chọn được phương pháp điều chế học ở nhà loại (bài 23)
1. Phương pháp nhiệt luyện
kim loại cụ thể cho phù hợp. bằng Phiếu 39
2. Phương pháp thuỷ luyện
- Quan sát thí nghiệm, hình ảnh, sơ đồ... hướng dẫn
để rút ra nhận xét về phương pháp điều học tập
3. Phương pháp điện phân chế kim loại.
a) Điện phân hợp chất nóng chảy
- Viết các PTHH điều chế kim loại cụ
b) Điện phân dung dịch thể. Trang 10 21
c) Tính lượng chất thu được ở các
- Tính khối lượng nguyên liệu sản xuất điện cực
được một lượng kim loại xác định theo
hiệu suất hoặc ngược lại. Tiết 39.
Luyện tập điều chế kim loại 40
Bài 24. Thực hành tính - Làm thí nghiệm
- Nêu được cách tiến hành, kĩ thuật thực Dạy học ở
Lấy điểm kiểm tra chất, điều chế kim - Viết tường trình
hiện các thí nghiệm: So sánh mức độ phòng thí 15 phút loại, sự ăn mòn kim
phản ứng của Al, Fe và Cu với ion H+ nghiệm loại
trong dung dịch HCl; Fe phản ứng với
Cu2+ trong dung dịch CuSO4; Zn phản
ứng với dung dịch H2SO4 ; dung dịch
H2SO4 có thêm vài giọt dung dịch
CuSO4.; dùng dung dịch KI kìm hãm
phản ứng của đinh sắt với dung dịch H2SO4.
- Sử dụng dụng cụ hoá chất để tiến hành
an toàn, thành công các thí nghiệm trên.
- Quan sát thí nghiệm, nêu hiện tượng,
giải thích và viết các phương trình hoá học. Rút ra nhận xét.
- Viết tường trình thí nghiệm.
Chủ đề 2: Bài 25. Tiết 41
- Nêu được: Cấu hình e; vị trí; tính chất Dạy học tại Mục B. Một Khuyến khích học 41 Kim loại
Kim loại I.Vị trí, cấu hình e kim loại kiềm, kim
vật lí; ứng dụng và TTTN của kim loại lớp/phòng số hợp chất sinh tự đọc 22
kiềm, kim kiềm và loại kiềm thổ. kiềm – kiềm thổ. học bộ quan trọng loại kiềm hợp chất
II. tính chất vật lí kim loại kiềm, kim
- Giải thích được một số tính chất vật lý, môn/phòng của kim loại 42 thổ và quan loại kiềm thổ.
hóa học của kim loại kiềm – kiềm thổ. thí nghiệm kiềm (bài hợp chất
trọng của III. ứng dụng, TTTN, điều chế kim loại - Viết và giải thích được một số pư hóa kết hợp với 25) quan kim loại
kiềm, kim loại kiềm thổ.
học, điều chế của kim loại kiềm – kiềm hướng dẫn 43 trọng của kiềm Tiết 42 thổ. HS tự học ở Mục B. 1. Tự học có hướng 23 chúng
IV. Tính chất hóa học của đơn chất kim - Mô tả, nhận biết và giải thích được các nhà bằng Canxi dẫn Bài 26.
loại kiềm, kim loại kiềm thổ
hiện tượng thí nghiệm. Phiếu hướng hiđroxit Kim loại Tiết 43 dẫn học tập (bài 26) 44
kiềm thổ Tính chất hóa học và ứng dụng của một - Nêu được tính chất hoá học, ứng dụng và hợp
số hợp chất quan trọng của KL kiềm
của Ca(OH)2, CaCO3, CaSO4.2H2O. chất thổ
- Nêu được khái niệm về nước cứng, tác
Kiểm tra 15 phút 45 quan
Tiết 44Nước cứng hại và cách làm mềm
(trong tiết 46)
trọng của 1. Khái niệm:
- Mô tả, nhận biết và giải thích được các kim loại Phân loại:
hiện tượng thí nghiệm. Trang 11 24
kiềm thổ * Tính cứng tạm thời:
- Giải thích được một số hiện tượng liên 46
* Tính cứng vĩnh cữu
quan đến thực tiễn và sử dụng kiến thức Bài 28.
* Tính cứng toàn phần:
hóa học để giải thích. Luyện 2. Tác hại
tập: Tính 3. Cách làm mềm nước cứng
- Giải quyết được các câu hỏi lý thuyết. chất của Nguyên tắc:
- Tính toán các đại lượng m, hiệu suất… kim loại
a) Phương pháp kết tủa
- Các bài tập yêu cầu HS phải sử dụng kiềm,
b) Phương pháp trao đổi ion
kiến thức, kỹ năng tổng hợp để giải kim loại
4. Nhận biết ion Ca2+, Mg2+ trong quyết.
kiềm thổ dung dịch và hợp Luyện tập chất của Tiết 45, 46 chúng - Luyện tập - Tìm tòi mở rộng Bài 27,29. Nhôm và
Tiết 47. NHÔM VÀ HỢP CHẤT
- Nêu được: Vị trí , cấu hình lớp electron Dạy học tại Bài 27: Mục Tự học có hướng 47 hợp chất của nhôm CỦA NHÔM
ngoài cùng, tính chất vật lí , trạng thái tự lớp/phòng II. Tính chất dẫn
I – VỊ TRÍ TRONG BẢNG TUẦN
nhiên, ứng dụng của nhôm học bộ vật lí Mục 25
HOÀN, CẤU HÌNH ELECTRON
- Trình bày được nhôm là kim loại có môn/phòng IV. Ứng NGUYÊN TỬ
tính khử khá mạnh: phản ứng với phi thí nghiệm dụng và
II – TÍNH CHẤT VẬT LÍ
kim, dung dịch axit, nước, dung dịch kết hợp với trạng thái tự
II. ỨNG DỤNG VÀ TRẠNG THÁI
kiềm, oxit kim loại. Nguyên tắc và sản hướng dẫn nhiên 48 THIÊN NHIÊN
xuất nhôm bằng phương pháp điện phân HS tự học ở Mục V. Sản 1. Ứng dụng
oxit nóng chảy. Tính chất vật lí và ứng nhà bằng xuất nhôm
2. Trạng thái thiên nhiên
dụng của một số hợp chất: Al2O3, Phiếu hướng
Al(OH)3 , muối nhôm. Tính chất lưỡng dẫn học tập Thí nghiệm Tích hợp khi dạy
Tiết 48.Tính chất hóa học và điều chế
tính của Al2O3, Al(OH)3 : vừa tác dụng 2, 3 bài 27, 29 nhôm
với axit mạnh, vừa tác dụng với bazơ Không yêu cầu học
IV – TÍNH CHẤT HOÁ HỌC
mạnh; Cách nhận biết ion nhôm trong Bài tập 6 sinh làm bài tập 6
1. Tác dụng với phi kim dung dịch. (Bài 27) và các dạng bài tập
a) Tác dụng với halogen
- Quan sát mẫu vật, thí nghiệm, rút tính toán liên quan 49
b) Tác dụng với oxi
ra kết luận về tính chất hóa học và đến phản ứng hóa
2. Tác dụng với axit nhận biết ion nhôm học giữa ion Al3+ 26
3. Tác dụng với oxit kim loại
- Viết các PTHH minh hoạ tính chất với ion OH- tạo
4. Tác dụng với nước hoá học của nhôm. Al(OH)3 kết tủa rồi Trang 12
5. Tác dụng với dung dịch kiềm
- Dự đoán, kiểm tra bằng thí nghiệm kết tủa tan trong 50 V. SẢN XUẤT NHÔM
và kết luận được tính chất hóa học OH- dư, hoặc các 1. Nguyên liệu:
của nhôm, nhận biết ion nhôm dạng bài tập tính
2. Điện phân nhôm oxit nóng chảy
- Viết các PTHH phân tử và ion rút toán liên quan đến
Tiết 49.Một số hợp chất quan trọng
gọn (nếu có) minh hoạ tính chất hoá phản ứng hóa học của nhôm
học của hợp chất nhôm. giữa ion AlO -2 với I – NHÔM OXIT
- Sử dụng và bảo quản hợp lý các đồ ion H+ tạo Al(OH)3 II. NHÔM HIĐROXIT dùng bằng nhôm.
kết tủa rồi kết tủa III – NHÔM SUNFAT
- Tính % khối lượng nhôm trong hỗn tan trong H+ dư
IV – CÁCH NHẬN BIẾT ION Al3+
hợp kim loại đem phản ứng. TRONG DUNG DỊCH
- Tính khối lượng boxit để sản xuất Tiết 50.
lượng nhôm xác định theo hiệu suất
Luyện tập nhôm và hợp chất nhôm phản ứng.
Bài 30. Thực hành tính chất của Thí nghiệm Tích hợp khi dạy
natri, magie, nhôm và hợp chất 1 học bài 39 của chúng Thí nghiệm Tích hợp khi dạy 2, 3 bài 27, 29 Dạy học tại 51 lớp kết hợp 27 Ôn tập kiểm tra giữa với hướng kì 2 dẫn HS tự học ở nhà 52 bằng Phiếu hướng dẫn học tập
Kiểm tra giữa kì 2 Nhà trường tổ chức Trang 13 Bài 31. Tiết 53.
- Nêu được: Vị trí , cấu hình electron lớp Dạy học tại Mục III.4. Không dạy Sắt
1 - VỊ TRÍ TRONG BẢNG
ngoài cùng, tính chất vật lí của sắt.Tính lớp/phòng Tác dụng với 53 Chủ đề 3: Bài 32.
TUẦN HOÀN, CẤU HÌNH
chất hoá học của sắt: tính khử trung bình học bộ nước (Bài
Sắt và hợp Hợp ELECTRON NGUYÊN TỬ
(tác dụng với oxi, lưu huỳnh, clo, nước, môn/phòng 31) 28 chất của
chất của 2 - TÍNH CHẤT VẬT LÍ:
dung dịch axit, dung dịch muối).Sắt thí nghiệm sắt sắt
3 - TÍNH CHẤT HOÁ HỌC
trong tự nhiên (các oxit sắt, FeCO3, kết hợp với
Bài 33. 1. Tác dụng với phi kim FeS2). hướng dẫn Hợp HS tự học ở
a) Tác dụng với lưu huỳnh
- Tính % khối lượng sắt trong hỗn hợp kim của
phản ứng. Xác định tên kim loại dựa vào nhà bằng
b) Tác dụng với oxi sắt
2. Tác dụng với dung dịch axit
số liệu thực nghiệm. Phiếu hướng
Bài 37. a) Với dung dịch HCl, H
- Nêu được: Tính chất vật lí, nguyên tắc dẫn học tập Luyện 2SO4 loãng
b) Với dung dịch HNO
điều chế và ứng dụng của một số hợp tập:
3 và H2SO4 đặc,
chất của sắt; tính khử của hợp chất sắt nóng Tính
3. Tác dụng với dung dịch muối (II): FeO, Fe(OH) 2, muối sắt (II); tính
chất hoá 4. Tác dụng với nước
oxi hóa của hợp chất sắt (III): Fe 2O3, học của Fe(OH) Bài 31: Tự học có hướng
4 - TRẠNG THÁI THIÊN NHIÊN 3, muối sắt (III). 54
- Dự đoán, kiểm tra bằng thí nghiệm và kết - Mục II. dẫn
luận được tính chất hoá học của sắt và các Tính chất vật Tiết 5 hợp chất của nó. lí
4. Hợp chất của sắt
- Viết các PTHH phân tử hoặc ion rút - Mục IV.
II - HỢP CHẤT SẮT (II)
gọn minh hoạ tính chất hoá học. Trạng thái tự
2. Sắt (II) hiđroxit nhiên 1. Sắt (II) oxit
- Nhận biết được ion Fe2+, Fe3+trong dung dịch. 3. Muối sắt (II)
- Tính % khối lượng các muối sắt hoặc
II - HỢP CHẤT SẮT (III)
oxit sắt trong phản ứng. 1. Sắt (III) oxit
2. Sắt (III) hiđroxit 3. Muối sắt (III)
- Xác định công thức hoá học oxit sắt
theo số liệu thực nghiệm. - Luyện tập
- Nêu được: Định nghĩa và phân loại
gang, sản xuất gang (nguyên tắc, nguyên
liệu); Định nghĩa và phân loại thép, sản
xuất thép (nguyên tắc chung); Ứng dụng của gang, thép.
- Viết các PTHH phản ứng oxi hoá - khử
xảy ra trong lò luyện gang, luyện thép.
- Phân biệt được một số đồ dùng bằng gang, bằng thép.
- Sử dụng và bảo quản hợp lí được một số hợp kim của sắt. Tiết 5
5. Hợp kim của sắt Trang 14
- Tính khối lượng quặng sắt cần thiết để
sản xuất một lượng gang xác định theo hiệu suất. Tiết 56. - Luyện tập (t ) 55 - Tìm tòi mở rộng Cả bài 33 Tự học có hướng 56 dẫn; Không học các loại lò luyện gang, thép, chỉ học thành phần hợp kim, nguyên tắc và các phản ứng xảy ra khi luyện gang, 29 thép; Không làm bài tập 2 Kiểm tra 15 phút (nếu cần thiết) Bài 34, 38. Crom và Tiết 57. Crom
- Nêu được: Vị trí, cấu hình electron hoá Dạy học tại Mục II. Tính Tự học có hướng 57 hợp chất của crom,
I - VỊ TRÍ TRONG BẢNG TUẦN trị, tính chất vật lí (độ cứng, màu, khối lớp/phòng chất vật lí dẫn luyện tập
HOÀN, CẤU HÌNH ELECTRON lượng riêng) của crom, số oxi hoá; tính học bộ (Bài 34) NGUYÊN TỬ
chất hoá học của crom là tính khử (phản môn/phòng
II - TÍNH CHẤT VẬT LÝ
ứng với oxi, clo, lưu huỳnh, dung dịch thí nghiệm 30
III - TÍNH CHẤT HÓA HỌC
axit); Tính chất của hợp chất crom (III), kết hợp với Trang 15
1. Tác dụng với phi kim
Cr2O3, Cr(OH)3 (tính tan, tính oxi hoá và hướng dẫn 58
2. Tác dụng với nước
tính khử, tính lưỡng tính); Tính chất của HS tự học ở
3. Tác dụng với axit
hợp chất crom (VI), K2CrO4, K2Cr2O7 nhà bằng
(tính tan, màu sắc, tính oxi hoá). Phiếu hướng
- Dự đoán và kết luận được về tính chất dẫn học tập
của crom và một số hợp chất .
- Viết các PTHH thể hiện tính chất
của crom và hợp chất crom.
- Tính thể tích hoặc nồng độ dung dịch
Tiết 58. Hợp chất của crom
K2Cr2O7 tham gia phản ứng.
IV - HỢP CHẤT CỦA CROM 1. Hợp chất crom (III)
a) Crom (III) oxit – Cr2O3
b) Crom (III) hiđroxit – Cr(OH)3
2. Hợp chất crom (VI)
a) Crom (VI) oxit – CrO3
b) Muối crom (VI) 59
Tiết 59. Luyện tập crom và hợp chất crom 31
Bài 35. Đồng và hợp chất của Cả bài Khuyến khích học đồng sinh tự đọc
Bài 36. Sơ lược về niken, kẽm, Cả bài Khuyến khích học chì, thiếc sinh tự đọc - Làm các thí nghiệm:
- Nêu được: Cách tiến hành, kĩ thuật Dạy học tại 60
Bài 39. Thực hành tính + So sánh khả năng phản ứng của Na,
thực hiện các thí nghiệm cụ thể : phòng thí Thí nghiệm Không làm
chất hóa học của sắt, Mg, Al với nước
+ Điều chế FeCl2, Fe(OH)2 và FeCl3, nghiệm 4
đồng và hợp chất của
+ Điều chế FeCl2, Fe(OH)2
Fe(OH)3 từ sắt và các hoá chất cần thiết. sắt, crom
+ Thử tính oxi hóa của K2Cr2O7
+Thử tính oxi hoá của K2Cr2O7. Thí nghiệm Tích hợp khi dạy - Viết tường trình
- Sử dụng dụng cụ hoá chất để tiến hành 1 (bài 30) học bài39
được an toàn, thành công các thí nghiệm trên.
- Quan sát thí nghiệm, nêu hiện tượng, Đánh giá lấy điểm
giải thích và viết các phương trình hoá thường xuyên học. Rút ra nhận xét.
- Viết tường trình thí nghiệm. Dạy học tại Cả bài Không dạy. Sử 61
Bài 40. Nhận biết một lớp/phòng dụng thời gian để Trang 16 số ion trong dung dịch học bộ luyện tập về nhận môn/phòng biết thí nghiệmkết hợp với Bài 42. Tích hợp phần hướng dẫn Luyện tập nhận biết ion trong HS tự học ở nhận biết dung dịch khi dạy 32 nhà bằng một số chất bài 40 Phiếu hướng vô cơ dẫn học tập Dạy học tại Cả bài Không dạy. Sử 62
Bài 41. Nhận biết một lớp/phòng dụng thời gian để số chất khí học bộ luyện tập về nhận môn/phòng biết một số chất thí nghiệm khí kết hợp với hướng dẫn Bài 42. Tích hợp phần HS tự học ở Luyện tập nhận biết chất khí nhà bằng nhận biết khi dạy bài 41
Phiếu hướng một số chất dẫn học tập vô cơ
Bài 43. Hóa học và vấn đề phát Cả bài Khuyến khích học triển kinh tế sinh tự đọc
Bài 44. Hóa học và vấn đề xã Cả bài Khuyến khích học hội sinh tự đọc
1. Hóa học với vấn đề ô nhiễm môi
- Trình bày được : Dạy học tại 63 Bài 45. Hóa học và trường
+ Một số khái niệm về ô nhiễm môi lớp kết hợp vấn đề môi trường
2. Hóa học với vấn đề phòng chống ô
trường, ô nhiễm không khí, ô nhiễm đất, với hướng nhiễm môi trường nước. dẫn HS tự
+ Vấn đề về ô nhiễm môi trường có liên học ở nhà quan đến hoá học. bằng Phiếu
+ Vấn đề bảo vệ môi trường trong đời hướng dẫn
sống, sản xuất và học tập có liên quan học tập qua đến hoá học. phương pháp
- Tìm được thông tin trong bài học, trên học tập dự
các phương tiện thông tin đại chúng về án
vấn đề ô nhiễm môi trường. Xử lí các
thông tin, rút ra nhận xét về một số vấn Trang 17 33
đề ô nhiễm và chống ô nhiễm môi trường.
-Giải quyết được một số tình huống về
môi trường trong thực tiễn.
- Tính toán được lượng khí thải, chất
thải trong phòng thí nghiệm và trong sản xuất. Dạy học tại 64 lớp kết hợp với hướng
Ôn tập kiểm tra cuối kì dẫn HS tự 34 65, 2 học ở nhà 66 bằng Phiếu hướng dẫn học tập 35
Kiểm tra cuối kì 2
DUYỆT CỦA BAN GIÁM HIỆU
TỔ TRƯỞNG CHUYÊN MÔN Trang 18



