






Preview text:
CHỦ ĐỀ 4: HYDROCARBON
BÀI 13: HYDROCARBON KHÔNG NO
I. KHÁI NIỆM, ĐỒNG PHÂN, DANH PHÁP
Hydrocarbon không no là những hydrocarbon trong phân tử có chứa liên kết đôi, liên kết ba ( gọi chung là
liên kết bội ) hoặc đồng thời cả liên kết đôi và liên kết ba.
ALKENE : CnH2n (n 2)
ALKYNE: CnH2n-2 (n 2)
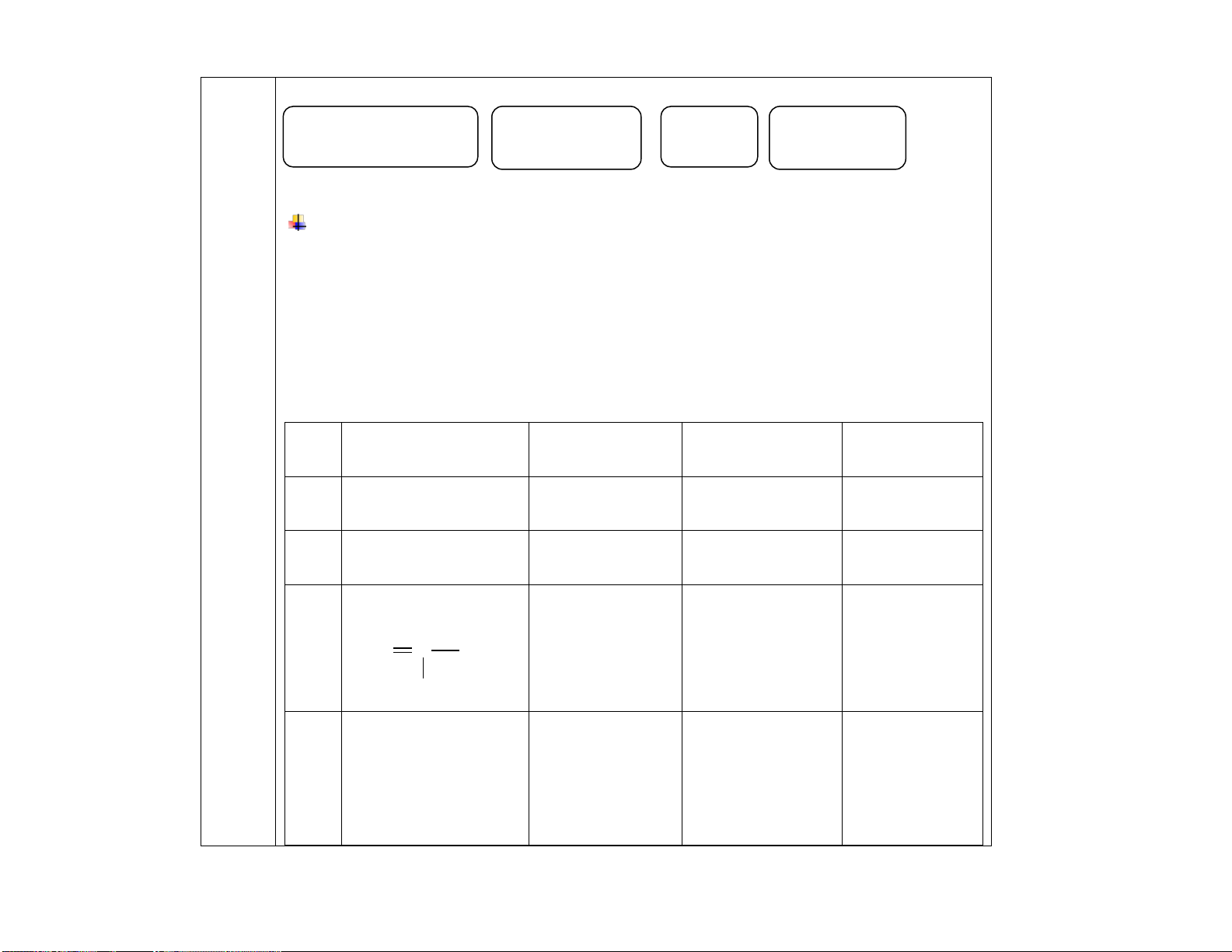
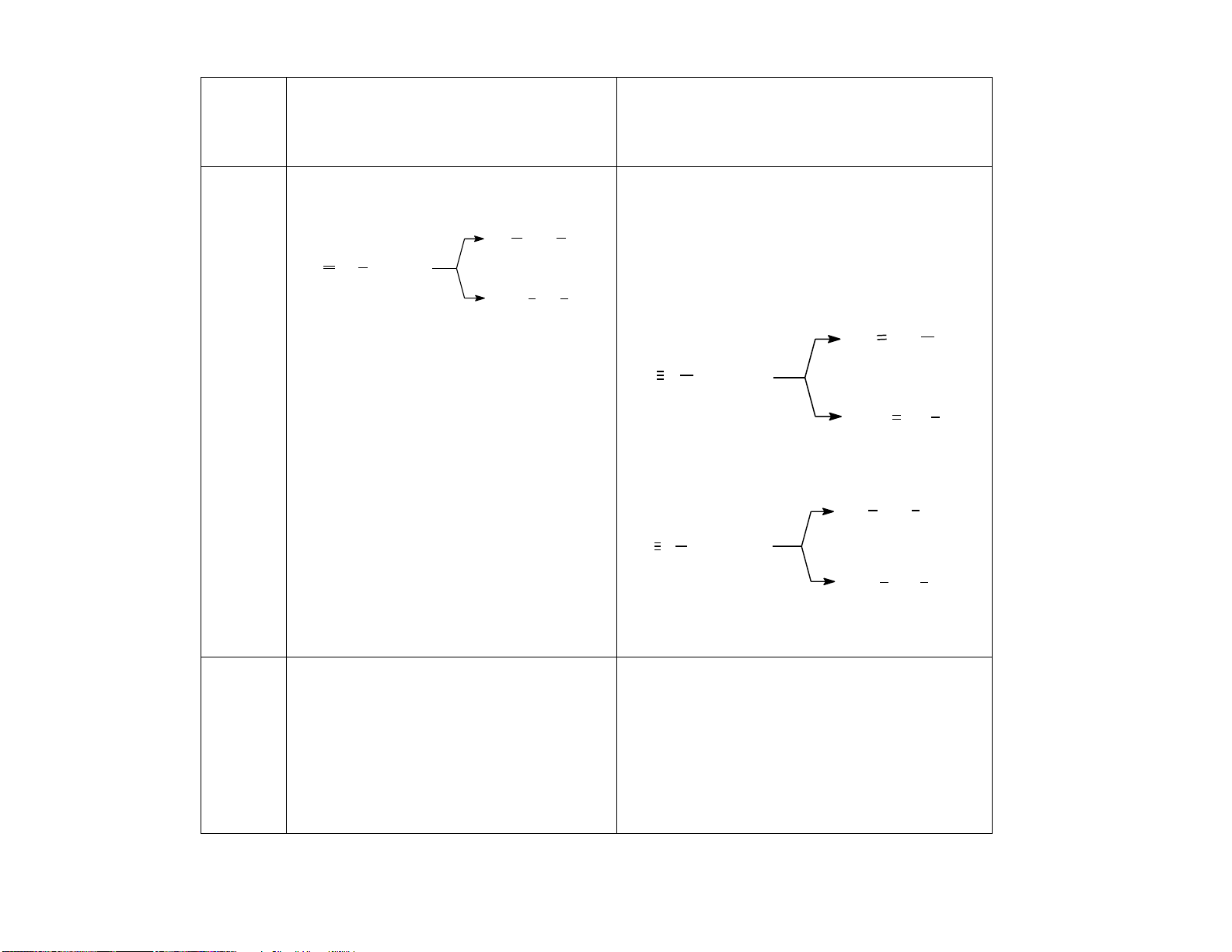
1.Khái Là các hydrocarbon không no, mạch hở, Là các hydrocarbon không no, mạch hở, niệm
có chứa một liên kết đôi C=C trong phân có chứa một liên kết ba C C trong phân tử. tử. Ví dụ: C Ví dụ 2H4, C3H6, C4H8,.. : C2H2, C3H4, C4H6,.. 2. - Đống phân cấu tạo :
- Đống phân cấu tạo : Đồng
+ Đồng phân vị trí liên kết bội (C4 trở đi) + Đồng phân vị trí liên kết bội (C4 trở đi). phân
+ Đồng phân mạch C: Từ C4 trở đi
+ Đồng phân mạch C: Từ C5 trở đi
- Đồng phân hình học (đphh) : có
- Đồng phân hình học : không có
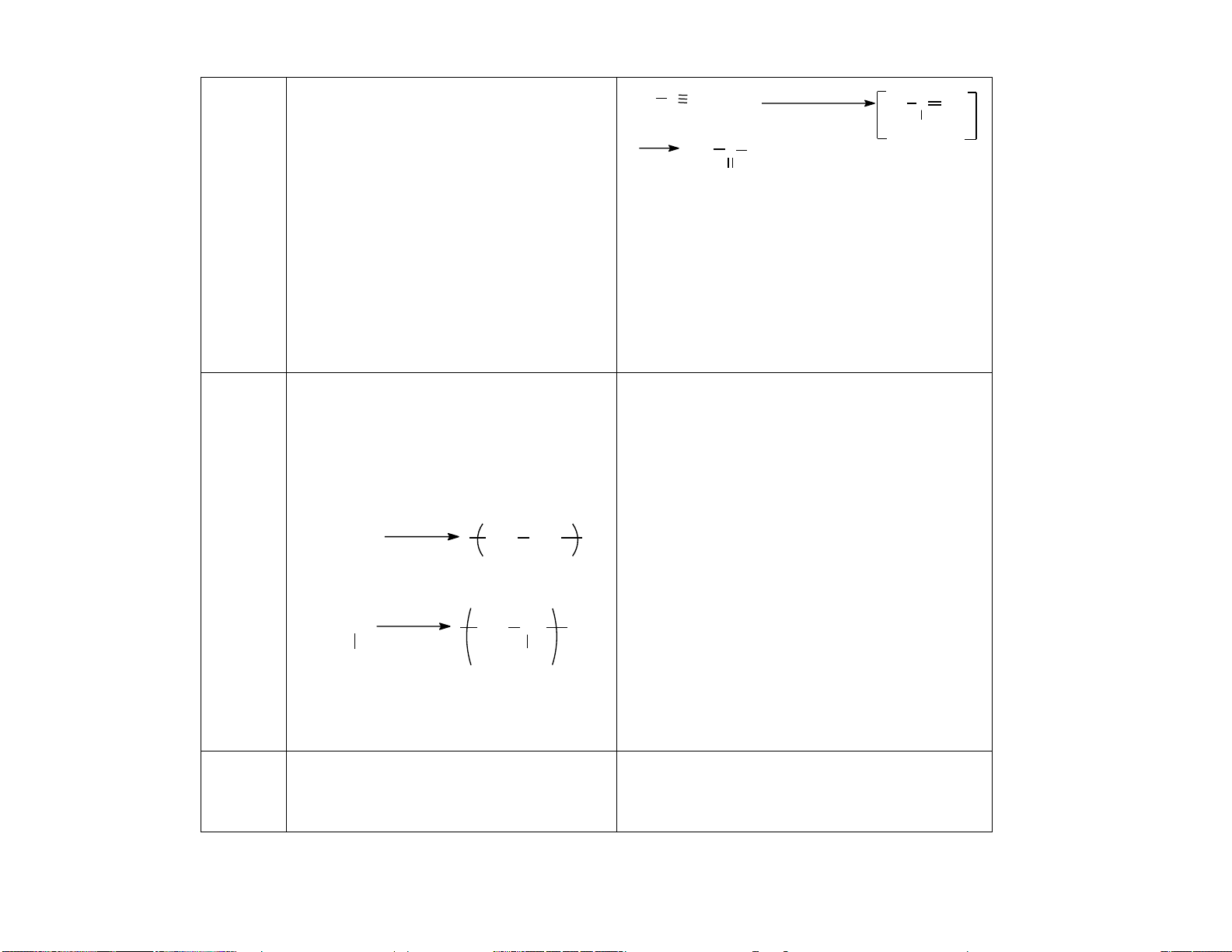
*Tính nhanh số đpct = 2n – 4+(n-2)
Ví dụ 1: C4H6 có 2 đồng phân alkyne với (3 < n < HC CCH CH 2 3 6) CH C C CH Ví dụ 1: 3 3
C4H8 có 3 đp cấu tạo; kể luôn Ví dụ 2: C đphh là 4
5H8 có 3 đồng phân alkyne HC≡C-CH2CH2CH3 CH2 = CH - CH2 - CH3 HC≡C-CH(CH3)-CH3
CH3 - CH = CH - CH3 (có đphh) CH3-C≡ C-CH2CH3 CH2 C CH3 CH3 : Ví dụ 2:
C5H10 có 5 đp cấu tạo; kể luôn đphh là 6
*Điều kiện alkene có đồng phân hình học là mỗi carbon mang nối đôi phải nối với 2 1
nguyên tử hoặc nhóm nguyên tử khác nhau. Alkene tổng quát
Điều kiện có đồng phân hình học a
- a ≠ b và c ≠ d (a,b,c,d: nguyên tử hoặc c nhóm nguyên tử) C C
- (a và c hoặc b và d có thể giống nhau) b d
- Nếu mạch chính ở cùng một phía của liên kết đôi, gọi là đồng phân cis.
- Nếu mạch chính ở hai phía khác nhau của liên kết đôi, gọi là đồng phân trans.
Ví dụ: But-2-ene có đồng phân hình học. mạch chính H H H 3C CH 3C 3 C C C C H H H CH 3
cis - but-2-ene trans - but-2-ene 2 3.
Danh pháp thay thế của Alkene, Alkyne Danh
Số chỉ vị trí nhánh - tên tên mạch chính vị trí liên
ene (alkene) pháp nhánh kết bội (Phần nền)
yne (alkyne)
(nếu có nhánh) (từ C 4)
Lưu ý khi gọi tên alkene và alkyne
- Chọn mạch carbon dài nhất, có nhiều nhánh nhất và có chứa liên kết bội làm mạch chính.
- Đánh số sao cho nguyên tử carbon có liên kết bội có chỉ số nhỏ nhất.
- Dùng chữ số (1,2,3,..) và gạch nối (-) để chỉ vị trí liên kết bội.
- Nếu alkene hoặc alkyne có nhánh thì cần thêm vị trí nhánh và tên nhánh trước tên
của alkene và alkyne tương ứng với mạch chính.
TÊN MỘT SỐ ALKENE VÀ ALKYNE Số Công thức alkene Tên alkene Công thức Tên alkyne C alkyne 2 H2C=CH2 ethene HC CH ethyne (ethylene) (acetylene) 3 H2C=CH-CH3 propene HC C - CH3 propyne (propylene) 4
CH2=CH- CH2 -CH3 but - 1 - ene HC C-CH -CH but-1-yne 2 3
CH3-CH = CH-CH3 but - 2 - ene CH -C C-CH but-2-yne 3 3 CH2 C CH3 methylpropene CH3 5 CH HC≡C 2=CH-CH2- pent-1-ene - pent-1-yne CH2CH3 pent-2-ene CH2CH2CH3 pent-2-yne CH3-CH=CH2- 2-methylbut-1- CH3-C≡ C- 3-methylbut-1- CH2CH3 en CH2CH3 yne HC≡C-CH(CH3)- 3 CH2 C CH2 CH3 CH3 CH3 2-methylbut-2- CH3 C CH CH3 en CH3 CH 3-methylbut-1- 2=CH CH CH3 en CH3 4
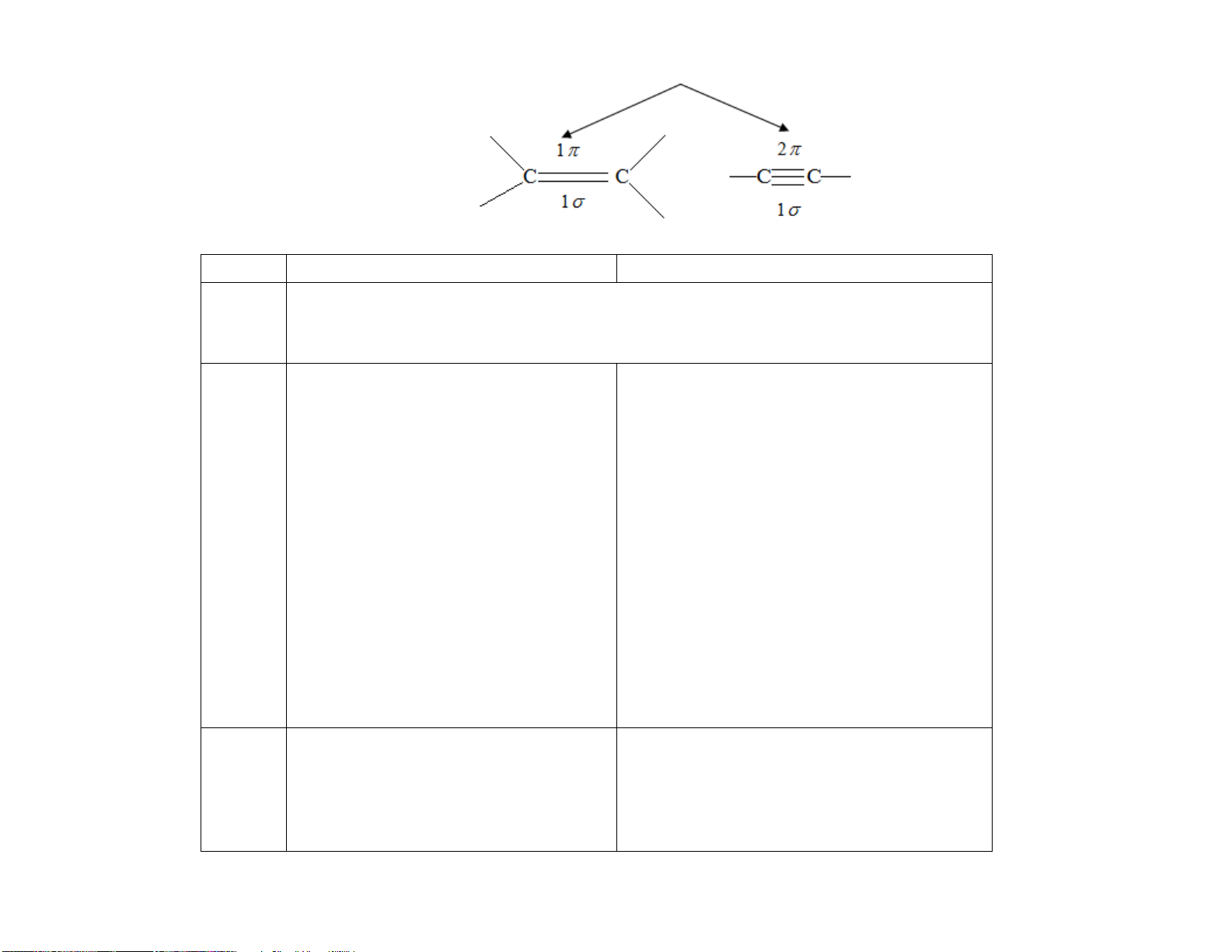
II. ĐẶC ĐIỂM CẤU TẠO ETHYLENE VÀ ACETYLENE ETHYLENE ACETYLENE
- Các nguyên tử trong C2H4 đều thuộc một - Các nguyên tử trong C2H2 đều nằm trên một mặt phẳng.
đường thẳng, góc liên kết CCH = 1800.
- Liên kết đôi C= C gồm 1 và 1 π.
- Liên kết ba C C gồm 1 và 2 π. 106,0 pm H C C H 120,3 pm
Mô hình dạng rỗng Mô hình dạng đặc
Mô hình dạng rỗng Mô hình dạng đặc
III. TÍNH CHẤT VẬT LÍ
- Nhiệt độ sôi, nóng chảy của alkene và alkyne gần giống alkane nhưng thấp hơn alkane cùng số C.
- Nhiệt độ sôi, nóng chảy của alkene và alkyne tăng dần theo số C do tăng khối lượng phân tử và lực tương tác van der Waals.
- Không mùi nhẹ hơn nước, rất ít hoặc không tan trong nước, tan trong dung môi không phân cực như: chloroform, diethyl ether,...
- Ở điều kiện thường alkene và alkyne có số C + C
: trạng thái khí (trừ but 2- C4 -2-yne). + C : trạng thái lỏng. 5-C17
+ C18 trở lên: trạng thái rắn.
IV. TÍNH CHẤT HÓA HỌC CỦA ALKENE VÀ ALKYNE
Liên kết kém bền dễ phản ứng => trung tâm phản ứng của alkene và alkyne ở
liên kết bội và phản ứng đặc trưng là phản ứng cộng. 5 TCHH ALKENE ALKYNE
1. Phản Alkene và alkyne cộng được: hydrogen (H2); halogen (chlorine: Cl2, bromine : Br2); ứng
hydrogen halide HX, (X = Cl,Br,I); nước (hydrate hóa). cộng
a.Cộng Dùng một trong các chất xúc tác: - Dùng xúc tác: Ni => tạo alkane hydroge
Ni,Pd, Pt, đun nóng, áp suất cao. C H + 2H 0 Ni, t , pC H n 2n - 2 2 n 2n+2 n C H + H 0 Ni, t , pC H Alkyne Alkane n 2n 2 n 2n+2 (hydrog Alkene Alkane 0 Ni,t ,p
CH CH+ 2H CH -CH en hóa) 2 3 3 0 Ni,t ,p CH = CH + H CH -CH 2 2 2 3 3
- Dùng xúc tác: Lindlar => tạo alkene C H + H 0
Lindlar, t C H n 2n - 2 2 n 2n Alkyne Alkene 0 Lindlar,t CH CH+ H CH =CH 2 2 2 P/s: Lindlar = Pd, CaCO3/BaSO4 Pb(CH
/quinoline (chất lỏng không 3COO)2 màu có công thức C N) do nhà bác4` học 9H7 Herbert Lindlar tìm ra
b.Cộng Alkene làm mất màu dung dịch Alkyne làm mất màu dung dịch bromine halogen bromine CH CH+ Br CHBr = CHBr 2 (1) (haloge CH = CH + Br CH Br-CH Br 2 2 2 2 2 1,2-dibromoethene n hóa) CHBr = CHBr + Br Br CH - CHBr 2 2 2 (2) 6 1,1,2,2- tetrabromoethane CH CH+ 2Br Br CH - CHBr 2 2 2 (3) c.Cộng CH = CH + HBr CH -CH Br CH CH+ HBr CH = CHBr 2 2 3 2 2 hydroge bromoethane bromoethene n halide CH3 CHBr CH3 CH = CHBr + HBr CH - CHBr 2 3 2 2-bromopropane CH2 CH CH3 + HBr (saû n phaå m chính) 1,1-dibromoethane CH 1:2 2Br CH2 CH3
CH CH+ 2HBr CH - CHBr 3 2 1-bromopropane CH2 CBr CH3 (saû n phaå m phuï) 2-bromopropene HC C CH 1:1 + 3 HBr (saû n phaå m chính) CHBr CH CH3 1-bromopropene (saû n phaå m phuï) CH3 CBr2 CH3 2,2-dibromopropane 1:2 HC C CH + 2 3 HBr (saû n phaå m chính) CHBr2 CH2 CH3 1,1-dibromopropane (saû n phaå m phuï) d.Phản
Alkene + H O => tạo alcohol O theo tỉ lệ mol 2
-Alkyne chỉ tác dụng với H2 ứng 0 H3PO4 ,t CH =CH +H O CH -CH OH
1:1 và chỉ có acetylene + H O tạo aldehyde, 2 2 2 3 2 2 cộng
các alkyne còn lại tạo ketone.
**Quy tắc Markovnikov: Phản ứng nước 2+ 0
cộng một tác nhân không đối xứng Hg ,H2SO4 ,t
CH CH+H O [CH =CH-OH] 2 2
(hydrate HX như HBr, HCl, HOH,..vào liên kết CH -CH=O vinylalcohol 3 hóa)
bội, nguyên tử hydrogen sẽ ưu tiên ethanal 7
cộng vào nguyên tử carbon có nhiều CH , t 0 3 C CH + CH
hydrogen hơn và X sẽ cộng vào H2O Hg2+, H2SO4 3 C CH2 OH
nguyên tử carbon có ít hydrogen hơn. CH3 C CH3 propen - 2 - ol => P/s: O
- Alkene, alkyne không đối xứng là dimethyl ketone
Alkene, alkyne có 2C không no không Khi viết phương trình hóa học thì viết : cùng bậc. 2+ 0 Hg ,H2SO4 ,t
CH CH+H O CH -CH=O 2 3
- Cách nhớ quy tắc Markovnikov: 2+ 0 Hg ,H2SO4 ,t
CH C-CH +H O CH COCH
Alkene, alkyne + HX => thì X vào C 3 2 3 3
không no bậc cao làm sản phẩm chính. 2
2. Phản ứng trùng hợp alkene là quá 2. Phản ứng của alk-1-yne với
trình cộng hợp liên tiếp nhiều phân tử AgNO3/NH3
alkene giống nhau hoặc tương tự nhau Các alkyne có liên kết ba ở đầu mạch có
(gọi là monomer) tạo thành phân tử có khả năng tham gia phản ứng với dung dịch
phân tử khối lớn ( gọi là polymer).
AgNO3 trong NH3 tạo kết tủa. Phản ứng 0 t , xt, p
này dùng nhận biết alkyne đầu mạch. n CH2=CH2 CH2 CH2 n
- Chỉ actylene thế 2 H bởi 2 Ag ethylene
HC CH+2AgNO 2NH AgC CAg +2NH NO polyethylene (PE) 3 3 4 3 (kết tủa vàng) 0 t , xt, p C H CH + 2[Ag(NH ) ]OH C
Ag CAg +4NH +2H O n CH 3 2 3 2 2=CH CH2 CH d
iamminesilver (I) hydroxide silver acetylide CH3 CH3 n (Thuoác thöû Tollens) propylene
polypropylene (PP) - Các alk-1-yne khác thế 1 H bởi 1 Ag
n : hệ số trùng hợp.
RC CH+AgNO NH RC CAg +NH NO 3 3 4 3 RC CH +
[Ag(NH ) ]OH RC CAg +2NH +H O 3 2 3 2
3. Phản a) Oxi hóa không hoàn toàn = mất a) Oxi hóa không hoàn toàn = mất màu
ứng oxi màu thuốc tím KMnO thuốc tím KMnO 4 (potassium 4 (potassium hóa permanganate) permanganate) 8 3CH 2=CH2+2KMnO4+4H2O 3 HC CH +8KMnO4 3KOOC-COOK + 3HO-CH 2CH2-OH+2MnO2 +2KOH 2KOH + 8MnO2 ethylene glycol +2H2O
b)Phản ứng oxi hóa hoàn toàn = phản b)Phản ứng oxi hóa hoàn toàn = phản ứng
ứng cháy => tỏa nhiều nhiệt.
cháy => tỏa nhiều nhiệt. 0 3n t 0 3n 1 t C n H2n O2 nCO2 nH2O CnH2n 2 O 2 nCO2 (n 1)H2O 2 2 0 0 C t t 2H4(g)+3O2(g) 2C2H2(g)+5O2 4CO2(g) +2H2O(g) 2CO2(g)+2H2O(g) 0 H r 298 = - 0 H r 298 = - 2602kJ 1411kJ V. ĐIỀU CHẾ ALKENE ALKYNE 1.Trong
Dehydrate ethanol => ethylene
Calcium carbide + H2O => Acetylene C2H2 phòng C 2H4 CaC2 H2O C2H2 Ca(OH)2 thí 0 H SO ,t 2 4
C H OH C H H O nghiệm 2 5 2 4 2 2.Trong
- Alkene C2-C4 được điều chế Nhiệt phân methane ở 1500 0C , làm lạnh công
bằng cách cracking alkane trong 0 1500 C, l.l.n
nhanh. 2CH C H 3H nghiệp. 4 2 2 2 các nhà máy lọc dầu. C Zeolite 15H32 0 2C 500 C 2H4+C3H8 +C8H18
- Dehydrogen các khí dầu mỏ (ethane, propane và butane. 9
Điều chế và thử tính chất của ethylene trong phòng thí nghiệm
Điều chế và thử tính chất của acetylene trong phòng thí nghiệm VI. ỨNG DỤNG 10
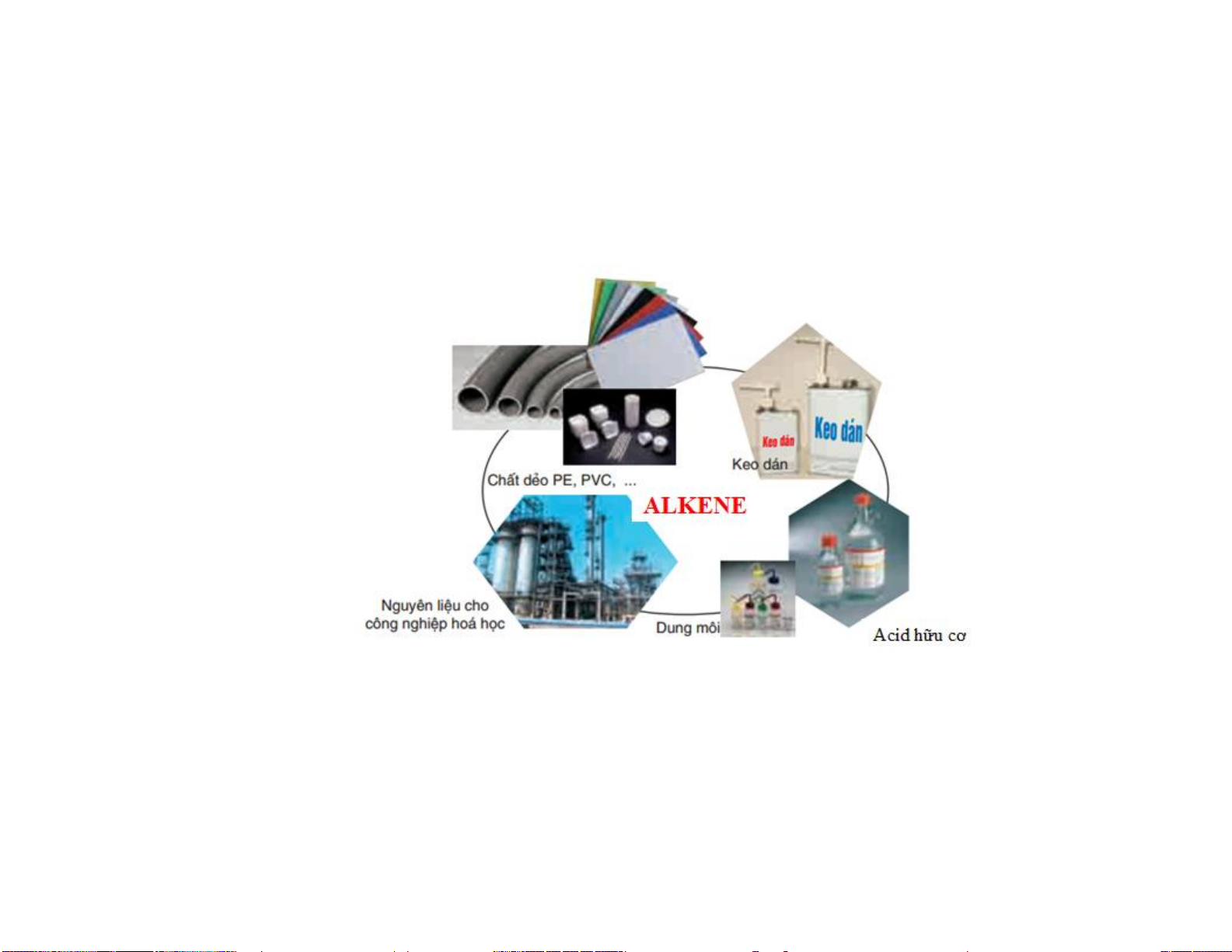
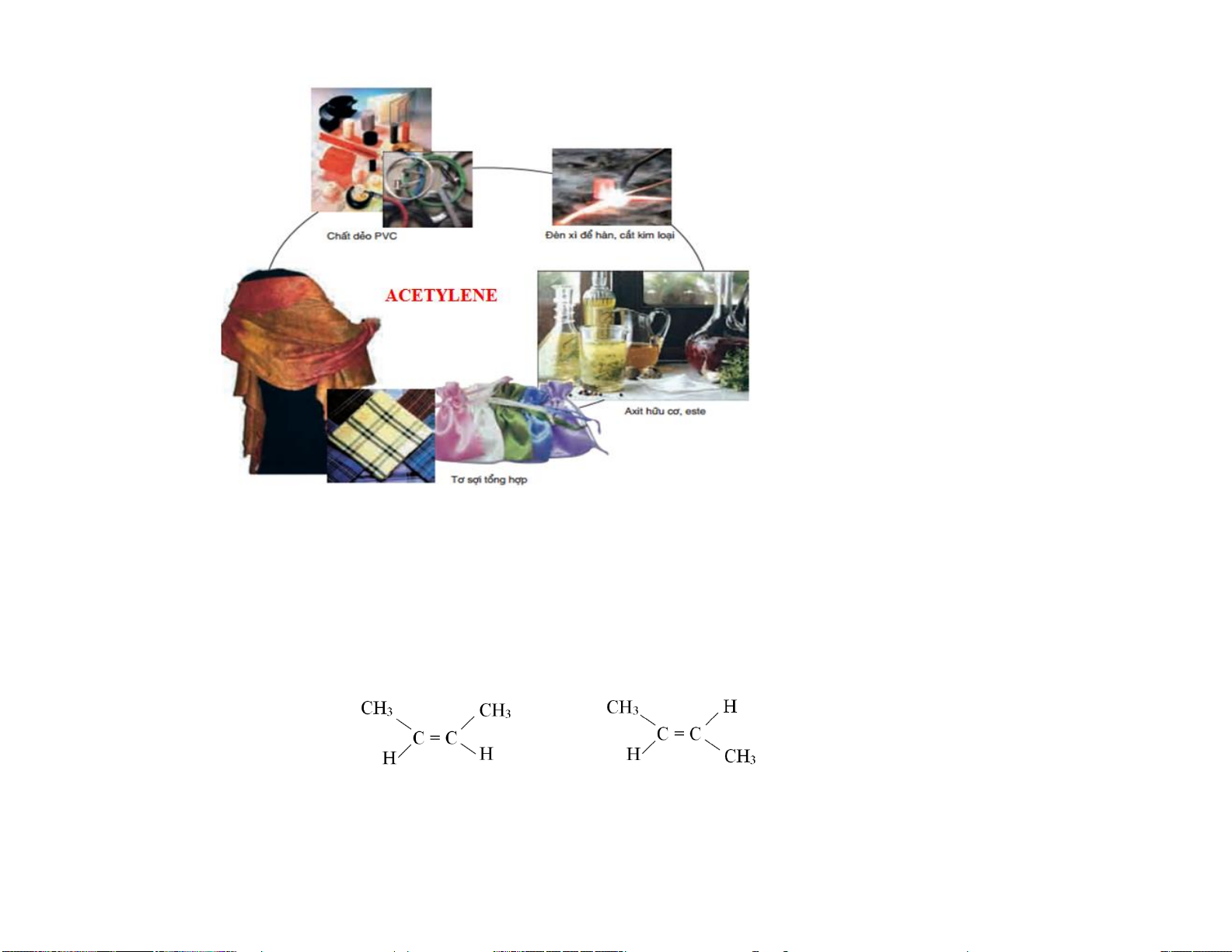
- Tổng hợp polymer như : polyethylene (PE), polypropylene (PP) => ly, cốc, tủ nhựa,...
- Ethylene, Acetylene kích thích hoa quả mau chín. Acetylene điều khiển quá trình sinh mủ của cây cao su,...
- Tổng hợp các polymer như : poly(vinyl alcohol), poly(vinyl acetate),..=> làm bao bì, keo dán, màng đệm.
- Acetylene cháy tỏa nhiều nhiệt => làm đèn xì oxygen-acetylene để hàn, cắt kim loại. - Sản xuất dược phẩm
- Công nghiệp hóa chất : sản xuất alcohol, aldehyde, ethylbebzene, cumene,... 11
VD:Viết công thức cấu tạo và gọi tên tất cả các alkene, alkyne có 4 nguyên tử carbon trong phân tử. Alkene nào
có đồng phân hình học? Gọi tên các đồng phân hình học đó. Hướng dẫn giải C4H8
(1) CH2=CH-CH2-CH3. But-1-ene (2) CH3-CH=CH-CH3. But-2-ene
Trong đó but-2-ene có đồng phân hình học.
cis-but-2-ene. trans-but-2-ene
(3) CH2=C(CH3) – CH3 2-methylpropene
VD: Số lượng đồng phân alkene ứng với công thức phân tử C4H8 là 12 A. 2. B. 3. C. 4. D. 5. C4H6
CH≡C – CH2 – CH3: But – 1 – yne.
CH3 – C ≡ C – CH3: But – 2 – yne.
VD: Viết công thức cấu tạo và gọi tên theo danh pháp thay thế của các alkene và alkyne có công thức phân tử
C5H10, C5H8. Alkene nào có đồng phân hình học? Gọi tên các đồng phân hình học đó. Hướng dẫn giải C5H10 STT Đồng phân Tên gọi thay thế 1 CH2=CH-CH2-CH2-CH3 Pent-1-ene 2 CH3-CH=CH-CH2-CH3
Pent-2-ene (có đồng phân hình học)
cis – but – 2 – ene trans – but – 2 – ene 3 CH2=C(CH3)-CH2-CH3 2-methylbut-1-ene 4 CH3-C(CH3)=CH-CH3 2-methylbut-2-ene 5 CH3-C(CH3)-CH=CH2 3-methylbut-1-ene C5H8 STT Đồng phân Tên gọi thay thế 1 CH≡C-CH2-CH2-CH3 Pent-1-yne 2 CH3-C≡C-CH2-CH3 Pen-2-yne 13 3 CH≡C-CH(CH3)-CH3 3-methylbut-1-yne
VD: Số lượng đồng phân alkene ứng với công thức phân tử C5H10 là A. 3. B. 4. C. 5. D. 6.
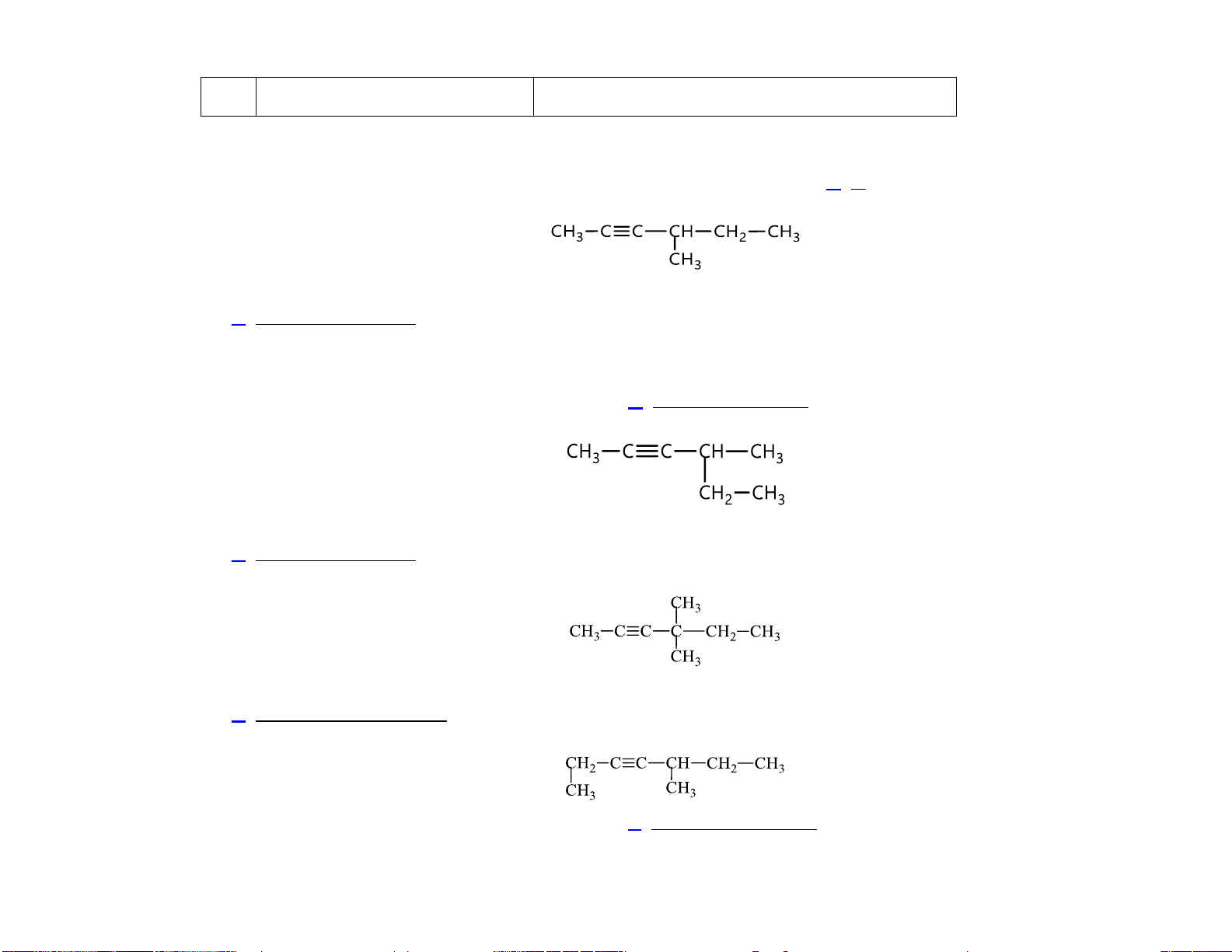
VD: Alkyne dưới đây có tên gọi là
A. 3-methylpent-2-yne.
B. 2-methylhex-4-yne.
C. 4-methylhex-2-yne. D. 3-methylhex-4-yne.
VD: Chất X có công thức: CH CH(CH ) CH CH . Tên gọi của X theo danh pháp IUPAC là 3 3 2
A. 2-methylbut-3-yne.
B. 2-methylbut-3-ene.
C. 3-methylbut-1-yne. D. 3-methylbut-1-ene.
VD: Alkyne dưới đây có tên gọi là
A. 4-ethylpent-2-yne.
B. 2-ethylpent-3-yne.
C. 4-methylhex-2-yne. D. 3-methylhex-4-yne.
VD: Alkyne dưới đây có tên gọi là
A. 3,3-đimethylpent-2-yne.
B. 4,4-đimethylpent-3-yne.
C. 4,4-đimethylhex-2-yne.
D. 3,3-đimethylpent-4-yne.
VD: Alkyne dưới đây có tên gọi là
A. 1,4-đimethylpent-2-yne.
B. 5-methylhept-3-yne. 14
C. 1,4-đimethylhex-2-yne. D. 4-methylhex-3-yne.
VD:Viết phương trình hóa học của các phản ứng:
(a) Propene tác dụng với hydrogen, xúc tác nickel.
(b) Propene tác dụng với nước, xúc tác acid H3PO4.
(c) 2-methylpropene tác dụng với nước, xúc tác acid H3PO4.
(d) But-1-ene tác dụng với HCl. Hướng dẫn giải
(a) Propene tác dụng với hydrogen, xúc tác nickel. 0 (a) CH Ni,t 2=CH-CH3 + H2 CH3-CH2-CH3
(b) Propene tác dụng với nước, xúc tác acid H3PO4. 0 (b) CH H3PO4 ,t 2=CH-CH3 + H2O CH3 – CHOH – CH3
(c) 2-methylpropene tác dụng với nước, xúc tác acid H3PO4. 0 (c) CH H3PO4 ,t 2=C(CH3)-CH3 + H2O (CH3)2 – C(OH) – CH3
(d) But-1-ene tác dụng với HCl.
CH CHCl CH CH (sp chÝnh) (d) CH 3 2 3 2=CH-CH2-CH3 + HCl CH Cl CH CH CH (sp phô) 2 2 2 3
VD:Viết phương trình hóa học của các phản ứng: Hướng dẫn giải
(a) Propene tác dụng với dung dịch KMnO4. (a) 3CH ↓+ 2KOH
2=CH-CH3 +4H2O + 2KMnO4 → 3HO-CH2-CH(OH)-CH3 + 2MnO2
(b) Propyne tác dụng với dung dịch AgNO3/NH3. (b) HC≡C-CH → AgC≡C ↓ + NH 3 + AgNO3 + NH3 -CH3 4NO3
(c) 2-methylbut-2-ene tác dụng với hydrogen chloride (tạo sản phẩm chính)
(c) CH3 – C(CH3) = CH – CH3 + HCl → (CH3)2 – CCl – CH2 – CH3
(d) but-1-yne tác dụng với nước có xúc tác Hg2+ ở 800C (tạo sản phẩm chính) CH CH C CH 2 o (d) CH Hg ,80 C 3 2 3 || 3 – CH2 – C ≡ CH + H2O O
BT 1/91:[CD - SGK] Viết công thức cấu tạo của các chất có tên dưới đây: 15
(a) pent – 2 – ene (b) 2-methylbut –2 – ene
(c) 3-methylbut –1 – yne (d) 2-methylpropene Hướng dẫn giải (a) CH – – 3 CH=CH – CH2 CH3 (b) CH – 3 C(CH3)=CH – CH3 (c) CH – 3 CH(CH3) – C ≡ CH (d) CH2 = C(CH3) – CH3
VD: BT4/91 [CD - SGK] Cho các đoạn mạch polymer như ở dưới đây: (a) (b) (c) (d)
Viết phương trình hóa học tổng hợp các polymer đó từ các alkene tương ứng. Hướng dẫn giải o (a) n CH t ,xt,p – 2 = CH2 ( CH2 CH2 ) n CH C H CH C H 2 o 2 (b) n | t ,xt,p | n Cl Cl CH C H CH C H 2 o 2 (c) n | t ,xt ,p | n CH CH 3 3 o (d) n CF t ,xt,p – 2 = CF2 ( CF2 CF2) n
BT3/91-CD Hãy trình bày phương pháp hóa học nhận biết ba khí sau: ethane, ethylene, acetylene. Hướng dẫn giải 16
Dẫn lần lượt từng khí qua dung dịch AgNO3/NH3, xuất hiện kết tủa vàng thì khí đó là acetylene.
Khí sinh ra làm mất màu dung dịch bromine hoặc dung dịch KMnO4 loãng. PTHH: HC≡CH + 2AgNO → AgC≡CAg↓+ 2NH 3 + 2NH3 4NO3
Lần lượt dẫn 2 mẫu khí còn lại qua dung dịch bromine, mẫu khí nào làm nhạt màu nước bromine là ethylene. PTHH: CH → CH 2=CH2 + Br2 2Br – CH2Br
Mẫu khí còn lại là ethane. ❖ BÀI TẬP TỰ LUẬN ♦ VÍ DỤ MINH HỌA
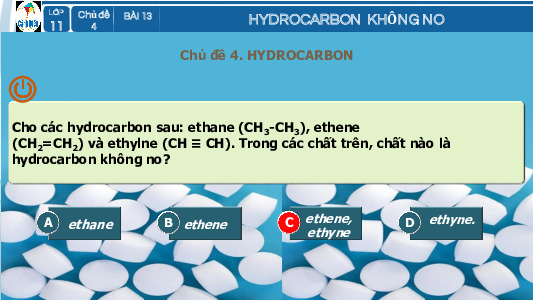
Câu 1. Cho các công thức: CH . Công thức nào
4, C2H2, C2H4, C2H6, C3H6, C4H4, C4H10, C4H6, C4H8, C5H8, C6H6
là của alkane, công thức nào có thể là của alkene, ankyne? Hướng dẫn giải Alkane: CH4, C2H6, C4H10. Alkene: C2H4, C3H6, C4H8. Alkyne: C2H2, C4H6, C4H8.
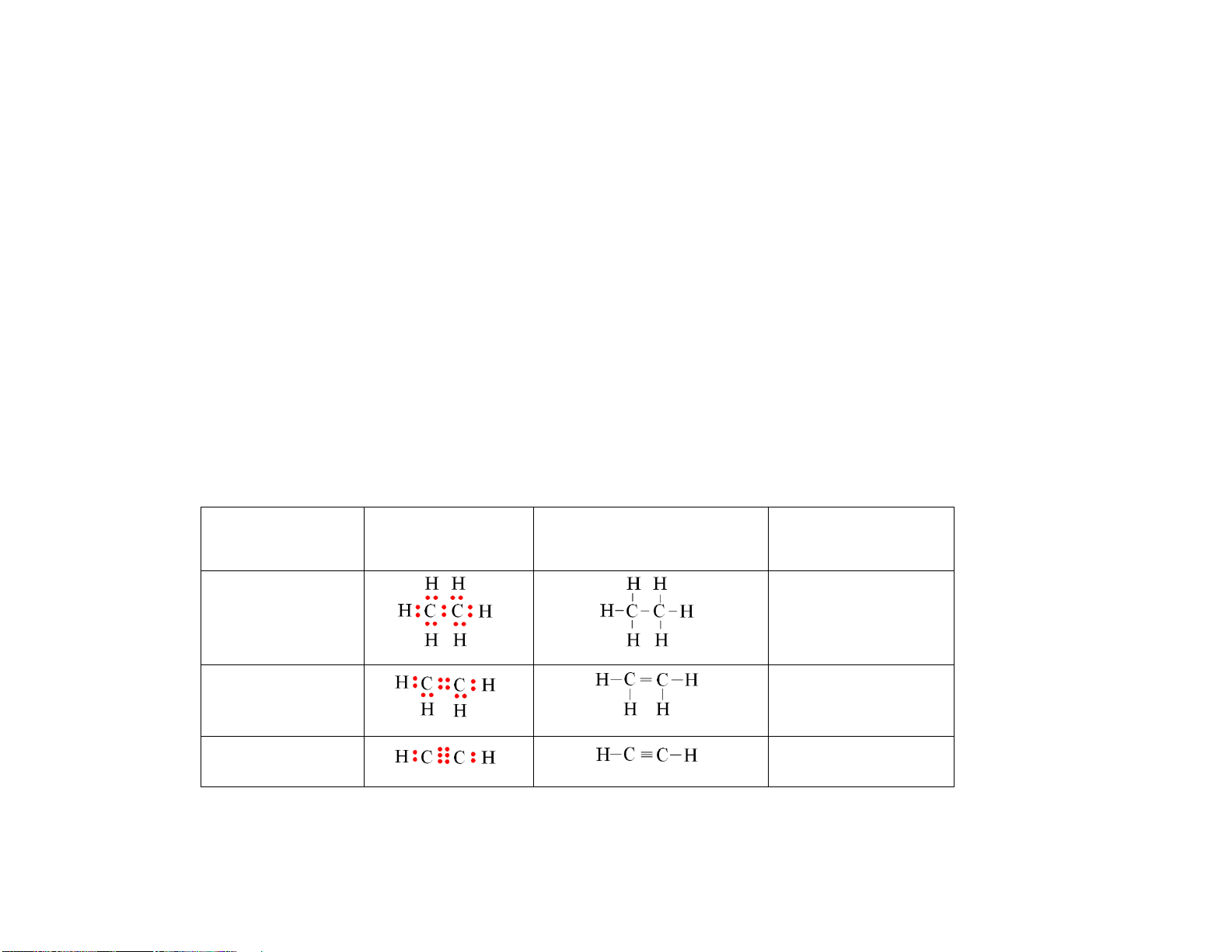
Câu 2. [KNTT - SGK] Em hãy viết công thức electron, công thức Lewis của các hidrocarbon sau: C2H6, C2H4,
C2H2. Nhận xét sự khác nhau về đặc điểm liên kết trong phân tử của ba hidrocarbon trên. Hướng dẫn giải Hidrocarbon Công
thức Công thức Lewis
Đặc điểm liên kết electron Chỉ chứa liên kết C2H6 đơn C2H4 Chứa 1 liên kết đôi C2H2 Chứa 1 liên kết ba
Câu 3. [KNTT - SGK] Viết công thức cấu tạo và gọi tên theo danh pháp thay thế của các alkene và alkyne có
công thức phân tử C5H10, C5H8. Alkene nào có đồng phân hình học? Gọi tên các đồng phân hình học đó. 17 Hướng dẫn giải C5H10 STT Đồng phân Tên gọi thay thế 1 CH2=CH-CH2-CH2-CH3 Pent-1-ene 2 CH3-CH=CH-CH2-CH3
Pent-2-ene (có đồng phân hình học)
cis – but – 2 – ene trans – but – 2 – ene 3 CH2=C(CH3)-CH2-CH3 2-methylbut-1-ene 4 CH3-C(CH3)=CH-CH3 2-methylbut-2-ene 5 CH3-C(CH3)-CH=CH2 3-methylbut-1-ene C5H8 STT Đồng phân Tên gọi thay thế 1 CH≡C-CH2-CH2-CH3 Pent-1-yne 2 CH3-C≡C-CH2-CH3 Pen-1-yne 3 CH≡C-CH(CH3)-CH3 3-methylbut-1-yne
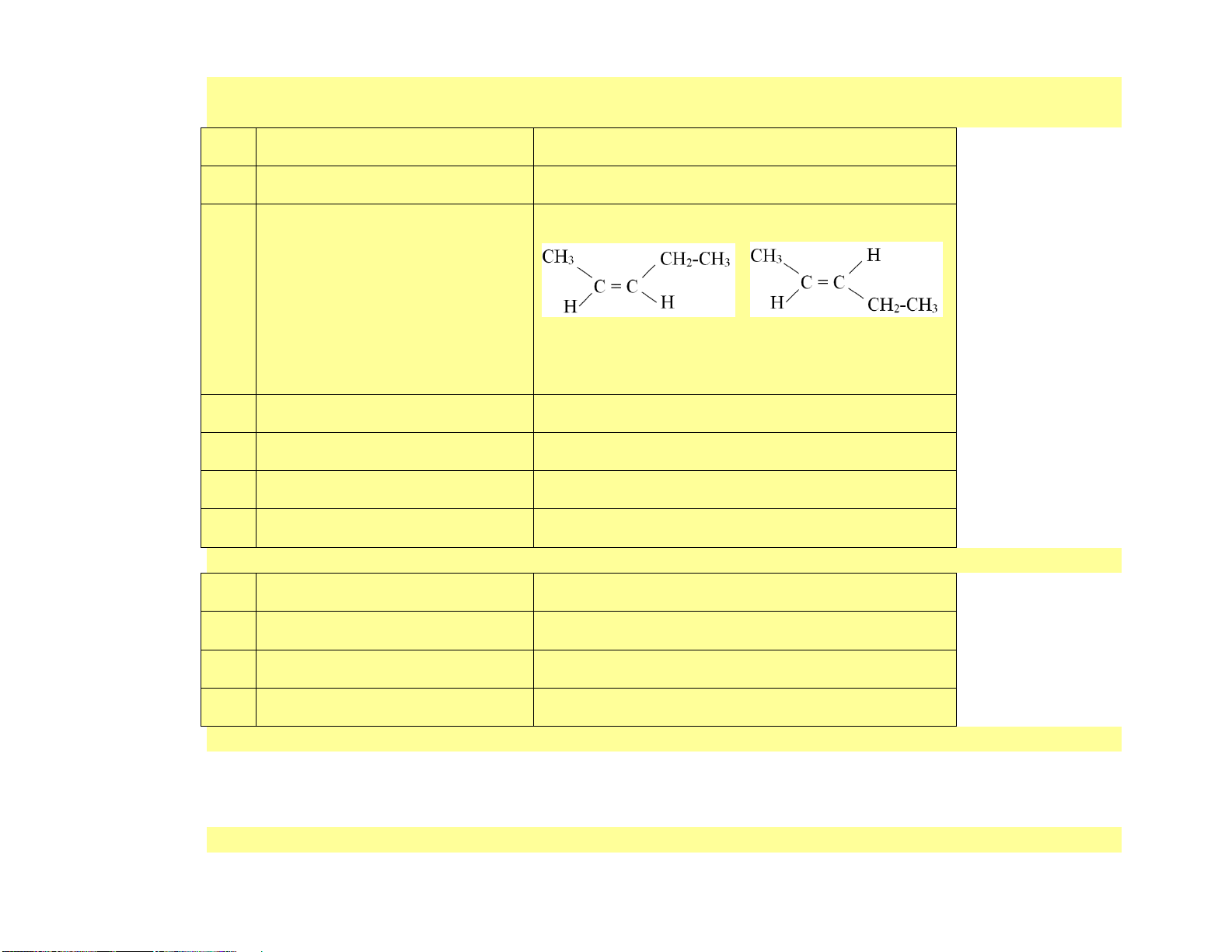
Câu 4. [KNTT - SGK] Trong các chất sau, chất nào có đồng phân hình học? (a) CH2=CH-CH3 (c) CH3-C(CH3)=CH-CH3 (b) CH3-CH2-CH=CH-CH3 (d) CH2=CH-CH2-CH3 Hướng dẫn giải 18 Chất (b) CH có đồ 3 -CH2-CH=CH-CH3
ng phân hình học. Vì một nguyên tử Carbon của liên kết đôi liên kết với
hai nhóm thế khác nhau (H, C2H5-) và nguyên tử còn lại liên kết với hai nhóm thế khác nhau (H,CH3-)
Chất (a), (c), (d) không có đồng phân hình học. Vì có nguyên tử carbon của liên kết đôi liên kết với hai nguyên
tử giống nhau hoặc hai nhóm nguyên tử giống nhau.
Câu 5. [CTST - SGK] Viết công thức cấu tạo các alkene và alkyne sau: (a) but-2-ene (c) but-1-yne (b) 2-methylpropene
(d) 3 – methylpent – 1 – yne Hướng dẫn giải (a) CH3-CH=CH-CH3 (c) CH ≡ C – CH2 – CH3 (b) CH2=C(CH3)-CH3
(d) CH ≡ C – CH(CH3) – CH2 – CH3
Câu 6. [CTST - SGK] Viết công thức khung phân tử của
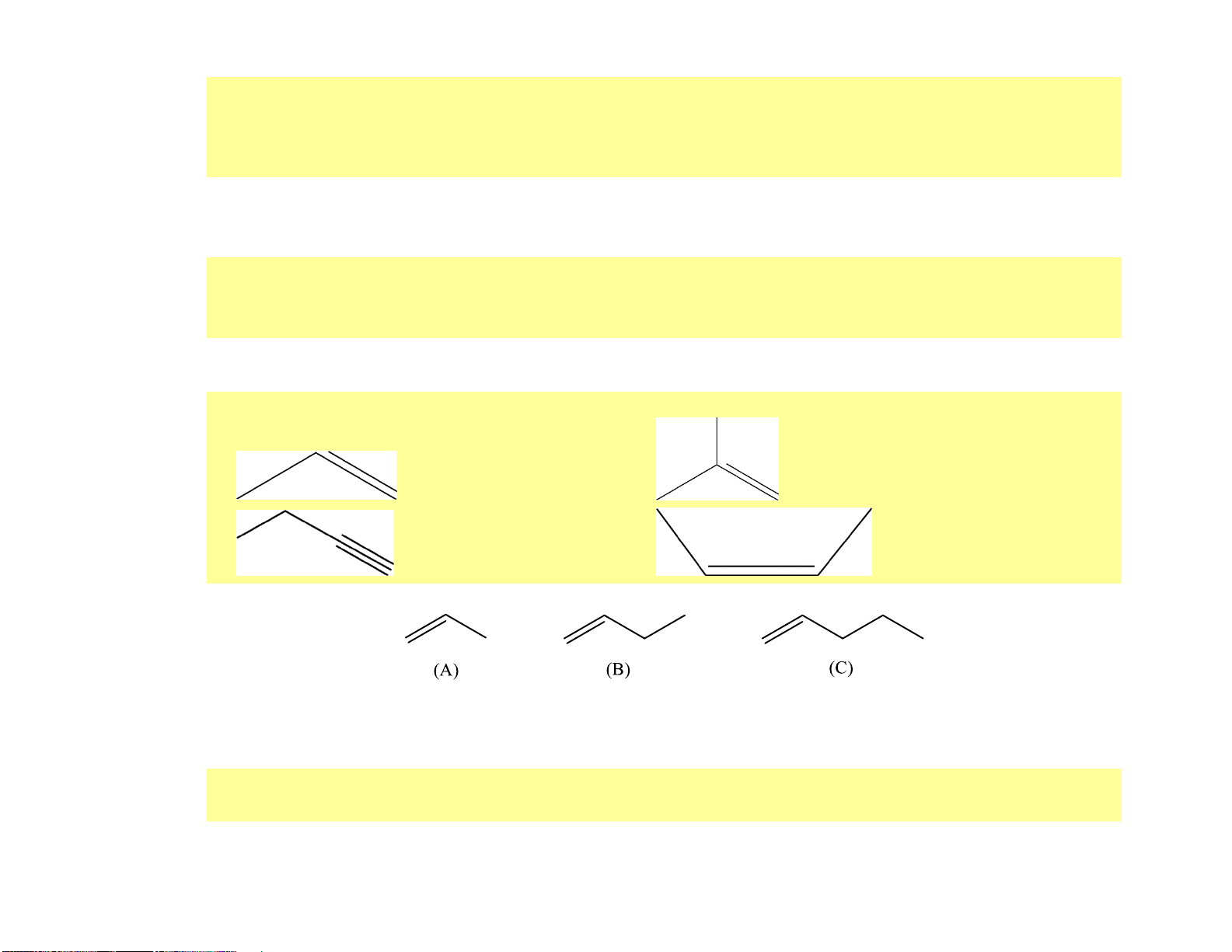
(a) propene. (b) 2-methylbut-1-ene. (c) but-1-yne. ( d) cis-but-2-ene Hướng dẫn giải (a) (b) (c) (d)
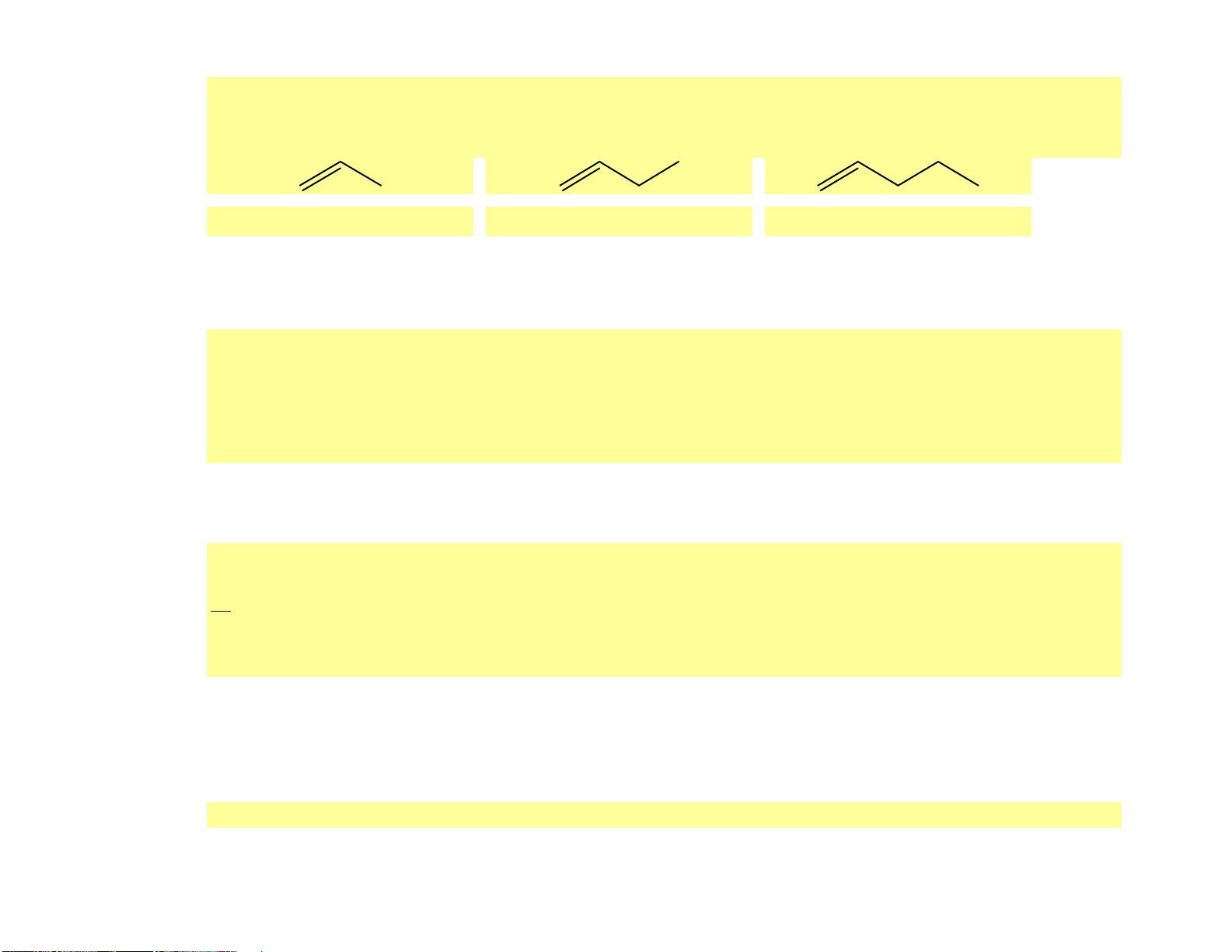
Câu 7. [CTST - SBT] Cho các phân tử alkene có công thức khung phân tử dưới đây:
(a) Gọi tên các phân tử alkene nêu trên theo danh pháp thay thế.
(b) So sánh tương tác van der Waals giữa các phân tử alkene nêu trên. Từ đó em có nhận xét gì về nhiệt độ sôi của các alkene trên. Hướng dẫn giải
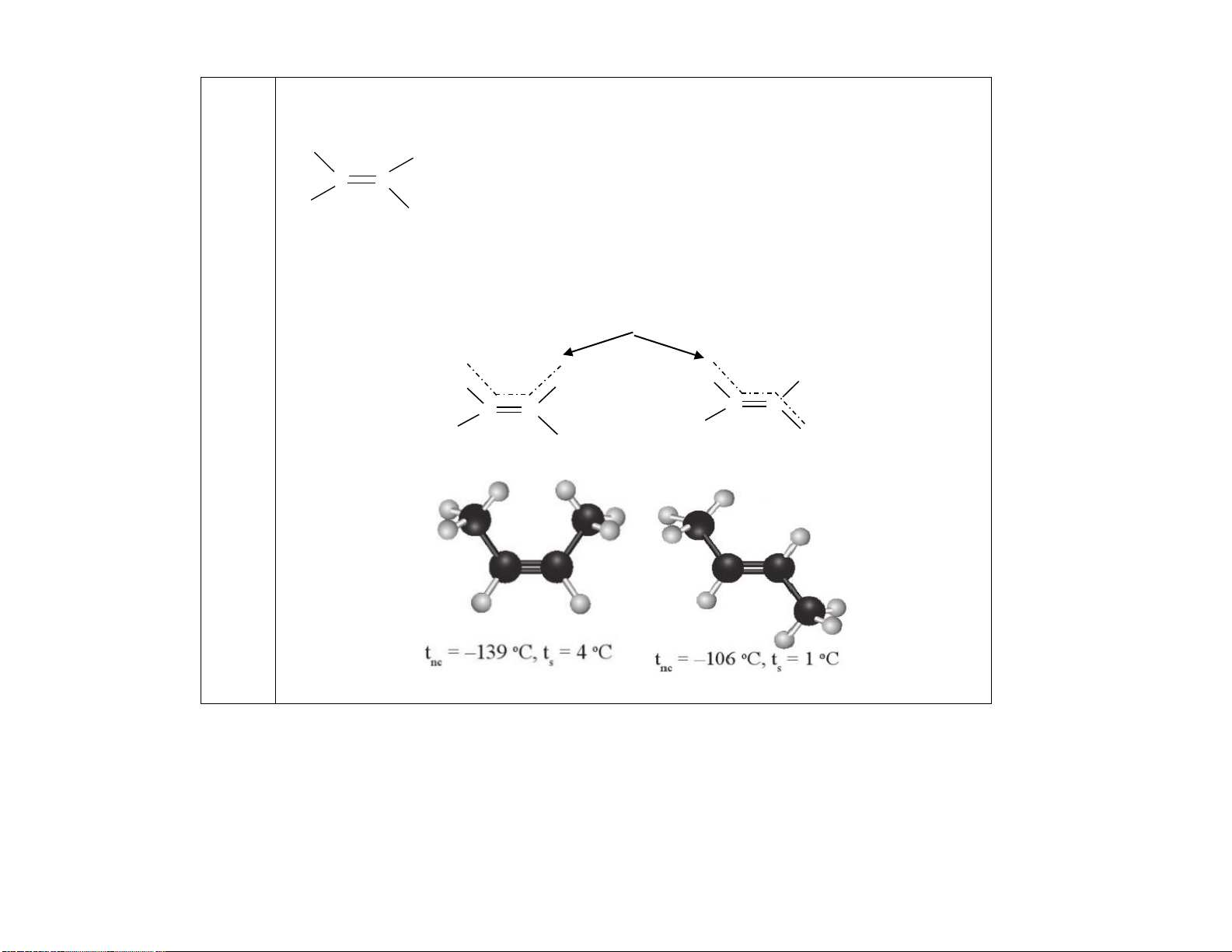
(a) (A): propene, (B): but-1-ene, (C): pent-1-ene. 19
(b) Đi từ propene đến pent-1-ene, kích thước phân tử alkene tăng dần làm cho diện tích bề mặt tiếp xúc giữa
chúng cũng tăng, tương tác van der Waals giữa các phân tử do đó cũng tăng dần, dẫn đến nhiệt độ sôi các
alkene tăng dần. Ở điều kiện thường, propene và but-1-ene là các chất khí trong khi pent-1-ene là chất lỏng. o o t 4 7,6 C o o t 6 ,3 C o o t 30,1 C s s s
Câu 8. [CD - SGK] Thêm hex -1 - ene ( khối lượng riêng D = 0,67 g.mL-1) vào mỗi ống nghiệm chứa nước (D
= 1,00 g.mL-1) hoặc chloroform (CHCl có (D = 1,49 g 3
.mL-1) rồi lắc đều. Sau khi để yên vài phút, trường hợp
nào xảy ra sự phân lớp và khi đó chất nào ở lớp trên, chất nào ở lớp dưới? Hướng dẫn giải
- Khi thêm hex -1 - ene (khối lượng riêng D = 0,67 g.mL-1) vào mỗi ống nghiệm chứa nước (D = 1,00 g.mL-1)
hoặc chloroform (CHCl có (D = 1,49 g 3
.mL-1) rồi lắc đều thì sau khi để yên vài phút, có xảy ra sự phân lớp, chất
ở lớp trên là hex -1 - ene, chất ở lớp dưới là nước hoặc chloroform. Vì dựa vào giá trị D, chất có D càng nhỏ thì
chất đó nhẹ hơn, sẽ nổi lên trên.
Câu 9. [CD - SGK Năng lượng liên kết của liên kết C–C (trong phân tử ethane) là 368 kJ mol -1 và năng lượng
liên kết của liên kết C=C (trong phân tử ethene) là 636 kJ mol-1. Hãy cho biết liên kết nào (σ hay π) d bị b gãy
hơn khi phân tử tham gia phản ứng. Hướng dẫn giải
Ta có: Năng lượng liên kết của σ = 368 kJ mol -1
3n 1 Năng lượng liên kết π trong ethene là 636 - 368 = 268 kJ mol -1 2
Năng lượng liên kết π nhỏ hơn năng lượng liên kết σ nên khi tham gia phản ứng, liên kết π k m bền hơn liên kết
σ nên d bị bẽ gãy hơn.
Câu 10. [KNTT - SGK] Viết phương trình hóa học của các phản ứng:
(a) Propene tác dụng với hydrogen, xúc tác nickel.
(b) Propene tác dụng với nước, xúc tác acid H3PO4.
(c) 2-methylpropene tác dụng với nước, xúc tác acid H3PO4.
(d) But-1-ene tác dụng với HCl. Hướng dẫn giải 20