





Preview text:
Chương 1: CẤU TẠO NGUYÊN TỬ VÀ HỆ THỐNG
TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC 1. Cấu tạo nguyên tử
1.1. Thành phần nguyên tử: 2 phần chính là vỏ nguyên tử và
hạt nhân nguyên tử ( có ở phổ thông rồi)
Hạt nhân mang điện tích dương, số đơn vị điện
tích dương của hạt nhân bằng số e trong vỏ ntu. Khối lương của hạt nhân xấp xỉ khối lượng nguyên tử 1.2. Thuyết lượng tử Planck:
Năm 1900, Planck: “ Ánh sáng hay bức xạ điện tử nói chung gồm những
lượng tử năg lượng phát đi từ nguồn sáng”
E = hv = hC/λ ( h= 6,625.10-34 J.s)
( Chú thích đơn vị: Ở trong sách)
λ Càng lớn thì tần số sóng càng bé, năng lượng càng nhỏ và ngược lại
1.3. Hệ thức tương đối Einstein:
Năm 1903, Einstein tìm ra mqh giữa vận tốc và khối lượng của vật chuyện động: E = mC2
Kết hợp với biểu thức của Planck: => mC2 = hC/λ => λ =h/mC
1.4. Bản chất sóng và hạt của electron 1.4.1. Mẫu ngtu Bohr E=hv=E2 – E1
Chuyển động của e trong ngtu gắn liền với việc thu hoặc
phát ra nặng dưới dạng bức xạ nên e cũng có tính chất sóng và hạt như bức xạ 1.4.2. Hệ thức De Broglie
Electron cũng có bản chất sóng và hạt nên mọi ptrinh mô tả
chuyển động của e phải thỏa mãn 2 t/chat đó λ = h/mv
1.4.3. Hệ thức bất định Heisenberg
“ Về nguyên tắc không thể xác định đồng thời chính xác cả
tọa độ và vận tốc của hạt, do đó không thể xác định hoàn
toàn chính xác quỹ đạo chuyển động của hạt ’’
2. Hàm sóng và ptrinh sóng của electron
2.1. Phương trình sóng Schrodinger
2.2. Kết quả giải phương trình sóng Schrodinger
2.3. Các số lượng tử và ý nghĩa
2.3.1. Số lượng tử chính(n): Số lớp
Ý nghĩa: Xác định năng lượng của electron
· n càng lớn thì năng lượng E càng lớn, electron càng ở cách xa nhân Số lượng tử 1 2 3 4 5 6 7 chính Mức năng lượng K L M N O P Q
2.3.2. Số lượng tử orbital (l) : Phân lớp
Ý nghĩa: Xác định momen động lượng của electron cũng
như xác định hình dạng và tên của orbital Số lượng tử orbital 0 1 2 3 4 (l) Phân lớp s p d f g
2.3.3. Số lượng tử từ ml
Trị số: ml có giá trị từ -l đến +l. => với 1 l thì có ( 2l +1) giá trị
Ý nghĩa; ml đặc trung cho sự định hướng của orbital trong
không gian xung quanh hạt nhân
2.3.4. Số lượng tử spin ms
Giá trị: ms chỉ nhận +1/2 hoặc -1/2
Ý nghĩa: ms đặc trưng cho trạng thái chuyển động riêng nội
tại của electron gắn với momen động lượng riêng của electron
· Trong từ trường ngoài, trạng thái ms = +1/2 có năng lượng thấp hơn
3. Orbital nguyên tử - Hình dạng các orbital nguyên tử ( Không đáng nhắc)
4. Ngtu nhiều electron – Sự phân bố electron trong ngtu nhiều e
4.1. Khái niệm về lớp, phân lớp và ô lượng tử
Lớp và phân lớp: Ở phổ thông
Ô lượng tử hay orbital: Các electron có 3 số lượng tử như nhau
(n,l,ml ) có trạng thái chuyển động orbital giống nhau thì tạo thành 1 orbital
VD: phân lớp d có l=2 -> ml = +2, +1, 0, -1, -2 có 5 ô lượng tử
4.2. Các quy luật phân bố electron trong nguyên tử nhiều electron 4.2.1. Nguyên lí Pauli
· Nội dung: Trong 1 nguyên tử không thể có hai hay nhiều
electron có cùng 4 số lượng tử
Dễ hiểu hơn: Trong 1 orbital chỉ có tối đa 2 e có spin ngược dấu
- Mũi tên hướng lên ứng với ms = +1/2
- Mũi tên hướng xuống ứng với ms = -1/2
4.2.2. Nguyên lí vững bền
“ Trong một nguyên tử ở trạng thái cơ bản, các e sẽ xếp
vào các phân lớp có mức năng lượng thấp trước sau đó
mới xếp sang các phân lớp có mức năng lượng cao hơn”
· Quy tắc Klechkowski: Lớp 10 4.2.3. Quy tắc Hund
“ Trong ngtu ở trạng thái cơ bản, các e thuộc cùng một
phân lớp sẽ được phân bố vào các ô lượng tử sao cho
tổng spin S của chúng ta là cực đại”
CHƯƠNG 2: CẤU TẠO PHÂN TỬ VÀ LIÊN KẾT HÓA HỌC
1 MỘT SỐ KHÁI NIỆM CẦN PHẢI HỌC THUỘC
1.1 KHÁI NIỆM VỀ PHÂN TỬ
phân tử là phần tử nhỏ nhất của một chất có khả năng tồn tại độc lập mà vẫn giữ nguyên tính chất của chất đó
VD: cùng là cacbon nhưng 1,2,3 nguyên tử cacbon hợp lại ko thành ra đc phân tử kim cương mà phải
cần đến 4 nguyên tử cacbon sắp xếp theo 1 trật tự xác định mới đc gọi là một phần tử của kim cương. 1.2 ĐỘ ÂM ĐIỆN
Đại lượng độ âm điện thể hiện khả năng hút cặp electron chung lại gần hạt nhân ( giống như lực hút của trái đất )
+ độ âm điện lớn lực hút mạnh
+ độ âm điện lớn tính phi kim mạnh ( dễ hiểu vì tính chất của phi kim là tính oxi hóa hay tính chất hút electron )
+ độ âm điện tăng theo chiều ngang trong bản tuần hoàn ( từ kim loại sang phi kim, từ trái sang phải )
+ độ âm điện tăng từ dưới lên trong bản tuần hoàn
+ giả sử có 2 chất A và B
lấy ĐỘ ÂM ĐIỆN CỦA CHẤT A – ĐỘ ÂM ĐIỆN CỦA CHẤT B = X( hiệu độ âm điện )
NẾU ĐỘ ÂM ĐIỆN CỦA CHẤT A – ĐỘ ÂM ĐIỆN CỦA CHẤT:
X >= 2 => cặp e chung lệch
về A và cho ra liên kết ion
NẾU ĐỘ ÂM ĐIỆN CỦA CHẤT A – ĐỘ ÂM ĐIỆN CỦA CHẤT: 0< X < 2 => cặp e chung lệch ko
nhiều về A và cho ra liên kết hóa trị phân cực
NẾU ĐỘ ÂM ĐIỆN CỦA CHẤT A – ĐỘ ÂM ĐIỆN CỦA CHẤT:
X = 0 => cặp e chung cách
đều A, B và cho ra liên kết hóa trị ko phân cực
tao phát hiện ra một cái rất hay đó là nguyên tắt L lớn và l nhỏ, mọi người lên mạng ghi cách
học thuộc bảng tuần hoàn nhanh, học thuộc bảng tuần hoàn sau đó t sẽ hướng dẫn cái nguyên
tắt L lớn và l nhỏ D D D D D D D D D
1.3 MỘT SỐ ĐẶC TRƯNG CỦA LIÊN KẾT 1.3.1
NĂNG LƯỢNG LIÊN KẾT
+ năng lượng liên kết là năng lượng đủ để phá vỡ liên kết để tạo thành nguyên tử ở trạng thái khí
ví dụ H2( khí ) -> H ( khí ) + H ( khí ) : NGUYÊN TỬ Ở TRẠNG THÁI KHÍ
+ năng lượng liên kết đặc trưng độ bền của liên kết, năng lượng lớn liên kết bền
1.3.2 ĐỘ DÀI LIÊN KẾT
nhớ 1 ý duy nhất: khoảng cách bé liên kết bền 1.3.3 GÓC LIÊN KẾT
góc liên kết là góc được tạo ra từ 3 nguyên tử
( là sao, cách hình dung thì cứ như hình học phẳng, đó là từ 3 điểm bất kì luôn tạo thành một phặt
phẳng, nối 3 điểm lại được 1 tam giác, sau đó chọn cái góc phù hợp là được )
VD trong nước thì lấy góc có đỉnh là nguyên tử oxi, chú ý cái ví dụ nha HOH=104,5 1.3.4
MOMEN LƯỠNG CỰC CỦA PHÂN TỬ
phần này khá khó hiểu nhưng mà yên tâm là t làm kĩ
đặt vấn đề: momen lưỡng cực là cái gì và nó được tạo ra nhằm mục đích gì ??????????????????
khi xét một phân tử khí bất kì, người ta muốn đánh giá xem là phân tử khí đó có phân cực ko và phân
cực mạnh hay yếu. lấy ví dụ là khí clorometan
ở đây để xác định là phân tử clorometan phân cực mạnh hay yếu thì người ta tạo ra momen lưỡng cực.
+ trọng tâm điện tích âm và dương có thể trùng nhau
+ trọng tâm âm dương trùng thì ko phân cực
+ trọng tâm âm dương ko trùng thì phân cực
Công thức tính mô men lưỡng cực
Mô men lưỡng cực (kí hiệu là µ) là tích của độ lớn của điện tích (Q) và khoảng cách giữa các tâm của
các điện tích dương và âm (r).
Mô men lưỡng cực (µ) = Điện tích (Q) * khoảng cách tách biệt (L)
Đo bằng đơn vị Debye ký hiệu là ‘D‘ (1D = 3,33564 × 10-30 C.m). Trong đó, Các đơn vị SI là
Coulomb (culông) nhân mét (C.m).
Ví dụ: Cho hai nguyên tử có độ âm điện là 2,0 và 4,0. Vậy Hiệu độ âm điện (Q) là 2,0 và nếu các
nguyên tử được phân tách bằng khoảng cách (r) 1,0 Angstrom, thì momen lưỡng cực sẽ là 2,0 D (Debye).
Mô men lưỡng cực liên kết phát sinh trong liên kết hóa học giữa hai nguyên tử có độ âm điện khác
nhau có thể được biểu thị như sau: μ = . d Trong đó:
● μ là mô men lưỡng cực liên kết, ●
là độ lớn của các điện tích riêng + và – ,
● Và d là khoảng cách giữa + và – .
Ví dụ: Nếu chúng ta coi HCl là một hợp chất ion thuần túy thì điện tích của hydro và clo = 4,8 × 10−10
esu và độ dài liên kết = 1,27 × 10 −8 cm.
Momen lưỡng cực của HCl μ = × d
= 4,8 × 10−10 × 1,27 × 10 −8 esu cm
Mômen lưỡng cực = 1,03 × 10 −18 esu cm = 1,03 Debye.
Mô men lưỡng cực của liên kết (μ) cũng là một đại lượng vectơ, có hướng song song với trục liên kết.
Trong hóa học, các mũi tên được vẽ để biểu diễn các mô men lưỡng cực bắt đầu ở điện tích dương và
kết thúc ở điện tích âm.
momen lưỡng cực của phân tử cộng hóa trị 0 < x <4, phân tử ion 4 < x < 11 2
LIÊN KẾT ION ( NHÀ VẬT LÝ NGƯỜI ĐỨC KOSSEL NĂM 1916 ) 2.1 ĐỊNH NGHĨA
bổ sung kiến thức về ion
Khi một nguyên tử hay nhóm nguyên tử bị mất (hoặc thu nhận thêm) một hay nhiều electron thì gọi là
ion (hoặc có thể gọi là điện tích).
Ion có thể được chia thành 2 loại chính là ion âm (anion) và ion dương (cation) - Quá trình tạo ra các ion gọi là ion hóa:
● Các ion âm mang điện tích âm khi thu được một hay nhiều electron.
● Các ion dương mang điện tích dương khi mất một hay nhiều electron. định nghĩa chính
+ liên kết ion hình thành do lực hút tĩnh điện giữa anion và cation
+ hợp chất tạo nên bằng cách đó gọi là hợp chất ion VD: NaCl
sự tạo thành liên kết ion _ kl có năng lượng ion hóa thấp -> cation
mục đích: để kl và pl đạt được
_pk có năng lượng ion hóa cao -> anion
cấu hình khí trơ
2.1 ĐIỀU KIỆN HÌNH THÀNH LIÊN KẾT ION LÀ ĐỘ ÂM ĐIỆN >= 2
2.2 ĐẶC ĐIỂM CỦA LIÊN KẾT ION
+ liên kết ko có tính định hướng: hút ion trái dấu về bất kì hướng nào
+ liên kết ko có tính bão hòa: các ion liên kết với nhau ko làm biến mất đi điện trường của ion nên có
1 ion có thể liên kết nhiều ion
===> DO 2 TÍNH CHÂT NÊU TRÊN
+ ion có khuynh hướng liên kết mạnh
+ ở nhiệt độ cao có thể tồn tại ion riêng lẻ
+ ở nhiệt độ thấp mọi hợp chất ion ở thể rắn, cấu trúc tinh thể, toàn bộ tinh thể là một phân tử khổng lồ,
+ có nhiệt độ nóng chảy, nhiệt độ sôi cao
VD: muối, oxid kl, hydroxid (OH) kl —
CHƯƠNG 3: NHIỆT ĐỘNG HÓA HỌC TÍNH ΔU TÍNH ΔQ TÍNH ΔH TÍNH ΔS TÍNH ΔG = U2-U1 = Q2-Q1 = H2-H1 = S2-S1 = G2-G1 = Q + A = ΔU + P.ΔV = ΔU + P.ΔV = R.ln (W2/W1) = ΔH – T.ΔS = Q - P.ΔV = ΔU + ΔnRT = Q/T ΔU: nội năng ΔQ: nhiệt năng ΔH: enthaply ΔS: entropy ΔG: thế đẳng áp 1. NGUYÊN LÍ I 1.1 NỘI DUNG
_Năng lượng ko tự nhiên sinh ra và mất đi, chúng chỉ chuyển từ dạn này sang dạng khác
_Nội năng của hệ cô lập được bảo toàn 1.2 BIỂU THỨC
ΔU = U2-U1 = Q + A = Q + A ( CHỐNG ÁP SUẤT ) + A ( LỰC KHÁC )
lưu ý lực khác có thể là lực ma sát,…
A ( CHỐNG ÁP SUẤT ) = -P. ΔV = -ΔnRT n: là số mol khí P: là áp suất (atm) V: là thể tích (l)
R: là hằng số (R=22,4:273 = 0,082)
T: là nhiệt độ kelvin (k) T = 273 + nhiệt độ C
=> ΔU = U1-U2 = Q + A = Q - P.ΔV => Q = ΔU + P.ΔV
xét biểu thức Q = ΔU + P.ΔV
đẳng tích ΔV = V2-V1 = 0 đẳng áp P = const
Q(v) = ΔU và A (chống áp suất) = P.ΔV = P.0 Q(p) = ΔH = ΔU + P. ΔV ( Enthalpy ) =0
PƯ trong chất rắn: Q(v) = Q(p) = ΔH = ΔU
lỏng: Q(v) = Q(p) = ΔH = ΔU
khí: ΔH = ΔU + P.ΔV = ΔU + ΔnRT (nếu thể tích khí không đổi hay Δn=0 => ΔH = ΔU)
1.3 NHIỆT HÓA HỌC: là sự mất hoặc thêm năng lượng dưới các dạng năng lượng
khác nhau trong PƯ (VD: quang năng, điện năng,…), đặt biệt nhiệt năng là quan trọng nhất.
@@@ chú ý quan trọng khi vào phần này là ΔH của phản ứng, ΔH0 là của chất ( thường là sản phẩm ).
1.3.1 HIỆU ỨNG NHIỆT CỦA PHẢN ỨNG: là lượng nhiệt tỏa ra hay thu vào trong
PƯ, đồng thời lượng nhiệt tỏa ra hay thu vào trong PƯ lại phụ thuộc vào sự tăng giảm ΔH.
_ Đơn vị đo: cal/mol; J/mol; Kcal/mol; KJ/mol.
_PƯ ko xúc tác nhiệt ΔH<0
_PƯ có xúc tác nhiệt ΔH>0
_ ΔH(0): hiệu ứng nhiệt tiêu chuẩn ở 25 độ C và 1 atm ( người ta tạo ra cái này để đi so sách
với ΔH có nhiệt độ khác 25 độ, 1 atm, khác một trong hai hoặc khác cả hai )
1.3.2 SINH NHIỆT ( NHIỆT TẠO RA TRONG PƯ ) ( ΔHs hoặc ΔHtt )
_Sinh nhiệt tiêu chuẩn của một hợp chất là hiệu ứng nhiệt trong PƯ hình thành chất đó
bằng các đơn chất khác, bền ở điều kiện tiêu chuẩn.
_Sinh nhiệt của các đơn chất bền = 0. VD: O2, H2, Cl2,…
1.3.2 NHIỆT PHÂN HỦY ( ΔHph )
_Nhiệt phân hủy tiêu chuẩn của một hợp chất là hiệu ứng nhiệt của PƯ phân hủy một mol
chất đó thành các đơn chấ bển ở đktt ( ngược lại với sinh nhiệt )
_ Do ngược với sinh nhiệt nên -ΔH0s = ΔH0ph
1.3.3 THIÊU NHIỆT ( NHIỆT ĐÓT CHÁY TRONG OXI ) ( ΔH0c )
_Thiêu nhiệt tiêu chuẩn của một chất là hiệu ứng nhiệt của PƯ đốt cháy 1 mol chất đó
bằng oxi vừa đủ để tạo thành oxit bền ở đktt.
_Đối với PƯ có chứa nguyên tố => thiêu nhiệt của nguyên tố = sinh nhiệt oxid
1.3.4 ĐỊNH LUẬT HESS: ĐƠN LÀ GIẢN LÀ TÍNH TỔNG NHƯ BTH ( CHÚ Ý DẤU )
ΔH(PƯ) = tổng ΔHs (SP) - tổng ΔHs (TG) (TG viết tắt của tham gia) ΔH(PƯ)
= tổng ΔHc (TG) - tổng ΔHc (SP)
_Hiệu ứng nhiệt của chuỗi PƯ vòng tròn = 0
_ΔH thuận = - ΔH nghịch NGUYÊN LÍ II
ü Không thể chuyển trạng thái từ lạnh sang nóng (chỉ chuyển được từ nóng sáng lạnh)
ü Công có thể biến đổi hoàn thành nhiệt, nhiệt không thể biến đổi thành công
ü Không thể tạo ra động cơ vĩnh cửu loại 2, loại động cơ biến nhiệt hoàn toàn thành công
CÁC CÔNG THỨC CHỦ YẾU CỦA BÀI VÀ MỘT SỐ CHÚ Ý 1. Hệ là gì?
ü Hệ là một vật thẻ hay một nhóm vật thể, cách biệt với môi trường xung quanh bằng
bề mặt thực hay tưởng tượng ·
Có các loại hệ: kín, hở, cô lập tự học
ü Hệ dị thể là hệ tồn trong đó tồn tại bề mặt phân chia giữa các phần trong hệ => Hệ đồng thể ngược lại 2. Qúa trình -
Là hệ biến đổi trạng từ trạng thái này sang trạng thái khác gọi là QUÁ TRÌNH -
Nếu sau một số biến đổi mà hệ trở về trạng thái ban đầu gọi là quá trình vòng
ngược lại quá trình mở - Qúa trình đẳng áp P=0 - Quá trình đẳng tích V=0 -
Quá trình đẳng nhiệt Q=0
Qúa trình không trao đổi nhiệt với môi trường, nhưng trao đổi A (công) được gọi là quá trình đoạn nhiệt
Ø CHÚ Ý: Đoạn nhiệt không trao đổi chất và năng lượng với môi trường
Thực hiện không cần quá trình ngoài (không tiêu thụ công từ bên ngoài) Tự diễn biến: Kết thúc lại sinh công Quá trình
Không tự diễn biến: không thực hiện được nếu không có sự tác động từ bên ngoài => tiêu tốn 3. HÀM TRẠNG THÁI -
Chỉ phụ thuộc vào trạng thái đầu và trạng thái cuối của hệ không phụ thuộc vào quá trình -
Nếu phụ thuộc vào quá trình là hàm quá trình
VD: P, V, U, S, H, G là những hệ thuộc hàm quá trình -
LƯU Ý: Q và A thuộc hàm quá trình Ø Các công thức lưu ý 1. Nội năng
Là năng lượng dữ trữ bên trong hệ
+ Năng lượng chuyển động tịnh tiến + Năng lượng hạt nhân
+ Năng lượng liên kết hóa học
+Năng lượng dao động nguyên tử ð ∆U=U2-U1
Nội năng phụ thuộc vào hàm trạng thái ∆U = A + Q
Hệ nhận nhiệt or công => Q,A> 0
Hệ Sinh nhiệt và công => Q,A <0 Q=∆U+ P.∆V A =- P.∆V -
Nếu quá trình đẳng tích thì ∆V= 0 => Q= ∆U
KẾT LUẬN: Nhiệt tỏa ra hay thu vào của quá trình đẳng tích bằng biến thiên nội năng của hệ 2. HIỆU ỨNG NHIỆT:
Hiệu ứng nhiệt là lượng nhiệt tỏa ra hay thu vào của 1 mol đơn chất or hợp chất
Lượng nhiệt tỏa ra hay thu vào bằng sự tăng hay giảm entaphy của hệ
Tỏa nhiệt ra môi trường: ∆H<0 Thu nhiệt: ∆H> 0 -
HƯN tiêu chuẩn là 25oC, 1atm Sinh nhiệt (∆Hs or ∆Ht ) Nhiệt phân hủy
-Là pứng tạo thành 1 mol hợp chất từ
Là pứng phân hủy từ 1 mol hợp những đơn chất bên
chất thành các đon chất đơn giản
VD ∆Hs(HCl) = -22,06 kcal/ mol
CHÚ Ý: Sinh nhiệt của các đơn chất bền CHÚ Ý: ∆Hph= -∆Hs ở đk chuẩn bằng 0 Thiêu nhiệt ( ∆Hc ) -
Là HƯN đốt cháy hoàn toàn 1 mol chất với oxi tạo ra oxit bằng -
Đốt chát 1 mol chất hữu cơ tạo thành co2 và h2o VD: C + O2 -> CO2 ∆Hc (C)
CHÚ Ý: Đối với nguyên tố, thiêu nhiệt của một nguyên tố chính là sinh nhiệt của oxit bền của nó
VD: - ∆H là Sinh nhiệt CO2 o Thiêu nhiệt của C Entaphy Entrophy
Đa số pứng xảy ra xác suất không đổi
Là hàm trạng thái, đặc trưng cho mức độ hỗn loạn ∆H= ∆U+ P∆V
của hệ. Hệ sẽ trạng thái bền nhất khi entropy cực đại
VẬY H là hàm trạng thái của hệ vì U,P,V đều là là (Smax) hàm trạng thái S = RlnW
Kết luận: lượng nhiệt tỏa ra thu vào trong quá trình
W xác suất của trạng thái, kí hiệu
đẳng áp bằng biến thiên enthalpy của hệ R là hằng số lí tưởng Ta có CHÚ Ý:
W1 có xác suất nhỏ hơn so với W2 cũng là hàm
Chỉ có chất rắn và chất lỏng tham gia => ∆U= trạng thái ) 0 vậy ∆H = ∆U ∆S = S2 – S1= RlnW2/W1
Đối với chất khí thì ta có ∆H = ∆U + ∆nRT ∆S = S2 – S1 >0
n= n (sp)- n ( tg), ∆n =0 => ∆U=∆H
Biến thiên entropy thuận nghịch ∆S = S2 – S1= Q/T
Q: lượng nhiệt thu vào hay tỏa
ra của hệ trong quá trình thuận nghịch
T: nhiệt độ tại đó xảy ra sư trao đổi nhiệt Chú ý:
- Hệ càng phức tạp, entrophy càng lớn - ∆V > 0 => S tăng - ∆V < 0 => S giảm - Entrophy cân bằng ∆Spu= ΣSsp – ΣStg Skhí > Slỏng > Srắn
Downloaded by Nguyen Linh (vjt68@gmail.com) 3. Định luật Hess:
Chỉ phụ thuộc vào bản chất và trạng thái đầu và trạng thái cuối không phụ thuộc vào quá trình.
VD: Nó xảy ra nhiều quá trình thì ta dùng cộng đại số hoặc trừ đại số Ø Hệ quả:
Sinh nhiệt: ∆Hpư= ΣHs(sp) – ΣH(tg)
Thiêu nhiệt: ∆Hpư= ΣHs(tg) – ΣH(sp) · CHÚ Ý:
Hiệu ứng nhiệt của một quá trình vòng bằng 0
Trong pứng thuận nghịch: ∆Hthuân = - ∆Hnghịch · Ưng dụng
- Tính hiệu ứng nhiệt của pứng theo đentaHs, đentaHc
- Tính hiệu ứng nhiệt của nhiều pứng không thể đo trực tiếp
- Tính năng lượng của thức ăn đưa vào trong cơ thể
Thế nhiệt động và tiêu chuẩn tự diễn biến và giới hạn của quá trình
vThế đẳng áp (năng lượng tự do Gibbs): DG = DH – TDS
DG0pứ = SDG0tt (sản phẩm) - SDG0tt (chất đầu) (kJ) (kJ/mol) (kJ/mol)
Đơn chất bền có DG0tt= 0
vTiêu chuẩn tự diễn biến và giới hạn của quá trình:
· DG < 0 phản ứng xảy ra tự phát tại nhiệt độ khảo sát hoặc xảy ra theo chiều thuận
(đối với phản ứng thuận nghịch).
· DG > 0 phản ứng không xảy ra tại nhiệt độ khảo sát hoặc xảy ra theo chiều ngược
lại (đối với phản ứng thuận nghịch).
· DG = 0 phản ứng đạt cân bằng.
vẢnh hưởng của T đến DG khi biết dấu DH và DS:
· DH và DS ngược dấu: dấu của DG không phụ thuộc nhiệt độ T.
DH < 0 và DS > 0: phản ứng tự phát xảy ra mọi nhiệt độ.
DH > 0 và DS < 0: phản ứng không xảy ra mọi nhiệt độ.
· DH và DS cùng dấu: dấu của DG phụ thuộc nhiệt độ T.
DH và DS cùng > 0: phản ứng tự phát xảy ra ở nhiệt độ cao T > DH/DS
DH và DS cùng <0 : phản ứng tự phát xảy ra ở nhiệt độ thấp T< DH/DS
Lưu ý:Hệsốcânbằngphảnứng
Trạng thái của các chất
Đơn vị của mỗi đại lượng
Dấu năng lượng (+, thu nhiệt) hay (-, tỏa nhiệt)
Chọn giá trị R phù hợp: R = 8,314 (J.mol-1.K-1) hoặc R = 1,987 (cal.mol-1.K-1)
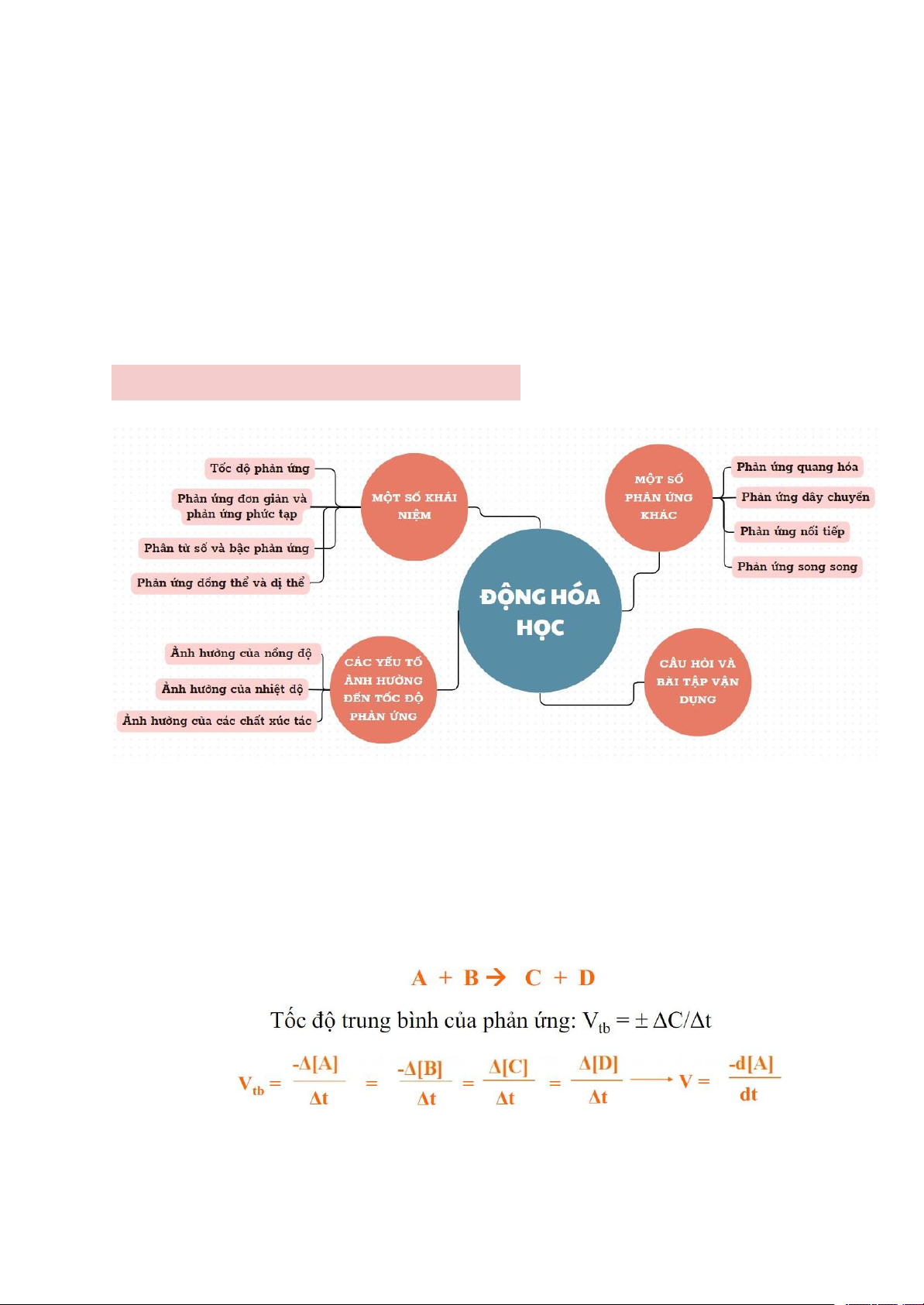
Downloaded by Nguyen Linh (vjt68@gmail.com) CHƯƠNG 4: ĐỘNG HÓA HỌC I.Một số khái niệm 1. Tốc độ phản ứng
- Mức độ nhanh/chậm của một phản ứng
- Biểu thị bằng biến thiên nồng độ của chất tham gia/ sản phẩm trong một đơn vị thời gian Trong đó: + C: nồng độ (mol/l)
Downloaded by Nguyen Linh (vjt68@gmail.com) + t: thời gian (giây) + v: tốc độ (mol/l.giây)
- Tốc độ tức thời của phản ứng: tốc độ tại thời điểm t xác định
+ Tính bằng đạo hàm của nồng độ theo thời gian (v>0)
Nếu C là nồng độ chất tham gia → lấy dấu trừ (-)
Nếu C là nồng độ sản phẩm → lấy dấu cộng (+) => Đảm bảo v>0
2. Phản ứng đơn giản và p/ư phức tạp
- P/ư đơn giản: chỉ diễn ra qua 1 giai đoạn vd: H2 + I2 → 2HI NO + O3 → NO2 + O2
- P/ư phức tạp: xảy ra qua nhiều giai đoạn vd:
là phản ứng phức tạp vì có 2 gđ:
+ N2O5 → N2O3 + O2 (1)
+ N2O5 + N2O3 → 4NO2 (2)
- Mỗi giai đoạn của phản ứng phức tạp được gọi là một tác dụng đơn giản. Tập
hợp các tác dụng đơn giản xảy ra trong một phản ứng phức tạp được gọi là cơ
chế của phản ứng.
3. Phân tử số và bậc phản ứng
a. Phân tử số: (số nguyên) là số tiểu phân (phân tử, nguyên tử hay ion) đồng thời
tương tác với nhau trong một giai đoạn của phản ứng.
- Người ta phân biệt phản ứng đơn phân tử, lưỡng phân tử, tam phân tử
vd: (đếm số phân tử tham gia) pư đơn phân tử
H2 + I2 → 2HI pư lưỡng phân tử
2NO + 2H2 → N2 + 2H2O pư tam phân tử
- Phản ứng 4 pt trở lên thường ít gặp, đại đa số là PUHH đơn hoặc lưỡng phân tử
b. Bậc phản ứng: (số nguyên hoặc phân số, có thể bằng 0) bằng tổng số mũ của
nồng độ các chất phản ứng ghi trong biểu thức định luật tác dụng khối lượng.
- Nếu tổng các số mũ đó là 1, 2, 3… thì phản ứng được gọi là phản ứng
bậc một, bậc hai, bậc ba … - Cách xđ bậc phản ứng
Downloaded by Nguyen Linh (vjt68@gmail.com)
+ Phản ứng phức tạp: (6 phút, dễ hiểu, phải xem)
https:/ www.youtube.com/watch?v=GoCpdOjxwNI
+ Phản ứng đơn giản: cộng hệ số
2H2 + O2 → 2H2O là pư bậc 3 (= hệ số H2 + hệ số O2) - Chú ý:
+ PƯ đơn giản → bậc phản ứng trùng với phân tử số
+ PƯ phức tạp → bậc phản ứng k trùng với pt số (do bậc pư xác
định dựa trên giai đoạn xảy ra chậm nhất)
+ Khi nồng độ các chất rất khác nhau → bậc của chúng k trùng với
hệ số tỉ lượng của chất pư vd:
là pư bậc 1 vì lượng nước khi thủy phân rất lớn -> ảnh hưởng
của nước đến quá trình hầu như k đổi → k cần chú ý đến
4. Phản ứng đồng thể và dị thể
- Phản ứng đồng thể: là pư xảy ra trong hệ đồng thể
N2(k) + 3H2(k) ⇄ 2NH3 (k)
- Phản ứng dị thể: là pư xảy ra trong hệ dị thể (phức tạp hơn đồng thể, vì
ngoài qtr chuyển hóa học còn có qtr chuyển vật thể đến biên giới tiếp xúc 2 pha và ngược lại)
C(r) + H2O(h) → CO(k) + H2(k) I .
Các yếu tố ảnh hưởng đến tốc độ phản ứng (áp suất, nhiệt độ, nồng độ
chất, S tiếp xúc, chất xúc tác,. ) → độ, chấ3 yếu tố cơ bản: nồng độ, nhiệtt xúc tác 1. Nồngđộ
- Định luật tác dụng khối lượng: Ở nhiệt độ xác định, tốc độ phản ứng tỉ
lệ thuận với tích số nồng độ các chất tham gia phản ứng với số mũ là hệ
số tỷ lượng của các chất đó trong ptr phản ứng.
- Các chất tham gia phản ứng va chạm nhau → xảy ra phản ứng hóa học
⇒ gọi là va chạm có hiệu quả
- Nồng độ các chất tăng → va chạm có hiệu quả tăng → tốc độ phản ứng tăng
- Đối với phản ứng tổng quát: aA + bB → cC + dD
Downloaded by Nguyen Linh (vjt68@gmail.com)
Tốc độ Phản ứng Theo Định Luật Tác Dụng Khối Lượng Được biểu diễn bằng công thức:
+ k: hằng số tốc độ, phụ thuộc vào bản chất của phản ứng và nhiệt độ
+ CA và CB: nồng độ mol/l của A và B tại thời điểm ksat
+ m,n: bậc pư của chất A và B (số mũ) - PƯ đơn giản m=a và n=b
- PƯ phức tạp m,n được xác định trong giai đoạn chậm nhất
+ m+n = bậc phản ứng (cách tính m,n,k trong video 6p ở trên)
- Đối với phản ứng thuận nghịch: aA + bB ⇌ cC + dD
Tốc độ phản ứng = hiệu số các tốc độ của pư thuận nghịch: v=v(t) - v(n)
Tại tt cân bằng: v=0 vì v(t)=v(n) 2. Nhiệt độ 3. Chất xúc tác III.
Một số phản ứng khác IV. Câu hỏi và BTVD
Downloaded by Nguyen Linh (vjt68@gmail.com)