Preview text:
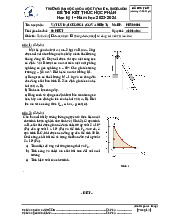
1. Momen quán tính
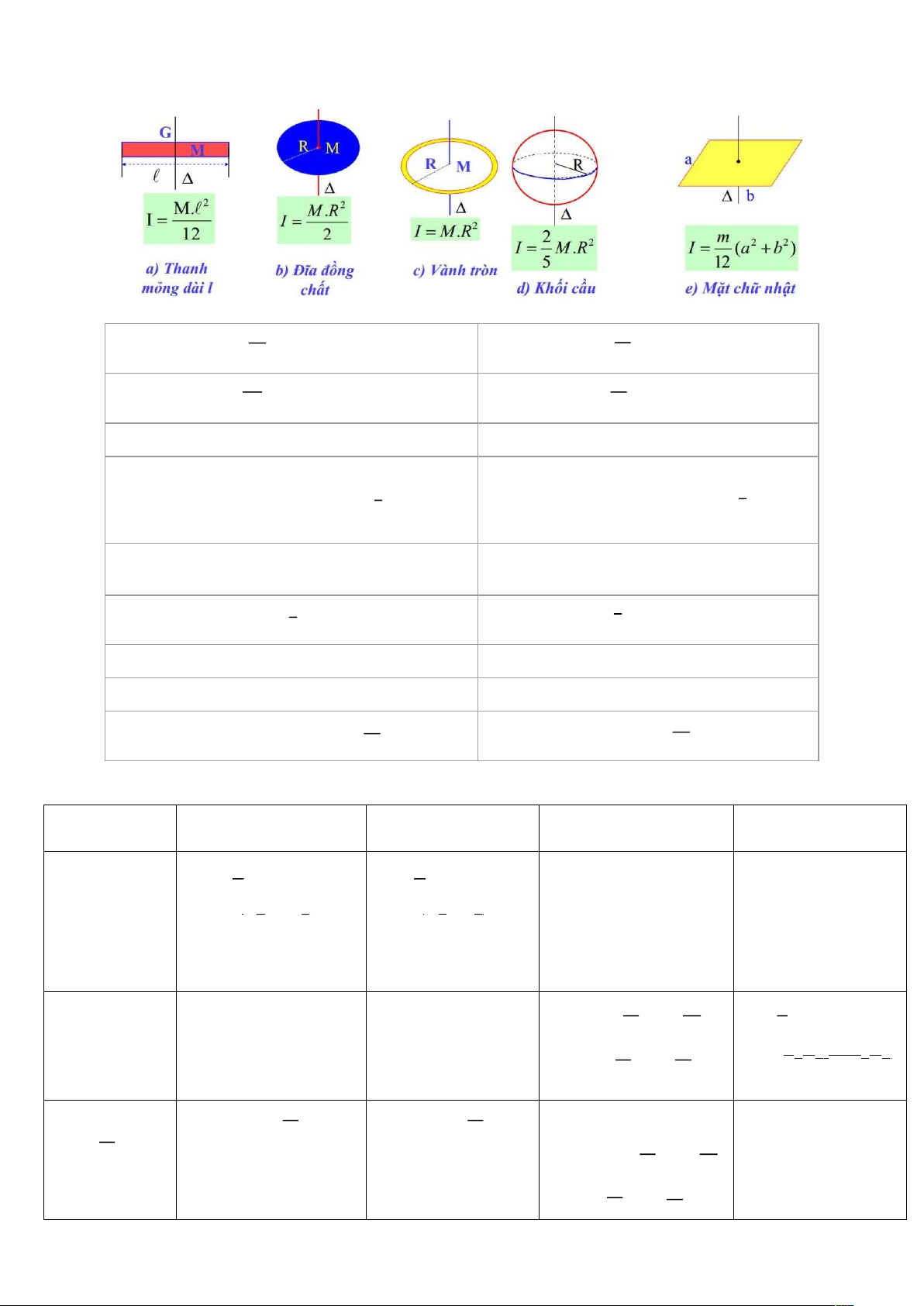
2. Các phương trình trong chuyển động quay & chuyển động tịnh tiến Vận tốc góc: 𝜔 = 𝜔 𝑑
Vận tốc dài: 𝑣 = 𝑑𝑠 𝑑𝑡 𝑑𝑟 𝜔 𝑑 𝑑𝑣 Gia tốc góc: 𝜔 = Gia tốc dài: 𝑎 = 𝑑𝑡 𝑑𝑡
Tổng mômen lực: ∑ 𝑀⃗→ = 𝜔 𝐼 →
Tổng hợp lực: ∑ 𝐹→ = 𝑚 → 𝑎 𝜔 𝑣 𝑓 = 𝜔𝑖 + 𝜔𝑡 𝑓 = 𝑣𝑖 + 𝑎𝑡
Nếu β = const: { 𝜔 = 𝜔 + 𝜔 𝑡 + 1 𝜔𝑡2
Nếu a = const: { 𝑠 = 𝑠 + 𝑣 𝑡 + 1 𝑎𝑡2 𝑓 𝑖 𝑖 𝑓 𝑖 𝑖 2 2
𝜔2 − 𝜔2 = 2𝜔(𝜔 − 𝜔 )
𝑣2 − 𝑣2 = 2𝑎(𝑠𝑓 − 𝑠𝑖) 𝑓 𝑖 𝑓 𝑖 𝑓 𝑖 𝜔 Công: A = ∫ 𝑓 𝜔 𝜔 𝑑 𝑠𝑓 Công: A = 𝐹𝑑𝑠 𝜔 ∫ 𝑖 𝑠𝑖
Động năng quay: 𝐾 = 1 𝜔 𝐼 2
Động năng: 𝐾 = 1 𝑚𝑣2 𝑅 2 2 Công suất: 𝑃 = M𝜔 Công suất: 𝑃 = 𝐹𝑣
Mômen động lượng: 𝐿 = 𝜔 𝐼
Động lượng: 𝑝 = 𝑚𝑣 𝑑𝑝
Phương trình mômen lực: ∑ 𝑀⃗→ = 𝑑⃗𝐿→
Phương trình lực: ∑ 𝐹→ = → 𝑑𝑡 𝑑𝑡 3. Phần nhiệt Đẳng tích Đẳng áp Đẳng nhiệt Đoạn nhiệt Quá trình (V = const) (P = const) (T = const) (Q = 0) Biểu thức cân P V PV = TVγ−1 = const bằng = const = const const T T T Vγ−1 = T P1 P P = 2 V1 1V1 = T =_2 Vγ−1 1 1 T2 T1 T2 P2V2 1 2 2 PVγ = const P Vγ = P Vγ 1 1 2 2 Công 0 A = −P(V i 2 − V1) m V2 A = − RTln V2 μ V A = (P2V2 − P A = − ∫ PdV 1 m P 1V1) 2 1 P V = − RTln 2V2 − P 1V1 1 A’=-A μ P = 2 γ − 1 Nhiệt lượng m m m 0 m Q = Q C Q = Q Q = −A = RTln Q = C∆T V = μ V∆T P = C μ V2 μ P∆T μ V1 m = P RTln 1 μ P2 Nội năng m iR m iR 0 m iR ∆U = ΔT ∆U = ΔT ∆U = ΔT μ 2 μ 2 μ 2 Phương trình iR i C ĐỘNG CƠ NHIỆT trạng thái khí lý V = C + 1) R 2 P = (
Hiệu suất của động cơ nhiệt: 2 tưởng: A′ Q′2 m PV =
Khí đơn nguyên tử (He, Ar, Xe, …): i =3 η = = 1 − μ
Khí hai nguyên tử (lưỡng nguyên tử) (H2, O2, Q 1 Q1 RT
A’: công mà động cơ sinh ra, Q1: nhiệt lượng N P (N/m2), 2, …): i = 5
động cơ nhận từ nguồn nóng, Q2’: nhiệt lượng
Khí ba nguyên tử trở lên (CO V (m3), m (kg), 2, H2O, …): i = 6
động cơ tỏa ra cho nguồn lạnh μ (kg/kmol),
Hệ số Poisson: γ = CP = 1 + 2
Chu trình Carnot: cho η cao nhất, gồm Đẳng R (J/(kmol K)), CV i
nhiệt-Đoạn nhiệt-Đẳng nhiệt-Đoạn nhiệt: C T T (K) P = CV + R η = 1 − 2 max T1
Cho biết các hằng số:
R = 8,31.103J/kmolK: Hằng số khí lí tưởng
NA = 6,023. 1026 phân tử khí trong 1 kmol, số Avoradro
kB = 1,38. 10−23J/K: Hằng số Boltzmann
Khối lượng phân tử của một số khí phổ biến: μH = 2kg/kmol; μ = 32kg/kmol; μ = 2 O2 H2O = 18kg/kmol; μN2
28kg/kmol μHe = 4kg/kmol; μCO = 44kg/kmol; μ 2 air = 29kg/kmol
Đơn vị áp suất: N/m2 = Pa 1atm = 760mmHg = 1,01. 105N/m2 1at = 736mmHg = 9,81. 104N/m2
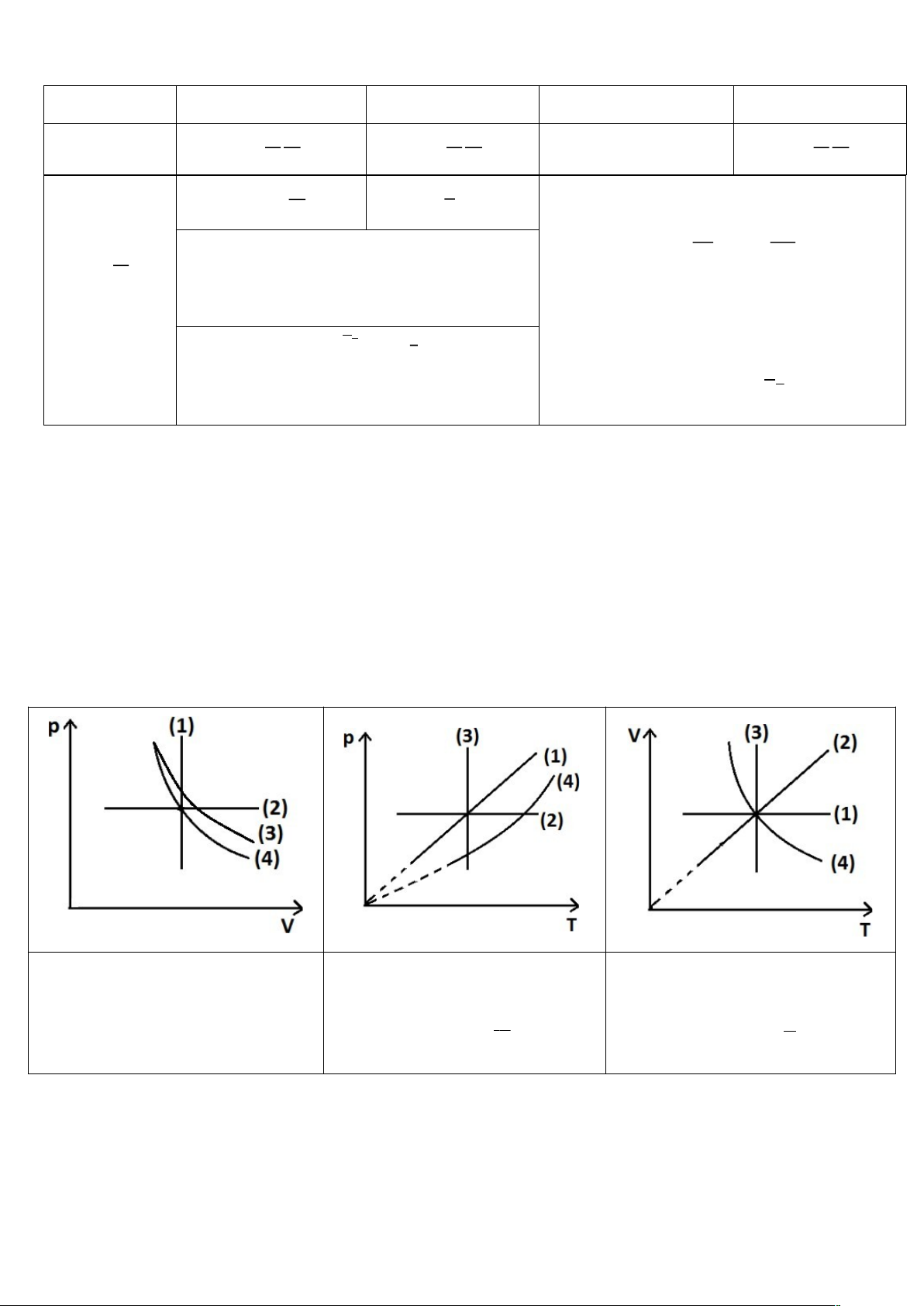
(1): Đẳng tích: V const
(1): Đẳng tích: P const.T
(1): Đẳng tích: V const (2): Đẳng áp: P const (2): Đẳng áp: P const
(2): Đẳng áp: V const.T
(3): Đẳng nhiệt: PV const
(3): Đẳng nhiệt: T const
(3): Đẳng nhiệt: T const
(4): Đoạn nhiệt: PV const 1
(4): Đoạn nhiệt: P T1
(4) : Đoạn nhiệt: V T1