





Preview text:
Nội dung 2: Xác định một số chỉ tiêu trong môi trường đất
2.1. Đại cương về độ chua
pH= -lg[H+], là đại lượng biể thị hoạt độ H+ trong môi trường đất. Đó
là chỉ tiêu đơn giản đầu tiên về độ chua thường được xác định nhất, nó
có ý nghĩa rất lớn trong việc đánh giá tính chất đất.
Độ chua là yếu tố đo độ phì nhiêu của đất, nó ảnh hưởng đến các
quá trình sinh lí hóa và sinh học trong đất. Đa số cây trồng thích ứng ở
đất, trung tính(pH= 6-7); một số có thể chịu đất chua như chè, khoai tây
(pH = 4,5-5,5). Đất chua là do sự có mặt của các ion H+ và Al3+ trong
dung dịch đất cũng như trong các hệ phức hấp thụ của đất càng chua và
ngược lại; độ chua của đất phụ thuộc vào các phương pháp xác định,
trong đó chất chiết rút có ý nghĩa lớn trong trao đổi các ion H+ và Al3+.
Trên cũng một loại đất, nếu dùng chất chiết rút NaOH 0,01M sẽ có nồng
độ chua lớn( khoảng 19mmol/100g đất), trong khi cới CH3COONa 1M thì
độ chua thấp ( khoảng 6mmol/100g đất); nếu dùng NaCl 1M thì độ chua
xác định được là rất thấp ( khoảng 0,2mmol/100g đất). Nguyên nhân do
H+ có khả năng liên kết mạnh với OH-, bé hơn với CH3COO- và không
liên kết với Cl-. Đa số đất Việt Nam là đất chua. Độ pH phản ánh mức độ
rửa trôi của các cation kiềm và kiềm thổ cũng như mức độ tích tụ các
cation sắt, nhôm trong đất.
Độ chua của đất thông thường được chia làm 2 loại:
- Độ chua hiện tại (độ chua hoạt tính): Là độ chua gây nên do
các ion H+tự do trong dung dịch đất và được xác định khi hoà
tan đất trong nước cất.
- Độ chua tiềm tàng: Được xác định khi chiết rút đất bằng dung
dịch muối. Dựa vào chất chiết rút, độ chua tiềm tàng được lại
được chia thành độ chua trao đổi và độ chua thuỷ phân
Độ chua trao đổi : Độ chua trao đổi được tạo nên bởi các ion H+ và
Al3+, khi pH= 5,5 – 6,5 thì còn rất ít hoặc không còn Al3+di động sử dụng
chất chiết rút là các dung dịch muối trung tính như KCl, NaCl, BaCl2. Các
cation của các muối này đẩy H+ và một phần Al3+ ra khỏi hệ phức hấp
phụ, Al3+bị thuỷ phân tạo thành độ chua của đất. Lượng H+và Al3+ trao
đổi nói lên mức độ rửa trôi cation kiềm, phá huỷ keo đất. Cây có thể chết
khi đất quá chua hoặc chứa nhiều nhôm di động. Độ chua trao đổi là 1
chỉ số để xác định nhu cầu bón vôi cho đất. Kí hiệu pHKCl
Độ chua thuỷ phân: Độ chua của đất được xác định khi sử dụng
chất chiết rút là một muối chứa anion thuỷ phân (như CH3COONa). Độ
chua thuỷ phân có trị số lớn hơnđộ chua trao đổi, vì gần như toàn bộ
H+và Al3+đã được trao đổi (Độ chua thuỷ phân chính là tổng số độ chua
tiềm tàng). Từ đó ta tính được lượng vôi cần bón, tính dung tích.
2.2. Hóa chất, dụng cụ
- Hóa chất: Các dung dịch đệm pH tiêu chuẩn: 4,01; 7,00; 9,18.
- Dung dịch trao đổi KCl 1M: Cân 74,5g KCl hòa tan thành 1 lít
dung dịch bằng nước cất. Độ pH của dung dịch bằng khoảng
độ pH của nước cất(5,6-6,6). Trong trường hợp độ pH của
dung dịch cao hoặc thấp hơn cần điều chỉnh bằng dung dịch
HCl 0,5M, kiểm tra bằng máy đo pH.
- Nước cất có độ dẫn điện riêng không lớn hơn 0,2ms/m và pH = 5,6 – 6,6 ở 25⸰
- Dụng cụ: Máy đo pH, máy lắc, bình tam giác 100ml, cối
nghiền, tủ sấy, rây sàng 0,3mm, máy lắc. 2.3. Xử lí mẫu
- Mặt đất lấy về được phơi khô ở điều kiện tự nhiên, không có
ánh sáng chiếu vào khoảng 5-7 ngày.
- Dùng cối xứ nghiền mịn mẫu đất, sau đó cho đi rây sàn kích thước 0,3mm.
2.4. Xác định độ chua
2.4.1. xác định độ chua hoạt tính
- Cân 20g mẫu đất đã được nghiền mịn cho vào bình có dung tích 100ml miệng rộng
- Thêm 50ml nước cất, lắc đều trên máy lắc 30 phút, để yên 2 giờ
- Lắc đều bằng tay cho huyền phù phân tách, đo ngay giá trị pH.
2.4.2. Xác định độ chua trao đổi
- Cân 20g mẫu đất đã được nghiền mịn cho vào bình có dung tích 100ml miệng rộng
- Thêm 50ml dung dịch KCl 1M, lắc xoáy bằng tay cho phân tán đất và
tiếp tục lắc đều trên máy lắc 30 phút, để yên 2 giờ (không quá 3 giờ).
- Lắc xoáy lại 2-3 lần bằng tay cho phân tách huyền phù.
- Sau đó đo ngay bằng máy đo pH. Vị trí ban đầu điện cức ở vị trí trung
tâm và rung điểm độ sau của dung dịch trong huyền phù.
- Đọc số đo sau khi giá trị ổn định sau 30s. Các ghi chú: -
Số đo cần được ghi đủ số có nghĩa theo mức độ chính xác của máy -
Trước khi đo, máy phải được hoạt động trước 30 phút, kiểm tra độ
nhay của máy, điều chỉnh máy bằng các dung dịch pH tiêu chuẩn. -
Sau mỗi lần đo cần rửa bầu điện cực bằng nước cất và thấm khô bằng giấy lọc mềm -
Sau nhiều nhất 10 lần đo mẫu, phải kiểm tra và điều chỉnh máy pH
chuẩn nằm trong khoảng đo. -
Sau khi đo xong cần rửa sạch điện cực, thấm khô và nhũng điện
cực trong cốc đựng dung dịch KCl bão hòa. -
Máy đang được để trong phòng khô, thường xuyên sấy máy bằng cách cho máy hoạt động. -
Điện cực luôn được ngâm trong cốc đựng dung dịch KCl bão hòa.
Thường xuyên bổ sung nước vào cốc, không để nước cạn khô và tinh
thể KCl bám trên điện cực.
2.5. Báo cáo kết quả và nhận xét
Nội dung 3 : Ứng dụng hóa học và hóa lý trong xử lý môi trường
3.1. Xử lý nước thải bằng phương pháp lọc Cơ sở lí thuyết
Lọc là quá trình làm sạch nước thông qua lớp vật liệu lọc, nhằm
tách các hạt cặn lơ lửng, các thể keo tụ và VSV trong nước.
Vật liệu lọc có nhiều loại như sỏi, thạch ạnh, cát thạch anh, than
hoạt tính, cát mangan,... Tuỳ theo đặc điểm của nước mà lựa chọn vật liệu lọc khác nhau. Tiến hành
- Đo chỉ số pH, độ đục, độ màu, SS, COD của nước thải trước khi lọc.
- Đóng van nước, đổ vật liệu lọc vào cột lọc sao cho có chiều cao bằng nhau.
- Chuẩn bị nước thải và cho đi qua cột lọc.
- Cho nước thải chảy qua cột lọc khoảng 10 – 15 phút thì tiến hành lấy
mẫu nước thải sau khi lọc và đem đo chỉ số pH, độ đục, độ màu, SS, DO.
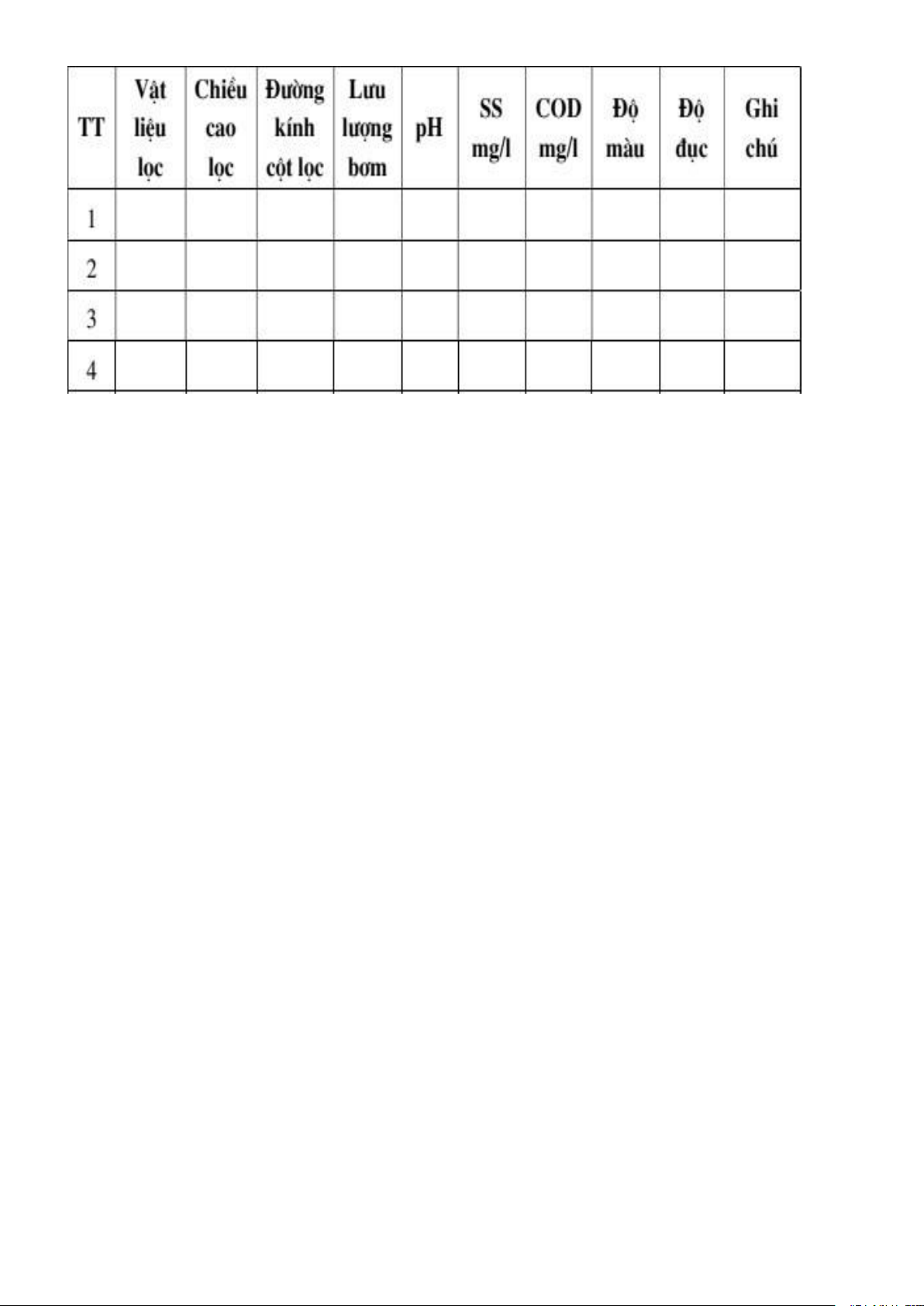
Bảng 3.1. Ảnh hưởng của vật liệu lọc tới hiệu quả xử lý nước
Báo cáo kết quả dạng bảng và đưa ra nhận xét.
3.2. Xử lý nước thải bằng phương pháp leo tụ tạo bông
Nước thải sinh hoạt, nước thải công nghiệp thường chứa một lượng lớn
các chất lơ lửng khó lắng và rất khó để xử lý được bằng phương pháp lắng thông thường.
Phương pháp xử lý keo tụ tạo bông là một trong những phương pháp
hữu hiệu để xử lí nguồn ô nhiễm này, phương pháp này thích hợp vối
nước thải chứa chất rắn lơ lửng cao; nước thải dệt nhuộm, nước thải giết
mổ, thủy sản, công nghiệp,…
Hóa chất keo tụ tạo bông thường dùng là: phèn nhôm(Al2(SO4)3), phàn
sắt II ( FeSO4), phèn sắt III(FeCl3), chất keo tụ PAC( Poly Aluminium Chloride)…
Nguyên lý của quá trình xử lý nước thải bằng đong keo tụ
Phương pháp đông tụ và keo tụ là quá trình thô húa các hạt phân
tán và nhũ tương, độ bên tập h[ bị phá hủy, hiện tượng lắng xảy ra. Sử
dụng đông tụ hiệu quả khi các hạt keo phân tán có kích thước 1-100 µm.
Để tạo sự đông tụ, cần có thêm các chất đông tụ như: -
Phèn nhôm Al2(SO4)3.18H20 . Độ hòa tan của phè nhôm trong nước
ở 200C là 362g/l, pH tối ưu từ 4,5-8.
- Phèn sắt FeSO4.7H2O . Độ hòa tan của phèn sắt trong nước ở 20oC
là 265 g/l. Quá trình đông tụ bằng phèn sắt xảy ra tốt nhất ở pH>9.
- Các muối FeCl3.6H2O, Fe2(SO4)3.9H2O, MgCl2.6H2O, MgSO4.7H2O. Tiến hành
Lấy 200ml mẫu nước thải cho vào cốc 1 lít và cho chất đông keo tụ cới
lượng nhỏ, sau mỗi lần tăng thêm lượng chất, khuấy trộn nhanh 1 phút
sau đó khuấy chậm 3 phúc. Thêm lượng chất đông keo tụ cho đến khi
thấy bông cặn hình thành. Ghi nhận lượng chất đông keo tụ.
Bảng 3.2. Lập bảng kết quả với từng chất đông keo tụ TT pH SS mg/l DO mg/l Độ màu Độ dục Ghi chú 1 2 3 4 5 6
Báo cáo kết quả dạng bảng và đưa ra nhận xét.
3.3. Khử trùng bằng nước Javel
Javel có tên gọi là Natri Hypoclorit (NaClO). Phương pháp khử
trùng nước thải bằng Javel được sử dụng phổ biến sau Clo. Nước Javel
có nồng độ Clo hoạt tính từ 6 – 8g/l.
Các phản ứng hóa học xảy ra khi cho Javel vào nước:
Tương tự như HClO, NaClO có tính oxi hóa rất mạnh nên phá vỡ
các sắc tố màu sắc của các chất, phá vỡ cấu trúc sinh học của vi sinh vật.
Ở trong nước NaClO:
Document Outline
- Các phản ứng hóa học xảy ra khi cho Javel vào nước



