


Preview text:
Số đăng ký thuốc là gì? Các ký hiệu số đăng ký thuốc, cách tra cứu
1. Số đăng ký thuốc là gì?
Nhằm đảm bảo thuốc được lưu hành trên thị trường tuân thủ đúng các quy
định của pháp luật và được sử dụng một cách an toàn, hiệu quả, các sản
phẩm là thuốc bao gồm thuốc, vắc xin, sinh phẩm cần được đăng ký thuốc.
Theo đó, hoạt động đăng ký thuốc là hoạt động xin cấp phép lưu hành hay
đăng ký lưu hành cho các sản phẩm là thuốc. Hoạt động này chịu sự quản lý của Bộ Y tế.
Cụ thể, đăng ký thuốc có mục đích là để chứng minh, chứng nhận loại thuốc
đó đảm bảo an toàn, hiệu quả. Cũng như đã được cơ quan có thẩm quyền
tiến hành các nghiệp vụ kiểm tra, cấp phép cho lưu hành rồi. Từ đó, đủ điều
kiện để lưu hành và sử dụng theo quy định của Bộ Y tế Việt Nam. Cũng như
các loại thuốc lưu hành trên thị trường bắt buộc phải được cấp phép lưu hành,
có số đăng ký thuốc theo trình tự, thủ tục quy định.
Số đăng ký thuốc có thể hiểu là ký hiệu chứng minh loại thuốc đó đảm bảo an
toàn, hiệu quả để lưu hành và sử dụng theo quy định của Bộ Y tế Việt Nam,
để các loại thuốc có thể lưu hành trên thị trường thuốc tại Việt Nam, các đơn
vị phải thực hiện hoạt động xin cấp phép lưu hành hay còn gọi là đăng ký
thuốc. Số đăng ký thuốc được ký hiệu bao gồm các chữ và số, phản ánh trên
bao bì của các sản phẩm thuốc được lưu hành. Trong đó, mỗi bộ phận lại
cung cấp và thể hiện một thông tin về loại thuốc đó. Số đăng ký này được các
cơ quan chức năng của Bộ y tế quy định cho một loại hoặc sinh phẩm chuẩn đoán.
Số đăng ký thuốc nhằm đảm bảo thuốc được lưu hành bên ngoài thị trường
sẽ đảm bảo được tính chất, chất lượng, an toàn và hiệu quả sử dụng. Nếu
sinh phẩm hóa dược đó đáp ứng các yêu cầu mà Bộ Y tế đưa ra thì chúng
được cấp số đăng ký thuốc.
2. Cách đọc số đăng ký thuốc
Như đã đề cập trước đó, số đăng ký thuốc là kí hiệu để chứng minh loại
thuốc đó an toàn, hiệu quả để lưu hành trên thị trường Việt Nam. Không chỉ
thuốc mà các loại dược phẩm khác cũng có kí hiệu riêng biệt. Việc đọc đúng
các ký hiệu trên bao bì sản phẩm không chỉ giúp người tiêu dùng phân biệt rõ
đâu là thuốc, đâu là thực phẩm chức năng, hóa mỹ phẩm,... thì số đăng ký
còn thể hiện xuất xứ và quy trình sản xuất của loại thuốc đó, được quy định
cụ thể tại quyết định số 1203/BYT-QĐ. Ví dụ:
VD-…-yy: thuốc sản xuất trong nước
VN-…-yy: thuốc nước ngoài
V…-H12-yy: thuốc từ dược liệu sản xuất trong nước
VS-…-yy: thuốc dùng ngoài sản xuất trong nước
GC-…-yy: thuốc sản xuất gia công
QLĐB-…-yy: các thuốc quản lý đặc biệt
3. Cách tra cứu số đăng ký thuốc
Để tra cứu số đăng kí thuốc, người tiêu dùng có thể tra cứu tại website
của Tổng công ty Dược Việt Nam (http://vinapharm.com.vn), có thể tra cứu
rất nhiều thông tin của các thuốc đang được phép lưu hành tại Việt Nam: Tên
thương mại, Hoạt chất, Số đăng ký thuốc, Nhà sản xuất.
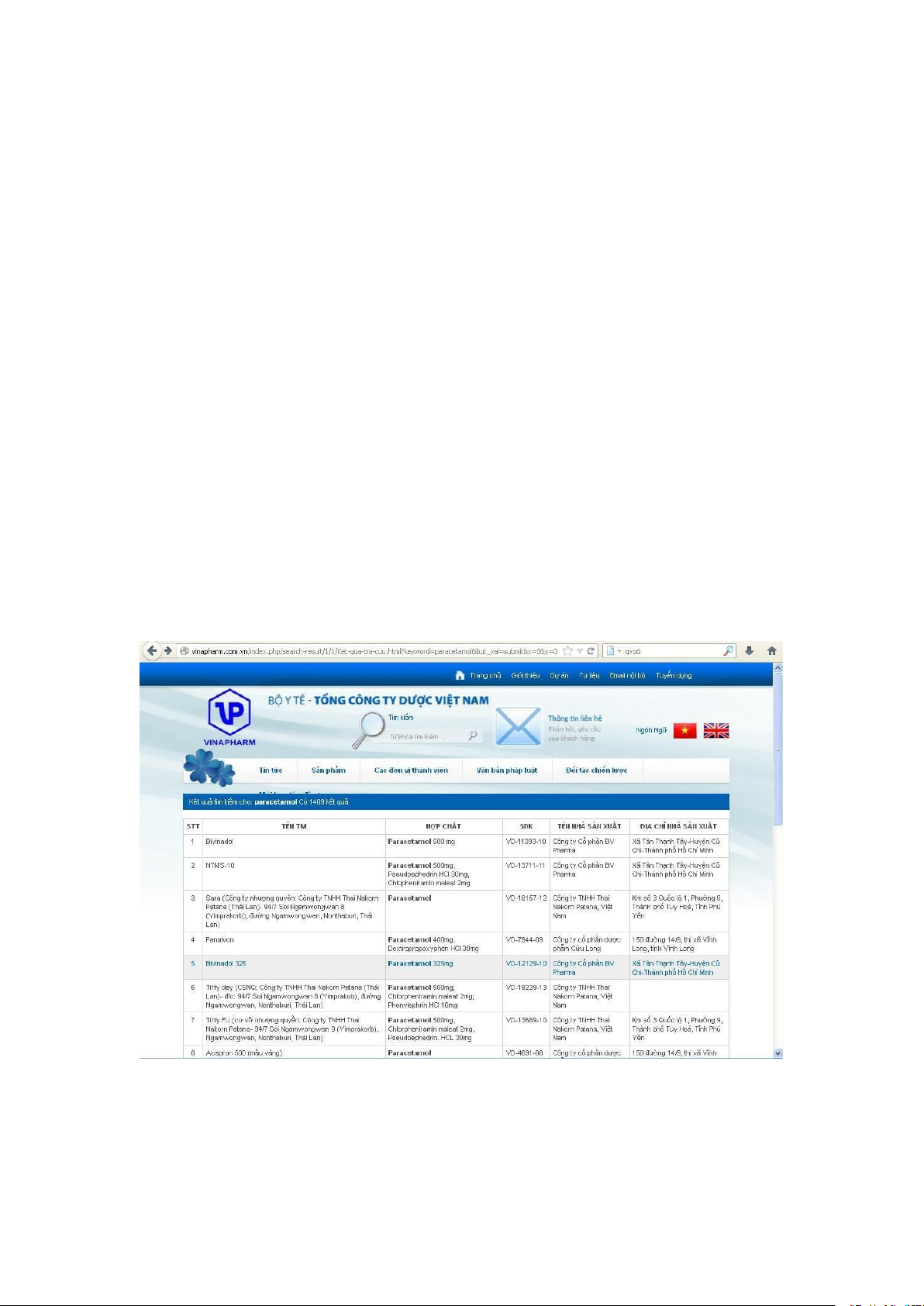
Ví dụ: Muốn tìm hiểu các thông tin về Paracetamol, gõ dòng chữ
“Paracetamol” rồi click ô “Tra cứu”, sẽ hiện ra bảng sau:
Đây là bảng cung cấp các thông tin cơ bản nhất, nếu muốn biết các thông tin
cụ thể hơn, click vào tên thương mại của các thuốc tương ứng cần tìm hiểu thông tin.
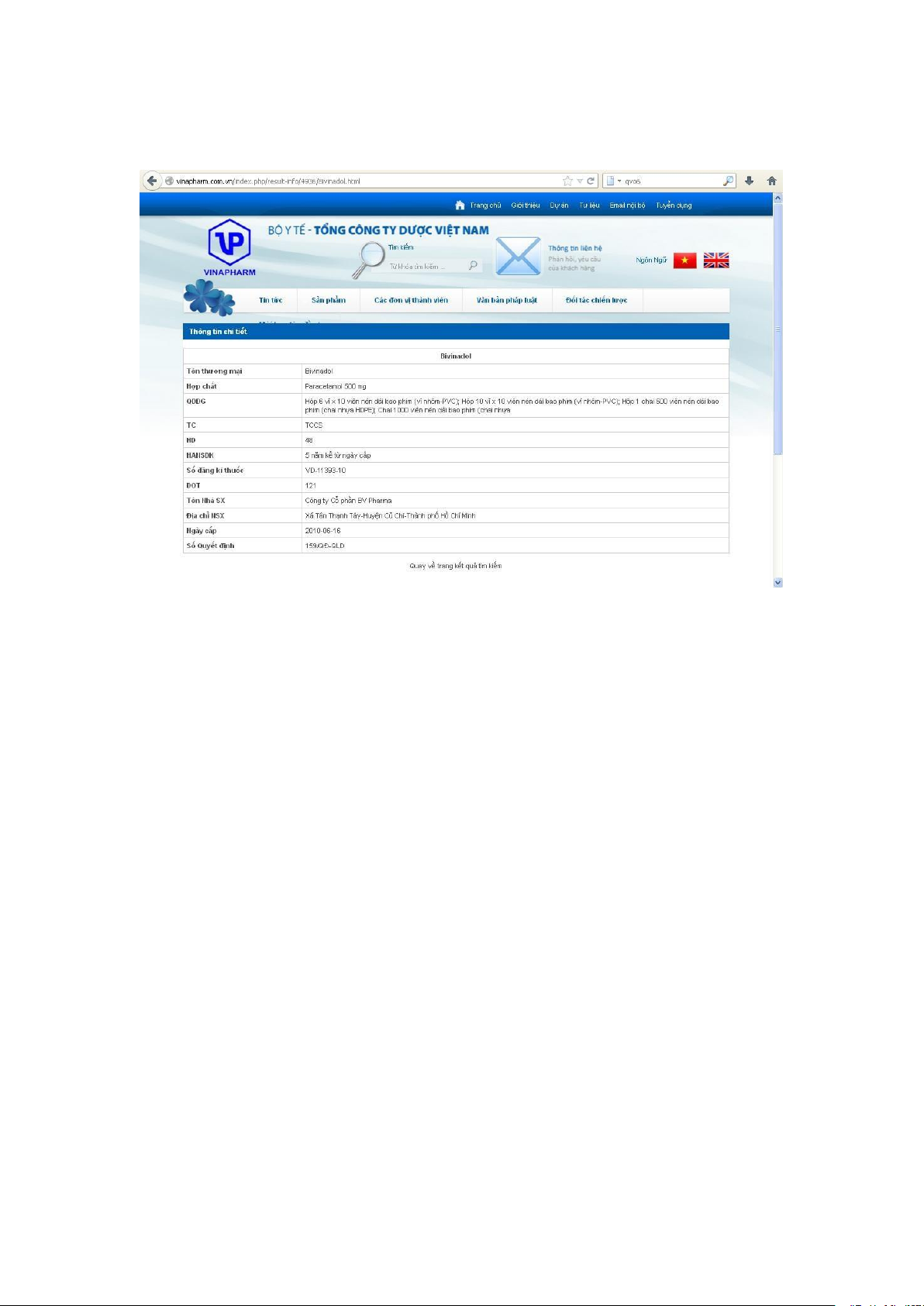
Ví dụ: Muốn tìm hiểu kỹ thông tin của thuốc Bivinadol, click vào dòng chữ
Bivinadol, sẽ hiện ra bảng thông tin sau:
Đây là bảng cung cấp tất cả các thông tin cụ thể về sản phẩm
Tương tự như vậy áp dụng với việc tìm các thông tin khác. Ví dụ như tìm các
sản phẩm của Công ty CPDP Trung ương 1 – Pharbaco, gõ dòng chữ
“Pharbaco” sẽ hiện ra bảng thông tin về các sản phẩm đang lưu hành của Công ty Lưu ý khi tra cứu:
- Khi muốn tra cứu thông tin cần nhập chính xác Tên thương mại, Hoạt chất,
Số đăng ký thuốc hoặc Nhà sản xuất (Không phân biệt chữ thường hay chữ in hoa)
- Đối với một số hoạt chất, do cách đặt tên quốc tế và Việt Nam có khác nhau
ở chữ “e” cuối cùng nên cần tra cứu cả hai trường hợp. Ví dụ: Khi cần tra cứu
thông tin của “Omeprazole” cần tra cứu cả “Omeprazole” và “Omeprazol” để
có được kết quả đầy đủ nhất.
4. Thủ tục trình tự đăng kí thuốc
4.1. Đối với thuốc tân dược sản xuất trong nước
Trình tự thực hiện đăng kí gồm các bước sau:
Bước 1: Hồ sơ đăng ký được gửi về Cục Quản lý Dược (Cục QLD)
Bước 2: Cục Quản lý Dược tiếp nhận, thẩm định hồ sơ và tổ chức hội đồng
xét duyệt thuốc và ban hành danh mục thuốc được cấp số đăng ký;
Bước 3: Trả cho đơn vị thông báo, Quyết định ban hành số đăng ký tại nơi tiếp nhận.
Việc thực hiện đăng ký qua đường bưu điện hoặc nộp trước tiếp tại Cục quản lý Dược.
Thời hạn giải quyết: Trong vòng 06 tháng kể từ ngày nhận đủ hồ sơ hợp lệ.
Thành phần hồ sơ đăng kí bao gồm: Trang bìa Mục lục hồ sơ Đơn đăng ký
Tóm tắt đặc tính thuốc Quy trình sản xuất
Tiêu chuẩn chất lượng và phương pháp kiểm nghiệm (đầy đủ, chi tiết);
Phiếu kiểm nghiệm thuốc của một trong những cơ sở: Viện kiểm nghiệm,
phân viện kiểm nghiệm. Có sở sản xuất đạt tiêu chuẩn GMP, phòng kiểm nghiệm đạt GLP
Tài liệu nghiên cứu về độ ổn định Nhãn thuốc
Mẫu nguyên liệu: 1 đơn vị đóng gói cho 1 quy cách đăng ký lưu hành
Tra cứu nhãn hiệu hàng hoá hoặc giấy chứng nhận bảo hộ nhãn hiệu hàng
hoá đối với thuốc mang tên thương mại.
4.2. Đối với thuốc tân dược nước ngoài lưu hành tại Việt Nam
Trình tự thực hiện đăng kí gồm các bước sau:
Bước 1: Hồ sơ đăng ký được gửi về Cục Quản lý Dược (Cục QLD)
Bước 2: Cục Quản lý Dược tiếp nhận, thẩm định hồ sơ và tổ chức hội đồng
xét duyệt thuốc và ban hành danh mục thuốc được cấp số đăng ký;
Bước 3: Trả cho đơn vị thông báo, Quyết định ban hành số đăng ký tại nơi tiếp nhận
Thời hạn giải quyết: Trong vòng 06 tháng kể từ ngày nhận đủ hồ sơ hợp lệ.
Cơ quan thực hiện thủ tục hành chính: Cục Quản lý Dược - Bộ Y tế.
Thành phần hồ sơ đăng ký bao gồm: Trang bìa Mục lục hồ sơ Đơn xin đăng ký
Giấy chứng nhận đủ điều kiện kinh doanh dược hoặc giấy phép đăng ký
công ty nước ngoài đối của Công ty đứng tên đăng ký.
Tóm tắt đặc tính thuốc
Giấy phép lưu hành thuốc tại nước sản xuất do cơ quan có thẩm quyền cấp (FSC hoặc CPP). Giấy chứng nhận GMP.
Quy trình sản xuất (Nêu đầy đủ, chi tiết);
Tiêu chuẩn chất lượng và phương pháp kiểm nghiệm.
Phiếu kiểm nghiệm thuốc của cơ sở sản xuất.
Tài liệu nghiên cứu về độ ổn định của thuốc.
Nhãn thuốc;(được thiết kế hoặc gắn). Mẫu thuốc.
Tra cứu nhãn hiệu hàng hoá hoặc giấy chưng nhận bảo hộ nhãn hiệu hàng
hoá đối với thuốc mang tên thương mại.
Lưu ý: Đối với hồ sơ đăng kí thuốc, tất cả các tài liệu trong hồ sơ phải được
cơ sở sản xuất ký xác nhận (ký tên và đóng dấu). Hồ sơ đăng ký thuốc nước
ngoài phải được viết bằng tiếng Việt hoặc tiếng Anh. Tờ tóm tắt đặc tính
thuốc phải được viết bằng tiếng Việt.
5. Một số lưu ý khi lưu hành thuốc
Bên cạnh những vấn đề cần lưu ý khi đăng ký thuốc như vấn đề về hồ sơ thủ
tục, cơ quản quản lý, thời hạn giải quyết,.. thì trong quá trình lưu hành thuốc,
cần lưu ý một số điểm như sau:
Theo luật định thì thời hạn hiệu lực của giấy đăng ký lưu hành thuốc, nguyên
liệu làm thuốc là 5 năm kể từ ngày cấp hoặc gia hạn. Ngoài ra cần lưu ý
về yêu cầu đối với nhãn thuốc cũng cần đảm bảo theo quy định pháp luật.
Thuốc thành phẩm nhập khẩu vào Việt Nam có hạn dùng trên 24 tháng thì
hạn dùng còn lại tối thiểu phải là 18 tháng kể từ ngày đến cảng Việt Nam. Đối
với thuốc có hạn dùng bằng hoặc dưới 24 tháng thì hạn dùng phải còn tối
thiểu là 12 tháng kể từ ngày đến cảng Việt Nam.
Document Outline
- Số đăng ký thuốc là gì? Các ký hiệu số đăng ký thu
- 1. Số đăng ký thuốc là gì?
- 2. Cách đọc số đăng ký thuốc
- 3. Cách tra cứu số đăng ký thuốc
- 4. Thủ tục trình tự đăng kí thuốc
- 4.1. Đối với thuốc tân dược sản xuất trong nước
- 4.2. Đối với thuốc tân dược nước ngoài lưu hành tạ
- 5. Một số lưu ý khi lưu hành thuốc




