












Preview text:
Bài 1: TÁCH VÀ ĐỊNH TÍNH CÁC SULFONAMID BẰNG
PHƯƠNG PHÁP SẮC KÝ LỚP MỎNG 1. Hóa chất
- Chất ối chiếu: sulfaguanidin, sulfamethoxazol, sulfanilamid, sulfacetamid. - Dung môi khai triển: + Chloroform + Methanol
- Paradimethyl amino belzaldehyd (PDAB).
- Mẫu thử: Mẫu tự tạo chứa 1 hoặc nhiều sulfonamid ở trên. 2. Dụng cụ
- Bản mỏng silicagel F254 (Merck) - Bình khai triển SKLM - Ống ong - Đũa khuấy - Mao quản chấm sắc ký
- Giấy bảo hòa bình sắc ký - Bình hút ẩm - Đèn tử ngoại 3. Tiến hành
3.1. Hoạt hóa bản mỏng:
Bản mỏng trước khi sử dụng cần ược hoạt hóa bằng cách ể 1 giờ trong tủ sấy ở 110
oC và làm nguội trong bình hút ẩm. 3.2. Chiết sulfonamid
Nghiền kỹ viên sulfamid (hoặc mẫu tự tạo do bộ môn chuẩn bị) cần ịnh tính trong
cối, cho 20ml ethanol vào. Lọc lấy dịch vào cốc có mỏ, làm bay hơi trên bếp cách
thủy. Cắn ược dùng ể chấm lên bản mỏng.
3.3. Chấm mẫu thử lên bản mỏng
- Dùng mao quản thủy tinh ể chấm:
+ Các vết sulfonamid chuẩn
+ Hỗn hợp những sulfonamid cần ịnh tính lOMoAR cPSD| 36844358
+ Một vết chấm trùng cho tất cả các dung dịch
(Chú ý: mỗi dung dịch ược chấm bằng một ống mao quản khác nhau)
- Các vết chấm nên nằm trên cùng một ường thẳng có ánh dấu cách bờ dưới
của bản mỏng khoảng 1cm và các vết chấm phải cách nhau ít nhất 1 cm.
- Vết chấm càng nhỏ càng tốt, tuyệt ối không làm thủng lớp silicagel khi
chấm. Khi chấm nhiều lần thì sau mỗi lần chấm phải ợi cho vết chấm khô
hẳn rồi mới chấm tiếp. 3.4. Triển khai sắc ký
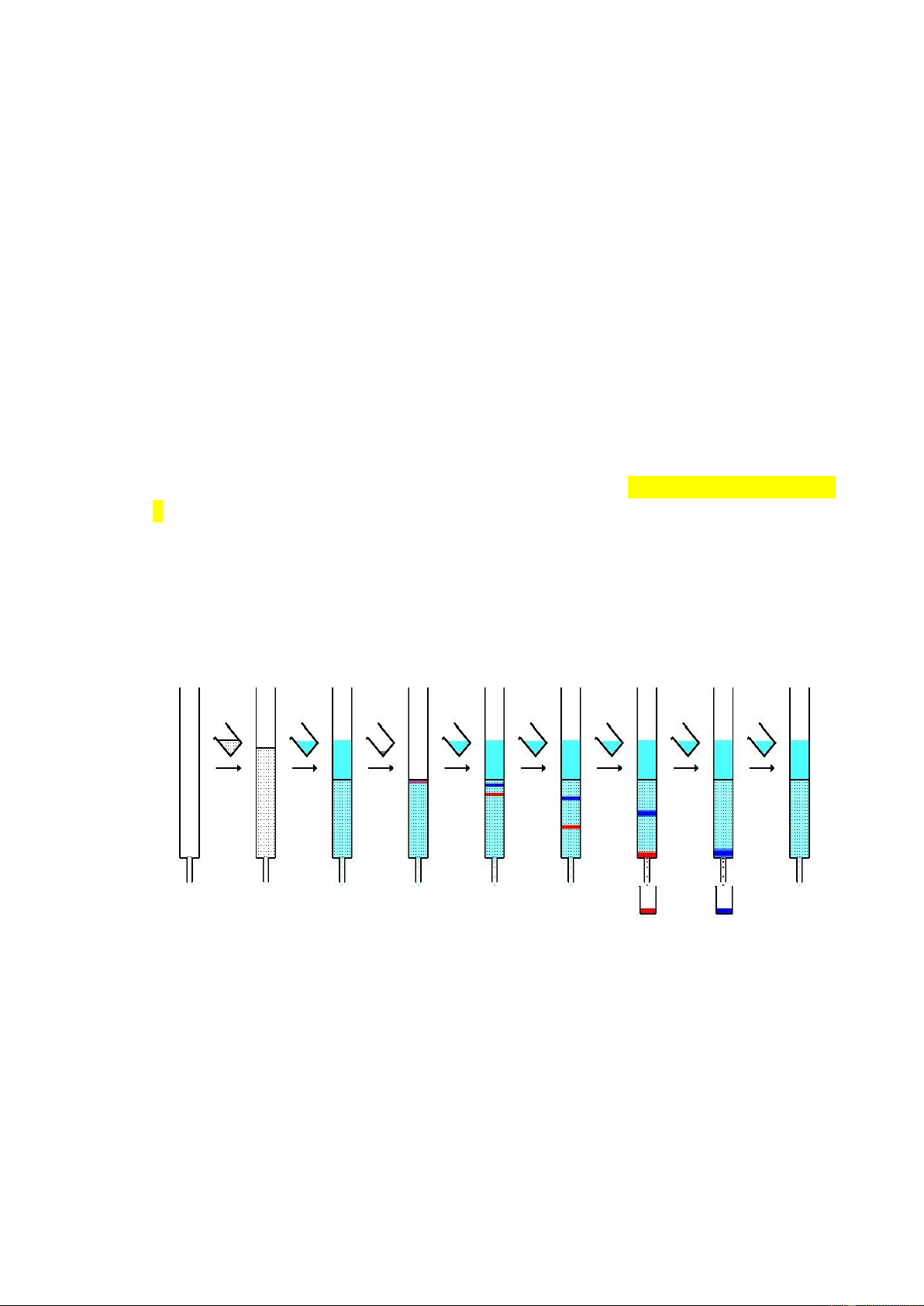
- Chuẩn bị bình khai triển: rửa sạch bình, làm khô. Cho dung môi khai triển
Chloroform – Methanol (3:1 v/v) vào bình và bão hòa dung môi trong bình
bằng giấy bão hòa sắc ký.
- Đặt bản mỏng ã chấm vào bình khai triển, những vết chấm phải nằm trên
mức dung môi trong bình. Đậy bình lại và triển khai ến khi vạch dung môi
cách mép trên của bản sắc ký khoảng 0,5 cm. Lấy bản mỏng ra khỏi bình và
vạch ngay ường dung môi bằng bút chì.
3.5. Phát hiện - Để khô bản mỏng ã triển khai ngoài không khí, quan sát dưới
ền tử ngoại, sau ó phun thuốc thử PDAB.
- Tính Rf của mỗi vết. Định danh hỗn hợp và xác ịnh tên từng vết chấm.
- Kết luận về thành phần mẫu tự tạo
Bài 2: ĐỊNH LƯỢNG Na+ VÀ Cl- BẰNG PHƯƠNG PHÁP SẮC
KÝ CỘT TRAO ĐỔI ION
I. ĐỊNH LƯỢNG CATION Na+ TRONG DUNG DỊCH
1. Hóa chất, thuốc thử
- Nhựa trao ổi ion cationit Purolite C-100
- Dung dịch chuẩn: NaOH 0,1N - Chỉ thị Phenolphtalein
2. Dụng cụ, thiết bị - Buret 25ml 3. Thực nghiệm
3.1. Chuẩn bị nhựa
Ngâm khoảng 10-12g nhựa Purolite C-100 vào nước cất vài phút làm cho
trương phồng lên. Cho nhựa vào cột. Cột này ã ược làm ầy trước bằng nước cất. lOMoAR cPSD| 36844358
Chiều cao của nhựa trong cột khoảng 15cm.
Để nước cất chảy qua nhựa sao cho nhựa luôn ược ngâm trong nước và không
bị bọt khí lẫn vào nhựa. -
Cho 15 ml HCl 4N chảy qua nhựa. -
Mở khóa buret sao cho lưu lượng của dịch chảy ra khoảng 20-30
giọt/phút. Khi toàn bộ acid ã i ngang qua cột, tráng ít nhất bằng 80ml nước cất (lưu lượng 30 giọt/phút) -
Những phân oạn nước cất ể rửa cột cuối cùng không ược còn acid. Thử
nước rửa trung tính bằng giấy chỉ thị vạn năng hoặc bằng cách cho 1 giọt kiềm vào
nước và quan sát màu với chỉ thị methyl da cam. Nếu còn tính acid phải rửa them
bằng nước cất cho tới khi nước rửa trung tính. -
Lúc này nhựa ã sẵn sàng ể sử dụng và phải luôn nhúng chìm trong nước
cất. Mực nước luôn cao hơn mặt nhựa khoảng 1cm. 3.2. Trao ổi ion Cho vào cột trên: -
10 ml dung dịch cần ịnh lượng Na+. -
Chỉnh lưu lượng khoảng 20 giọt/phút, hứng dịch ể ịnh lượng vào 1 bình nón 250ml. -
Tráng buret 4 lần bằng nước cất (20ml x 4 lần), iều chỉnh lưu lượng 30
giọt/phút, tiếp tục hứng dịch chảy vào bình nón bên trên (sử dụng khoảng 120 ml nước cất). -
Những phân oạn nước cất cuối cùng không ược còn acid. Thử nước rửa
trung tính bằng giấy chỉ thị vạn năng hoặc bằng cách cho 1 giọt kiềm vào nước và
quan sát màu với chỉ thị methyl da cam. Nếu còn acid thì phải rửa tiếp bằng nước cất
cho tới khi nước rửa trung tính. 3.3. Định lượng
Thêm 2 giọt chỉ thị phenolphtalein vào bình nón chứa dịch cần ịnh lượng.
Định lượng bằng NaOH 0,1N ến khi chuyển sang màu hồng. Gọi V1 ml là số ml
NaOH 0,1N ã sử dụng ể trung hòa lượng acid có trong bình nón. 4. Tính kết quả
Trình bày kết quả bằng g/l và bằng mmol Na+/lít dung dịch.
II. ĐỊNH LƯỢNG ANION Cl- TRONG DUNG DỊCH
1. Hóa chất, thuốc thử
- Nhựa trao ổi ion anionit Purolite A-400 lOMoAR cPSD| 36844358
- Dung dịch chuẩn: HCl 0,1N - Chỉ thị Heliatin
2. Dụng cụ, thiết bị - Buret 25ml 3. Thực nghiệm
3.1. Chuẩn bị nhựa
Ngâm khoảng 10-12g nhựa Purolite A-400 vào nước cất vài phút làm cho
trương phồng lên. Cho nhựa vào cột. Cột này ã ược làm ầy trước bằng nước cất. Chiều
cao của nhựa trong cột khoảng 15cm.
Để nước cất chảy qua nhựa sao cho nhựa luôn ược ngâm trong nước và không
bị bọt khí lẫn vào nhựa.
- Cho 15 ml NaOH 4N chảy qua nhựa.
- Mở khóa buret sao cho lưu lượng của dịch chảy ra khoảng 20-30
giọt/phút. Khi toàn bộ kiềm ã i ngang qua cột, tráng ít nhất bằng 80ml nước cất (lưu lượng 30 giọt/phút) -
Những phân oạn nước cất ể rửa cột cuối cùng không ược còn kiềm. Thử
nước rửa trung tính bằng giấy chỉ thị vạn năng hoặc bằng cách cho 1 giọt acid vào
nước và quan sát màu với chỉ thị. Nếu còn tính kiềm phải rửa them bằng nước cất cho
tới khi nước rửa trung tính. -
Lúc này nhựa ã sẵn sang ể sử dụng và phải luôn nhúng chìm trong nước
cất. Mựa nước luôn cao hơn mặt nhựa khoảng 1cm. 3.2. Trao ổi ion Cho vào cột trên: -
10 ml dung dịch cần ịnh lượng Cl-. -
Chỉnh lưu lượng khoảng 20 giọt/phút, hứng dịch ể ịnh lượng vào 1 bình nón 250ml. -
Tráng buret 4 lần bằng nước cất (20ml x 4 lần), iều chỉnh lưu lượng 30
giọt/phút, tiếp tục hứng dịch chảy vào bình nón bên trên (sử dụng khoảng 120 ml nước cất). -
Những phân oạn nước cất cuối cùng không ược còn base. Thử nước rửa
trung tính bằng giấy chỉ thị vạn năng hoặc bằng cách cho 1 giọt acid vào nước và
quan sát màu với chỉ thị methyl da cam. Nếu còn tính kiềm thì phải rửa tiếp bằng
nước cất cho tới khi nước rửa trung tính. lOMoAR cPSD| 36844358 3.3. Định lượng
Thêm 3 giọt chỉ thị heliatin vào bình nón chứa dịch cần ịnh lượng. Định lượng
bằng HCl 0,1N ến khi chuyển sang màu hồng cam. Gọi V2 ml là số ml HCl 0,1N ã sử
dụng ể trung hòa lượng kiềm có trong bình nón. 4. Tính kết quả
Trình bày kết quả bằng g/l và bằng mmol Cl-/lít dung dịch.
Bài 3: PHÂN TÍCH SẮC TỐ Ở LÁ CÂY BẰNG SẮC KÝ CỘT 1. Nguyên tắc
Trong các loại lá cây thường có chứa sắc tố gồm chlorophyll, carotenoid… Những
loại sắc tố này ược dùng rộng rãi trong thực phẩm cũng như y dược. Ở bài thực hành
này, chúng ta dùng phương pháp sắc ký hấp phụ ể tách chúng ra khỏi hỗn hợp.
Trước hết các sắc tố ược cho hấp phụ vào cột cellulose (cellulose ược xem như là
phase tĩnh), sau ó phân tích chúng nhờ các loại dung môi khác nhau (phase ộng) ể
tách chúng ra khỏi hỗn hợp. Như ta ã biết các loại sắc tố có trong lá cây, nếu ứng về
mặt phân cực tăng dần thì sẽ như sau: carotene, xanthophyl, chlorophyll a, chlorophyll
b. Như vậy ta sẽ cho dung ly chúng bằng các loại dung môi phân cực tăng dần: ether
dầu hỏa, ether dầu hỏa 5% acetone, ether dầu hỏa 10% acetone và cuối cùng là ether
dầu hỏa 15% acetone. Cuối cùng ta sẽ tách ược các sắc tố riêng biệt.
Sau khi có ược những sắc tố, ta phải ịnh tính và ịnh lượng chúng. Về ịnh tính, sẽ
khảo sát phổ hấp thu của nó. Mỗi sắc tố sẽ có phổ hấp thu riêng, nhở những mũi hấp
thu cực ại cho phép xác ịnh chúng. Muốn ịnh lượng riêng từng sắc tố, thông thường
người ta dùng phương pháp thực nghiệm (gần úng). ự ắ
2. Thiết bị, dụng cụ, hóa chất, nguyên liệu * Thiết bị • Cân phân tích • Máy quang phổ UV-Vis •
Thiết bị lọc chân không * Dụng cụ • Cột sắc ký lOMoAR cPSD| 36844358 • Cốc mỏ • Pipette • Ống ong 50ml • Đũa thủy tinh • Ống nghiệm • Bình tia • Cối sứ Giấy lọc 8 * Hóa chất
• Bột cellulose (dùng cho sắc ký hấp phụ) • Ether dầu hỏa • Acetone * Nguyên liệu Lá rau má 3. Tiến hành
* Ly trích sắc tố từ lá cây
Nghiền nhuyễn trong cối sứ 20g lá cây tươi (thường dùng là lá rau má). Thêm vào
30ml acetone, trộn nhiều lần trong 10 phút, lọc qua phễu Buchner và hứng phần acetone.
Đổ dịch chiết acetone vào trong 1 phễu chiết, cho vào phễu chiết 10ml ether dầu
hỏa, lắc nhẹ, ể yên sẽ tách thành 2 phase. Bỏ phase dưới, thêm 50ml nước cất, lắc nhẹ
(có thể có nhũ tương, thời gian lắc khoảng 5 – 10 phút), bỏ phần dưới (phase nước)
và cứ làm như thế khoảng 10 lần cho ến khi hết mùi acetone (có thể ngửi ể xác ịnh,
nếu dung dịch còn chứa acetone thì không thể tách carotene ra ược). Mục ích là có
một hỗn hợp chứa các sắc tố trong dung môi không phân cực. Nếu dung dịch còn
nhiều (>2ml), un cách thuỷ ến khi thể tích còn khoảng 2ml ( ong thể tích chính xác
của dung dịch này). Các sắc tố hòa tan trong ether dầu hỏa sẽ ược tách ra nhờ phép
sắc ký hấp phụ trên cột cellulose.
* Sự phân ly các sắc tố trên cột cellulose
Để vào dưới cột 1 miếng bông gòn nhỏ. Ngâm trong ether dầu hỏa 1 lượng vừa ủ
bột cellulose trong 15 phút và ổ vào cột, vừa ổ, vừa gõ nhẹ vào cột ể bột cellulose
lắng ều và không ể cho cellulose khô. Bề cao của cột cellulose khoảng 12 – 15cm. Để
yên trong khoảng 15 phút cho cột ổn ịnh, mở khóa cho dung môi chảy xuống cho ến
khi mực ether dầu hỏa vừa xuống ến ầu cột cellulose, cho vào một cách thận trọng
1ml dung dịch sắc tố trong ether dầu hỏa.
Mở khóa cho dung môi chảy xuống, khi dung môi còn lại trên cột vừa chạm ến ầu
cột, cho 1ml ether dầu hỏa, làm như thế 3 lần ể cho hỗn hợp sắc tố nằm hoàn toàn
trong cột, lúc này sắc tố ược hấp phụ trên cột cellulose. lOMoAR cPSD| 36844358
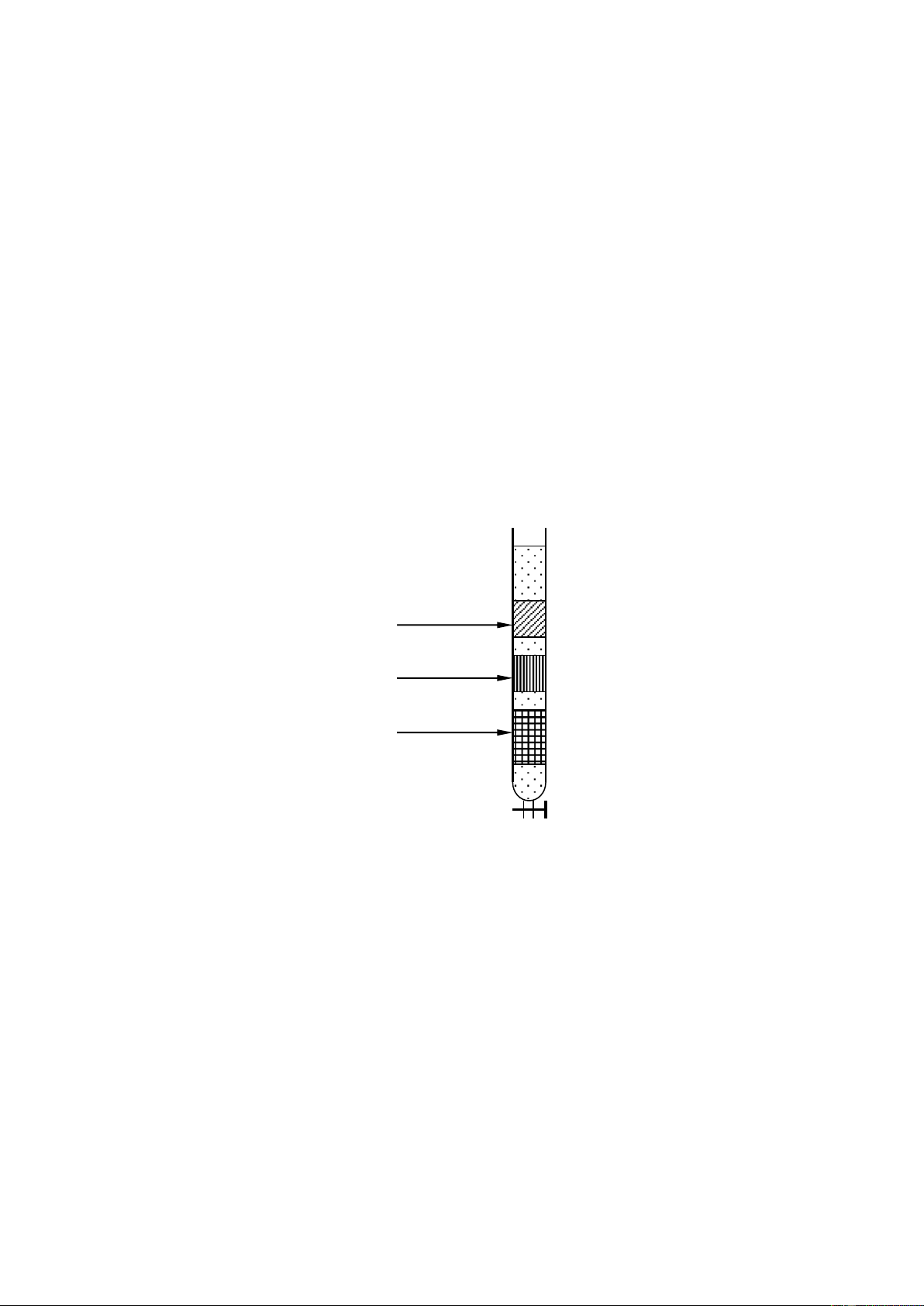
Sự phân ly ược thực hiện với các dung môi ether dầu hỏa có nồng ộ acetone cao dần.
1. Ether dầu hỏa
Được dùng ể dung ly carotene. Khi phần ether dầu hỏa dùng ể rửa hạ xuống ầu
cột, ổ 1 lượng vừa ủ ether dầu hỏa ể dung ly (khoảng 5 – 10ml), ta hứng phần dung
dịch chứa carotene. Cho chảy ến khi nào phần dưới cột ra hết phần carotene.
2. Hỗn hợp ether dầu hỏa 5% acetone
Đổ vào cột hỗn hợp ether dầu hỏa + 5% acetone, thấy xuất hiện 3 lớp: xanthophyl
và chlorophyll b, chlorophyll a (xanthophyl có màu vàng, chlorophyll b có màu xanh
lá cây, chlorophyll a có màu xanh vỏ ậu). Cứ tiếp tục dung ly sẽ thu ược xanthophyl.
Phần xanthophyl thường khá nhiều, vì vậy khi dung ly gần hết xanthophyl, ta bắt ầu
cho ether dầu hỏa 10% acetone vào, cả 2 sắc tố xanthophyl và chlorophyll b ều di
chuyển nhưng xanthophyl di chuyển nhanh hơn.
3. Hỗn hợp ether dầu hỏa 10% aceton
Hỗn hợp này dùng ể dung ly chlorophyll a 4.
Hỗn hợp ether dầu hỏa 15% aceton Chlorophyll b Chlorophyll a Xanthophyl
Hình 6.2 Quá trình tách sắc tố trong cột
Hỗn hợp này dùng ể dung ly chlorophyll b.
* Vẽ quang phổ hấp phụ của các sắc tố
Để các phần dung ly hứng ược vào trong quang phổ kế, o ở ộ dài song từ 350 -
700nm và tăng dần từng 20nm, ta sẽ có sự thay ổi mật ộ quang của các sắc tố này.
(Chọn dung dịch không là ether dầu hỏa khi o carotene, hỗn hợp ether dầu hỏa + 5% acetone khi o xanthophyl…)
Vẽ quang phổ hấp thu của các sắc tố ược phân ly (trục tung là mật ộ quang, trục hoành là ộ dài sóng)
Chú ý: Trong khi o quang phổ hấp thu, nhớ o mật ộ quang của các dung dịch: lOMoAR cPSD| 36844358
- Chlorophyl a, chlorophyll b ở các ộ dài sóng 661,6 và 644,8nm.
- Với carotene và xanthophyl thì trộn lẫn rồi o mật ộ quang ở ộ dài sóng 470nm. 4. Định lượng
Các sắc tố ược ịnh lượng theo các công thức thực nghiệm sau:
Ca = 11,24A661,6 – 2,04A644,8
Cb = 20,13A644,8 – 4,19A661,6
Ca+b = 7,05A661,6 + 18,09A644,8
1000A470 – 1,90Ca – 63,14Cb Cx+c = 214
Trong ó: Ca: nồng ộ chlorophyll a ( g/ml)
Cb: nồng ộ chlorophyll b ( g/ml)
Ca+b: nồng ộ tổng cộng của chlorophyll ( g/ml)
Cx+c: nồng ộ tổng cộng của carotenoid (carotene và xanthphyl) ( g/ml) Aλ: ộ
hấp thụ ở bước sóng λ.
Lưu ý: khi tính nồng ộ các sắc tố, mật ộ quang của các sắc tố ược tính trên cùng một
ơn vị thể tích cố ịnh. Muốn vậy, chúng tôi ề nghị lúc ầu ong thể tích của carotene giả
sử V ml, sau ó với các dung dịch xanthophyl, chlorophyll a và chlorophyll b chúng
ta cô trên bếp cách thuỷ ể loại bớt dung môi sao cho các loại sắc tố ều có thể tích thu ược là V ml.
Bài 4: ĐỊNH LƯỢNG ĐỒNG THỜI PARACETAMOL VÀ CAFEIN
TRONG CHẾ PHẨM BẰNG SẮC KÝ LỎNG HIỆU NĂNG CAO
1. Hóa chất, thuốc thử
- Chất ối chiếu paracetamol: chất chuẩn quốc gia, Viện Kiểm nghiệm - Bộ Y tế.
- Chất ối chiếu codein phosphat: chất chuẩn quốc gia, Viện Kiểm nghiệm - Bộ Y tế.
- Methanol ạt tiêu chuẩn dùng cho HPLC (Merck, Đức)
- Acid acetic băng ạt tiêu chuẩn dùng cho HPLC (Merck, Đức)
- Nước cất hai lần dùng cho HPLC
- Viên nén HAPACOL EXTRA chứa 500mg paracetamol và 65 mg caffein do Công
ty cổ phần dược Hậu Giang sản xuất. (hoặc chế phẩm tương tự). lOMoAR cPSD| 36844358
2. Dụng cụ, thiết bị
- Máy sắc ký lỏng hiệu năng cao, detector mảng diod (DAD), iều khiển bằng phần mềm tương thích i kèm. - Máy lắc siêu âm - Giấy parafilm - Máy lắc xoáy (vortex) - Màng lọc mẫu 0,45 m
- Hệ thống lọc pha ộng dưới áp suất giảm, màng lọc dung môi 0,45 m
- Dụng cụ thủy tinh: Bình ịnh mức, pipet chính xác, cốc có mỏ, ống ong, lọ ựng mẫu sắc ký (vial)…
3. Tiến hành
3.1. Chuẩn bị pha ộng
- Sử dụng ống ong pha 500ml pha ộng gồm 345ml nước, 140 ml methanol và 15 ml
acid acetic băng, trộn ều, lọc dưới áp suất giảm qua màng lọc 0,45 m. - Loại bọt khí
trong pha ộng bằng siêu âm trong 10 phút.
3.2. Chuẩn bị các mẫu ối chiếu và mẫu thử
- Chuẩn bị dung dịch mẫu ối chiếu gốc (bình 1)
+ Cân chính xác khoảng 100 mg paracetamol ối chiếu và 13 mg cafein ối chiếu
cho vào bình ịnh mức 50 ml (bình 1). Thêm khoảng 35 ml methanol, lắc kỹ,
sau ó em i siêu âm trong 10 phút. Thêm methanol ến vạch, lắc ều. Dung dịch
thu ược có nồng ộ paracetamol xấp xỉ 2000 g/ml và nồng ộ caffein xấp xỉ 260 g/ml.
- Chuẩn bị dung dịch chuẩn ối chiếu chạy sắc ký (bình 2)
Hút 2 ml dung dịch 1 cho vào bình ịnh mức 20 ml (bình 2). Thêm pha ộng ến
vạch, lắc kỹ. Lọc qua màng lọc millipore 0,45 m. Dung dịch của mẫu ối chiếu
chạy sắc ký có nồng ộ paracetamol xấp xỉ 200 g/ml và nồng ộ caffein xấp xỉ 26 g/ml.
- Chuẩn bị dung dịch gốc của mẫu thử (bình 3)
Cân 20 viên nén HAPACOL EXTRA. Tính khối lượng trung bình của 1 viên.
Nghiền trộn 20 viên này bằng cối chày ến khi thu ược một hỗn hợp bột mịn ồng
nhất. Cân chính xác một lượng bột viên tương ứng 100 mg paracetamol vào bình
ịnh mức 50 ml (bình 3), thêm khoảng 35 ml methanol,lắc kỹ sau ó siêu âm trong
10 phút. Thêm methanol ến vạch, lắc ều. lOMoAR cPSD| 36844358
Mẫu thử của bình 3 có nồng ộ paracetamol xấp xỉ 2000 g/ml và nồng ộ caffein xấp xỉ 260 g/ml.
- Chuẩn bị dung dịch mẫu thử chạy sắc ký (bình 4)
Lọc dung dịch bình 3 qua giấy lọc. Bỏ khoảng 15-20 ml dịch lọc ầu. Lấy chính
xác 2 ml dịch lọc pha loãng trong bình ịnh mức 20 ml (bình 4) với pha ộng. Lọc
qua màng lọc millipore 0,45 m. Dung dịch của mẫu thử chạy sắc ký có nồng ộ
paracetamol xấp xỉ 200 g/ml và nồng ộ caffein xấp xỉ 26 g/ml.
Các dung dịch sau khi chuẩn bị cần bảo quản ở nhiệt ộ 2-8 oC, ược bít kín
miệng bình bằng giấy parafilm
3.3. Tiến hành sắc ký
3.3.1. Điều kiện sắc ký
Thực hiện lắp cột sắc ký và cài ặt một số thông số cơ bản trên hệ thống sắc ký: pha
ộng, tốc ộ dòng, thể tích tiêm, nhiệt ộ cột, bước sóng phát hiện. Điều kiện sắc ký bao gồm
- Cột sắc ký C18 (150 x 4,6 mm, 5 mcm)
- Pha ộng: Nước – methanol – acid acetic băng (69:28:3 v/v/v)
- Nhiệt ộ cột: 45 ± 1 oC
- Lưu lượng dòng: 1,0 mL/phút.
- Bước sóng phát hiện: 275 nm. - Tiêm mẫu: 10 mcl
3.3.2. Vận hành máy
- Cột sắc ký ược cân bằng trong khoảng 30 phút trước khi phân tích. Lần lượt tiêm
dung dịch mẫu ối chiếu (bình 2) ( lặp lại 6 lần) và mẫu thử (bình 4) (lặp lại 3 lần)
vào hệ thống và xác ịnh các yếu tố sau:
+ Phổ UV tương ứng của pic paracetamol và píc caffein
+ Quan sát sắc ký ồ, ghi lại các thông số sắc ký như thời gian lưu, diện tích píc, chiều
cao pic, ộ rộng áy píc,… từ ó tính các thông số như hệ số dung lượng, hệ số chọn lọc,
số ĩa lý thuyết, ộ phân giải píc, hệ số bất ối của píc trong dung dịch mẫu ối chiếu và mẫu thử.
3.3.3. Tính toán kết quả - Ghi lại sắc ồ.
- Tính hệ số dung lượng, hệ số chọn lọc, hệ số bất ối, ộ phân giải và số ĩa lý thyết
trung bình của píc trong dung dịch mẫu ối chiếu và mẫu thử.
- Tính ộ lệch chuẩn tương ối của diện tích pic và thời gian lưu paracetamol và caffein
sau 6 lần phân tích mẩu chuẩn. lOMoAR cPSD| 36844358
Tính hàm lượng hoạt chất trong viên dưới dạng HL % so với nhãn lOMoAR cPSD| 36844358
Bài 5: ĐỊNH LƯỢNG CURCUMIN TRONG BỘT CỦ NGHỆ BẰNG HPLC
1. Hóa chất, thuốc thử
- Chất ối chiếu curcumin
- Methanol ạt tiêu chuẩn dùng cho HPLC (Merck, Đức)
- Acid acetic băng ạt tiêu chuẩn dùng cho HPLC (Merck, Đức)
- Nước cất hai lần dùng cho HPLC - Bột củ nghệ.
2. Dụng cụ, thiết bị
- Máy sắc ký lỏng hiệu năng cao, detector mảng diod (DAD), iều khiển bằng phần mềm tương thích i kèm. - Máy lắc siêu âm - Giấy parafilm - Máy lắc xoáy (vortex) - Màng lọc mẫu 0,45 m
- Hệ thống lọc pha ộng dưới áp suất giảm, màng lọc dung môi 0,45 m
- Dụng cụ thủy tinh: Bình ịnh mức, pipet chính xác, cốc có mỏ, ống ong, lọ ựng mẫu sắc ký (vial)…
3. Thực nghiệm
3.1. Chuẩn bị pha ộng
- Sử dụng ống ong pha 500ml pha ộng gồm 450 ml nước, 539 ml nước cất 2 lần và
11 ml acid acetic băng, trộn ều, lọc dưới áp suất giảm qua màng lọc 0,45 m. - Loại
bọt khí trong pha ộng bằng siêu âm trong 10 phút.
3.2. Chuẩn bị các mẫu chuẩn và mẫu thử
Chuẩn bị mẫu chuẩn
Cân chính xác khoảng 100 mg chuẩn curcumin vào bình ịnh mức 50 ml, ịnh mức
bằng MeOH ược dung dịch chuẩn gốc có nồng ộ 2 mg/ml. Pha loãng dung dịch
chuẩn gốc với MeOH ể có dãy dung dịch chuẩn làm việc có nồng ộ từ 0,1 – 100
µg/ml trong các bình ịnh mức 10ml. Các dung dịch này ược lọc qua màng 0,45µm
trước khi tiêm vào hệ thống sắc ký.
Chuẩn bị mẫu thử
Cân chính xác khoảng 0,15 g bột củ nghệ vào bình ịnh mức 50ml, thêm 30 ml
MeOH 70%, lắc ều và siêu âm trong 20 phút ở 60 oC, ịnh mức tới vạch. Dung dịch
này ược lọc qua màng 0,45µm trước khi tiêm vào hệ thống sắc ký. lOMoAR cPSD| 36844358
3.3. Tiến hành sắc ký
3.3.1. Điều kiện sắc ký
Thực hiện lắp cột sắc ký và cài ặt một số thông số cơ bản trên hệ thống sắc ký: pha
ộng, tốc ộ dòng, thể tích tiêm, nhiệt ộ cột, bước sóng phát hiện. Điều kiện sắc ký bao gồm -
Cột Zorbaz Eclipse XDB-C18 (150 × 4,6 mm; 5 µm) -
Detector PDA, bước sóng phát hiện: 420 nm -
Pha ộng: ACN: Acid acetic 2% (45:55) - Tốc ộ dòng: 1,0 ml/phút - Thể tích tiêm: 20 µl -
Thời gian phân tích: 15 phút.
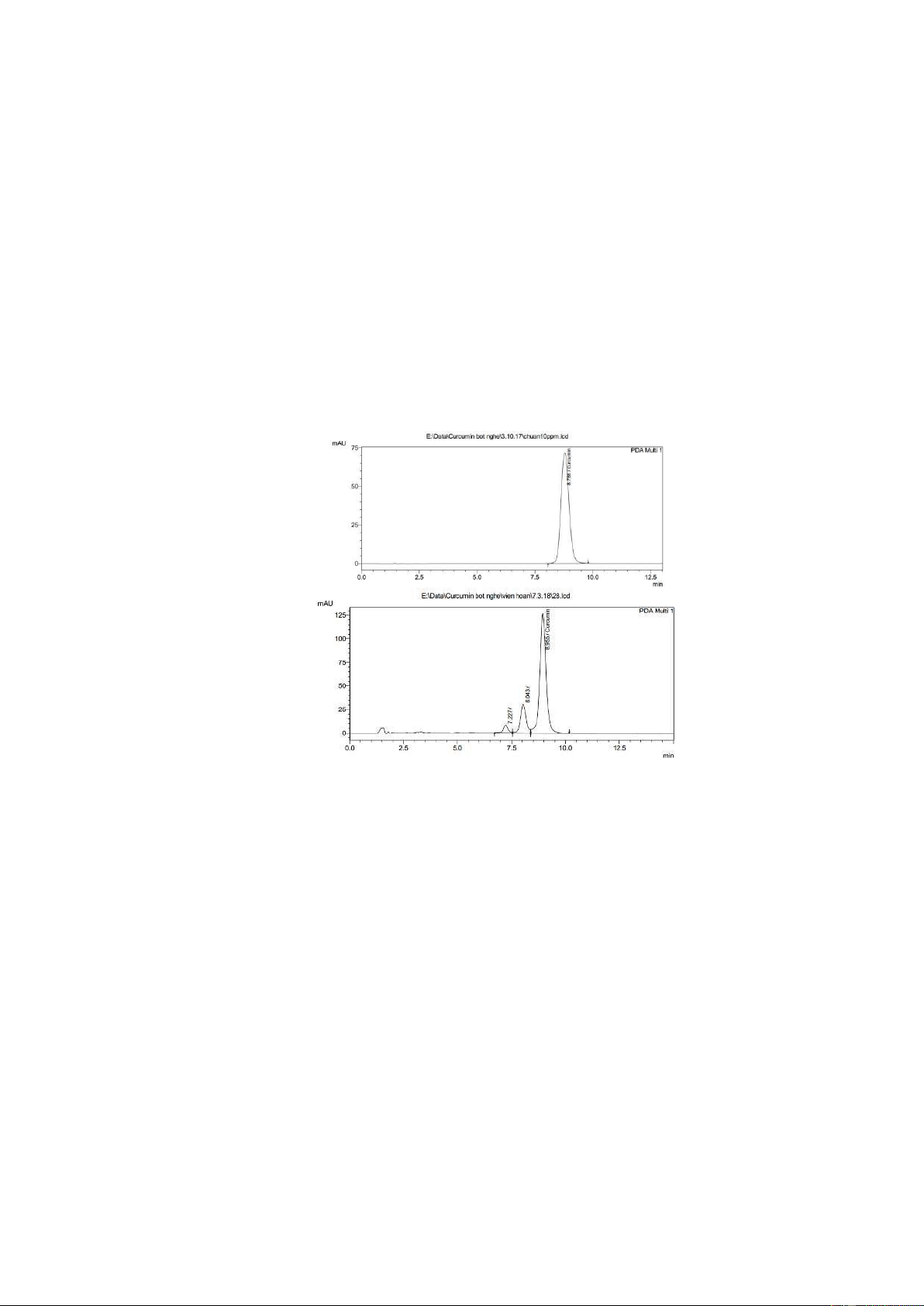
Hình 1: Sắc ký ồ thể hiện tính chọn lọc của phương pháp
(a): mẫu chuẩn; (b): mẫu thử.
3.3.2. Vận hành máy -
Cột sắc ký ược cân bằng trong khoảng 30 phút trước khi phân tích. Lần lượt
tiêm các dung dịch mẫu chuẩn và mẫu thử (lặp lại 3 lần) vào hệ thống. -
Xác ịnh dung dịch chuẩn có nồng ộ gần với dung dịch thử nhất, tiêm lặp lại 6
lần dung dịch chuẩn này và xác ịnh các yếu tố sau:
+ Phổ UV tương ứng của pic curcumin
+ Quan sát sắc ký ồ, ghi lại các thông số sắc ký như thời gian lưu, diện tích píc, chiều
cao pic, ộ rộng áy píc,… từ ó tính các thông số như hệ số dung lượng, hệ số chọn lọc,
số ĩa lý thuyết, ộ phân giải píc, hệ số bất ối của píc trong dung dịch mẫu ối chiếu và mẫu thử. lOMoAR cPSD| 36844358
4.1.4. Tính toán kết quả - Ghi lại sắc ồ. -
Tính hệ số dung lượng, hệ số chọn lọc, hệ số bất ối, ộ phân giải và số ĩa lý
thyết trung bình của píc trong dung dịch mẫu ối chiếu và mẫu thử. -
Tính ộ lệch chuẩn tương ối của diện tích pic và thời gian lưu curcumin sau 6
lần phân tích mẩu chuẩn. - Xây dựng ường chuẩn -
Hàm lượng curcumin trong mẫu bột củ nghệ ược xác ịnh dựa vào ường chuẩn
ược xây dựng trong cùng ngày phân tích.
Hàm lượng curcumin trong mẫu nguyên trạng ược tính theo công thức : HL mg g( / ) S b f 1000 V a m
S : diện tích pic (mAU.s) a, b : hệ số trong phương trình ường
chuẩn S = a.C + b (C : µg/ml) f : hệ số pha loãng V : thể tích pha
mẫu (ml) m : khối lượng mẫu cân (g)
Bài 7: ĐỊNH LƯỢNG ĐỒNG THỜI PARACETAMOL VÀ
CAFEIN TRONG CHẾ PHẨM BẰNG ĐIỆN DI MAO QUẢN
1. Hóa chất, thuốc thử
- Chất ối chiếu paracetamol: chất chuẩn quốc gia, Viện Kiểm nghiệm - Bộ Y tế
- Chất ối chiếu codein phosphat: chất chuẩn quốc gia, Viện Kiểm nghiệm - Bộ Y tế
- Methanol ạt tiêu chuẩn dùng cho CE (Merck, Đức)
- Natri tetraborat deccahydrat ạt tiêu chuẩn dùng cho CE (Sigma-Aldrich)
- Natri doecyl sulfat (SDS) ạt tiêu chuẩn dùng cho CE (Merck, Đức)
- Nước deion, NaOH 0,1M cho CE
- Viên nén HAPACOL EXTRA chứa 500mg paracetamol và 65 mg caffein do Công
ty cổ phần dược Hậu Giang sản xuất. (hoặc chế phẩm tương tự).
2. Dụng cụ, thiết bị
- Máy iện di mao quản Agilent 7100 (Mỹ), detector mảng diod (DAD), iều khiển
bằng phần mềm tương thích i kèm. - Máy lắc siêu âm - Micropipet các thể tích lOMoAR cPSD| 36844358 3. Tiến hành
3.1. Chuẩn bị dung dịch iện li nền, dung dịch tiêm CE
- Dung dịch iện li nền (BGE): Hòa tan 953,43 mg natri tetraborat decahydrat và 2,88
g SDS vào 100 ml nước deion, iều chỉnh pH 9,3 bằng acid boric. Lọc qua màng lọc
0,45 μm, siêu âm uổi bọt khí.
- Dung dịch tiêm CE: Dung dịch mẫu chuẩn và mẫu thử ã chuẩn bị ở bài trước ược
ưa về nhiệt ộ phòng. Pha loãng dung dịch chuẩn và thử này 4 lần bằng dung dịch BGE. - Nước deion, NaOH 0,1M.
3.2. Tiến hành iện di
3.2.1. Điều kiện iện di
Chuẩn bị cột mao quản, lắp cột mao quản và cài ặt một số thông số cơ bản trên hệ
thống iện di: bước sóng phát hiện, vial inlet home, vial outlet home, iện thế nguồn,
nhiệt ộ cassette, chương trình luyện cột, kiểu tiêm. Điều kiện iện di bao gồm:
- Dung dịch iện di nền (BGE): Đệm borat 25 mM pH 9.3 chứa SDS 100 mM
- Cột mao quản fused silica (EL: 40 cm, TL: 48,5 cm, OD: 360 µm, ID: 50 µm)
- Nhiệt ộ cassette: 25 ± 1 oC
- Điện thế nguồn: 20 kV, detector về phía cathod - Cường ộ dòng: 100 µA
- Bước sóng phát hiện: 275 nm
- Tiêm mẫu: 50 mBar – 3s
- Luyện cột giữa các lần tiêm: NaOM 0,1 M trong 2 phút – Nước 2 phút – BGE trong 2 phút
3.2.2. Vận hành máy
- Luyện cột. Lần lượt tiêm dung dịch mẫu ối chiếu (bình 3) ( lặp lại 6 lần) và mẫu
thử (bình 5) (lặp lại 3 lần) vào hệ thống và xác ịnh các yếu tố sau:
+ Phổ UV tương ứng của pic paracetamol và píc caffein
+ Quan sát iện di ồ, ghi lại các thông số iện di như thời gian lưu, diện tích píc, chiều
cao pic, ộ rộng áy píc, số ĩa lý thuyết, ộ phân giải píc, hệ số bất ối … của píc trong
dung dịch mẫu ối chiếu và mẫu thử.
a. Tính toán kết quả - Ghi lại iện di ồ. lOMoAR cPSD| 36844358
- Tính hệ số dung lượng, hệ số chọn lọc, hệ số bất ối, ộ phân giải và số ĩa lý thyết
trung bình của píc trong dung dịch mẫu ối chiếu và mẫu thử.
- Tính ộ lệch chuẩn tương ối của diện tích pic và thời gian lưu paracetamol và caffein
sau 6 lần phân tích mẩu chuẩn.
- Tính hàm lượng hoạt chất trong viên dưới dạng HL % so với nhãn