

Preview text:
THỰC HÀNH THÍ NGHIỆM PHẢN ỨNG ESTE HÓA
XÀ PHÒNG HÓA:Đồng nhất
THỦY PHÂN HÓA:Phân lớp Quy trình:
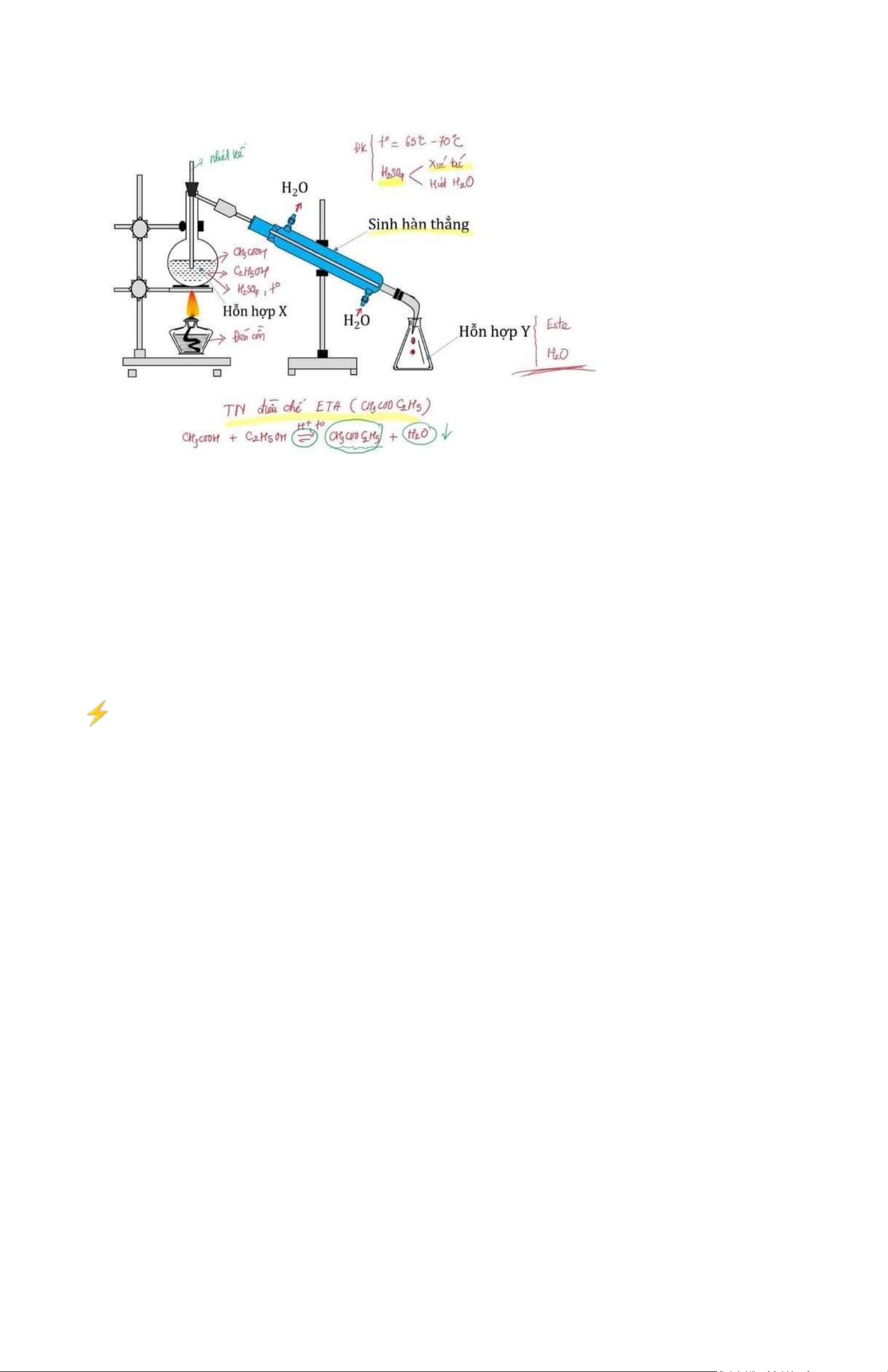
Tiến hành thí nghiệm điều chế etyl axetat theo các bước sau đây:
- Bước 1: Cho 1 ml C2H5OH, 1 ml CH3COOH và vài giọt dung dịch H2SO4 đặc vào ống nghiệm.
- Bước 2: Lắc đều ống nghiệm, đun cách thủy (trong nồi nước nóng) khoảng 5 - 6 phút ở 65 - 70oC.
- Bước 3: Làm lạnh, sau đó rót 2 ml dung dịch NaCl bão hòa vào ống nghiệm. CÁC LƯU Ý CẦN NHỚ!
- H2SO4 đặc vừa có vai trò xúc tác vừa là chất hút nước tăng hiệu suất phản ứng điều chế este (theo nguyên lý chuyển dịch cân bằng). Do đó,
không thể dùng H2SO4 loãng, HCl, HNO3 để thay thế vì chúng không có khả năng hút nước…
- Ở bước 2 có thể thay thế việc đun cách thủy bằng cách đun nhẹ hỗn hợp bằng ngọn lửa đèn cồn (tránh nhiệt độ quá cao vì lúc ấy axit, ancol sẽ
bị bay hơi, phản ứng không xảy ra được, giảm hiệu suất tổng hợp);
- NaCl bão hoà (36 g/100 ml (25 ℃) được thêm vào hiểu đơn giản là để tách lớp dung dịch (hay là để este tách ra), làm tăng khối lượng riêng của
dung dịch và giảm độ tan của este sinh ra. Cụ thể bản chất như sau: Este là chất không phân cực (không có liên kết H với nước) – không tan
trong dung dịch NaCl bão hòa, tách nổi lên trên. Axit, ancol tạo liên kết H với nước trong dung dịch muối, tỉ trọng của cả hệ tăng, nằm ở dưới phễu chiết. Hóa chất Tỉ trọng (g/cm3) NaCl 2,16 C2H5OH 0,789 CH3COOH 1,05 H2O 1,0 CH3COOC2H5 0,897
- Có thể thay NaCl bằng muối khác như KCl... Các muối có độ tan tốt sẽ có vai trò tách làm các chất khác không tan được trong nước và bị tách ra;
- Không thay thế NaCl bão hoà bằng HCl bão hòa được vì HCl dễ bay hơi;
- Phản ứng este hoá trên là phản ứng thuận nghịch nên sau bước 3 dung dịch tách thành 2 lớp (sau phản ứng sẽ thu được este, axit cacboxylic dư và ancol dư);
- Việc làm lạnh bằng nước đá hoặc ống sinh hàn là để ngưng tụ este. Este thu được qua ống sinh hàn thường không tinh khiết;
- Vai trò của đá bọt là để dung dịch sôi đều, êm dịu, tránh sôi một cách cục bộ; Đá bọt là loại đá thu được từ dung nham núi lửa, nhẹ, cấu trúc
xốp, nhiều lỗ rỗng. Nếu dùng đá bọt để điều hòa quá trình đun sôi ta không nên cho đá bọt vào chất lỏng đang sôi hay đang đun nóng vì sẽ làm
cho chất lỏng sôi bùng lên trào ra ngoài rất nguy hiểm và đồng thời đá bọt cũng mất tác dụng điều hoà sự sôi. Có thể thay đá bọt bằng cát sạch, mảnh sứ sạch…
- Phản ứng cần đun nóng ở 65 - 70 độ C thì mới xảy ra được, dùng nhiệt kế để đảm bảo nhiệt độ trong khoảng đấy (duy trì nhiệt độ này là phù
hợp vì chỉ cần đun ở nhiệt độ cao hơn, ví dụ 78 độ C thì ancol đã bị bay hơi). Thực ra phản ứng este hóa tương đối phức tạp vì tạo hỗn hợp đẳng phí (cùng sôi);
- Để kiểm soát nhiệt độ trong quá trình đun nóng ta có thể dùng nhiệt kế;
- Để tăng hiệu suất thì hạn chế sự có mặt của nước vì thế cần dùng ancol nguyên chất và axit nguyên chất;
- Phản ứng ở nhiệt độ 65 - 70 độ C nên sau phản ứng sẽ có axit hữu cơ, ancol, este, và nước bị bay hơi, và đi qua ống sinh hàn sẽ ngưng tụ
thành chất lỏng. Vì vậy dung dịch các chất lỏng ngưng tụ sẽ có axit hữu cơ, ancol, este, và nước và chú ý sẽ không có H2SO4 vì axit này bay hơi
ở nhiệt độ rất cao 337 °C;
- Tắt đèn cồn trước nếu quá trình điều chế este được thực hiện trong ống nghiệm. Vì este khi bay hơi dễ bắt lửa gây mất an toàn.
- Ống sinh hàn có tác dụng hạn chế sự thất thoát của các chất lỏng trong ống nghiệm;
- Este gần như không tan trong nước nên chất lỏng thu được phân thành 2 lớp, este nhẹ hơn nước nên nổi lên trên bề mặt;
- Tách este sinh ra sau bước 3 bằng phương phát chiết (phương pháp chiết là phương pháp vật lý để tách 2 phần chất lỏng không tan vào nhau)
bằng cách sử dụng phễu chiết;
- CaCl2 dùng để hút các chất lỏng có độ phân cực như ancol , H2O để đảm bảo thu este nguyên chất;
- Este sinh ra auto có mùi thơm (mùi gì thì tùy loại este).
Dùng NaHCO3, Na2CO3,... để trung hòa axit cacboxylic dư trong sau phản ứng, trong phễu chiết phần trên là este chưa khô & sạch hoàn toàn
nên phải dùng thêm CaCl2 khan (chất hút ẩm mạnh) để hút nước & ancol và sau khi hút ẩm CaCl2 vẫn ở dạng rắn nên dễ tách este hơn H2SO4
ở dạng lỏng vì vậy không dùng H2SO4 đặc (hút ẩm) thay cho CaCl2 vì H2SO4 đặc có thể khiến 1 phần este bị thủy phân.
P/s: Hình vẽ chưa được đẹp và chuẩn lắm nhưng Thầy lười vẽ lại quá ^^
Đọc hết bí kíp này thì các bạn tự tin trả lời tất cả các câu hỏi liên quan đến thí nghiệm tổng hợp este rồi nhé ^^


