


Preview text:
BÀI 4: TỔNG HỢP ACID BENZOIC
A. CÂU HỎI PHẦN BÁO CÁO
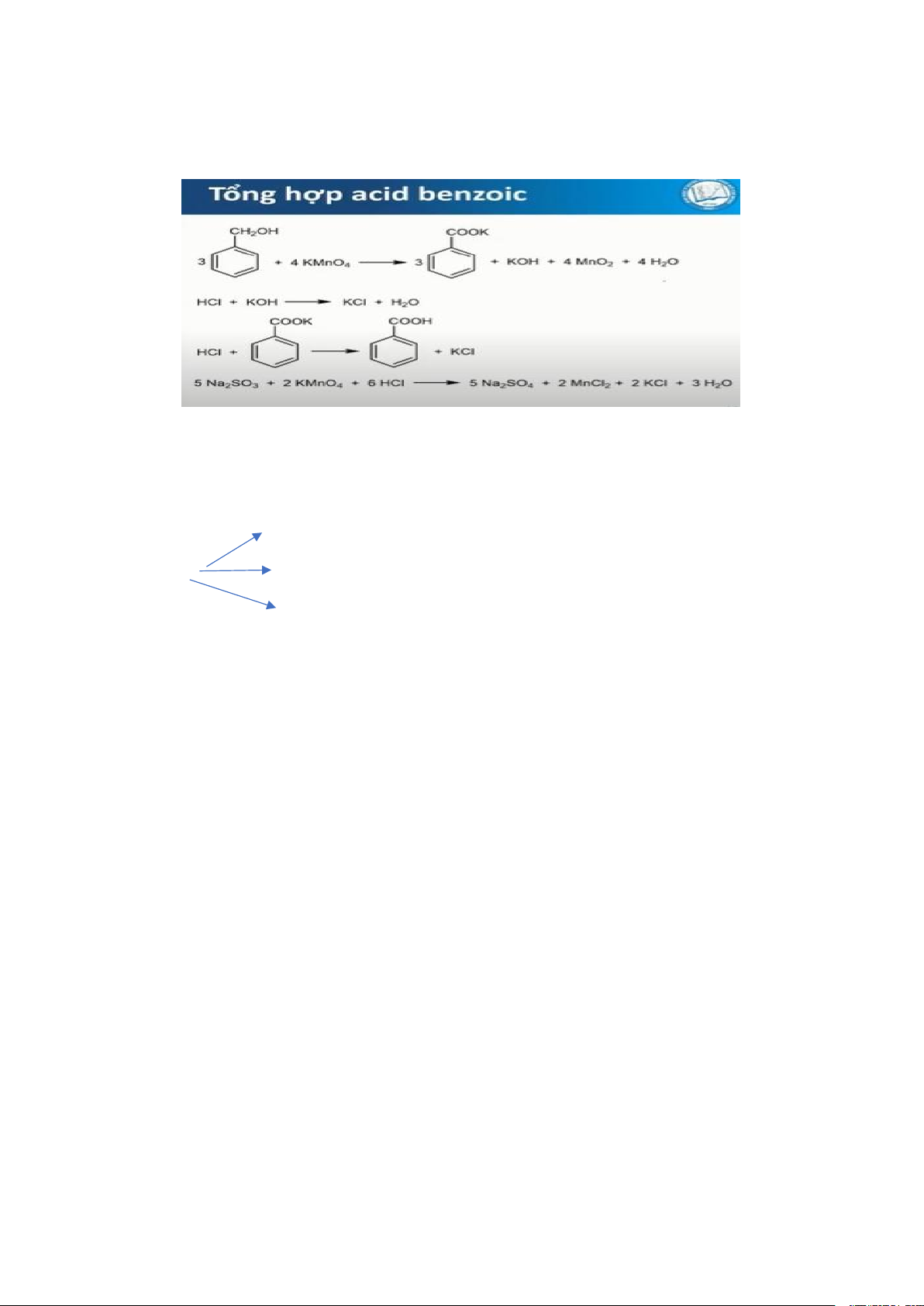
1. Tóm tắc các giai đoạn tổng hợp acid benzoic bằng phản ứng hoá học
2. Ảnh hưởng của pH đến khả năng oxy hoá của KMnO4
Môi trường trung tính : Mn+7 → Mn+4 ( màu xám đen) KMn+7O4
Môi trường acid : Mn+7 → Mn+2 ( không màu)
Môi trường kiềm : Mn+7 → Mn+6 ( màu xanh lá không bền, chuyển thành Mn+4 )
3. Cho biết công dụng của HCl ở giai đoạn 2.3
- Tạo sản phẩm: chuyển Kali benzoat thành acid benzoic - Trung hoà KOH:
- Tạo môi trường acid cho phản ứng loại bỏ KMnO4 bằng Na2SO3
4. Đề nghị vài hoá chất có thể thay thế cho Na2SO3 . Giải thích - Na2S2O3, K2SO3, KNO2, NaNO2
- Vì các chất này có tính khử mạnh tương tự như Na2SO3
5. Giai đoạn acid hoá: tại sao phải cận thận, lành mạnh và cho HCl vào từ từ
- HCl là một acid mạnh và đậm đặc, nếu thêm vào nhanh sẽ gây nguy hiểm, cần thêm vào từ từ để có
được lượng dư làm môi trường cho phản ứng khử loại KMnO4 ở bước 2.5. Và phải thêm vào từ từ
để toàn bộ lượng Kali benzoat chuyển thành acid benzoid, để thu được sản phẩm nhiều nhất có thể
- Phải làm lạnh để phản ứng kết tinh hoàn toàn, tránh thất thoát sản phẩm trung quá trình lọc
6. Tính hiệu suất tổng hợp 1
II. CÂU HỎI LƯỢNG GIÁ
1. Hãy nêu các tác dụng của acid benzoic? - Kháng nấm, kháng khuẩn
- Tá dược trong ngành dược lẫn mỹ phẩm, thực phẩm ( chất bảo quản)
2. Nếu nguyên tắc điều chế acid benzoic trong bài thực tập?
- Acid benzoic ( acid benzen carboxylic) được điều chế từ sự oxy hoá benzyl alcol bằng Kali
permanganat trong dung môi trung tính
- Trong công nghiệp, acid benzoic được điều chế từ sự oxy hoá trực tiếp toluen bằng KMnO4,
K2CrO4, HNO3 dưới áp suất cao
3. Hãy so sánh khả năng oxy hóa của kali permanganat trong các môi trường pH khác nhau?
Môi trường trung tính : Mn+7 → Mn+4 ( màu xám đen) KMn+7O4
Môi trường acid : Mn+7 → Mn+2 ( không màu)
Môi trường kiềm : Mn+7 → Mn+6 ( màu xanh lá không bền, chuyển thành Mn+4 )
4. Nêu thứ tự cho các hóa chất trong bài tổng hợp acid benzoic? Giải thích tại sao phải cho theo thứ tự này?
Vì Nếu cho KMnO4 và benzylic alcol trước thì 2 chất này
có thể phản ứng với nhau gây cháy nổ, nên chúng ta phải
cho nước vào trước , để nước pha loãng KMnO4 ra, sau đó thêm benzyl alcol vào. 2
5. Vì sao phải đun hỗn hợp phản ứng đến sôi nhẹ trong 90 phút?
- Thời gian 90 phút là thời gian phản ứng xảy ra hoàn toàn bằng cách theo dõi phản ứng bằng sắc ký
lớp mỏng với chất đối chiếu là benzyl alcol
6. Ở bài tổng hợp acid benzoic, khi đun hỗn hợp phản ứng trong bình cầu trong thời gian 90
phút, các sản phẩm tạo thành là những chất gì? Viết phương trình phản ứng xảy ra? - Kali benzoat - KOH
- Tủa MnO2 có màu nâu đen - Nước
7. Trong bài tổng hợp acid benzoic, vì sao phải đun hoàn lưu? Tác dụng của đá bọt khi cho vào là gì?
- Vì chúng ta thực hiện phản ứng ở nhiệt độ cao hơn nhiệt độ sôi của nước và chúng ta cần hồi lưu
để ngưng tụ nước lại.
- Dùng đá bọt để dịch tản nhiệt đều, sôi đều, kết tủa MnO2 không bị vón lại ở đáy. Nếu không dùng
đá bọt thì sử dụng cá từ, đun cách cát (không đun cách thủy vì dung dịch bên trong bình cầu sẽ
không thể sôi được), đun trong dầu,
8. Hãy nêu các sản phẩm của phản ứng tổng hợp acid benzoic: CoH5CH2OH + KMnO4? Theo bài
thực tập, trong 2 nguyên liệu sử dụng, nguyễn liệu nào dư sau phản ứng? Giải thích tại sao?
- Sản phẩm sau phản ứng : Kalibenzoat, KOH, Tủa MnO2, Nước, KMnO4
- Nguyên liệu dự là KMnO4 vì để đảm bảo alcol phản ứng hết
9. Sau phản ứng tổng hợp acid benzoic, trong bình cầu có những chất gì? Chất nào dễ loại bỏ
nhất và phương pháp loại bỏ là gì? - Acid benzoic, nước, MnO2
- Chất dễ bị loại bỏ là tủa MnO2, loại tủa bằng phương pháp lọc áp suất giảm để lấy dịch
10. Trong bài tổng hợp acid benzoic, sau khi lọc bỏ MnO2, hỗn hợp có màu gì? Đó là do chất gì và cách loại bỏ?
- Sau khi lọc bỏ MnO2, hỗn hợp hợp có màu hồng hoặc tím, do có KMNO4 dư
11. Hãy nêu 3 vai trò của HCl đậm đặc trong bài tổng hợp acid benzoic. - Trung hoà KOH
- Đẩy acid benzoic ra khỏi muối Kalibenzoat
- Làm môi trường acid cho phản ứng khử Na2SO3 đối với KMnO4
12. Vì sao khi cho HCl đậm đặc, phải kiểm tra để đạt pH = 2?
- Vì pH cao hơn thì acid không tủa hết làm giảm hiệu suất 3
13. Hãy đề xuất một phương pháp loại bỏ MnO2 mà không sử dụng phương pháp lọc? Giải thích phương pháp này -
14. Sau khi thực hiện xong phản ứng, sinh viên rửa bình cầu nhưng không thể sạch được mà luôn
lẫn các vết màu đen. Đó là do chất gì và nêu cách rửa sạch?
- Các vết màu đen là MnO2
- Chuẩn bị dung dịch hỗn hợp HCl và Na2SO3. - PTPU
MnO2 + Na2SO3 + 2HCl → MnCl2 + Na2SO4 + H2O
15. Phương pháp tinh chế acid benzoic trong bài thực tập là gì? Hãy đề xuất một phương pháp
khác có thể tinh chế acid benzoic? Hãy cho biết giai đoạn nào trong quá trình tổng hợp acid
benzoic là giai đoạn tinh chế?
- Phương pháp kết tinh lại
16. Dung môi để tinh chế acid benzoic là gì? Vì sao có thể chọn dung môi này?
- Nước sôi, do acid benzoic kém tan trong nước lạnh, nhưng tan tốt trong nước nóng
17. Vì sao phải đun nhẹ và khuấy đều acid benzoic trước khi lọc nóng?
- Vìa acid benzoic dễ thăng hoa, nếu khuấy mạnh tinh thể acid benzoid sẽ kết tinh bám lên thành cốc
và khi đun thì cốc sẽ nóng lên làm cho acid benzoic thăng hoa dẫn đến giảm hiệu suất sản phẩm do
đó phải đun nhẹ và thỉnh thoảng khuấy đều
18. Nêu ít nhất 3 yêu cầu về thao tác khi lọc nóng?
- Tráng phiễu và giấy lọc bằng nước nóng rồi mới lọc
- Lọc nhanh hỗn hợp còn nóng qua giấy lọc xếp nếp - Acid benzoic
19. Sau khi lọc nóng thu được acid benzoic tinh khiết, nên để nguội từ từ hay làm lạnh ngay? Giải thích?
- Nên để nguội từ từ vì nếu làm lạnh ngay tinh thể acid benzoic sẽ bị nát vụn
- Sau đó làm lạnh trong thau nước đá để kết tinh hoàn toàn tiếp đến lọc dưới áp suất giảm cho đến khô
20. Vì sao chỉ được sấy acid benzoic ở 60°C? Nếu sấy ở nhiệt độ cao hơn hoặc thấp hơn thì sẽ như
thế nào? Giải thích
- Vì acid bezoic có tính thăng hoa
- Sấy ở nhiệt độ cao thì acid benzoid bị thăng hoa, chuyển từ dạng rắn sang dạng khí. 4
Document Outline
- 3.Cho biết công dụng của HCl ở giai đoạn 2.3
- 4.Đề nghị vài hoá chất có thể thay thế cho Na2SO3 .
- 5.Giai đoạn acid hoá: tại sao phải cận thận, lành mạ
- II. CÂU HỎI LƯỢNG GIÁ
- 2.Nếu nguyên tắc điều chế acid benzoic trong bài thự
- 3.Hãy so sánh khả năng oxy hóa của kali permanganat
- 4.Nêu thứ tự cho các hóa chất trong bài tổng hợp aci
- 5.Vì sao phải đun hỗn hợp phản ứng đến sôi nhẹ trong
- 6.Ở bài tổng hợp acid benzoic, khi đun hỗn hợp phản
- 7.Trong bài tổng hợp acid benzoic, vì sao phải đun h
- 8.Hãy nêu các sản phẩm của phản ứng tổng hợp acid be
- 9.Sau phản ứng tổng hợp acid benzoic, trong bình cầu
- 10.Trong bài tổng hợp acid benzoic, sau khi lọc bỏ Mn
- 11.Hãy nêu 3 vai trò của HCl đậm đặc trong bài tổng h
- 12.Vì sao khi cho HCl đậm đặc, phải kiểm tra để đạt p
- 13.Hãy đề xuất một phương pháp loại bỏ MnO2 mà không
- 15.Phương pháp tinh chế acid benzoic trong bài thực t
- 16.Dung môi để tinh chế acid benzoic là gì? Vì sao có
- 17.Vì sao phải đun nhẹ và khuấy đều acid benzoic trướ
- 18.Nêu ít nhất 3 yêu cầu về thao tác khi lọc nóng?
- -Acid benzoic
- 20.Vì sao chỉ được sấy acid benzoic ở 60°C? Nếu sấy ở


