








Preview text:
VÍ DỤ VÀ BÀI TẬP
CHƯƠNG CẤU TRÚC VẬT LIỆU I – PHẦN VÍ DỤ
1) Tính mật độ xếp thể tích Mv của NaCl, biết r(Na+) = 0,98 Ao, R(Cl-) = 1,81 Ao. Giải: 4 4 3 3 4 ( r ) 4 ( R ) 3 3 M x 100 % v 3 ( 2 r 2 R ) 4 4 3 3 4 [ ( 0 ,98) ] 4 [ (1,81) ] 3 3 M x 100 % 67 % v 3 [ 2 .( 0 ,98 ) 2 .(1,81 )]
2) Đồng (Fcc) có bán kính nguyên tử là 1,278 Ao. Tính khối lượng riêng của Cu và so sánh với số liệu trong phụ lục Giải: a 2 4 r 4 x 1 . 278 Trong Fcc, r a 3 . 61 Ao 4 2 2
Số nguyên tử/ 1 ô cơ sở = 4
Khoái löôïng 1 oâ cô sôû
(Soá nguyeân töû / oâ cô sôû) (Khoái löôïng 1 nguyeân töû)
Khoái löôïng rieâng = Theå tích 1 oâ cô sôû Theå tích 1 oâ cô sôû
Khoái löôïng 1 nguyeân töû = Nguyeân töû gam [g/mol] / Soá nguyeân töû trong 1 mol [ nguyeân töû / mol ]
Soá nguyeân töû trong 1 mol = Soá Avogadro = 6,02 x 10 23 nguyeân töû / mol
Khối lượng riêng dCu = 4 (63,5 / 6,02. 1023) / (3,61. 10-8)3 = 8,98 g/cm3
Theo phụ lục dCu = 8,96 g/cm3
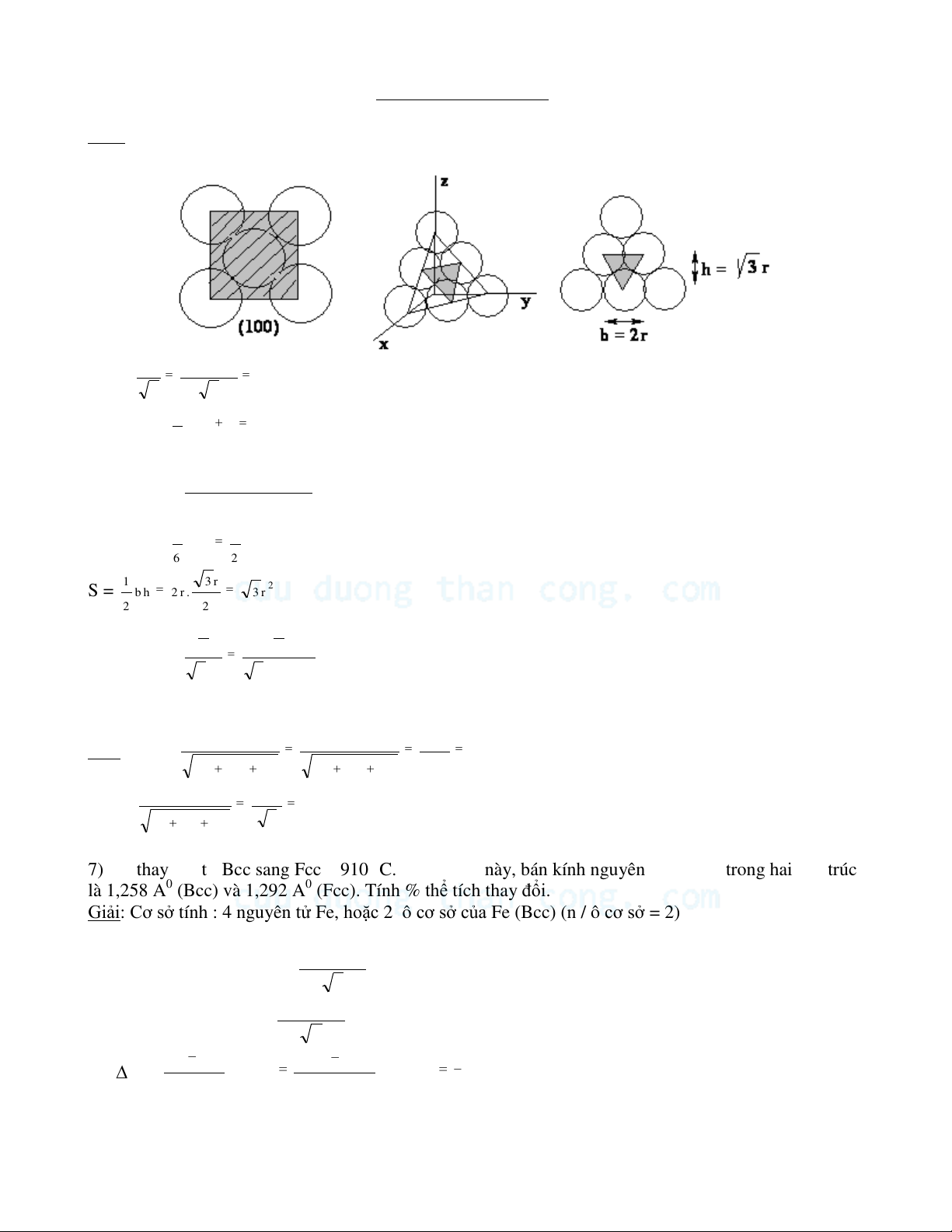
3) Tính mật độ thẳng của nguyên tử theo phương [110] của Cu (Fcc).
Giải: Mật độ thẳng = số nguyên tử / chiều dài (cm) 2 2 7 ( Linear density ) LD = 3 ,9 x 10 ng tu / cm 8 a 2 ( 3 , 61 . 10 ) 2
4) Tính độ lặp lại trên phương [211] của Cu (Fcc).
Độ lặp lại theo một phương (Repetition spacing) = khoảng cách giữa các nguyên tử trên phương đó.
Phương [211]: đường thẳng nối từ gốc O đến điểm (1, 1/2, 1/2) : điểm K ở giữa của mặt ABCD. OK2 = OM2 + MK2 D C D C = OA2 + AM2 + MK2 K K [ 2 1 1 ] 2 2 a a a 6 3,6 1 6 2 0 a / 2 O OK = a = 4 ,4 3 A a 4 4 2 2 [ 1 1 0 ] A B A B a / 2 M
5) Tính mật độ phẳng trên (100), (111), của Pb (Fcc)
Mật độ phẳng = số nguyên tử / 1 đơn vị diện tích (mm2 ) CuuDuongThanCong.com
https://fb.com/tailieudientucntt 2 Mật
S o á n g u y e ân tö û tre ân m a ët S
độ phẳng (Planar density: PD) = D ie än tíc h m a ët S
Giải: Từ phụ lục rPb = 1,750 A0 4 r 4 (1,7 5 0 ) aPb = = 4,95 Ao 2 2 1 nS (100) = x 4 1 2 nguyên tử 4 S = a2 2 PD (100) = = 8,2. 1012 nguyên tử/mm2 2 (4 ,9 5 1 0 -7 x m m ) 1 1 nS (111) = x 3 n g u y e ân tö û 6 2 1 3 r S = 2 b h 2 r . 3 r 2 2 1 1 PD (111) = 2 2
= 0,095 nguyên tử / A2 = 9,5. 1012 nguyên tử / mm2 2 2 3 r 3 . (1,7 5 )
6) So sánh d111 vàø d200 trong Pb (Fcc), aPb = 4,95 A0. Giải a 4 ,9 5 4 ,9 5 : d 0 200 = 2 ,4 7 5 A h 2 k 2 l 2 2 2 2 2 2 0 0 4 ,9 5 4 ,9 5 d 0 111 = 2 ,8 6 A 2 2 2 1 1 1 3
7) Sắt thay đổi từ Bcc sang Fcc ở 9100 C. Ở nhiệt độ này, bán kính nguyên tử của sắt trong hai cấu trúc
là 1,258 A0 (Bcc) và 1,292 A0 (Fcc). Tính % thể tích thay đổi.
Giải: Cơ sở tính : 4 nguyên tử Fe, hoặc 2 ô cơ sở của Fe (Bcc) (n / ô cơ sở = 2)
hoặc 1 ô cơ sở của Fe (Fcc) (n / ô cơ sở = 4) Đối 4 x 1, 258 với Bcc V0 = 2a3 = 2 [ ]3 = 49,1 A3 3 4 x 1, 292 Fcc V1 = a3 = [ ]3 = 48,7 A3 2 V V 48 ,7 49 1 , V = 1 0 .100 % x 100 % 0 ,8 % V 49 1 , 0 CuuDuongThanCong.com
https://fb.com/tailieudientucntt 3
8) Hợp kim chứa 80% khối lượng Al và 20 % khối lượng Mg. Tính % nguyên tử mỗi loại.
Giải: Cơ sở tính 100g hợp kim Al Mg 80g
Khối lượng mỗi nguyên tố 20g
Số nguyên tử mỗi nguyên tố 23 80 x ( 6 ,02 .10 ) khoái löôïng 20 ( x Soá Avogadro ) 23 x ( 6 ,02 .10 ) 26 ,98 nguyeân töû gam 24 ,3 g = 2,97 x 6,02.1023 (
x nguyeân töû /mol ) = 0,823 x 6,02. 1023 g/mol
Tổng số nguyên tử = (2,97 + 0,823). 6,02. 1023 23 2 ,97 x 6 ,02 . 10 % nguyên tử Al = x 100% = 78% 23 3 , 793 x 6 ,02 .10 2 3 0 ,8 2 3 x 6 ,0 2 1 . 0 % nguyên tử Mg = x 100% = 22% 2 3 3,7 9 3 x 6 ,0 2 1 . 0
9) Trong cấu trúc MgO, các ion Mg2+ bị thay thế bởi Fe2+ theo tỷ lệ Mg2+ / Fe2+ = 17 / 10. Tính tỉ số khối lượng MgO / FeO. 2 Giải M g 1 7 : = tỉ số mol F e 2 1 0 17 ( 24 ,3 16 ) 685 Khối lượng MgO = AN : Số Avogadro 23 6 , 02 . 10 AN 10 ( 55 ,8 16 ) 718 Khối lượng FeO = = 23 6 , 02 . 10 AN MgO 685 Tỉ số khối lượng 0 ,96 FeO 718
10) Khối lượng riêng thực tế của Al đơn tinh thể là 2,679 g/cm3. Hằng số mạng a = 4,049 A0 (Al : Fcc).
Nếu sự khác nhau giữa khối lượng riêng thực tế và tính toán là do sự có mặt các lỗ trống trong tinh thể.
a) Tính phần nguyên tử bị bỏ trống.
b) Tính số lỗ trống trên 1cm3. Giải 2 ,6 9 7 n g u y e ân tö û
: Số nguyên tử thực tế / 1 cm3 = 2 2 6 ,0 2 . 1 0 2 3 3 (2 6,9 8 ) / (6,0 2 1 . 0 ) c m
S o á n g u y e ân tö û / O Â c ô s ô û 4 n g u y e ân tö û
Số vị trí của nguyên tử / 1cm3 = 2 2 6 ,0 3. 1 0
T h e å tíc h o â c ô s ô û ( 8 3 3 4 ,0 4 9 .1 0 ) c m n g u y e ân tö û
b) Số vị trí bị bỏ trống / cm3 = (6,03 – 6,02).1022
= 0,01.1022 chổ trống / cm3 c m 3 2 2 0 ,0 1 1 . 0 1
a) Phần vị trí bỏ trống =
Cứ 600 vị trí sẽ có 1 vị trí bị bỏ trống. 2 2 6 ,0 2 1 . 0 6 0 0
11) Mạng FeO có Fe3+ với tỷ lệ Fe3+/ Fe2+ = 1/2
a) Tính phần vị trí trống trong tổng số các vị trí cation
b) Tính phần khối lượng oxy. Giải: CuuDuongThanCong.com
https://fb.com/tailieudientucntt 4
a) Để cân bằng điện tích 2 ( 3 ) / / F e 2 V ( F e ) 2 Fe3+ 1 trống Fe2+ F e 2 1 0 0 5 0 100 ion Fe2+ = 50 ion Fe3+ = 25 vị trí trống Fe2+ 2 2
Tổng số vị trí cation 100 + 50 + 25 = 175
Phần vị trí trống = 25 / 175 = 0,14 b) 100 Fe2+ 100 O2- (FeO) 50 Fe3+ 75 O2- (Fe2O3) 150 ion Fe 175 O2-
Khối lượng oxy = 175 (16 / AN) = 2800 / AN
Khối lượng sắt = 150 (55,8 / AN) = 8370 / AN Phần 2 8 0 0 / A N khối lượng oxy = = 0,251 (2 8 0 0 8 3 7 0 ) / A N
12) a) Tính số nguyên tử / ô cơ sở của CaF2 (số Ca2+, F-)
b) Tính khối lượng 1 ô cơ sở. 1 1 a) n x x C a 2 8 6 4 , nF- = 8 8 2 8 x 1 9 4 x 4 0 ,0 8
b) Khối lượng 1 ô cơ sở = 2 2 5,2 x 1 0 g 2 3 6 ,0 2 x 1 0
13) Ferrospinel có công thức 32 O2-, 16 Fe3+ và 8 ion hóa trị 2.
Nếu tỷ lệ ion hóa trị 2 là Zn2+/ Ni2+= 3/ 5. Tính phần khối lượng ZnO, NiO và Fe2O3 phải sử dụng để chế tạo ferrospinel.
Giải: 5 NiO + 3 ZnO + 8 Fe2O3 (Zn3, Ni5)Fe16O32 Cơ sở tính: 8 mol Fe2O3 Phần khối lượng
5 NiO = 5 (58,71 + 16) = 373,5 = 0,197
3ZnO = 3 (65,37 + 16) = 244,1 = 0,129
8 Fe2O3 = 8 (2 x 55,8 + 3 x 16) = 1277,6 = 0,673 1895,2 0,999
14) Xét mẫu MgO chứa 0,2% khối lượng Li2O. Tính sự tăng mật độ trống do sự có mặt của tạp chất
(Nếu xem như không tạo nguyên tử xen kẻ). MLi = 6,941, M0 = 16, MMg = 24,31
Cơ sở tính 100 g vật liệu: g Số L i O 0 ,2 mol Li 2 2O = 6,7.10-3 mol 2 M M L i O 2 x 6 ,9 4 1 1 6
sẽ có 2 x 6,7.10-3 mol Li+ và 6,7.10-3 mol O2- g M gO 9 9 ,8 Số mol MgO = = 2,4758 mol M M M g O 2 4 ,3 1 1 6
sẽ có 2,4758 mol Mg2+ và 2,4758 mol O2-
Trong mẫu có 1,34.10-2 mol Li+ 2,478 mol Mg2+
6,7.10-3+ 2,4758 = 2,48425 mol O2- Tổng số mol 4,9759 mol 2 L i / V M g O 3 Số N 2 x 6 ,7 1 . 0 trống oxy: N L i OV = = 6,7.10-3 mol 2 2 CuuDuongThanCong.com
https://fb.com/tailieudientucntt 5 3 Mật N 6 ,7 1 . 0 độ trống oxy: C o v 3 OV = 1,3 4 1 . 0 N T 4 ,9 7 5 9
15) Trong một vài cấu trúc tinh thể, mật độ trống ở 350 C gấp 2 lần so với 250 C. Ở nhiệt độ nào thì mật
độ trống = 1 / 2 ở 250 C.
CV (350 C) = 2CV (250 C) (1) T1 = 35 + 273 = 308
CV (T) = 1/2 CV (250 C) (2) T2 = 25+ 273 = 298 Q Q Q 1 Q 1 exp(- ) 2 e x p ( ) ( ) ln 2 ( ) (3) R .3 0 8 R .2 9 8 R 3 0 8 R 2 9 8 Q 1 Q Q 1 Q 1 exp(- ) e x p ( ) ( ) ln 2 ( ) (4 ) R T 2 R .2 9 8 R T R 2 9 8 Cộng 2 vế (3) & (4): Q 1 1 Q 2 1 1 2 [ ] R 308 T R 298 308 T 298 T = 288,6 0K = 15,6 0C
16) Giả sử có ion X3+ thay thế Mg2+ trong MgO
a) Viết phương trình cấu trúc cho sự thay thế
b) Nếu tỷ lệ X3+ / Mg2+ = 0,25. Tính tỉ lệ cation / anion 2 X V / / M g M g 100 Mg2+ 25 X3+ 12,5 V Tổng Mg
số cation 125 (không phải tổng số vị trí cation) 100 Mg2+ 100 O2- 25 X3+ 37,5 O2- Tổng cation 125 anion = 137,5 Tỉ số 0 ,91 anion 137 ,5
17) Ở 1000 0C có 1,7% kl Cacbon tạo dung dịch rắn với Fe (Fcc)
Sẽ có bao nhiêu nguyên tử C cho 100 ô cơ sở. Fe(Fcc) nFe/ô = 4 100 ô = 400 nguyên tử Fe Khối 55 ,85
lượng 400 nguyên tử = 400 x AN Khối 55 ,85 100 22726 lượng 100 ô = 400 x x AN 98 ,3 AN Số 2 2 7 2 6 1,7 A N nguyên tử Cacbon x x 3 2 A N 1 0 0 1 2 ,0 1
18) Mạng khuyết tật Fe(1-x)O có cấu trúc giống NaCl, ngoại trừ vài vị trí trống ion Fe2+ và có một vài
phần Fe3+ thay thế Fe2+. Trong đó x= 0,04 0,16 tùy thuộc vào nhiệt độ và lượng oxy có sẳn. Nếu
mạng này chứa 52% nguyên tử oxy và có hằng số mạng là 0,429 nm.
a) Tính tỉ số Fe2+ / Fe3+ b) Tính khối lượng riêng.
Cơ sở tính 100 nguyên tử = 52 nguyên tử oxy và 48 nguyên tử Fe 2 ( 3 ) / / F e 2 V ( F e ) F e 2
Giả sử có y Fe3+: 52(-2) + y(+3) + (48 - y) (+2) = 0 y = 8
Hóa trị O2- Hóa trị Fe3+ Hóa trị Fe2+ Fe3+= 8 Fe2+ = 40 CuuDuongThanCong.com
https://fb.com/tailieudientucntt 6 Fe2+ / Fe3+ = 5 Có 52 O2-
tính cho 13 ô cơ sở (vì mỗi ô có 4 O2-) 48 ( 55 ,85 ) 52 (16 ) d = 3 5 , 7 g / cm 23 9 3 6 , 02 . 10 x 13 x ( 0 , 429 . 10 ) Thể tích 1 ô 19) CaF
, sau khi có mất trật tự thì có khối lượng riêng là d . Biết
2 có khối lượng riêng ban đầu là d0 1
MCa = 40; MAl = 27; MSr = 87,62; MY = 88,91; MF = 19. Nếu d1 < d0 thì đó là do nguyên nhân nào dưới đây:
a) mất trật tự kiểu Frenkel anion
b) mất trật tự kiểu Schottky c) khi Sr2+ thay chổ Ca2+ d) Thêm YF ) ở vị trí xen kẽ
3 vào CaF2 sao cho Y3+ thay chổ Ca2+, F (trong YF3
e) Thêm AlF3 vào CaF2 sao cho Al3+ thay chổ Ca2+, trống Ca2+ Giải: 4 x 40 8 x 19 d 0 ANxV
a) Mất trật tự kiểu Frenkel anion: tạo F- ở vị trí xen kẽ và trống F, như vậy số ion F trong một ô không đổi, nên d1 = do
b) Mất trật tự kiểu Schottky: trống Ca và trống F, như vậy số ion Ca và F trong một ô đều giảm, nên d1 < do
c) Sr2+ thay chổ Ca2+: không tạo điện tích dư, MSr > MCa nên d1 > do
d) Y3+ thay chổ Ca2+, F (trong YF ) ở vị trí xen kẽ: ( ’ 3 Y3+).(Ca2+) = Fi
Do MY > MCa và số ion F trong một ô tăng lên, nên d1 > do
e) Al3+ thay chổ Ca2+, trống Ca2+: 2(Al3+). ’’ (Ca2+) = V(Ca2+)
Như vậy cứ 2 Al3+ đi vào, sẽ có 3 Ca2+ đi ra.
e) 2 x 27 < 3 x 40 nên d1 < do
Tóm lại nếu d1 < do thì đó là do a) và e)
20) Nếu ứng suất tiếp tới hạn trên phương [1 1 0] và trên mặt (111) của đơn tinh thể Cu nguyên chất là
142 psi (0,1 kg/ mm2), thì ứng suất áp dụng trên phương [100] là bao nhiêu để tạo ra trượt trên mặt (111) n [ 1 1 1 ] Cách 1: Dùng hình học h a èn g s o á m a ïn g a 1 cos = 0 ,5 7 7
ñ ö ô øn g c h e ùo k h o ái a 3 3 h a èn g s o á m a ïn g a 1 c o s 0 , 7 0 7
ñ ö ô øn g c h e ùo m a ët a 2 2 1 4 2 = 3 5 0 psi c o s c o s 0 ,7 0 7 x 0 ,5 7 7 [ 1 1 0 ] Cách 2: Dùng công thức
Góc giữa phương [100] và mặt (111) x 1 + 0 x 1 + 0 x 1 [ 1 0 0 ] 1 1 c o s = 0,577 = ? 2 2 2 2 2 2 1 0 0 1 1 1 3
Góc giữa phương [100] và phương [1 1 0] 1 x 1 + 0 x ( - 1 ) + 0 x 0 1 c o s 0 , 7 0 7 2 2 2 2 2 2 1 0 0 1 ( 1) 0 2 Tính như cách 1 CuuDuongThanCong.com
https://fb.com/tailieudientucntt 7
II PHẦN BÀI TẬP
1) Điền vào bảng, quan hệ giữa bán kính nguyên tử r và các kích thước của ô cơ sở đối với Bcc, Fcc
và Lập phương đơn giản (chỉ có 8 nguyên tử trên 8 đỉnh của hình lập phương). Bcc Fcc LP Hằng số mạng a Đường chéo mặt Đường chéo khối
2) Ag (Fcc) có r = 1,444 A0. Tính hằng số mạng và thể tích ô cơ sở.
3) Au (Fcc) có a = 4,078 A0, Nguyên tử lượng 197. Tính khối lượng riêng của nó.
4) Zn (Hcp) có c = 4,94 A0, khoảng cách giữa tâm 2 nguyên tử kề nhau trên mặt đáy ô cơ sở là 2,665
A0. Tính: a) Số nguyên tử / ô cơ sở b) Thể tích ô cơ sở c) Tính khối lượng riêng
ĐS: a) 6 b) 9,1.10-23 cm3 c) 7,16 g / cm3
5) Nguyên tử lượng của Na là 22,990 và Cl là 35,453. Nếu khối lượng riêng là 2,165 g / cm3. Tính: a)
Hằng số mạng a b) Đường chéo mặt c) Đường chéo khối của ô cơ sở NaCl.
ĐS: a) 5,64 A0 b) 7,89 A0 c) 9,77 A0
6) Tinh mật độ phẳng của nguyên tử theo phương [112] của: a) Fe (Bcc) có rFe = 1,241 A0 b) Ni (Fcc) có rNi = 1,245 A0.
ĐS: a) 1,42.107 nguyên tử / cm b) 2,32.107 nguyên tử / cm
7) Tính mật độ phẳng của Cu (Fcc), rCu = 1,278 A0 trên mặt a) (100), b) (110) c) (111)
ĐS: a) 1,53.1013 nguyên tử /mm2 b) 1,08.1013 nguyên tử / mm2 c) 1,77.1013 nguyên tử / mm2
8) Al (Fcc) có a = 4,049 A0. Tính a) d220 b) d111 c) d200
ĐS: a) 1,432 A0 b) 2,338 A0 c) 2,025 A0
9) Khoảng cách giữa các mặt (110) trong cấu trúc Bcc của một kim loại là 2,03 A0. a) Tính hằng số
mạng a b) Tính bán kính nguyên tử. c) Kim loại đó là kim loại nào (Tra từ khối lượng nguyên tử)
ĐS: a) 2,87 A0 b) 1,243 A0 c) Fe (Bcc) hoặc Ni
10) MgO có cấu trúc giống NaCl, khối lượng riêng của nó là 3,65 g / cm3. Tính kích thước ô cơ sở a và
kiểm tra lại với r 2M g = 0,78A0, R O 2 = 1,32A0.
11) Titan có cấu trúc Hcp với a = 2,965 A0, c = 4,683 A0 ở nhiệt độ 880 0C và sẽ có cấu trúc Bcc với
a = 3,32 A0 ở nhiệt độ 880 0C.
a) Mạng Ti sẽ dãn ra hay co lại khi đun nóng nó đến 900 0C.
b) Tính độ thay đổi thể tích theo cm3 /g.
ĐS: a) mạng sẽ dãn ra b) 0,007 cm3 / g.
12) Na (Bcc) có a = 4,29 A0. Biểu diễn sự sắp xếp nguyên tử (một cách gần đúng) trên mặt (110) và
tính khoảng cách giữa các mặt này. CuuDuongThanCong.com
https://fb.com/tailieudientucntt 8
13) Kim cương có hằng số mạng a = 3,56 A0. Tính: a) Mật độ xếp thể tích b) Khối lượng riêng của kim cương.
ĐS: a) 33,9 % b) 3,54 g / cm3.
14) Tính số nguyên tử trong một mẫu hình trụ lấy trên mặt đồng rắn (Cu có khối lượng riêng 8,93
g/cm3, nguyên tử lượng 63,55), biết mẫu có đường kính 1 m và dày 1 m. ĐS: 6,64.1010 nguyên tử.
15) Một mol của MgO rắn chiếm một khối vuông có cạnh là 22,37 mm. Tính khối lượng riêng của
MgO (MMg = 24,31; MO = 16). ĐS: 3,60 g / cm3
16) Một hợp kim chứa 85% khối lượng Cu và 15 % kl Sn. Tính % nguyên tử mỗi loại. Biết MCu = 63,55; MSn = 118,69. ĐS: 8,63 % Sn, 91,37 % Cu.
17) Có 5% nguyên tử Mg trong hợp kim Al-Mg. Tính % Khối lượng Mg và Al. Biết MMg = 24,31; MAl = 26,98.
ĐS: 4,53 % kl Mg và 95,47 % kl Al.
18) Hợp kim chứa 75% kl Cu và 25% kl Zn. Biết MCu = 63,55; MZn = 65,37.
a) Tính % nguyên tử mỗi loại. b) Loại pha của hợp kim và loại cấu trúc của ô cơ sở. c) Tính khối lượng
1 ô cơ sở của hợp kim. d) Biết khối lượng riêng của hợp kim là 8,5 g/cm3, tính thể tích ô cơ sở. e) Tính
hằng số mạng trung bình của ô cơ sở.
ĐS: a) 75,53 % nguyên tử Cu, 24,47 % Zn b) Dd rắn, Fcc của đồng
c) 4,25.10-22 g d) 5.10-23 cm3 e) 3,68 A0
19) Dung dịch rắn xen kẻ của Fe chứa C theo tỷ lệ C: Fe = 33:108. Tính % khối lượng Cacbon có mặt
trong dung dịch rắn. ĐS: 6,2 % Cacbon.
20) Hợp kim chứa 80% kl Ni và 20% Cu tạo dd rắn thay thế (Fcc) với a = 3,54A0. Biết MCu = 63,55;
MNi = 58,71. Tính khối lượng riêng của hợp kim. ĐS: 8,923 g / cm3.
21) Nếu 1% khối lượng Cacbon có trong Fe (Fcc), tính phần trăm các ô cơ sở có chứa cacbon. Giả sử
mỗi ô cơ sở chỉ chứa tối đa 1 nguyên tử Cacbon.
ĐS: 19% ô cơ sở có chứa cacbon
22) Tìm bán kính nguyên tử lớn nhất có thể nằm ở khe hở của Fe mà không gây ra ứng suất nội (do sai
lệch mạng) a) Đối với Fe (Bcc) b) Đối với Fe (Fcc) Gợi 1 1 1 1 1
ý: Tâm lỗ hổng lớn nhất ở Bcc ( , , 0 ) , Fcc ( , , ) 2 4 2 2 2
ĐS: a) r (lỗ) = 0,37 A0 b) r(lỗ) = 0,54 A0
23) Đối với Cu ở 1000 0C, cứ 473 nút mạng thì có 1 nút trống. Nếu số nút trống vẫn giữ nguyên khi Cu
được làm nguội về 20 0C. Tính khối lượng riêng của Cu ở nhiệt độ 200 C. ĐS: 8,92 g / cm3.
24) Tính khối lượng riêng của FeO chứa Fe2O3, nếu Fe3+/ Fe2+ = 0,14. Biết FeO + Fe2O3 có cấu trúc
của NaCl và trung bình (rFe+ R0) = 2,15 A0. ĐS: 5,73 g / cm3
25) a) Tính số nguyên tử / ô cơ sở của CaF2 b) Tính khối lượng 1 ô cơ sở. ĐS: b) 5,2.10-22 g. CuuDuongThanCong.com
https://fb.com/tailieudientucntt 9
26) Periclase (MgO) có cấu trúc giống NaCl.
a) Nếu RO2-= 1,32 A0, rMg2+ = 0,78 A0. Tính MV
b) Nếu r/R = 0,414. Tính MV ĐS: a) 63 % b) 79 %
27) a) Trong CsCl, RCl- = 1,81A0, rCs+ = 1,65 A0. Tính MV
b) Nếu r/ R = 0,732. Tính MV ĐS: a) 68 % b) 73 %
28) CaF2 có rCa2+ = 1,06 A0, RF = 1,33 A0. Tính MV và khối lượng riêng của CaF2
ĐS: Mv = 0,59; d = 3,09 g/cm3
29)Tính khối lượng riêng của ZnS (Sphalerite) với rZn2+ = 0,83A0, RS2- = 1,74 A0. Khi K = 6. Giả sử
khi K = 4 thì r’ = 0,94 r, R’ = 0,94 R (r,R là bán kính cation và anion khi K= 6). ĐS: d = 3,73 g/cm3
30) MnS có hai dạng cấu trúc, một dạng với cấu trúc giống NaCl, một dạng giống với ZnS
(Sphalerite).Tính khối lượng riêng và MV trong mỗi trường hợp.
Biết: a) Với cấu trúc NaCl, RS2+ = 1,74 A0, rMn2+= 0,91 A0, K = 6
b) Với cấu trúc ZnS, RS2+ = 1, 64 A0, rMn2+= 0,68 A0, K = 4
ĐS: a) 3,38 g/cm3 b) 3,76 g/cm3
31) Viết các ký hiệu Kroger-Vink a) Trống Oxy trong MgO
b) Sai hỏng Frenkel cation và anion trong MgO
c) Sai hỏng Schottky trong MgO
d) Sai hỏng Frenkel cation trong Li3N
e) Trong SrCl2 khi Ca2+ thay Sr2+, Na+ thay Sr2+, Al3+thay thế Sr2+
32) Nếu người ta muốn tăng số ion F- trong SrF2 ở vị trí xen kẻ thì người ta phải thêm NaF hay LaF3.
Tương tự nếu muốn tăng số lỗ trống F- thì phải thêm NaF hay LaF.
33) Giả sử có đơn tinh thể kim loại chịu tải theo phương [110]
a) Nếu ứng suất trượt tới hạn là 0,34 MPa thì ứng suất áp đặt là bao nhiêu để tạo ra trượt trong hệ trượt (111) [110].
b) Với hệ trượt trên thì kim loại có cấu trúc Fcc, Bcc hay Hcp
34) Đơn tinh thể kim loại Fcc có ứng suất trượt tới hạn là 55,2 MPa.
a) Tìm ứng suất lớn nhất có thể đặt vào một thanh kim loại này theo phương [112] để tạo ra trượt theo
phương [101] trong mặt (111)
b) Tính lại kết quả nếu kim loại là Bcc, khi đó hệ trượt là [111] (101) với cùng giá trị tới hạn. BÀI TẬP LÀM THÊM
1) Si (có cấu trúc giống kim cương, a = 0,543 nm) chứa 1021 nguyên tử B trong 1 m3 để tạo bán dẫn
loại p. Tính phần trăm khối lượng của B và số ô cơ sở Si có chứa 1 nguyên tử B. Biết MSi = 28,09, MB = 10,81. CuuDuongThanCong.com
https://fb.com/tailieudientucntt 10
2) Biết CaF2 có rCa = 0.106 nm và RF = 0,133 nm. Hảy xác định : a) Hình chiếu trên mặt phẳng đáy
của CaF2 và mật độ xếp thể tích của khối lập phương tạo bởi 8 ion F-. b) Mật độ xếp của một mặt
phẳng chỉ chứa ion dương. c) Mật độ xếp của một mặt phẳng chỉ chứa ion âm.
3) Ở 912 0C thể tích ô cơ sở của Fe (Bcc) là 0,02464 nm3 và của Fe (Fcc) là 0,0486 nm3. Tính phần
trăm thay đổi khối lượng riêng khi Fe chuyển từ Bcc sang Fcc. Biết MFe = 55,85.
4). Biết bán kính r (Ni2+) = 0,078 nm, r (O2-) = 0,132 nm, hảy dự đoán cấu trúc, biểu diễn hình chiếu
trên mặt phẳng ngang và tính mật độ sắp xếp thể tích của NiO.
5) Nếu CaF2 (không có khuyết tật) đã được thay thế Ca2+ bởi Y3+ với tỉ lệ Y3+/ Ca2+ = 0.1. Tính khối lượng riêng CaF
. Biết MCa = 40, MY = 88,91, MF = 19 , rCa = 0,106 nm và RF = 0,133 2 khi có YF3 nm
Giả sử khi thêm YF3 vào CaF2 thì không tạo ra ion xen kẻ và hằng số mạng CaF2 vẫn không đổi.
6) Si (có cấu trúc giống kim cương, a = 0,543 nm) chứa 0,000 001 % khối lượng P để tạo bán dẫn loại
n. Tính số nguyên tử P trong 1 m3 Si và số ô cơ sở Si có chứa 1 nguyên tử P. Biết MSi = 28,09, MP= 30,97.
7) Biết ZnS (sphalerite) có rZn = 0,083 nm và RS = 0,174 nm. Hảy xác định : a) Hình chiếu trên mặt
phẳng đáy và khoảng cách gần nhất giữa hai ion dương. b) Mật độ xếp của một mặt phẳng chỉ chứa ion
dương. c) Mật độ xếp của một mặt phẳng chỉ chứa ion âm.
8) MnS có hai dạng cấu trúc, một dạng với cấu trúc giống NaCl { r ( Mn2+) = 0,083 nm, r (S2-) = 0,174
nm}, một dạng giống với ZnS (sphalerite) { r ( Mn2+) = 0,068 nm, r (S2-) = 0,164 nm}. Tính phần trăm
thay đổi thể tích khi dạng ZnS chuyển thành dạng NaCl.
9) Biết bán kính r(Cs+) = 0,167 nm, r(I-) = 0,22 nm, hảy dự đoán cấu trúc, biểu diễn hình chiếu trên mặt
phẳng ngang và tính mật độ sắp xếp thể tích của CsI.
10) Mạng KCl (giống NaCl, không có khuyết tật) đã được thay thế K+ bởi Ti4+ với tỉ lệ Ti4+/ K+ = 0.1.
Tính khối lượng riêng KCl khi có TiCl . Biết M 4
K = 39, MTi = 47,9, MCl = 35,5, rK = 0,133 nm và RCl = 0,181 nm
Giả sử khi thêm TiCl4 vào KCl thì không tạo ra ion xen kẻ và hằng số mạng KCl vẫn không đổi.
11) Ở 1000 0 C có 1,7 % khối lượng cacbon tạo dung dịch rắn với Fe (Fcc) . Tính số nguyên tử cacbon
trong 100 ô cơ sở của sắt. MFe = 55,85 và MC = 12,01.
12) Biết CsCl có rCs = 0,165 nm và RCl = 0,181 nm. Hảy xác định : a) Hình chiếu trên mặt phẳng đáy
và khoảng cách từ gốc đến mặt (112). b) Mật độ xếp của một mặt phẳng chỉ chứa ion dương. c) Mật độ
xếp của một mặt phẳng chỉ chứa ion âm.
13) Hằng số mạng của kim cương a = 0,357 nm. Tính phần trăm thay đổi thể tích khi 1 g kim cương
chuyển thành 1 g graphít, biết khối lượng riêng của graphít là 2,25 g/cm3. Biết MC = 12,01.
14) Biết bán kính r (Mg2+) = 0,066 nm, r (O2-) = 0,132 nm, hảy dự đoán cấu trúc, biểu diễn hình chiếu
trên mặt phẳng ngang và tính mật độ sắp xếp thể tích của MgO. CuuDuongThanCong.com
https://fb.com/tailieudientucntt 11
15) Mạng NaCl (không có khuyết tật) đã được thay thế Na+ bởi Al3+ với tỉ lệ Al3+/ Na+ = 0.1. Tính
khối lượng riêng NaCl khi có AlCl3 . Biết MNa = 23, MAl = 27, MCl = 35,5, rNa = 0.098 nm và RCl = 0,181 nm
Giả sử khi thêm AlCl vào NaCl thì không tạo ra ion xen kẻ và hằng số mạng NaCl vẫn không đổi 3
16) Ni có cấu trúc Fcc với MNi = 58,71, khối lượng riêng theo lý thuyết của Ni là 8,91 g/cm3 và khối
lượng riêng thực tế là 8,87 g/cm3. Nếu sự khác nhau về khối lượng riêng là do sự có mặt của nút trống,
hỏi cứ bao nhiêu vị trí nguyên tử thì có một vị trí bị bỏ trống.
17) Biết NaCl có rNa = 0,098 nm và RCl = 0,181 nm. Hảy xác định : a) Hình chiếu trên mặt phẳng đáy
và khoảng cách giữa hai ion dương ở (0,1,0) và ( 1 1 ,0 ,
). b) Mật độ xếp của một mặt phẳng chỉ chứa 2 2
ion dương. c) Mật độ xếp của một mặt phẳng chỉ chứa ion âm.
18) MnS có hai dạng cấu trúc, một dạng với cấu trúc giống NaCl { r ( Mn2+) = 0,083 nm, r (S2-) =
0,174 nm}, một dạng giống với ZnS (sphalerite) { r ( Mn2+) = 0,048 nm, r (S2-) = 0,158 nm}. Tính phần
trăm thay đổi thể tích khi dạng NaCl chuyển thành dạng ZnS.
19) Biết bán kính r (Cd2+) = 0,069 nm, r (S2-) = 0,174 nm, hảy dự đoán cấu trúc, biểu diễn hình chiếu
trên mặt phẳng ngang và tính mật độ sắp xếp thể tích của CdS.
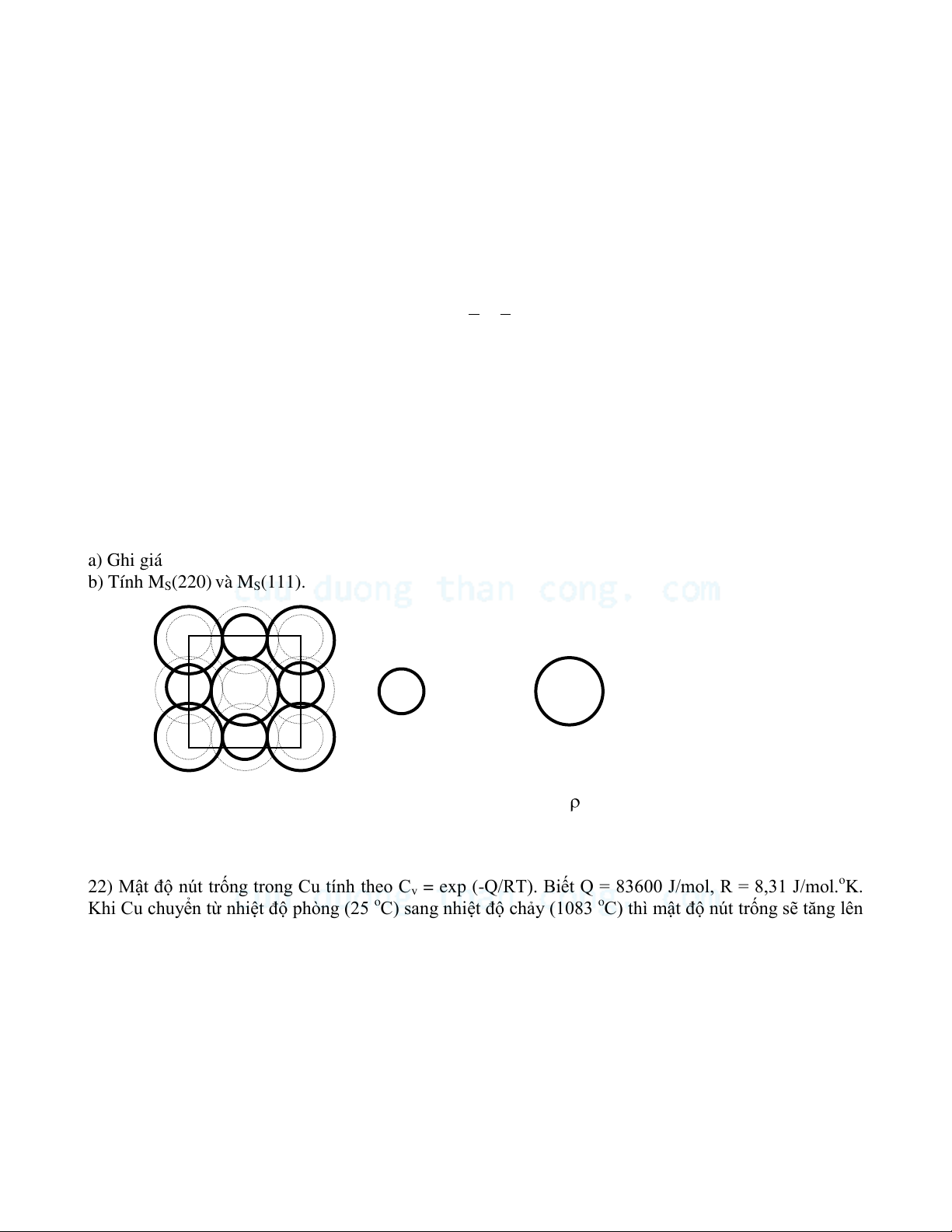
20) MnS ở dạng NaCl có rMn2+ = 0.91 A và RS2- = 1.74 A . MMn = 55, MS = 32.
a) Ghi giá trị tọa độ z trên hình vẻ, tính khối lượng riêng và mật độ xếp thể tích Mv. b) Tính MS(220) và MS(111). Mn2+ S2
21) Co có cấu trúc lục giác xếp chặt (Hcp) với khối lượng riêng = 8,83 g/cm3 , nguyên tử lượng MCo
= 58,93 và tỷ số c/a = 1,62. Hảy tính hằng số mạng a, c và bán kính nguyên tử Co. So sánh với giá trị
bán kính nguyên tử Co là 0,125 nm trong sổ tay.
22) Mật độ nút trống trong Cu tính theo Cv = exp (-Q/RT). Biết Q = 83600 J/mol, R = 8,31 J/mol.oK.
Khi Cu chuyển từ nhiệt độ phòng (25 oC) sang nhiệt độ chảy (1083 oC) thì mật độ nút trống sẽ tăng lên bao nhiêu lần CuuDuongThanCong.com
https://fb.com/tailieudientucntt

