Quiz: TOP 100 câu trắc nghiệm Đại cương về kim loại có lời giải chi tiết (Nâng cao - phần 2)
Câu hỏi trắc nghiệm
Các kim loại Na, Ba, K khi tác dụng với dd FeCl3 sẽ tác dụng với H2O trước tạo ra dung dịch bazơ.
Các dung dịch bazơ tsac dụng mới FeCl3 tạo kết tủa Fe(OH)3
→ Đáp án A
Theo định luật II của Pha - ra - đây thì khối lượng Ag sinh ra ở catot là:
![]()
→ Đáp án B
PT điện phân: CuCl2 -đp dung dịch→ Cu + Cl2↑
Áp dụng công thức có:
mCu = (64×5×2720)/(2×96500) = 4,512 g → nCl2 = nCu = 4,512/64 = 0,0705 mol
VCl2 = 0,0705 × 22,4 = 1,5792 lít
→ Đáp án B
Theo phương trình: 2NaCl + 2H2O ⟶ 2NaOH + H2 + Cl2
Khối lượng Hyđro bằng:
![]()
Khối lượng Clo bằng:
![]()
Tổng khối lượng khí thoát ra bằng 0,06 + 2,1322 ≈ 2,19 (g).
→ Đáp án C
Theo định luật II của Pha - ra - đây thì:
+ Khối lượng Cu sinh ra ở catot là:
![]()
+ Khối lượng O2 sinh ra là:
![]()
Thể tích khí bằng: 22,4.(0,08/32) = 0,056 (l).
→ Đáp án B
Số mol e trao đổi bằng:
![]()
Đặt 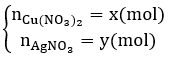
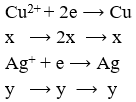
Khối lượng cực âm tăng thêm chính là tổng khối lượng Ag và Cu nên có hệ:
![]()
Nồng độ mol của mỗi muối trong dung dịch ban đầu lần lượt là:
CM(Cu(NO3)2 = 0,02: (200/1000) = 0,1 (M);
CM(AgNO3) = 0,02: (200/1000) = 0,1 (M)
→ Đáp án B
Số mol khí thoát ra bằng 0,336/22,4 = 0,015 (mol) nên số mol e trao đổi bằng 0,015.4 = 0,06 (mol)
Đặt ![]()
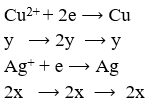
Khối lượng catot tăng thêm chính là tổng khối lượng Ag và Cu nên có hệ:
![]()
Khối lượng kim loại bám ở catot lần lượt là: 0,02.2.108 = 4,32 (g) và 0,01.64 = 0,64 (g).
→ Đáp án A
Khí thu được chính là Clo với số mol bằng: 5,6/22,4 = 0,25 (mol)
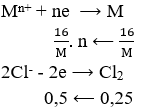
Theo bảo toàn e ta có: (16/M). n = 0,5 ⇒ M = 32n. Chỉ có n = 2, M = 64 thoả mãn. M là Cu.
→ Đáp án C
Dung dịch chứa một chất tan có pH = 13, tức là có tính kiềm.
Theo định luật bảo toàn nguyên tố đối với K thì:
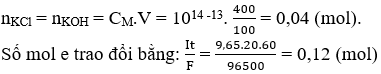
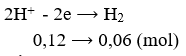
Số mol H2 do KCl sinh ra bằng: 0,04:2 = 0,02 (mol)
⇒ Số mol H2 do HCl sinh ra bằng: 0,06 - 0,02 = 0,04 (mol)
⇒ nHCl = 0,04.2 = 0,08 (mol).
Nồng độ mol/lit của HCl và KCl trong dung dịch ban đầu lần lượt bằng:
CM (HCl) = 0,08: (400/1000) = 0,2 M và CM (KCl) = 0,04: (400/1000) = 0,1 M
→ Đáp án C
Dung dịch sau có màu xanh nhạt nghĩa là vẫn còn ít ion đồng → H+ chưa bị điện phân.
Gọi số mol Cu2+ điện phân là a (mol) còn số mol O2 tạo ra ở anot là b (mol).
Bảo toàn e suy ra: a = 2b
Khối lượng dung dịch giảm gồm khối lượng Cu và khối lượng khí oxi sinh ra nên:
64a + 32b = 0,64
Từ hai phương trình trên suy ra: b = 0,004 (mol); a =0,008 (mol).
nH+ lúc sau = nH+ ban đầu + nH+ tạo ra = 0,01 + 0,016 = 0,026 (mol)
⇒ CM = 0,0026:(100/1000) = 0,26M
→ Đáp án D
Tại catot: Cu2+: a mol; Na+: b mol;
Cu2+ (a) + 2e (2a) → Cu
Hết Cu2+: 2H2O + 2e → 2OH- + H2
Tại anot: Cl-: b mol; SO2−4: a mol; H2O
2Cl- (b) → Cl2 + 2e (b)
Hết Cl-: 2H2O − 4e → 4H+ + O2
Vì dung dịch sau điện phân làm phenolphtalein chuyển sang màu hồng chứng tỏ ở catot Cu2+ hết trước Cl- ở anot, còn ở anot Cl- vẫn điện phân ⇒ 2a < b
→ Đáp án A
Do hai bình mắc nối tiếp điện tích qua chúng không đổi, dẫn tới số mol e trao đổi của chúng bằng nhau:
![]()
→ Đáp án B
Ta có:
![]()
![]()
Ta có ![]()
Thứ tự điện phân tại catot và anot là:
Tại catot:
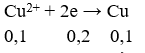
⇒ Cu2+ chưa bị điện phân hết.
⇒ mkim loại ở catot = 0,1.64 = 6,4 (gam)
Tại anot:
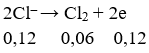
⇒ ne (do Cl- nhường) = 0,12 < 0,2 mol
⇒ tại anot Cl- đã bị điện phân hết và đến nước bị điện phân.
Ta có: ne (do H2O nhường) = 0,2 - 0,12 = 0,08 (mol)
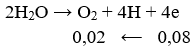
Vkhí thoát ra ở anot = (0,06 + 0,02).22,4 = 1,792 (lít).
→ Đáp án A
Theo định luật II của Pha - ra - đây thì khối lượng Cu sinh ra ở catot là:
![]()
→ Đáp án A
nKCl = 0,1 mol, nCu(NO3)2 = 0,15 mol
![]()
mdung dịch giảm = 0,05.2 + 0,05 .71 = 3.65 g < 10,75 g
⇒ Cu(NO3)2 tiếp tục bị điện phân:
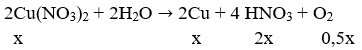
mdung dịch giảm = 10,75 - 3.65 = 7,1 = 64.x + 32.0,5x ⇒ x = 0,08875 (mol)
Nhận thấy: nHNO3 = 2x = 0,1775 mol, nKOH = 0,1 mol, nCu(NO3)2 dư = 0,06125 (mol).
→ Đáp án A
Ta tính được: nKCl = 0,4 mol, nCu(NO3)2 = 0,1 mol
Coi hỗn hợp ban đầu gồm 0,1 mol CuCl2, 0,2 mol KCl và 0,2 mol KNO3.
Điện phân: ![]()
⇒ mgiảm = 0,1.64 + 0,1.71 = 13,5 (g)
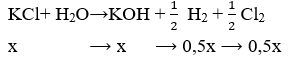
⇒ 0,5x.2 + 0,5x.71 = 17,15 - 13,5 ⇒ x = 0,1 mol
Vậy sau phản ứng có 0,1 mol KCl, 0,1 mol KOH, 0,2 mol KNO3
⇒ sau pư có HNO3, Cu(NO3)2 dư, KNO3.
Nồng độ mol lớn nhất của các chất sau điện phân chính là nồng độ của KNO3, bằng: 0,2:(400/1000) = 0,5 (M).
→ Đáp án D
catot(-) ← M(NO3)2 (dung dịch); NaNO3(dung dịch) → anot(+)
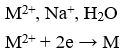
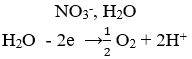
Phương trình điện phân:
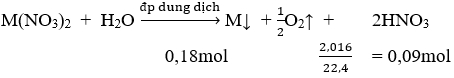
⇒ M = 11,52/0,18 = 64 đ.v.c ⇒ M là Cu
Theo định luật Faraday mCu = (64/2). [(I.2895)/96500] = 11,52 ⇒ I = 12A
Điện phân hết 0,18 mol Cu2+ tạo ra 0,18 mol Cu cần t1 = 2895s
Vậy điện phân hết 0,4 mol Cu2+ tạo ra 0,4 mol Cu cần t2 = (0,4.2895)/0,18 = 6433
Vậy chỉ có phát biểu đầu tiên đúng.
→ Đáp án B
Ta có: nZn = 13/65 = 0,2 mol và nN2 = 0,448/22,4 = 0,02 mol
ne nhường = 2.nZn = 0,4 mol > ne nhận = 10.nN2 = 0,2 mol → phản ứng tạo thành NH4NO3.
nNH4NO3 = (0,4 - 0,2)/8 = 0,025 mol (vì khi tạo thành NH4N+O3: N + 8-3e → N)
Khối lượng muối trong dung dịch X là: 180.0,2 + 80.0,025 = 39,80 gam
Lưu ý: Đề bài không nói thu được khí X duy nhất nên có thể có muối NH4NO3 tạo thành.
→ Đáp án B
Ta có: ![]()
![]()
Ta có ![]()
Thứ tự điện phân tại catot và anot là:
Tại catot: 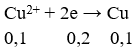
⇒ Cu2+ chưa bị điện phân hết.
⇒ mkim loại ở catot = 0,1.64 = 6,4 (gam)
Tại anot: 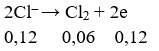
⇒ ne (do Cl- nhường) = 0,12 < 0,2 mol
⇒ tại anot Cl- đã bị điện phân hết và đến nước bị điện phân.
Ta có: ne (do H2O nhường) = 0,2 - 0,12 = 0,08 (mol)
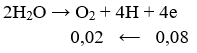
Vkhí thoát ra ở anot = (0,06 + 0,02).22,4 = 1,792 (lít).
→ Đáp án A
Khi cho dung dịch FeSO4 vào trong hỗn hợp Zn và HCl thì xảy ra thêm phản ứng
Zn + Fe2+ → Fe + Zn2+
Phản ứng này tạo ra lớp sắt bám trên bề mặt kẽm làm xảy ra hiện tượng ăn mòn điện hóa và vì vậy khiến kẽm bị ăn mòn mạnh hơn.
→ Đáp án C
Trong quá trình điện phân xảy ra sự ăn mòn Cu ở anot và sự tái tạo Cu ở catot với tốc độ bằng nhau nên nồng độ Cu2+ trong dung dịch không đổi.
→ Đáp án A
Áp dung ĐLBT khối lượng:
nCO2 = nNO = x mol
moxit + mCO = mchất rắn + mCO2
28x - 44x = 11,2 - 16 ⇒ x = 0,3.
Vậy VCO = 0,3.22,4 = 6,72 lit
→ Đáp án B
Gọi công thức của oxit kim loại là M2On.
Ta có:
M2On → M2(SO4)n
O → SO42-
1 mol → mtăng = 96 -16 = 80 gam
x mol → mtăng = 80x = 50 - 20 = 30 gam
→ x = nO/oxit = 30/80 = 0,375 mol
Khi khử oxit bằng CO ta có: nO/oxit = nCO = 0,375 mol
→ VCO = 0,375.22,4 = 8,4 lit
→ Đáp án D
Ta có: nO/oxit = nH2 = 1,344 : 22,4 = 0,06 mol
→ mO/oxit = 0,06.16 = 0,96 gam
→ mM = moxit - mO/oxit = 3,48 - 0,96 = 2,52 gam
Gọi hóa trị của M là n.
PTPƯ: 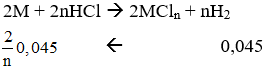
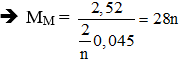
| n | 1 | 2 | 3 |
| M | 28 | 56 | 84 |
| Loại | Fe (TM) | Loại |
Vậy M là Fe.
→ nFe = 2,52 : 56 = 0,045
![]()
Vậy oxit Fe là Fe3O4.
→ Đáp án A
Do H2 chỉ khử được Fe2O3 thành Fe nên B gồm Fe và Al2O3, chỉ có Fe tạo H2.
Ta có nFe = nH2 = 2,24/22,4 = 0,1 (mol)
⇒ nFe2O3 = 0,05 (mol) ⇒ mFe2O3 = 0,05. 160 = 8 (g).
⇒%m Fe2O3 = (8/14,2).100% = 56,34 (%).
⇒ %mAl2O3 = 100% - 56,34 = 43,66%
→ Đáp án D
Ta có: mO = 0,32 (g) → nO = 0,32/16 = 0,02 (mol) nên số mol của hỗn hợp CO, H2 cũng bằng 0,02 (mol)
⇒ V = 0,02. 22,4 = 0,448 (l).
Theo định luật bảo toàn khối lượng: m = 16,8 - 0,02.16 = 16,48 (g).
→ Đáp án D
nCaCO3 = 2/100 = 0,02 mol; nFe = 0,84/56 = 0,015 mol
Phản ứng: 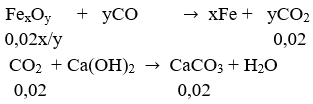
Ta có nFe = 0,02x : y = 0,015 ⇒ 0,015 : 0,02 = 3 : 4
Vậy CTPT của oxit là Fe3O4
→ Đáp án C
Gọi CTTB của 2 kim loại kiềm hóa trị I là M.
Đặt số mol của Ba và M lần lượt là a và b mol.
Ta có: mBa + mM = 46 → 137.a + M.b = 46 → M = (46 - 137a)/b (∗)
PTPU: 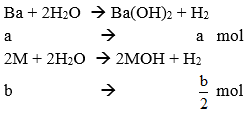
![]()
Thế (∗∗) vào (∗) ta được: ![]()
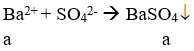
Theo giả thiết ta có: 0,18 < a < 0,21
→ 29,7 < M < 33,3
→ A và B là Na và K.
→ Đáp án B
nAlCl3 = 1,5.0,2 = 0,3 mol;
![]()
Thấy nAl(OH)3 < nAlCl3 → Để lượng dd NaOH dùng tối đa thì kết tủa tạo ra tối đa, sau đó bị tan mất một phần.
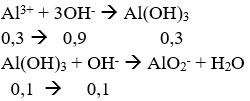
Vì nAl(OH)3 = 0,2 mol nên có 0,1 mol Al(OH)3 bị tan mất.
→ nNaOH = nOH- = 0,9 + 0,1 = 1 mol
→ VNaOH max = 1 : 0,5 = 2 lit.
→ Đáp án C
nAl(OH)3 = 7,8/78 = 0,1 mol
![]()
Để NaOH phản ứng nhiều nhất thu được 0,1 mol kết tủa Al(OH)3 thì Al2(SO4)3 phải phản ứng hết tạo kết tủa tối đa, sau đó kết tủa tan một phần sao cho lượng kết tủa cuối cùng thu được bằng 0,1 mol
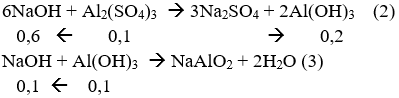
Từ (1), (2) và (3) ta có:
nNaOH pư = 0,6 + 0,1 + 0,2 = 0,9 mol
→ Vdd NaOH = 0,9 : 2 = 0,45 M
→ Đáp án A