



Preview text:
Amin bậc 2 là gì? Amin nào sau đây là amin bậc 2?
Amin bậc 2 là gì? Amin nào là amin bậc 2? Cùng tham khảo bài viết dưới đây của Luật Minh Khuê để
biết thêm chi tiết nhé.
Mục lục bài viết
Việc tìm hiểu vè amin bậc 2 cũng như các tính chất vật lí, hoá học của amin bậc 2 để dễ dàng phân biệt
được với các amin khác.
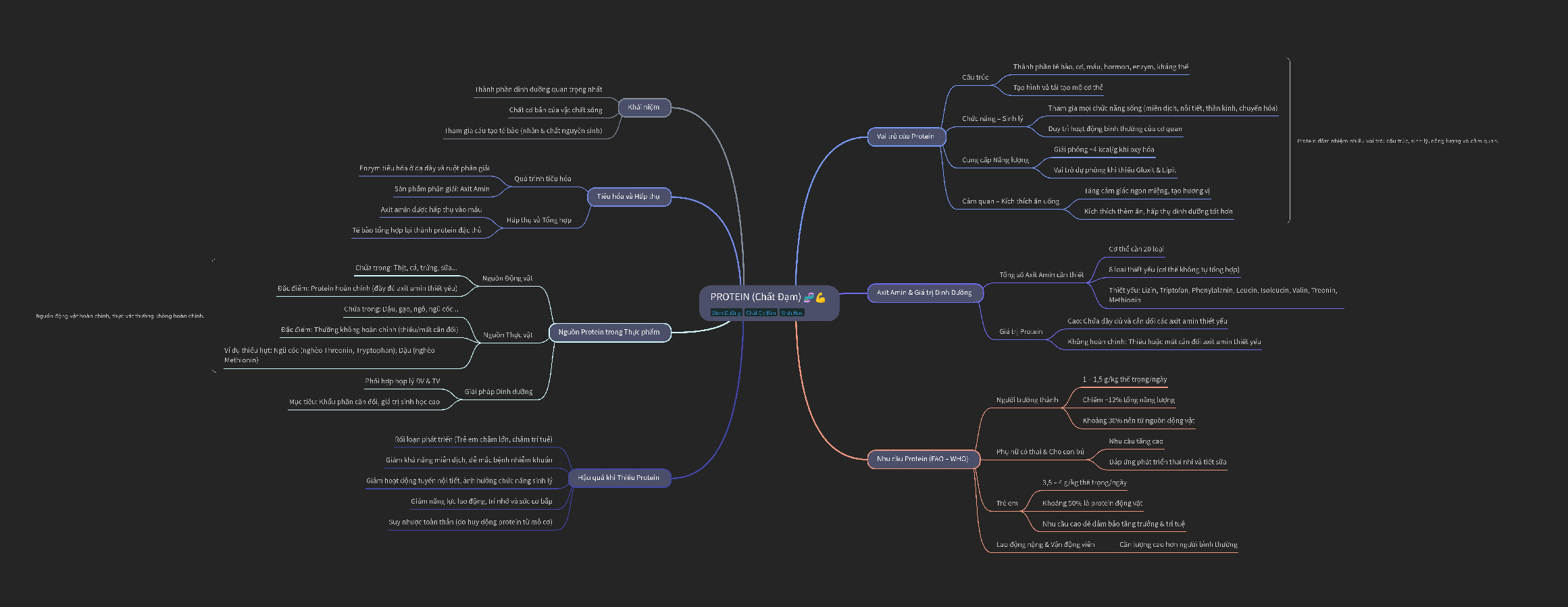
1. Amin bậc hai là gì?
Amin bậc 2 là các amin có hai nhóm thế ankin hoặc aryl được liên kết với nguyên tử Nitơ trong phân
tử các amin bậc 2 cũng được gọi là amin thơm do nhóm thế arin thường được tìm thấy trong các hợp
chất hữu cơ thơm như benzen và các dẫn xuất của nó. 2. Các loại Amin
Có hai cách phân loại amin đó là theo gốc Hidrocacbon và theo bậc amin.
- Theo gốc Hidrocacbon người ta phân loại thành amin thơm, amin béo và amin dị vòng.
Một số amin thơm như: C6H5NH2 CH3C6H4NH2...
Amin béo: C2H5NH2, CH3C6H4NH2
- Theo bậc amin: bậc amin là số nguyên tử H trong phân tử NH3 bị thay thế bởi gốc Hidrocacbon. Theo
bậc amin thì các amin gồm: Amin bậc 1, Amin bậc 2 và amin bậc 3
+ Amin bậc 1: R- NH2 (dãy béo tác dụng với axit nito tạo thành alcohol tương ứng và giải phóng khí N2)
Ví dụ: CH3 - CH2 - CH2 - NH2
+ Amin bậc 2: R - NH - R': dãy béo cùng dãy thơn tác dụng với axit nito sinh ra nitrisamin là những chất
màu vàng, để phân biệt được amin bậc hai và amin bậc 1.
Ví dụ: CH3 - CH2 - NH - CH3
+ Amin bậc 3: RN(R'') R' dãy béo không tác dụng với axit nito hoặc chỉ tạo thành muối không bền dễ bị
thuỷ phân. Amin bậc 3 dãy thơm tác dụng với axit nitro cho sản phẩm thế ở nhân thơm Ví dụ: (CH3)3N
3. Công thức của Amin
Công thức tổng quát: CxHyNz
+ Amin đơn chức: CxHyN
+ Amin đơn chức no: CnH2n + 1NH2 hay CnH2n + 3N
+ Amin đa chức no: CnH2n + 2 - u(NH2)u hay CnH2n + 2 uNu
4. Cách gọi tên amin
- Cách gọi tên theo danh pháp gốc - chức
Tên gốc chức = gốc Hidrcacbon + amin
Ví dụ: C2H5- NH2 đọc là Etylamin
CH3NH2 đọc là Metylamin
- Cách gọi tên theo danh pháp thay thế:
Tên thay thế = tên Hidrocacbon + vị trí = amin
Ví dụ: CH3NH2 đọc là metanamin
C2H5- NH2 đọc là Etanamin
Một số tên gọi đặc biệt của một số amin Hợp chất tên gốc - chức tên thay thế tên thường CH3NH2 metylamin metanamin C2H5NH2 etylamin etanamin CH3CH2CH2NH2 propylamin propan - 1- amin CH3CH(NH2)CH3 isopropylamin propan - 2 - amin H2N(CH2)6NH2 hexametyllenđiamin hexan - 1,6 - điamin C6H5NH2 phenylamin Benzenamin anilin C6H5NHCH3 metylphenylamin N - Metybenzenamin N - Metylanilin C2H5NHCH3 etylmetylamin N - Metyletanamin C2H5NHCH3
5. Tính chất vật lí của amin bậc 2
Các tính chất vật lý của amin bậc 2 phụ thuộc vào cấu trúc phân tử và đặc tính của nhóm thế alkyl hoặc aryl.
- Độ nóng chảy và độ sôi: các amin bậc 2 có thể là chất rắ, lỏng hoặc khí tuỳ thuộc vào cấu trúc và số
lượng nhóm thế alkyl hoặc aryl trong phân tử. Độ nóng chảy và độ sôi của các amin bậc 2 thường cao
hơn so với các amin bậc 1, do có sự tương tác giữa các nhóm thế trong phân tử. Ví dụ: độ sôi của
etylamin là 17,3 độ trong khi butylamin là 77,2 độ
- Độ hoà tan: Các amin bậc 2 có khả năng hoà tan trong nước và các dung môi polar khác. Tuy nhiên,
độ hoà tan có thể khác nhau tuỳ thuộc vào cấu trúc phân tử và đặc tính của nhóm thế alkyl hoặc aryl.
Những amin bậc 2 có nhóm thế alkyl dài có độ hoà tan thấp hơn so với những amin bậc 2 có nhóm thế alkyl ngắn.
- Độc tín: một số amin bậc 2 có thể gây độc tính đối với con người và động vật nếu được tiếp xúc hoặc
uống phải một lượng lớn. Ví dụ: methylamin có thể gây ra kích ứng da và đau đầu.
- Màu sắc và mùi vị: Nhiều amin bậc 2 có màu trắng và không có mùi hoặc có mùi hôi như những gì ta
có thể thấy trong các chất tẩy rửa hoặc trong một số loại thuốc.
6. Tính chất hoá học của amin bậc 2
Amin bậc 2 có nhiều tính chất hoá học quan trọng bao gồm:
- Tính bazo: amin bậc 2 có tính bazo do có khả năng nhận proton để tạo thành ion amonium dương.
Tính bazo của amin bậc 2 tăng khi số lượng nhóm amin tăng lên.
- Phản ứng với axit: amin bậc 2 phản ứng với axit để tạo ra muối amonium.
Ví dụ: ethylamine phản ứng với axit hydrocloric để tạo ra muối ethylammonium clorua
- Phản ứng với axit carboxylic: amin bậc 2 phản ứng với axit carboxylic để tạo ra amin và nước
Ví dụ: athylamine phản ứng với axit axetic để tạo ra etyl axetat và nước
- Phản ứng với chất oxi hoá: amin bậc 2 phản ứng với chất oxi hoá để tạo ra nito hoặc oxit nito
Ví dụ: ethylamine phản ứng với chất oxi hoá như brom hoặc axit nitric để tạo ra nito hoặc oxit nito
- Phản ứng với halogen: amin bậc 2 phản ứng với halogen để tạo ra sản phẩm halogennua hữu cơ
Ví dụ: ethylamine phản ứng với clo để tạo ra 2 - chloroethylamine
- Phản ứng với aldehyde và ketone: amin bậc 2 phản ứng với aldehyde và ketone để tạo ra imine hoặc enamine.
Ví dụ: Ethylamine phản ứng với butyraldehyde để tạo ra N - ethylidenebutan - 1 - amine
7. Ứng dụng của amin bậc 2 trong đời sống
Những tính chất hoá học của amin bậc 2 có thể được sử dụng để tổng hợp chất hữu cơ phức tạp, bao
gồm các amini axit, protein, alkaloid và thuốc.
- Làm chất xúc tác: amin bậc 2 được sử dụng như chất xúc tác trong các phản ứng hoá học
- Tổng hợp thuốc: rất nhiều loại thuốc được tổng hợp từ amin bậc 2 bao gồm thuốc kháng sinh, chất
ức chế men, chất kháng sinh, chất chống trầm cảm và chất giảm đau.
- Sản xuất chất tẩy rửa và chất làm mềm da: amin bậc 2 được sử dụng làm chất hoạt động bề mặt
trong sản xuất chất tẩy rửa và chất làm mềm da
- Sản xuất nhựa và sợi: amin bậc 2 được sử dụng trong quá trình sản xuất nhựa và sợi.
- Làm chất phụ gia, thực phẩm: amin bậc 2 còn được sử dụng như là chất phụ gia thực phẩm, đặc biệt
là chất phụ gia thực phẩm, trong sản xuất các sản phẩm chứa protein như thịt, cá và đậu phụ.
8. Bài tập vận dụng
Câu 1: Công thức của amin bậc 2 là A. CH3CH2NH2 B. CH3CH(NH2)CH3 C. CH3NHCH2CH3 D. (CH3)2NC2H5 Đáp án C
Câu 2: Thuỷ phân hoàn toàn 1 mol pentapeptit X thu được 2 mol glyxin (gly) 1 mol alanin, 1 mol valin
và 1 mol phenylalanin. Thuỷ phân không hoàn toàn X thu được đipeptit Val- phe và tripeptit Gly - Ala -
Val nhưng không thu được đipeptit Gly - Gly. Chất X có công thức là;
A. Val - phe - gly - ala- gly
B. gly - phe - gly - ala - val
C. gly - ala - val - val - phe
D. gly - ala - val - phe - gly Đáp án D
Câu 3: Thuỷ phân không hoàn toàn a gam tetrapeptit Gly - ala - gly - val trong môi trường axit, thu
được 0.2 mol gly - ala, 0.3 mol gly - val, 0.3 mol ala và m gam hồn hợp 2 amino axit gly và val. Giá trị của m là? A. 57.2 B. 82.1 C. 60.9 D. 69 Đáp án C
Câu 4: Hợp chất nào dưới đây là este của amino axit A. H2NCH2COONH3CH3 B. H2NCH2COOH C. 2NCH2CONHCH2COOH D. H2NCH2COOH Đáp án D
Câu 5: Cho 0.18 mol hỗn hợp X gồm glyxin và lysin phản ứng vừa đủ với 240 ml dung dịch HCl 1M. Nếu
lấy 26,64 gam X trên phản ứng với 300 ml dung dịch KOH 1M, cô cạn dung dịch sau phản ứng, thu
được m gam muối khan. Giá trị của m là? A. 32.58 g B. 38.04 g C. 38.58 g D. 36.90 g Đáp án: D
Câu 6: Hỗ hợp E chứa ba peptit mạch hở được tạo bởi glyxin, alanin và valin, trong đó có hai peptit có
cùng số nguyên tử cacbon, tổng số nguyên tử oxi của ba peptit là 10. Thuỷ phân hoàn toàn 23,06 gam
E bằng 400 ml dung dịch NaOH 1M, cô cạn dung dịch sau phản ứng, lấy phần rắn đem đốt cháy cần
dùng 0.87 mol O2, thu được Na2CO3 và 1,50 mol hỗn hợp T gồm CO2, H2O và N2. Phần trăm khối
lượng của peptit có khối lượng phân tử nhỏ nhất là: A. 45,79% B. 57,24% C. 65,05% D. 56,98% Đáp án: B
Trên đây là một số thông tin về amin bậc 2 Luật Minh Khuê xin gửi tới bạn đọc. Mong rằng bài viết
trên là những tài liệu tham khảo hữu ích dành cho bạn. Chúc các bạn học tốt.