









Preview text:
Chương 2: NITROGEN VÀ SULFUR
Tiết 11+12: AMMONIA VÀ MỘT SỐ HỢP CHẤT AMMONIUM
I. MỤC TIÊU
1. Yêu cầu cần đạt
- Mô tả được công thức Lewis và hình học của phân tử ammonia. Viết được CTPT, CTCT của NH3
- Dựa vào đặc điểm cấu tạo của phân tử ammonia, giải thích được tính chất vật lí (tính tan), tính chất hoá học (tính base, tính khử). Viết được phương trình hoá học minh hoạ.
- Viết được phương trình hoá học minh hoạ NH3 có tính base, tính khử.
- Vận dụng được kiến thức về cân bằng hoá học, tốc độ phản ứng cho phản ứng tổng hợp ammonia từ nitơ và hydrogen.
- Trình bày được tính chất cơ bản của muối ammonium (dễ tan và phân li, chuyển hoá thành ammonia trong kiềm, dễ bị nhiệt phân) và nhận biết được ion ammonium trong dung dịch.
- Trình bày được ứng dụng của ammonia (chất làm lạnh; sản xuất phân bón như: đạm, ammophos; sản xuất nitric acid; làm dung môi...); của ammonium nitrate và một số muối ammonium tan như: phân đạm, phân ammophos...
- Thực hiện được (hoặc quan sát video) thí nghiệm nhận biết được ion ammonium trong phân đạm chứa ion ammonium.
2. Năng lực
a. Năng lực chung
- Tự chủ và tự học: chủ động, tích cực tìm hiểu về bộ môn hóa học, tự đề xuất cách thực hiện thí nghiệm nhận biết ammonium trong mẫu phân đạm chứa ammonium
- Giao tiếp và hợp tác: sử dụng ngôn ngữ khoa học để mô tả được công thức Lewis và hình học của phân tử ammonia, giải thích được tính chất vật lí, tính chất hoá học của ammonia, vận dụng được kiến thức về cân bằng hoá học, tốc độ phản ứng cho phản ứng tổng hợp ammonia từ nitơ và hydrogen, trình bày được tính chất cơ bản của muối ammonium và nhận biết được ion ammonium trong dung dịch, trình bày được ứng dụng của ammonia, của ammonium nitrate và một số muối ammonium tan như: phân đạm, phân ammophos; hoạt động nhóm cách hiệu quả theo đúng yêu cầu của giáo viên, đảm bảo các thành viên trong nhóm đều được tham gia và trình bày báo cáo.
- Giải quyết vấn đề và sáng tạo: thảo luận với các thành viên trong nhóm nhằm giải quyết các vấn đề trong bài học hoàn thành nhiệm vụ học tập.
b. Năng lực hóa học
- Nhận thức hóa học:
+ Mô tả được công thức Lewis và hình học của phân tử ammonia
+ Trình bày được các nội dung về tính chất, ứng dụng của ammonia và muối ammonium.
+ Giải thích được tính chất vật lí, tính chất hóa học của ammonia. Viết được PTHH minh họa.
- Tìm hiểu thế giới tự nhiên dưới góc độ hóa học:
+ Thực hiện được (hoặc quan sát video) thí nghiệm nhận biết được ion ammonium trong phân đạm chứa ion ammonium.
+ Thực hiện được thí nghiệm về tính tan và tính base của ammonia.
- Vận dụng kiến thức, kĩ năng đã học:
+Vận dụng được kiến thức về cân bằng hoá học, tốc độ phản ứng, enthalpy cho phản ứng tổng hợp ammonia từ nitrogen và hydrogen trong quá trình Haber.
+Vận dụng được kiến thức đã học về muối ammonium để giải thích ứng dụng của bột khai (một loại bột nở dùng để làm bánh).
3. Phẩm chất
- Chăm chỉ, tham gia tích cực hoạt động nhóm phù hợp với khả năng của bản thân.
- Khách quan, trung thực trong quá trình làm thí nghiệm về tính chất của ammonia và thí nghiệm nhận biết ion ammonium: Viết và trình bày đúng với kết quả thực nghiệm.
- Có niềm say mê hứng thú với việc khám phá và học tập hóa học.
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
1. Giáo viên:
- Hình ảnh về cấu tạo phân tử, công thức Lewis, mô hình phân tử ammonia, hình ảnh một số muối ammonium, một số loại phân bón ammonium
+ Thí nghiệm tính tan của ammonia(1 bộ/lớp):
Ống vuốt nhọn (1 cái); chậu thủy tinh (1 cái); bình đầy khí NH3 (1 bình); dung dịch phenolphthalein.
+ Thí nghiệm tính base của ammonia (1 bộ/nhóm):
Kẹp gỗ (2 cái); quỳ tím (1 cuộn); ống nghiệm (6 cái); chậu thủy tinh (1 cái); dung dịch NH3 loãng; dung dịch AlCl3; bình tia chứa nước cất (1 bình).
+ Thí nghiệm nhận biết ion ammonium (1 bộ/1 nhóm):
Kẹp gỗ (1 cái); ống nghiệm (2 cái); đèn cồn (1 cái); diêm (1 hộp) hay bật lửa; mẫu phân đạm ammonium; dung dịch Ba(OH)2; dung dịch NaOH; nước cất; quỳ tím (1 hộp).
- Phiếu học tập
- Kế hoạch bài dạy, phiếu học tập.
- Bài giảng powerpoint và các thiết bị hỗ trợ trình chiếu
2. Học sinh
Sách giáo khoa, đọc trước bài ở nhà.
II. TIẾN TRÌNH DẠY HỌC
1. Hoạt động 1: Khởi động
a. Mục tiêu
- Tạo hứng thú và kích thích sự tò mò của học sinh vào chủ đề học tập. Học sinh tiếp nhận kiến thức chủ động, tích cực, hiệu quả.
b. Nội dung: HS quan sát đoạn phim phóng sự trả lời câu hỏi của GV
CÂU HỎI KHỞI ĐỘNG Câu 1: Qua phóng sự trên em rút ra được điều gì ? |
c. Sản phẩm: Các câu trả lời của HS.
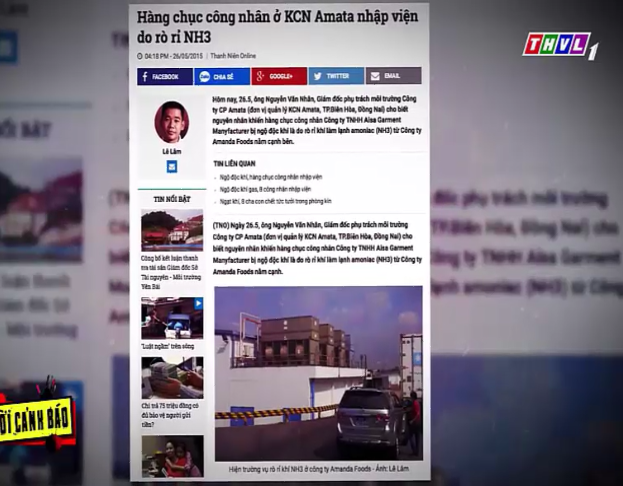
TRẢ LỜI CÂU HỎI KHỞI ĐỘNG Câu 1: Amonia là chất khí rất độc, nếu bị rò rỉ ra môi trường bên ngoài sẽ để lại hệ quả khôn lường Tuy nhiên ammonia lại có nhiều ứng dụng trong sản xuất và đời sống thực tiến, nên nguy cơ xảy ra sự cố là rất cao. |
d. Tổ chức thực hiện
HOẠT ĐỘNG CỦA GIÁO VIÊN | HOẠT ĐỘNG CỦA HỌC SINH |
Bước 1: Chuyển giao nhiệm vụ học tập Yêu cầu học sinh quan sát hình ảnh trong đời sống và trong lớp học hoạt động cá nhân trả lời câu hỏi: Hầu hết mọi thứ xung quanh chúng ta đều liên quan đến hóa học. Em hãy lấy một số ví dụ để minh họa cho điều này?
|
|
Bước 2: Thực hiện nhiệm vụ Theo dõi và hỗ trợ cho nhóm HS |
|
Bước 3: Báo cáo kết quả và thảo luận Yêu cầu đại diện một học sinh báo cáo kết quả |
|
Bước 4: Kết luận và nhận định GV đưa ra vấn đề vào bài: Amonia là chất khí rất độc, nếu bị rò rỉ ra môi trường bên ngoài sẽ để lại hệ quả khôn lường Tuy nhiên ammonia lại có nhiều ứng dụng trong sản xuất và đời sống thực tiến, nên nguy cơ xảy ra sự cố là rất cao. Vậy nó tính chất như thế nào có vai trò ra sao trong đời sống và sản xuất? |
2. Hoạt động 2: Hình thành kiến thức mới
2.1 Hoạt động tìm hiểu cấu tạo phân tử của ammonia
a. Mục tiêu
Trình bày và giải thích được công thức Lewis, cấu trúc hình học, tính chất (vật lí, hoá học), ứng dụng của ammonia và viết được các PTHH minh họa cho các tính chất hóa học; vận dụng được kiến thức về cân bằng hoá học, tốc độ phản ứng, enthalpy cho phản ứng tổng hợp ammonia trong quá trình Haber.
b. Nội dung
Từ đặc điểm cấu tạo phân tử, HS dự đoán tính chất của ammonia. Nhóm HS thực hiện các thí nghiệm về tính base, xem GV biểu diễn thí nghiệm về tính tan và xem video thí nghiệm về tính khử của ammonia để kiểm chứng dự đoán và đi đến kết luận về tính chất của ammonia. HS tham khảo SGK để trình bày ứng dụng và điều chế của ammonia.
c) Sản phẩm:
(1) Bài trình bày kết quả thực hiện các thí nghiệm về tính tan, tính base của ammonia; Mô tả và giải thích một số tính chất vật lí, tính chất hóa học (tính base yếu, tính khử mạnh) của ammonia kèm theo PTHH minh họa tính chất hóa học của ammonia.
(2) Nội dung trình bày về tính chất cơ bản của muối ammonium (dễ tan và phân li, tác dụng với dung dịch kiềm, dễ bị nhiệt phân) và các PTHH minh họa cho các tính chất này; kết quả và kết luận về thí nghiệm nhận biết ion ammonium.
d) Tổ chức thực hiện:
Hoạt động của GV | Hoạt động của HS |
2.1. Tìm hiểu cấu tạo của ammonia: | |
- Giới thiệu công thức và mô hình phân tử của ammonia (NH3), yêu cầu HS thảo luận theo cặp để viết công thức electron, công thức cấu tạo và mô tả đặc điểm liên kết của phân tử ammonia. - Gọi đại diện một cặp lên bảng trình bày câu trả lời, một số cặp khác nhận xét, bổ sung. GV kết luận công thức đúng của ammonia:
| - Thảo luận theo cặp. - Trình bày câu trả lời hoặc nhận xét, bổ sung.
|
Kiến thức trọng tâm - Đặc điểm cấu tạo: nguyên tử N liên kết với 3 nguyên tử H bằng 3 liên kết cộng hóa trị có cực, ở nguyên tử N còn một cặp electron chưa liên kết; Nguyên tử N có số oxi hóa là -3 (số oxi hóa thấp nhất của N); phân tử NH3 phân cực. | |
2.2 Hoạt động tìm hiểu tính chất vật lí, tính chất hóa học của ammonia
a. Mục tiêu
- Trình bày và giải thích được tính tính tan của muối ammonia; thực hiện được thí nghiệm về tính tan của ammonia.
- Trình bày được tính chất cơ bản, ứng dụng của ammonia, muối amoni um; thực hiện được thí nghiệm về tính base của ammonia và
b. Nội dung:
Từ đặc điểm cấu tạo phân tử, HS dự đoán tính chất của ammonia. Nhóm HS thực hiện các thí nghiệm về tính base, xem GV biểu diễn thí nghiệm về tính tan và xem video thí nghiệm về tính khử của ammonia để kiểm chứng dự đoán và đi đến kết luận về tính chất của ammonia. HS tham khảo SGK để trình bày ứng dụng và điều chế của ammonia.
(2) Nhóm HS tìm hiểu về tính chất cơ bản của muối ammonium và thực hiện thí nghiệm nhận biết ion ammonium theo câu hỏi định hướng của giáo viên.
c) Sản phẩm:
(1) Bài trình bày kết quả thực hiện các thí nghiệm về tính tan, tính base của ammonia; Mô tả và giải thích một số tính chất vật lí, tính chất hóa học (tính base yếu, tính khử mạnh) của ammonia kèm theo PTHH minh họa tính chất hóa học của ammonia.
(2) Nội dung trình bày về tính chất cơ bản của muối ammonium (dễ tan và phân li, tác dụng với dung dịch kiềm, dễ bị nhiệt phân) và các PTHH minh họa cho các tính chất này; kết quả và kết luận về thí nghiệm nhận biết ion ammonium.
d) Tổ chức thực hiện:
Hoạt động của GV | Hoạt động của HS |
2.1. Tìm hiểu tính tan ammonia | |
Chia lớp thành các nhóm (khoảng 5 - 6 HS/nhóm). 1. Dựa vào đặc điểm cấu tạo phân tử ammonia, dự đoán tính tan và tính chất vật lí của ammonia. Giải thích. 2. Thực hiện bước 1 trong phiếu học tập (phụ lục). Kiểm tra để đảm bảo HS đã hiểu rõ nhiệm vụ thông qua các câu hỏi phụ. Cho HS quan sát lọ đựng khí NH3, sau đó biểu diễn thí nghiệm tính tan của ammonia. | 1. Kết hợp làm việc cá nhân và thảo luận theo nhóm lần lượt đưa ra các dự đoán theo gợi ý của GV. 2. Thảo luận nhóm về cách tiến hành TN, ghi lại kết quả bước 1 vào phiếu chung (giấy A3). |
Kiến thức trọng tâm Tính chất vật lí: Ammonia là chất khí không màu, mùi khai, xốc, nhẹ hơn không khí, tan nhiều trong nước, tạo thành dung dịch có tính kiềm. | |
2.2. Tìm hiểu tính chất hóa học của ammonia | |
Yêu cầu HS thảo luận và thực hiện các nội dung sau: 3. Các nhóm thực hiện thí nghiệm theo phiếu hướng dẫn (phụ lục) và dụng cụ, hóa chất đã chuẩn bị sẵn. 4. GV chiếu video thí nghiệm về tính khử của ammonia. HS thảo luận và hoàn thiện kết quả theo hướng dẫn của phiếu học tập. - Quan sát các nhóm làm việc, ghi lại những thiếu sót trong quá trình làm việc của các nhóm. - Cung cấp bảng mô tả hiện tượng, giải thích, PTHH và kết luận để HS tự đánh giá. Nhận xét kết quả của các nhóm, giải thích thêm (nếu cần). Kết luận về các tính chất của ammonia:
| 3. Xem GV biểu diễn thí nghiệm, thực hiện các thí nghiệm về tính base của ammonia, trình bày kết quả. 4. Xem video thí nghiệm tính khử của ammonia. Ghi hiện tượng, giải thích, viết PTHH và kết luận về tính chất vào phiếu chung của nhóm. - Các nhóm nộp kết quả hoạt động của nhóm, tự đánh giá theo bảng kiểm và báo cáo kết quả tự đánh giá. - Đại diện nhóm trình bày kết quả hoạt động và kết quả đánh giá, các nhóm khác bổ sung. - Kết luận vào vở |
Kiến thức trọng tâm Tính chất hóa học: - Tính base: Tác dụng với nước tạo dung dịch base: NH3(g) + H2O(l) Tác dụng với acid tạo muối ammonium: NH3(g) + HCl(g) Tác dụng với dung dịch muối tạo hydroxide không tan: AlCl3(aq) + 3NH3(g) + 3H2O(l)
- Tính khử: 4NH3(g) + 3O2(g) C.Kh C.Oxh | |
Giao nhiệm vụ sau tiết 1: Yêu cầu HS về nhà tìm những ứng dụng của ammonia trong đời sống, trong các lĩnh vực khác để trình bày ở tiết học tiếp theo (Ghi kết quả vào vở bài tập).
TIẾT 2
2.3. Tìm hiểu về ứng dụng và điều chế amonia
a. Mục tiêu
- Trình bày được ứng dụng của ammonia (chất làm lạnh; sản xuất phân bón như: đạm, ammophos; sản xuất nitric acid; làm dung môi...); của ammonium nitrate và một số muối ammonium tan như: phân đạm, phân ammophos...
- Vận dụng được kiến thức về cân bằng hoá học, tốc độ phản ứng cho phản ứng tổng hợp ammonia từ nitơ và hydrogen.
b. Nội dung
HS hoàn thành nhiệm vụ giao vè nhà từ tiết trước, cử đại diện lên trình bày ứng dụng của ammonia
HS trả lời câu hỏi trong phiếu học tâp số 5
c. Sản phẩm
Bảng kết quả của nhóm chính xác nhất
d.Tổ chức thực hiện:
Hoạt động của GV | Hoạt động của HS | ||||||||||||
Chiếu video hoặc sử dụng tranh in sẵn về quá trình sản xuất ammonia, Yêu cầu HS thảo luận theo cặp, trả lời các câu hỏi sau:
1. Viết PTHH của phản ứng tổng hợp ammonia trong công nghiệp. Nêu đặc điểm của phản ứng tổng hợp. 2. Vận dụng nguyên lí chuyển dịch cân bằng Le Chatelier nêu các biện pháp đã sử dụng để tăng hiệu suất phản ứng. - Câu hỏi bổ sung: + Vì sao nhiệt độ sử dụng là 450 – 500oC? + Vai trò của chất xúc tác? Giới thiệu thêm về chu trình tổng hợp là khép kín: hóa lỏng và tách NH3 (do NH3 dễ hóa lỏng) còn N2 và H2 chưa phản ứng đưa trở lại tháp tổng hợp. | Trình bày kết quả hoặc nhận xét, bổ sung. - Làm việc theo cặp. 1. Phản ứng tổng hợp ammonia: N2(g) +3H2(g) 2. Các biện pháp sử dụng
- Biện pháp: hạ nhiệt độ, tăng áp suất. Tuy nhiên, nhiệt độ thấp quá thì tốc độ phản ứng xảy ra rất chậm và áp suất cao quá thì đòi hỏi thiết bị cồng kềnh, phức tạp.
| ||||||||||||
Kiến thức trọng tâm
+ Ammonia được dung để sản xuất nitric acid, các loại phân đạm. + Làm chất làm lạnh, dung môi…
+ Phản ứng tổng hợp ammonia: N2(g) + 3H2(g) + Đặc điểm: Phản ứng tỏa nhiệt và áp suất giảm. + Điều kiện tối ưu: 200 - 300 atm, 450 - 500oC, xúc tác Fe trộn Al2O3.K2O. + Biện pháp tang hiệu suất tổng hợp NH3: hạ nhiệt độ, tăng áp suất. Tuy nhiên, nhiệt độ thấp quá thì tốc độ phản ứng xảy ra rất chậm và áp suất cao quá thì đòi hỏi thiết bị cồng kềnh, phức tạp. | |||||||||||||
2.4. Tìm hiểu muối ammonium
a. Mục tiêu
- Trình bày được tính chất cơ bản, ứng dụng của muối ammonium; thực hiện được thí nghiệm về tính base của ammonia và thí nghiệm nhận biết được ion ammonium trong phân đạm chứa ion ammonium.
- Thực hiện được thí nghiệm nhận biết được ion ammonium trong phân đạm chứa ion ammonium.
b. Nội dung
Nhóm HS tìm hiểu về tính chất cơ bản của muối ammonium và thực hiện thí nghiệm nhận biết ion ammonium theo câu hỏi định hướng của GV.
c. Sản phẩm
Nội dung trình bày về tính chất cơ bản của muối ammonium (dễ tan và phân li, tác dụng với dung dịch kiềm, dễ bị nhiệt phân) và các PTHH minh họa cho các tính chất này; kết quả và kết luận về thí nghiệm nhận biết ion ammonium.
2.4. Tìm hiểu muối ammonium | |
Giới thiệu về vụ nổ ở Liban do sự phân hủy ammonium nitrate. Yêu cầu HS thảo luận theo cặp trả lời các câu hỏi sau: 1. Kể tên, công thức một số muối ammonium và nêu một số ứng dụng của muối ammonium. 2. Nhận xét về tính tan của muối ammonium. Viết phương trình điện li của muối NH4Cl. 3. Nhận xét về tính bền với nhiệt của các muối ammonium. Viết phương trình nhiệt phân của muối NH4Cl, NH4HCO3, NH4NO3. Nhận xét về sản phẩm của các phản ứng nhiệt phân. 4. Viết PTHH dạng phân tử và ion thu gọn xảy ra giữa các cặp chất sau đây (nếu có): NH4Cl(aq) + Ba(OH)2 (aq) NH4Cl(aq) + AgNO3(aq) Nhận xét, bổ sung lưu ý về sản phẩm nhiệt phân của muối ammonium phụ thuộc vào đặc điểm gốc acid.
- Nhận xét, phân tích những phương án chưa hợp lí. - Yêu cầu các nhóm tiến hành thí nghiệm theo phương án đề xuất đã được duyệt, nêu hiện tượng, viết PTHH, phương trình ion thu gọn và rút ra kết luận tổng quát về cách nhận biết ion ammonium. | - Đọc SGK và thảo luận theo cặp để trả lời các câu hỏi. - Đại diện HS viết các PTHH lên bảng và trình bày các câu trả lời còn lại trước lớp. Các HS khác quan sát, lắng nghe, nhận xét và góp ý. - Kết luận vào vở. - Các nhóm thảo luận đưa ra phương án, chọn những phương án hợp lí như: dung dịch NaOH, KOH, Ca(OH)2, Ba(OH)2. - Các nhóm tiến hành thí nghiệm, rút ra kết luận về cách nhận biết ion ammonium. |
Kiến thức trọng tâm
+ Dễ phân hủy khi đun nóng * Muối amonium tạo bởi gốc acid không có tính oxi hóa (HCl,...) → NH3 + acid Ví dụ: NH4Cl(s) NH4HCO3(s) * Muối amonium tạo bởi gốc acid có tính oxi hóa (HNO3, HNO2): NH4NO3(s) NH4NO2(s) + Tác dụng với dung dịch kiềm: (NH4)2SO4(aq) + 2NaOH(aq) → Na2SO4(aq) + 2NH3(g) + 2H2O(l) NH4+ + OH- → NH3↑ + H2O (Để điều chế NH3 trong PTN và nhận biết muối amonium). | |
3. Hoạt động 3: Luyện tập
a. Mục tiêu: Tái hiện và vận dụng những kiến thức đã học trong bài về cấu tạo phân tử, tính chất vật lí, tính chất hóa học, điều chế và ứng dụng của ammonia và muối ammonium.
b. Nội dung: Tổ chức trò chơi “Gắp thăm may mắn” (Bộ câu hỏi ở phần phụ lục).
c. Sản phẩm: Câu trả lời của các câu hỏi trong trò chơi.
d. Tổ chức thực hiện:
- GV phổ biến luật chơi: có 8 lá thăm tương ứng với 6 câu hỏi được chọn (trong đó có 2 thăm may mắn) người chơi xung phong chọn. Nếu người chơi trả lời và giải thích đúng thì được gắp thăm phần thưởng Nếu trả lời sai thì HS khác được quyền trả lời và gắp thăm chọn phần thưởng. Con số trên thăm phần thưởng là số kẹo nhận thưởng. Trong 8 lá thăm câu hỏi sẽ có 2 lá thăm may mắn, người chơi không phải trả lời câu hỏi vẫn được nhận thưởng.
- HS tham gia trò chơi, nhận xét câu trả lời các bạn.
- GV theo dõi câu trả lời của HS, trao phần thưởng và nhận xét, bổ sung những câu trả lời chưa chính xác.
4. Hoạt động 4: Vận dụng
a. Mục tiêu: Vận dụng được kiến thức đã học về phương pháp Haber để sản xuất phân bón cung cấp cho ngành trồng trọt để sản xuất nguồn thực phẩm cho khoảng một phần ba dân số thế giới.
b. Nội dung: Nhiệm vụ về nhà:
Các nhà khoa học ước tính công nghiệp sản xuất phân bón từ amoniac theo phương pháp Haber đã giúp duy trì nguồn thực phẩm cho khoảng một phần ba dân số trên Trái đất.Em hãy tìm hiểu và giải thích
c. Sản phẩm: Bài trình bày của HS được ghi vào vở.
d. Tổ chức thực hiện
- GV giao nhiệm vụ cho HS như mục Nội dung và yêu cầu nghiêm túc thực hiện nhiệm vụ ở nhà. HS nộp bài làm vào buổi học tiếp theo.
- GV chấm bài, nhận xét và có thể cho điểm.
IV. PHỤ LỤC: Hồ sơ dạy học
4.1. Phiếu học tập của hoạt động 2.2 và 2.3
4.1.1.Phiếu học tập liên quan câu hỏi cho các phần kiến thức:
Phiếu học tập số 1 Quan sát mô tả cấu tạo phân tử ammonia. Dự đoán tính tan (trong nước) và tính oxi hóa – khử của ammonia. Giải thích? |
Phiếu học tập số 2 - Nêu và giải thích hiện tương thí nghiệm. Từ đó cho biết tại sao không thu khí NH3 bằng phương pháp đẩy nước. - Tính tỉ khối NH3 so với không khí. Từ kết quả đó hãy giải thích vì sao có thể thu khí NH3 bằng phương pháp đẩy không khí (úp ngược bình) |
Phiếu học tập số 3 1. Căn cứ vào hiện tượng thí nghiệm về tính tan của NH3 trong nước và khả năng thay đổi số oxi hóa của N. Em hãy dự đoán tính chất hóa học của NH3? 2. Cho các phương trình phản ứng sau: (a) NH3 + HCl → NH4Cl (b) 4NH3 + 5O2 → 4NO + 6H2O (c) 4NH3 + 3O2 → 2 N2 + 6H2O Tìm các phản ứng phù hợp để minh chứng cho tính chất hóa học mà em đã dự đoán. |
Phiếu học tập số 4 Quan sát và nêu hiện tượng xảy ra. Kết hợp với tính acid – base của NH3 trong dung dịch. Hãy đề xuất phương pháp nhận biết NH3 bằng 2 cách: + Quỳ tím + Dung dịch HCl đặc |
Phiếu học tập số 5 Viết phương trình nhiệt động học tổng hợp ammonia? Dựa vào nguyên lí chuyển dịch cân bằng Le Chatelier, hãy cho biết để tăng hiệu suất phản ứng tổng hợp NH3 cần điều chỉnh nhiệt độ và áp suất như thế nào. Điều đó có gây trở ngại pư tổng hợp NH3 trên thực tế không? Vì sao? |
Phiếu học tập số 6 Kể tên, công thức của một số muối ammonium và nêu một số ứng dụng của muối ammonium. Nhận xét về tính tan của muối ammonium. Viết phương trình điện li của ammonium chloride, ammonium sulfate và ammonium nitrate trong dung dịch. |
4.1.2.Phiếu học tập liên quan phần thực hành thí nghiệm
Bước 1: Đọc cách tiến hành thí nghiệm 1 đến 4 (trong phần hướng dẫn tiến hành thí nghiệm). Viết dự đoán hiện tượng vào các ô “Dự đoán hiện tượng”. Bước 2: Xem GV biểu diễn thí nghiệm tính tan của ammonia, ghi lại hiện tượng và giải thích. Bước 3: Tiến hành thí nghiệm 2, 3, 4 theo hướng dẫn, ghi lại hiện tượng. So sánh kết quả thí nghiệm với dự đoán, giải thích và viết PTHH (nếu có). Bước 4: Xem video thí nghiệm 5. Ghi lại hiện tượng, viết PTHH và giải thích. Bước 5: Rút ra kết luận về tính chất của ammonia.
|
4.2. Phiếu hướng dẫn tiến hành thí nghiệm
PHIẾU HƯỚNG DẪN TIẾN HÀNH THÍ NGHIỆM
(Xem GV biểu diễn thí nghiệm 1, thực hiện thí nghiệm 2, 3, 4 )
TT | Thí nghiệm | Cách tiến hành | |
1 | Tính chất vật lí và tính tan của NH3 trong nước (Xem GV biểu diễn) |
- Đậy bình chứa NH3 bằng nút cao su có gắn ống dẫn khí vuốt nhọn, đầu vuốt nhọn của ống cắm vào phía trong bình. Dùng ngón tay bịt đầu ống dẫn khí và úp ngược bình vào 1 chậu thuỷ tinh đựng nước có thêm vài giọt phenolphthalein. Mở ngón tay. Quan sát hiện tượng xảy ra, giải thích, kết luận về tính tan của NH3 trong nước. | |
2 | NH3 với chất chỉ thị | Nhỏ vài giọt dung dịch NH3 vào một mẩu giấy quỳ tím. Quan sát hiện tượng. | |
3 | NH3 tác dụng với HCl | Dùng 2 cái tăm bông, 1 cái nhúng vào dung dịch NH3 đặc, cái kia nhúng vào dung dịch HCl đặc. Thả cả 2 tăm bông vào 1 ống nghiệm rồi đậy nút lại. Quan sát hiện tượng. Viết phản ứng hoá học xảy ra. | |
4 | NH3 tác dụng với dung dịch AlCl3 | Cho vào ống nghiệm 2 - 3 mL dung dịch AlCl3. Nhỏ từ từ từng giọt NH3 vào ống nghiệm cho đến dư NH3. Quan sát hiện tượng thí nghiệm. |
4.3. Bảng kết quả các thí nghiệm để học sinh đối chiếu tự đánh giá hoạt động 2.2 và 2.3
BẢNG KẾT QUẢ CÁC THÍ NGHIỆM
Thí nghiệm | Hiện tượng và giải thích | PTHH và vai trò của các chất tham gia phản ứng |
1. Tính chất vật lí và tính tan của NH3 trong nước | - Chất khí, không màu. - Nước phun vào bình thành tia có màu hồng do khí NH3 tan nhiều trong nước và tạo thành dung dịch có tính base. | NH3 + H2O Base |
2. NH3 với chất chỉ thị | - Quỳ tím hóa xanh - Phenolphthalein hóa hồng Do dung dịch NH3 có tính base |
NH3 + H2O Base |
3. NH3 tác dụng với HCl | Có khói trắng tạo thành Khói trắng là những tinh thể NH4Cl. | NH3(g) + HCl(g) Base acid |
4. NH3 tác dụng với AlCl3 | Có kết tủa trắng keo tạo thành, đó chính là Al(OH)3. | AlCl3 + 3NH3 + 3H2O |
5. NH3 tác dụng với O2 | Ammonia cháy với ngọn lửa màu vàng do phản ứng với oxygen tạo thành N2. | 4NH3 + 3O2 C.Kh C.Oxh |
4.4. Bảng kiểm để học sinh tự đánh giá hoạt động 2.2 và 2.3
BẢNG KIỂM
(Đánh X vào ô “Đạt” hoặc “Không đạt” cho các tiêu chí của từng thí nghiệm)
Thí nghiệm | TIÊU CHÍ | GHI CHÚ (Sửa chữa, bổ sung) | |||||
Có ghi lại hiện tượng dự đoán | Mô tả đúng và đầy đủ hiện tượng | Giải thích và viết đúng PTHH | |||||
Đạt | Không đạt | Đạt | Không đạt | Đạt | Không đạt | ||
1 | |||||||
2 | |||||||
3 | |||||||
4 | |||||||
5 | |||||||
4.5. Bộ câu hỏi ở hoạt động luyện tập
BỘ CÂU HỎI CỦA TRÒ CHƠI GẮP THĂM MAY MẮN
Câu 1: Liên kết trong phân tử Ammonia thuộc loại kiên kết nào sau đây?
A. Cộng hóa trị không cực B. Ion
C. Cộng hóa trị D. Kim loại
Câu 2: Chất khí nào sau đây làm xanh quỳ tím ẩm?
A.N2 B. O2 C. NH3 D. HCl
Câu 3: Ammonia có thể phản ứng được với tất cả các chất trong nhóm nào sau đây? (các điều kiện coi như có đủ)
A. HCl, O2, H2O, dd AlCl3. B. H2SO4, FeCl3, O2, NaOH.
C. HCl, KOH, FeCl3, Cl2. D. H2, HNO3, O2, AlCl3.
Câu 4: Nhận xét nào sau đây đúng?
A. Tính chất hóa học của NH3 là tính baze yếu. B. Tăng nhiệt và tăng áp suất.
C. Trong phòng thí nghiệm, khí NH3 được tổng hợp từ H2 và N2
D. Khí NH3 nhẹ hơn không khí, tan nhiều trong nước, không màu, mùi khai.
Câu 5: Cho NaOH dư tác dụng với 150 ml dung dịch (NH4)2SO4 1M, đun nóng. Sau phản ứng thu được bao nhiêu lít NH3 (đkc) ?
- 5,498 B. 3,7185 C. 2,479 D. 7,437
Câu 6: Để điều chế 17 gam NH3, cần lấy V lít khí N2 (đkc)? Biết hiệu suất phản ứng tính theo N2 là 25%. Giá trị của V là
A. 49,58. B. 24,79. C. 37,185. D. 74,37.





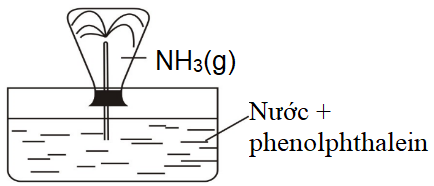 - Quan sát bình chứa NH3, nêu trạng thái, màu sắc.
- Quan sát bình chứa NH3, nêu trạng thái, màu sắc.


