



Preview text:
ỦY BAN NHÂN DÂN TỈNH QUẢNG NGÃI
TRƯỜNG ĐẠI HỌC PHẠM VĂN ĐỒNG ---------00--------- BÀI GIẢNG HÓA HỌC HỮU CƠ 2 Quảng Ngãi, 2025 MỤC LỤC
Chương 1. DẪN XUẤT HALOGEN - ALCOHOL - PHENOL.............................................. 1
1.1. Dẫn xuất halogen ............................................................................................................ 1
1.1.1. Khái niệm, phân loại, danh pháp, đồng phân ......................................................... 1
1.1.2.Tính chất vật lí....................................................................................................... 3
1.1.3.Tính chất hoá học .................................................................................................. 3
1.1.4. Điều chế ............................................................................................................. 11
1.2. Alcohol ..................................................................................................................... 13
1.2.1 Khái niệm, danh pháp .......................................................................................... 13
1.2.2. Đặc điểm cấu tạo ................................................................................................ 15
1.2.3. Tính chất vật lí .................................................................................................... 15
1.2.4. Tính chất hóa học ............................................................................................... 16
1.2.5. Điều chế ............................................................................................................. 20
1.3. Phenol ....................................................................................................................... 23
1.3.1. Khái niệm ........................................................................................................... 23
1.3.2. Đặc điểm cấu tạo của phenol .............................................................................. 23
1.3.3. Tính chất vật lí .................................................................................................... 24
1.3.4. Tính chất hóa học ............................................................................................... 24
1.3.5. Ứng dụng, điều chế ............................................................................................. 26
Chương 2. HỢP CHẤT CARBONYL .................................................................................. 28
2.1. Khái niệm, danh pháp ................................................................................................ 28
2.1.1. Khái niệm ........................................................................................................... 28
2.1.2. Danh pháp .......................................................................................................... 28
2.2. Đặc điểm cấu tạo ....................................................................................................... 29
2.3.Tính chất vật lí ........................................................................................................... 29
2.4. Tính chất hóa học ...................................................................................................... 29
2.4.1.Phản ứng cộng nucleophin ................................................................................... 29
2.4.2. Phản ứng thế nguyên tử oxygen của nhóm carbonyl ............................................ 31
2.5. Điều chế .................................................................................................................... 35
2.5.1. Từ hydrocarbon .................................................................................................. 35
2.5.2. Từ dẫn xuất halogen ........................................................................................... 36
2.5.3. Đi từ alcohol ....................................................................................................... 36
2.5.4. Đi từ carboxylic acid và muối ............................................................................. 36
Chương 3. CARBOXYLIC ACID ........................................................................................ 37
3.1. Định nghĩa- Phân loại- Danh pháp ............................................................................. 37
3.1.1. Định nghĩa .......................................................................................................... 37
3.1.2. Phân loại ............................................................................................................. 37
3.1.3. Danh pháp .......................................................................................................... 37
3.2. Đặc điểm cấu tạo ....................................................................................................... 38
3.3. Tính chất vật lí .......................................................................................................... 38
3.4.Tính chất hóa học ....................................................................................................... 39
3.4.1. Phản ứng làm đứt liên kết O-H. Tính acid ........................................................... 39
3.4.2. Phản ứng làm đứt liên kết CO-OH ...................................................................... 40
3.5. Điều chế .................................................................................................................... 43
3.5.1.Oxygen hóa hợp chất hữu cơ. Tổng hợp giảm mạch và giữ nguyên mạch ............ 43
3.5.2. Chuyển hóa dẫn xuất monohalogen. Tổng hợp tăng mạch ................................... 43
Chương 4. ESTER-LIPID .................................................................................................... 45
4.1. Ester .......................................................................................................................... 45
4.1.1. Khái niệm ........................................................................................................... 45
4.1.2. Danh pháp .......................................................................................................... 45
4.1.3. Tính chất vật lí .................................................................................................... 45
4.1.4.Tính chất hóa học ................................................................................................ 45
4.1.5. Điều chế và ứng dụng ......................................................................................... 48
4.2. Lipid ......................................................................................................................... 48
4.2.1. Khái niệm về lipid, chất béo, acid béo ................................................................. 48
4.2.2. Tính chất vật lí của chất béo ............................................................................... 49
4.2.3. Tính chất hóa học của chất béo ........................................................................... 49
4.2.4. Ứng dụng của chất béo và acid béo ..................................................................... 50
4.3. Xà phòng và chất giặt rửa .......................................................................................... 50
4.3.1. Khái niệm, đặc điểm cấu tạo, tính chất giặt rửa của xà phòng và chất giặt rửa ..... 50
4.3.2. Phương pháp sản xuất xà phòng và chất giặt rửa tổng hợp .................................. 52
4.3.3. Sử dụng xà phòng và chất giặt rửa hợp lí, an toàn ............................................... 53
Chương 5. CARBOHYDRATE ........................................................................................... 54
5.1. Khái niệm và phân loại carbohydrate ......................................................................... 54
5.1.1. Khái niệm ........................................................................................................... 54
5.1.2. Phân loại ............................................................................................................. 54
5.2. Glucose và fructose ................................................................................................... 54
5.2.1. Tính chất vật lí, trạng thái tự nhiên và ứng dụng ................................................. 54
5.2.2. Cấu tạo phân tử ................................................................................................... 54
5.2.3. Tính chất hóa học ............................................................................................... 55
5.3. Saccharose-Maltose ................................................................................................... 59
5.3.1. Tính chất vật lí, trạng thái tự nhiên và ứng dụng ................................................. 59
5.3.2. Cấu tạo phân tử ................................................................................................... 60
5.3.3.Tính chất hóa học ................................................................................................ 60
5.4. Polysaccharide .......................................................................................................... 62
5.4.1. Tinh bột .............................................................................................................. 62
5.4.2. Glicogen ............................................................................................................. 64
5.4.3. Cellulose ............................................................................................................ 65
Chương 6. HỢP CHẤT CHỨA NITROGEN ....................................................................... 68
6.1. Amine ....................................................................................................................... 68
6.1.1. Định nghĩa- Phân loại- Danh pháp ...................................................................... 68
6.1.2. Tính chất vật lí .................................................................................................... 69
6.1.3. Tính chất hóa học ............................................................................................... 70
6.1.4. Điều chế ............................................................................................................. 78
6.2. Amino acid ................................................................................................................ 79
6.2.1. Khái niệm ........................................................................................................... 79
6.2.2. Danh pháp .......................................................................................................... 80
6.2.3. Tính chất vật lí .................................................................................................... 80
6.2.4. Tính chất hóa học ............................................................................................... 80
6.2.5. Điều chế ............................................................................................................. 84
6.2.6. Ý nghĩa và ứng dụng ........................................................................................... 85
6.3. Peptide ...................................................................................................................... 85
6.3.1. Khái niệm và đặc điểm cấu tạo ........................................................................... 86
6.3.2. Đồng phân và danh pháp..................................................................................... 86
6.3.3. Tính chất ............................................................................................................ 86
6.3.4. Tổng hợp peptide ................................................................................................ 88
6.3.5. Xác định cấu trúc của peptide ............................................................................. 90
6.4. Protein ....................................................................................................................... 93
6.4.1. Định nghĩa-Phân loại- Cấu trúc ........................................................................... 93
6.4.2. Tính chất ............................................................................................................ 96
6.4.3. Vai trò của protein với sự sống ........................................................................... 97
6.5. Enzyme ..................................................................................................................... 97
6.5.1. Vai trò của enzyme trong phản ứng sinh hóa ....................................................... 97
6.5.2. Ứng dụng của enzym trong công nghệ sinh học .................................................. 97
Chương 7. HỢP CHẤT CAO PHÂN TỬ (POLYMER) ....................................................... 98
7.1. Đại cương về hợp chất cao phân tử ............................................................................ 98
7.1.1. Khái niệm- Phân loại .......................................................................................... 98
7.1.2. Cấu trúc của polymer .......................................................................................... 98
7.1.3. Tính chất lí học và cơ tính................................................................................... 99
7.1.4. Tính chất hóa học ............................................................................................. 100
7.1.5. Các phương pháp tổng hợp polymer ................................................................. 103
7.2. Chất dẻo .................................................................................................................. 105
7.2.1. Khái niệm- Thành phần chất dẻo ...................................................................... 105
7.2.2. Ứng dụng.......................................................................................................... 106
7.3. Tơ tổng hợp ............................................................................................................. 106
7.3.1. Khái niệm ......................................................................................................... 106
7.3.2. Phân loại ........................................................................................................... 106
7.3.3. Tính chất chung của tơ tổng hợp và bán tổng hợp ............................................. 106
7.3.4. Điều chế ........................................................................................................... 106
7.4. Cao su ..................................................................................................................... 107
7.4.1. Cao su thiên nhiên ............................................................................................ 107
7.4.2. Cao su tổng hợp ................................................................................................ 108
7.4.3. Lưu hóa cao su ................................................................................................. 108
TÀI LIỆU THAM KHẢO .................................................................................................. 110
Chương 1. DẪN XUẤT HALOGEN - ALCOHOL - PHENOL 1.1. Dẫn xuất halogen
1.1.1. Khái niệm, phân loại, danh pháp, đồng phân
a. Khái niệm: dẫn xuất halogen là những hợp chất hữu cơ trong đó một hoặc
nhiều nguyên tử H của HC được thay thế bằng nguyên tử nguyên tố halogen: F, Cl, Br, I. b. Phân loại
- Tuỳ theo số lượng halogen trong phân tử ta phân biệt: monohalogen (CH3Br),
dihalogen (CH2Cl2), trihalogen (CHCl3) và polihalogen.
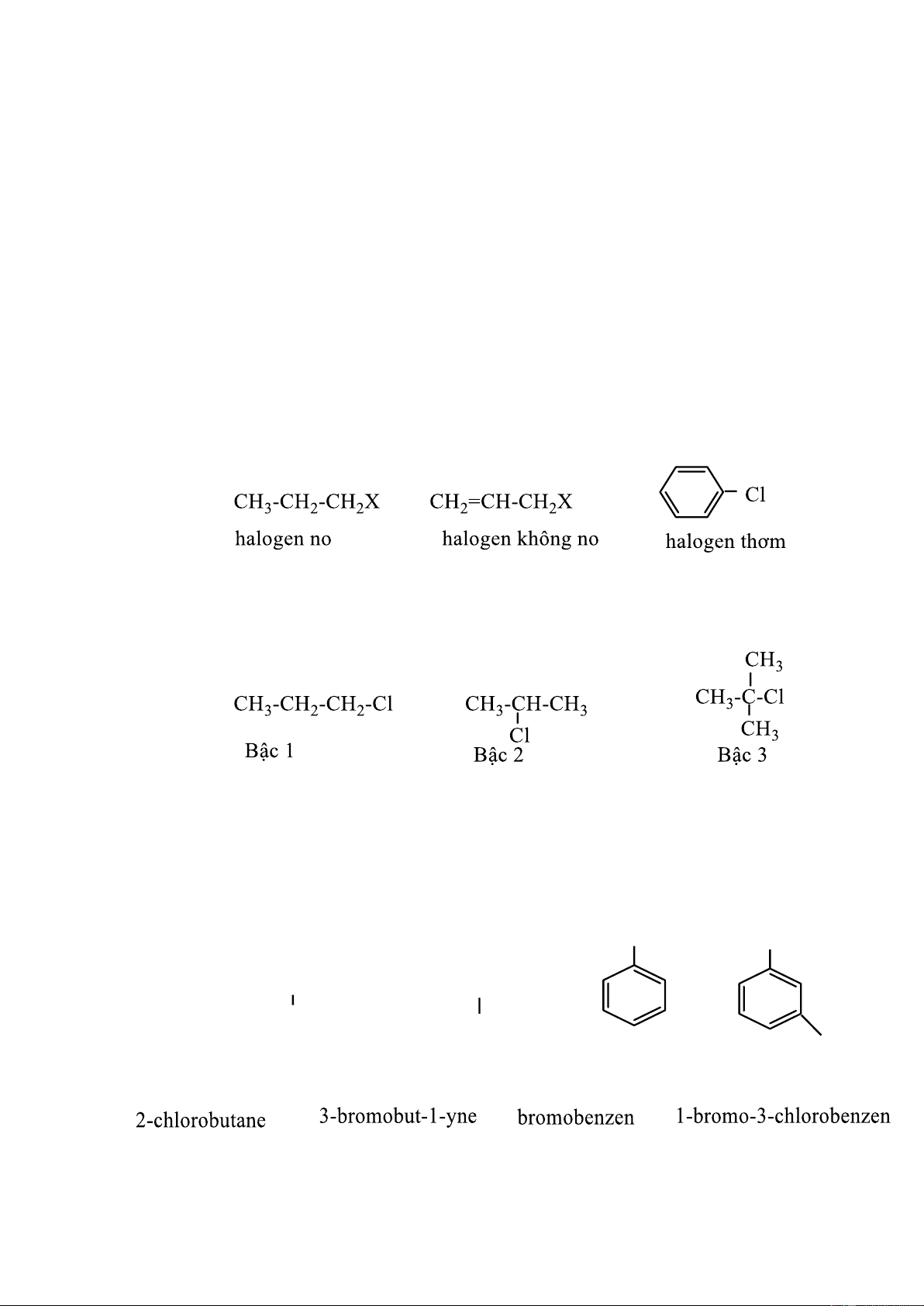
- Tuỳ theo đặc điểm của gốc hydrocarbon, ta phân biệt: dẫn xuất halogen no, không no và thơm
- Tuỳ theo bậc của nguyên tử carbon liên kết với halogen ta có dẫn xuất halogen bậc 1, bậc 2, bậc 3 c. Danh pháp
- Danh pháp thay thế (IUPAC):
Vị trí halogen-halogeno + tên hydrocarbon Br Cl CH3-CH2-CH-CH3 CHC-CH-CH3 Cl Br Br
Nếu tất cả các nguyên tử H của hydrocarbon được thay thế bằng halogen cùng loại thì tên là: 1 perhalogeno + hydrocarbon
Ví dụ: CCl3-CCl2-CCl3: percloropropane
- Danh pháp gốc-chức
Tên gốc hydrocarbon + halide Ví dụ: CH3-Cl (CH3)3C-Br Methyl chloride tert-butyl bromide
- Tên thường (được IUPAC lưu dùng) CHF3 : Fluoroform CHI3: Iodoform CHCl3: Chloroform CHBr3: Bromoform
CCl4: Carbon tetrachloride (tên thay thế là: tetrachloromethane) CFC: Freon CCl2F2: Freon-12 d. Đồng phân
- Đồng phân cấu tạo
+ Đồng phân về vị trí nguyên tử halogen CH3-CH2-CH2-CH2-Cl CH3-CH2-CH-CH3 Cl Butylclorua sec-Butylclorua
+ Đồng phân về mạch carbon CH3 CH CH 3-CH2-CH2-CH2-Cl CH3-CH-CH2-Cl 3-C-Cl CH3 CH3 isobutylclorua tert-Butylclorua
+ Đồng phân về vị trí liên kết bội CH2=CH-CH2-Br CH3-CH=CH-Br
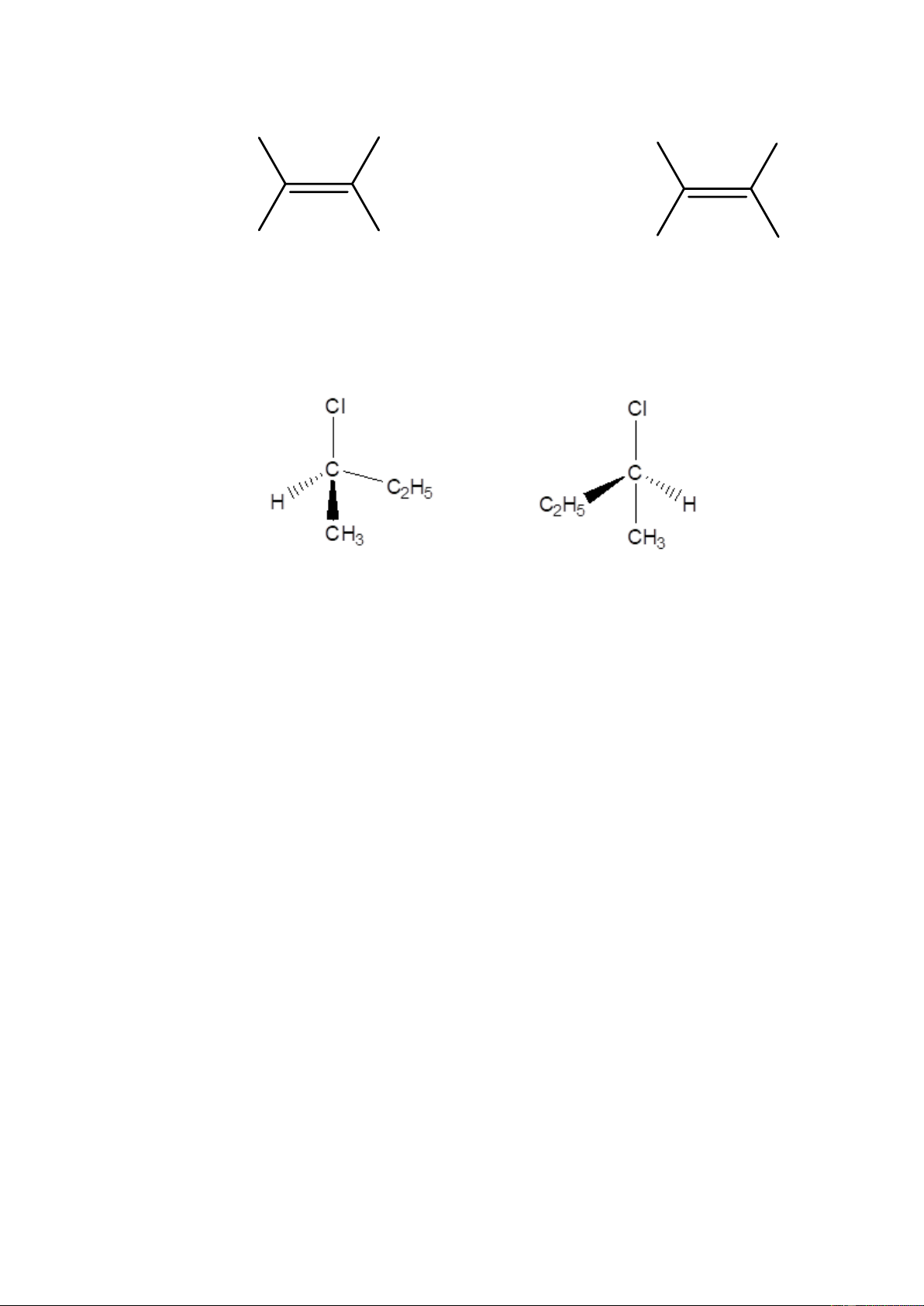
- Đồng phân cấu hình
+ Đồng phân hình học 2 H Cl 3C H3C H H H H Cl (Z) hoặc cis- 1cloropropen
(E) hoặc trans- 1cloropropen
+ Đồng phân quang học
1.1.2.Tính chất vật lí
- Trạng thái: các dẫn xuất halogen có số nguyên tử C thấp là chất khí, số nguyên
tử C cao là chất lỏng, cao hơn và dẫn xuất đihalogen thơm hoặc thế nhiều lần là chất rắn.
- ToS: ảnh hưởng bởi cấu tạo gốc hydrocarbon và bản chất nguyên tử halogen.
+ Nếu gốc hydrocarbon như nhau: nhiệt độ sôi tăng theo nguyên tử khối và theo
độ phân cực hoá của halogen.
RF< RCl < RBr < RI ( do bán kính nguyên tử I> Br> Cl>F)
+ Nếu halogen như nhau : nhiệt độ sôi tăng theo chiều dài của mạch HC cùng loại
do tăng diện tích tiếp xúc và tăng lực hút Vandervan.
Vd: tos: C4H9X> C3H7X>C2H5X> CH3X
+ Nếu cùng dẫn xuất halogen, cùng số nguyên tử C: tos dẫn xuẩt bậc 1> dx bậc 2> dx bậc 3
(do tăng tính đối xứng cầu và làm giảm lực hút Vandervan)
- Độ tan: rất ít hay không tan trong nước , dễ tan trong các dung môi hữu cơ: hydrocarbon, alcohol, ether.
1.1.3.Tính chất hoá học
Xét cấu tạo của dx halogen: 3
Liên kết C-X là liên kết cộng hoá trị phân cực do sự chênh lệch về độ âm điện
(X: F, Cl, Br) và độ phân cực hóa cao (X: I) C X
Khả năng phản ứng của liên kết C-X phụ thuộc vào sự phân cắt liên kết mà sự
phân cắt liên kết C-X phụ thuộc chủ yếu vào độ phân cực hoá
+ Nếu gốc R như nhau ta có:
R-I > R-Br > R-Cl >> R-F + Nếu X như nhau ta có:
C6H5CH2-X; CH2=CHCH2-X > CH3CH2-X > CH2=CH-X;C6H5-X
- Phản ứng cho liên kết C-X:
* Phản ứng thế nucleophin nguyên tử halogen
* Phản ứng tách hydrogen halogenua
* Phản ứng với kim loại
1.1.3.1. Phản ứng thế nucleophin (SN)
Các dẫn xuất R-I, R-Br, R-Cl tham gia phản ứng thế với tác nhân nucleophin
Y(-) tạo thành sản phâm thế R-Y theo sơ đồ:
Tác nhân nucleophin Y(-) là những anion như : HO(-), CH3COO(-), C2H5O(-),
CN(-) hoặc những phân tử trung hoà có cặp electron tự do có thể nhường cho Cδ+ như H2O, C2H5OH, NH3, CH3NH2
Một số phản ứng thế nucleophin quan trọng của dx halogen
a. Thuỷ phân bằng kiềm (điều chế alcohol) (-) H (-) 2O R-X + HO R-OH + X (-) H2O (-) C2H5-Br + HO C2H5-OH + Br
b. Tổng hợp Williamson (điều chế ether) 4 (-) (-) R-X + R'-O R-O-R' + X (-) (-) C2H5-Cl + CH3-O C2H5-O-CH3 + Cl c. Tổng hợp ester (-) (-) R-X + R'COO R'-COOR + X C2H5-Cl + CH3COOAg CH3COOC2H5 + AgCl
d.Tổng hợp Kolbe (điều chế nitrin) (-) (-) R-X + CN R-CN + X C + KCN 6H5CH2-Cl C6H5CH2-CN + KCl
e. Tổng hợp Finkelstrin (trao đổi halogen)
f. Alkyl hoá Hofmann (tổng hợp amine)
Cơ chế phản ứng thế nucleophin:
Tùy theo cấu tạo gốc R, tác nhân nucleophin Y(-), dung môi… mà các phản ứng
thế ở trên có thể xảy ra theo cơ chế thế nucleophin lưỡng phân tử SN2 hoặc cơ chế
thế nucleophin đơn phân tử SN1.
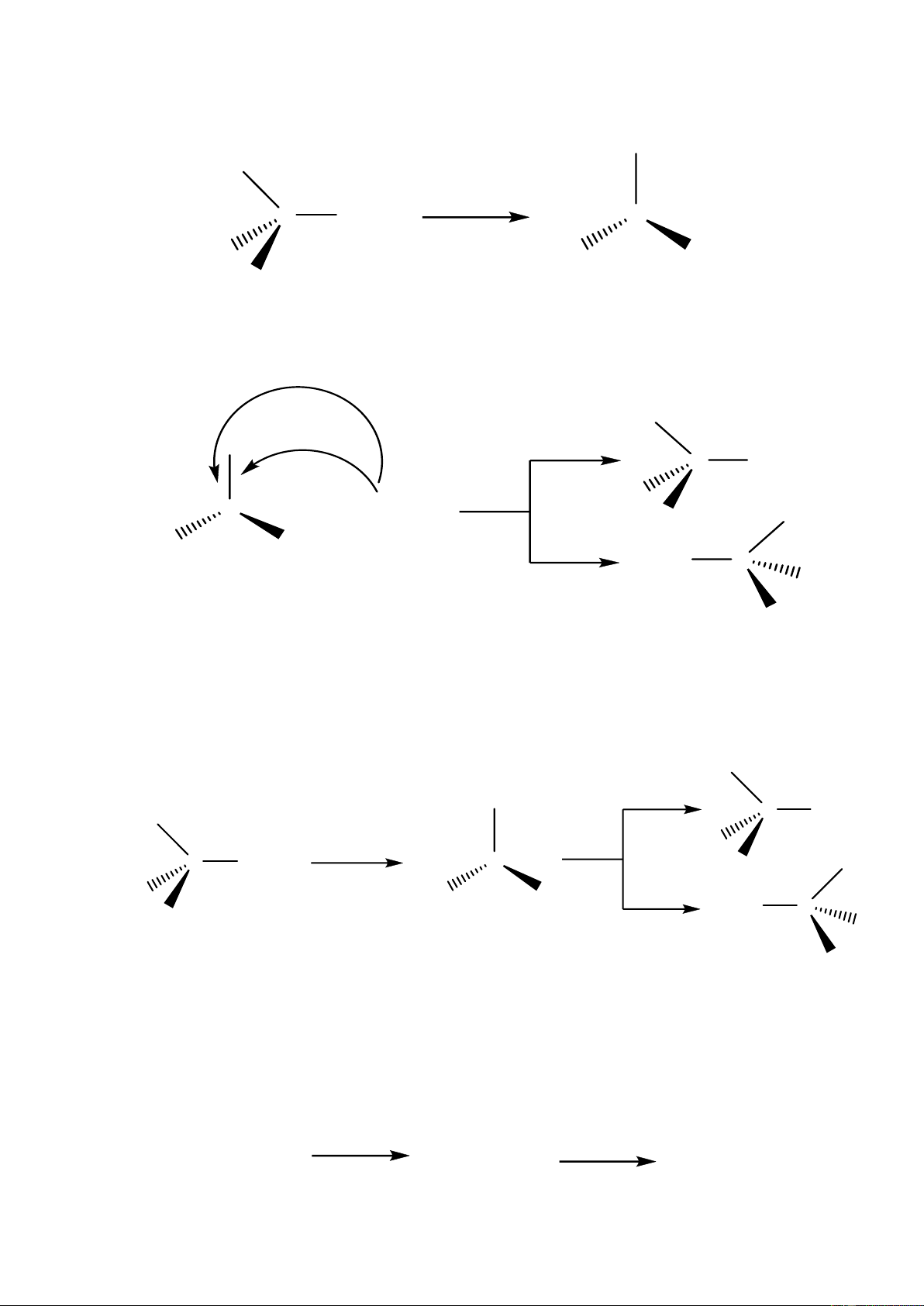
Cơ chế thế nucleophin đơn phân tử SN1: gồm 2 giai đoạn 5
- GĐ 1: Đứt liên kết C-X tạo thành carbocation C(+) và anion X(-) đây
là giai đoạn chậm quyết định tốc độ phản ứng. (-) chËm (+) C X C + X ChÊt ®Çu
- GĐ 2: Là sự kết hợp của carbocation C(+) với tác nhân nucleophin Y(-) tạo sản phẩm C Y (-) (+) nhanh C + Y Y C S¶n phÈm • Sơ đồ chung C Y chËm (+) nhanh C X C - X(-) - Y(-) Y C S¶nphÈm
Tốc độ pư: v= k [ -C-X ]
Ví dụ: Cơ chế pư SN1 của tert-butylbromide (CH (CH 3)3C-Br 3)3C(+) HOH (CH3)3C-OH -Br(-) -H(+) 6
Cơ chế thế nucleophin lưỡng phân tử SN2:
Có 1 giai đoạn: sự đứt liên kết cũ C-X và sự hình thành liên kết mới C-Y xảy
ra đồng thời tức chạy qua 1 trạng thái chuyển tiếp (phức hoạt động) Sơ đồ chung: Y(-) + C X Y C X Y C + X(-) chÊt ®Çu tr¹ ng th¸ i chuyÓn tiÕp S¶n phÈm (phøc ho¹ t ®éng)
Tốc độ phản ứng : v= k [-C-X] [Y(-)]
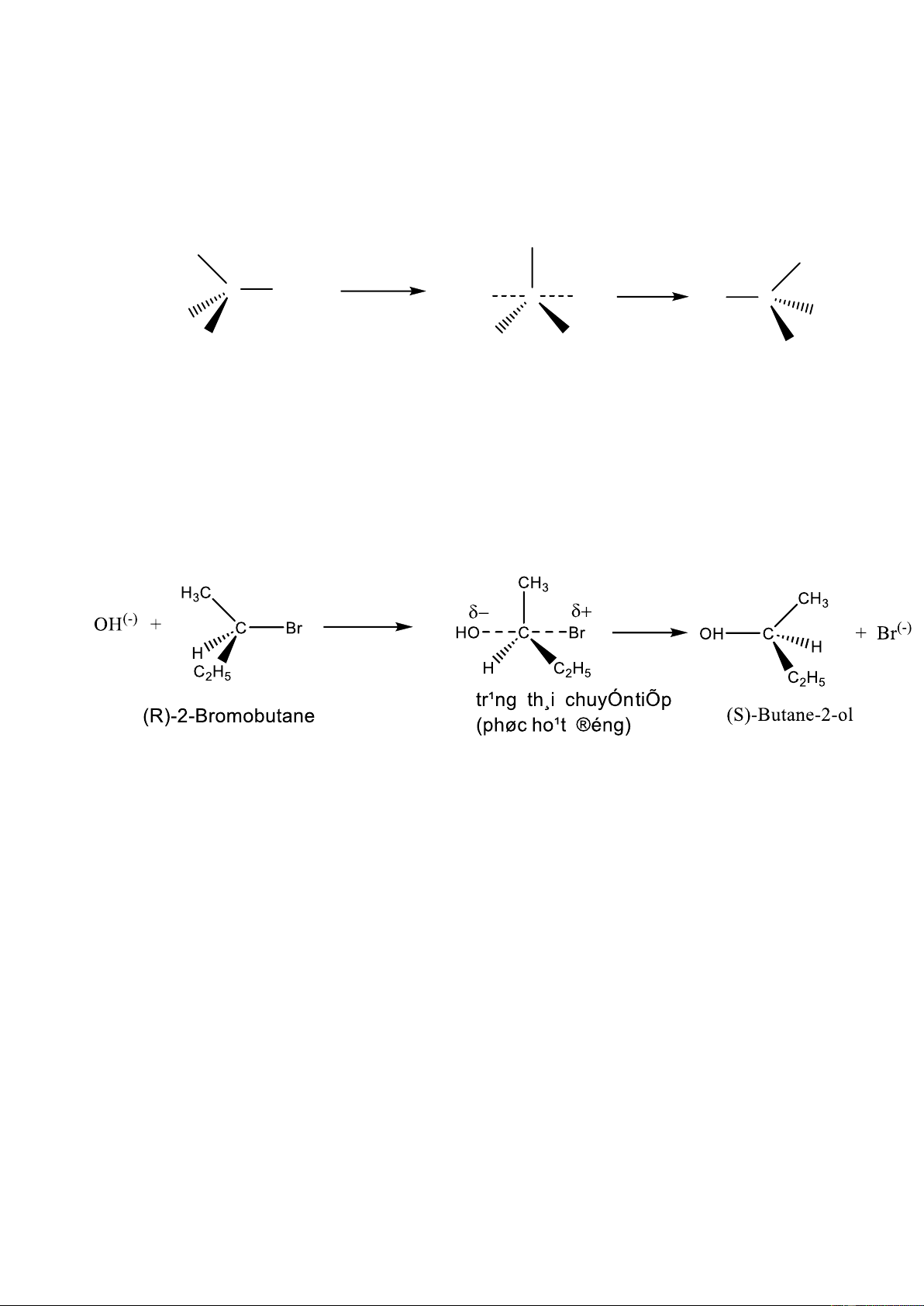
Nếu chất đầu có C* thì sản phẩm sinh ra có cấu hình ngược với cấu hình chất
đầu( vì Y(-) tấn công vào phía đối lập với X thuận lợi hơn).
Ví dụ: Cơ chế thuỷ phân 2-Bromobutan bằng kiềm
Các yếu tố ảnh hưởng đến cơ chế phản ứng: - Cấu tạo gốc HC:
+ Nếu R là những gốc no, bậc của R càng cao thì khả năng phản ứng SN2
của RX càng giảm (vì sự án ngữ không gian ở gốc R gây khó khăn cho sự tấn
công của Y(-), trong khi đó khả năng pư SN1 của RX lại càng tăng vì carbocation
R(+) sinh ra càng bền và càng dễ)
SN2: CH3X > CH3CH2-X>(CH3)2CH-X >(CH3)3C-X
SN1: CH3X < CH3CH2-X<(CH3)2CH-X <(CH3)3C-X
+ Nếu R là những gốc không no và gốc thơm, khả năng phản ứng SN2 cũng
như SN1 của các dẫn xuất anlyl CH2=CH-CH2-X và benzyl C6H5CH2-X đếu rất
cao (vì trạng thái chuyển tiếp trong SN2 được ổn định và carbocation trong SN1
được bền vững hoá nhờ hiệu ứng + C của liên kết C=C). 7
Ngược lại các dẫn xuất vinyl CH2=CH-X và phenyl C6H5-X đều rất khó tham gia
phản ứng SN1, SN2 vì hiệu ứng +C của X
SN2 và SN1 : CH2=CH-X << CH3CH2CH2-X < CH2=CHCH2-X - Tác nhân nucleophin Y(-)
+ SN2: tốc độ phản ứng phụ thuộc vào nồng độ của dẫn xuất halogen [RX] và tác
nhân nucleophin [Y(-)]. Do đó tác nhân nucleophin mạnh thuận lợi cho cơ chế SN2.
Ngược lại, pư SN1 chỉ phụ thuộc nồng độ của [RX], không chịu ảnh hưởng của
tác nhân nucleophin. Do vậy, tốc độ phản ứng SN2 giảm theo sự giảm lực nucleophin
• Tác nhân nucleophin mang điện tích mạnh hơn phân tử trung hòa.
Ví dụ: HO- > HOH, RO- > ROH
• Nguyên tố có độ âm điện lớn sẽ giữ chặt các e hơn do đó tính nucleophin
yếu hơn nguyên tố có độ âm điện nhỏ.
Ví dụ: HS- > HO- , NH3> HOH
- Ảnh hưởng của dung môi
SN1: Giai đoạn chậm quyết định tốc độ pư là giai đoạn ion hóa. Do vậy dung môi
phân cực mạnh là môi trường tốt cho quá trình ion hóa, tăng độ phân cực của dung
môi sẽ làm tăng tốc độ của phản ứng SN1.
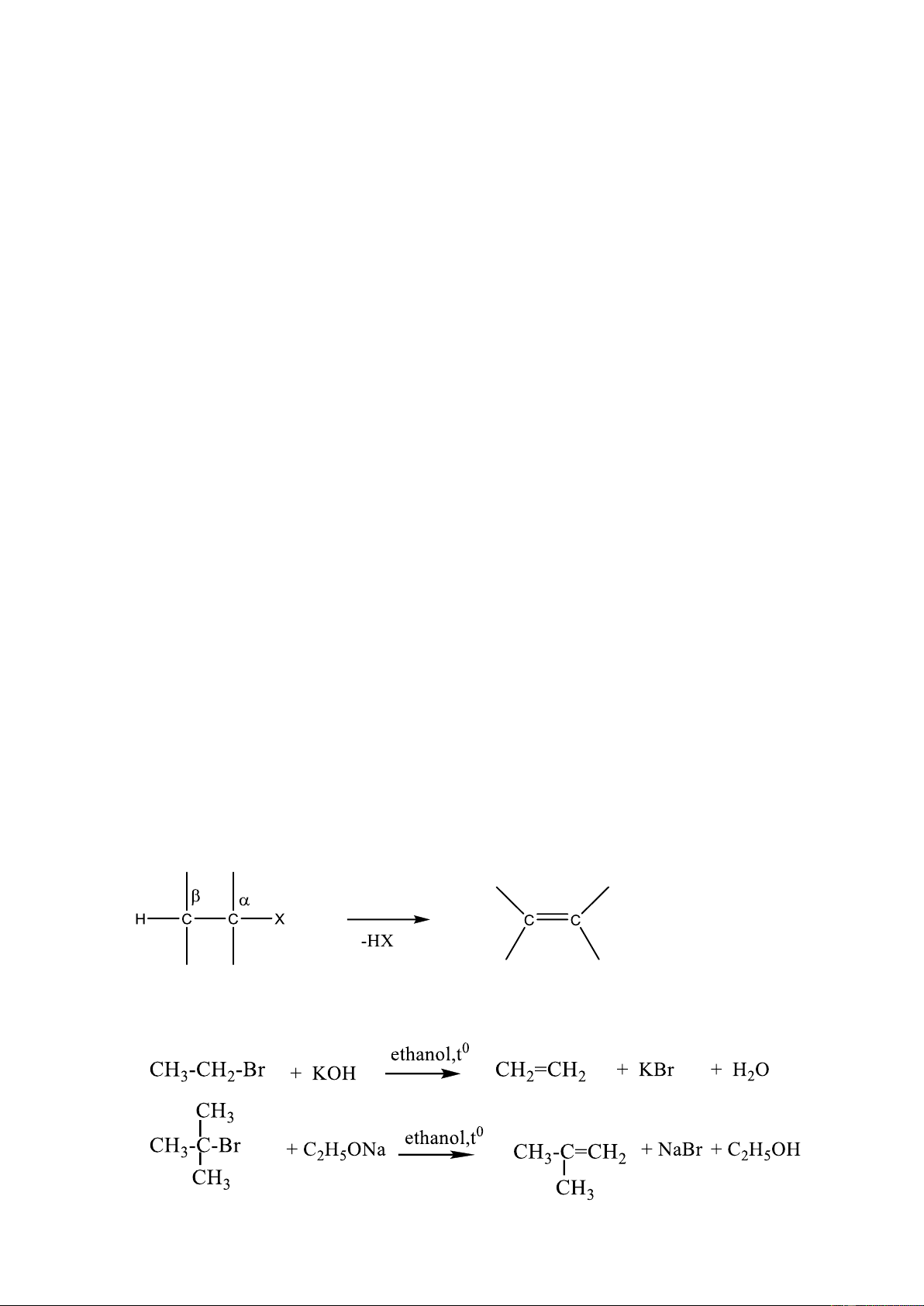
1.1.3.2. Phản ứng tách HX (E)
Phản ứng dehydrogen halide (tách HX) có thể xảy ra với dẫn xuất halogen có ít
nhất một nguyên tử H ở C
Khi có tác dụng của base trong dung môi rượu nguyên tử H ở vị trí β bị tách ra
cùng với X tạo liên kết đôi C=C như sau:
Base như: HO- (NaOH, KOH), NH - 2 (NaNH2), RO- (RONa)… 8
• Các dẫn xuất gem-dihalogen RCH2CHX2 và vic-dihalogen RCHX-CH2X
có thể tham gia phản ứng tách HX theo 2 nấc tạo thành sản phẩm có nối đôi hoặc
nối ba. Ngoài ra chúng còn tham gia phản ứng tách X2 nhờ tác dụng của Zn tạo
thành sản phẩm có nối đôi (đ/c alkene).
• Cơ chế phản ứng tách (*)
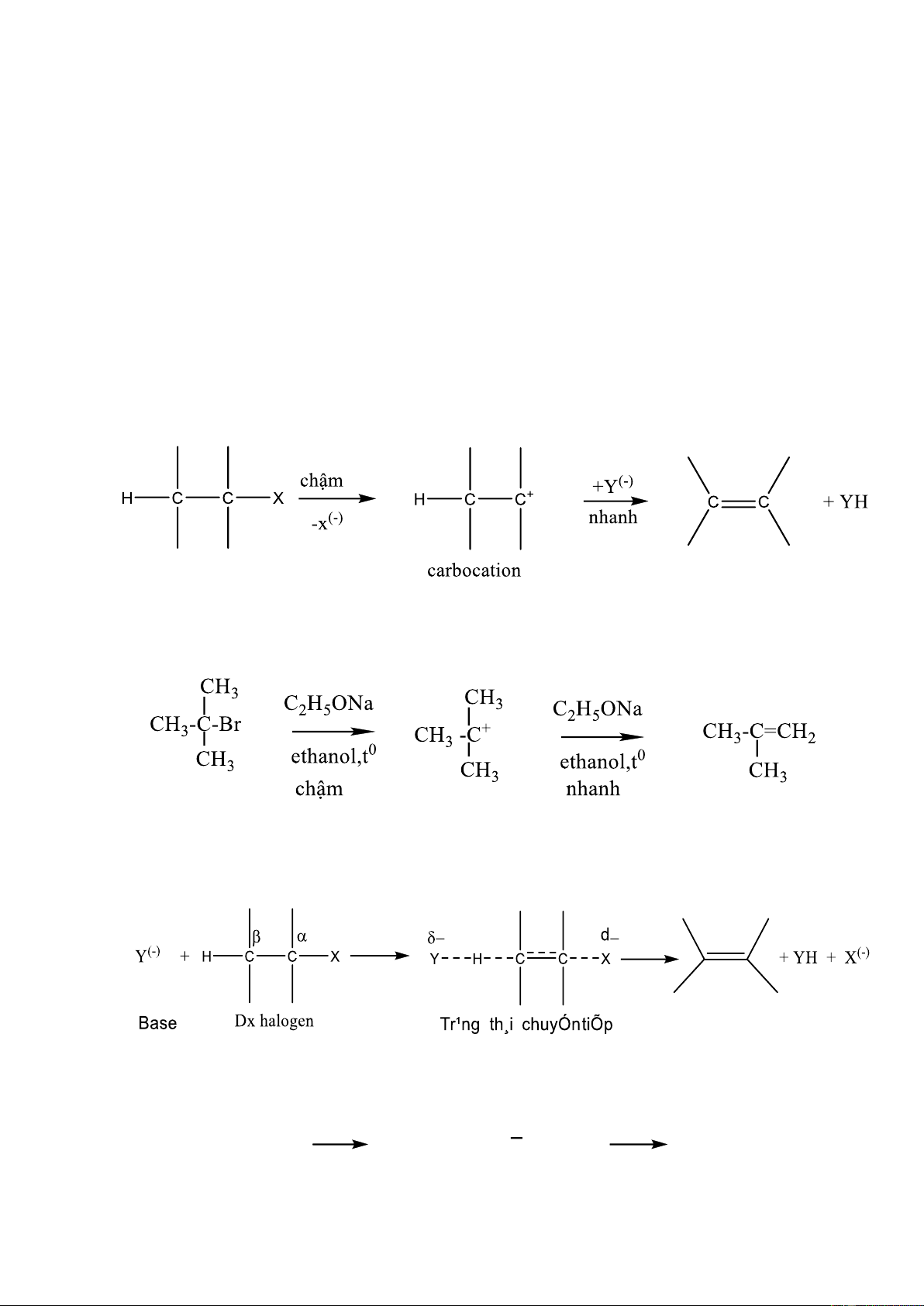
a. Cơ chế tách nucleophin đơn phân tử (E1)
Tương tự cơ chế SN1 vì giai đoạn chậm quyết định tốc độ phản ứng cũng tạo
carbocation C+, sau đó C+ bị tách proton tạo alkene. Sơ đồ chung:
Tốc độ phản ứng: v=k [RX]
b. Cơ chế tách nucleophin lưỡng phân tử (E2)
Tương tự cơ chế SN2 vì cũng xảy ra qua trạng thái chuyển tiếp:
Tốc độ phản ứng: v=k [RX] [Y(-)] OH(-) + H-CH2-CH2-Br HO....H.....CH2....CH2....Br HOH + CH2=CH2 + Br(-)
Hướng của phản ứng tách : tuân theo qui tắc Zaixep 9
Qui tắc Zaixep: khi tách hydrogenhalogen, nguyên tử hydrogen ưu tiên
tách ra cùng với halogen ở bên cạnh là nguyên tử Ccó bậc cao nhất. Ví dụ: CH3-CH=CH-CH3 (81%) b2 b1 -HBr C sp chÝnh CH 2H5ONa 3-CH2-CH-CH3 Br C2H5OH CH3-CH2-CH=CH2 (19%) -HBr sp phô
Qui tắc Zaixep áp dụng cho phản ứng tách HX theo cơ chế E1, E2 khi tác nhân
nucleophin có thể tích không lớn lắm. Hướng của phản ứng tách phụ thuộc vào
độ bền của alkene tạo thành, không chịu ảnh hưởng của sự che chắn không gian(sp
chính là alkene bền hơn). Độ bền của alkene:
R2C=CR2 > R2C=CHR > R2C=CH2, RCH=CHR > RCH=CH2 > H2C=CH=
Qui tắc Hofmann: áp dụng cho trường hợp tác nhân nucleophin có thể tích
lớn, có độ phân nhánh cao, yếu tố chắn không gian có ý nghĩa quyết định đối với
hướng tách loại HX theo cơ chế E2 ưu tiên tạo alkene kém bền (ngược Zaixep) CH3-CH=C-(CH3)2 (28%)
Do kÝch th- í c lí n cña Y(-) (CH3)3CONa CH3-CH2-C-(CH3)2 E2 Br CH (72%) 3-CH2-C=CH2 CH3 (CH3)3-C-CH2C=CH2 (81%) C CH3 2H5ONa (C H3)3-C-CH2-C-(CH3)2 E 2 Cl (CH3)3C-CH=C(CH3)3 (19%)
Do kÝch th- í c lí n cña (CH3)3C ë gèc HC
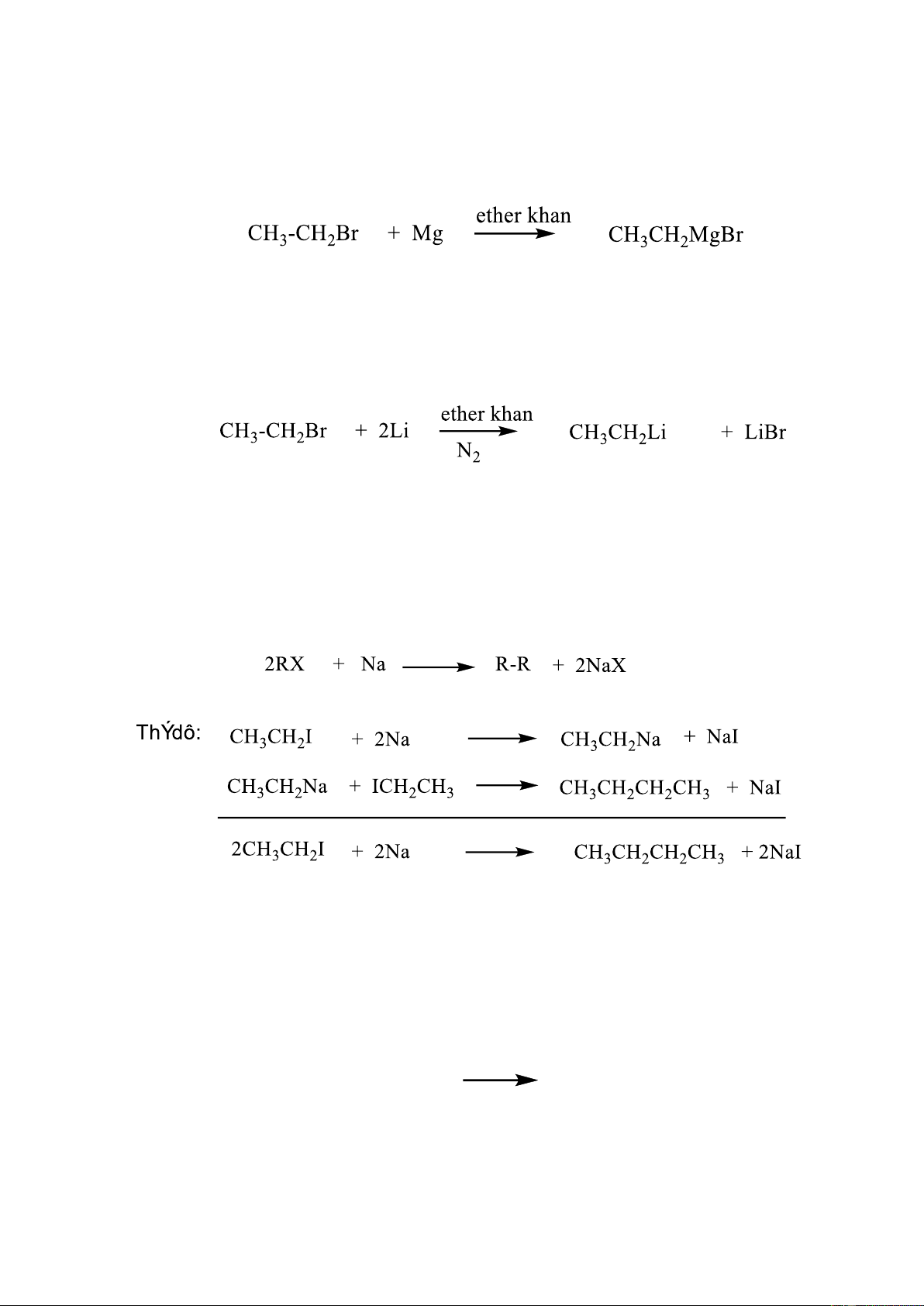
1.1.3.3. Phản ứng với kim loại
a. Phản ứng với Mg (pư Grinha) 10
Các dẫn xuất bromo, iodo và chloro của hydrocarbon kể cả dx aryl và vinyl có thể
tác dụng với Mg trong dung môi ether khan tạo thành hợp chất cơ magiê tương ứng
b. Phản ứng với Lithium
Các Alkyl halogenua tác dụng với Li (trong dung môi benzene hoặc ether) sinh ra
hợp chất cơ Li gọi chung là Alkyl liti
Phản ứng thực hiện trong khí quyển trơ (N2) vì hợp chất cơ Li tác dụng được với O2, CO2 và hơi nước.
c. Phản ứng với Na
Tác dụng của RX với Na không dừng lại ở hợp chất cơ kim mà phản ứng tiếp tục
để tạo hydrocarbon có mạch dài hơn. 1.1.4. Điều chế
Từ 2 nguồn nguyên liệu chính là hydrocarbon và alcohol bằng phản ứng thế và phản ứng cộng
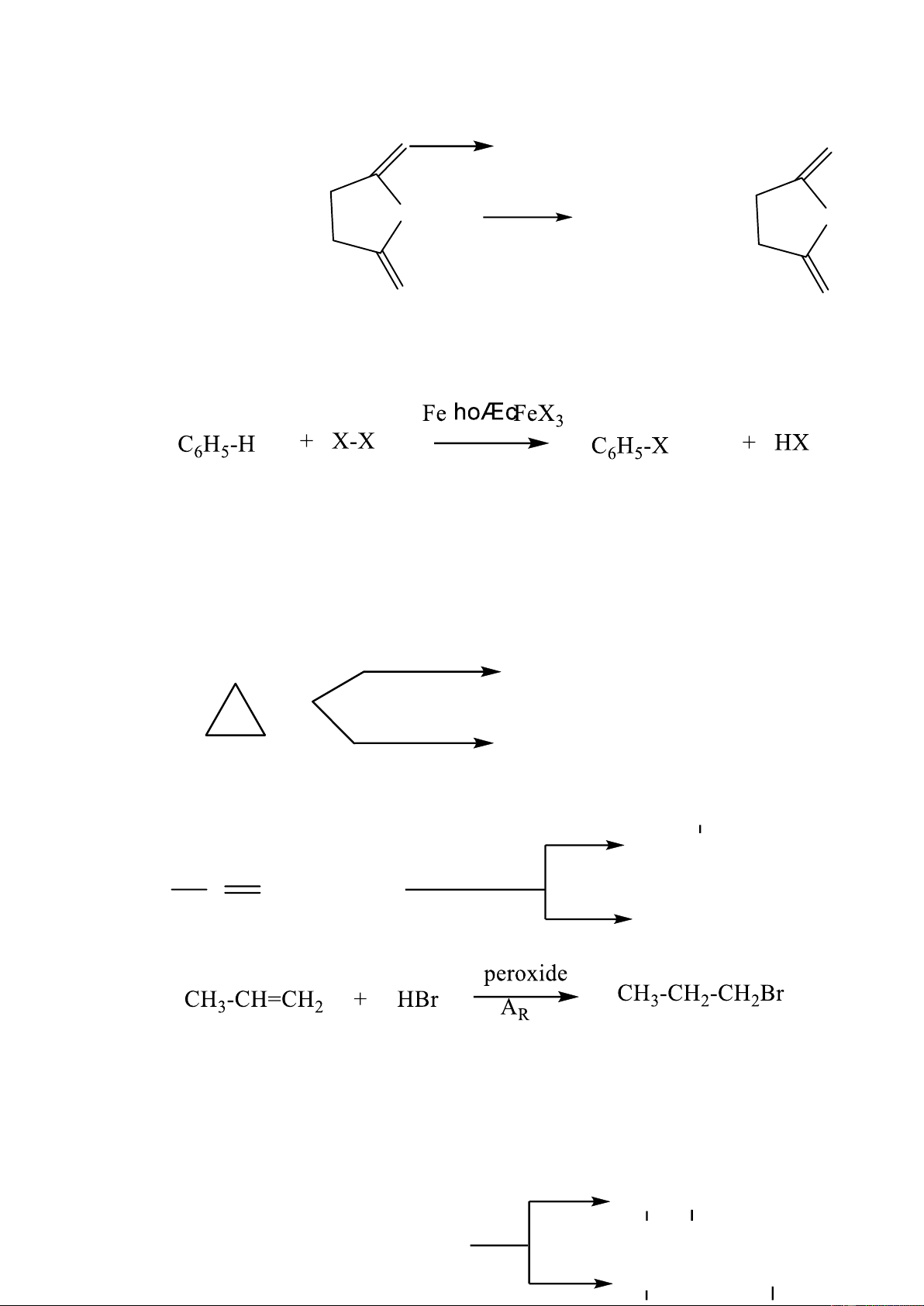
1.1.4.1. Từ hydrocarbon- Phản ứng thế
a. Thế hydrogen của alkane và cycloalkane có vòng 5,6 cạnh h R-H + X-X R-X + HX
b. Thế hydrogen của alkene
Pư thế chỉ xảy ra ở các alkene thấp như etylene, propene với chlorine ở nhiệt độ cao 11 5000C CH O O 2=CH2 + Cl2 CH2=CHCl + HCl t0 CH2=CHCH3 + N-Br CH2=CHCH2Br + N-H CCl4 O O N-Bromosucxinimit sucxinimit
c. Thế hydrogen ở nhân thơm của arene
1.1.4.2. Từ hydrocarbon- Phản ứng cộng
Để tạo ra dẫn xuất monohalogen ta dùng tác nhân phản ứng là HX (HBr,
HCl, HI), để điều chế dẫn xuất đihalogen ta dùng tác nhân phản ứng là X2 hoặc X-X’ (ICl, IBr, BrCl..)
a. Cộng vào cyclopropane Br2 Br-CH -CH -CH -Br CCl 2 2 2 4 HX CH -CH -CH X 3 2 2 b. Cộng vào alkene Br (1) CH (95%) 3-CH-CH3 kh«ng cã oxi H3C C CH2 + HBr H (2) CH (5%) 3-CH2-CH2-Br
c. Cộng vào alkadiene liên hợp và alkyne tothÊp CH céng-1,2 2-CH-CH=CH2 12 Br Br CH + Br 2=CH-CH=CH2 2 t0cao CH céng-1,4 2-CH=CH-CH2 Br Br -800C CH céng-1,2 3-CH-CH=CH2 Br CH2=CH-CH=CH2 + HBr 400C CH céng-1,4 3-CH=CH-CH2 Br
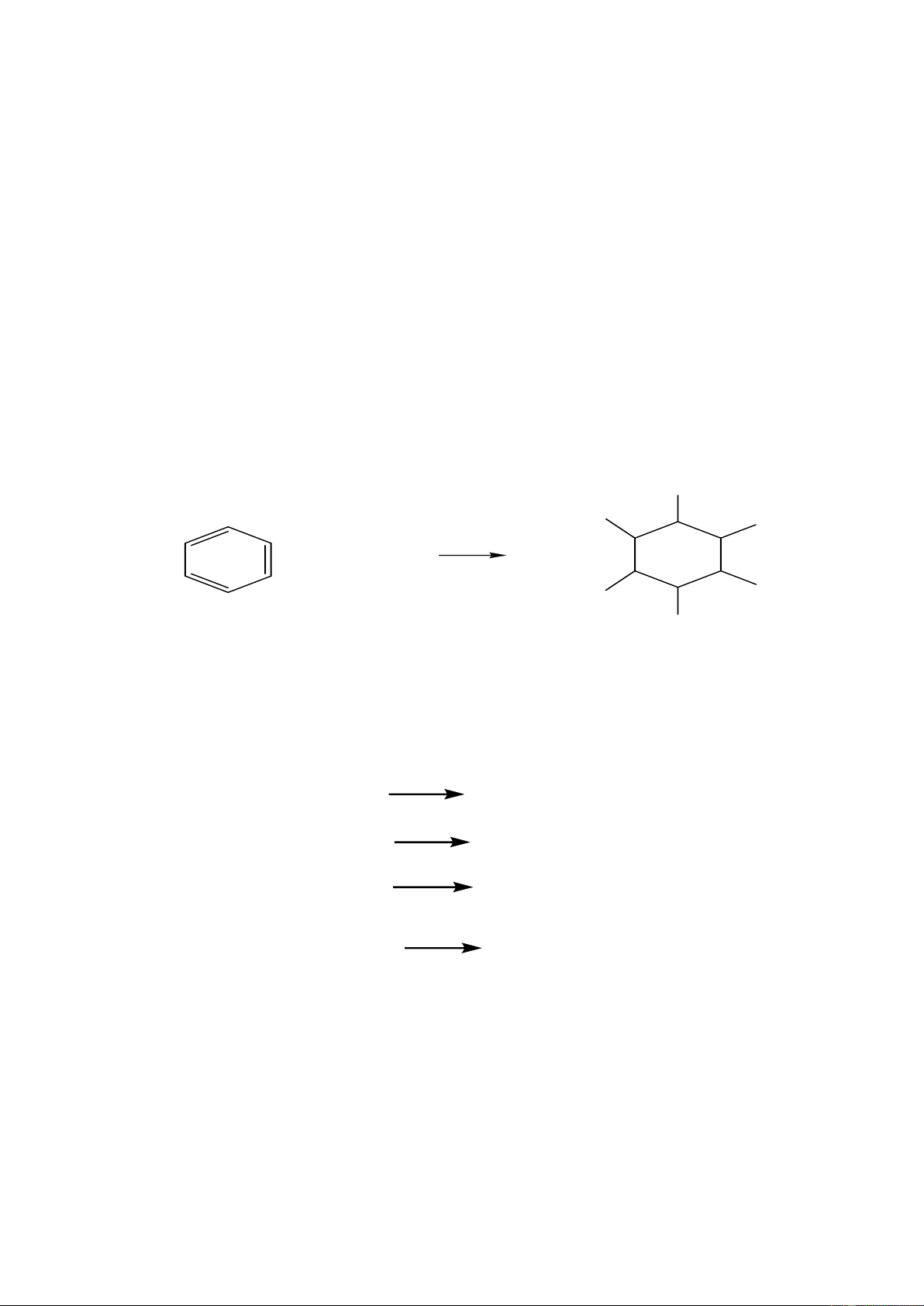
d. Cộng vào vòng thơm của arene Cl Cl Cl h + 3Cl2 500C Cl Cl Cl
1.1.4.3. Từ alcohol- Phản ứng thế
Đun nóng alcohol với HX (HCl, HBr, HI) có mặt ZnCl2 khan, alcohol sẽ chuyển thành RX tương ứng: ZnCl2 R-OH + HX R-X + HOH t0 RCl + PCCl R-OH + PCl5 3 + HCl 3R-OH + PI3 3RI + H3PO3 piridin R-OH + SOCl2 R-Cl + SO2 + HCl 1.2. Alcohol
1.2.1 Khái niệm, danh pháp 1.2.1.1. Khái niệm
Alcohol là những hợp chất hữu cơ trong phân tử có chứa nhóm hydroxy (-
OH) liên kết với nguyên tử carbon.
Alcohol no, đơn chức, mạch hở trong phân tử có một nhoms –OH liên kết
với gốc alkyl, có công thức tổng quát là CnH2n+1OH (n ≥ 1). 13
Ví dụ: CH3-OH; CH3-CH2-OH; ...
Nếu alcohol có hai hay nhiều nhóm –OH thì các alcohol đó được gọi là các
alcohol đa chức (polyalcohol).
Ví dụ: HO-CH2-CH2-OH; HO-CH2-CH(OH)-CH2-OH; ...
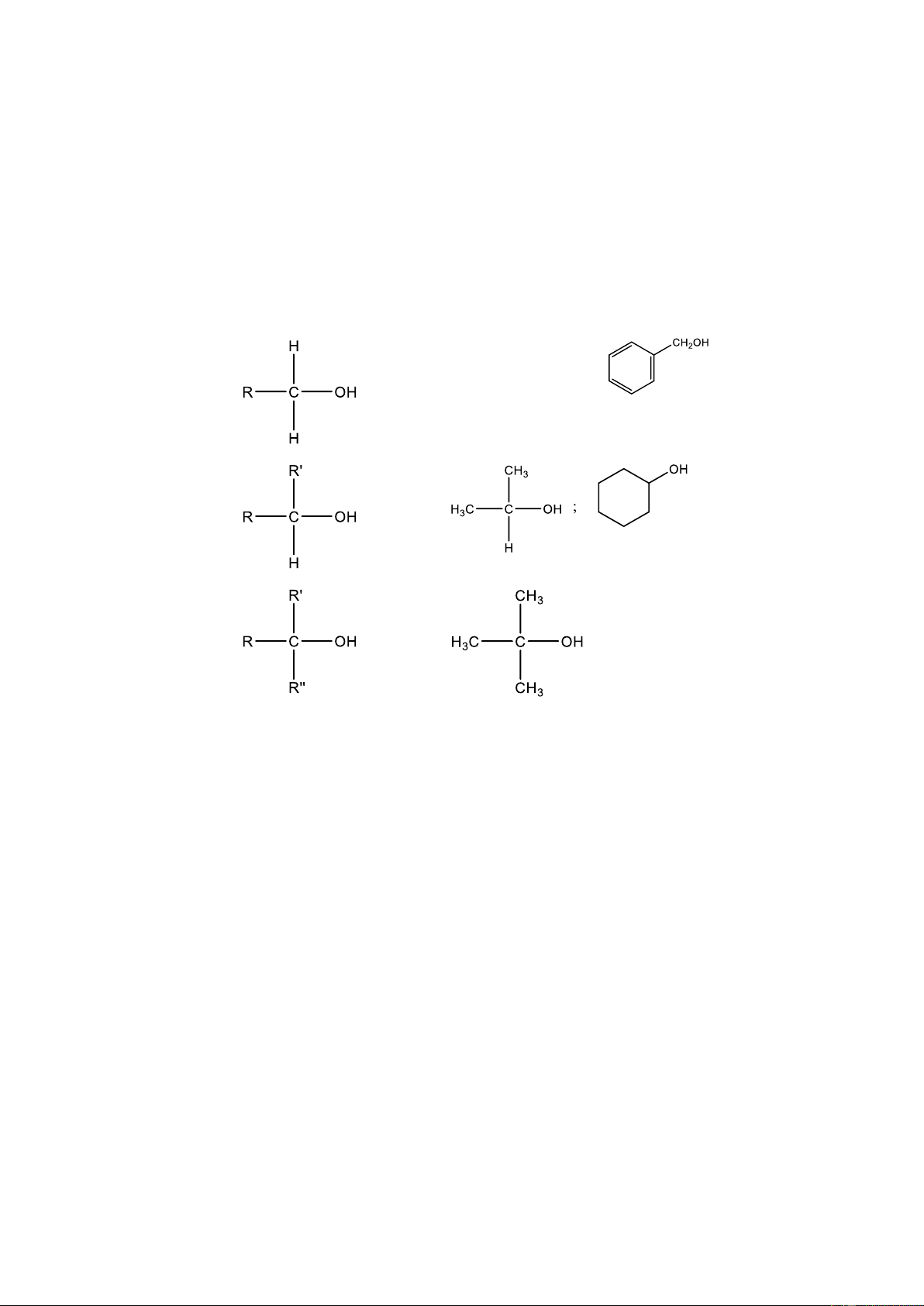
Bậc của alcohol là bậc của nguyên tử carbon liên kết với nhóm hydroxy. Ta
có alcohol bậc I, alcohol bậc II và alcohol bậc III (Bảng 3.1) Alcohol Công thức tổng quát Ví dụ Bậc I CH3-CH2-OH; Bậc II Bậc III
(R, R’, R’’ là các gốc hydrocarbon) 1.2.1.2. Danh pháp
- Tên theo danh pháp thay thế của monoalcohol:
Tên hydrocarbon (bỏ e ở cuối)- vị trí nhóm –OH – ol
- Tên theo danh pháp thay thế của polyalcohol:
Tên hydrocarbon - vị trí nhóm –OH – độ bội nhóm –OH-ol Chú ý:
+ Nếu nhóm –OH chỉ có một vị trí duy nhất thì không cần số chỉ vị trí nhóm –OH.
+ Chọn mạch C dài nhất có nhóm OH và chứa cả liên kết kép.
+ Đánh số thứ tự từ phía gần nhóm OH hơn
+ Nếu mạch carbon có nhánh thì cần thêm tên nhánh ở phía trước. 14
+ Nếu có nhiều nhóm –OH thì cần thêm độ bội (di, tri, ...) trước ol và giữ nguyên tên hydrocarbon. Ví dụ:
Bảng 1.2. Tên theo danh pháp thay thế và tên thông thường của một số alcohol Công thức cấu tạo
Tên theo danh pháp thay thế Tên thông thường CH3OH Methanol Methyl alcohol CH3CH2OH Ethanol Ethyl alcohol CH3CH2CH2OH Propane-1-ol Propyl alcohol Propane-2-ol Isopropyl alcohol Ethane-1,2-diol Ethylene glycol Propane-1,2,3-triol glycerol
1.2.2. Đặc điểm cấu tạo
Trong phân tử alcohol, các liên kết O-H và C-O đều phân cực về phía nguyên
tử oxygen do oxygen có độ âm điện lớn δ+ δ- δ+ Vì vậy, trong các ph R ả n ứng C hóa O h ọc, al
H c ohol thường bị phân cắt ở liên kết O- H hoặc liên kết C-O.
1.2.3. Tính chất vật lí 15