
Preview text:
PHỤC LỤC ĐỀ THI HỌC PHẦN HÓA ĐẠI CƯƠNG
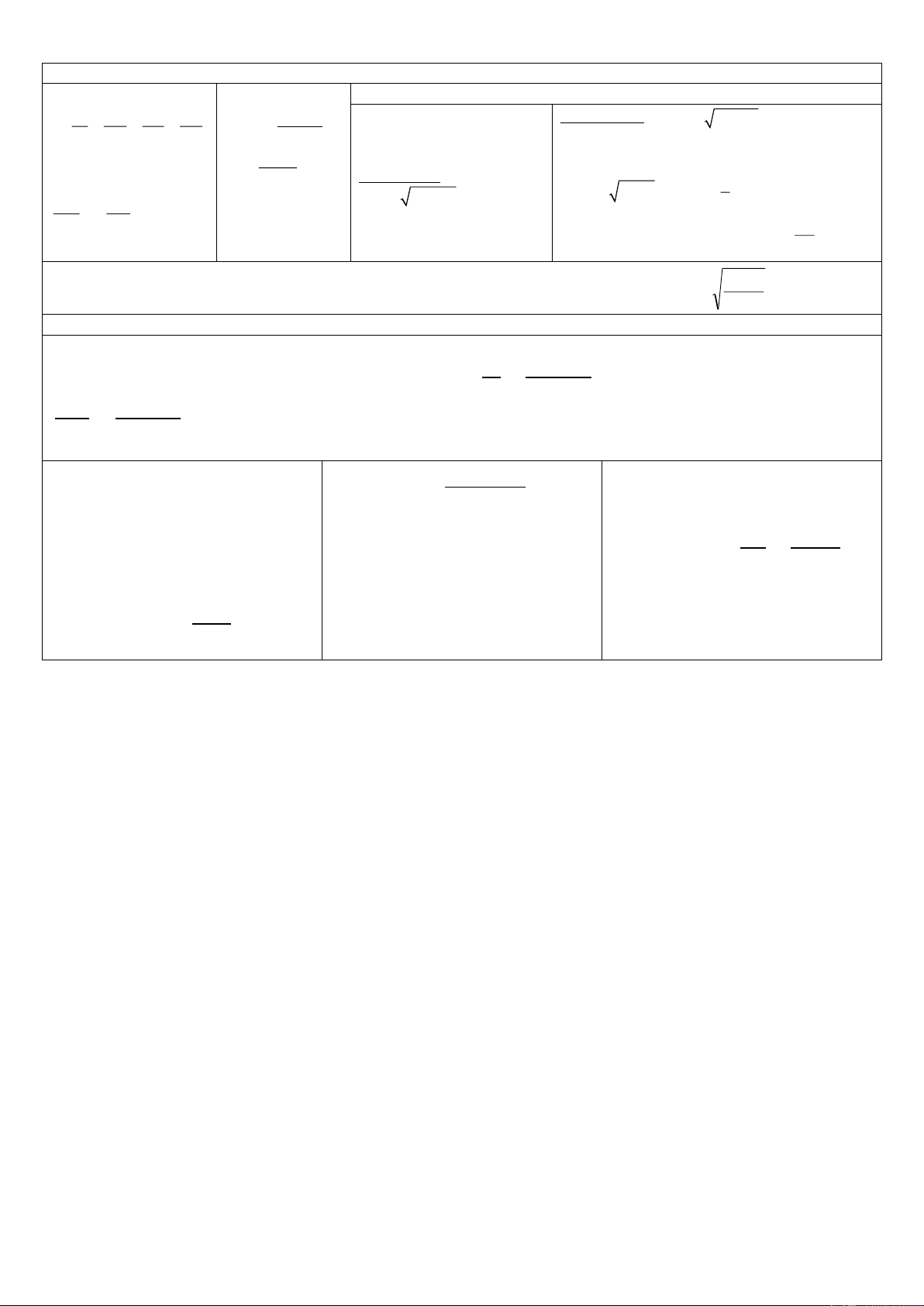
PHỤ LỤC 1. CÁC CÔNG THỨC
NHIỆT ĐỘNG LỰC HỌC CỦA QUÁ TRÌNH HÓA HỌC Số Avogadro NA = 6,022×1023 Phương trình khí lý PV = nRT tưởng Hằng số khí R 0,082 L.atm.mol–1.K–1 Năng lượng tự do Gibbs: G = H – TS 8,314 J.mol–1.K–1
Biến thiên NL Gibbs:
∆𝑟𝐺 = ∆𝑟𝐻 − 𝑇∆𝑟𝑆
1,987 cal.mol–1.K–1 0 °C 273 K Cân bằng hóa học.
Xét phản ứng: aA + bB ⇌ cC + dD 1 N = 1 kg.m-2.s-1 1 eV = 1,602×10-19 J 𝛥 𝑐 𝑑 𝑟𝐺𝑜 = - RTlnK𝑃 𝑃 .P 𝐾 𝐶 𝐷 𝑃 = ( ) 𝑃𝑎 𝑏 𝐴 .P𝐵 cb 1 atm = 1,013×10-5 Pa (s) _ rắn, 𝑄 𝐶𝑐.C𝑑 𝛥 𝑃 𝐶 𝐷 (l) _ lỏng 𝑟G = RTln 𝐾 𝐾𝐶 = ( ) 𝑃 𝐶𝑎.C𝑏 (g) _ khí hoặc hơi 𝐴 𝐵 𝑐𝑏 n 𝑃𝑐.P𝑑 với i C = i 𝑄 𝐶 𝐷 V 𝑃 = ( ) 𝑃𝑎 𝑏 𝐴 .P𝐵 Tốc độ phản ứng: 1 dCA 1 dCB 1 dCC 1 dCD v = − = − = + = +
Xét phản ứng: aA + bB → cC + dD a dt b dt c dt d dt Bậc 1 𝑣 = kC Bậc 2 𝑣 = 𝑘𝐶2 1 𝐶 1 1 1 𝑘 = 𝑙𝑛 𝑜 𝑘 = ( − ) 𝑡 𝐶 𝑡 𝐶 𝐶𝑜 1 ln2 0,693 𝑡1/2 = 𝑡1/2= = 𝑘𝐶 𝑘 𝑘 𝑜 𝑘 𝐸 1 1 Phương trình Arrhenius 𝐸 2 𝑎 𝑎 𝑘 = 𝐴𝑒−𝑅𝑇 ln = − ( − ) 𝑘1 𝑅 𝑇2 𝑇1
NỒNG ĐỘ DUNG DỊCH (V: mL; m: g)
1. N. độ phần trăm khối 2. N.độ phần trăm thể 3. Nồng độ g/L: 4. Nồng độ mol CM: lượng: tích: m n m m .d t C = .1000 t t t C = .1000 = .1000 = .1000 m m V g/L M t t V C% = .100 = .100 t C% = .100 V M.V M.mdd m V.d V dd
5. Nồng độ đương lượng CN: 6. Nồng độ molan:
7. Nồng độ phần mol: Ni= N1 + N2 + N3 +….= 1 𝑛 𝑚 𝐶 𝐸 𝑡.𝑧 n m n n 𝑁 = .1000 = .1000; 𝑉 M.V t t C = .1000 = .1000 N = i = i 𝑚 𝑀 m m M.m i n + n + n + ... + n + ... n 1 2 3 i 𝑛 dm dm i 𝐸 = ; 𝐸 = 𝐸 𝑧
8. Quan hệ giữa CM và C% kl:
9. Quan hệ giữa CN và C% kl: 10. Quan hệ giữa CM và 11. Nồng độ Cm và Ni: C%.10.d C%.10. . z d C 𝐶 N: 𝑚 C = C = 𝑁 M N 𝑖 = M M 1000 𝐶 C 𝑚 + N = CM.z 𝑀dm 12. Pha chế dung dịch: C .V.M C .V.M Từ chất lỏng đ.đặc:
Từ dd có nồng độ cao: C1V1=C2V2 Từ chất rắn: N M m = = c 10.P.z 10.P C .V.M C .V.M
(Không áp dụng với các nồng độ N M V = = f 10.C.d.z 10.C.d C%kl, Ni,Cm)
TÍNH CHẤT VẬT LÝ CỦA DUNG DỊCH LOÃNG CHỨA CHẤT TAN KHÔNG BAY HƠI, KHÔNG ĐIỆN LY 1. Áp suất thẩm thấu: 2. Áp suất hơi bão hòa
3. Nhiệt độ sôi, nhiệt độ đông đặc n Δt 𝑜=K Π=C RT= .RT P - P P ; m ΠV=nRT= .RT o = = N ; 𝑠 = t𝑠 − t𝑠 𝑠.C𝑚 M 𝑜 V M P P
Δt𝑑 = tđ − tđ =Kđ.C𝑚 0 o
(R= 22,4/273 0,082 L.atm.K-1; T=273+toC) P = Po.No DUNG DỊCH ĐIỆN LY
1. Hệ số Van't Hoff (i): 2. và i , và K: Các công thức tính pH: ' ' ' ' Π ΔP Δt Δt 𝑖 − 1 𝐾 + Đơn base: - s đ [OH ]= K ×C i = = = = 𝛼 = 𝑊= [H+][OH-] b b Π ΔP Δt Δt 𝑚 − 1 pKa + pKb = pK s đ 𝑊 [OH-]2 + Kb[OH-] – KbCb = 0 2 ' = i = iC Cα pH = -lg[H+]
+ Muối có anion lưỡng tính HA- MRT; K= + Đơn acid: t' = it = iKC (1-α) m ; 1 + + ΔP' ΔP H [ ]= K ×C [H ]= K K pH= (pK +pK ) 1 2 1 2 = a a 2 i = .N i P P [H+]2 + Ka[H+] – KaCa = 0 C 0 0 + Dung dịch đệm: pH = pK a a – lg Cb m+n Tích số tan và độ tan K : A = sp mBn ⇌ mAn+ +nBm- n+ m m- n m n (m+n) K [A ] [B ] =m n S = sp S m n m n ĐIỆN HÓA HỌC
Xét phản ứng oxi hóa khử tổng quát: aA + bB ⇌ cC + dD 𝑅𝑇 [𝐴]𝑎×[𝐵]𝑏
Sức điện động được xác đinh theo phương trìnht: E = E𝑜 + 𝑙𝑛 hoặc E = E𝑜 + 𝑛𝐹 [𝐶]𝑐[𝐷]𝑑 0,059 [𝐴]𝑎×[𝐵]𝑏 𝑙𝑔 𝑛 [𝐶]𝑐[𝐷]𝑑
E = (+) − (−) ; E𝑜 = o(+) − o(−)
G = –nFE và Go = –nFEo 𝐴 × 𝐼 × 𝑡
Đối với quá trình điện cực tổng quát: Với
n – số e trao đổi trong phản m = 𝑛. 𝐹
aOx + ne ⇌ bKh ứng;
m – Lượng chất tạo thành hay hòa tan Phương trình Nernst:
F – hằng số Faraday (96485 C/mol). ở điện cực (gam) 𝑅𝑇 [𝑂𝑥]𝑎 Go = –RTlnK φ = φ𝑜 + 𝑙𝑛 C A – nguyên tử gam 𝑛𝐹 [𝐾ℎ]𝑏 Với
R – Hằng số khí (8,314 n – hóa trị của chất biến đổi J/mol.độ)
I – cường độ dòng điện (Ampe) 𝐧𝐅𝐄𝐨 𝐥𝐧𝑲
t – thời gian dòng điện chạy qua chất 𝐂 = 𝐑𝐓 điện ly (giây)
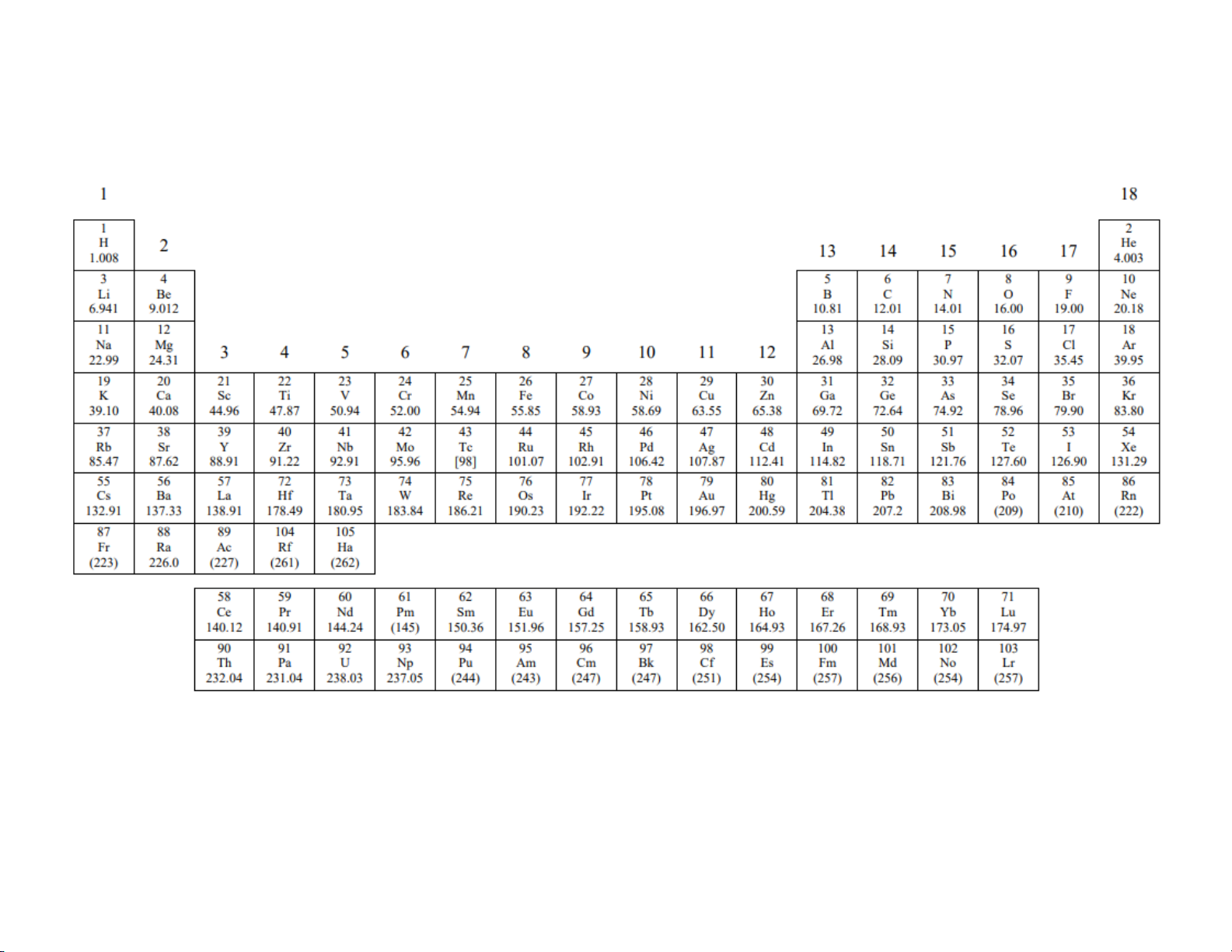
PHỤ LỤC 2. BẢNG HỆ THỐNG TUẦN HOÀN CÁC NGUYÊN TỐ HÓA HỌC



