




Preview text:
VẬT LIỆU KỸ THUẬT ĐIỆN Presented by PHAM THANH CHUNG 1 Introduction ★ Pham Thanh Chung
★ School of Electrical Engineering.
★ Hanoi University of Science and Technology.
★ Email: chung.phamthanh1@hust.edu.vn ★ Phone: 0912021209 2
Kiến thức cần thiết ★ Vật lý I, II, ★ Hóa học
★ Lý thuyết trường
Tài liệu học tập
★ Giáo trình VLKTĐ- PGS.TS.Nguyễn Đình Thắng
★ Vật lý chất rắn- Nguyễn Thị Bảo Ngọc 3 Schedule
★ PHẦN 1 VẬT LIỆU ĐIỆN
• Chương 1. Cấu tạo của vật chất.
• Chương 2. Vật liệu dẫn điện
• Chương 3. Vật liệu bán dẫn
• Chương 4. Vật liệu từ
• Chương 5. Vật liệu siêu dẫn
★ PHẦN 2 VẬT LIỆU ĐIỆN MÔI
• Chương 6. Các quá trình điện lý của điện môi
• Chương 7. Các đặc tính cơ-lý-hóa của điện môi
• Chương 8. Vật liệu điện môi
• Chương 9. Điện môi khí
• Chương 10. Điện môi lỏng
• Chương 11. Điện môi rắn
• Chương 12. Cách điện dùng trong các thiết bị điện 4 Giới thiệu chung
Muc đích của môn học:
Thông qua môn học này, hiểu được tính chất và đặc
điểm của các vật liệu: Vật liệu dẫn điện
Vật liệu bán dẫn điện Vật liệu từ Vật liệu siêu dẫn Vật liệu cách điện
Học để trả lời - Vì sao nó cách điện?
- Vì sao nó dẫn điện?
- Vì sao nó dẫn từ…? 5 Giới thiệu chung
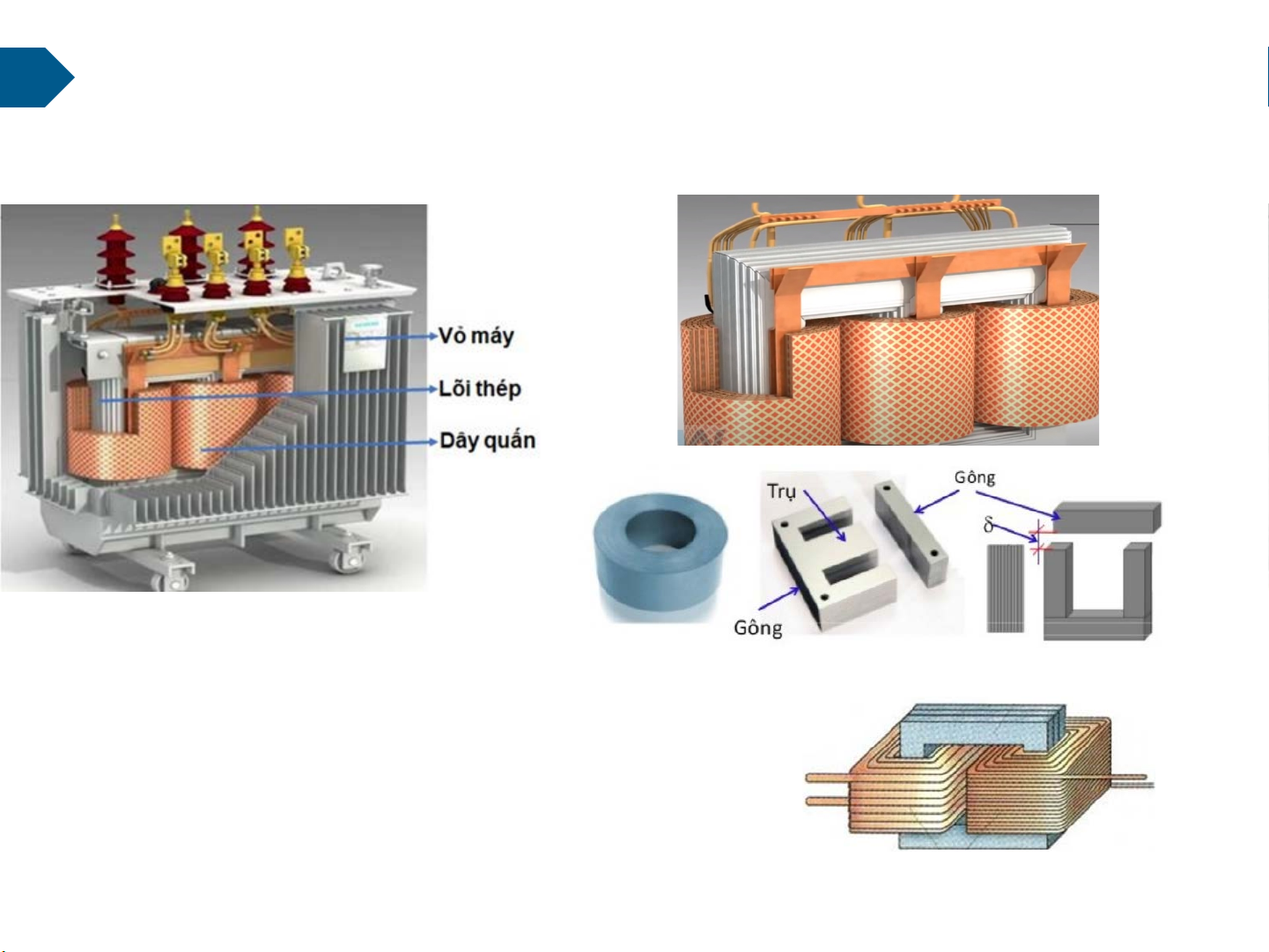
Tại sao phải sử dụng các loại vật liệu khác nhau? Cấu tạo của MBA Lõi thép (mạch từ)
Lõi thép: Fe, thép, tôn silic, titan… Dây quấn: Cu
Vỏ: Nhựa, gỗ, thép, gang hoặc tôn mỏng
Cách điện: Sứ ra của dây quấn cao áp và dây quấn hạ áp
Ê may, phủ sơn cách điện, giấy dầu, tơ cách điện…. Dầu máy biến áp.. Dây quấn 6 Giới thiệu chung
Cách chúng liên kết lại với nhau để tốt hơn?
VD: Sắt (Fe) bình thường dẫn điện tốt
Nếu trộn thêm Carbon (C) → thép cacbon (cacbua sắt Fe3C)
Nếu trộn thêm Silic (Si) → thép silic (tôn silic) → dẫn điện tốt hơn
Nếu trộn thêm Crôm (Cr)→ thép không gỉ Fe Tôn silic Thép mạ Crôm 7
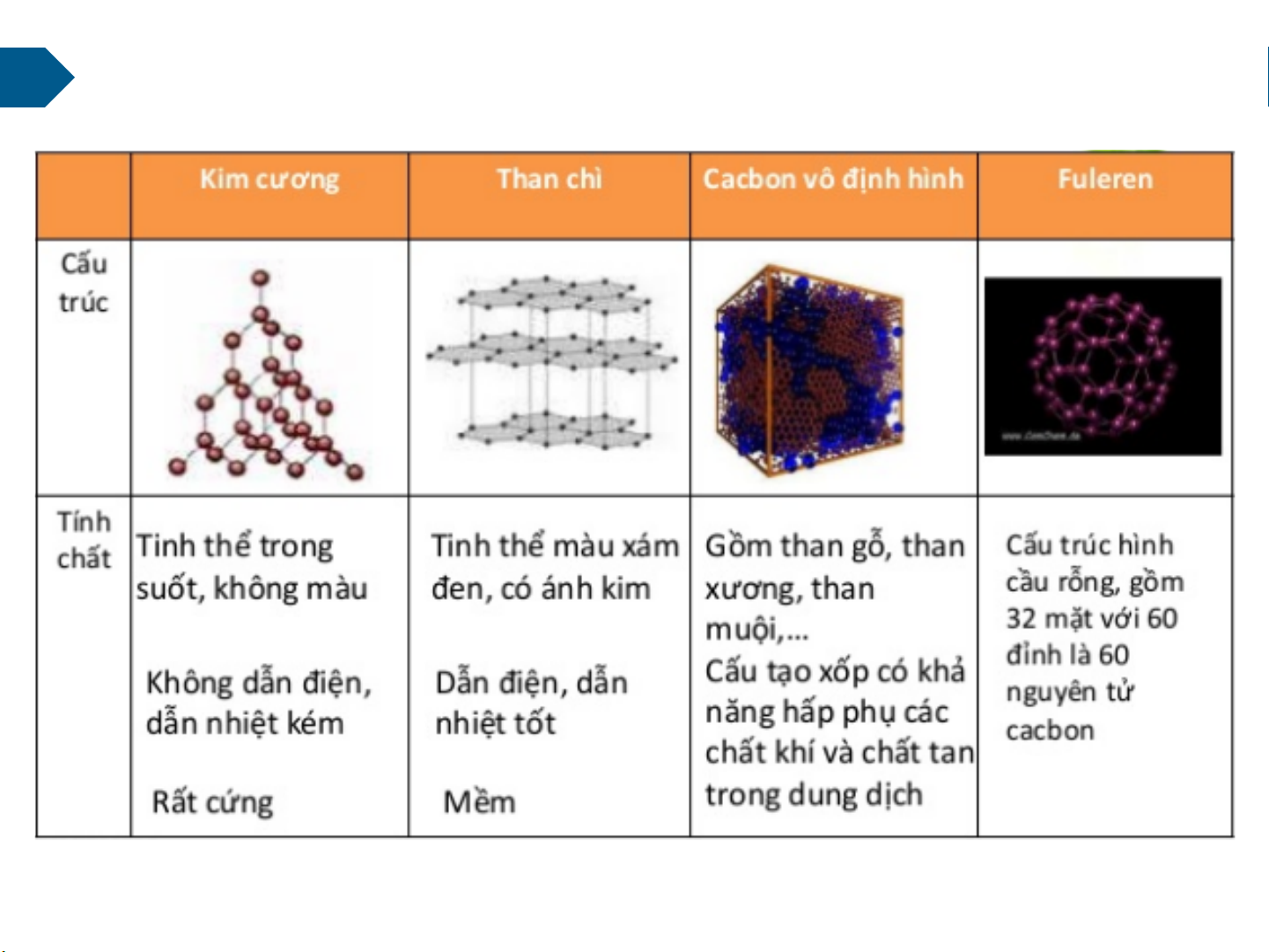
Cấu trúc tinh thể sắp xếp khác nhau?
Một số dạng đặc thù của Cacbon (C) 8
Cấu trúc tinh thể sắp xếp khác nhau?
Một số dạng đặc thù của Cacbon (C)
CaCO3 (hàng triệu n/tử →viên phấn) 9 Giới thiệu chung
Lịch sử phát triển của khoa học vật liệu
★ Loài người thông minh ∼35 nghìn năm (thời kỳ đồ đá):
sử dụng gỗ, đá, da để săn bắn, hái lượm và trồng trọt.
★ Chữ viết & số học:3000 năm TCN (nền văn minh Ai Cập
cổ đại – dọc dòng sông Nile)
★ Thuyết đầu tiên về KHVL cửa Empedocles (Hy Lạp)
∼450 TCN – Khởi nguồn lý thuyết vũ trụ của 4 nguyên
tố (gốc rễ) nước, đất, kk và lửa →tạo ra tất cả cấu trúc TG.
★ ∼420 TCN, Leucippe- ptriển cấu tạo nguyên tử đầu tiên.
Trong T/học: cho rằng cái tồn tại (ng tử) tồn tại, nhưng
cái không tồn tại (chân không) cũng tồn tại…
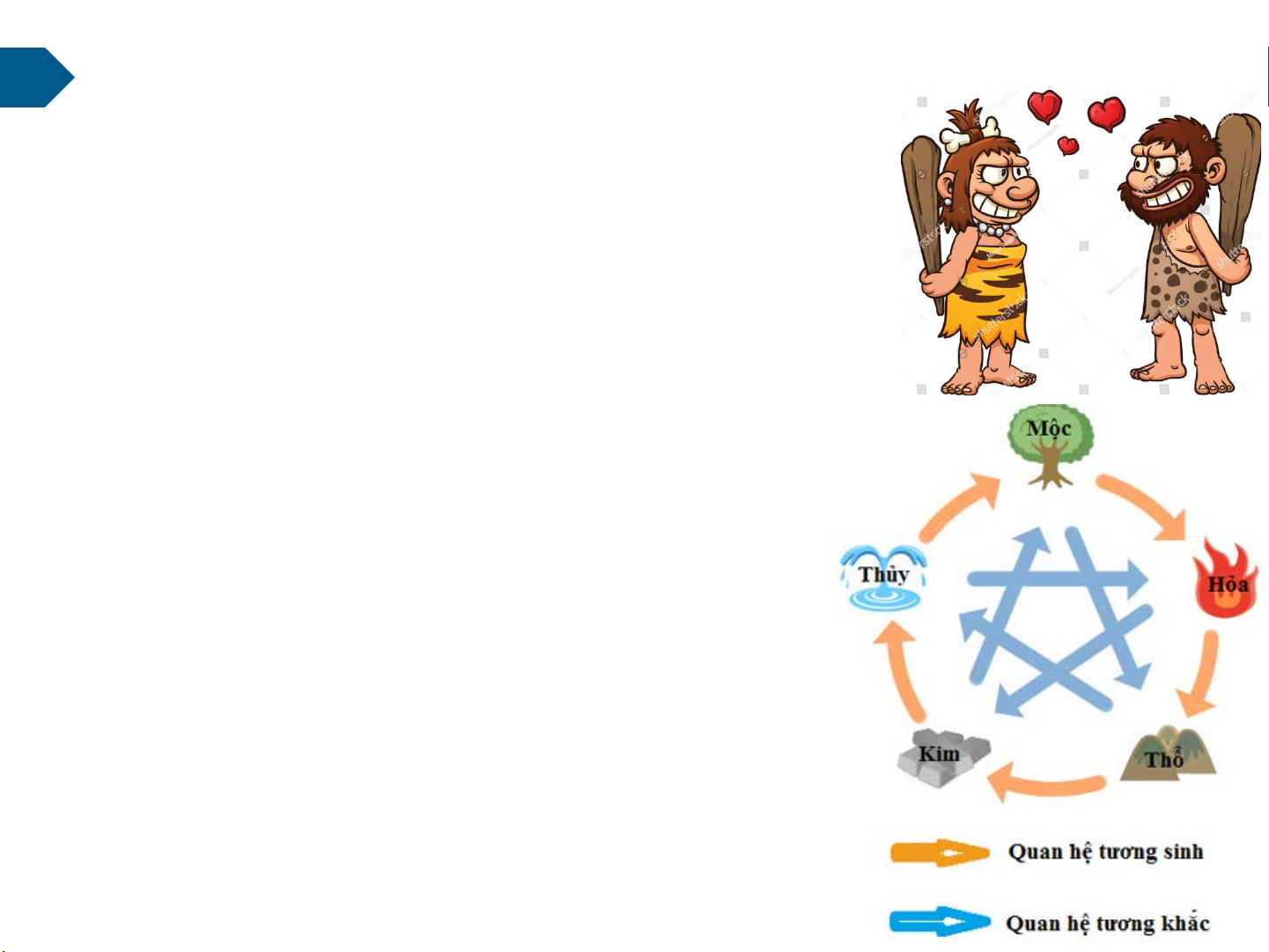
★ Trong T/học Trung Hoa, tất cả vạn vật đều phát sinh từ
5 ng tố cơ bản: Kim, Mộc, Thủy, Hỏa,Thổ (thời nhà Chu,
T/kỷ 12 TCN ÷256 TCN) 10
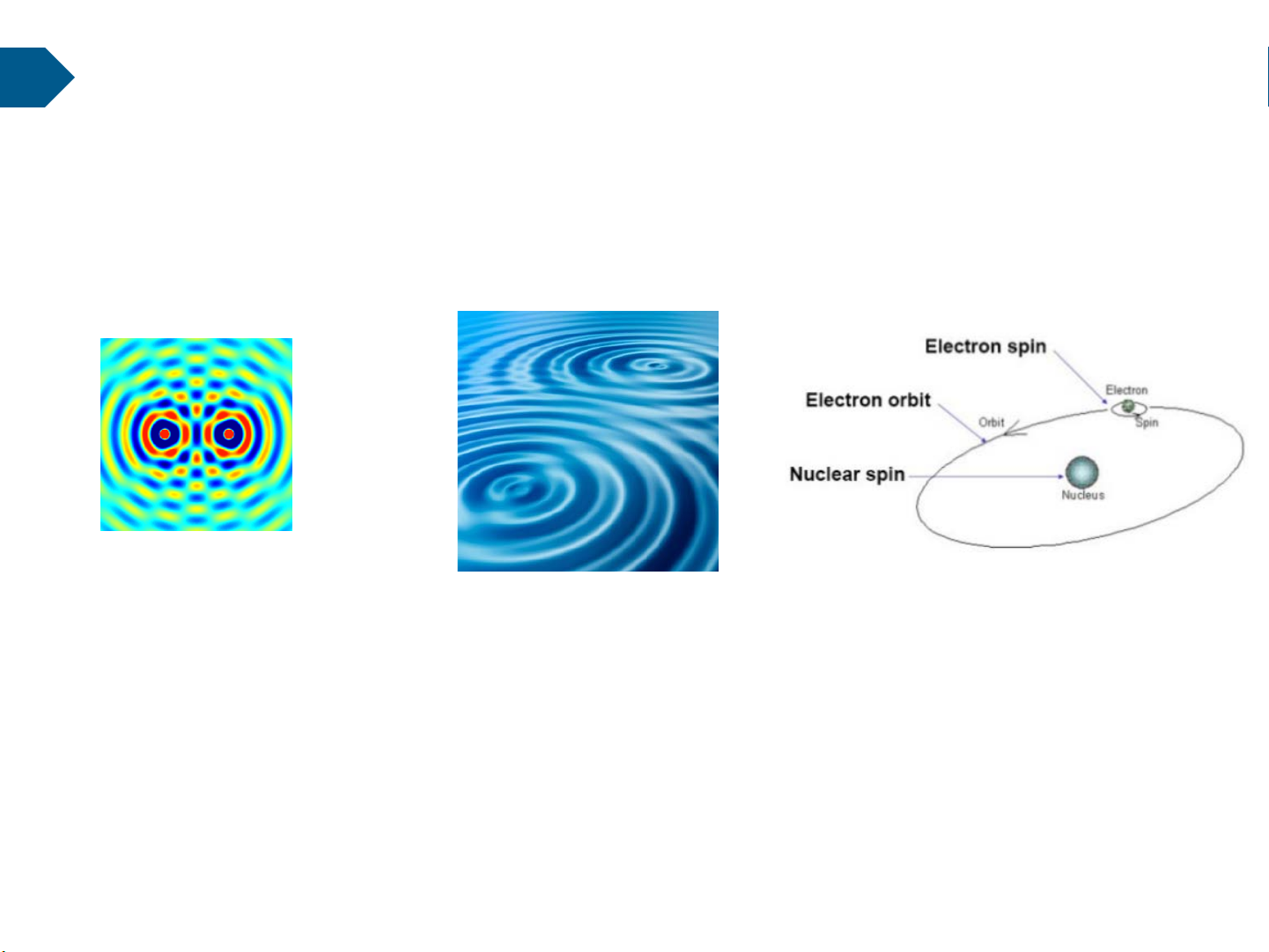
Chương 1. Cấu tạo của vật chất
1. Cấu tạo của nguyên tử.
1.1. Mô hình nguyên tử BORH
Nguyên tử là phần tử nhỏ nhất có thể
nhìn thấy được (tuy nhiên không phải nhỏ
nhất là không thể phân chia được)
Bất kỳ nguyên tử nào cũng được cấu tạo:
-Hạt nhân mang điện tích (+)
-Các điện tử (electron) mang điện tích (-) chuyển động xung quanh hạt nhân
theo 1 quĩ đạo nhất định.
Các nguyên tử khác nhau ở chỗ: Hạt nhận to hay bé Điện tử nhiều hay ít
(nhiều nguyên tử chỉ tồn tại trong t/g rất ngắn)
(Trong bẳng tuần hoàn có hơn 100 nguyên tử) 11
Chương 1. Cấu tạo của vật chất
1.1. Mô hình nguyên tử BORH
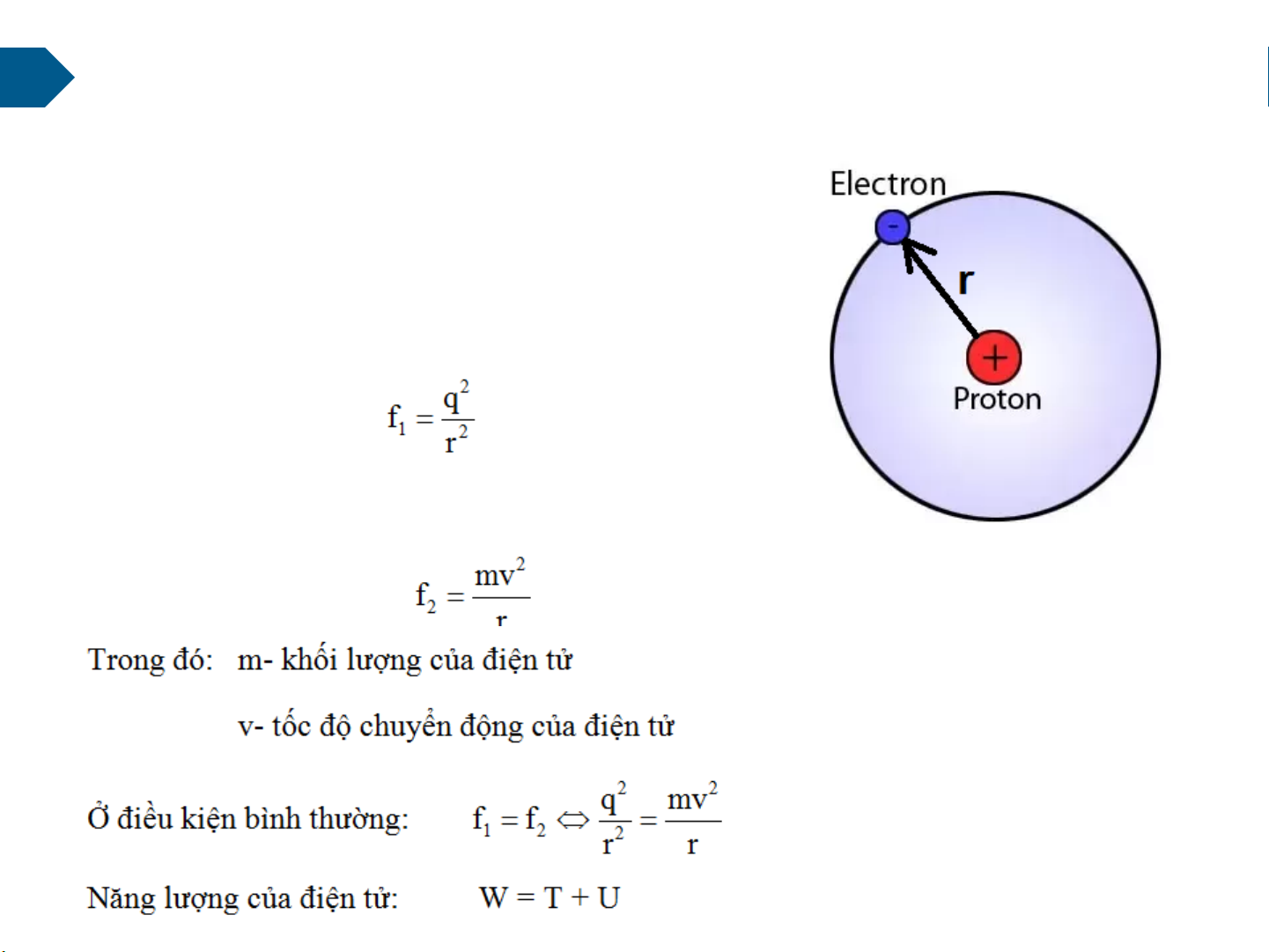
Giữa hạt nhân và e có quan hệ ?
Khi điện tử chuyển động trên quỹ đạo tròn bán
kính r xung quanh hạt nhân thì điện tử sẽ chịu lực hút của hạt nhân f1:
Lực hút f1 sẽ được cân bằng với lực ly tâm trong quá trình chuyển động: 12 2 q 2r
Chương 1. Cấu tạo của vật chất .
1.1. Mô hình nguyên tử BORH
Giữa hạt nhân và e có quan hệ ?
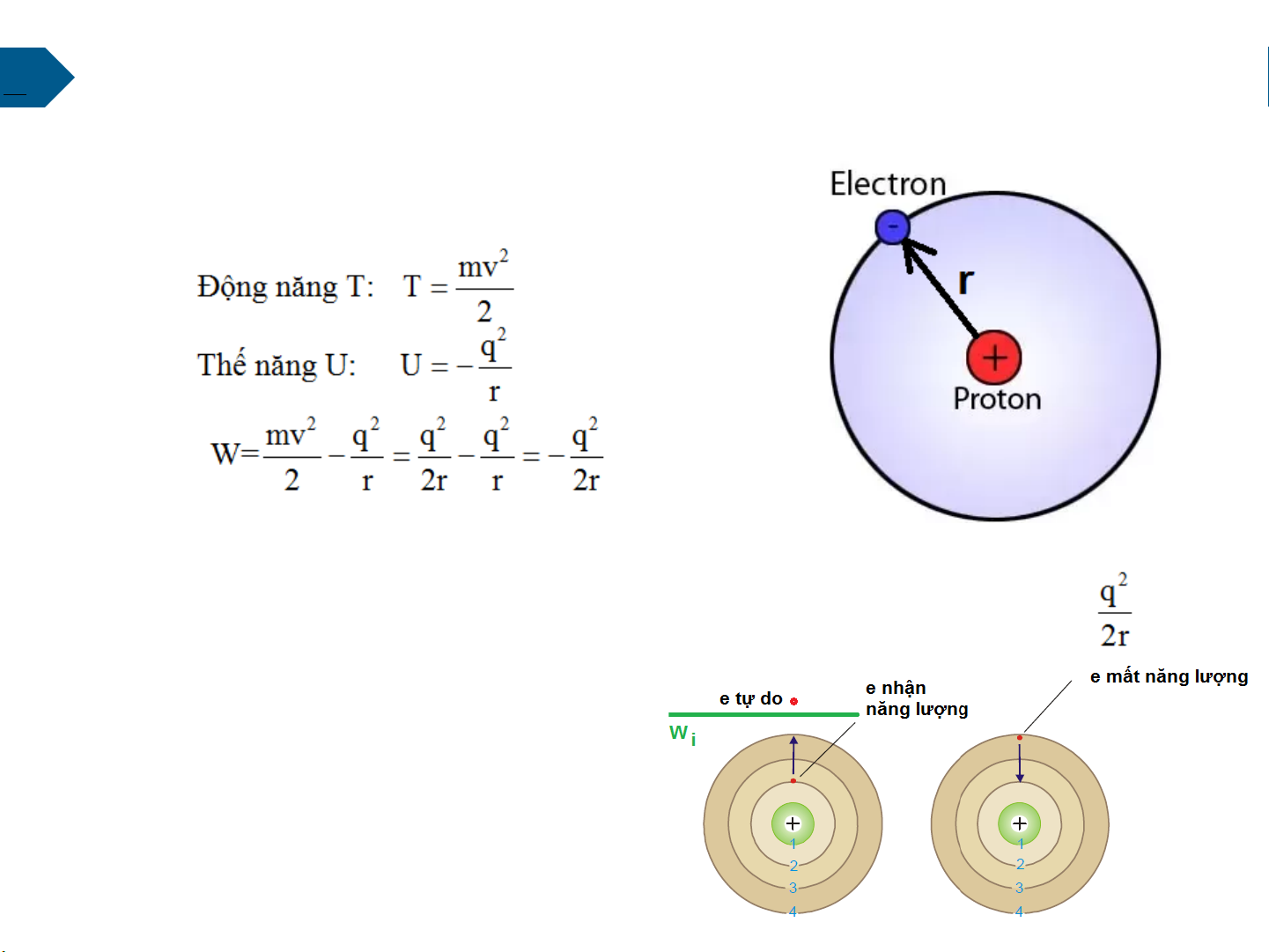
Để di chuyển điện tử từ quỹ đạo chuyển động bán kính r ra xa vô cùng
cần phải cung cấp cho nó một năng lượng lớn hơn hoặc bằng
Năng lượng ion hóa (Wi)
Năng lượng tối thiểu cung cấp cho điện
tử để điện tử tách rời khỏi nguyên tử trở thành điện tử tự do 13
Chương 1. Cấu tạo của vật chất
Yếu điểm của mô hình?
Mô hình nguyên tử Borh không giải thích được:
-Vì sao các e cđ trong cùng 1 quỹ đạo xq hạt nhân?
-Có nguyên tử sáng hơn nguyên tử khác?
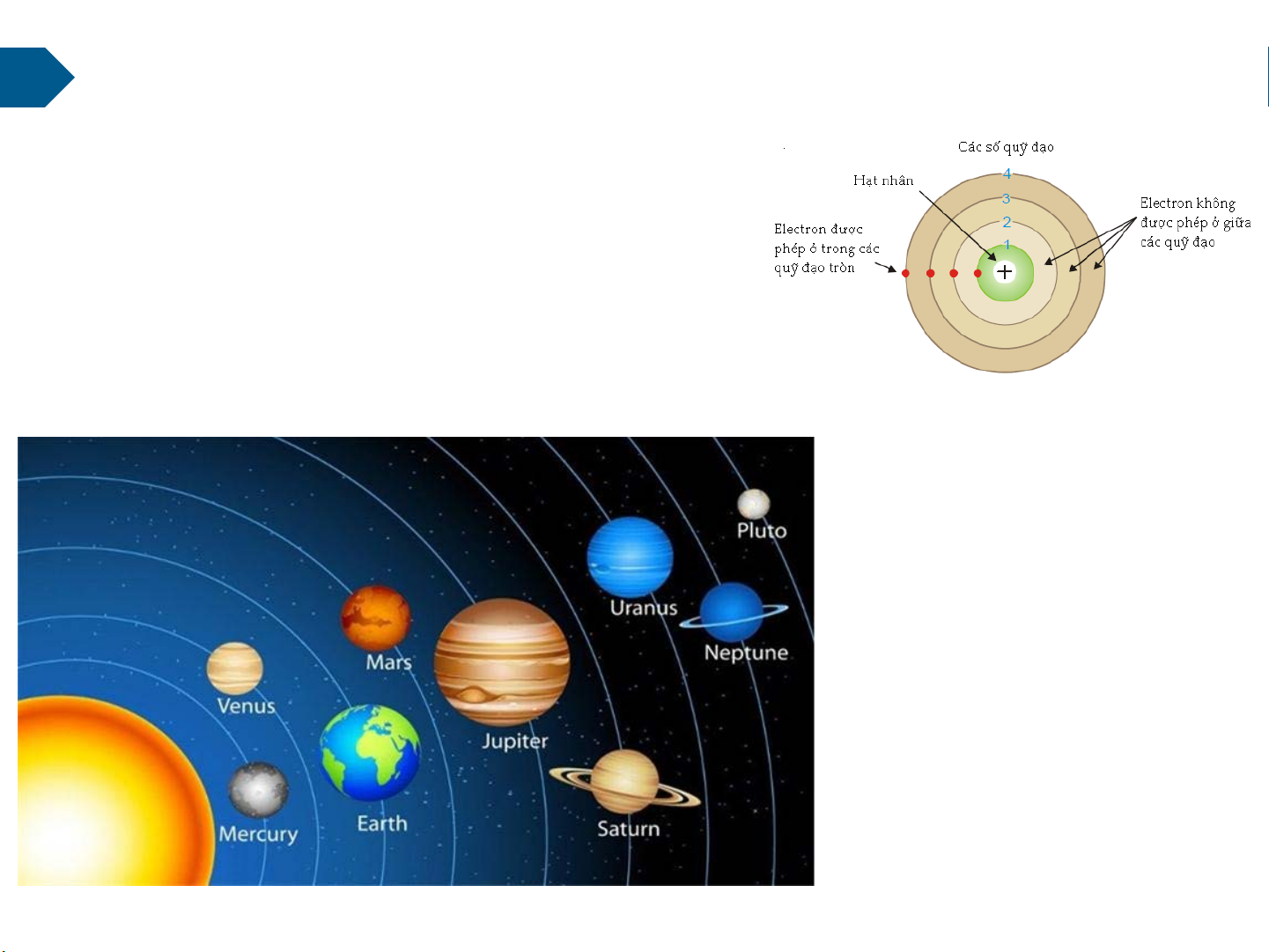
Các mức năng lượng của e là gián đoạn: -Khi e còn nằm trong a/hg
của hạt nhân, e chỉ được
phép c/đ sang các quỹ đạo
1,2,3..(ko thể là 1.5, 2.5.. ko liên tục)
- Khi e di chuyển ra mức Wion
hóa có thể nhận bất kỳ mức NL nào. 14
Chương 1. Cấu tạo của vật chất
1.2. Thuyết cơ học lượng tử
Theo Borh: e có tính hạt (quan tâm đến bán kính & khoảng cách)
2 e đập vào nhau →không to hơn
Lượng tử: e có tính hạt + sóng (quan tâm đến không gian và thời gian)
Có 4 số lượng tử (n, l, m, ms)
-Số lượng tử chính n với các giá trị 1, 2, 3 …xác định kích cỡ quỹ đạo (orbit) của điện
tử và năng lượng của nó.
- Số lượng tử orbital l (hay còn gọi là số lượng tử mômen góc quỹ đạo) mô tả
mômen góc của chuyển động quỹ đạo.
- Số lượng tử từ m mô tả thành phần của mômen góc quỹ đạo l theo một phương
nhất định, còn gọi là phương lượng tử hóa. Đa số các trường hợp phương lượng
tử hóa được chọn trùng với phương của trường ngoài.
- Số lượng tử spin ms mô tả thành phần của spin điện tử theo một phương nhất định,
thông thường là phương của trường đặt vào. 15
Chương 1. Cấu tạo của vật chất
2. Cấu tạo phân tử và các dạng liên kết
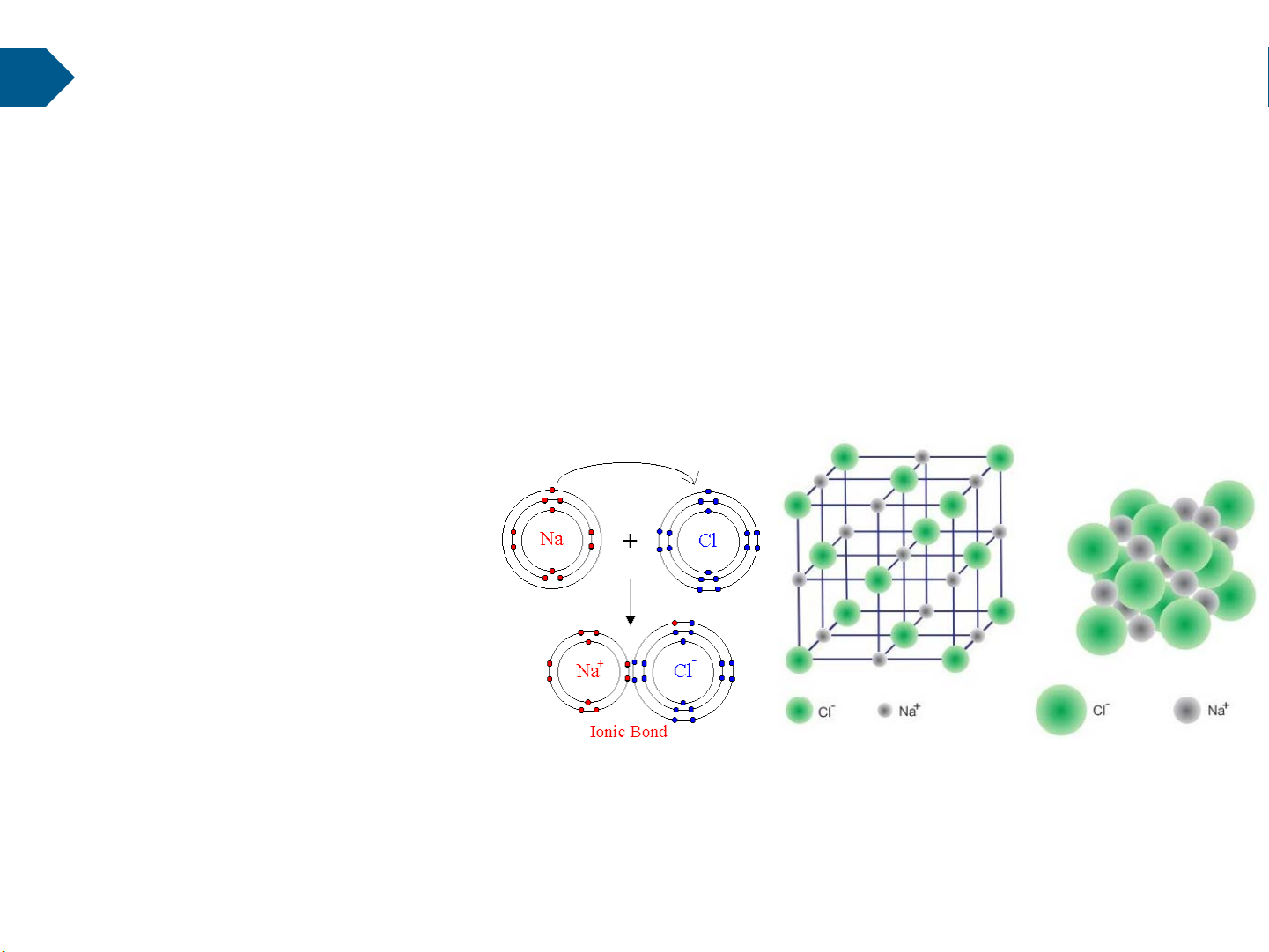
Phân tử được cấu tạo bởi mối liên kết giữa các nguyên tử với nhau 2.1. Liên kết ion
Liên kết ion được xác lập bởi lực hút tĩnh điện giữa các ion (+) và các ion (-) trong
phân tử. Lực liên kết này là rất lớn nên là liên kết khá bền vững, có độ bền cơ học và
nhiệt độ nóng chảy cao. (ví dụ: Na+Cl- …)
Nguyên tử Na (stt11):cấu trúc 2/8/1 Nguyên tử Cl (stt17): 2/8/7
Trong tự nhiên, các nguyên tử luôn có
xu hướng (hoàn thiện) phải có đầy
đủ số điện tử ở lớp ngoài cùng (hoàn
hảo) → tồn tại lâu dài Cấu trúc liên kết
Mô hình mạng tinh thể NaCl ion clorua natri 16
Chương 1. Cấu tạo của vật chất
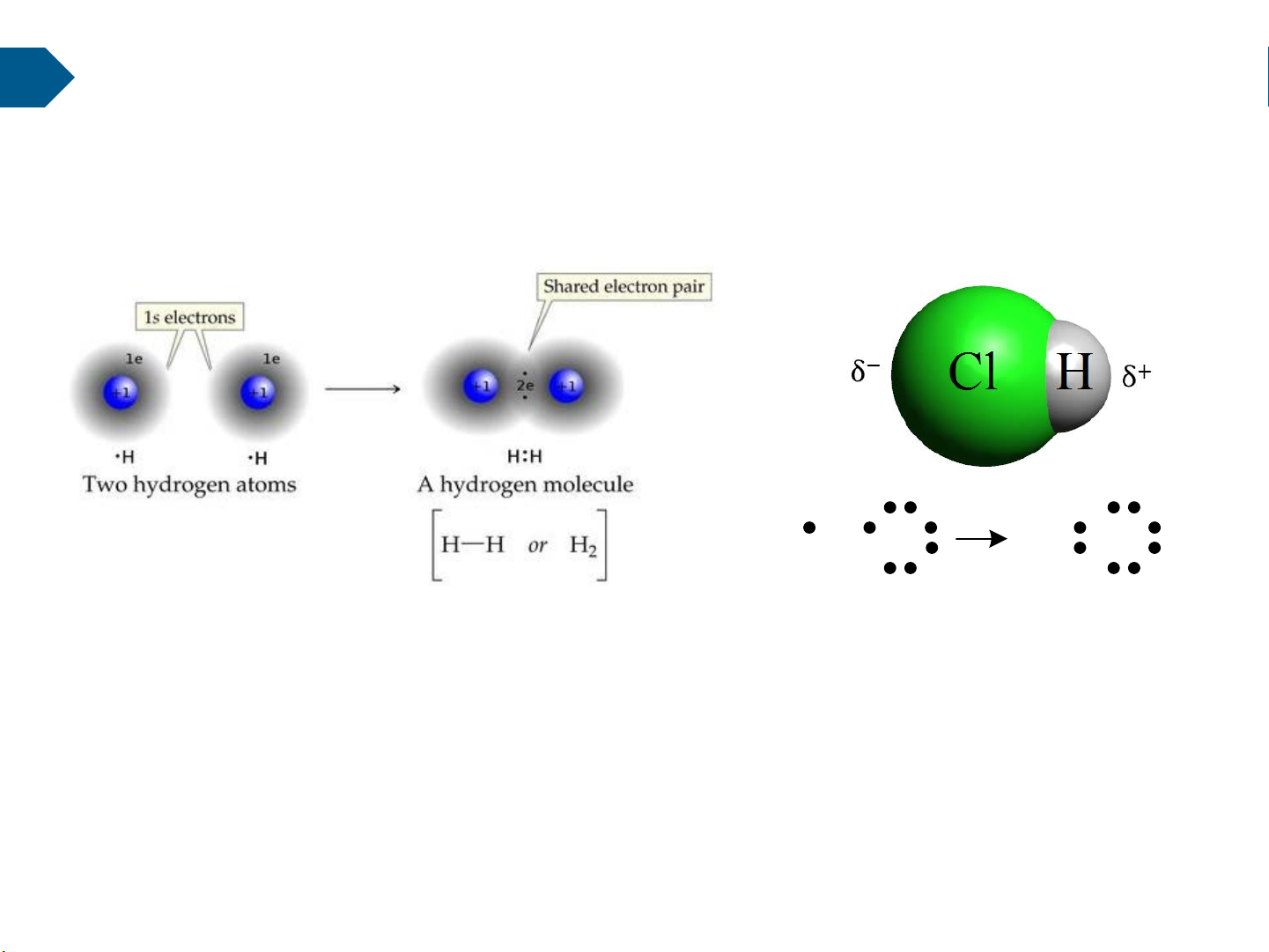
2.2. Liên kết cộng hóa trị
Liên kết cộng hoá trị được đặc trưng bởi sự dùng chung những điện tử của các nguyên tử trong phân tử. H + Cl H Cl
Tuỳ thuộc vào cấu trúc đối xứng hay không đối xứng mà phân tử liên kết đồng hoá
trị có thể là trung tính hay cực tính (lưỡng cực):
- Phân tử có trọng tâm của các điện tích dương và âm trùng nhau là phân tử trung
tính (không cực tính). Các chất tạo nên từ các phân tử trung tính được gọi là chất trung
tính. (chẳng hạn như: Cl2, H2…)
- Phân tử có trọng tâm của các điện tích dương và âm không trùng nhau, cách nhau
một khoảng a nào đó là phân tử cực tính (lưỡng cực). Các chất tạo nên từ các phân tử
cực tính được gọi là chất cực tính. (chẳng hạn như: HCl…) 17
Chương 1. Cấu tạo của vật chất
2.2. Liên kết cộng hóa trị
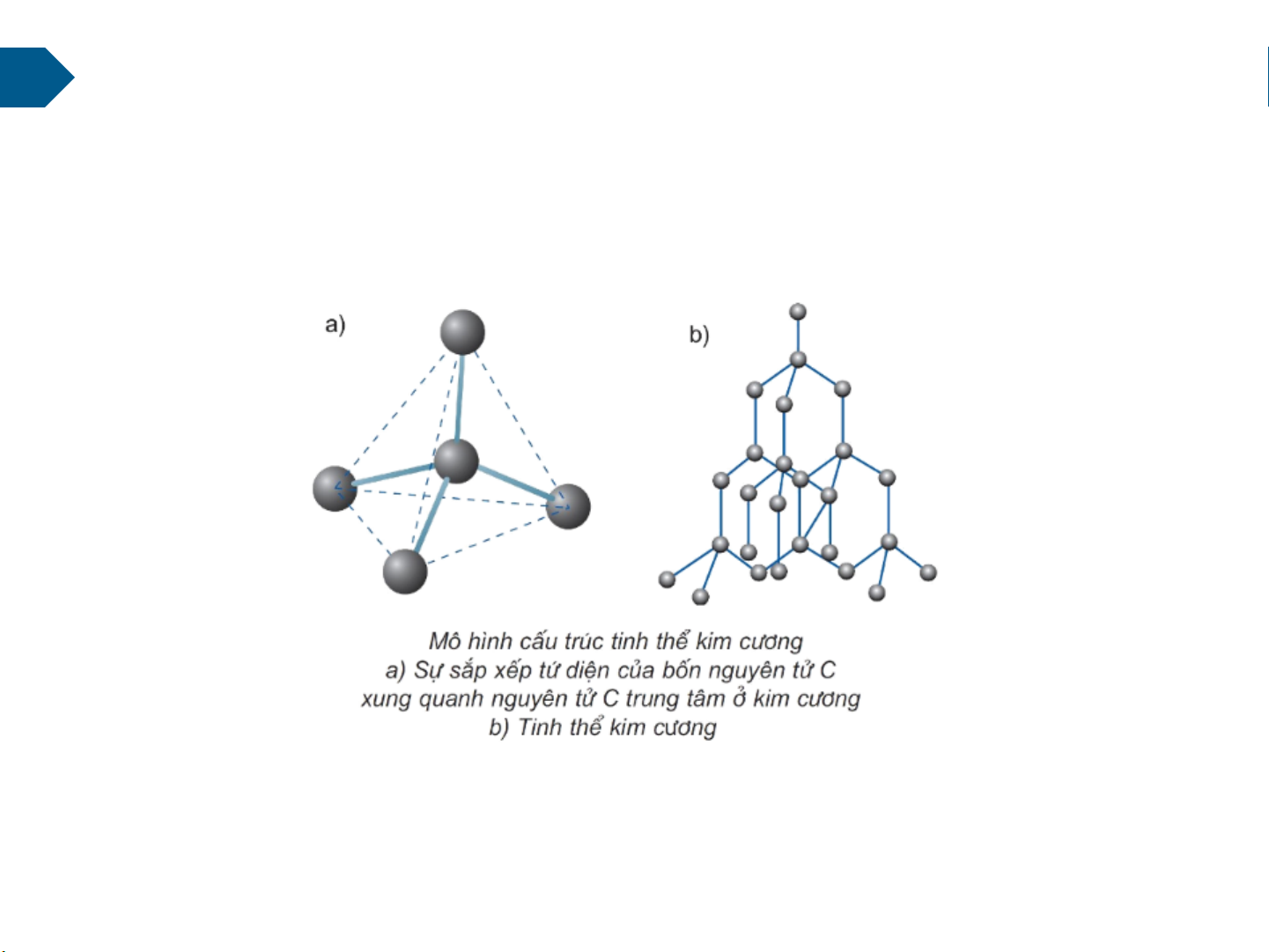
Liên kết cộng hóa trị còn thấy ở cả chất rắn vô cơ có mạng tinh thể cấu tạo từ các nguyên
tử, ví dụ như kim cương
Tinh thể nguyên tử cấu tạo từ những nguyên tử được sắp xếp một cách đều đặn, theo
một trật tự nhất định trong không gian tạo thành một mạng tinh thể. Ở các điểm nút
của mạng tinh thể là những nguyên tử liên kết với nhau bằng các liên kết cộng hóa trị. 18
Chương 1. Cấu tạo của vật chất
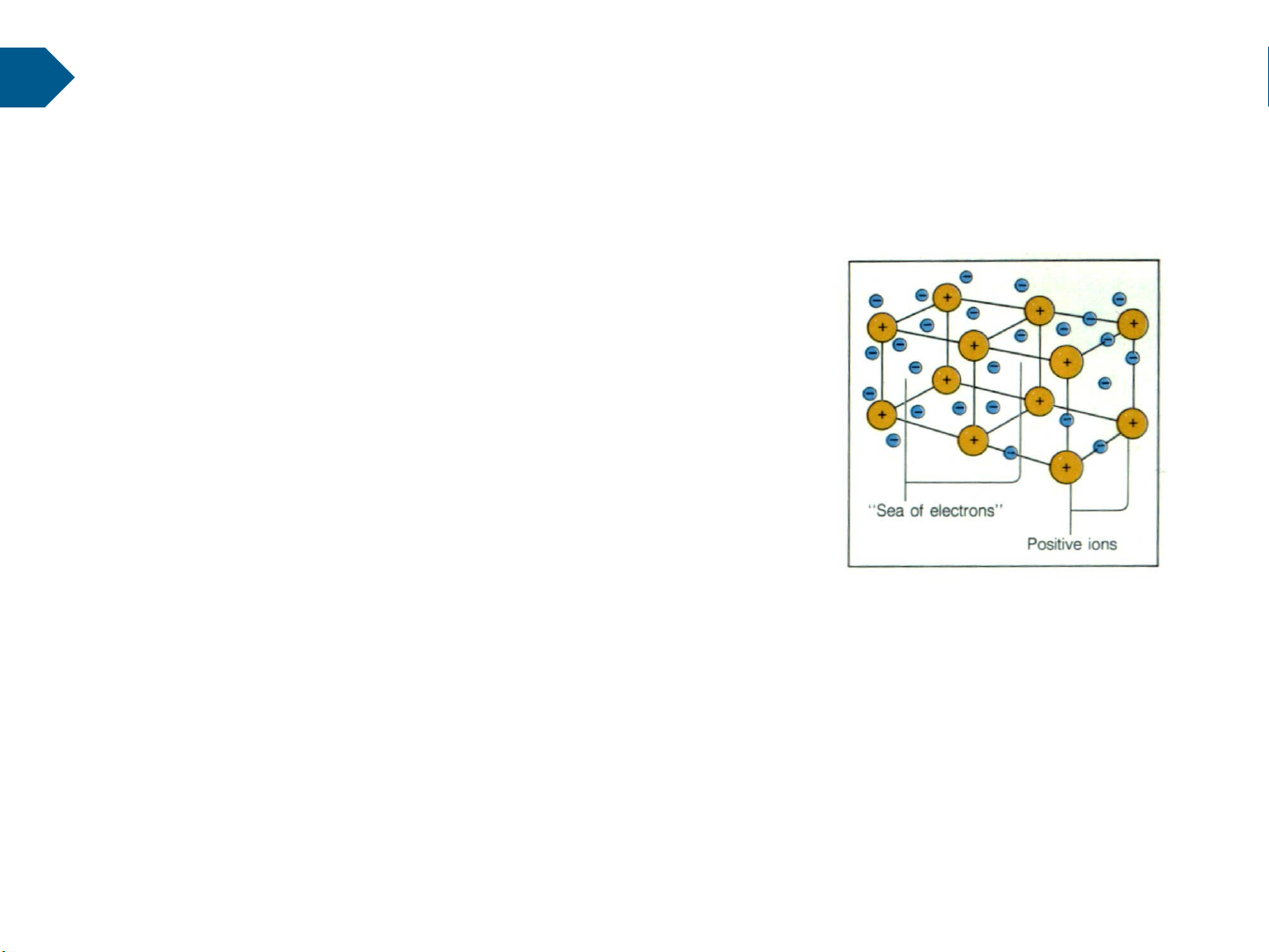
2.3. Liên kết kim loại
Đặc trưng cho các kim loại trong thực tế. Các nguyên tử kim loại lên kết với nhau qua liên kết kim loại.
Mô hình liên kết kim loại với các
ion dương cố định ở nút mạng liên
kết với “biển điện tử” xung quanh. Ví dụ: Fe có 26 e
• Dạng liên kết này tạo nên trong các tinh thể vật rắn (kim loại).
• Lực hút giữa các ion dương và các điện tử tự do tạo nên tính nguyên khối của kim loại.
Vì vậy đây là liên kết bền vững, có độ bền cơ học và nhiệt độ nóng chảy cao.
• Sự tồn tại của các điện tử tự do làm cho kim loại có tính ánh kim và tính dẫn điện, dẫn
nhiệt cao. Tính dẻo của kim loại được giải thích bởi sự dịch chuyển và trượt trên nhau
giữa các lớp ion, cho nên kim loại dễ cán kéo thành lớp mỏng. 19
Chương 1. Cấu tạo của vật chất
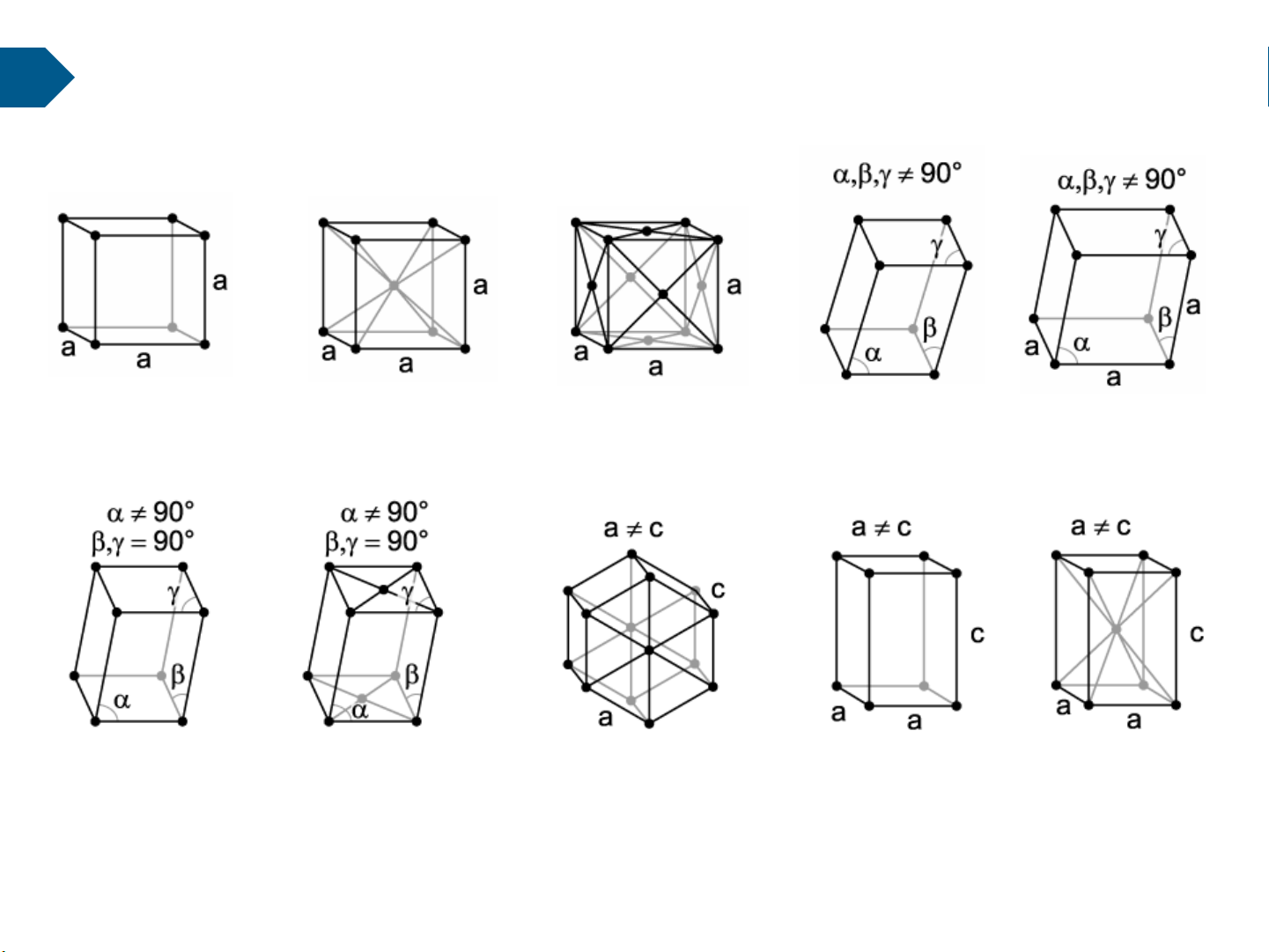
a. Cấu trúc tinh thể dạng ô lưới Cubic Cubic Dạng đơn giản Cubic Đối xứng qua tâm Đối xứng qua mặt Triclinic Rhombohedral Monoclinic Monoclinic Hexagonal Tetragonal Tetragonal Dạng đơn giản Đối xứng qua 2 mặt Dạng đơn giản Đối xứng qua tâm 20