




Preview text:
lOMoARcPSD|36442750 2.2 Nguyen ly 1 NDH DHBKHN
Vật lý I (Trường Đại học Bách khoa Hà Nội)
Studocu is not sponsored or endorsed by any college or university
Downloaded by v?n ti?n Lê (vantienle525@gmail.com) lOMoARcPSD|36442750 3/23/20
NGUYÊN LÝ THỨ NHẤT CỦA
NHIỆT ĐỘNG LỰnCội bộ HỌC
1. Nhiệt động lực học
2. Nội năng hệ nhiệt động – Công và nhiệt 3. Nội du ác ư ng, ý u nghĩ hành
a, hệ quả nguyên lý 1 4. C L
quá trình cân bằng của khí lý tưởng 1
1. NHIỆT ĐỘNG LỰC HỌC
! Khái niệm Nhiệt động lực học (NĐLH): Xuất phát từ ngôn ngữ Hy
Lạp therme (nhiệt) và dynamis (sức mạnh), mô tả những cách thức nhằm
biến đổi nhiệt thành năng lượng.
! Trên phương diện lịch sử, NĐLH được phát n triển ội bộ do nhu cầu tăng hiệu
suất của các động cơ hơi nước (thế kỷ 17-18).
! NĐLH: Khoa học về năng lượng, đặc trưng bởi các nguyên lý (định
luật) về nhiệt động lực thể hiện sự trao đổi năng lượng giữa các hệ vật lý
dưới dạng công và nhiệt hành .
! NĐLH nghiên cứu về sự biến đổi năng lượng thành công và nhiệt
trong mối liên hệ với các đại lượng vĩ mô là nhiệt độ, thể tích và áp suất
trên cơ sở xem xét CĐ của tập hợp các hạt bằng vật lý thống kê. ! L Ngày ưu
nay, NĐLH bao gồm các lĩnh vực nghiên cứu về năng lượng,
chuyển đổi năng lượng, phát điện, quá trính làm lạnh và các mối quan hệ
về tính chất nhiệt của vật chất. 2 1
Downloaded by v?n ti?n Lê (vantienle525@gmail.com) lOMoARcPSD|36442750 3/23/20
1. NHIỆT ĐỘNG LỰC HỌC Nhiệt độ môi trường Cà phê nóng Nhiệt nội bộ Bộ thu nhận NL mặt trời Phòng tắm Nước nóng
ưu hành Bình chứa nước nóng Nước lạnh L Trao đổi nhiệt Bơm 3
2. NỘI NĂNG HỆ NHIỆT ĐỘNG Hệ nhiệt động
! Hệ vật lý bao gồm một số lớn các hạt
(nguyên tử, phân tử) luôn có CĐ nhiệt hỗn
loạn và trao đổi NL cho nhau.
" Có thể là khối khí, chất rắn, chất lỏng. nội bộ
" Các vật bên ngoài hệ đang xét gọi là môi
trường bên ngoài (xung quanh). ! Hệ cô lập:
" Nhiệt: Hệ không trao đổi nhiệt với môi trường bên ngoài
" Cơ: Hệ không trao đổi công với môi trường bên ngoài ! L Hệ ưu hành
không cô lập: Hệ có tương tác hay trao đổi công hoặc nhiệt với môi trường bên ngoài 4 2
Downloaded by v?n ti?n Lê (vantienle525@gmail.com) lOMoARcPSD|36442750 3/23/20
2. NỘI NĂNG HỆ NHIỆT ĐỘNG Năng lượng
! Vật chất luôn vận động ! năng lượng là đại
lượng đặc trưng mức độ vận động của vật chất.
! Mỗi trạng thái ! tương ứng dạng vận động
xác định " có năng lượng xác định. nội bộ
" Trạng thái thay đổi " năng lượng thay đổi.
" Biến thiên năng lượng của hệ trong quá trình
biến đổi chỉ #vào trạng thái đầu và cuối, $ quá trình biến đổi.
" Năng lượng là hàm trạng thái. ! Nă ượ độ L ng l ư ng: u hành
ng năng ứng với CĐ có hướng + thế năng của hệ trong
trường lực + nội năng của hệ
" NĐLH: hệ không CĐ và không đặt trong trường lực
" Năng lượng của hệ = Nội năng của hệ: W = U 5
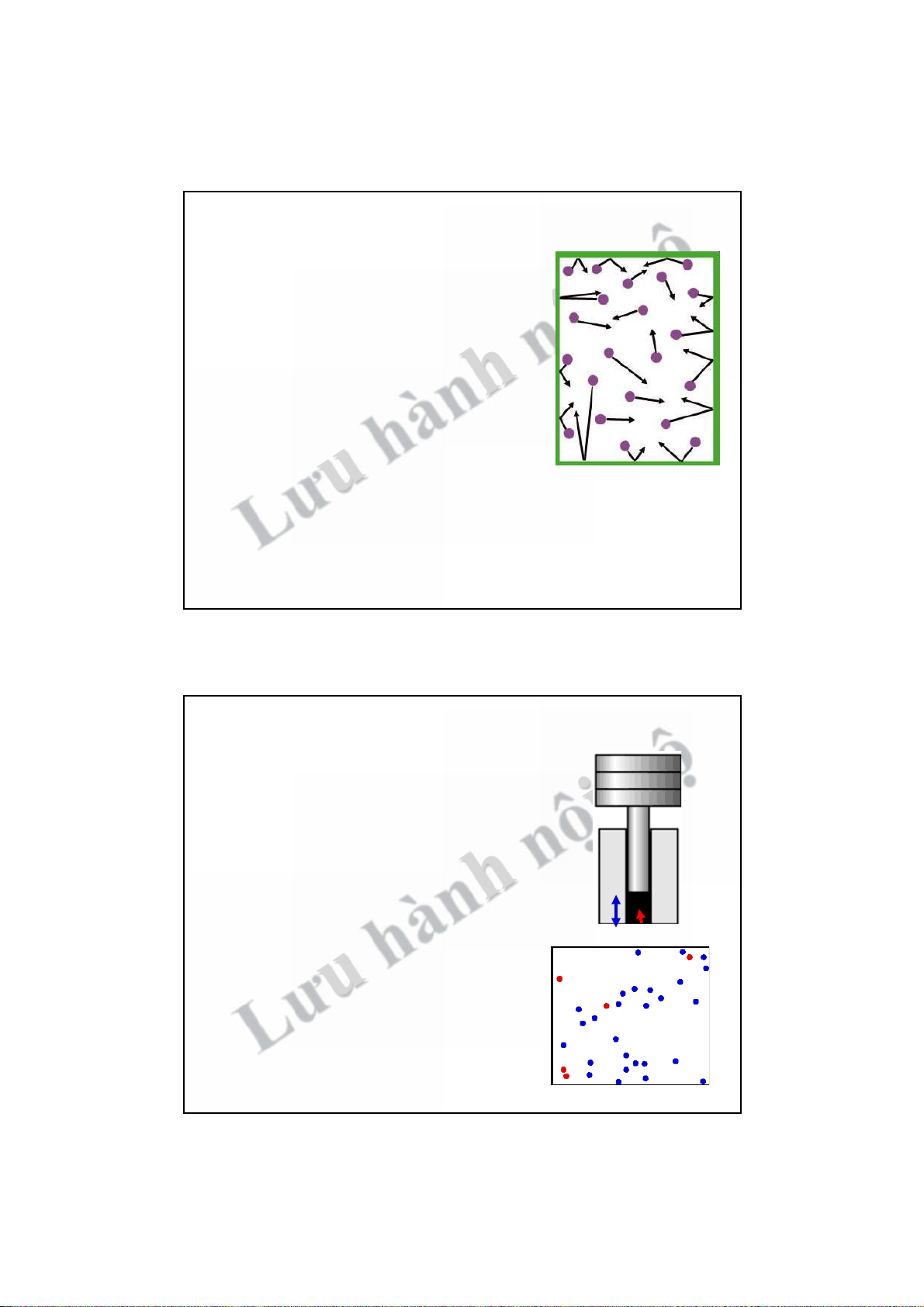
2. NỘI NĂNG HỆ NHIỆT ĐỘNG Công
! Mô hình: Khối khí đựng trong xy-lanh giãn nở
(CĐ có hướng) ! piston CĐ " sinh công ra bên ngoài ! NL hệ giảm.
! Đại lượng đặc trưng cho mức độ trao đổi nă
lượng thông qua CĐ có hướng của hệ - A. n ng ội bộh iston P -lan Xy
" Chỉ xuất hiện trong quá trình biến đổi. Nhiệt Khối khí ! Mô hì ! Đại l ư nh: C u ung cấp hành
nhiệt cho khối khí và giữ
nguyên thể tích ! CĐ hỗn loạn của các phân tử tăng ! NL hệ tăng.
Lượng đặc trưng cho mức độ trao đổi
năng lượng thông qua CĐ của các phân tử - Q.
" Chỉ xuất hiện trong quá trình biến đổi 6 3
Downloaded by v?n ti?n Lê (vantienle525@gmail.com) lOMoARcPSD|36442750 3/23/20
2. NỘI NĂNG HỆ NHIỆT ĐỘNG
Sự tương đương giữa công và nhiệt
! Công - nhiệt: 2 đại lượng khác nhau nhưng có mối liên hệ với nhau.
! Công - nhiệt: 2 đại lượng đo mức độ trao đổi n NL ! ội bộ không phải là NL " T c L hí nghiưu hành
ệm của James Joule: nhiệt do
" Quá trình nhiệt sinh công
ông thực hiện bởi trọng lực sinh ra
" Tốn 1 công = 4,18 J ! thu được nhiệt = 1 calo, hoặc, 1 calo nhiệt có thể
tạo ra công có giá trị = 4,18 J . 7 3. NGUYÊN LÝ 1 NĐLH
! Định luật bảo toàn và chuyển hóa NL cơ: Độ biến thiên năng lượng cơ của
hệ trong quá trình biến đổi bằng công mà hệ trao đổi trong quá trình đó !W = W2 – W1 = A
! Đ/V NĐLH: hệ trao đổi NL dưới dạng công và n nhiệt ội bộ (sự tương đương nhau) !W = W2 – W1 = A + Q
" Độ biến thiên năng lượng của hệ trong quá trình biến đổi bằng tổng công và
nhiệt mà hệ nhận được trong quá trình đó. ! Nguyên lý 1: hành
Do W = U # !U = U2 – U1 = A + Q " T L rong ưu
quá trình biến đổi, độ biến thiên nội năng của hệ bằng tổng công và
nhiệt mà hệ nhận được trong quá trình đó.
" Nếu quá trình biến đổi vô cùng nhỏ: dU = "A + "Q 8 4
Downloaded by v?n ti?n Lê (vantienle525@gmail.com) lOMoARcPSD|36442750 3/23/20 3. NGUYÊN LÝ 1 NĐLH Ý nghĩa ! Qui ước:
" A > 0: Công hệ nhận được
" Q > 0: Nhiệt hệ nhận được
" A’ = -A < 0: Công hệ sinh ra " Q’ = -Q n < 0: ội bộ Nhiệt hệ sinh ra
! Nếu: A > 0 và Q > 0 ! "U > 0 ! U2 > U1 : Nội năng hệ tăng # độ tăng
nội năng đúng bằng công và nhiệt hệ nhận được
! Nếu: A < 0 và Q < 0 ! "U < 0 ! U2 < U1 : Nội năng hệ giảm # độ
giảm nội năng đúng bằng công hệ sinh ra và nhiệt hệ tỏa ra
! Nếu; A = 0 và Q = 0 ! "U = 0 ! U2 = U1 : nội năng hệ bảo toàn khi hệ L không trao ư đổi c u hành
ông và nhiệt với bên ngoài.
" Năng lượng không tự sinh ra và cũng không tự mất đi, nó chỉ chuyển hóa
từ dạng này sang dạng khác (hoặc từ hệ này sang hệ khác). 9 3. NGUYÊN LÝ 1 NĐLH Hệ quả
! Hệ quả 1: trường hợp hệ thực hiện quá trình kín (chu trình) ! hệ trở lại trạng
thái ban đầu sau quá trình biến đổi, hay: U2 = U1 " #U = U ! 2 – U1 = A + Q = 0 A = - Q
" A > 0: hệ nhận công " Q < 0: hệ thực sự tỏa nội bộ nhiệt
" Q > 0: hệ nhận nhiệt " A < 0: hệ thực sự sinh công
" Một động cơ muốn sinh công " phải nhận nhiệt từ bên ngoài Lưu hành
" Không tồn tại động cơ sinh công mãi mãi mà không cần cung cấp năng
lượng (gọị là Động cơ vĩnh cửu loại 1) 10 5
Downloaded by v?n ti?n Lê (vantienle525@gmail.com) lOMoARcPSD|36442750 3/23/20 3. NGUYÊN LÝ 1 NĐLH Hệ quả
" Hệ quả 2: Trường hợp hệ cô lập, tức là hệ không trao đổi công và nhiệt với
môi trường bên ngoài, khi đó, A = Q = 0
! "U = U2 – U1 = 0 hay U2 n =U ội bộ 1
" Xét hệ 2 vật cô lập, chỉ trao đổi nhiệt với nhau:
! Q1, Q2: nhiệt lượng từng vật nhận được ! Q1 = - Q2
! Q1 > 0: Vật thứ nhất nhận nhiệt ! Q2 < 0: vật thứ hai thực sự tỏa nhiệt
! Q2 > 0: Vật thứ hai nhận nhiệt ! Q1 < 0: vật thứ nhất thực sự tỏa nhiệt ! Tr L ong m ưu hành
ột hệ cô lập gồm 2 vật trao đổi nhiệt, nhiệt lượng do vật này tỏa ra
bằng nhiệt lượng vật kia thu vào 11
4. CÁC QUÁ TRÌNH CÂN BẰNG
Trạng thái cân bằng và quá trình cân bằng
! Trạng thái cân bằng: Trạng thái trong đó mọi thông số của hệ được hoàn
toàn xác định và sẽ tồn tại mãi mãi nếu không có n tác ộ động t i bộ ừ bên ngoài !
biểu diễn trên đồ thị OpV bằng các điểm có tọa độ p, V.
! Quá trình cân bằng: Quá trình biến đổ P
i gồm một chuỗi liên tiếp các trạng
thái cân bằng ! biểu diễn trên đồ thị P a a
OpV bằng các đường cong liên tục.
" Thực tế không có quá trình hoàn toàn b cân bằng " Điều kiệ tiến hành ư n để được u hành Pb c
một quá trình biến đổi Pc trạngL
coi là quá trình cân
bằng: Quá trình tiến hành rất chậm để O
thái cân bằng được thiết lập trong V V a c Vb V
toàn hệ trước khi chuyển sang trạng thái cân bằng tiếp theo. 12 6
Downloaded by v?n ti?n Lê (vantienle525@gmail.com) lOMoARcPSD|36442750 3/23/20
4. CÁC QUÁ TRÌNH CÂN BẰNG
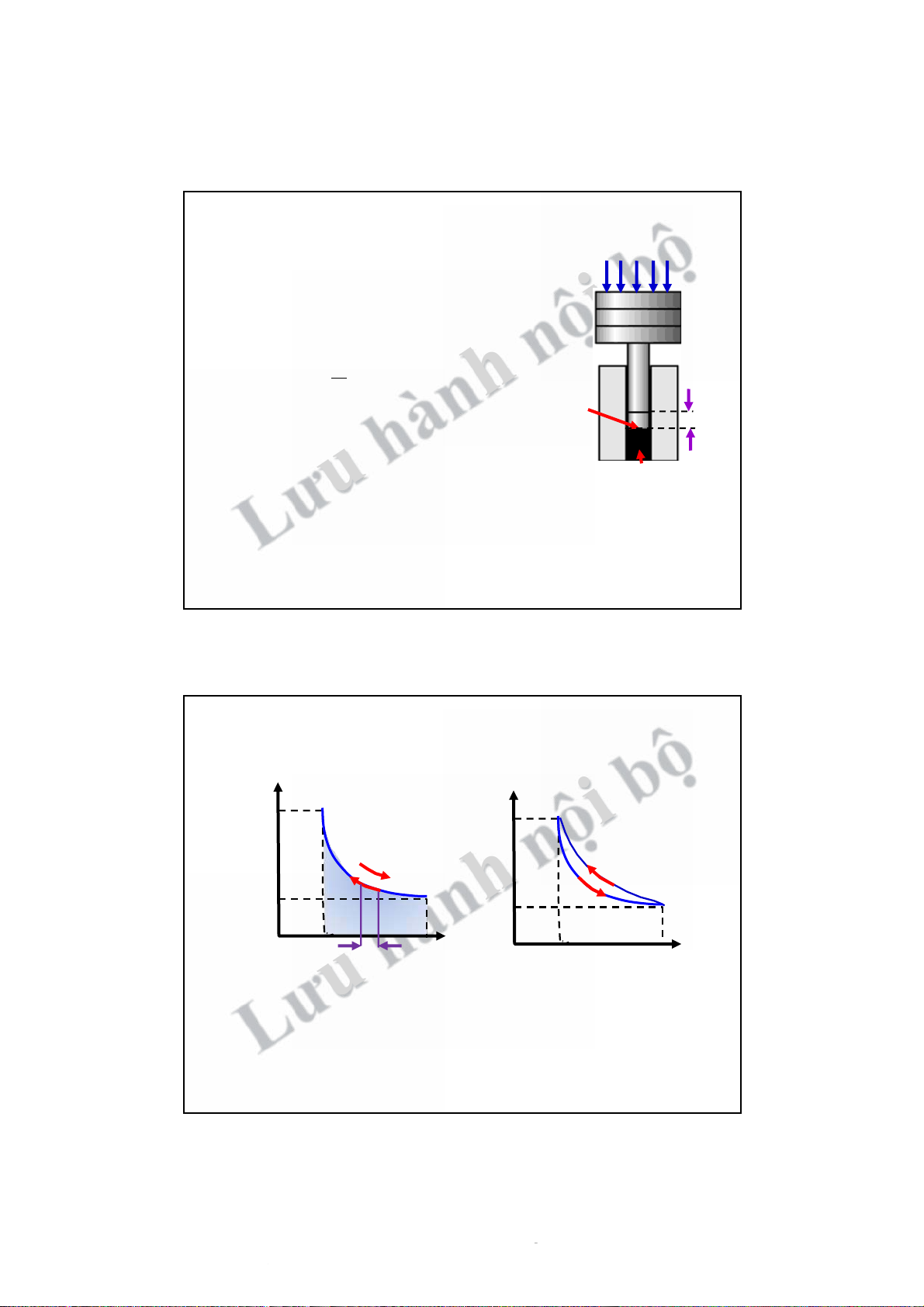
Công trong quá trình cân bằng
! Khối khí (thể tích V) + xy-lanh + piston (tiết diện S).
! Nén khối khí bằng lực F. F nội bộh
" Áp suất: p = S iston -lan Tiết diện P Xy
" Piston CĐ ! Hệ (khối khí) nhận công: piston dl A ! Fdl = do "A " Hay: ! Công ư > 0, nh A ! = u ưng dl hành < 0 # A " !Fdl = Khối khí pSdl ! = pdV
LkhốikhínhậnđượctrongquátrìnhbiếnđổitừthểtíchV đế1nV2 2 V2 A = ! dA ! " = pdV 1 V 13 1
4. CÁC QUÁ TRÌNH CÂN BẰNG
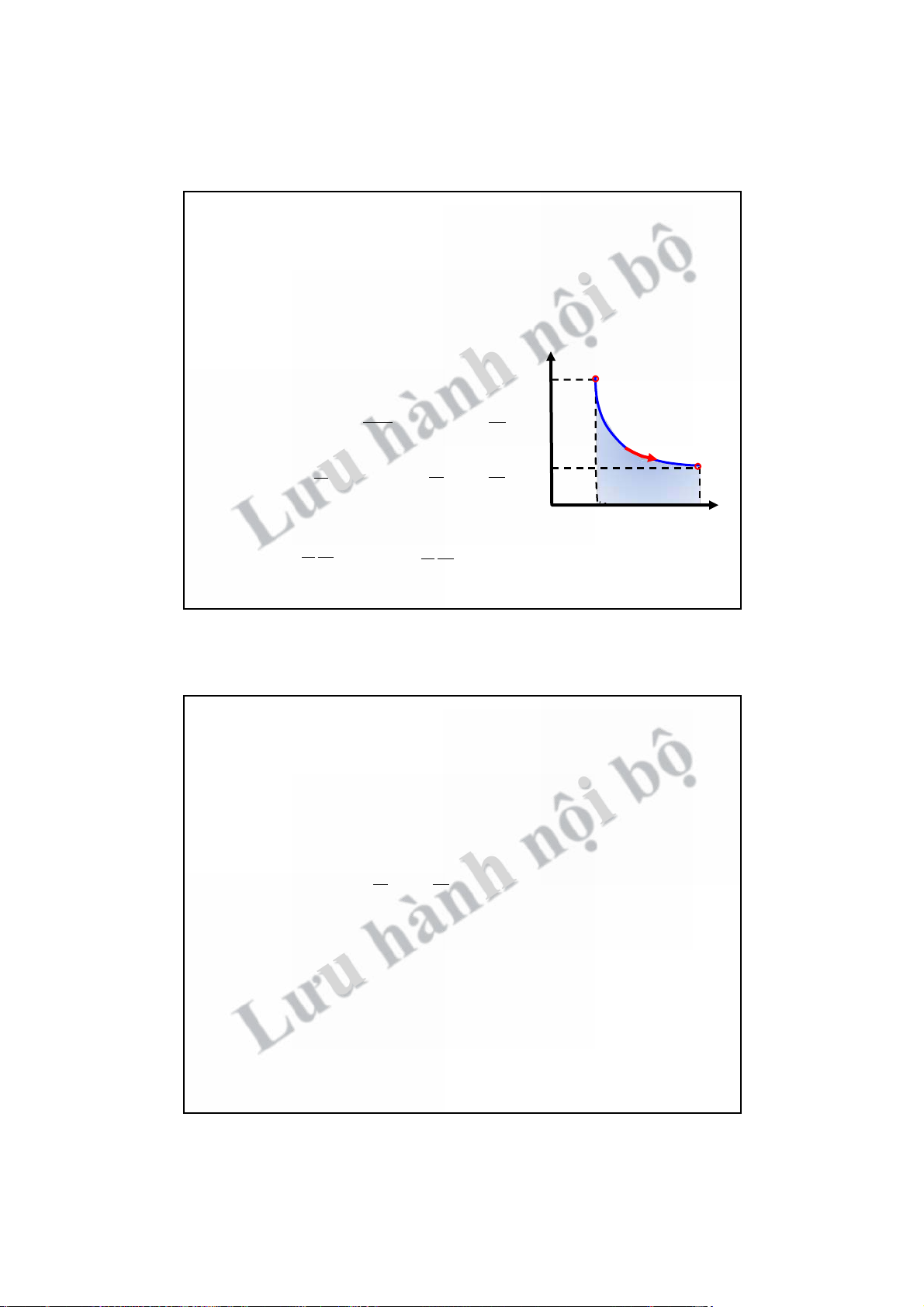
Công trong quá trình cân bằng p p p2 C2 p1 A nội bộ 2 p C 1 1 1 p B 2 O V2 dV V1 V O V1 V2 V ! A = A S ! = 1 A B 2
! Chiều chu trình ngược chiều kim ! Chiều ư SC C V V 1 2 2 quá tr u 1 hành
L ình!"trụcV:A>0 đồnghồ:A>0
! Chiều quá trình !! trục V: A < 0
! Chiều chu trình thuận chiều kim đồng hồ: A < 0
! Công trong quá trình cân bằng không những phụ thuộc vào điểm đầu
điểm cuối mà còn cả hình dạng đường đi (các trạng thái trung gian). 14 7
Downloaded by v?n ti?n Lê (vantienle525@gmail.com) lOMoARcPSD|36442750 3/23/20
4. CÁC QUÁ TRÌNH CÂN BẰNG
Nhiệt trong quá trình cân bằng
! Khối khí (khối lượng m, nhiệt độ T)
! Hơ nóng khối khí ! biến thiên nhiệt độ dT
" Nhiệt hệ (khối khí) nhận được trong quá trìnhnội bộ Q ! = mcdT 1 Q ! ! có: c = m dT
! Đại lượng vật lý có giá trị bằng nhiệt lượng mà một Đơn vị ư đơn vị u khối lượ hành
ng của hệ nhận được để
nhiệt độ của nó biến thiên 1 độ: Nhiệt dung (c) "
Lnhiệtdung:J/kg.K
" Nhiệt dung phân tử (C): Đại lượng có giá trị bằng năng lượng mà một mol
khí nhận được để nhiệt độ của nó biến thiên 1 độ: C = µ.c (J/mol.K)
" µ: khối lượng 1 mol khí 15
4. CÁC QUÁ TRÌNH CÂN BẰNG
Nhiệt trong quá trình cân bằng
! Hơ nóng hệ: nhiệt độ tăng ! dT > 0 ! "Q > 0: hệ thực sự nhận nhiệt
! Làm lạnh hệ: nhiệt độ giảm ! dT < 0 ! "Q < 0: hệ thực sự tỏa nhiệt ! nội bộ
Nhiệt 1 mol khí nhận được trong quá trình Q ! = cdT µ = CdT
! Nhiệt 1 khối khí, khối lượng m kg, nhận được trong quá trình: ! Mỗi quá ư trình u! hành m Q = CdT µ
L nhiệtđộng!nhiệtdungphântửđặctrưngtươngứng m " Quá trình đẳng tích: Q ! = C dT V V µm " Quá trình đẳng áp: Q ! = C dT p p µ 16 8
Downloaded by v?n ti?n Lê (vantienle525@gmail.com) lOMoARcPSD|36442750 3/23/20
4. CÁC QUÁ TRÌNH CÂN BẰNG
Quá trình đẳng tích
! Quá trình biến đổi trong đó thể tích của hệ không đổi (V = const)
! Phương trình quá trình biến đổi (tuân theo đ/l P P P P 1 2 = = T T T 1 1 n Gay-L ộ ussaci bộ ): 2
! Công hệ nhận được trong quá trình biến đổi 2 V2 A ! 0 = " pdV = (do V = const) 3 V1 ! Biến thi m iR Vì: U ư ên nội m iR = unăngtrhành ong quá trình biến đổi O V T ! U T ! = ! Lµ 2 µ 2
! Nhiệt hệ nhận được trong quá trình biến đổi m iR Vì: Q = U " ! A ! Q = T ! µ 2 17
4. CÁC QUÁ TRÌNH CÂN BẰNG
Quá trình đẳng tích
! Nhiệt dung phân tử đẳng tích: m iR Có: Q = T ! µ 2 nội bộ iR C m V = Mặt khác: Q = C T ! 2 V V µ 3R 3
" Khí đơn nguyên tử: i = 3: C = = 31 , 8 . J / mol K . ! 3 cal / mol K . V 2 2 5R 5 " K ư hí hai u hành
nguyên tử: i = 5: C = = 31 , 8 . J / mol K . ! 5 cal / mol K . L V 2 2 6R 6
" Khí đa nguyên tử: i = 6: C = = 31 , 8 . J / mol K . ! 6 cal / mol K . V 2 2 18 9
Downloaded by v?n ti?n Lê (vantienle525@gmail.com) lOMoARcPSD|36442750 3/23/20
4. CÁC QUÁ TRÌNH CÂN BẰNG Quá trình đẳng áp
! Quá trình biến đổi trong đó áp suất của hệ không đổi (p = const). V V V 1 2
! Phương trình quá trình biến đổi (tuân theo đ/l
! Công hệ nhận được trong quá trình biến đổi P V V 2 2 n Gay-L ộ ussaci bộ ): = = T T T 1 2
A = ! pdV = p ! dV = ! p " " (V !V ) 2 1 1 2 V V p 1 1
! Biến thiên nội năng trong quá trình biến đổi m iR m iR Vì: U T = ! U T ! = ! ! Nhiệt h m iR m iR m Vì: Q = ư µ 2 ệ nhận u hành µ 2 O V
được trong quá trình biến đổi V1 V2
LU"!A ! Q= T!+p(V2"V)= T!+ R T! µ 2 1 µ 2 µ m ' iR $ Hay: Q = % + R " T ! µ & 2 # 19
4. CÁC QUÁ TRÌNH CÂN BẰNG Quá trình đẳng áp
! Nhiệt dung phân tử đẳng áp: m ' iR $ m Có: Q = % + R " T ! = (C + R ! V ) T µ & 2 # µ i + 2 m C C R R P = V + = Mặt khác: Q = C T ! nội bộ 2 p p µ
" Khí đơn nguyên tử: i = 3: C 5 ! cal / mol K . p
" Khí hai nguyên tử: i = 5: C 7 ! cal / mol K . p " K ư hí đa u hành nguyên tử: i = 6: C 8 ! cal / mol K . p
" Khí đơn nguyên tử: i = 3: ! = 1,67 C !L p Tỉ số Poisson (!) ! =
" Khí hai nguyên tử: i = 5: ! = 1,40 CV
" Khí đa nguyên tử: i = 6: ! = 1,33 20 10
Downloaded by v?n ti?n Lê (vantienle525@gmail.com) lOMoARcPSD|36442750 3/23/20
4. CÁC QUÁ TRÌNH CÂN BẰNG
Quá trình đẳng nhiệt
! Quá trình biến đổi trong đó nhiệt độ của hệ không đổi (T = const)
! Phương trình quá trình biến đổi (tuân theo đ/l
pV = p V = p V P 1 1 2 n Boyle-ộ Mari i bộ otte): 2
! Công hệ nhận được trong quá trình biến đổi P 1 1 2 V 2 V p V V 1 1 2 A ! = pdV ! " = dV ! " = p V ln 1 1 V V V V 1 1 1 m m V P 2 2 Vì: p V = RT 2 ! A RT = ! ln 1 1 O ! V Biến thi ư 1 µ u hành 1 V µ 1
Lênnộinăngtrongquátrìnhbiếnđổi 1 V2 V m iR m iR Vì: U T = ! U T 0 ! = ! = (do T = const) µ 2 2 µ 21
4. CÁC QUÁ TRÌNH CÂN BẰNG
Quá trình đẳng nhiệt
! Nhiệt hệ nhận được trong quá trình biến đổi Vì: Q = U " ! A m V2 nội bộ ! Q = ! A = RT ln 1 µ V1
" Nội năng của hệ không đổi trong quá trình biến đổi " Hệ nhận sinh ư công công u A (A > hành
0) ! hệ thực sự tỏa nhiệt
" HệL A(A<0)!hệthựcsựthunhiệt
" Quá trình nén đẳng nhiệt: A > 0 và Q < 0) ! hệ nhận công và tỏa nhiệt
" Quá trình giãn đẳng nhiệt: A < 0 và Q > 0) ! hệ nhận nhiệt và sinh công 22 11
Downloaded by v?n ti?n Lê (vantienle525@gmail.com) lOMoARcPSD|36442750 3/23/20
4. CÁC QUÁ TRÌNH CÂN BẰNG
Quá trình đoạn nhiệt
! Quá trình biến đổi trong đó hệ không trao đổi nhiệt với bên ngoài (!Q = 0)
! Xét quá trình vô cùng nhỏ: dU = "A + "Q = "A và "Q = 0 m iR m Vì: U T C T = = và "A = -pdV V µ 2 µ nội bộ m m RT # C dT = ! pdV = ! dV V µ C dT Hay: V = ! hành µ V dV RT dT R $ # T V const ln + ln = T ưRdV + u V L 0 = C V C V V R C !C p V Do: 1 = = " !1 # T V T V "! const ln + (" ! ) 1 ln = ln( . ) = C C V V 23
4. CÁC QUÁ TRÌNH CÂN BẰNG
Quá trình đoạn nhiệt P 1
! Phương trình của quá trình P1 " 1 ! 1 T . " 1 ! ! " V = T .V = T .V ) 1 ( 1 1 2 2 . ! p V = p . ! V = p . ! V ( ) 2 1 1 2 2 nội bộ P2 1"! 1 ! " 1 ! " 2 ! ! ! Tp = T p = T p ) 3 ( 1 1 2 2
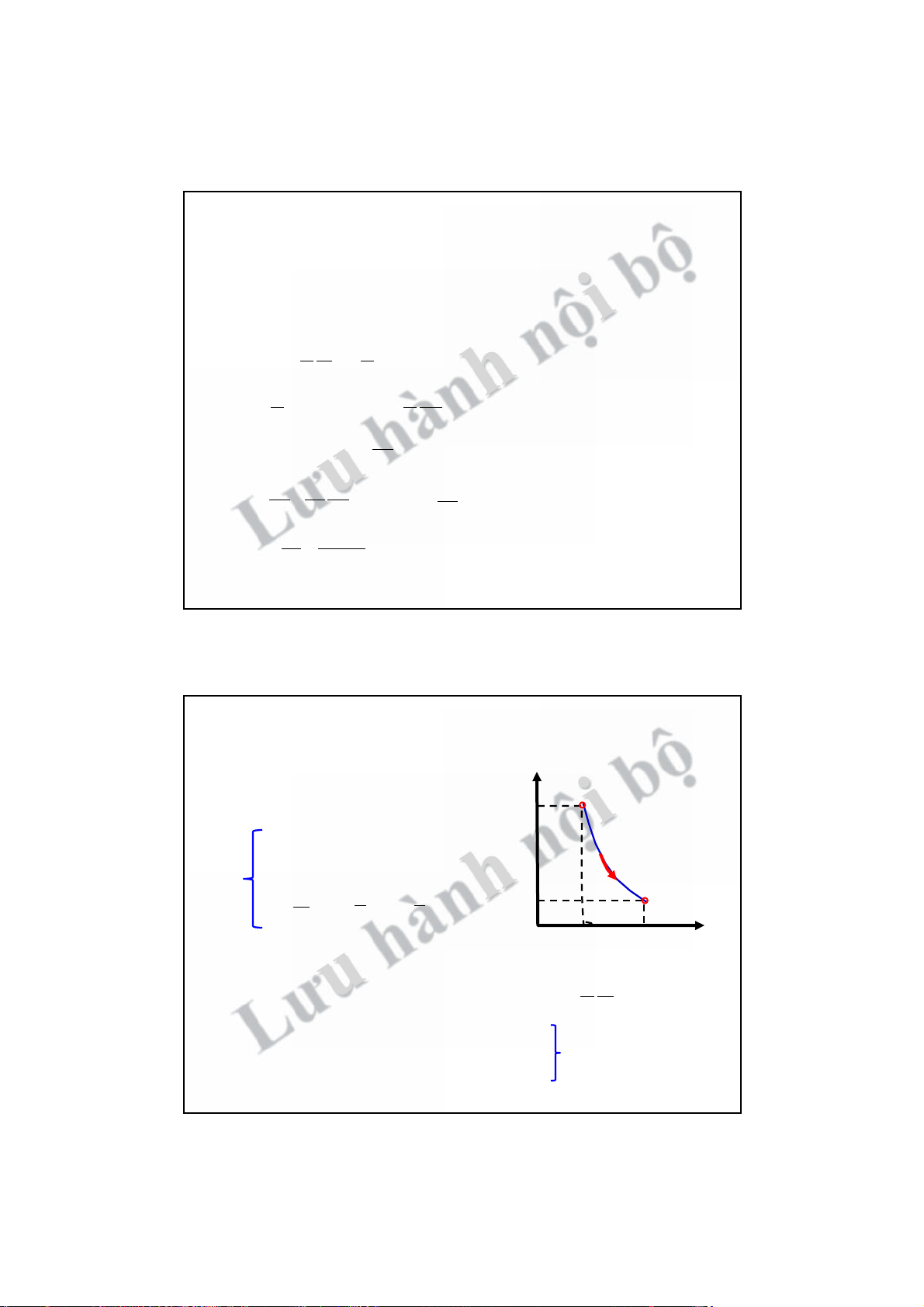
! Đặc trưng OpV dốc hành O V1 V2 V m iR " Biến t ư
hiên n u hơn so với quá trình đẳng nhiệt
ội năng trong quá trình biến đổi: U T ! = ! L µ 2 " do !Q = 0 " dU = !A
p tăng do V giảm và T tăng " # > 1 "
" Nén đoạn nhiệt " !A > 0 " dU > 0 " dT > 0 đường cong dốc hơn 24 12
Downloaded by v?n ti?n Lê (vantienle525@gmail.com) lOMoARcPSD|36442750 3/23/20
4. CÁC QUÁ TRÌNH CÂN BẰNG
Quá trình đoạn nhiệt m iR A = U ! " Q = U ! = ! µ 2 ! V ! ! nội bộ
! Công hệ nhận được trong quá trình biến đổi: " Vì: Q = 0 ! T !
" Trong quá trình đoạn nhiệt: pV = p V p V ! p = p 1 1 = 2 2 1 1 ! V V V V 2 2 2 dV dV A = ! # pdV = ! " " p V p V 1 1 1 V V V V V 1 1 " p V ( 1!" V ! !" V 1 1 2 hành # = # " 1 ! " 1 ! A ư = u 1 )1 " !1 L " 1!" " 1 p V V ! !" p V V p V ! p V Hay: 2 2 1 1 2 1 2 2 1 1 A = = " !1 " !1 25
4. CÁC QUÁ TRÌNH CÂN BẰNG
Quá trình đoạn nhiệt m Vì: p V = ! RT 1 1 1 µ & .'1 # & m - V * m -V * ' 1 nội bộ
! Công hệ nhận được trong quá trình biến đổi: . # A = RT $ 1 ' ! RT 1 1 = $ 2 ' ! 1 1 µ $++ (( ,V V 2 ) ! µ $++ (( , 1 ) ! % " % " !"1 " 1 ! T (V % ( V % 1 "! "! Lại có: T .V T . 1 2 1 1 1 = V 2 hành 1 2 = = && ## && ## T V V 2 ' 1 $ ' 2 $ Và: ư " 1 ! !"1 ! ! T ( P % ( P % T u " 1 ! " 1 ! ! ! L p T p 1 2 1 1 1 = 2 2 = = && ## && ## T P P 2 ' 1 $ ' 2 $ " 1 ( ! % m RT . V + m RT (T % V P (T !T ) 1 1 1 2 1 1 2 1 A = & !1# = ,, )) & !1 = # µ " !1 V &- * # µ " !1 T ' $ (" ! ) 1 T 2 1 1 ' $ 26 13
Downloaded by v?n ti?n Lê (vantienle525@gmail.com) lOMoARcPSD|36442750 3/23/20
Những nội dung cần lưu ý
1. Nguyên lý 1 nhiệt động lực học (nội dung, biểu thức, ý nghĩa và hệ quả).
2. Khái niệm trạng thái cân bằng và c n ác ội bộ
quá trình cân bằng,
điều kiện tiến hành để có quá trình cân bằng.
3. Các biểu thức tính công và nhiệt trong các quá trình cân
bằng đẳng áp, đẳng nhiệt, đẳng tích. 4. Khái ưniệu m và c hành
ách thiết lập phương trình liên hệ giữa áp
suất và thể tích của khối khí trong quá trình đoạn nhiệt. L 27 14
Downloaded by v?n ti?n Lê (vantienle525@gmail.com)

