






Preview text:
BÀI GIẢNG: ÔN TẬP CHƯƠNG 6
CHUYÊN ĐỀ: KIM LOẠI KIỀM - KIỀM THỔ - NHÔM
MÔN HÓA: LỚP 12
THẦY GIÁO: PHẠM THANH TÙNG – TUYENSINH247.COM
Câu 1: Kim loại nào sau đây không phải là kim loại kiềm: A. Na B. Ca C. Li D. K
Hướng dẫn giải: Các kim loại kiềm g m ồ : Li, Na, K, Rb, Cs, Fr.
Vậy kim loại Ca không phải là kim loại kiềm (Ca là kim loại kiềm th ) ổ . Đáp án B
Câu 2: Kim loại nào sau đây là kim loại kiềm th : ổ A. Na B. K C. Mg D. Al
Hướng dẫn giải: Kim loại kiềm th n
ổ ằm ở nhóm IIA trong bảng hệ th ng t ố
uần hoàn. Các kim loại kiềm th l ổ à Be, Ca,Mg, Sr, Ba.
Vậy Mg là kim loại kiềm th . ổ Đáp án C
Câu 3: Kim loại kiềm thường được bảo quản trong: A. Nước B. Dầu h a ỏ C. Axit D. Ancol
Hướng dẫn giải:
Muốn bảo quản kim loại kiềm ta phải chọn 1 chất mà không phản ứng với kim loại kiềm và cũng ngăn không cho
kim loại kiềm tiếp xúc với m t ộ s c
ố hất ngoài không khí ví dụ c như oxi, nướ .
Vậy trong các đáp án chỉ có dầu hỏa không phản ứng được với kim loại kiềm (dầu h a
ỏ là các ankan ở trạng thái
lỏng nên không phản ứng với kim loại kiềm). Vậy kim loại ki ng ềm thườ
được bảo quản trong dầu h a ỏ . Đáp án B
Câu 4: Soda là thành phần chính trong nhiều loại nước có ga. Công thức hóa h c ọ c a ủ so a đ là: A. Na2CO3 B. NaHCO3 C. NaCl D. Na2SO4
Hướng dẫn giải:
Soda là natri cacbonat, có công thức hóa h c ọ là Na2CO3. Đáp án A
Câu 5: Chất nào sau đây thường được trộn vào bột nở khi làm bánh: 1 Truy c p
ậ trang Tuyensinh247.com h để c ọ Toán L – ý H – óa S – inh – Văn – Anh S – ử – Địa G – DCD
tốt nhất! A. Na2CO3 B. NaHCO3 C. NaCl D. Na2SO4
Hướng dẫn giải:
Muốn trộn vào bột nở khi làm bánh thì chất đó khi nhiệt phân phải sinh ra khí. Khí đó mới làm phồng bánh lên.
Vậy chất NaHCO3 thường được tr n và ộ o b t ộ nở khi làm bánh. Đáp án B
Câu 6: Thành phần chính của đá vôi là: A. CaCO3 B. CaO C. Ca(HCO3)2 D. Ca(OH)2
Hướng dẫn giải:
Thành phần chính của đá vôi là: CaCO3.
Còn CaO thường gọi là vôi sống. Còn Ca(OH)2 gọi là nước vôi trong. Đáp án A
Câu 7: Nhôm không tan trong dung dịch nào sau đây: A. NaOH B. HCl C. HNO3 D. H2SO4 đặc ngu i ộ
Hướng dẫn giải:
- Al và Zn tan được trong dung dịch kiềm, ví d N ụ aOH.
- Al tan được trong dung dịch HCl hoặc H2SO4 loãng tạo mu i ố , giải phóng khí H2.
- Al tan được trong dung dịch HNO3 (trừ HNO3 đặc ngu i
ộ ) giải phóng sản phẩm khử như NO, NO2, N2O, N2, NH4NO3.
- Có 3 kim loại Al, Fe, Cr bị th ụ ng hóa độ
trong HNO3 đặc nguội hoặc H2SO4 đặc ngu i ộ .
Do đó đáp án đúng là D. Nhôm không tan trong dung dịch H2SO4 đặc ngu i ộ . Đáp án D Câu 8: Nhúng qu t
ỳ ím vào dung dịch Na2CO3 thì: A. Qu c ỳ huyển màu xanh. B. Qu c ỳ huyển màu đỏ. C. Qu c ỳ huyển màu h ng. ồ D. Qu không c ỳ huyển màu.
Hướng dẫn giải:
Muối tạo bởi kim loại mạnh và axit yếu sẽ tạo dung dịch có môi trường bazo nên làm quỳ tím chuyển thành màu xanh. Đáp án A
Câu 9: Nhỏ từ từ tới dư dung dịch NaOH vào dung dịch AlCl3. Hiện tượng thu được là:
A. xuất hiện kết t a ủ trắng.
B. xuất hiện kết t a ủ xanh.
C. xuất hiện kết t a ủ trắng r i ồ tan.
D. xuất hiện kết t a ủ xanh r i ồ tan.
Hướng dẫn giải:
Ở chương này có nhiề trườ u
ng hợp có hiện tượng: xuất hiện kết tủa rồi tan. Đó là:
Nhỏ từ từ dung dịch kiềm vào mu i
ố nhôm hoặc nhỏ từ từ dung dịch axit vào dung dịch NaAlO2 (hoặc AlO2-). 2 Truy c p
ậ trang Tuyensinh247.com h để c ọ Toán L – ý H – óa S – inh – Văn – Anh S – ử – Địa G – DCD
tốt nhất! Vậy hiện tượng ở t
đây là xuấ hiện kết t a ủ trắng r i ồ tan.
AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
Nếu dùng dư NaOH thì: Al(OH)3 + NaOH → NaAlO2 + 2H2O Đáp án C
Câu 10: Hấp thụ từ từ tới dư CO2 vào dung dịch Ba(OH)2. Hiện tượng thu được là:
A. Xuất hiện kết t a ủ trắng.
B. Xuất hiện kết t a ủ xanh.
C. Xuất hiện kết t a ủ trắng rồi tan.
D. Xuất hiện kết t a ủ xanh r i ồ tan.
Hướng dẫn giải:
Khi cho CO2 vào dung dịch Ba(OH)2 thì ban đầu xuất hiện kết t a
ủ trắng (là BaCO3). Sau đó cho CO2 dư vào thì
hòa tan kết tủa đó ra tạo muối axit Ba(HCO3)2. Đáp án C Câu 11: Hòa tan h n h ỗ
ợp X gồm: Na, K, Ba vào nước dư tạo thành dung dịch Y và 5,6 lít H2 (đktc). Thể tích dung
dịch H2SO4 2M tối thiểu để trung hòa Y là: A. 100 ml B. 125 ml C. 150 ml D. 200 ml
Hướng dẫn giải: Khi cho X g m
ồ các kim loại kiềm và kiềm th
ổ vào nước thì thu được dung dịch Y gồm các bazơ (hay các OH-) X + H2O → OH- + ½ H2
Ta có: nH2 = 0,25 mol → nOH- = 2.nH2 = 0,5 mol OH- + H+ → H2O 0,5 → 0,5 mol
Suy ra nH2SO4 = 0,25 mol → Vdd = n/CM = 0,25/2 = 0,125 lít = 125 ml Đáp án B
Câu 12: Thực hiện hai thí nghiệm sau:
- Thí nghiệm 1: Cho m gam h n h ỗ
ợp Ba và Al vào nước dư, thu được 0,896 lít khí (ở đktc).
- Thí nghiệm 2: Cho m gam h n h ỗ
ợp trên vào dung dịch NaOH dư thu được 2,24 lít khí (đktc).
Biết các phản ứng xảy ra hoàn toàn. Giá trị c a ủ m là: A. 2,85 gam B. 2,99 gam C. 2,72 gam D. 2,80 gam
Hướng dẫn giải: -Thí nghiệm 1: Ba + 2H2O → Ba(OH)2 + H2 x x x mol
Ba(OH)2 + 2Al + 2H2O → Ba(AlO2)2 + 3H2 x 3x mol Vậy t ng s ổ m
ố ol H2 là x + 3x = 0,04 mol → x = 0,01 mol 3 Truy c p
ậ trang Tuyensinh247.com h để c ọ Toán L – ý H – óa S – inh – Văn – Anh S – ử – Địa G – DCD
tốt nhất!
- Thí nghiệm 2: cả Ba và Al đều tan hết: nH2 = 0,1 mol Ba + 2H2O → Ba(OH)2 + H2 0,01 0,01 mol
Al + OH- + H2O → AlO2- + 3/2 H2↑ 0,06 0,09 mol
Vậy m = 0,01.137 + 0,06.27 = 2,99 gam Đáp án B
Câu 13: Hấp thụ từ từ tới hết 7,84 lít CO2 (đktc) vào 1 lít dung dịch X chứa NaOH 0,2M và Ca(OH)2 0,1M. Kh i ố
lượng kết tủa thu được là: A. 5 gam B. 10 gam C. 15 gam D. 20 gam
Hướng dẫn giải:
Ta có nCO2 = 0,35 mol; nCa2+ = 0,1 mol; nOH- = nNaOH + 2.nCa(OH)2 = 0,4 mol Tính t n1,14 ỉ lệ (*) = OH → 1 < (*) < 2 nCO2
Suy ra nCO3(2-) = nOH- - nCO2 = 0,4 0,35 = – 0,05 mol CO32- + Ca2+ → CaCO3 ↓
0,05 → 0,05 0,05 mol (chú ý s m
ố ol Ca2+ bằng 0,1 mol nên Ca2+ dư, ta tính theo số mol CO32-).
Vậy mkết tủa = 0,05.100 = 5 gam Đáp án A
Câu 14: Cho 200 ml dung dịch AlCl3 1M tác dụng với dung dịch NaOH 0,5M thu được m t
ộ kết tủa keo, đem sấy
khô cân được 7,8 gam. Thể tích dung dịch NaOH 0,5M lớn nhất là: A. 0,6 lít B. 0,8 lít C. 1,4 lít D. 1,9 lít
Hướng dẫn giải:
Ta có: nAl3+ = 0,2 mol, nkết tủa = 0,1 mol n TH1: n
Al(OH)3 = OH → nOH- = 3.nkết tủa = 0,3 mol 3
TH2: n↓ = 4.nAl3+ - nOH- → nOH- = 0,7 mol
Đề bài hỏi thể tích NaOH lớn nhất nên ta chỉ chọn nOH- = 0,7 mol Vậy V = 0,7: 0,5 = 1,4 lít Đáp án C
Câu 15: Hòa tan hoàn toàn 10,72 gam h n ỗ hợp X g m
ồ Mg, MgO, Ca, CaO bằng dung dịch HCl vừa đủ, thu được
3,248 lít khí (đktc) và dung dịch Y chứa hỗn hợp a gam CaCl2 và 12,35 gam MgCl2. Giá trị của a là: A. 15,54 gam B. 16,65 gam C. 27,75 gam D. 5,55 gam
Hướng dẫn giải: 4 Truy c p
ậ trang Tuyensinh247.com h để c ọ Toán L – ý H – óa S – inh – Văn – Anh S – ử – Địa G – DCD
tốt nhất!
Quy đổi hỗn hợp X thành Mg, Ca, O2 → hỗ ợp + HCl → H n h
2: 0,145 mol + H2O + CaCl2, MgCl2 (0,13 mol)
Bảo toàn nguyên tố Mg ta có: nMg = 0,13 mol
Đặt nCa = x mol; nO2 = y mol
Ta có 40x + 32y = 10,72 - 0,13.24 = 7,6 gam
Dựa vào bảo toàn electron: Mg - 2e → Mg+2 2H+ + 2e H → 2 0,13 → 0,26 0,29 ← 0,145 Ca - 2e → Ca+2 O2 + 4e → 2O-2 x 2x → y → 4y Áp d ng ụ
định luật bảo toàn electron: 0,26 + 2x = 0,29 + 4y
Giải hệ trên ta có: x = 0,14 mol → a = mCaCl2 = 0,14.111 = 15,54 gam Đáp án A Câu 16: Trộn m gam b t
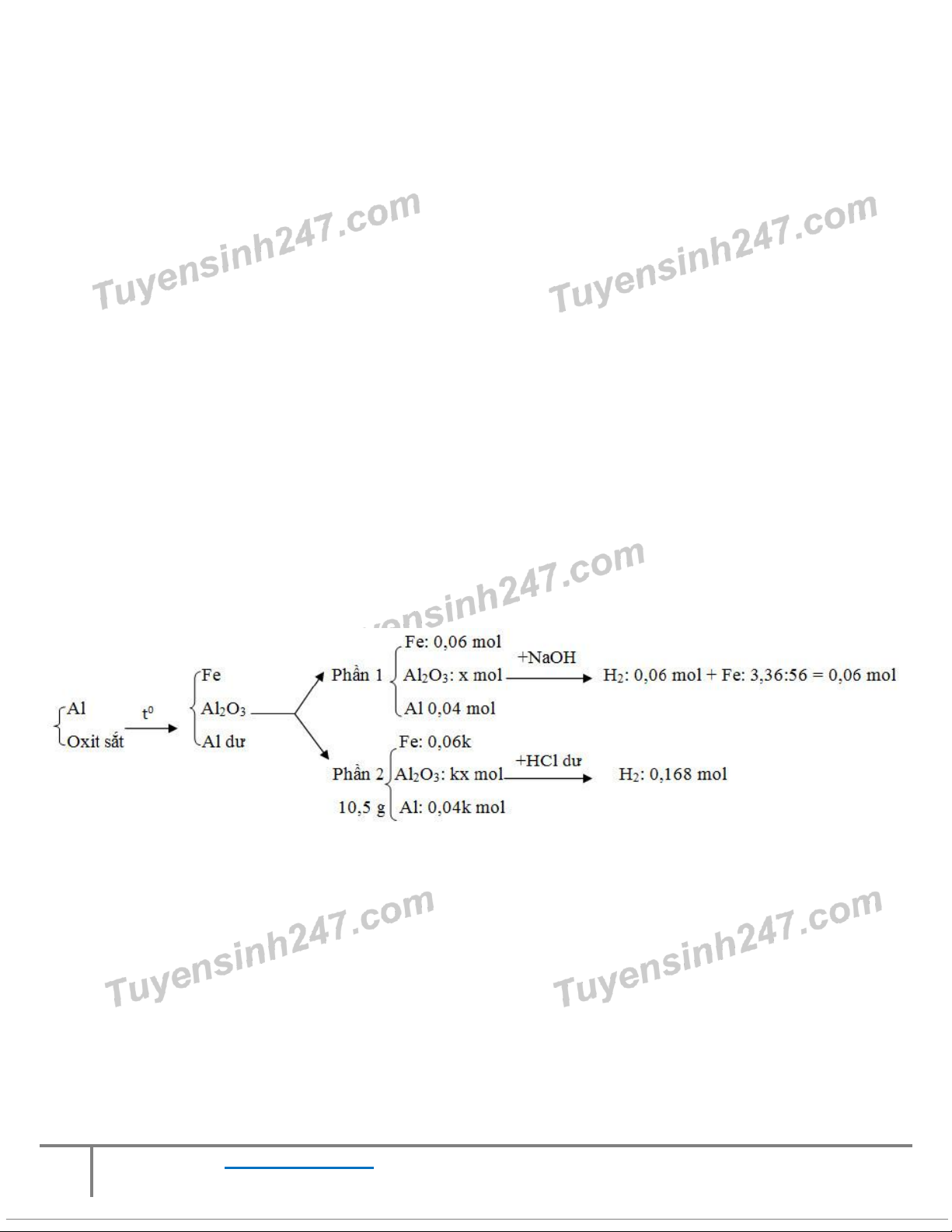
ộ Al với bột oxit sắt rồi nung trong điều kiện không có oxi cho tới khi phản ứng xảy ra
hoàn toàn, được hỗn hợp X. Chia X thành 2 phần. Phần 1 cho tác dụng với dung ịch d NaOH dư thoát ra 0,12 gam
khí và còn lại 3,36 gam chất không tan. Phần 2 có khối lượng 10,5 gam, cho tác d ng ụ
với dung dịch HCl dư thoát
ra 0,168 mol khí. Giá trị c a ủ m là: A. 4,86 gam B. 5,40 gam C. 6,48 gam D. 8,64 gam
Hướng dẫn giải:
Phần 2 gấp k lần phần 1 nên phần 2 có 0,06k mol Fe, kx mol Al2O3 và 0,04k mol Al
Ta có: Fe và Al phản ứng với HCl sinh ra khí suy ra nH2 = 0,06k + 0,06k = 0,168 mol → k = 1,4
Ta có: 10,5 = 56.0,06k + 102.kx+ 27.0,04k → x = 0,03
Bảo toàn nguyên tố Al ta có: nAl = 2x+ 0,04+ 2.kx+ 0,04k =0,24 mol → m =mAl = 0,24.27 = 6,48 gam Đáp án C Câu 17: Nh
ỏ từ từ từng giọt đến hết 300 ml dung dịch HCl 1M vào 100 ml dung dịch chứa Na2CO3 2M và
NaHCO3 2M, sau phản ứng thu được khí CO2 và dung dịch X. Cho dung dịch Ba(OH)2 dư vào dung dịch X đến
khi phản ứng xảy ra hoàn toàn, thu được m gam kết t a ủ . Giá trị c a ủ m là: A. 19,7 gam B. 29,55 gam C. 39,4 gam D. 59,1 gam 5 Truy c p
ậ trang Tuyensinh247.com h để c ọ Toán L – ý H – óa S – inh – Văn – Anh S – ử – Địa G – DCD
tốt nhất!
Hướng dẫn giải: Ta có: nH+ = 0,3 mol CO32- 0,2 mol H+ +
→ HCO3- 0,3 mol Ba(OH)2du BaCO3 ↓ HCO3- 0,2 mol Thứ tự phản ứng: H+ + CO32- → HCO3- 0,2 0,2 ← → 0,2 mol H+ + HCO3- → CO2 + H2O 0,1→ 0,1 0,1 mol
Sau phản ứng thì nHCO3- = 0,2 + (0,2 - 0,1) = 0,3 mol
Bảo toàn nguyên tố ta có: nBaCO3 = nHCO3- = 0,3 mol suy ra mkết tủa = 0,3.197 = 59,1 gam = m Đáp án D
Câu 18: Cho 2,16 gam Mg tác d n
ụ g với dung dịch HNO3 (dư). Sau khi phản ứng xảy ra hoàn toàn thu được 0,896
lít khí NO (ở đktc) và dung dịch X. Khối lượng muối khan thu được khi làm bay hơi dung dịch X là: A. 8,88 gam B. 13,92 gam C. 6,52 gam D. 13,32 gam
Hướng dẫn giải:
Sơ đồ: Mg + HNO3 → Mg(NO 3)2 + NO + H2O 0,09 mol 0,04 mol Mg0 - 2e → Mg+2 0,09 → 0,18 mol N+5+ 3e → N+2 04 m 0,12← 0, ol Ta thấy s m ố ol e cho khác s m ố ol e nhận.
Vậy còn có sản phẩm khử NH4NO3 N+5 + 8e → N-3 0,06 → 7,5.10-3 mol Vậy mu c
ối khan thu đượ có 0,09 mol Mg(NO3)2 và 7,5.10-3 mol NH4NO3 → mmuối = 13,92 gam Đáp án B Câu 19: Cho 46,6 gam h n ỗ hợp X g m
ồ Na, K, Ba và Al2O3 (trong đó oxi chiếm 30,9% về khối lượng) tan hết vào
nước thu được dung dịch Y và 8,96 lít H2 (đktc).
Cho 3,1 lít dung dịch axit HCl 0,5M vào dung ịch d Y đến khi
phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Giá trị c a ủ m gần nh t ấ với: A. 8,0 B. 16,0 C. 21,0 D. 28,0 6 Truy c p
ậ trang Tuyensinh247.com h để c ọ Toán L – ý H – óa S – inh – Văn – Anh S – ử – Địa G – DCD
tốt nhất!
Hướng dẫn giải:
Do oxi chiếm 30,9% về khối lượng nên tính được nAl2O3 = 0,3 mol kim loại Kim loại M+ 46,6 gam X +H2O: x mol OH- y mol + H2 0,4 mol Al2O3 0,3 mol AlO2- 0,6 mol +H+: 1,55 mol Kết t a ủ
Đặt nH2O = x mol; nOH- = y mol
Bảo toàn nguyên tố H ta có: 2x = y + 0,8
Bảo toàn nguyên tố O ta có: 0,3.3 + x = y + 0,6.2 → 0,9 + x = y + 1,2
Giải hệ ta có x = 0,5 và y = 0,2 H++ OH- → H2O 0,2 ← 0,2
H+ + AlO2- +H2O → Al(OH)3↓ 0,6 0,6 0,6 ← 3H+ + Al(OH)3 → Al3 + 3H2O 0,75 0,6 0,75 → 0,25
Vậy nAl(OH)3 = 0,6 - 0,25 = 0,35 mol suy ra mAl(OH)3 = 0,35.78 = 27,3 gam gần nhất với giá trị 28,0 nhất. Đáp án D
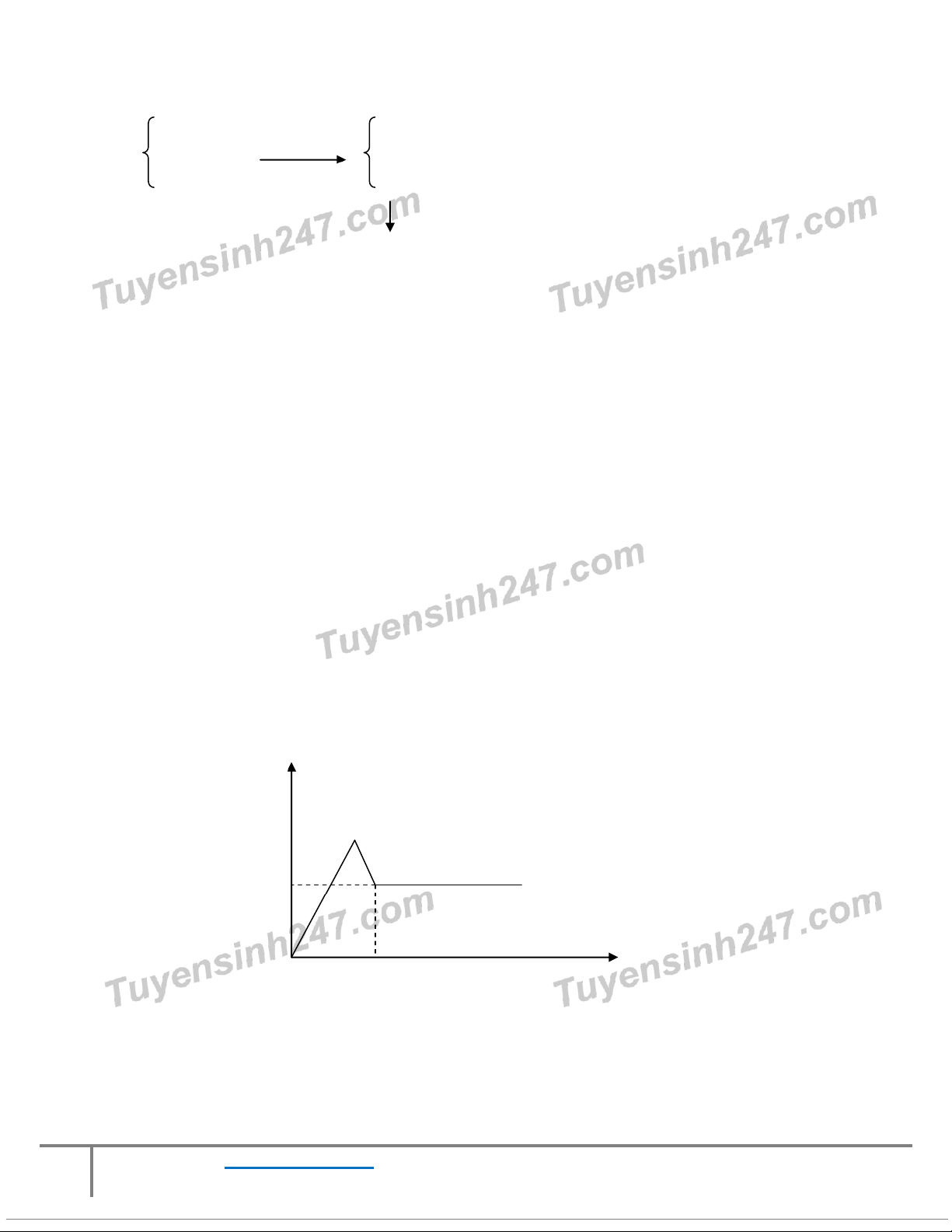
Câu 20: Cho 10,72 gam h n ỗ hợp g m
ồ Al(OH)3 và FeSO4 vào dung dịch chứa a mol H2SO4 loãng dư thu được
dung dịch X. Cho Ba(OH)2 dư vào X, phản ứng được biểu diễn theo đồ thị sau: Số mol kết t a ủ 0,25 0,22 Số mol Ba(OH)2 Giá trị c a ủ a là: A. 0,05 B. 0,1 C. 0,15 D. 0,2
Hướng dẫn giải: 7 Truy c p
ậ trang Tuyensinh247.com h để c ọ Toán L – ý H – óa S – inh – Văn – Anh S – ử – Địa G – DCD
tốt nhất! Al(OH)3 x mol Al3+ x mol 10,72 gam + H2SO4 a mol → Fe2+ y mol FeSO4 y mol H+ 2a-3x mol SO42- a+y mol
+ Ba2+ 0,22 mol; OH-: 0,44 mol BaSO4 a+y mol Fe(OH)2 y mol Ta có 78x + 152y = 10,72 gam Số mol kết t a
ủ bằng a + y + y = 0,25 mol → a + 2y = 0,25
Tại thời điểm OH- phản ứng vừa đủ với các chất: nOH- = nH+ + 2.nFe2+ + 4.nAl3+ = 2a - 3x + 2y + 4x = 0,44
Giải 3 phương trình trên ta có a = 0,15; x = 0,04; y = 0,05 Đáp án C 8 Truy c p
ậ trang Tuyensinh247.com h để c ọ Toán L – ý H – óa S – inh – Văn – Anh S – ử – Địa G – DCD
tốt nhất!




