


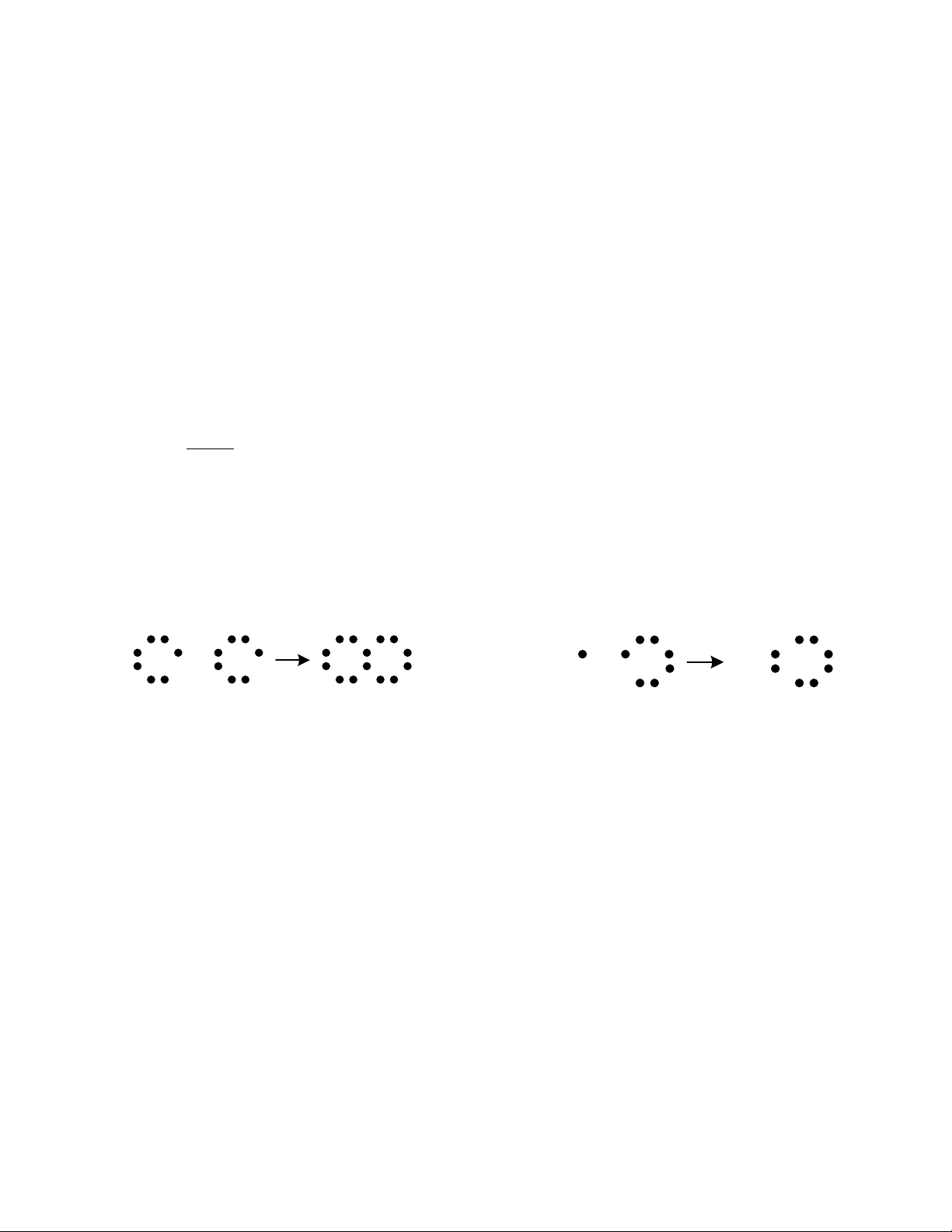









Preview text:
Trường ĐHBK Hà Nội
Bộ môn Hệ thống điện BÀI GIẢNG
VẬT LIỆU ĐIỆN VÀ CAO ÁP Người soạn: Phạm Thành Chung Chungpt-fee@mail.hut.edu.vn 1 Hà Nội, tháng 10-2011 CHƯƠNG I
CẤU TẠO VẬT CHẤT
1.1 NGUYÊN TỬ, PHÂN TỬ VÀ CÁC DẠNG LIÊN KẾT
1.1.1 Cấu tạo nguyên tử
Như chúng ta đã biết mọi vật chất được cấu tạo từ nguyên tử và phân tử. Nguyên tử là
thành phần cơ bản nhất của vật chất. Theo mô hình nguyên tử của Borh, nguyên tử được cấu
tạo bởi hạt nhân mang điện tích (+) và các điện tử (electron) mang điện tích (-) chuyển động
xung quanh hạt nhân theo 1 quĩ đạo nhất định.
Hạt nhân nguyên tử gồm:
+ Nơtron - không mang điện tích
+ Prôton - mang điện tích (+) với số lượng là: Q = Z.q
Với Z- số lượng điện tử của một nguyên tử
q- điện tích của điện tử e (qe=1,602. 10-19 )
Ở điều kiện bình thường (nhiệt độ phòng) nguyên tử được trung hòa về điện, tức là trong 2
nguyên tử có tổng các điện tích dương của hạt nhân bằng tổng các điện tích âm của điện tử.
+ Khi mất điện tử: nguyên tử trở thành ion (+)
+ Khi nhận điện tử: nguyên tử trở thành ion (-)
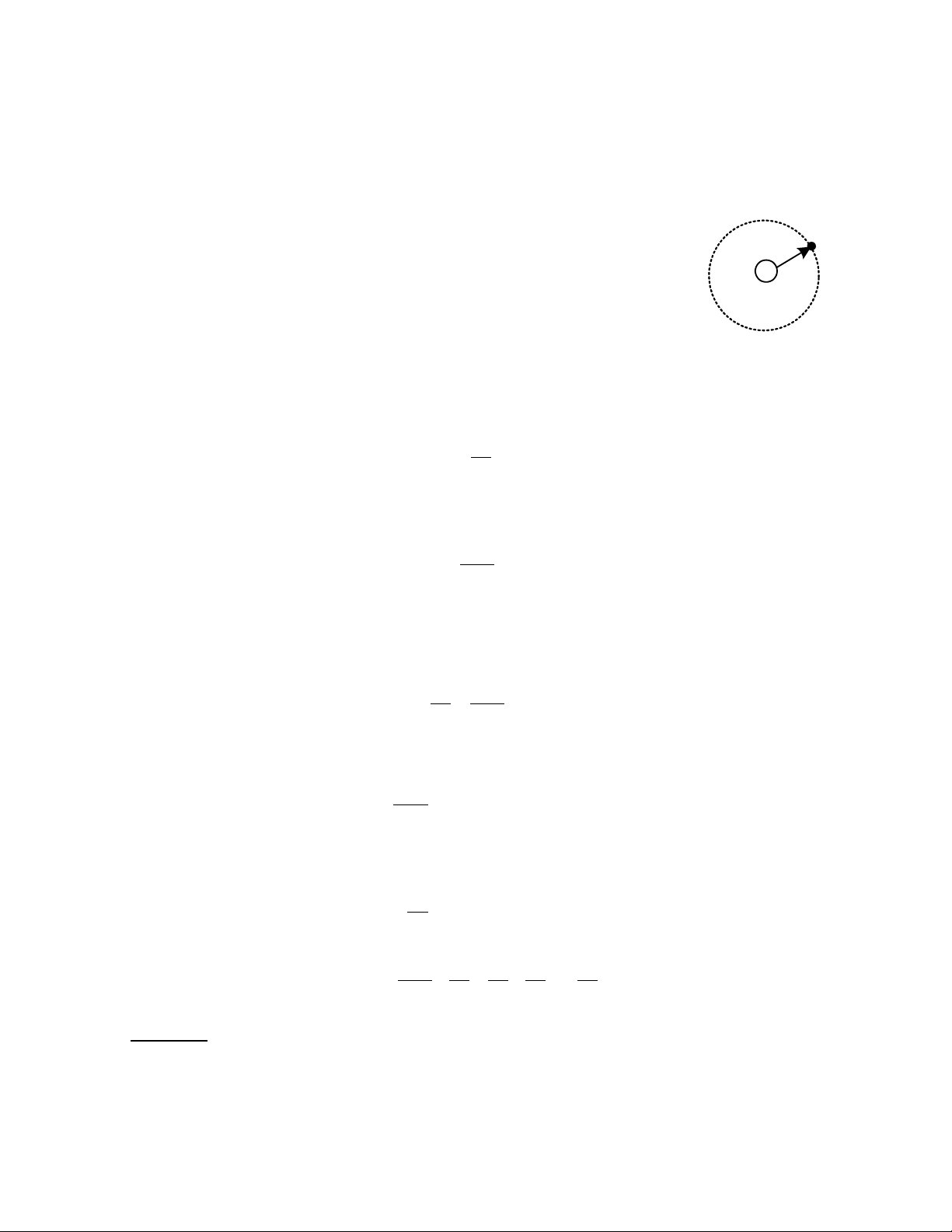
Năng lượng của điện tử: e
Để có khái niêm về năng lượng của điện tử ta xét nguyên tử r +
của Hydro, nguyên tử này được cấu tạo từ một proton và một điện tử.
Khi điện tử chuyển động trên quỹ đạo tròn bán kính r xung quanh Hình 1-1 Quỹ đạo chuyển
hạt nhân thì điện tử sẽ chịu lực hút của hạt nhân f động của điện tử 1: 2 q f = (1-1) 1 2 r
Lực hút f1 sẽ được cân bằng với lực ly tâm trong quá trình chuyển động: 2 mv f = (1-2) 2 r
Trong đó: m- khối lượng của điện tử
v- tốc độ chuyển động của điện tử 2 2
Ở điều kiện bình thường: q mv f = f ⇔ = (1-3) 1 2 2 r r
Năng lượng của điện tử: W = T + U 2 mv Động năng T: T = (1-4) 2 2 q Thế năng U: U = − (1-5) r 2 2 2 2 2 mv q q q q W= − = − = − (1-6) 2 r 2r r 2r Nhận xét:
Biểu thức (1-6) chứng tỏ rằng mỗi điện tử của nguyên tử có một mực năng lượng nhất
định, năng lượng này tỷ lệ nghịch với bán kính của quỹ đạo chuyển động của điện tử. 3
Để di chuyển điện tử từ quỹ đạo chuyển động bán kính r ra xa vô cùng cần phải cung 2
cấp cho nó một năng lượng lớn hơn hoặc bằng q . 2r
Năng lượng tối thiểu cung cấp cho điện tử để điện tử tách rời khỏi nguyên tử trở thành
điện tử tự do gọi là năng lượng ion hóa (Wi). Khi bị ion hóa (bị mất điện tử), nguyên tử trở
thành ion dương. Quá trình biến nguyên tử trung hòa thành ion dương và điện tử tự do gọi là
quá trình ion hóa.
Trong một nguyên tử năng lượng ion hóa của các lớp điện tử khác nhau cũng khác
nhau, các điện tử hóa trị ngoài cùng có mức năng lượng ion hóa thấp nhất vì chúng cách xa hạt nhân.
Khi điện tử nhận được năng lượng nhỏ hơn năng lượng ion hóa chúng sẽ bị kích thích
và có thể di chuyển từ mức năng lượng này sang mức năng lượng khác, xong chúng luôn có
xu thế trở về vị trí trạng thái ban đầu. Phần năng lượng cung cấp để kích thích nguyên tử sẽ
được trả lại dưới dạng năng lượng quang học (quang năng).
Trong thực tế, năng lượng ion hóa và năng lượng kích thích nguyên tử có thể nhận
được từ nhiều nguồn năng lượng khác nhau, ví dụ: nhiệt năng, quang năng, điện năng, năng
lượng của các tia sóng ngắn như: α, β, γ hay tia rơnghen…
1.1.2 Cấu tạo phân tử
Năng lượng liên kết của một phân tử là năng lượng tối thiểu để tách các nguyên tử của
chúng và đưa chúng ra một khoảng cách đủ lớn để chúng không còn tương tác với
nhau nữa. Năng lượng liên kết thường được biểu diễn bằng đơn vị eV/mol hoặc kJ/mol (1kJ/mol=1.037. 10-2eV/mol).
Tuỳ theo vị trí trong bảng Mendeleev, các nguyên tử liên kết với nhau bằng các liên
kết hoá trị với các bản chất khác nhau. Theo độ mạnh yếu của liên kết hoá trị người ta chia
làm các loại liên kết hoá trị mạnh và liên kết hoá trị yếu. Liên kết hoá trị mạnh bao gồm liên
kết ion, liên kết cộng hoá trị và liên kết kim loại. Trong khi đó liên kết hoá trị yếu bao gồm
liên kết Van der Waals và liên kết hydro. Liên kết ion và liên kết cộng hoá trị đặc trưng cho
các oxít và sunphít trong khi các điện môi chủ yếu được tạo thành từ các liên kết Van der
Waals và hydro. Rất ít phân tử được tạo thành từ một loại liên kết duy nhất, chúng thường có
từ hai đến ba loại liên kết trong đó có một loại liên kết mạnh hơn cả. Ví dụ trong tinh thể Ga 4
As thì liên kết cộng hoá trị mạnh hơn hai lần so với liên kết ion, trong khi đó phân tử NaCl thì
liên kết ion chiếm tới 94% sau đó mới đến liên kết cộng hoá trị. Còn Silicum thì cấu tạo thuần
tuý là liên kết cộng hoá trị. Đặc tính của từng loại vật chất như điện, cơ, lý, hóa…do liên kết
chủ yếu trong nó quyết định. Sau đây ta đi vào chi tiết từng loại liên kết
1.1.3 Các dạng liên kết
a. Liên kết đồng hoá trị
Liên kết đồng hoá trị được đặc trưng bởi sự dùng chung những điện tử của các
nguyên tử trong phân tử. Khi đó mật độ đám mây điện tử giữa các hạt nhân trở thành bão
hòa, liện kết phân tử bền vững.
Ví dụ: Phân tử Clo (Cl2) gồm 2 nguyên tử Clo, mỗi nguyên tử Clo có 17 điện tử,
trong đó có 7 điện tử hoá trị ở lớp ngoài cùng. Hai nguyên tử này được liên kết bền vững
với nhau bằng cách sử dụng chung hai điện tử, lớp vỏ ngoài cùng của mỗi nguyên tử được
bổ xung thêm 1 điện tử của nguyên tử kia. Cl + Cl Cl Cl H + Cl H Cl
Hình 1-2 Liên kết đồn hóa trị trong phân tử Cl2 và HCl
Tuỳ thuộc vào cấu trúc đối xứng hay không đối xứng mà phân tử liên kết đồng hoá trị có
thể là trung tính hay cực tính (lưỡng cực).
- Phân tử có trọng tâm của các điện tích dương và âm trùng nhau là phân tử trung
tính (không cực tính). Các chất tạo nên từ các phân tử trung tính được gọi là chất trung
tính. (chẳng hạn như: Cl2, H2…)
- Phân tử có trọng tâm của các điện tích dương và âm không trùng nhau, cách nhau
một khoảng a nào đó là phân tử cực tính (lưỡng cực). Các chất tạo nên từ các phân tử cực
tính được gọi là chất cực tính. (chẳng hạn như: HCl…)
Liên kết đồng hóa trị còn thấy ở cả chất rắn vô cơ có mạng tinh thể cấu tạo từ các nguyên
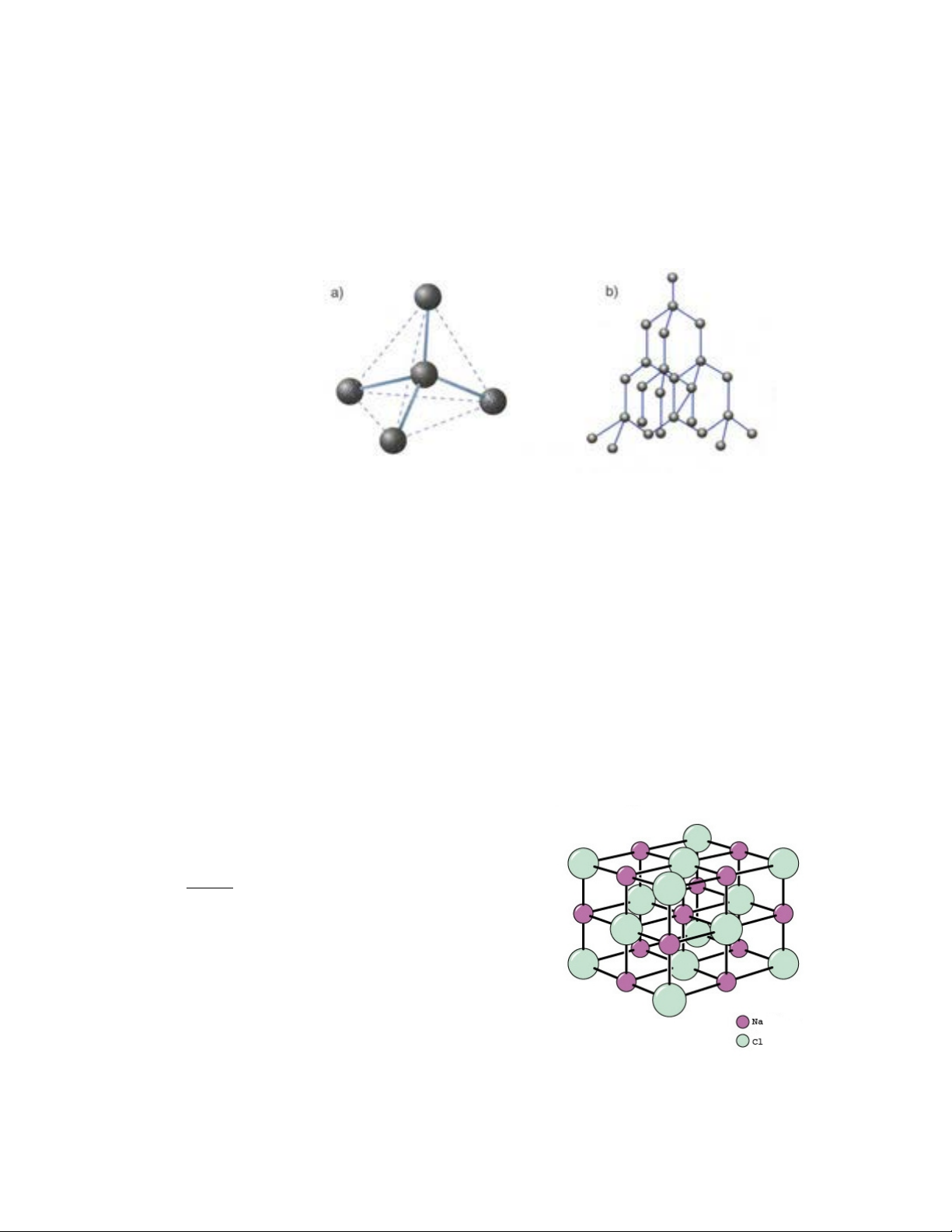
tử, ví dụ như kim cương (hình vẽ 1-3) 5
Hình 1-3: Mô hình cấu trúc tinh thể kim cương.
a. Sự sắp xếp tứ diện của bốn nguyên tử C xung quanh nguyên tử C trung tâm ở kim cương, b. Tinh thể kim cương
Tinh thể nguyên tử cấu tạo từ những nguyên tử được sắp xếp một cách đều đặn, theo
một trật tự nhất định trong không gian tạo thành một mạng tinh thể. Ở các điểm nút của mạng
tinh thể là những nguyên tử liên kết với nhau bằng các liên kết cộng hóa trị. b. Liên kết ion
Liên kết ion được xác lập bởi lực hút giữa các ion (+) và các ion (-) trong phân tử. Lực
liên kết này là rất lớn nên là liên kết khá bền vững, có độ bền cơ học và nhiệt độ nóng chảy cao.
Ví dụ: muối NaCl nguyên tử kim loại kiềm Na
có một điện tử ở lớp ngoài cùng liên kết yếu với hạt
nhân luôn có xu hướng nhường điện tử này đi để tạo
thành cation Na+ và nguyên tử halogen Cl có lớp
ngoài thiếu một điện tử nên sẵn sàng nhận điện tử do
nguyên tử Na nhường để trở thành anion Cl- có cấu
hình ổn định. Liên kết ion gây bởi lực hút Coulomb
Hình 1-4: Cấu trúc liên kết ion clorua natri
giữa các ion tích điện trái dấu từ quá trình cho nhận 6
kể trên. Clorua natri tạo thành các tinh thể có cấu trúc cân đối lập phương. Trong các tinh
thể này, các ion clorua lớn hơn được sắp xếp trong khối khép kín lập phương, trong khi các
ion natri nhỏ hơn điền vào các lỗ hổng bát diện giữa chúng. Mỗi ion được bao quanh bởi 6 ion khác loại.
Khả năng tạo nên một chất hoặc một hợp chất mạng không gian nào đó phụ thuộc
chủ yếu vào kích thước nguyên tử và hình dáng lớp điện tử hóa trị ngoài cùng. c. Liên kết kim loại
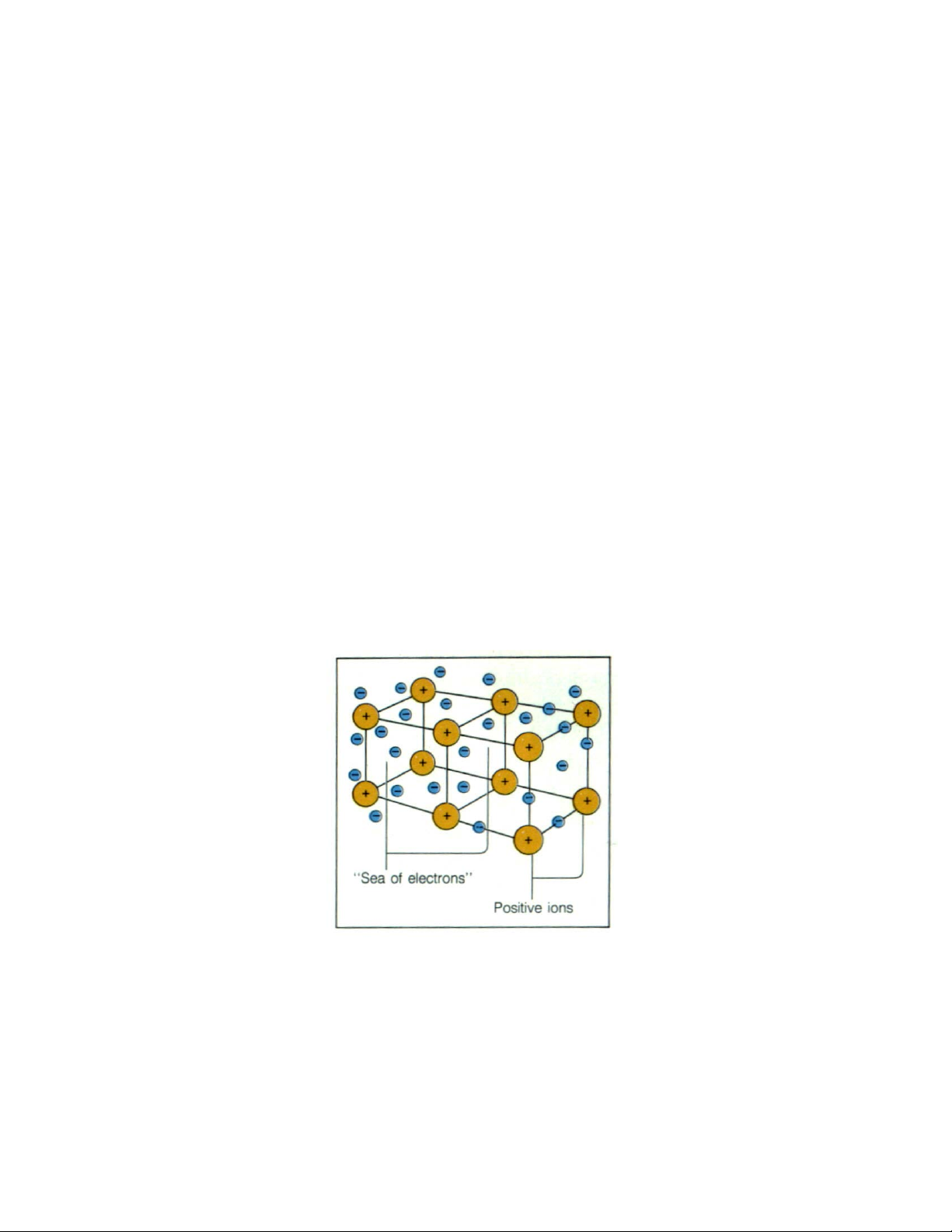
Dạng liên kết này tạo nên trong các tinh thể vật rắn (kim loại). Kim loại được coi
như là 1 hệ thống cấu tạo từ các ion dương nằm trong môi trường các điện tử tự do.
Lực hút giữa các ion dương và các điện tử tự do tạo nên tính nguyên khối của kim
loại. Vì vậy đây là liên kết bền vững, có độ bền cơ học và nhiệt độ nóng chảy cao.
Sự tồn tại của các điện tử tự do làm cho kim loại có tính ánh kim và tính dẫn điện,
dẫn nhiệt cao. Tính dẻo của kim loại được giải thích bởi sự dịch chuyển và trượt trên nhau
giữa các lớp ion, cho nên kim loại dễ cán kéo thành lớp mỏng.
Hình 1-5: Mô hình liên kết kim loại với các ion dương cố định ở nút mạng
liên kết với “biển điện tử” xung quanh 7
d. Liên kết Van der Waals
Trong liên kết sơ cấp, các nguyên tử đều có xu hướng tạo nên cấu hình điện tử
của các nguyên tử khí hiếm bằng cách cho nhận hoặc chia sẻ điện tử. Thực tế thì các
nguyên tử vẫn có thể tạo thành liên kết với nhau mà không cần cho nhận hay chia sẻ điện
tử, ví dụ như ở nhiệt độ thấp các nguyên tử khí hiếm đều liên kết với nhau để tạo thành
dạng dạng lỏng hay rắn. Như vậy phải có một loại liên kết nào đó hình thành giữa các
nguyên tử khí hiếm ở nhiệt độ thấp, mà ta biết rằng cấu trúc đối xứng hoàn hảo của các
điện tử trong nguyên tử khí hiếm không tạo ra bất kỳ điện trường nào bên ngoài chúng.
Liên kết đó được gọi là liên kết Van der Waals hay là một dạng của liên kết thứ cấp.
Liên kết Van der Waals có mặt trong tất cả các vật liệu nhưng nó rất yếu so với
các liên kết sơ cấp. Năng lượng liên kết của liên kết VdW thường nhỏ hơn 40kJ/mol. Nó
là nguyên nhân dẫn tới sự hoá lỏng hay sự hoá rắn của các khí như H2, N2, O2…
1.1.4 Cấu trúc tinh thể và khuyết tật trong cấu tạo mạng tinh thể
Như vậy tính chất của vật liệu phụ thuộc rất lớn vào cấu trúc của nó ở cỡ nguyên tử
như tương tác giữa hạt nhân với điện tử, giữa nguyên tử với các điện tử của các
nguyên tử bên cạnh hoặc với các nguyên tử bên cạnh thông qua các trị số như khoảng cách
ổn định giữa các nguyên tử, góc liên kết hay số ion liên kết với ion mốc, độ âm điện…Trong
phần này chúng ta sẽ đề cập đến cấu trúc của vật liệu nhưng ở cỡ lớn hơn cỡ nguyên tử: cấu
trúc của vật liệu do trong tập hợp của rất nhiều nguyên tử hay còn gọi là kích cỡ xa (long range order-LRO).
Trong chất rắn nói chung các nguyên tử được cố định tại các vị trí nhất định, đó là lí
do tại sao nó được gọi là chất rắn. Khi chất rắn được cung cấp một lượng nhiệt vừa đủ, liên
kết để làm các nguyên tử cố định bị đứt và chúng có xu hướng di chuyển một cách hỗn loạn.
Trong trường hợp này nếu các nguyên tử vẫn còn giữ được khoảng cách tương đối gần nhau
chất rắn sẽ chuyển thành chất lỏng. Nếu tiếp tục tăng nhiệt lượng cung cấp để cho các nguyên
tử có khả năng rời nhau ra xa và các nguyên tử có thể di chuyển trong những khoảng cách rất
xa mà không va chạm với nhau, khi đó chất lỏng trở thành chất khí. Ba trạng thái này thay
đổi cho nhau khi nhiệt độ hoặc áp suất thay đổi. Như vậy cấu trúc của chất rắn là cơ sở cho
các hiểu biết về chất lỏng và khí nên sẽ được đề cập một cách tương đối chi tiết trong phần
này để chúng ta nắm được những khái niệm về cấu trúc của vật chất nói chung.
Chất rắn được chia làm hai loại cơ bản: một loại theo quy luật sắp xếp của vị trí các
nguyên tử trên khoảng cách xa (LRO) và loại kia không theo quy luật nào cả. Loại vật liệu 8
thứ nhất được gọi là có cấu trúc tinh thể (crystal), còn loại thứ hai được gọi là cấu trúc vô
định hình (amorphous). Chất rắn vô định hình chủ yếu là thủy tinh và một số loại chất dẻo,
các phân tử của chất rắn vô định hình được sắp xếp một cách hỗn độn giống như ở trạng thái
lỏng, vì thế nó còn được gọi chẩt lỏng siêu mát (supercooled liquide). Ở chất rắn vô định
hình, ở điểm nóng chảy khi chuyển từ trạng thái rắn sang lỏng không có sự thay đổi đột ngột
về pha mà nó mềm dần khi tăng dần nhiệt độ đốt nóng. Tính chất vật lý của chất rắn vô định
hình là giống nhau đối với mọi hướng vì thế người ta còn gọi nó là có tính đẳng hướng.
Hơn 90% các chất rắn tồn tại trong tự nhiên hoặc được sản xuất nhân tạo có dạng tinh
thế, có thể kể ra một số loại có cấu trúc tinh thể như đất sét (clay), đá vôi
(limestone), carbon (kim cương hoặc than chì), muối (NaCl hoặc KCl), kim loại …
1.1.4.1 Cấu trúc mạng tinh thể
Cấu trúc của hầu hết vật liệu ở cỡ nguyên tử đều là cấu trúc tinh thể, có nghĩa là các
nguyên tử trong vật liệu được sắp xếp một cách có trật tự và tuần hoàn. Trong không gian
ba chiều có 14 cách khác nhau để phân bố tuần hoàn các điểm sao cho mỗi điểm có cùng số
điểm bên cạnh được sắp xếp theo cùng một khoảng cách và cùng hướng. Người ta định
nghĩa một ô cơ sở (unit cell) là cấu trúc nhỏ nhất của cấu trúc tinh thể sao cho nó lặp lại
chính nó khi ta dịch chuyển nó trong tinh thể. Điểm mấu chốt của ô cơ sở là nó bao hàm
cấu trúc đấy đủ của tinh thể và một mạng tinh thể hoàn chỉnh là do sự sắp xếp liên tiếp các
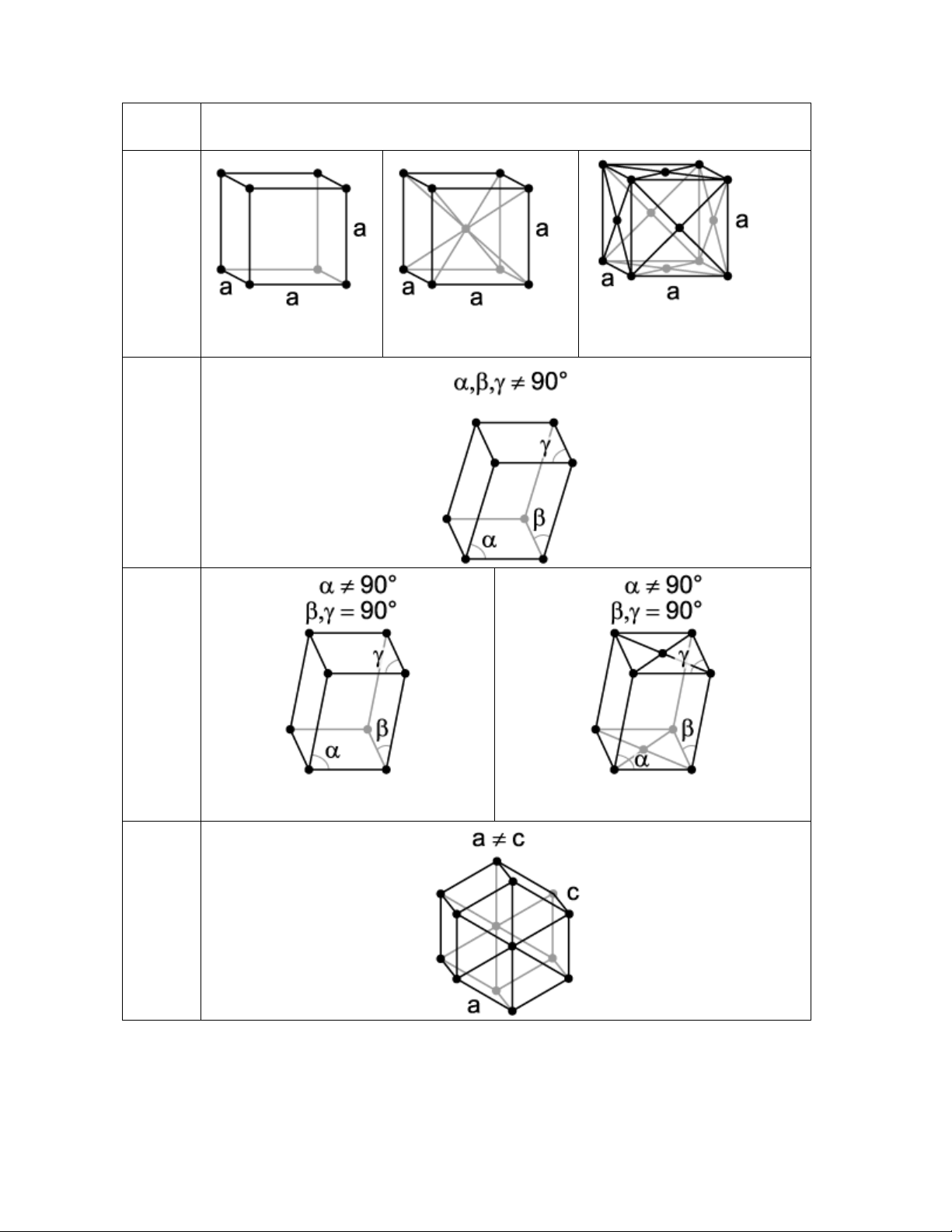
ô cơ sở đó trong không gian ba chiều. Mỗi hình dáng cụ thể của ô cơ sở gọi là hệ tinh thể
(crystal system). Coi nguyên tử là những hình cầu cố định trong cấu trúc, tùy theo khoảng
cách giữa các nguyên tử của ô cơ sở trong không gian ba chiều (các cạnh a, b và c) và góc
tạo bởi các cạnh, chỉ có 7 hệ tinh thể có thể tồn tại trong không gian bao gồm: lập phương
(cubic system), trụ tù (triclinic system), trụ đứng hình thoi (monoclinic system), bát trụ
(hexagonal system), tứ trụ (tetragonal system), orthorhomic system, rhombohedral
system. Nguyên tử có thể đặt được đặt trên các vị trí tâm đối xứng trên 7 hệ tinh thể này để
tạo thành 14 ô lưới (lattice) tinh thể khác nhau hay còn gọi là 14 lưới Bravais. 7 hệ tinh thể
và biến thể thành 14 ô lưới Bravais được trình bày trên bảng 1.1 9 Hệ tinh Dạng ô lưới thể Cubic Dạng đơn giản
Dạng đối xứng qua tâm Dạng đối xứng qua mặt (simple) (body centered) (face centered) Triclinic Monoclini c Dạng đơn giản (simple)
Dạng đối xứng qua hai mặt (base centered) Hexagonal 10 Tetragonal Dạng đơn giản (simple)
Dạng đối xứng qua tâm (body centered) Orthorho mic Dạng đơn
giản Đối xứng qua hai mặt Đối xứng qua tâm (body Đối xứng qua mặt (face (simple) (base centered) centered) centered) Rhombohe dral
Bảng 1.1 : 7 hệ tinh thể cơ bản và 14 ô lưới Bravais
Phần lớn kim loại có cấu trúc tinh thể là một trong ba dạng ô lưới: lập phương
đối xứng tâm và lập phương đối xứng mặt. Gốm và thủy tinh có thành phần hóa học phức
tạp hơn kim loại và vì thế cấu trúc tinh thể cũng đa dạng hơn với nhiều dạng ô lưới
khác nhau. Vì thế tính chất của gốm cũng thay đổi theo, ví dụ trong khi gốm được coi là
chất cách điện và cách nhiệt rất tốt thì ôxít gốm (ceramic oxide) với nền tảng là Y-Ba-
Cu-O được dùng để chế tạo vật liệu siêu dẫn ở nhiệt độ cao. Cũng phải lưu ý rằng cấu trúc
của gốm có thể rất phức tạp chứ không chỉ là có cấu trúc thuần tinh thể, cấu trúc của gốm
có thể là hoàn toàn vô định hình, hoàn toàn là tinh thể hoặc hỗn hợp tinh thể- vô định
hình. Polymer với cấu tạo từ trùng hợp các monomer có cấu trúc tinh thể phức tạp.
Các polymer thương mại thường chỉ có cấu trúc tinh thể một phần. Còn phần lớn các chất
bán dẫn có cấu trúc tinh thể có độ tinh khiết cao. 11
1.1.4.2 Khuyết tật trong mạng tinh thể
Trong thực tế ta không thể có được một vật liệu với cấu trúc tinh thể hoàn hảo mà
không có bất kỳ một tạp chất hóa học nào. Sự xuất hiện của các nguyên tử hay ion lạ sẽ
làm thay đổi tính tuần hoàn của cấu trúc tinh thể cũng như độ tinh khiết của vật chất.
Tương tự như vậy, tính chất của mạng tinh thể cũng sẽ bị ảnh hưởng khi tại một vị trí nào
đó trên ô lưới bị mất đi một nguyên tử hoặc một ion. Sự mất tuần hoàn trong một cấu trúc
tinh thể như vậy được gọi là sai hỏng (hay khuyết điểm) trong mạng tinh thể. Thông
thường người ta phân loại sai hỏng trong mạng tinh thể theo chiều của nó trong không gian bao gồm:
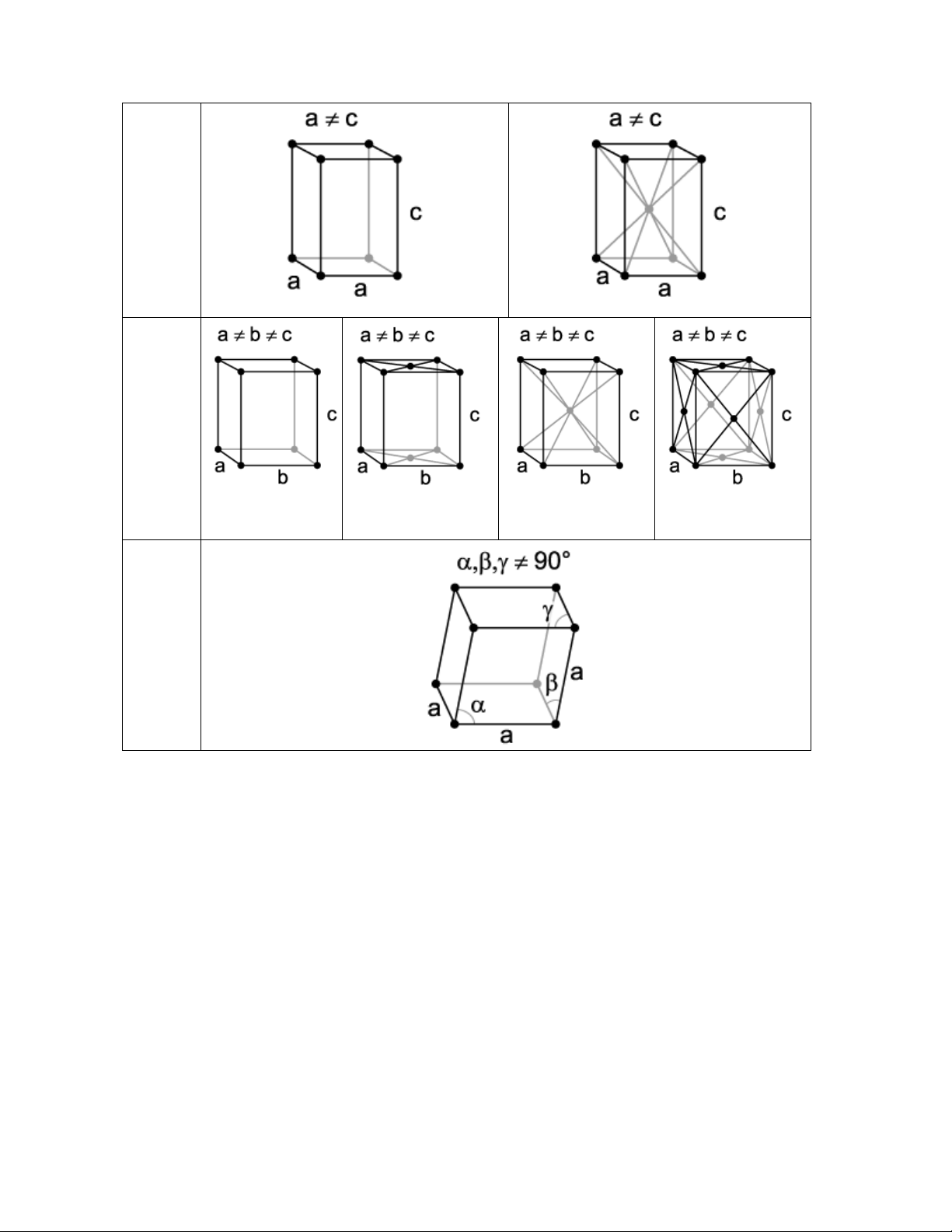
a. Sai hỏng điểm (point defect) hay sai hỏng không có chiều
Loại sai hỏng điểm này gồm có lỗ trống (vacancies), kẽ hở (interstitial) và tạp
chất (impurity). Lỗ trống là một vị trí trong ô lưới tinh thể bình thường có một nguyên tử
giữ, tuy nhiên vì một lý do nào đó nó không còn nằm ở vị trí đó nữa nên để lại một lỗ
trống. Trong một tinh thể hoàn hảo các nguyên tử nằm ở những nút trong ô lưới, có
những vị trí giữa các nguyên tử là trống và bình thường không có nguyên tử nào của tinh 12
thể nằm ở đó. Khi một nguyên tử nằm ở những vị trí đó ta gọi là kẽ hở, nguyên tử tạo nên
kẽ hở này chính là nguyên tử của tinh thể. Nếu nguyên tử tạo kẽ hở là một nguyên tử lạ
hoặc một số nguyên tử ở nút mạng bị thay thế bằng nguyên tử lạ thì trường hợp đó ta gọi là tạp chất. Hình 1-6: Các dạng sai hỏng điểm
b. Sai hỏng đường (line defect) hay sai hỏng một chiều
Sai hỏng đường thường được gọi là sự trật khớp (dislocation) là hiện tượng một
vài nguyên tử trong lưới tinh thể không thẳng hàng. Sự trật khớp có hai loại: trật khớp
cạnh (edge dislocation) và trật khớp xoay (screw dislocation). Trật khớp đường viền(hình
1-7-a) giống như ta thêm (hoặc bớt) một nửa mặt phẳng chứa nguyên tử vào trong một
mạng tinh thể có trước, tưởng tượng hai nửa của mạng tinh thể chuyển động ra xa (hoặc
tiến lại gần) nhau hay nói cách khác là chuyển động theo hướng vuông góc với nửa mặt
phẳng thêm vào (hoặc bớt đi). Trật khớp xoay (hình 1-7-b) là do sự dịch chuyển tương đối
của nửa mạng tinh thể này so với nửa mạng tinh thể bên kia, nói cách khác là chúng
chuyển động song song so với nửa mặt phẳng thêm vào. Trong thực tế trật khớp trong
tinh thể của vật liệu hiếm khi chỉ là một trong hai loại trên mà nó là hỗn hợp của cả hai loại (hình 1-7-c).
Hình 1-7: Trật khớp đường viền, trật khớp xoay và trật khớp hỗn hợp 13
1.1.5 Lý thuyết phân vùng năng lượng trong chất rắn
Có thể sử dụng lý thuyết phân vùng năng lượng để giải thích, phân loại vật liệu
thành các nhóm vật liệu dẫn điện, bán dẫn và điện môi (cách điện).
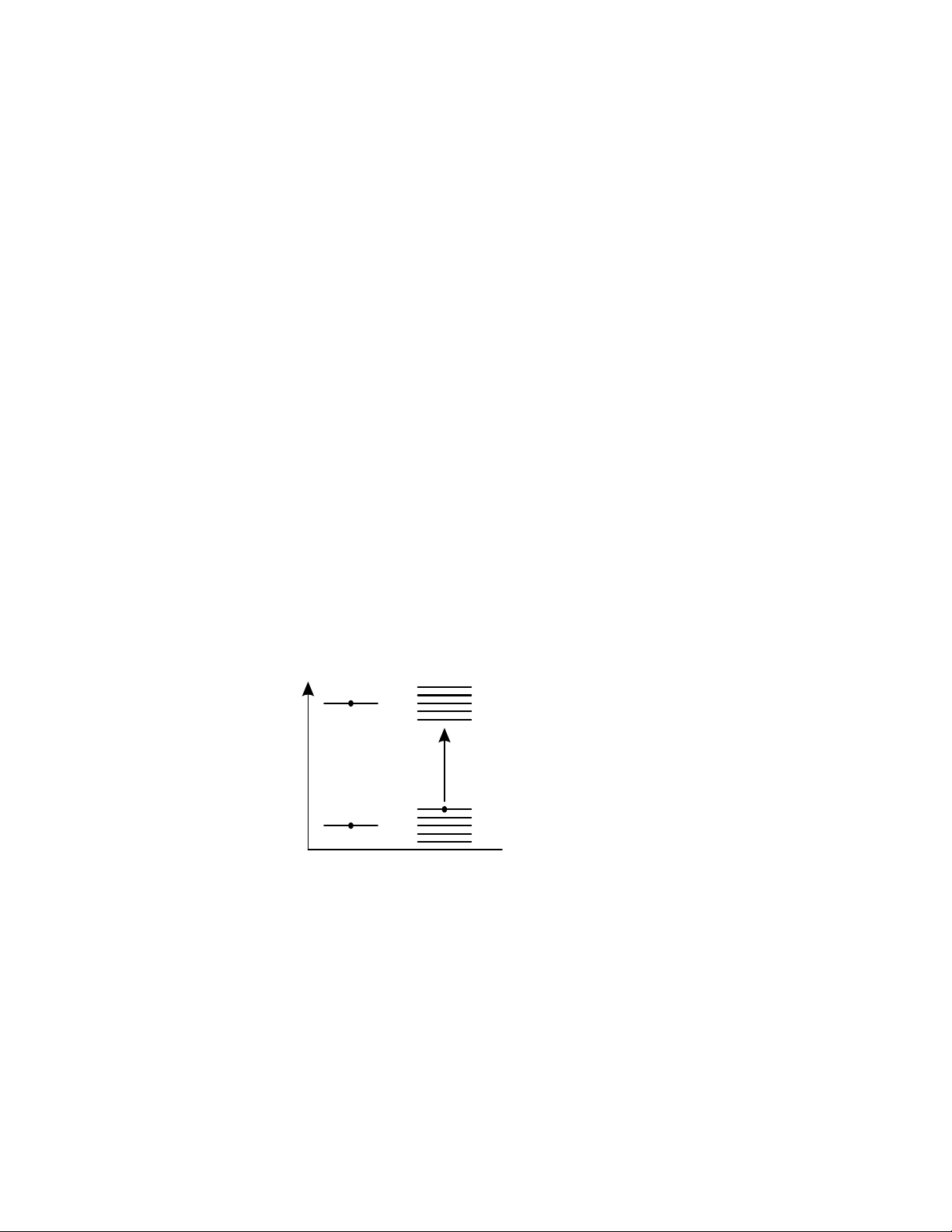
Mỗi điện tử tồn tại ở một mức năng lượng nhất định và được mô tả bằng bốn số
lượng tử. Mỗi khi thay đổi trạng thái chúng hấp thụ hoặc bức xạ một lượng tử năng
lượng. Ta tưởng tượng các mức năng lượng cho phép của điện tử giống như các vạch
trên một tờ giấy, khoảng cách giữa các vạch chính năng lượng chúng cần háp thụ hoặc
bức xạ để đạt đến trạng thái mới. Khi các nguyên tử kết hợp với nhau để tạo nên vật chất,
khoảng cách của chúng gần nhau đến nỗi các lớp, các phân lớp, các quỹ đạo xếp liên tiếp
lên nhau làm cho số lượng các mức năng lượng cho phép của điện tử (tức các vạch trên
tờ giấy) rất nhiều. Khi số nguyên tử tăng lên đến một số vô cùng lớn các mức năng
lượng cho phép gần như liên tục để tạo thành một vùng năng lượng cho phép. Tương tự
như thế, các mức năng lượng không được phép của điện tử khi có tương tác của nhiều
nguyên tử cũng tăng lên và tạo thành một vùng liên tục. Cả trạng thái cho phép và không
cho phép của điện tử tạo thành ba vùng năng lượng cơ bản sau: W Vùng tự do (điện dẫn) Vùng cấm (vùng trống) ΔW
Vùng hoá trị (vùng đầy) Nguyên tử Vật thể
Hình 1-8: Phân bố mức năng lượng nguyên tử riêng biệt và của vật rắn phi kim loại
- Vùng hoá trị (vùng đầy): Ở đây các điện tử hoá trị có mức năng lượng thấp.
- Vùng tự do (vùng điện dẫn): các điện tử vùng này có mức năng lượng cao hơn.
- Vùng cấm (vùng trống): nằm giữa vùng hoá trị và vùng tự do.
Để 1 điện tử trong vùng hoá trị trở thành điện tử tự do thì phải tích luỹ cho nó 1 năng lượng
W>ΔW (năng lượng vùng cấm). Tuỳ theo chiều rộng dải cấm mà người ta chia vật chất ra 3 dạng sau:
- Vật dẫn (có vùng tự do nằm sát vùng đầy, xếp chồng) ΔW < 0.2eV 14
- Bán dẫn (có vùng cắm hẹp hơn điện môi) ΔW =0.2-1.5eV
- Điện môi (có vùng cấm lớn ΔW=1.5-vài điện tử von (eV)
1.2 PHÂN LOẠI VẬT CHẤT THEO ĐỘ DẪN ĐIỆN VÀ TỪ TÍNH
1.2.1 Phân loại vật chất theo độ dẫn điện
Phân loại vật chất theo trị số của năng lượng vùng trống như trên không thực sự thuận
tiện, trong thực tế căn cứ vào trị số của điện trở suất người ta phân loại vật liệu thành
dẫn điện, bán dẫn hay cách điện. Vật liệu dẫn điện gồm các kim loại và các dẫn xuất là
các hợp kim ở điều kiện bình thường có điện trở suất nhỏ hơn 10-5 Ω.m. Nếu điện trở suất
của các vật liệu lớn hơn 108 Ω.m, thì người ta xếp chúng vào nhóm điện môi, tức là những
chất dẫn điện rất kém. Vật liệu cách điện được hiểu là các điện môi dẫn điện vô cùng kém
với điện trở suất từ 1010 Ω.m trở lên. Nhóm các vật liệu có điện trở suất nằm giữa các
chất dẫn điện và các điện môi gọi là vật liệu bán dẫn.
Theo định nghĩa của các thuật ngữ điện quốc tế, điện môi là các chất mà tính chất điện
từ cơ bản là khả năng bị phân cực dưới tác dụng của điện trường bên ngoài. Còn vật liệu cách
điện là các chất mà điện dẫn suất thường đủ nhỏ để có thể sử dụng làm các chất cách điện giữa
các phần dẫn điện mang điện áp khác nhau. Như vậy thuật ngữ "điện môi" mang tính chất
chung hơn thuật ngữ "cách điện" cho dù có đôi lúc chùng ta thường đồng nghĩa chúng với nhau.
1.2.2 Phân loại vật liệu theo từ tính
Theo từ tính, các vật liệu được chia thành vật liệu nghịch từ, vật liệu thuận từ và vật liệu sắt từ.
Nghịch từ là các chất có độ từ thẩm nhỏ hơn 1 và không phụ thuộc vào cường độ
từ trường ngoài. Loại này gồm hydro, các khí hiếm, đa số các hợp chất hữu cơ, các kim
loại đồng, bạc, kẽm, vàng, thuỷ ngân...
Thuận từ là các chất có độ từ thẩm lớn hơn 1 và cũng không phụ thuộc vào cường
độ từ trường ngoài. Loại này gồm oxy, nitơ, đất hiếm, kim loại kiềm, nhôm, bạch kim, muối coban, niken ...
Dẫn từ là các chất có độ từ thẩm lớn hơn rất nhiều so với 1 và phụ thuộc vào
cường độ từ trường ngoài. Loại này gồm sắt, niken, coban và các hợp chất của chúng,
hợp kim crôm với mangan, ferrite... 15 Phần I CHƯƠNG 2
VẬT LIỆU DẪN ĐIỆN VÀ BÁN DẪN
2.1 TÍNH DẪN ĐIỆN CỦA KIM LOẠI
Ở chương I chúng ta đã phân biệt ba loại vật liệu căn cứ vào độ rộng của vùng
trống trong phân vùng năng lượng của chúng. Trong tinh thể kim loại nguyên tử cố định
ở nút mạng và không di chuyển khi có tác dụng của điện trường ngoài. Chỉ có các điện
tửu trong vùng dẫn liên kết yếu với hạt nhân tham gia vào quá trình dẫn điện khi kim loại
đặt trong điện trường ngoài. Vì tính chất của điện tử quyết định quá trình dẫn điện của
kim loại nên trong phần này chúng ta đề cập chủ yếu đến đặc tính của điện tử, từ đó rút ra
các nhận xét về tính dẫn điện của kim loại.
2.1.1 Các điện tích chuyển động
Tính dẫn điện của các vật liệu là thước đo khả năng cho một dòng điện đi qua khi
nó được nối với một nguồn điện. Trước hết chúng ta tập trung vào xem xét sự chuyển
động các điện tích tự do nghĩa là dòng điện.
Ví dụ về các dòng điện có rất nhiều từ các dòng điện phóng điện sét đến các dòng 16
điên thần kinh rất nhỏ điều khiển các bắp thịt của chúng ta. Tuy dòng điện là dòng của
các điện tích chuyển động nhưng không phải mọi điện tích chuyển động đều tạo nên dòng
điện. Nếu ta nói một dòng điện đi qua một mặt đã cho thì phải có một dòng chảy thực sự
của các điện tích qua mặt đó, và sự chuyển động của các điện tích phải có một hướng xác định. 2.1.2. Dòng điện
Khi một khung dẫn cô lập, dù nó có điện tích hay không, mọi điểm của nó có
cùng một điện thế. Điện trường không thể tồn tại trong vật này hay song song với nó. Tuy
có các điện tử dẫn (điện tử tự do) nhưng không có lực điện tác dụng lên chúng và do đó không có dòng điện.
Nếu bây giờ ta đạt lên khung này một điện áp, ví dụ nối nó với một ắc qui thì nó
không còn ở cùng một điện thế nữa. Điện trường bên trong vật liệu tác dụng lên các điện
tử tự do và tạo thành một dòng chảy thực sự của các điện tích.
Nếu có một điện tích dq chuyển qua một mặt phẳng tưởng tượng trong thời gian
dt, thì dòng điện được định nghĩa là : 17 dq i = (2.1) dt
Ta có thể tính điện tích đi qua mặt phẳng trong khoảng thời gian từ 0 đến t bằng tích phân: t
q = ∫ dq = ∫ idt (2.2) 0
Với các điều kiện dừng được giả thiết gồm dòng điện không phải là hàm của thời
gian và dòng điện như nhau đối với tất cả các mặt phẳng bất kể sự định hướng của chúng
như thế nào, thì một điện tích đi vào điện môi hay một vật dẫn ở một đầu thì phải có một
điện tích đi ra ở đầu kia.
Đơn vị của dòng điện là Culông trên giây (C/s) hoặc ampe (A).
Dòng điện theo định nghĩa trên đây là một đại lượng vô hướng vì ở đây cả điện
tích và thời gian đều là các đại lượng vô hướng. Điều đó gây nên khó khăn vì ta thường
biểu diễn dòng điện bằng một mũi tên chỉ chiều chuyển động của các điện tích. Trên thực
tế nếu các điện tích tự do tham gia vào dòng điện mang điện tích âm chúng sẽ chuyển
động ngược với chiều của điện trường bên ngoài. Các điện tích dương chuyển động theo
chiều của điện trường. Vì các hạt mang điện tích khác nhau chuyển động theo chiều
ngược nhau nên ta phải chọn một trong hai dòng điện tích để biểu thị chiều của dòng
điện. Theo quy ước lịch sử, mũi tên chỉ chiều dòng điện được vẽ theo chiều chuyển động
của các điện tích dương, thậm chí ngay cả khi các hạt chuyển động không mang điện tích dương.
2.1.3. Mật độ dòng điện, vận tốc chuyển động của các điện tích và điện dẫn suất của vật liệu
a. Mật độ dòng điện
Khái niệm cường độ dòng điện cho ta biết độ mạnh của dòng điện qua một đơn vị
diện tích cho trước tuy nhiên nó không cho biết độ mạnh và hướng của dòng điện tại từng
điểm trong vật liệu có dòng điện chảy qua. Để đặc trưng cho độ mạnh của dòng điện tại
từng vị trí người ta đưa vào khái niệm mật độ dòng điện. Hình 2.1:
Xét một đơn vị thể tích dSdl được đặt dưới một hiệu điện thế dV (hình 2.1).
Người ta định nghĩa véc tơ mật độ dòng điện tại một điểm trong đơn vị thể tích này là
một véc tơ có hướng là hướng chuyển động của hạt mang điện dương đi qua điểm đó và
có độ lớn xác định bởi biểu thức: 18 j=dI/dS (A/m2) (2.3)
b. Vận tốc chuyển động của điện tích
Khi đặt dưới điện trường một số điện tử thoát khỏi liên kết với nguyên tử và
chuyển động trong tinh thể kim loại để tạo nên dòng điện. Trong quá trình di chuyển
chúng va chạm với các thành phần khác trong tinh thể, sau mỗi lần va chạm như vậy
đường đi của điện tử lại thay đổi. Các va chạm này có thể bao gồm:
• Va chạm điện tử-phonon, phonon là lượng tử năng lượng do các ion dao
động nhiệt trong tinh thể mạng bức xạ ra dưới dạng sóng âm. (Từ phonon
tương tự như từ photon- lượng tử năng lượng do sóng điện từ).
• Va chạm điện tử-sai hỏng mạng tinh thể, loại va chạm này là do sự rối
loạn về điện thế của mạng tinh thể đặt lên điện tử, loại sai hỏng của mạng
tinh thể trong trường hợp này do các biến dạng cơ học trong mạng tinh thể
gây ra, chủ yếu là do sai hỏng đường ( trật khớp)
• Va chạm điện tử-tạp chất trong tinh thể, tạp chất trong tinh thể ở đây là
trong trường hợp sai hỏng điểm với các nguyên tử lạ nằm ở nút mạng hoặc ở kẽ hở
Sau mỗi lần va chạm như thế vận tốc của điện tử cũng thay đổi một lượng bất kỳ
và giả thiết là thời gian va chạm rất nhỏ so với thời gian giữa hai lần va chạm, trị số của
thời gian giữa hai lần va chạm là một biến số ngẫu nhiên và trong tính toàn người ta dùng
giá trị thời gian trung bình giữa hai lần va chạm τ. Vận tốc của điện tử trong tinh thể bao
gồm hai thành phần: vận tốc chuyển động nhiệt hỗn loạn νt trong tinh thể khi không có
điện trường và vận tốc có hướng ν do ảnh hưởng của điện trường. Gọi quãng đường tự do
trung bình mà điện tử chuyển động được trước khi chịu một va chạm kế tiếp là x ta tính được: x = ν τ (2.4)
Với ν là trị số trung bình của vận tốc có hướng.
Nếu gọi n0 là mật độ khối của hạt mang điện, e là độ lớn điện tích của mỗi hạt
và ν là vận tốc có hướng trung bình thì trong một đơn vị thời gian số hạt mang điện dn di
qua diện tích dS chính là số hạt mang điện nằm trong đoạn ống có đáy là dS và chiều dài là ν : dn= n ν 0 dS (2.5)
Như vậy cường độ dòng điện chạy qua diện tích dS trong một đơn vị thời gian
theo định nghĩa ở công thức II.1 là:
dI= e dn= n0 e ν dS (2.6) 19
Như vậy biểu thức mật độ dòng điện có thể viết lại thành: j= n0 e ν (2.7)
Mà vận tốc trung bình có hướng của hạt mang điện được tính theo tỉ lệ giữa
khoảng cách di chuyển trung bình x và thời gian giữa hai lần va chạm trung bình τ theo công thức 2.4, ta suy ra : ν x e = = aτ = τE τ (2.8) mn
Trong đó a là gia tốc của hạt mang điện và m là khối lượng n của hạt mang điện.
Mặt khác, theo định luật Ohm ta có: j=σE (2.9)
Với σ là điện dẫn suất của vật liệu
Từ các biểu thức 2.7, 2.8 và 2.9 trên ta rút ra: 2 n e τ o ρ= = n eµ m o n (2.10) n
Từ công thức 2.10 ta nhận thấy điện dẫn suất (hay khả năng dẫn điện) của vật liệu
tỉ lệ thuận với mật độ điện tích khối của hạt mang điện và độ linh động của chúng. Điều
này có nghĩa là, một vật liệu dẫn điện tốt thì điều kiện cần thiết là cả n đều 0 và µn phải có
những giá trị lớn. Cụ thể trong các vật liệu dẫn điện, mật độ các điện tích tự do và các độ
linh động của chúng rất lớn nên chúng dẫn điện rất tốt. Ngược lại trong các điện môi, chỉ
có rất ít các điện tích tự do có thể tham gia vào quá trình dẫn điện, điện dẫn suất rất nhỏ
nên chúng là những vật liệu cách điện. Trong các vật liệu bán dẫn điện, độ linh hoạt của
các điện tử lớn hơn trong các kim loại nhưng điện dẫn suất của chúng vẫn bé hơn bởi vì
mật độ điện tích tự do trong các vật liệu bán dẫn nhỏ hơn từ 106 đến 108 lần so với trong
các vật liệu dẫn điện.
Biểu thức điện dẫn suất có thể viết cho trường hợp tổng quát trong đó hạt mang
điện có các bản chất khác nhau (điện tử, ion, lỗ trống…) như sau: p σ = ∑ n e µ (2.11) 0i i ni i =1 20




