






Preview text:
BÀI TẬP
Câu 1: Cho các hợp chất sau: HCl, H2O, H2S, NH3, CH4, F2, N2. Cho biết loại liên kết trong các phân tử
trên và liên kết nào trong phân tử trên là phân cực mạnh nhất.
Câu 2: So sánh độ phân cực của các liên kết trong phân tử H2, HCl, HF, HI, HBr.
Câu 3: So sánh độ phân cực của các liên kết trong các hợp chất sau: CH4, NH3, H2O, HF.
Câu 4: Cho dãy các oxit sau: Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7.
a. Cho biết độ phân cực của các liên kết trong cùng dãy oxit trên của các nguyên tử thay đổi như thế nào.
b. Cho biết loại liên kết trong các oxit trên.
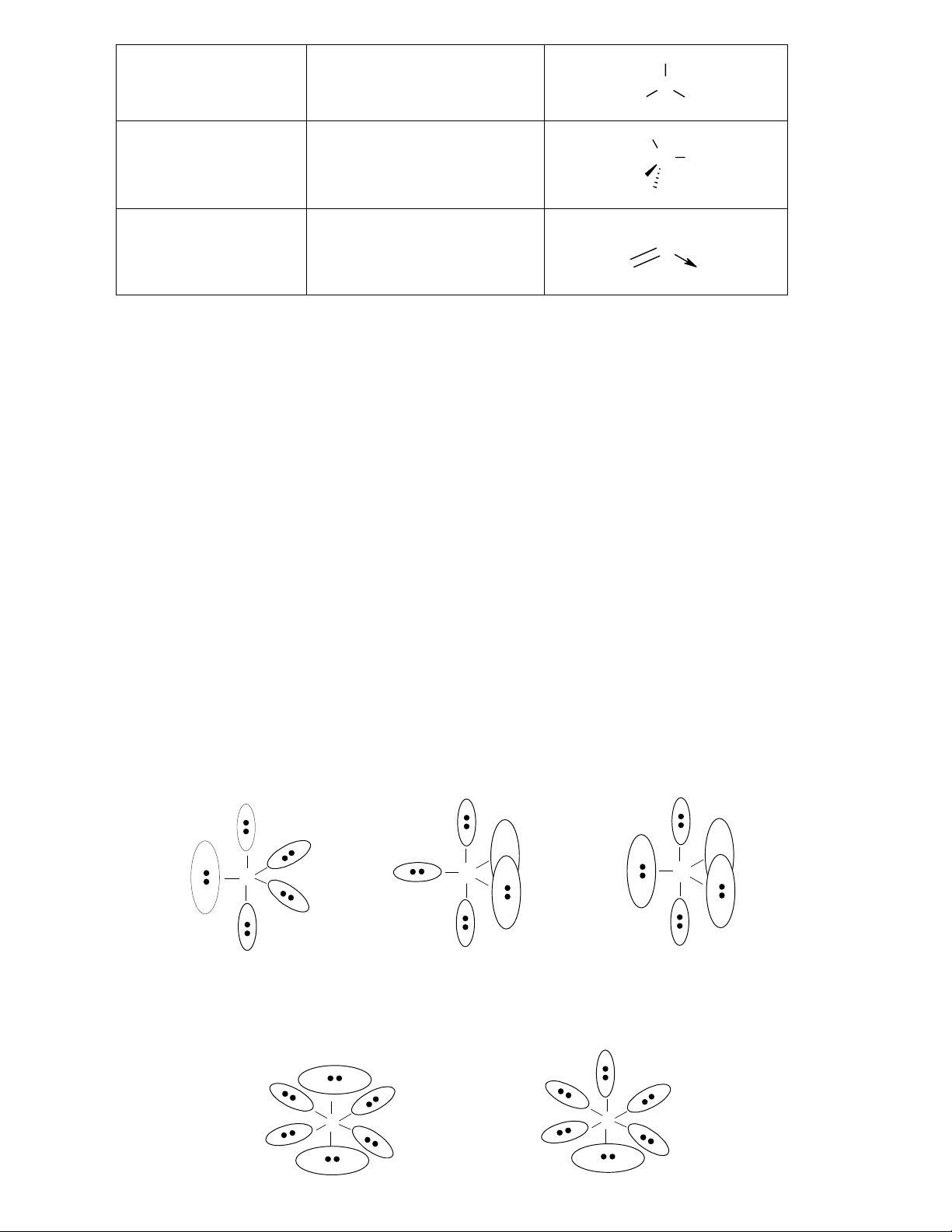
Câu 5: Cho các phân tử sau: CH4, NH3, BF3, NCl3, CO2, H2O, CCl4. Phân tử nào phân cực, phân tử nào không phân cực? Vì sao?
Câu 6: Hãy vẽ vectơ momen lưỡng cực của liên kết trong các phân tử sau: HF, H2O, NH3, SO2, CH4, BF3.
Câu 7: Thực nghiệm cho biết cả ba hợp chất CHBr3, SiHBr3, CH(CH3)3 đều có cấu tạo tứ diện. Có ba trị
số góc liên kết tại tâm là 110o; 111o; 112o(không kể tới H khi xét các góc này). Độ âm điện của H là 2,20;
CH3 là 2,27; Csp3 là 2,47; Si là 2,24; Br là 2,50. Dựa vào mô hình sự đẩy giữa các cặp e hóa trị (VSEPR)
và độ âm điện, hãy cho biết trị số góc của mỗi hợp chất và giải thích.
Câu 8: Có thể xác định cấu trúc hình học của các phân tử hay ion nhiều nguyên tử dựa vào việc
khảo sát số cặp electron tạo liên kết σ và số cặp electron chưa liên kết ở lớp vỏ hoá trị của nguyên
tử trung tâm của phân tử hay ion.
1. Nếu quanh nguyên tử A của phân tử AX -n
2 hay ion AX2 có số cặp electron bao gồm các cặp
electron tạo liên kết σ và các cặp electron chưa liên kết là 2 hoặc 3, 4, 5, 6 thì ở trường hợp nào
phân tử hay ion có cấu trúc thẳng, trường hợp nào không? vì sao? (1)
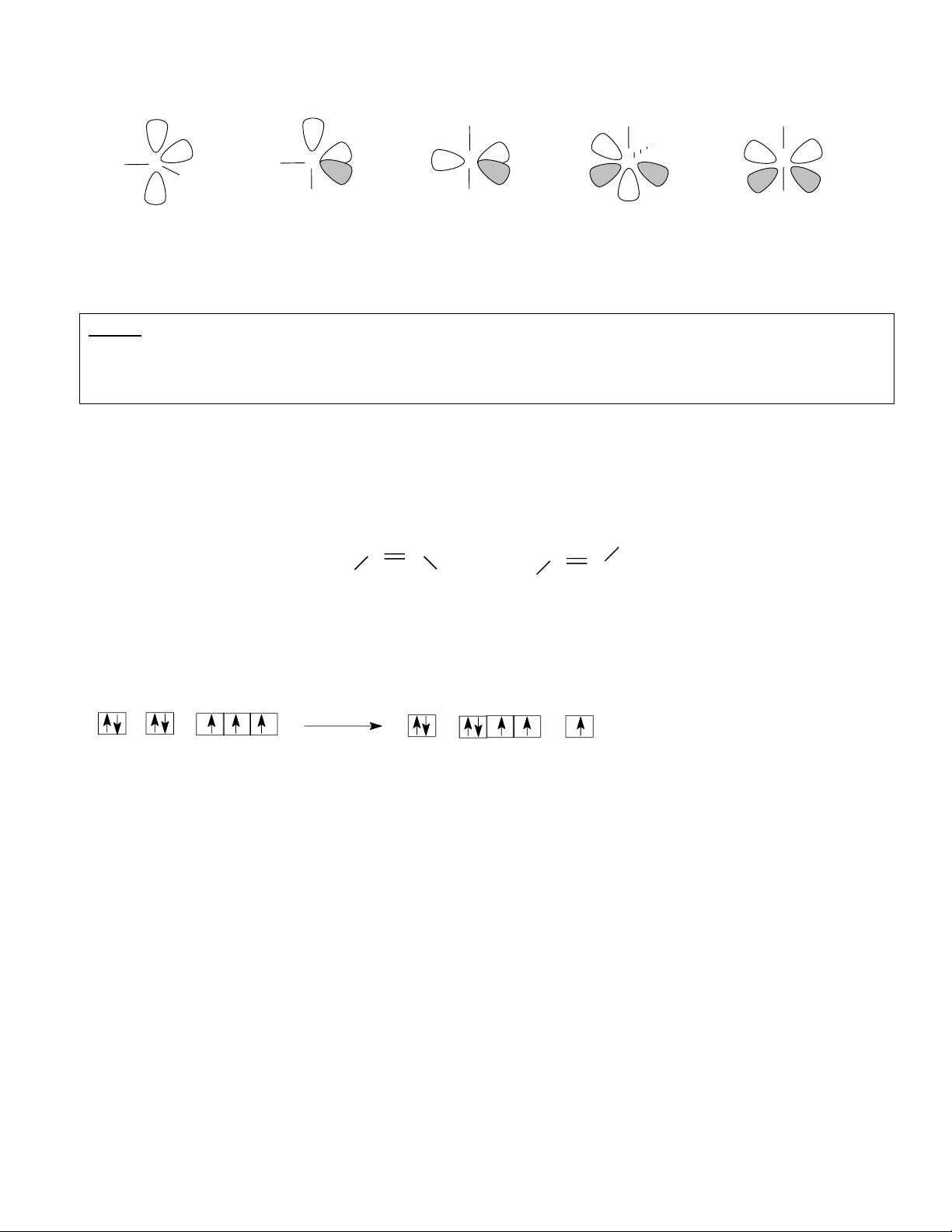
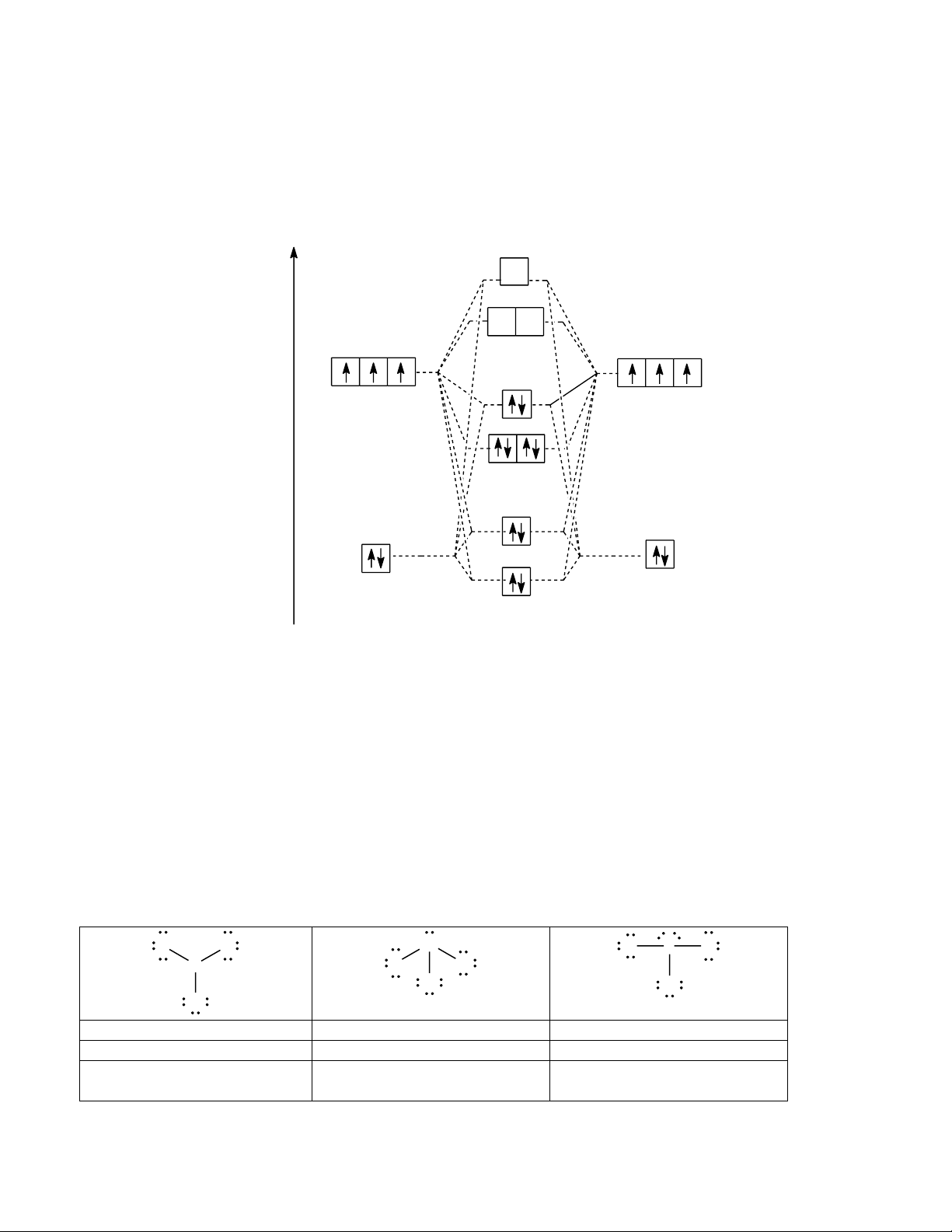
2. Tuỳ thuộc vào số cặp electron mà phân tử có thể có một vài hình dạng khác nhau, hãy minh hoạ bằng hình vẽ.
3. Trong số các kết luận rút ra ở (1), trường hợp nào có tồn tại các chất có hình dạng đúng như dự đoán. Cho thí dụ.
4. Có thể giải thích cấu trúc hình học của phân tử dựa vào thuyết liên kết hoá trị. Hãy cho biết
trạng thái lai hoá tương ứng với mỗi trường hợp ở (1). Hướng đẫn giải 1. n = 2 n = 3 n = 4 n = 5 n = 6 X X X – A – X A A X A A X X X X X K hông t hẳng Các cặp electron Không thẳng Các cặp electron tự Trong trường hợp đ
ẩy nhau và rời xa vìcặpelectron vìcặpelectron do có thể tích lớn này 4 cặp electron
nhau đến mức tối tự do đẩy các tự do đẩy các
nên ở chỗ rộng – vị chưa liên kết đều đ
a (1800), cấu trúc cặp liên kết. cặp liên kết. trí xích đạo. Các ở vị trí xích đạo. thẳng.
cặp liên kết ở vị trí Phân tử hay ion trục. Phân tử hay thẳng. ion thẳng.
Cấu trúc thẳng xuất hiện ứng với 2, 5 hay 6 cặp electron .
2. Khi có 5 hay 6 cặp electron thì có thể có một vài dạng phân tử: X X X X X A X A A A A X X X X - - 3. Trường hợp: n = 2: BeCl2 n = 5: I3 , ICl2 , XeF2 4. Số cặp electron 2 3 4 5 6 Lai hoá sp sp2 sp3 sp3d (dsp3) d2sp3
Câu 9: Xét đồng phân cis- và trans- của điimin N2H2:
* Hãy viết công thức cấu tạo của mỗi đồng phân này.
* Trong mỗi cấu tạo đó, nguyên tử N ở dạng lai hoá nào? Hãy trình bày cụ thể.
* Đồng phân nào bền hơn? Hãy giải thích. Hướng đẫn giải
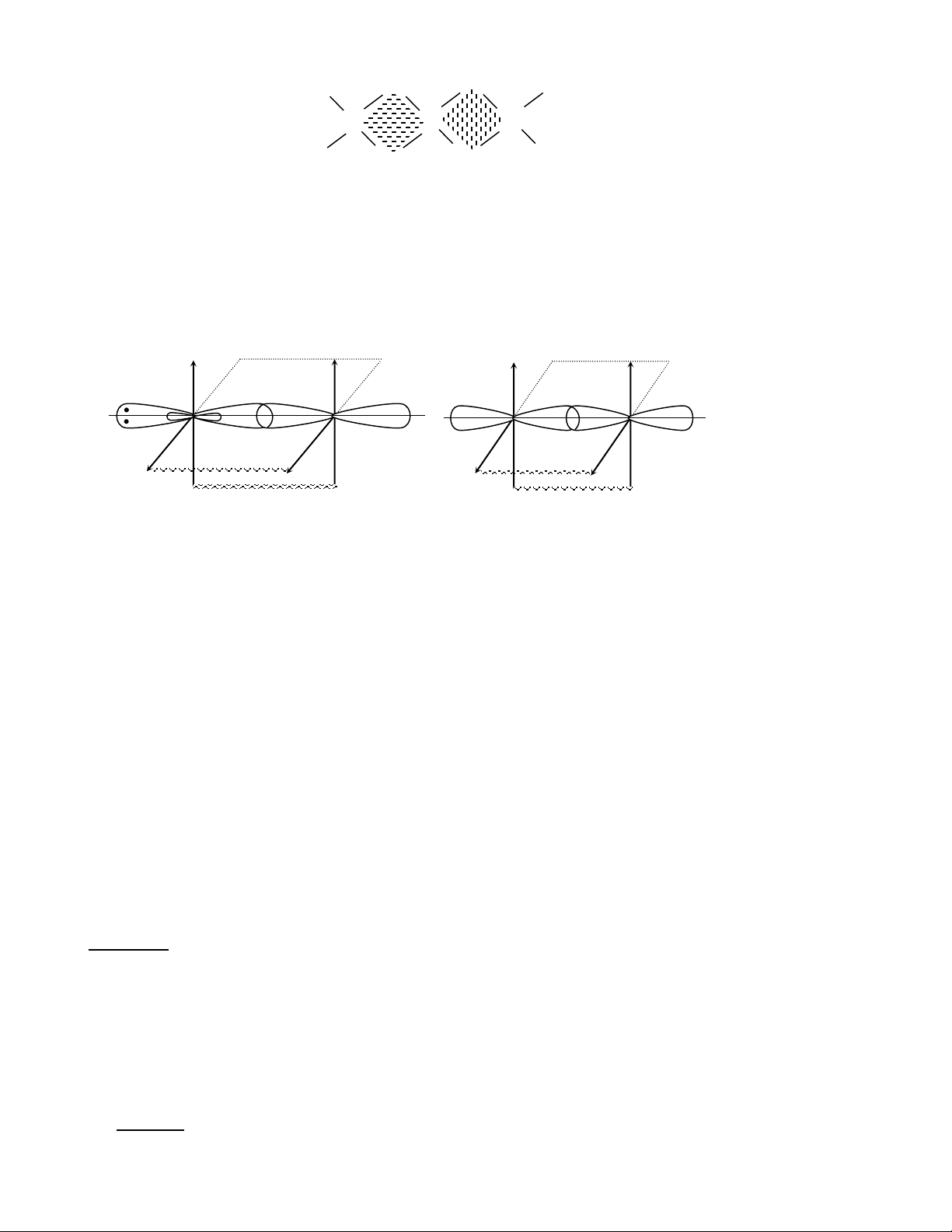
* Hai đồng phân hình học của điimin là: . . . . H . . N N N N . . H H H Cis-§iimin Trans-§ iimin
* Cả hai đồng phân đó đều phẳng, mỗi nguyên tử nitơ đều tham gia 3 liên kết (2 liên kết xich ma (ú), 1
liên kết pi (ð)) và đều còn 1 đôi electron riêng. Vậy ta giả thiết mỗi nguyên tử nitơ đó đều có lai hoá sp2.
ở trạng thái cơ bản, nguyên tử nitơ N (Z =7) có cầu hình electron N 1s22s22p3; khi liên kết, nguyên tử
nitơ N đã ở vào trạng thái lai hoá sp2 . lai ho¸ 1s2 2s2 2p3 1s2 3 AO - sp2 AO - p nguyªn chÊt
Như vậy trong nguyên tử N có 3 obitan lai hoá sp2 và 1 obitan p nguyên chất. 2 trong 3 obitan lai
hoá sp2 đó cùng với1 obitan p nguyên chất đều có 1 e độc thân. Obitan lai hoá sp2 còn lại có 1 đôi e riêng.
2 obitan lai hoá sp2 đều có 1 e độc thân của 1 nguyên tử N xen phủ với 1 obitan loại đó của nguyên tử N
bên cạnh và 1 obitan 1s của 1 nguyên tử H tạo 2 liên kết xich ma (ú). 2 obitan p nguyên chất đều có 1 e
độc thân của 2 nguyên tử N xen phủ nhau tạo1 liên kết pi (ð) giữa chúng.
* Cấu tạo trans- bền hơn cấu tạo cis-. Trong cấu tạo trans- cả 2 mây electron của 2 liên kết xich ma (ú)
N-H cũng như cả 2 mây electron của 2 đôi e riêng
của 2 N đều được phân bố về 2 phía của trục liên kết xich ma (ú) giữa 2 nguyên tử N. Do đó lực đẩy
giữa các cặp mây electron đó trong cấu tạo trans-
yếu hơn lực đẩy này trong cấu tạo cis-. Như vậy cấu tạo trans- tồn tại ở trạng thái năng lượng thấp hơn
cấu tạo cis-.Vì thế cấu tạo trans- bền hơn cấu tạo cis-.
Hình1 dưới đây minh hoạ nội dung trên. ↑↓ ↑↓ ↑↓ H N N N N H H H ↑↓ Cis-§ iimin Trans-§ iimin C¸ c m©y e gÇn nhau C¸ c m©y e xa nhau ®Èy nhau m¹ nh ®Èy nhau yÕu
Câu 10: Thực nghiệm cho biết BF3 có hình tam giác đều, tâm là B. Áp dụng thuyết lai hoá đối với B,
hãy giải thích các kết quả đó. Hướng đẫn giải
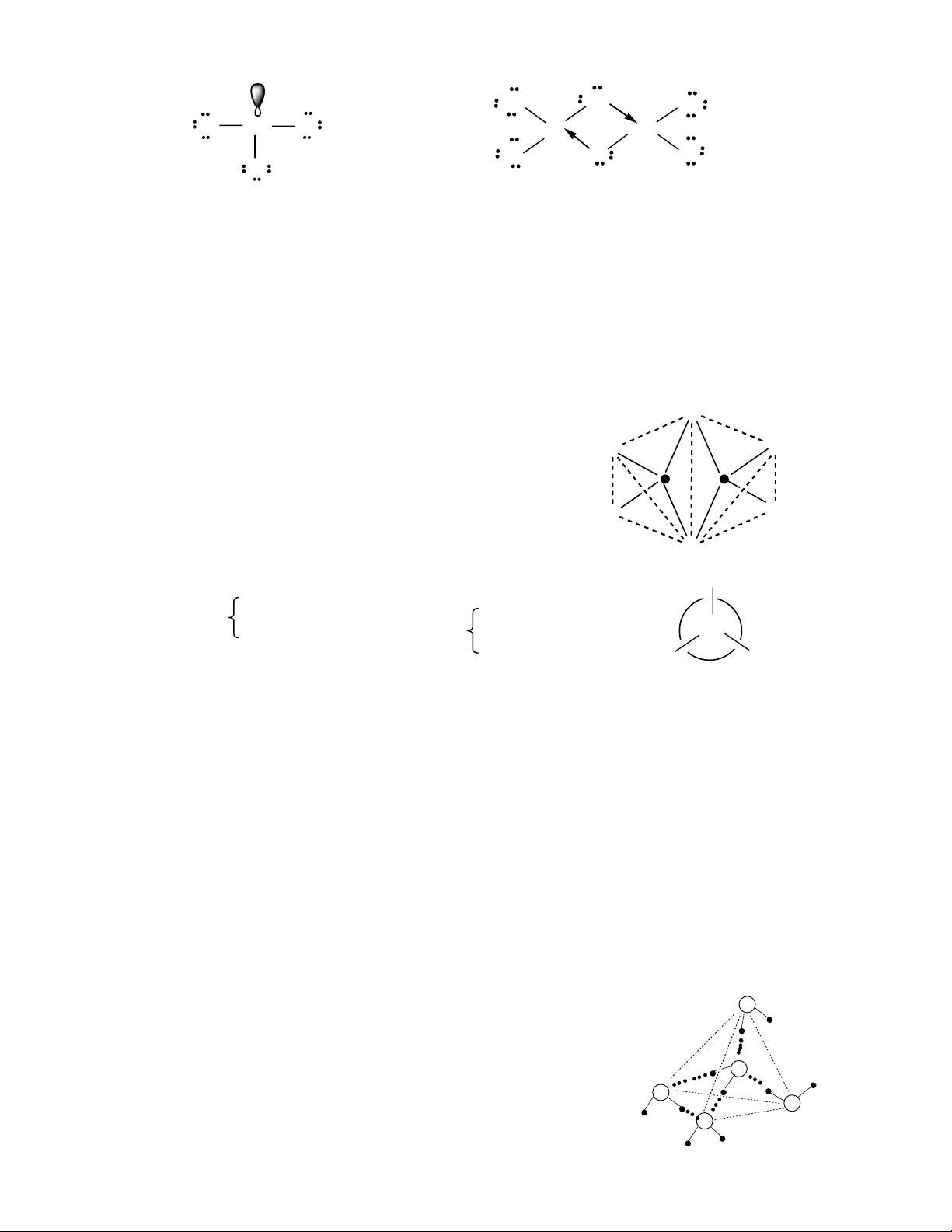
Cấu hình electron của các tử tạo ra phân tử BF3:
B (Z = 5)1s22s22p1 F (Z = 9)1s22s22p5 (a1) (b) 1s2 2s2 2p1
* Biểu diễn hình dạng của phân tử B F 1s2 2s2 2p5 3:
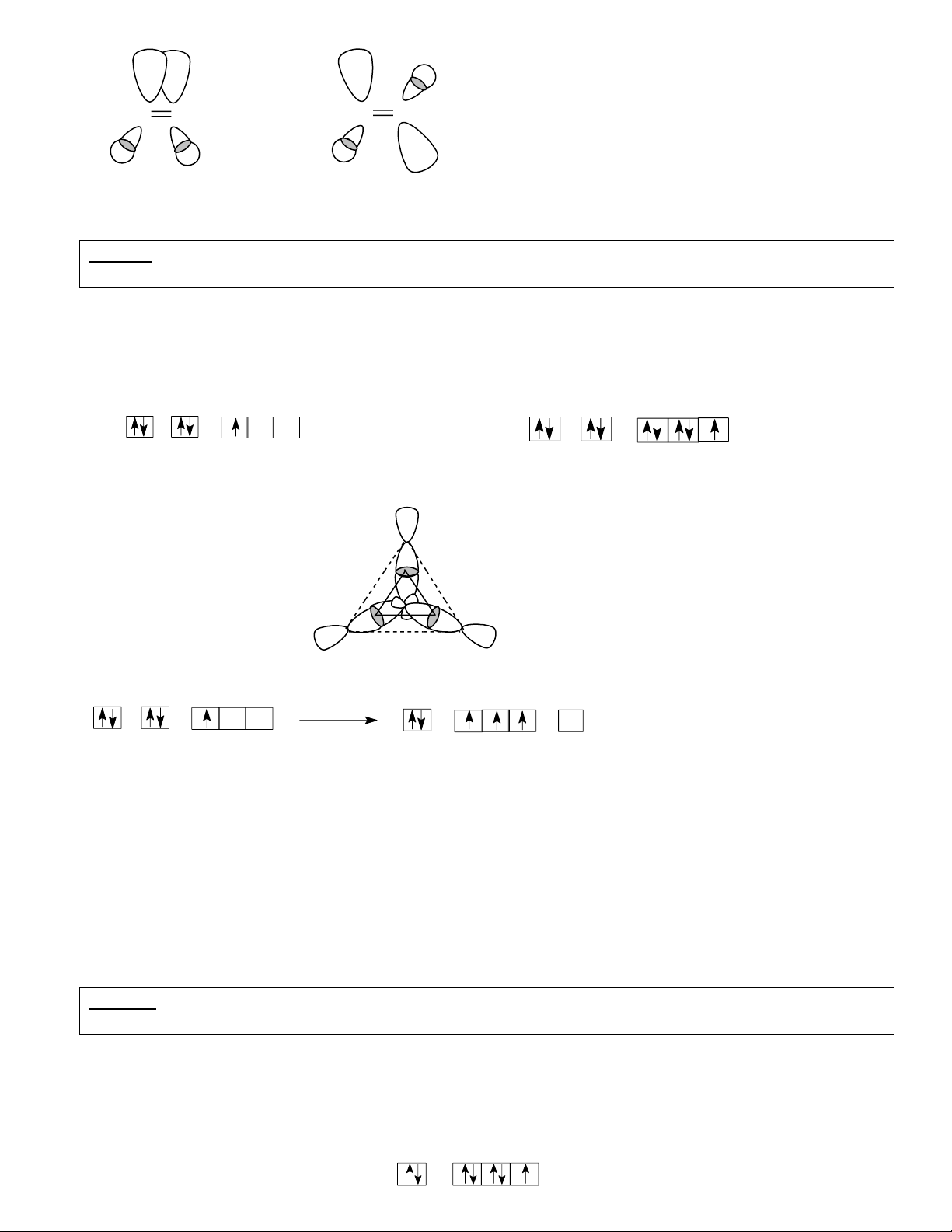
Hình 2: Hình dạng phân tử BF3 tam giác đều,
tâm là B (3 đỉnh tam giác (nhỏ) là 3 vùng xen phủ tạo 3 liên kết B o -F). 120
Vậy ta giả thiết trong phân tử BF3 nguyên tử trung tâm B có lai hoá sp2 với sự phân bố electron như sau: lai ho¸ (a2) 1s2 2s2 2p3 1s2 3 AO - sp2 AO-p nguyªn chÊt
3 đỉnh của 3 obitan lai hoá sp2 hướng về 3 phía của một mặt phẳng tạo thành 3
đỉnh của một tam giác đều có tâm là B. Trong mỗi obitan lai hoá sp2 này có 1 electron độc thân.
Theo (b) ở trên, nguyên tử F có1 electron độc thân trong1obitan p nguyên chất. Sự xen phủ trục giữa 1
obitan p nguyên chất này với1obitan lai hoá sp2 của B tạo thành liên kết xich ma (ú) giữa 2 nguyên tử.
Vậy 1 trong phân tử BF3 có 3 liên kết xich ma (ú) với 3 vùng xen phủ . 3 hạt nhân của 3 nguyên tử F là 3
đỉnh của tam giác đều có tâm là B như thực nghiệm đã chỉ ra. 3 trục của 3 liên kết đó cắt nhau từng đôi
một tạo thành góc 120o. Kết quả trên về hình học phân tử hoàn toàn phù hợp với kết quả mà thực nghiệm đã chỉ ra.
Câu 10: Thực nghiệm cho biết PCl5 có hình song tháp tam giác, góc liên kết trong mặt phẳng đáy là 120o,
trục với mặt đáy là 90o. Áp dụng thuyết lai hoá, hãy giải thích kết quả đó. Hướng đẫn giải
a) Trước hết ta xét cấu hình electron của các nguyên tử.
P (Z = 15) [Ne]3s23p3 (a) Cl (Z = 17) [Ne]3s23p5 (b)
Kí hiệu [Ne] biểu thị cấu hình 1s22s22p6. Cl (5)
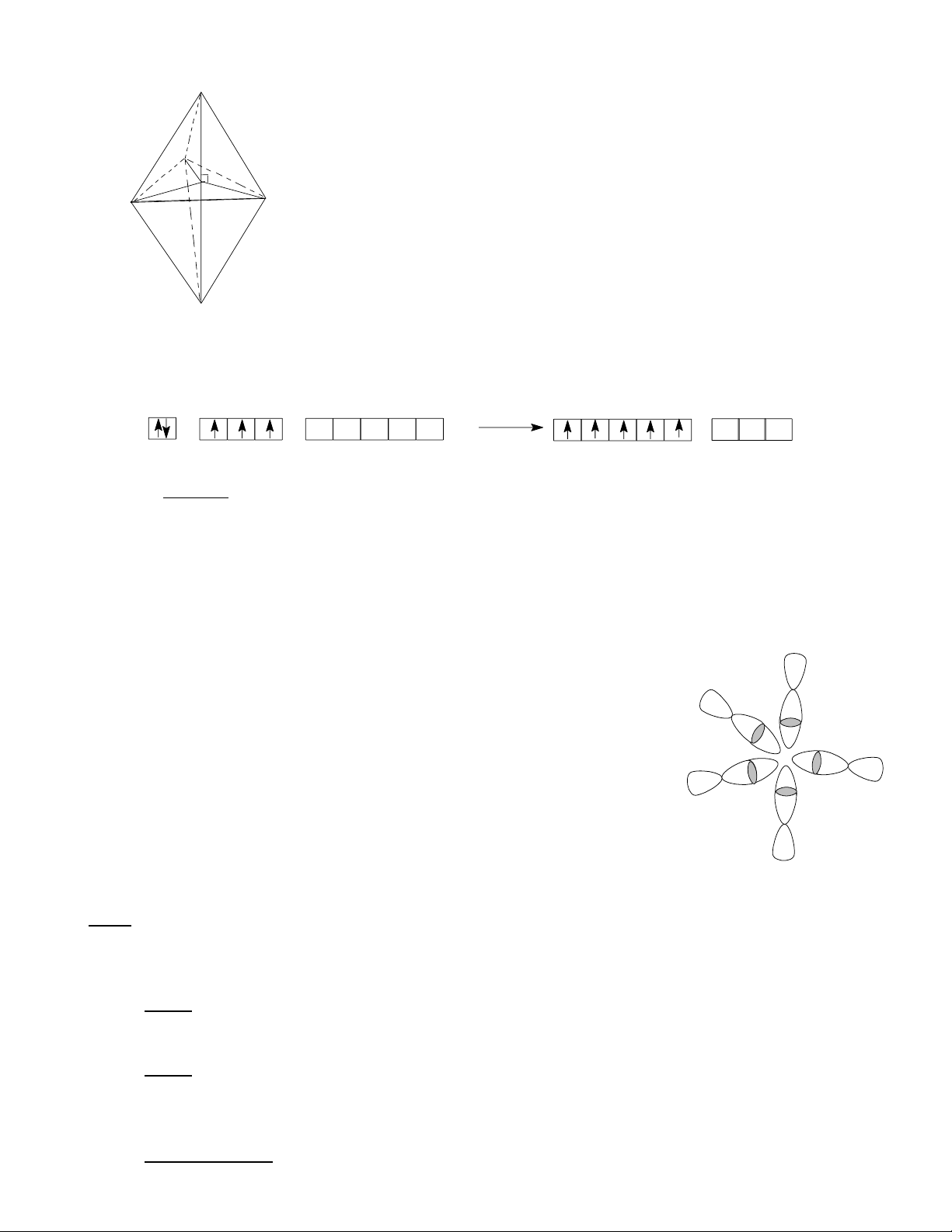
b) Hình dạng của PCl5 được mô tả như hình bên:
Mặt đáy tam giác (Ä) có 3 đỉnh là 3 nguyên tử Cl (1), (2),
(3); tâm là P. Góc ClPCl trong mặt đáy này là 120o. Cl
Tháp phía trên có đỉnh là nguyên tử Cl(5), tháp phía dưới có (
đỉnh là nguyên tử Cl (4). Hai đỉnh này cùng ở trên đường P Cl (3) Cl (1)
thẳng đi qua P. Góc Cl (4) PCl (1) bằng 90o.
Độ dài liên kết trục PCl (4) hay PCl (5) đều lớn hơn độ dài
liên kết ngang trong mặt đáy, dt > dn. Cl (4)
c) Giải thích: Trong cấu hình electron của các nguyên tử P có 3 e độc thân. Để trở thành nguyên tử trung
tâm trong PCl5, một phân tử có 5 liên kết tạo thành hình song tháp tam giác, P ở dạng lai hoá thích hợp là sp3d. lai ho¸ (a) (a1) 3s2 3p3 3d sp3d d
(Ghi chú : Giả thiết P ở dạng lai hoá sp2d2 vẫn được coi là hợp lí).
Do lai hoá như vậy, trong P có 5 obitan chứa 5 e độc thân (xem (a1) trên). 3 trong số 5 obitan đó ở trong
cùng mặt phẳng có 3 đỉnh hướng về 3 phía lập thành 3 đỉnh của tam giác đều; 3 trục của chúng cắt nhau
từng đôi một tạo thành góc 120o. P ở tâm tam giác đều này. 2 obitan còn lại có 2 đỉnh trên cùng một
đường thẳng vuông góc (tạo góc 90o) với mặt phẳng tam giác và hướng về hai phía của mặt phẳng tam giác này.
Mỗi Cl có 1 AO-p nguyên chất chứa 1 e độc thân (xem (b) ở trên). Do đó mỗi AO này xen phủ với
1 obitan lai hoá của P tạo ra 1 liên kết xích ma (ú).
Trong mỗi vùng xen phủ đó có một đôi electron với
spin ngược nhau (), do P và mỗi Cl góp chung, chuyển động. Cl (5)
Vậy trong 1 phân tử PCl5 có 5 liên kết xích ma (ú). 3 trong 5 Cl (2)
liên kết được phân bố trong mặt đáy tam giác. 2 liên kết còn lại
ở trên đưòng thẳng vuông góc (tạo góc 900) với mặt phẳng tam Cl (3) P
giác và hướng về hai phía của mặt phẳng tam giác này. Cl (1)
(Hình bên minh hoạ rõ ràng kết quả đó). Cl (4)
Như vậy, PCl5 có hình song tháp tam giác là hợp lí.
Bài 1. Hãy cho biết cấu hình hình học của phân tử và ion dưới đây, đồng thời sắp xếp các góc liên kết
trong chúng theo chiều giảm dần. Giải thích. a) NO + - 2; NO2 ; NO2 . b) NH3; NF3.
Bài 2: Có các phân tử XH3:
a) Hãy cho biết cấu hình hình học của các phân tử PH3 và AsH3.
b) So sánh góc liên kết HXH giữa hai phân tử trên và giải thích.
Bài 3: Xét các phân tử POX3
a) Các phân tử POF3 và POCl3 có cấu hình hình học như thế nào?
b) Góc liên kết XPX trong phân tử nào lớn hơn?
Cho biết: ZP = 15; ZAs = 33; ZO = 8; ZF = 9; ZCl = 17; ZB = 5; ZN = 7; ZSi = 14; ZS = 16. Bài 4:
Mô tả liên kết trong ion I -
3 , xác định dạng hình học và dạng lai hóa của nguyên tử I trung tâm.
I.2 Bằng thuyết lai hoá hãy giải thích sự tạo thành phân tử XA.
I.3 CO có khả năng tạo phức mạnh với nhiều kim loại chuyển tiếp. Giải thích sự hình thành liên kết
trong phân tử phức [Ni(CO)4] bằng thuyết VB và cho biết từ tính của phức.
I.4 Giải thích vì sao SiO2 lại có nhiệt độ nóng chảy rất cao so với XA2.
I.2 Giải thích sự tạo thành phân tử CO bằng thuyết lai hoá. C: [He] 2s2 2p2 O: [He] 2s2 2p4
Cacbon dùng 1 obitan 2s tổ hợp với 1 obitan 2p tạo ra 2 obitan lai hoá sp hướng ra hai phía khác nhau,
trong đó có một obitan bão hoà và 1 obitan chưa bão hòa.
Cacbon dùng 1 obitan lai hoá chưa bão hoà xen phủ xichma với 1 obitan p chưa bão hoà của oxi và dùng 1
obitan p thuần chủng chưa bão hoà xen phủ pi với 1 obitan p chưa bão hoá còn lại của oxi. Oxi dùng 1
obitan p bão hoà xen phủ với obitan p trống của cacbon tạo liên kết pi kiểu p p.
Công thức cấu tạo: :C O:
I.3 Sự hình thành liên kết trong phân tử Ni(CO)4
Ni (Z = 28) [Ar] 3d8 4s2 4p0 Ni* [Ar] 3d8 4s0 4p0
Ở trạng thái kích thích, nguyên tử Ni dùng 1 obitan 4s trống tổ hợp với 3 obitan 4p tạo thành 4 obitan lai
hoá sp3 trống hướng ra 4 đỉnh của hình tứ diện đều tâm là nguyên tử Ni.
CO dùng cặp electron tự do chưa liên kết trên nguyên tử cacbon tạo liên kết phối trí với các obitan lai hoá
trống của Niken tạo ra phân tử phức trung hoà Ni(CO)4 Ni* [Ar] 3d8 4s0 4p0
:CO :CO : CO :CO
Phân tử Ni(CO)4 có tính nghịch từ vì không còn electron độc thân.
I.4 Cacbondioxit có cấu trúc đường thẳng O = C = O ứng với trạng thái lai hoá sp của nguyên tử cacbon.
Trái lại, SiO2 có cấu tạo tứ diện ứng với trạng thái lai hoá sp3 của nguyên tử Silic. Trong tinh thể SiO2,
nguyên tử Si nằm ở tâm của tứ diện liên kết công hoá trị với 4 nguyên tử oxi nằm ở 4 đỉnh của tứ diện đó.
Như vậy mỗi nguyên tử oxi liên kết với hai nguyên tử Silic ở hai tứ diện cạnh nhau. Do đó, SiO2 ở dạng
polime với cấu trúc 3 chiều nên quá trình nóng chảy có liên quan đến quá trình cắt đứt liên kết hoá học,
còn CO2 ở trang thái rắn tạo ra tinh thể phân tử, quá trình nóng chảy không liên quan đến sự đứt liên kết
hoá học trong phân tử CO2.
1) Cho các phân tử sau: POF3 ; BF3 ; SiHCl3 ; O3. Nêu tra ̣ng thái lai hóa của các nguyên tử trung
tâm và vẽ cấu trúc hình ho ̣c của các phân tử trên. Công thức phân tử
Tra ̣ng thái lai hóa của Cấu trúc hình ho ̣c nguyên tử trung tâm O POF3 sp3 P F F F F BF3 sp2 B F F H HSiCl Cl 3 sp3 Si Cl Cl . . O3 sp2 O O O
9.Hãy cho biết: cấu tạo lewis; dạng lai hóa(nếu có); hình dạng phân tử theo mô hình VSEPR; mô men
lưỡng cực của mỗi phân tử sau: SF -
4; HClO2; HOCl; ICl4 ; IF7; BrF5; HNO3; C2H6.
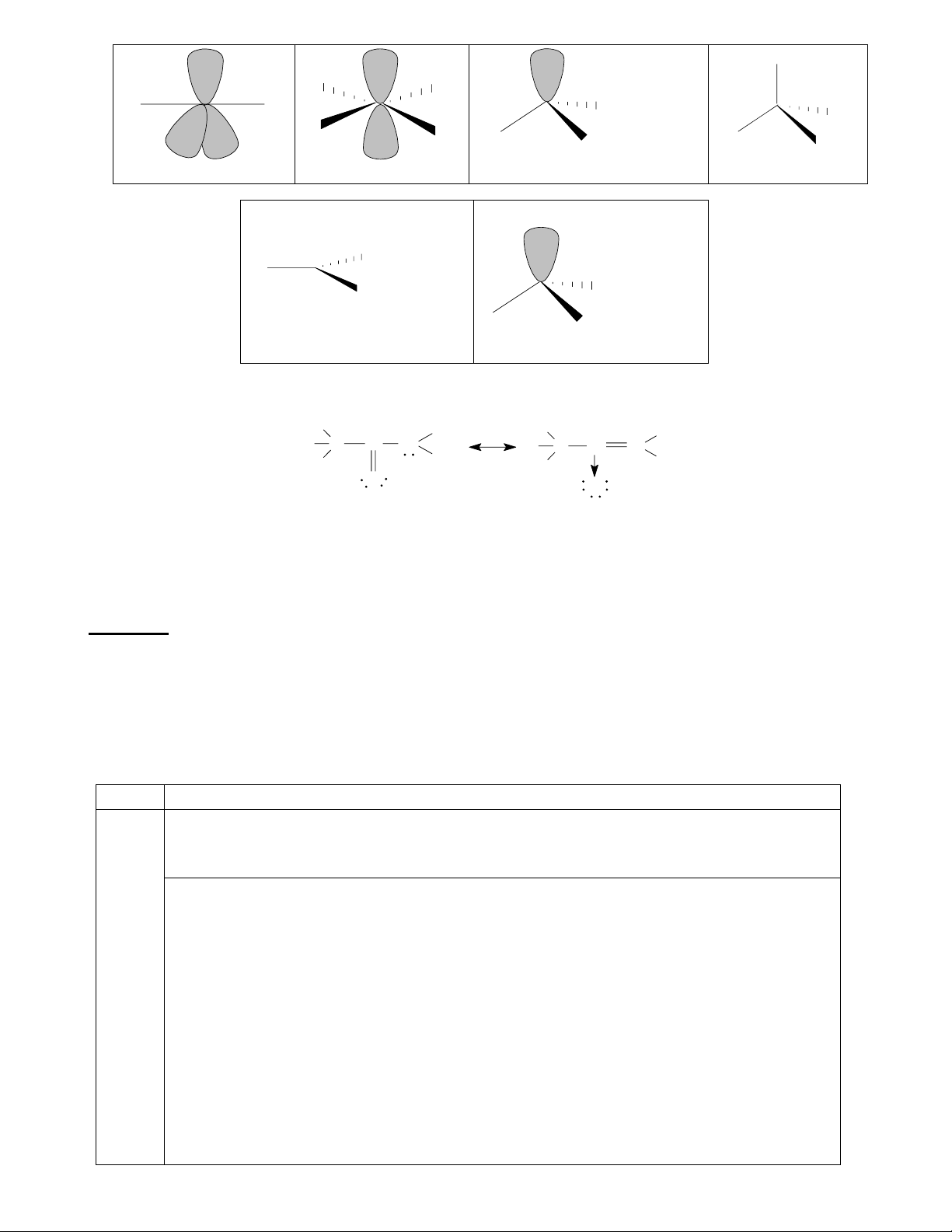
1) * SF4: (AX4 E) ; lai hóa sp3d; hình dạng cái bập bênh; 0 ; 1 đôi e không liên kết được phân bố
trong mặt phẳng kết quả tạo ra hình cái bập bênh
* HClO2: (AX3E2) lai hóa sp3d; hình dạng chữ T; 0 ; 2 đôi e riêng được phân bố trong mặt phẳng, 3
đôi e liên kết tạo ra 3 liên kết A – X sắp xếp thành hình chữ T.
* HOCl: (AX2E3) lai hóa sp3d ; hình dạng đường thẳng; 0 ; 3 đôi e riêng được phân bố trong mặt
phẳng, còn 2 đôi e liên kết tạo 2 liên kết A – X được phân bố trên trục vuông góc với mặt phẳng trên. Hai
liên kết A – X nằm trên đường thẳng nên phân tử có dạng đường thẳng. * ICl -
4 : (AX4E2) ; hình dạng vuông phẳng; = 0 ; theo mô hình sức đẩy cặp e trong vỏ hóa trị : 2 đôi e
riêng được phân bố trans- so với nhau. Do đó 4 cặp e liên kết tạo 4 liên kết A – X trong mặt phẳng
phân tử có dạng vuông phẳng.
* IF7: (AX7), lai hóa sp3d3, dạng lưỡng chóp ngũ giác ; 0 ;
* BrF5: (AX5E) lai hóa sp3d2, hình dạng tháp vuông, 0 ; 5 đôi e liên kết được phân bố 4 đôi trong mặt
phẳng và một đôi trên trục tạo ra hình dạng tháp vuông. Một đôi e không liên kết được phân bố phía còn
lại của trục. Do sự biến dạng như vậy nên độ dài liên kết ngang và trục không tương đương hình học.
* HNO3: (AX3) lai hóa sp2, hình tam giác phẳng, 0 ; 3 đôi e được phân bố trên mặt phẳng là 3 đỉnh của tam giác đều.
* C2H6: (AX4) lai hóa sp3, hình tứ diện, 0 ; 4 đôi e được phân bố trên 4 đỉnh của tứ diện đều, tâm tứ diện là A. X X X X E E E A E A X A E E X X X X (AX (AX (AX2E3) 4E) 3E2) X E X X X X A A X X X X E E (AX4E2) (AX5E)
Trình bày liên kết trong phân tử: NO + 2 , ICl-4 : * NO + 2 N :
Nguyên tử N lai hóa sp. Một obitan lai hóa chứa e_ độc thân liên kết
với obitan 2p của O tại liên kết . Còn obitan lai hóa chứa cặp e- tự O :
do liên kết cho nhận với obitan p trống của O+. Còn 2 obitan không
lai hóa của N xen phủ với obitan chứa e- độc thân của O và O+ O+ : Vậy ion NO + 2 có cấu trúc thẳng : O N+ = O * ICl-4 : I :
I* : Cl :
Cl- :
Nguyên tử I* lai hóa sp3d2. Ba obitan sp3d2 chứa e- độc thân liên kết với 3 obitan 3p chứa e- độc
thân của 3 nguyên tử Cl tạo 3 liên kết . Một obitan 3p chứa cặp e- tự do của Cl- tạo liên kết cho nhận với
obitan sp3d2 trống I*. Hai cặp e- tự do chiếm vị trí trục xuyên tâm Cl Cl Vậy : ion ICl -
4 có cấu trúc vuông phẳng I Cl Cl
Câu 1: Hãy giải thích:
1) Vì sao O3 hoạt động hoá học hơn O2.
2) Phân tử CO2 là chất khí còn SiO2 là phân tử khổng lồ.
3) CO và N2 có tính chất vật lí gần giống nhau nhưng lại có tính chất hoá học khác nhau?
4) SiCl4 lại dễ bị thuỷ phân còn CCl4 lại không bị thuỷ phân? 1)
- Phân tử oxi không phân cực, độ bội liên kết giữa 2 nguyên tố lớn nên chúng khó phân li thành nguyên
tử do vậy mà hoạt động kém. (0,5đ)
- Phân tử O3 phân cực, độ bội liên kết giữa 2 nguyên tử O bé, khả năng tách thành nguyên tử O* dễ dàng
hơn, do đó O3 hoạt động mạnh hơn. (0,5đ) E* O O O O + O* 2) O
- Phân tử CO2: C có bán kính nguyên tử bé, khả năng tạo liên kết bội P P π
bền vững phân tử tồn tại dạng thẳng: O=C=O (0,5đ) (sp)
- Phân tử SiO2 : Si có bán kính nguyên tử lớn hơn, khả năng hình thành liên kết kém vì khi hình thành
liên kết có xuất hiện lực đẩy mạnh giữa các nguyên tử Si do các lớp vỏ đầy e bên trong gây ra. Vì vậy
SiO2 là phân tử polime khổng lồ. Ở đó, mỗi nguyên tử Si tạo 4 liên kết đơn với 4 nguyên tử O hình thành
nên các tứ diện SiO4. (0,5đ) O O Si Si Si O O 3)
- CO và N2 là những phân tử đẳng e và đẳng khối lượng nên tạo ra tính chất vật lý tương tự nhau. (vẽ giản đồ MO) (0,5đ)
- Phân tử N2 : N có cặp e ghép đôi nằm trên AO2s (năng lượng thấp), không thuận lợi cho quá trình tạo liên kết. (0,25đ)
- Phân tử CO: C có cặp e ghép đôi nên trên AOsp (năng lượng cao) thuận lợi cho quá trình hình thành liên
kết (liên kết cho nhận) nên CO dễ tạo phức và tham gia phản ứng hoá học (cho cặp e tự do). Vd: phức Fe(CO)5, [Ni(CO)4] (0,25đ) C O N N 4)
- Phân tử CCl4 đã có đầy đủ e nên có tính trung hoà và trơ. (0,5đ)
- Phân tử SiCl4 : còn AO3d nên nguyên tử Si trống nên có thể nhận e thể hiện tính axit do vậy SiCl4 dễ bị
thuỷ phân (dễ tạo phức chất hoạt động). (0,5đ) SiCl4 + 3H2O = H2SiO3 + 4HCl Năm 2003
1. Nhôm clorua khi hoà tan vào một số dung môi hoặc khi bay hơi ở nhiệt độ không quá cao thì tồn tại ở
dạng đime (Al2Cl6). ở nhiệt độ cao (7000C) đime bị phân li thành monome (AlCl3). Viết công thức cấu tạo
Lewis của phân tử đime và monome; Cho biết kiểu lai hoá của nguyên tử nhôm, kiểu liên kết trong mỗi
phân tử ; Mô tả cấu trúc hình học của các phân tử đó.
2. Phân tử HF và phân tử H2O có momen lưỡng cực, phân tử khối gần bằng nhau (HF 1,91 Debye, H2O
1,84 Debye, MHF 20, M H O 18); nhưng nhiệt độ nóng chảy của hiđroflorua là– 830C thấp hơn nhiều so với 2
nhiệt độ nóng chảy của nước đá là 00C, hãy giải thích vì sao? Lời giải:
1.* Viết công thức cấu tạo Lewis của phân tử đime và monome.
Nhôm có 2 số phối trí đặc trưng là 4 và 6. Phù hợp với quy tắc bát tử, cấu tạo Lewis của phân tử đi me và monome: Cl Cl Cl Cl Al Cl Al Al Monome ; Đi me Cl Cl Cl Cl
* Kiểu lai hoá của nguyên tử nhôm : Trong AlCl3 là sp2 vì Al có 3 cặp electron hoá trị;
Trong Al2Cl6 là sp3 Vì Al có 4 cặp electron hoá trị .
Liên kết trong mỗi phân tử:
AlCl3 có 3 liên kết cộng hoá trị có cực giữa nguyên tử Al với 3 nguyên tử Cl.
Al2Cl6: Mỗi nguyên tử Al tạo 3 liên kết cộng hoá trị với 3 nguyên tử Cl và 1 liên
kết cho nhận với 1 nguyên tử Cl (Al: nguyên tử nhận; Cl nguyên tử cho).
Trong 6 nguyên tử Cl có 2 nguyên tử Cl có 2 liên kết, 1 liên kết cộng hoá trị thông thường và liên kết cho nhận. * Cấu trúc hình học: Phân tử AlCl O
3: nguyên tử Al lai hoá kiểu sp2 (tam giác phẳng)
nên phân tử có cấu trúc tam giác phẳng, đều, nguyên tử Al ở O O
tâm còn 3 nguyên tử Cl ở 3 đỉnh của tam giác.
-Phân tử Al2Cl6: cấu trúc 2 tứ diện ghép với nhau. Mỗi nguyên
tử Al là tâm của một tứ diện, mỗi nguyên tử Cl là đỉnh của tứ O O
diện. Có 2 nguyên tử Cl là đỉnh chung của 2 tứ diện. Al O O Cl Cl M = 20 2. 1200 1200 = 1,91 Debye M = 18 * Phân tử H Al
-F Jt ; H-O-H = 1,84 Debye Cl Cl
có thể tạo liên kết hiđro – HF – có thể tạo liên kết hiđro – 1200 H…O –
* Nhiệt độ nóng chảy của các chất rắn với các mạng lưới phân tử (nút lưới là các phân tử)
phụ thuộc vào các yếu tố:
- Khối lượng phân tử càng lớn thì nhiệt độ nóng chảy càng cao.
- Lực hút giữa các phân tử càng mạnh thì nhiệt độ nóng chảy càng cao. Lực hút giữa các phân tử gồm:
lực liên kết hiđro, lực liên kết van der Waals (lực định hướng,lực khuếch tán).
*Nhận xét: HF và H2O có mo men lưỡng cực xấp xỉ nhau, phân tử khối gần bằng nhau và đều có liên kết
hiđro khá bền, đáng lẽ hai chất rắn đó phải có nhiệt độ nóng chảy xấp xỉ nhau, HF có nhiệt độ nóng chảy
phải cao hơn của nước (vì HF mo men lưỡng cực lớn hơn, phân tử khối lớn hơn, liên kết hiđro bền hơn).
Tuy nhiên, thực tế cho thấy Tnc (H2O) = 00C > Tnc(HF) = – 830C. * Giải thích:
Mỗi phân tử H-F chỉ tạo được 2 liên kết hiđro với 2 phân tử HF khác ở hai bên
H-F…H-F…H-F. Trong HF rắn các phân tử H-F liên kết với nhau nhờ liên kết hiđro tạo thành chuỗi một
chiều, giữa các chuỗi đó liên kết với nhau bằng lực van der Waals yếu. Vì vậy khi đun nóng đến nhiệt độ
không cao lắm thì lực van der Waals giữa các chuỗi đã bị phá vỡ, đồng thời một phần liên kết hiđro cũng
bị phá vỡ nên xảy ra hiện tượng nóng chảy.
Mỗi phân tử H-O-H có thể tạo được 4 liên kết hiđro với 4
phân tử H2O khác nằm ở 4 đỉnh của tứ diện. Trong nước đá mỗi
phân tử H2O liên kết với 4 phân tử H2O khác tạo thành mạng lưới
không gian 3 chiều. Muốn làm nóng chảy nước đá cần phải phá vỡ mạng
lưới không gian 3 chiều với số lượng liên kết hiđro nhiều hơn so với ở HF
rắn do đó đòi hởi nhiệt độ cao hơn.
2. Trong số các phân tử và ion: CH2Br2, F - , CH2O, Ca2+, H3As, (C2 H5 )2O , phân tử và ion nào có
thể tạo liên kết hiđro với phân tử nước? Hãy giải thích và viết sơ đồ mô tả sự hình thành liên kết đó.
Hướng dẫn giải:
2/ Các vi hạt CH2Br2, Ca2+, H3As không có nguyên tử âm điện mạnh nên không thể tạo liên kết hiđro với
phân tử nước. Các vi hạt F - , CH2O, (C2 H5 )2O có nguyên tử âm điện mạnh nên có thể tạo liênkết hiđro với phân tử nước: H H F H O C O 2H5 H O . . . O H C . . . O H C H 2H5 H
2. Viết công thức Lewis và xác định dạng hình học của các phân tử và ion sau: BCl + 3, CO2, NO2 , NO2, IF3
3. Tại sao bo triclorua tồn tại ở dạng monome (BCl3) trong khi nhôm triclorua lại tồn tại ở dạng đime (Al2Cl6)? Hướng dẫn chấm
2. a (0,5 điểm). Công thức Lewis: + BCl NO NO 3 CO2 2 2 IF3 Cl F : : . + .
O : : C : : O
O : : N : : O . I . . . B N F . . .. . . . . . . . : . . Cl Cl O O F
b (1 điểm). Dạng hình học:
BCl3: Xung quanh nguyên tử B có 3 cặp electron (2 cặp và 1 "siêu cặp") nên B có lai hoá sp2, 3
nguyên tử F liên kết với B qua 3 obitan này, do đó phân tử có dạng tam giác đều.
CO2: Xung quanh C có 2 siêu cặp, C có lai hoá sp, 2 nguyên tử O liên kết với C qua 2 obitan này.
Phân tử có dạng thẳng.
NO+: Ion này đồng electron với CO2 nên cũng có dạng thẳng.
NO2: Xung quanh N có 3 cặp electron quy ước gồm 1 cặp + 1 siêu cặp (liên kết đôi) + 1 electron
độc thân nên N có lai hoá sp2. Hai nguyên tử O liên kết với 2 trong số 3 obitan lai hoá nên phân tử có cấu
tạo dạng chữ V (hay gấp khúc). Góc ONO < 120o vì sự đẩy của electron độc thân.
IF3: Xung quanh I có 5 cặp electron, do đó I phải có lai hoá sp3d, tạo thành 5 obitan hướng đến 5
đỉnh của một hình lưỡng chóp ngũ giác. Hai obitan nằm dọc trục thẳng đứng liên kết với 2 nguyên tử F.
Nguyên tử F thứ ba liên kết với 1 trong 3 obitan trong mặt phẳng xích đạo. Như vậy phân tử IF3 có cấu tạo
dạng chữ T. Nếu kể cả đến sự đẩy của 2 cặp electron không liên kết, phân tử có dạng chữ T cụp. Cl . .... . O C O . B O N O N F I F . . . . . . . . . . .. . . O O Cl Cl F
3 (0,5 điểm). BF3: B có 3 electron hoá trị. Khi tạo thành liên kết với 3 nguyên tử F, ở nguyên tử B chỉ có 6
electron, phân tử không bền. Để có bát tử nguyên tử B sử dụng 1 obitan p không lai hoá để tạo liên kết π
với 1 trong 3 nguyên tử F. Kết quả là tạo thành phân tử BF3 có dạng tam giác đều giống BCl3 đã trình bầy ở trên.
AlCl3: AlCl3 cũng thiếu electron như BF3, nhưng Al không có khả năng tạo thành liên kết π kiểu
pπ-pπ như B. Để có đủ bát tử, 1 trong 4 obitan lai hoá sp3 của nguyên tử Al nhận 1 cặp electron không liên
kết từ 1 nguyên tử Cl ở phân tử AlCl3 bên cạnh. Phân tử AlCl3 này cũng xử sự như vậy. Kết quả là tạo thành một đime.
1. Phân loa ̣i các chất sau đây theo bản chất của lực tương tác giữa các đơn vi ̣cấu trúc trong ma ̣ng
tinh thể của chúng: Cu, kim cương, MgO, C6H12O6, I2, Pb, BN, NaH. Hướng dẫn giải:
1. - Tương tác kim loại - kim loại: Cu, Pb.
- Tương tác tĩnh điện giữa các ion tích điện trái dấu: MgO, NaH.
- Tương tác bằng lực liên kết cộng hoá trị: kim cương, BN.
- Tương tác bằng lực giữa các phân tử: C6H12O6, I2.
Câu 2 (2 điểm).
1. Sử du ̣ng mô hình về sự đẩy nhau của các că ̣p electron hóa tri ̣(mô hình VSEPR), dự đoán da ̣ng
hình ho ̣c của các ion và phân tử sau: BeH 2- + -
2, BCl3, NF3, SiF6 , NO2 , I3 .
2. So sánh và giải thích khả năng ta ̣o thành liên kết π của C và Si. Hướng dẫn giải:
1. BeH2: dạng AL2E0. Phân tử có dạng thẳng: H−Be−H.
BCl3: dạng AL3E0, trong đó có một “siêu cặp” của liên kết đôi B=Cl. Phân tử có dạng tam giác đều, phẳng.
NF3: dạng AL3E1. Phân tử có dạng hình chóp đáy tam giác đều với N nằm ở đỉnh chóp.
Góc FNF nhỏ hơn 109o29’ do lực đẩy mạnh hơn của cặp electron không liên kết. SiF 2-
6 : dạng AL6E0. Ion có dạng bát diện đều. NO +
2 : dạng AL2E0, trong đó có 2 “siêu cặp” ứng với 2 liên kết đôi N=O ([O=N=O]+). Ion có dạng đường thẳng. I -
3 : dạng AL2E3, lai hoá của I là dsp3, trong đó 2 liên kết I−I được ưu tiên nằm dọc theo trục thẳng
đứng, 3 obitan lai hoá nằm trong mặt phẳng xích đạo (vuông góc với trục) được dùng để chứa 3 cặp
electron không liên kết. Ion có dạng đường thẳng.
2. C và Si cùng nằm trong nhóm 4A (hay nhóm 14 trong Bảng tuần hoàn dạng dài) nên có nhiều sự tương
đồng về tính chất hoá học. Tuy nhiên, hai nguyên tố này thể hiện khả năng tạo thành liên kết π khác nhau
trong sự tạo thành liên kết của các đơn chất và hợp chất.
- Ở dạng đơn chất: Cacbon tồn tại dưới dạng kim cương (chỉ có liên kết đơn C-C) và graphit,
cacbin...(ngoài liên kết đơn còn có liên kết bội C=C và C≡C), nghĩa là tạo thành cả liên kết σ và liên kết π.
Silic chỉ có dạng thù hình giống kim cương, nghĩa là chỉ tạo thành liên kết σ.
- Ở dạng hợp chất: Trong một số hợp chất cùng loại, điển hình là các oxit: cacbon tạo thành CO và
CO2 mà phân tử của chúng đều có liên kết π, trong khi silic không tạo thành SiO, còn trong SiO2 chỉ tồn
tại các liên kết đơn Si–O. Giải thích:
Liên kết π được tạo thành do sự xen phủ của các obitan p. Nguyên tử cacbon (Chu kỳ 2) có bán
kính nhỏ hơn nguyên tử silic (Chu kỳ 3) nên mật độ electron trên các obitan của nguyên tử C cao hơn mật
độ electron trên các obitan tương ứng của nguyên tử Si. Khi kích thước của các obitan bé hơn và mật độ
electron lớn hơn thì sự xen phủ của các obitan hiệu quả hơn, độ bền của liên kết cao hơn. Do đó, cacbon
có thể tạo thành liên kết π cả ở dạng đơn chất và hợp chất, trong khi silic hầu như không có khả năng này.
Câu 2. (2,0 điểm): 1. 1,0 điểm; 2. 0,5 điểm; 3. 0,25 điểm; 4. 0,25 điểm.
Cho các phân tử: xenon điflorua (1), xenon tetraflorua (2), xenon trioxit (3), xenon tetraoxit
(4), bo triflorua (5), trimetylamin (6), axetamit (7).
1. Vẽ cấu trúc hình học phân tử (cả các cặp electron tự do (nếu có) của nguyên tử trung tâm) của các chất từ (1) đến (6).
2. Dự đoán góc liên kết ở mỗi phân tử nói trên.
3. Trong phân tử axetamit, 3 liên kết với nguyên tử nitơ đều nằm trong cùng một mặt phẳng. Vì sao?
4. Hãy đề xuất một phương pháp thích hợp để điều chế: xenon điflorua (1), xenon tetraflorua (2), xenon trioxit (3). 1. 2.
Câu 2. (2,0 điểm): 1. 0,75 điểm; 2. 0,5 điểm; 3. 0,5 điểm; 4. 0,25 điểm. 1. XeF2: XeF4: XeO3: XeO4: 2. O F F F F O O F F O O O O Thẳng, 180o Vuông, 90o Chóp tam giác, < 109o28 Tứ diện, 109o28 BF3: (CH3)3N: F F CH F 3 CH Tam giác phẳng, 120 3 CH o 3 Chóp tam giác, < 109o28
3. Ba liên kết với nguyên tử nitơ đều nằm trong cùng một mặt phẳng, vì liên kết giữa nitơ với cacbon
mang một phần đặc điểm của liên kết đôi. H sp3 H H sp2 H H C C N H C C N H H H H O O
4. Xenon điflorua (1) và xenon tetraflorua (2) được điều chế bằng phản ứng giữa các đơn chất (có chiếu sáng thích hợp).
Điều chế xenon trioxit (3) bằng phản ứng thủy phân XeF6 hoặc XeF4: XeF6 + 3 H2O → XeO3 + 6 HF
3 XeF4 + 6 H2O → Xe + 2 XeO3 + 12 HF Năm 2011
1. Clo, brom, iot có thể kết hợp với flo tạo thành các hợp chất dạng XFm. Thực nghiệm cho thấy
rằng m có 3 giá trị khác nhau nếu X là Cl hoặc Br, m có 4 giá trị khác nhau nếu X là I.
a) Hãy viết công thức các hợp chất dạng XFm của mỗi nguyên tố Cl, Br,I.
b) Dựa vào cấu tạo nguyên tử và độ âm điện của các nguyên tố, hãy giải thích sự hình thành các hợp chất trên.
Cho: Độ âm điện của F là 4,0; Cl là 3,2; Br là 3,0; I là 2,7. Câu 1 1
a) Công thức các hợp chất XFm: (2,0
X là Cl có ClF; ClF3; ClF5 (a); X là Br có BrF; BrF3; BrF5 (b); điểm)
X là I có IF; IF3; IF5; IF7 (c).
b) Các hợp chất trên đều có liên kết cộng hóa trị, mỗi liên kết được tạo thành do 2
electron có spin đối song song của 2 nguyên tử góp chung.
* F (Z = 9; n = 2) có 4 AO hóa trị, vì vậy cấu hình chỉ có 1 electron độc thân:
* Cl (Z = 17; n = 3), Br (Z = 35; 9n = 4), I (Z = 53; n = 5) giống nhau đều có 9 AO hóa trị, có thể có:
1 electron độc thân, hoặc 3 electron độc thân, 5 electron độc thân, 7 electron độc thân (Vẽ ô lượng tử)
- Hợp chất ClF7 không tồn tại vì thể tích nguyên tử clo rất nhỏ, lực đẩy của các
vỏ nguyên tử flo sẽ phá vỡ liên kết trong phân tử. Hợp chất BrF7 tương tự hợp chất
ClF7 (hợp chất BrF7 hiện nay chưa điều chế được).
- Hợp chất IF7 tồn tại vì thể tích nguyên tử iot rất lớn so với thể tích nguyên tử flo, lực
đẩy của các vỏ nguyên tử flo không phá vỡ được các liên kết trong phân tử. Năm 2012
Câu 1. (3,0 điểm): 1. 1 điểm; 2. 0,5 điểm; 3. 1,5 điểm.
1. Phân tử NH3 có dạng hình chóp tam giác đều (nguyên tử N ở đỉnh hình chóp). Ion + NH có dạng hình 4
tứ diện đều (nguyên tử N nằm ở tâm của tứ diện đều). Dựa vào sự xen phủ của các obitan, hãy mô tả sự
hình thành các liên kết trong phân tử NH3 và ion + NH . 4 1. Trong phân tử NH sp3 3 và ion +
NH , N có lai hóa sp3: 4 2s 2p
Trong NH3 một obitan lai hóa sp3 có cặp electron không liên kết, còn 3 obitan lai hóa sp3 khác với 1
electron độc thân xen phủ với 1 obitan s của nguyên tử H có 1 electron, tạo ra các liên kết σ bền vững. Trong +
NH , ngoài 3 liên kết σ như trong NH 4
3, còn 1 obitan lai hóa sp3 với đôi electron xen phủ
với AO 1s của H+ không có electron, tạo ra liên kết σ thứ 4. H N N H H H H H H + NH NH 3 4
Câu I (3,0 điểm)
1. Cho chất N≡SF3 lỏng tác dụng với [XeF][AsF6], thu được sản phẩm là [F3SN-XeF][AsF6] (1). Ở trạng
thái rắn, khi bị đun nóng, (1) chuyển thành [F4SN-Xe][AsF6] (2). Phản ứng của (2) với HF, thu được sản
phẩm [F5SN(H)-Xe][AsF6] (3), [F4SNH2][AsF6] (4) và XeF2.
a) Sử dụng mô hình sự đẩy của các cặp electron hóa trị (VSEPR), đề xuất cấu trúc của anion [AsF ] , cation 6
trong các hợp chất (1), (2), (3), (4) và cho biết (có giải thích) cation nào có liên kết giữa S và N ngắn nhất, dài nhất.
b) Cho biết trạng thái lai hóa của nguyên tử lưu huỳnh trong các hợp chất (1), (2), (3) và (4).
2. Sử dụng thuyết obitan phân tử (thuyết MO) để giải thích tại sao năng lượng ion hóa thứ nhất của phân
tử nitơ (1501 kJ∙mol-1) lớn hơn năng lượng ion hóa thứ nhất của nguyên tử nitơ (1402 kJ·mol-1). Hướng dẫn chấm
1. a) Cấu trúc của các cation và anion trong các hợp chất: F F F F F F F H S N Xe F S N F S N S N H F F F F Xe H F F F Xe F 1 2 3 4 F F F As F F F 5
Ở hợp chất (1), liên kết giữa S và N là liên kết ba. Ở hợp chất (2) và (4), liên kết giữa S và N là
liên kết đôi. Ở hợp chất (3), liên kết giữa S và N là liên kết đơn. Vì vậy, liên kết giữa S và N trong (1)
ngắn nhất; liên kết giữa S và N trong (3) dài nhất.
b) Trạng thái lai hóa của lưu huỳnh trong hợp chất (1): sp3; trong (2), (4): sp3d; trong (3): sp3d2.
2. Giản đồ MO của phân tử N2 có dạng như sau: * E z * * x y z 2p 2p x y * s 2s 2s s N N2 N
Năng lượng ion hóa thứ nhất của phân tử nitơ tương ứng với quá trình: N +
2 → N2 + e. Quá trình này
tương ứng với quá trình tách 1 electron ở MO σz ra xa phân tử N2 vô cùng.
Năng lượng ion hóa thứ nhất của nguyên tử nitơ tương ứng với quá trình: N → N+ + e. Quá trình này
tương ứng với quá trình tách 1 electron ở một AO 2p ra xa nguyên tử N vô cùng.
Từ giản đồ MO dễ thấy, năng lượng của obitan σz (trong phân tử N2) thấp hơn năng lượng của obitan
2p (trong nguyên tử N), nên electron ở obitan σz khó tách hơn electron ở obitan 2p. Do đó, năng lượng ion
hóa phân tử N2 (1501 kJ·mol-1) lớn hơn năng lượng ion hóa nguyên tử N (1402 kJ·mol-1).
Câu I : Xét các phân tử BF3, NF3 và IF3. Trả lời các câu hỏi sau :
I.1. Viết công thức chấm electron Lewis của các chất trên
I.2. Dựa vào thuyết lai hóa obitan nguyên tử hãy cho biết tr ạng th ái lai hóa của nguyên tử
trung tâm và dạng hình học của mỗi phân tử
1.3. Xác định xem phân tử nào là phân cực và không phân cực. Giải thích kết quả đã chọn F F N F I F S F F F F F Lai hóa sp2 Lai hóa sp3 Lai hóa sp3d Tam giác phẳng Tháp đáy tam giác Hình chữ T
Không cực vì momen lưỡng
Có cực vì lưỡng cực liên kết
Có cực vì lưỡng cực liên kết
cực liên kết bị triệt tiêu không triệt tiêu không triệt tiêu CÂU I (4 điểm)
I.1. Viết công thức cấu tạo Lewis, nêu trạng thái lai hóa và vẽ dạng hình học của các phân tử sau: (a) B2H6 (b) XeO3 (c) Al2Cl6
Giải thích vì sao có Al2Cl6 mà không có phân tử B2F6? I.2.
I.2.1. Trình bày cấu tạo của các ion sau: O , O 2 theo thuyết MO (cấu hình electron, công 2 2
thức cấu tạo). Nhận xét về từ tính của mỗi ion trên.
I.2.2. So sánh và giải thích ngắn gọn độ phân cực (momen lưỡng cực) của các chất sau: NH3, NF3, BF3.
I.3. Hòa tan 2,00 gam muối CrCl3.6H20 vào nước, sau đó thêm lượng dư dung dịch AgNO3 và lọc nhanh
kết tủa AgCl cân được 2,1525 gam. Cho biết muối crom nói trên tồn tại dưới dạng phức chất.
I.3.1. Hãy xác định công thức của phức chất đó.
I.3.2. Hãy xác định cấu trúc (trạng thái lai hóa, dạng hình học) và nêu từ tính của phức chất trên. H H H B B H H H Xe O
B lai hãa sp3, ph©n tö B2H6 gßm O
2 tø diÖn lÖch cã 1 c¹nh chung, O
liªn kÕt BHB lµ liªn kÕt 3 t©m vµ Xe lai hãa sp3 ph©n tö
chØ cã 2 electron, 1 electron cña d¹ng th¸p tam gi¸c H vµ 1 electron cña B. Có phân tử Al Cl
2Cl6 vì nguyên tử Al đạt cấu Cl Cl trúc bát tử vững bền. Al Al
Không có phân tử B2F6 vì: phân tử BF3 bền
do có liên kết pi không định chỗ được tạo Cl Cl Cl
thành giữa obitan trống của B với cặp
electron không liên kết của F và kích thước
Al lai hãa sp3, ph©n tö Al2Cl6 gßm 2 tø diÖn lÖch
cã 1 c¹nh chung, cã 2 liªn kÕt cho nhËn ®-îc
của nguyên tử B bé so với nguyên tử F nên
t¹o thµnh do cÆp e kh«ng liªn kÕt cña Cl vµ
tương tác đẩy giữa 6 nguyên tử F lớn làm
obitan trèng cña Al.Trong Al 2Cl6 nguyªn tö Al
cho phân tử B2F6 trở nên kém bền.
®¹t ®-îc cÊu tróc b¸t tö v÷ng bÒn. I.2. I.2.1. O O O : ( lk ) 2 ( * ) 2 ( lk )2 ( lk ) 2 =( lk ) 2 ( * )1=( * ) 0,25đ 2 s s z x y x y 2 0,25đ 2 O O O : ( lk ) 2 ( * ) 2 ( lk )2 ( lk ) 2 =( lk ) 2 ( * )2=( * )2 2 s s z x y x y
O có electron độc thân nên thuận từ. O 2 không có electron độc thân nên 0,25đ 2 2 ngịch từ. I.2.2. F N N H F B H F F F H F (0,75đ)
C¸ c vect¬ momen l- ì ng cùc C¸ c vect¬ momen l- ì ng cùc
Ph©n tö d¹ ng tam gi¸ c ®Òu
cña c¸ c liª n kÕt vµ cÆp
cña c¸ c liª n kÕt vµ cÆp
C¸ c vect¬ momen l- ì ng cùc
electron kh«ng liª n kÕt cï ng
electron kh«ng liª n kÕt ng- î c
cña c¸ c liª n kÕt triÖt tiª u lÉn
chiÒu nª n momen l- ì ng cùc chiÒu nª n momen l- ì ng cùc
nhau(tæng b»ng kh«ng) ph©n cña ph©n tö lí n nhÊt.
cña ph©n töbÐ h¬n NH3. tö kh«ng ph©n cùc.
(0,25 đ) (0,25 đ) (0,25 đ)
I.3.1. n(AgCl) = (2,1525:143,5) = 0,015; n(CrCl3 . 6H2O) = (2:266,5) = 7,5.10-3
n(Cl- tạo phức) = 3(7,5.10-3) - 0,015 = 7,5.10-3 (0,75đ)
Trong phân tử phức chất tỷ lệ mol Cl : Cr3+ = (7,5.10-3) : (7,5.10-3) = 1:1
Công thức của phức: Cr(H2O)5Cl2+ I.3.2.
Cr3+ (1s2 2s2 2p6 3s2 3p6 3d3) Cr3+ : [Ar] 3d3 24 24 Cl 900 H 3d3 4s 4p 2O H2O (0,75 đ) Ar A H H 2O 2O 900 H Cr lai hãa sp3d2 2O Phøc thuËn tõ (0,25đ) B¸t diÖn ®Òu (0,25đ) Câu I (4 điểm)
Cho bộ bốn số lượng tử của electron chót cùng trên nguyên tử của các nguyên tố A, X, Z như sau:
A: n = 3, l = 1, m = - 1, s = -1/2
X: n = 2, l = 1, m = - 1, s = -1/2
Z: n = 2, l = 1, m = 0, s = +1/2 I.1 Xác định A, X, Z.
I.2 Trạng thái lai hoá và cấu trúc hình học của các phân tử và ion sau: ZA 2- 2- 2, AX2, AX3 , AX4
I.3 Bằng thuyết lai hoá giải thích sự tạo thành phân tử ZX. Giải thích vì sao ZX có moment lưỡng cực bé.
Giải thích sự hình thành liên kết trong phân tử phức trung hoà Fe(CO)5 bằng thuyết VB.
I.4 Giải thích vì sao AX 2- 2-
3 lại có khả năng hoà tan A tạo thành A2X3 . Câu I I.1
Nguyên tố A: n = 3, l = 1, m = -1, s = -1/2 3p4 A là S
Nguyên tố X: n = 2, l = 1, m = -1, s = -1/2 2p4 X là O
Nguyên tố Z: n = 2, l = 1, m = 0, s = +1/2 2p2 Z là C I.2 Phân tử, iôn Trạng thái lai hoá cuả Cấu trúc hình học nguyên tử trung tâm CS2 sp Đường thẳng SO2 sp2 Góc SO 2 sp3 Chóp đáy tam giác đều 3 SO 2 sp3 Tứ diện đều 4 I.3 C: [He] 2s2 2p2 O: [He] 2s2 2p4
Cacbon dùng 1 obitan 2s tổ hợp với 1 obitan 2p tạo ra 2 obitan lai hoá sp hướng ra hai phía khác nhau,
trong đó có một obitan bão hoà và 1 obitan chưa bão hòa.
Cacbon dùng 1 obitan lai hoá chưa bão hoà xen phủ xichma với 1 obitan p chưa bão hoà cuả oxi và dùng 1
obitan p thuần chủng chưa bão hoà xen phủ pi với 1 obitan p chưa bão hoá còn lại cuả oxi. Oxi dùng 1
obitan p bão hoà xen phủ vơí obitan p trống của cacbon tạo liên kết pi kiểu p p.
Công thức cấu tạo: :C O:
+ CO có moment lưỡng cực bé vì trong phân tử có liên kết phối trí ngược cặp electron của nguyên tử oxi
cho sang obitan trống cuả nguyên tử cacbon làm giảm độ phân cực của liên kết nên làm giảm moment lưỡng cực.
+ Sự hình thành liên kết trong phân tử Fe(CO)5 Fe (Z = 26) [Ar] 3d6 4s2 4p0 Fe* [Ar] 3d8 4s0 4p0
Ở trạng thái kích thích, nguyên tử Fe dùng 1 obitan 3d trống tổ hợp với 1obitan 4s và 3 obitan 4p tạo
thành 5 obitan lai hoá dsp3 trống hướng ra 5 đỉnh của hình lưỡng chóp đáy tam giác đều tâm là nguyên tử Fe.
CO dùng cặp electron tự do chưa liên kết trên nguyên tử cacbon tạo liên kết phối trí với các obitan lai hoá
trống của sắt tạo ra phân tử phức trung hoà Fe(CO)5 Fe* [Ar] 3d8 4s0 4p0 :CO :CO :CO : CO :CO I.4 S [Ne] 3s2 3p4 S* [Ne] 3s2 3p4 SO 2- 2-
3 có khả năng kết hợp thêm 1 nguyên tử S
để tạo S2O3 vì trên nguyên tử S trong SO 2-
3 còn có một cặp electron tự do chưa liên kết có khả năng cho vào obiatn 3p trống của
nguyên tử S tạo liên kết cho nhận. 2- S 2- S O S O S O O O O Câu 1. (4 điểm).
1. Hãy cho biết dạng hình học và trạng thái lai hóa của nguyên tử trung tâm đối với phân tử H2O và
H2S. So sánh góc liên kết trong 2 phân tử đó và giải thích.
2. Bán kính nguyên tử của các nguyên tố chu kì 3 như sau, hãy nhận xét và giải thích: Nguyên tử Na Mg Al Si P S Cl o Bán kính ( A ) 1,86 1,60 1,43 1,17 1,10 1,04 0,99
3. Khí N2 và khí CO có một số tính chất vật lý giống nhau như sau: Năng lượng phân ly Khoảng cách giữa các Nhiệt độ nóng chảy phân tử (kJ/mol) o hạt nhân ( A ) (oC) N2 945 1,10 – 210 CO 1076 1,13 – 205
Dựa vào cấu hình MO của phân tử N2 và phân tử CO để giải thích sự giống nhau đó.
4. Giải thích độ bền phân tử và tính khử của các hợp chất hydrohalogenua.
Đáp án câu 1. (4 điểm).
1. – Phân tử H2O và H2S đều là phân tử có góc vì chúng thuộc dạng AX2E2.
– Trạng thái lai hóa của oxi và lưu huỳnh đều là sp3.
– Oxi có độ âm điện lớn hơn lưu huỳnh, mây electron liên kết bị hút mạnh về phía nguyên tử trung
tâm sẽ đẩy nhau nhiều hơn, làm tăng góc liên kết. Vì vậy góc liên kết trong phân tử H2O lớn hơn
góc liên kết trong phân tử H2S. 2.
Nhận xét: Từ đầu đến cuối chu kì bán kính nguyên tử giảm dần.
Giải thích: Trong chu kì, số lớp electron như nhau nhưng do điện tích hạt nhân tăng dần, số
electron lớp ngoài cùng tăng dần, làm cho lực hút giữa hạt nhân với lớp ngoài cùng mạnh dần dẫn
đến bán kính nguyên tử giảm.
3. Cấu hình MO của phân tử N * 2:
(2s)2 (2s )2 (x)2 = (y)2 (z)2 bậc liên kết = 3
Cấu hình MO của phân tử CO: ( *
2s)2 (2s )2 (x)2 = (y)2 (z)2 bậc liên kết = 3
Liên kết trong phân tử N2 và CO rất giống nhau đã dẫn đến một số tính chất vật lý giống nhau.
4. Các hợp chất hydrohalogenua: HF HCl HBr HI
– Độ bền phân tử giảm từ HF đến HI vì độ âm điện giảm và bán kính nguyên tử tăng từ F đến I.
– Tính khử tăng từ HF đến HI vì độ âm điện giảm từ F đến I làm cho khả năng nhường electron
tăng từ F–1 đến Cl–1.
BÀI TẬP TỰ GIẢI CÓ HƯỚNG DẪN GIẢI
Bài 1: Cho phân tử ClF3 hãy
- Viết công thức cấu tạo; cho biết kiểu lai hoá trong phân tử; Mô tả hình dạng phân tử. Cho : (độ
phân cực của phân tử là 0,55D; góc liên kết FClF = 870
- Độ phân li nhiệt (tính theo %) ở 1000K của các halogen: F2 Cl2 Br2 I2 % 4,3 0,035 0,23 2,8
Hãy nêu qui luật chung của sự biến thiên độ phân li nhiệt, giải thích sự bất thường về độ phân li nhiệt từ F2 đến Cl2
HD: Từ F2 đến Cl2: Trong F2 chỉ có liên kết đơn duy nhất giữa 2 nguyên tử
Trong Cl2ngoài liên kết cộng hoá trị thường còn liên kết phối trí kiểu p – d độ
bền liên kết trong Cl2 lớn hơn trong F2
Từ Cl2 đến Br2: liên kết tương tự nhau nhưng do độ dài liên kết tăng (bán kính nguyên tử tăng) độ bền liên kết giảm
Bài 2: Cho các trị số góc liên kết: 100,30; 97,80 ; 101,50 ; 1020 và các góc liên kết IPI; FPF; ClPCl;
BrPBr. Hãy gán trị số cho mỗi góc liên kết và giải thích.
ĐS: FPF > ClPCl > BrPBr > IPI
Dựa vào lực đẩy của cặp e liên kết trong mỗi phân tử
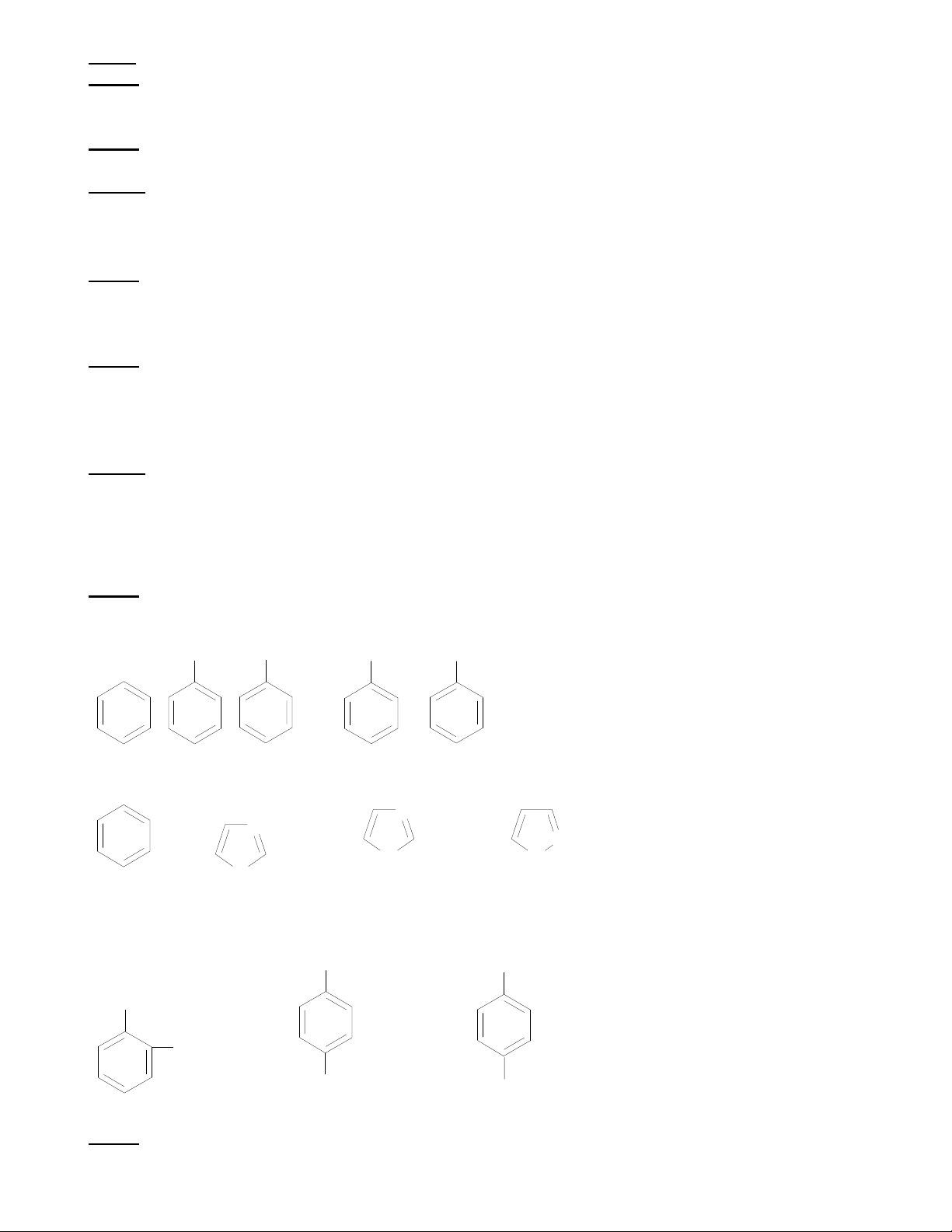
Bài 3: Một trong 3 chất hữu cơ sau: ortho-điclobenzen; meta-điclobenzen; para-điclobenzen có momen
lưỡng cực bằng 1,53D. Hãy chỉ rõ đó là chất nào? có giải thích, biết rằng monoclobenzen có momen lưỡng cực là 1,53D ĐS: meta-điclobenzen
Bài 4: Giải thích tại sao Cl2 và N2 có độ âm điện xấp xỉ nhau nhưng ở nhiệt độ thường Cl2 là một chất
hoạt động hoá học mạnh còn N2 hầu như trơ về mặt hoá học, chỉ hoạt động mạnh khi ở nhiệt độ cao?
ĐS: Dựa vào độ bội của liên kết
Bài 5: Vì sao nước đá lại nhẹ hơn nước lỏng?
Dựa vào cấu tạo mạng lưới tinh thể khi nước đá ở trạng thái rắn: có các ô trống trong mạng lưới tinh thể
thể tích tăng so với nước ở trạng thái lỏng khối lượng riêng giảm Bài 6: Momen lưỡng cực
của liên kết C – Cl bằng 1,6D. Triclo – benzen có momen lưỡng cực = 0. Hãy chỉ rõ cấu tạo của đồng
phân này? Nêu cấu tạo của đồng phân C6H3Cl6 có momen lưỡng cực lớn nhất và tính momen đó. ĐS: 1,3,5-triclobenzen
Bài 7: Có 3 hiđrocacbon: C2H6 ; C2H4; C2H2
Người ta ghi được các số liệu sau:
- Về góc hoá trị (góc liên kết) : 1200; 1800; 1090
- Về độ dài liên kết: 1,05 A0; 1,070; 1,090; 1,2A0; 1,34A0; 1,54A0.
- Độ âm điện của nguyên tử cacbon: 2,5 ; 3,28; 2,75
- hãy điền các giá trị phù hợp với từng hiđrocacbon theo bảng sau: Hiđrocacbon Kiểu lai Góc hoá
Độ dài liên kết Độ dài liên kết C- Độ âm điện của hoá trị C-C (A0) H (A0) nguyên tử C Etan Etilen Axetilen
Bài 8: So sánh độ mạnh của các axit HF , HCl, HBr, HI. Giải thích. Vì sao axit flohiđric lại tạo được
muối axit còn các axit HX khác thì không có muối axit?
So sánh và giải thích tính axit của HClO ; HClO2; HClO3; HClO4 với nhau
ĐS: Dựa vào độ dài liên kết để giải thích: HF < HCl < HBr < HI
HF có khả năng tạo liên kết H liên phân tử H2F2
Bài 9: Tại sao có phân tử Al2Cl6 mà không có phân tử B2Cl6?
HD: dựa vào cấu tạo nguyên tử Al : có obitan d còn trống tạo liên kết phối trí giữa đôi e tự do của
Cl với obitan đó còn B thì không có obitan d
Bài 10: Điểm sôi của NF3 = -1290C còn của NH3 = -330C. Amoniac tác dụng như một bazơ Lewis còn
NF3 thì không. Momen lưỡng cực của NH3 = 1,46D; NF3 = 0,24 mặc dù về độ âm điện của F lớn hơn H nhiều.
ĐS: NH3 có liên kết hiđro còn NF3 không có liên kết hiđro;
Bài 11: Xét 2 phân tử PF3 và PF5.
a) Viết công thức cấu tạo theo Lewis các phân tử trên. Cho biết trạng thái lai hoá của nguyên tử trung
tâm và dạng hình học phân tử của chúng.
b) Trong hai phân tử trên, phân tử nào có cực, phân tử nào không cực? Giải thích.
c) Có phân tử NF5, AsF5 không ? Tại sao?
Bài 12: Hãy giải thích tại sao:
a) oxi là nguyên tố có độ âm điện lớn hơn clo nhưng ở điều kiện thường lại hoạt động hoá học kém hơn ?
b) ở điều kiện thường nitơ là chất khí nhưng photpho lại là chất rắn? phot pho là nguyên tố có độ âm
điện nhỏ hơn nitơ nhưng lại hoạt động hơn nitơ?
c) Phân tử NO2 có khả năng trùng hợp còn phân tử SO2 lai không?
Bài 13: Khảo sát cấu trúc phân tử của : SOF - +
4; PBr2F3; SF4 ; ICl 4 ; NO2F; CO3-; PCl4 ; ICl3
Bài 1: Cho hợp chất có dạng AXmEn trong đó: A là nguyên tử trung tâm, X là phối tử có liên kết đơn với
nguyên tử A, E là cặp e tự do của A. Biết m + n = 5
Hãy biện luận theo m, n về khả năng lai hóa của A và dạng hình học của phân tử
Bài 2: Cho biết các năng lượng phân li liên kết sau đây: Liên kết O – H C – C
C = C C – H Cl – Cl H – Cl C- O C - Cl
E (kcal/mol) 11 83 143 100 57 103 84 78,5
Hãy tính hiệu ứng nhiệt trong các phản ứng sau đây
a) HCl + CH2 = CH2 CH3 – CH2Cl b) C2H5OH H2O + CH2 = CH2 c) CH4 + Cl2 HCl + CH3Cl
Bài 3: Cho biết các năng lượng liên kết sau đây: EC-C = 343,4 kJ/mol, EC=C = 597,7 kJ/mol; EC-H = 418,4 kJ/ mol
a) Hãy tính năng lượngnt hóa của ben zen ứng với công thức cổ điển của Kekule
b) B) So sánh với giá trị thực nghiệm EA = 5496,7 kJ/mol và giải thích ĐS: EA = 5333,7 kJ
Bài 4: a) Đối với những hợp chất tương tự thì những hợp chất có khối lượng phân tử lớn thường có nhiệt
độ sôi cao, tại sao H2S lại có nhiệt độ sôi thấp hơn nước
b) Tại sao dung dịch các hợp chất NR4OH (R là gốc hiđrocacbon ) là một bazơ mạnh giống như bazơ
kiềm còn dung dịch NH3 và các dung dịch amin bậc 1, 2, 3 là bazơ yếu
c) Tại sao p- O2N- C6H4-OH lại có nhiệt độ sôi, nhiệt độ nóng chảy, độ tan trong các dung môi phân cực
lớn hơn so với o- O2N- C6H4-OH Bài 5:
a) Tại sao trong các phân tử H2O, NH3 các góc liên kết HOH (104,50) < HNH(1070) < góc tứ diện (109028’)
b) Tại sao góc HSH (92015’) trong phân tử H2S < HOH trong phân tử H2O
c) Xét 2 phân tử H2O và F2O tại sao góc FOF (103015’) lại nhỏ hơn góc HOH
d) Tại sao trong phân tử HCHO góc HCH (1160) lại nhỏ hơn 1200 và góc HCO (1220) lại lớn hơn 1200
Bài 6: Đối với mỗi hợp chất sau đây: F2O, NF3, BF3 hãy cho biết:
a) Số cặp e liên kết và không liên kết của nguyên tử trung tâm
b) Cấu trúc hình học của phân tử
c) Đánh giá các góc liên kết FOF, FNF, FBF
Bài 7: Hãy giải thích tại sao góc ClSCl < ClOCl trong các phân tử SCl2, OCl2
FOF < ClOCl trong các phân tử OF2 và OCl2
Bài 8: áp dụng qui tắc bát tử ( octet) hãy viết sơ đồ Lewis của các phân tử sau: NH3, H2O2, CH3CN,
CH3COOH, HNO3, N2O5, SO3, SOCl2, CO, SO2, H2SO4, HClO4, H2S2O7, H2S2O8
Bài 9: Nêu ra 5 ví dụ về những trường hợp mà quy tắc bát tử không được nghiệm đúng
Bài 10: Hãy viết sơ đồ Lewis của các phân tử sau đây và hãy cho biết phân tử nào không chứa điện tích
hình thức dương hoặc âm
(CH3)3N-B(CH3)3; (CH3)2NOCH3; CH2N2; (CH3)3NO; F3BO(CH3)2; HClO, HClO2, HClO3
Bài 11: Trong các chất sau đây chất nào tồn tại được loại đồng phân hỗ biến (tautome) : CH3COCH2CHO;
CH3CHOHCH2CH2CHO; CH3COCH2COOCH3; CH3COCH2OOCCH3; CH3COCH=CHCHO Bài 12:
Biết rằng momen lưỡng cực của clobenzen là 1 =1,53 D, anilin có 2 = 1,6 D, nitrobenzen có 3
= 3,9D hãy tính momen lưỡng cực O , m , p của các hợp chất o-, m-, p- điclobenzen, nitroclobenzen, nitro anilin, clo anilin
Bài 13: Cho các phân tử sau: a) CO2 b) H2O c) NH3 d) NF3 e) PCl5
1. Phân tử nào có liên kết phân cực nhất
2. Phân tử nào phân cực ? không phân cực? Tại sao?
Bài 14: Xét 2 phân tử PF3 va PF5
a) Viết công thức Lewis của các phân tử trên. Cho biết trạng thái lai hóa của nguyên tử trung tâm và dạng
hình học phân tử của chúng
b) Giải thích trong 2 phân tử trên, phân tử nào có cực và không cực
c) Có tồn tại phân tử NF5 và AsF5 không? Tại sao?
Bài 15: Hai phân tử NH3 và NF3 đều có cấu trúc tháp tam giác
a) hãy cho biết công thức cấu tạo và trạng thái lai hóa của N trong cả hai trường hợp, biểu diễn chúng bằng sơ đồ
b) Giải thích tại sao NH (1,46D) >> 3 3 NF (0,2D)
c) So sánh góc liên kết trong các phân tử trên Bài 16
Giải thích sự khác nhau về nhiệt độ sôi trong mỗi dãy sau: a. CH CH -CH O-CH OH 3 2 3 3 80oC 110oC 136oC 182oC 155oC b. N N N N N N S H H 115oC 117oC 256oC 187oC c. OH NO2 NO2 OH NO 2 Cl 214oC 279oC 239oC Bài 17
Hãy giải thích sự tăng dần nhiệt độ sôi của :
a.CH3OH (65oC) < CH3CH2OH (78,5oC) < n-C3H7OH (97,2oC)< n-C4H9OH (138oC).
b. Rượu X CH3CH2CH2OH có nhiệt độ sôi cao hơn rượu Y (CH3)2CH-OH Bài 18
Một trong những hợp chất mới có thể được dùng để thay thế CFCl3 (Freon-11) trong điều hoà và tủ
lạnh là hợp chất X có thành phần nguyên tố 23,54% C , 1,98% H và 74,48 % F. 1, Xác định CTDGN của X
2, Xác định CTPT của X biết MX= 90 đến 100.
3, Viết công thức các đồng phân cấu tạo của X và cho biết đồng phân nào có độ phân cực lớn nhất . Bài 19
1.HF có = 1,91 D và sôi ở 19,34oC.
C2H5F có =1,80D và sôi ở –37,7oC
Tại sao lại có sự khác biệt như vậy?
2.Hai amin có cùng phân tử khối là (CH3)3N và CH3CH2CH2NH2 . Một chất sôi ở 49 oC , chất còn lại sôi
ở 3oC . Hỏi chất nào sôi ở nhiệt độ nào ? Bài 20
So sánh nhiệt độ sôi và giải thích ?
n-Hexan, iso-Hexan, 3-metylpentan, 2,3-đimetylbutan. Bài 21
Cho 4 chất thơm có độ sôi tương ứng như sau: Chất thơm A B C D toC (oC) 80 132,1 184,4 181,2
Hãy xác định A, B, C, D là những chất nào trong số các chất sau :
C6H5NH2, C6H5OH , C6H5Cl, C6H6. Bài 22
So sánh nhiệt độ sôi của các chất sau: a. CHO O CH OH OH (A) (B) b. C2H5NH2 (CH3)3N C2H5-NH-CH3 (A) (B) (C) c. C2H5OH (A) và CH3OCH3 (B) d. C2H5OH (A) và C2H5Br (B) Bài 23
Hãy giải thích tại sao ở điều kiện thường những chất trong từng cặp chất sau có sự khác nhau về trạng thái :
a. CH3CH2OH (chất lỏng) và CH3OCH3 (khí).
b. H2O (lỏng) và H2S (khí). Bài 24
Vì sao khi cho Etanol vào nước thì thể tích hỗn hợp dung dịch thu được lại giảm so với tổng thể tích hai chất ban đầu? Bài 25
Cho các chất hữu cơ sau:
CH3COOH (A) CH3OCH3 (B) CH3CH2CH=O (C) NH N CH O 3 CHCl3 (D) (E) (G) (H) COOH COOH OH OH NH2 OH OH (I) (K) (L) (M) HO-CH -CH -CH -OH 2 2 2 (N)
a. Những chất nào có liên kết Hiđro liên phân tử ?
b. Những chất nào có liên kết Hidro nội phân tử?
c. Những chất nào tạo được liên kết Hiđro với nước?
d. Những chất nào tạo được liên kết Hiđro với axeton? Bài 26
Có 5 chất hữu cơ: cis- CHCl=CHCl ; trans- CHCl=CHCl ;
cis- CH3- CH=CHCl ; trans- CH3-CH=CHCl và trans- CH3-CH=CH-COOH
với các giá trị momen lưỡng cực sau đây: Chất hữu cơ A B C D E (D) 0,00 1,89 2,13 1,97 1,71
Hãy chỉ rõ A,B,C,D,E ứng với chất nào? Giải thích Bài 27
Căn cứ vào tính chất hãy chỉ rõ đồng phân nào (A hoặc B) là đồng phân cis hoặc đồng phân trans.
a. FCH=CHF A=0,0 B = 2,4
b. C6H5 CH=CH-COOH tonc (A) = 68oC , tonc (B) =134oC




