Preview text:
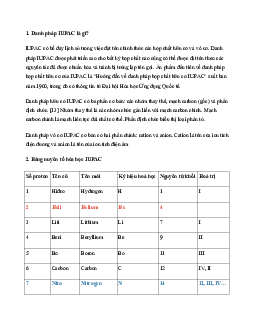
CHUYÊN ĐỀ HÓA HỌC 10: BÀI TẬP ĐỒNG VỊ
A. KIẾN THỨC TRỌNG TÂM
Đồng vị là những nguyên tử có cùng số proton nhưng khác số notron, do đó số
khối của chúng khác nhau.
Ví dụ: Nguyên tố O có 3 đồng vị là 16 17 18 O; O; O 8 8 8
Nguyên tử khối trung bình Công thức A .x + A .y + A .z +. . A .n 1 2 3 n A = 100
- Trong đó A1, A2, A3,… là số khối của các đồng vị.
- x,y,z,… là thành phần % của các đồng vị.
DẠNG I. TÍNH % KHỐI LƯỢNG CỦA MỘT ĐỒNG VỊ TRONG PHÂN TỬ
1. Phương pháp giải
Hầu hết các nguyên tố có mặt trong tự nhiên là hỗn hợp các đồng vị bền Áp dụng công thức A .x + A .x + A .x +. . A .x 1 1 2 2 3 3 n n A = 100
- Trong đó A1, A2, A3,… là số khối của các đồng vị.
- x1,x2,x3,… là thành phần % của các đồng vị.
Sử dụng sơ đồ đường chéo: x1 A1 A2 - A x A - A A 1 2 => = (A > A ) 2 1 x2 A - A1 x2 A2 A - A1 2. Ví dụ minh họa
Ví dụ 1: Trong tự nhiên nguyên tố Brom có 2 đồng vị, trong đó đồng vị 79Br 35
chiếm 54,5% về số lượng. Số khối của đồng vị còn lại là? Hướng dẫn giải
Đặt A2 là số khối của đồng vị thứ hai.
Phần trăm số lương của nó là: 100 - 54,5 = 45,5 Ta có: A .x + A .x 54,5.79 + A .45,5 1 1 2 2 2 M = A 81 2 100 100
3. Bài tập vận dụng
Câu 1. Khối lượng nguyên tử của B bằng 10,81. B trong tự nhiên gồm hai đồng
vị 10B và 11B. Hỏi có bao nhiêu phần trăm 11B trong axit boric H3BO3. Cho H3BO3 = 61,81. Hướng dẫn giải
Giả sử % của 10B và 11B trong tự nhiên lần lượt là x, y. Ta có hệ phương trình: 1
0x 11y 10,81 x 0,19 x y 1 y 0,81 11 0,81.11 % B 14,42% 2 10,8116.3
Câu 2. Trong tự nhiên đồng vị 37Cl chiếm 24,23,% số nguyên tử clo.Tính thành
phần phần trăm về khối lượng 37Cl có trong HClO4 ( với hidro là đồng vị 1H, oxi là
đồng vị 16O). Cho khối lượng nguyên tử trung bình của Clo là 35,5. Hướng dẫn giải
Đặt số mol HClO4 là 1 mol thì có 0,2423 mol 37Cl 37 37.0,2423 % Cl .100% 8,9205% 1 35,5 16.4
Câu 3. Trong tự nhiên Brom có 2 đồng vị là 79Br và 81Br có nguyên tử khối trung
bình là 79,92. Thành phần phần trăm về khối lượng của 81Br trong NaBr là bao nhiêu. Cho MNa = 23 Hướng dẫn giải
Gọi phần trằm đồng vị 79Br là a%
=> Phần trăm của đồng vị 81Br là 100% - a%
Nguyên tử khối trung bình của Br: 79 . a 81(100 a)
.100% 79,9 a 54,5 100
Câu 4. Cho hợp chất XY 79
2 tạo bởi hai nguyên tố X, Y. Y có hai đồng vị : Y chiếm
55% số nguyên tử Y và đồng vị 8 Y 1
. Trong XY2, phần trăm khối lượng của X là bằng
28,51%. Tính nguyên tử khối trung bình của X, Y.
Đáp số: X: 63,7, Y: 79,9
Câu 5.Trong tự nhiên Cu có 2 đồng vị là là 63Cu và 65Cu . Khối lượng nguyên tử
trung bình của Cu là 63,54. Thành phần phần trăm về khối lượng của là 63Cu trong Cu2O là bao nhiêu.
Giả sử % nguyên tử 65Cu và 63Cu trong tự nhiên lần lượt là x, y Ta có hệ phương trình x y 1 x 0,73 63x 65y 63,54 y 0, 27
Phần trăm khối lượng của 63Cu trong CuCl2 là: 63 0,73.63 % Cu 31,18 63,54 35,5.2
Câu 6. Trong tự nhiên clo có hai đồng vị bền là 37Cl và 35Cl. Tính thành phần phần
trăm về khối lượng 35Cl có trong KClO3 ( với kiện là đồng vị 39K, oxi là đồng vị 16O).
Cho khối lượng nguyên tử trung bình của Clo là 35,5
Giả sử % nguyên tử 35Cl và 37Cl trong tự nhiên lần lượt là x, y. x y 1 x 0,75 3 5x 37 y 35,5 y 0, 25
Phần trăm khối lượng của 37Cl trong KClO3 là: 37 0,25.37 % Cu 7,55% 39 35,5 16.3
Câu 7. Cacbon có hai đồng vị bền là 126C và 136C , và AC 12,01. Tính % khối lượng 12
của 6C trong hợp chất CO2 ( cho MNa = 23; MO = 16)
Gọi % số nguyên tử của đvị 12C và 13C lần lượt là x và y Ta có hệ:
Gọi % số nguyên tử của đvị 12C và 13C lần lượt là x và y Ta có hệ:
x y 100 x 99 1 2x 13y 12,01 y 1 100
Xét 1 mol CO2 1 mol C => mC = 12,01 2 mol O => mO = 32
Ta biết % số nguyên tử = % số mol nên
Số mol của 12C là: 0,99.1 = 0,99 mol
%m12C = (0,99.12.100)/(12,01+ 32) = 27
Xét 1 mol CO2 1 mol C => mC = 12,01 2 mol O => mO = 32
Ta biết % số nguyên tử = % số mol nên
Số mol của 12C là: 0,99.1 = 0,99 mol
%m12C = (0,99.12.100)/(12,01+ 32) = 27
Câu 8. Nguyên tố Bạc có 2 đồng vị trong tự nhiên là 107Ag chiếm 51,839% số
nguyên tử. Tính số khối của đồng vị còn lại biết trong AgCl bạc chiếm 75,254% về khố lượng. Cho Cl = 35,5
Gọi nguyên tử khối của bình của Ag là M. →%mAg =M/(M+35,5) = 75,254% →M = 107,9575
Gọi số khối của đồng vị còn lại là x, đồng vị này chiếm 48,161%
→ 107.51,839% + x.48,161% = 107,9575 → x = 109 Đáp số: 109
Câu 10. Trong tự nhiên, X có hai đồng vị 35X và 37X, chiếm lần lượt 75,77% và
24,23% số nguyên tử X. Y có hai đông vị à 11Y và 12Y, chiếm lần lượt 99,2% và 0,8% số nguyên tử Y.
a) Trong tự nhiên có bao nhiêu loại phân tử XY?
b) Phân tử khối trung bình của XY là
Đáp án hướng dẫn giải
X có hai đồng vị 35X và 37X => 35.75,77 37.24,23 X 35,4846 35,5 100 Đây là Cl
Y có hai đồng vị 1Y và 2Y => 1.99,2 2.0,8 Y
1g / mol 100 => Đây là H
1 nguyên tử H gắn với 1 nguyên tử Cl
+ Số cách chọn nguyên tử Cl ứng với 2 cách chọn tương đương 2 đồng vị
+ Số cách chọn nguyên tử H: 2 cách chọn tương đương 2 đồng vị => có 2.2 = 4 cách chọn
Câu 11. Nguyên tố clo có hai đồng vị bền 35Cl chiếm 75,77% và 37Cl chiếm 24,23%.
Tính nguyên tử khối trung của clo?
Đáp án hướng dẫn giải
Áp dụng công thức tính nguyên tử khối trung bình: . A x . B y A X 100
Trong đó đồng vị A có x% số nguyên tử, đồng vị B có y% số nguyên tử.
Vậy nguyên tử khối trung bình của nguyên tố clo bằng: 35.75,77 37.24,23 35,48 100 Đáp số: 35,5
Câu 12. Trong tự nhiên có hai đồng vị bền: 37Cl chiếm 24,23% tổng số nguyên tử,
còn lại là 35Cl. Thành phần % theo khối lượng của 37Cl trong HClO4 là: %35Cl = 100% - 24,23% = 75,77%
→ MCl = 37 x 0,2423 + 35 x 0,7577 = 35,4846.
→ Thành phần % của 37Cl trong HClO4 là 0,2423.37 %37Cl 8,92 1 35,4846 16.4 Đáp số: 8,92%
DẠNG II. TÍNH SỐ NGUYÊN TỬ CỦA ĐỒNG VỊ TRONG MỘT LƯỢNG CHẤT 1. Ví dụ minh họa
Ví dụ 2: Khối lượng nguyên tử trung bình cả Bo (B) là 10,812u. Số nguyên tử 11B 5
khi có 94 nguyên tử 10B 5 là bao nhiêu? Hướng dẫn giải A .x + A .x A .x + (100 - x ).A 1 1 2 2 1 1 1 2 M = 100 100 A .x + (100 - x ).11 1 1 1 10,812 x 18,8% 1 100
Suy ra phần trăm số lượng của 11B 5 là: 100% - 18,8% = 81,2%
Do đó, số nguyên tử 11B B 5
khi có 94 nguyên tử 105 là:
94.81,2/18,8 = 406 nguyên tử
2. Bài tập vận dụng
Câu 10. Trong tự nhiên Cu có 2 đồng vị là 63Cu và 65Cu. Nguyên tử trung bình của
Cu là 63,546. Số nguyên tử 63Cu có trong 31,773g Cu là bao nhiêu? Hướng dẫn giải
Giả sử % của 63Cu và 65Cu trong tự nhiên lần lượt là x, y. Ta có hệ phương trình:
63x 65y 63,5 x 0,75 x y 1 y 0, 25 16 nCuSO 0,100313mol 4 63,5 32 16.4
Số nguyên tử Cu = số phân tử CuSO4 = 0,100313 . 6,02 . 1023 = 6,03887 x 1022.
→ Số nguyên tử 65Cu có trong 16 gam CuSO4 là 0,25 . 6,03887 x 1022 = 1,50972 . 1022
Câu 11. Trong tự nhiên Clo có 2 đồng vị là 35Cl và 37Cl có nguyên tử khối trung bình
là 35,5. Tính số nguyên tử của đồng vị 37Cl, trong 3,65g HCl (cho khối lượng mol của H=1). Hướng dẫn giải
Ta có tỉ lệ nguyên tử 35Cl:37Cl = 1,5:0,5 = 3:1 nHCl = 0,1 => nCl = 0,1
Số mol 37Cl = 0,1.1/(1+3) = 0,025
=> Số nguyên tử 37Cl = 0,025.6,02.1023
Số nguyên tử 37Cl = 0,025.6,02.1023 = 1,505.1022
Câu 12. Hidro có nguyên tử khối trung bình là 1,008. Hỏi có bao nhiêu nguyên tử
của đồng vị 2H trong 9 gam nước (cho rằng trong nước chỉ có đồng vị 1H và 2H, cho MH2O= 18). Hướng dẫn giải
1ml có khối lượng là 1gam. Số mol H2O = 1/18 = 0,056 mol H2O -> 2H + O
Nên số mol H = 2.0056 = 0,112 mol. Số nguyên tử H là 0,122.6,023.1023 = 674576.1017
Gọi a, b tương ứng là tỉ lệ % của 1H và 2H Ta có: a + 2b = 1,008
a + b = 1 => b = 0,008 (0,8%) =>a = (99,2%)
Như vậy số nguyên tử 1H là 0,992.674576.1017 nguyên tử. Số nguyên tử 2H là
0,008.67456.1017 = 5396608.1014 nguyên tử
Câu 13. Hidro có nguyên tử khối trung bình là 1,008. Hỏi có bao nhiêu nguyên tử
của đồng vị 2H trong 1 ml nước (Cho khối lượng của nước 1g/ml). Hướng dẫn giải
Gọi % đồng vị là a: 1.(100 a) 2a 1,008 a 0,8 => a = 0,8; % là 0,8% 100 m của 1ml H2O: 1 gam MH2O = 16 + 2,016 = 18,016u
—> Khối lượng của 1 mol H2O là 18,016g.
Số nguyên tử H có trong 1ml H2O 1.6.1023.2 23
0,666.10 = 0,666.1023 nguyên tử = 666.1020 nguyên tử 1,8.0,16 Số nguyên tử chiếm: 20 666.10 .0,8 20
5,325.10 = 5,325.1020 nguyên tử. 100
Câu 14. Cho 2 đồng vị hiđro với tỉ lệ % số nguyên tử : 11H ; 21H . Hãy tính số nguyên
tử 11H trong 2,24 lít khí H2. Biết nguyên tử khối trung bình của hiđro là 1,001.
Câu 15. Nguyên tố Magiê có 3 đồng vị khác nhau ứng với số và thành phần %
tương ứng như sau: 24Mg ( 78,99%) , 25Mg ( 10%) và 26Mg ( 11.01%). a/ tính
nguyên tử khối trung bình Mg b/ Giả sử trong hỗn hợp trên có 25 nguyên tử 25Mg
thì số nguyên tử tương ứng của 2 đồng vị còn lại là bao nhiêu?
Đáp án hướng dẫn giải Ta có:
A = 78,99%.24 + 10%.25 + 11,01%.26 = 24,3202 Mà %Mg = 10% Theo bài ra: N25Mg=25 ⇒∑N= 25/10% =250
Vậy: Số nguyên tử: N24Mg = 250.78,99%≈197
Số nguyên tử N26Mg= 250.11,01% ≈ 27
Câu 16. Tổng số các hạt cơ bản (p, n, e) của một nguyên tử X là 28. Số hạt mang điện
nhiều hơn số hạt không mang điện là 8. Xác định ký hiệu và tên nguyên tử X. Hướng dẫn giải:
Tổng số các hạt cơ bản (p, n, e) của một nguyên tử X là 28
=> n + p + e = 28 => 2p + n = 28 (1)
Số hạt mang điện nhiều hơn số hạt không mang điện là 8
=> p + e – n = 8 => 2p – n = 8 (2)
Từ (1) và (2) => p = 9, n = 10 p = 9 => X là F => AF = p + n = 9 + 10 = 19
Ký hiệu nguyên tử của F là:
Câu 17. Một nguyên tử R có tổng số hạt mang điện và không mang điện là 34, trong
đó số hạt mang điện gấp 1,833 lần số hạt không mang điện. Xác định tên của R và
các định số khối của R Hướng dẫn giải:
Trong R, tổng số hạt mang điện và không mang điện là 34
=> p + n + e = 34 => 2p + n = 34 (1)
Mặt khác, số hạt mang điện gấp 1,833 lần số hạt không mang điện
=> p + e = 1,833n => 2p = 1,833n (2)
Từ (1) và (2) => p = 11, n =12 Z = 11 => R là Al AR = 11 + 12 = 23