












Preview text:
lOMoAR cPSD| 46342985
BÀI TẬP HÓA PHÂN TÍCH II
Tính hệ số hấp thụ riêng và hệ số hấp thụ mol của Y biết MW = 300
1. Trinh bày công thức của định luật Lambert – Beer, khái niệm hệ số hấp thụ
phân tử. Tính hệ số hấp thụ phân tử của chất A ở 420 nm, biết dung dịch chất A
(MW = 225) nồng độ 3,75 mg/ 100 ml có độ truyền qua T= 35,6% khi đo trong
cuvet có bề dày 1,00 cm ở 420 nm. Tóm tắt: Bài làm: Bs=420nm
Độ hấp thụ của chất A là: C = 3,75
A = -log(T ¿=−log (0,356) ¿0,449 hệ số hấp mg/100ml=3,75.10-3 %
thụ phân tử của chất A ở 420 nm là: T = 35,6 % A 0,449 L=1cm
A = ε . l C => ε=lC = 1.3,75.10− = 3 MW = 225 119,73 KL:
2. Một dung dịch phức của Fe3+ với o-phenanthrolin có hệ số hấp thụ phân tử ε = 9,32. 103 ở 510 nm:
a/. Tính độ hấp thụ của dung dịch phức có nồng độ 5.10-5 M ở 510 nm, cuvet 1 cm? b/.
Tính độ truyền qua T của dung dịch đã miêu tả trong (a)? Tóm tắt: ε Bài làm: = 9,32. 103
độ hấp thụ của dung dịch phức là: A = C=5.10-5 M
ε . l C= 9,32. 103 . 1. 5.10-5 =0,466 Độ L=1
truyền qua T của dung dịch là: Tính A, T
A = -log(T ¿ => T= 10-A . 100 =100,466 .100 =34,2%
3. Cân chính xác 0,1005 g chất Y tinh khiết hòa tan thành dung dịch tới vừa đủ
100,0 ml (dung dịch A). Lấy chính xác 5 ml dung dịch A pha thành 100,0 ml
(dung dịch B). Đo độ hấp thụ của dung dịch B trên máy quang phổ ở bước sóng
270 nm với cuvet 1 cm, thu được A = 0,420.
Tính hệ số hấp thụ riêng và hệ số hấp thụ mol của Y ở bước sóng trên? Biết chất Y có MW = 300. Tóm tắt: Bài làm: M= 0,1005g
Nồng độ dung dịch ban đầu là: V= 100 ml lOMoAR cPSD| 46342985 P: 5ml →100ml A= 0,420 m MW=300 C% = v = 100 = 0,1005%
Nồng độ của dung dịch chất Y đem đi đo quag là: C% 5
Cs = K = 0,1005.100 = 5,025.10-3 %
Hệ số hấp thụ riêng của chất Y ở bước sóng 270 nm là: A = A(1%,1cm) . l.C% A 0,42
A(1%,1cm) = l⋅C = 1.5,025.10−3=83,58
hệ số hấp thụ mol của Y ở bước sóng 270nm là: M. A
M.A(1%,1cm)=10ε => ε=
(1%,1cm) = 300.83,5810 = 10 2570,46
14. Cân chính xác 0,0200 g chất X tinh khiết hòa tan trong dung môi tới vừa đủ 100,0
ml (dung dịch A). Lấy chính xác 10 ml dung dịch A thêm dung môi tới vừa đủ
100,0 ml (dung dịch B). Đo độ hấp thụ của dung dịch B trên máy quang phổ ở
bước sóng cực đại là 280 nm và 365 nm, cuvet có bề dày 1 cm, thu được độ hấp
thụ lần lượt là 0,220 và 0,660.
a. Tính hệ số hấp thụ riêng E (1%, 1 cm) của chất X ở 280 nm và 365 nm ?
b. Nếu ứng dụng phương pháp quang phổ UV-VIS để định lượng chất X thì nên
chọn bước sóng nào ? Tại sao ? lOMoAR cPSD| 46342985 Tóm tắt: Bài làm: mx = 0,02g v = 100ml Nồng
độ ban đầu của dung dịch p: 10ml → 100ml bs : chất X là: 280 A=0,22 bs: 365 A m = 0,66 a, A(1%,1cm) b C% = v = 100 = 0,02% chọn bước sóng nào?
Nồng độ của dung dịch chất X đem đi đo quag là: C% 10
Cs = K = 0,02.100 = 0,002 %
Hệ số hấp thụ riêng của chất X ở bước sóng 280 nm là: A = A(1%,1cm) . l.C% A(1%,1cm) = l =
Hệ số hấp thụ riêng của chất X ở bước sóng 300 nm là: A = A(1%,1cm) . l.C% A(1%,1cm) = l = B,
Nếu ứng dụng phương pháp quang phổ UV-VIS để định
lượng chất X thì nên chọn bước sóng 300 vì độ hấp thụ
riêng ở bs 300nm lớn hơn (330>110) Có độ nhạy cao hơn.
15. a/. Một dung dịch của một chất thuốc có nồng độ 6,4.10-5 M, đo độ hấp thụ của
dung dịch này ở bước sóng 255 nm, dùng cuvet 1 cm thu được độ hấp thụ A = 0,847.
Tính hệ số hấp thụ phân tử e của chất ở 255 nm ?
b/ Cân chính xác 10,0 mg của thuốc nói trên (có phân tử lượng MW = 354,0), hoà
tan trong nước vừa đủ 1 lít. Đo độ hấp thụ ở bước sóng 255 nm với cuvet 1 cm được A
= 0,556. Hãy tính hàm lượng % của chất phân tích trong mẫu thuốc. lOMoAR cPSD| 46342985 Tóm tắt:
Bài làm : hệ số hấp thụ phân tử e C = 6,4. 10-5 M của chất ở 255 nm là: Bs= 255nm A=ε.lC M L= 1 cm A 0,847 A= 0,847 => ε=l.CM= 1.6,4.10−5= A(1%,1cm)
13234,375 Nồng dộ dung dịch đem đi đo B, m= 10mg MW= 354 quang là: V=1000ml 10. A= 0,556
ε=M . A(1%,1cm) 10.ε 10.13234,375 A(1%,1cm)= M = 354 =373,85 A 0,556 C%= A
(1%,1cm) .l= =1,487.10- 3
Khối lượng chất thuốc có trong mẫu là: m
C%=V ⋅100 => m=C%.V: 100 =
1,487.10-3.1000:100 = 0.01487(g)=14,87 (mg)
hàm lượng % của chất phân tích trong mẫu thuốc m 14,87 %m = mm .100 = 10 .100=¿148,722%
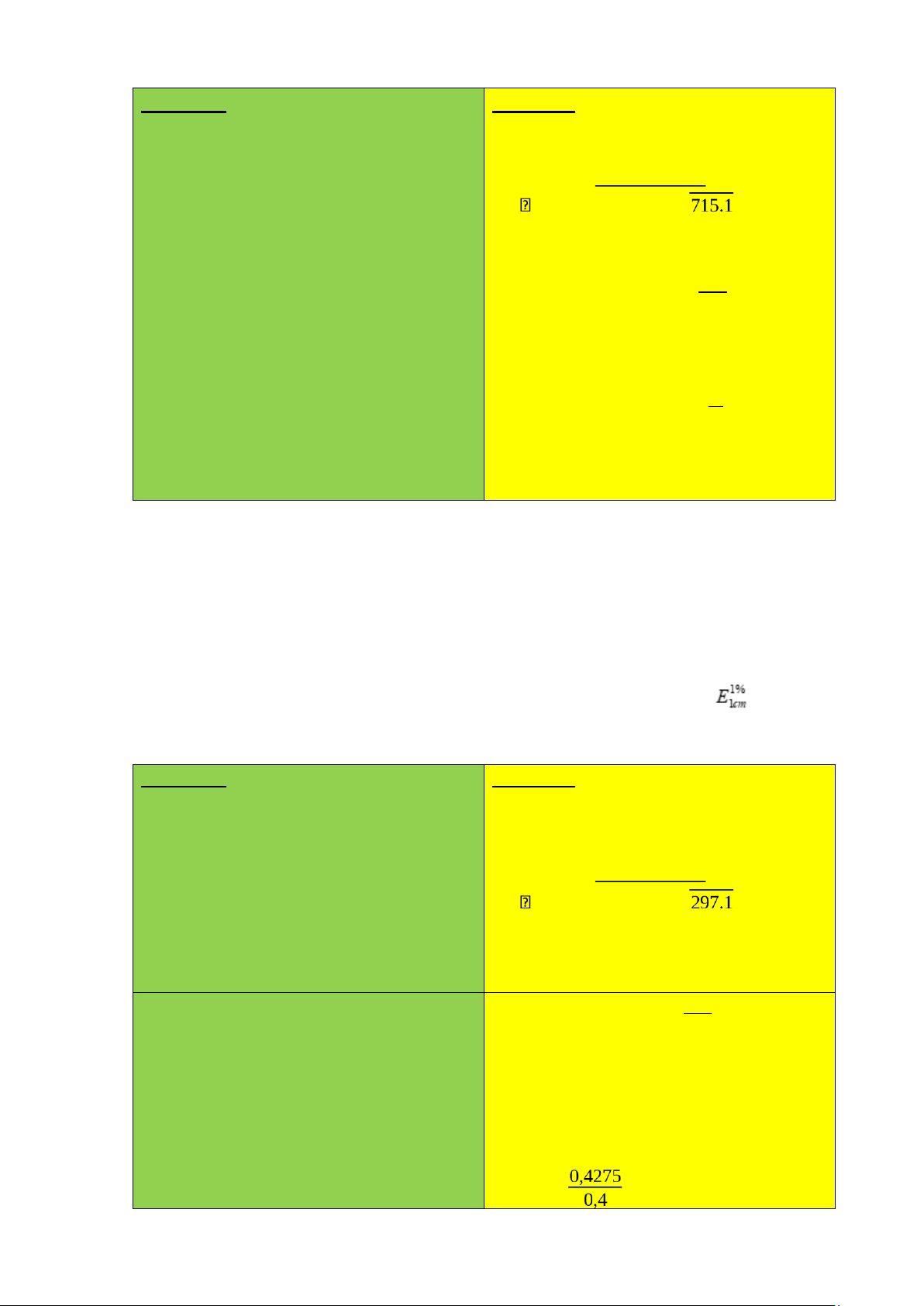
16. Paracetamol có hệ số hấp thụ riêng E (1%, 1 cm) = 715 ở 257 nm. Nếu một viên
nén paracetamol được hoà tan trong dung môi pha mẫu và hoà loãng tới đủ 200
ml, sau đó pha loãng 1,00 ml dung dịch này tới vừa đủ 100,0 ml với cùng dung
môi trên thì độ hấp thụ của dung dịch thu được đo ở 257 nm, cuvet 1 cm là 0,565.
a/ Hãy tính hàm lượng (mg/ viên) của paracetamol trong viên?
b/. Trình bày điều kiện áp dụng áp dụng định luật Lambert – Beer trong định lượng
bằng quang phổ hấp thụ UV – VIS. lOMoAR cPSD| 46342985 Tóm tắt: Bài làm: E(1%,1cm) = 715
Nồng độ dung dịch đem đi đo quang là : V= 200ml A=A(1%,1cm).l.Cs P: 1 ml → 100ml A 0,565 L=1cm
Cs= A (1%,1cm) .l= = A= 0,565 7,902.10-4 a. Hàm lượng paracetamol
Nồng độ dung dịch ban đầu là:
b. Điều kiện áp dụng định luật 100
Cs = C%. K= 7,902.10-4 . 1 =0,07902 %
hàm lượng (mg/ viên) của
paracetamol trong viên là: m
C%=V ⋅100 => m=C%.V: 100 =
0.079.200:100 = 0,15804 (g)= 158 (mg/viên)
17. Để định lượng thuốc nhỏ mắt cloramphenicol 0,4% bằng phương pháp quang
phổ,người ta tiến hành như sau: Hòa loãng 2,00 ml dung dịch chế phẩm với nước
tới vừa đủ 500,0 ml. Độ hấp thụ của dung dịch này ở bước sóng cực đại 278 nm,
cuvet đo dày 1 cm, mẫu trắng là nước cất là A = 0,508.
a/. Tính hàm lượng phần trăm của cloramphenicol trong chế phẩm so với hàm lượng
ghi trên nhãn? Biết hệ số hấp thụ riêng của cloramphenicol ở 278 nm là = 297.
b/. Trình bày công thức cơ bản của định luật Lambert – Beer trong quang phổ hấp thụ. Tóm tắt: Bài làm: P: 2ml → 500ml
Nồng độ dung dịch cloramphenicol đem L = 1cm đi đo quang là: A = 0,508 A=A(1%,1cm).l.Cs A(1%,1cm)=297 A 0,508
a, hàm lượng cloramphenicol
Cs= A (1%,1cm) .l= =1,71.10-3 %
Nồng độ ban đầu của dung dịch cloramphenicol là: 500
Cs = C%. K=1,71.10-3 . 2 =0,4275 %
hàm lượng phần trăm của
cloramphenicol trong chế phẩm so với hàm lượng ghi trên nhãn là lOMoAR cPSD| 46342985 H(5%)= = 1,06875% KL:
18. Để định lượng dung dịch tiêm pyridoxin hydroclorid 5% bằng phương pháp quang
phổ, người ta tiến hành như sau: Lấy chính xác 2,00 ml dung dịch chế phẩm pha
loãng tới vừa đủ 200,0 ml bằng dung dịch HCl 0,1 N, sau đó pha loãng 2,00 ml
dung dịch này với dung dịch HCl 0,1 N vừa đủ 100 ml. Lắc đều. Độ hấp thụ của
dung dịch này ở bước sóng cực đại 291 nm, mẫu trắng là dung dịch HCl 0,1 N là 0,432.
a/. Tính hàm lượng của Pyridoxin hydroclorid, C8H11NO3. HCl , trong chế phẩm so với
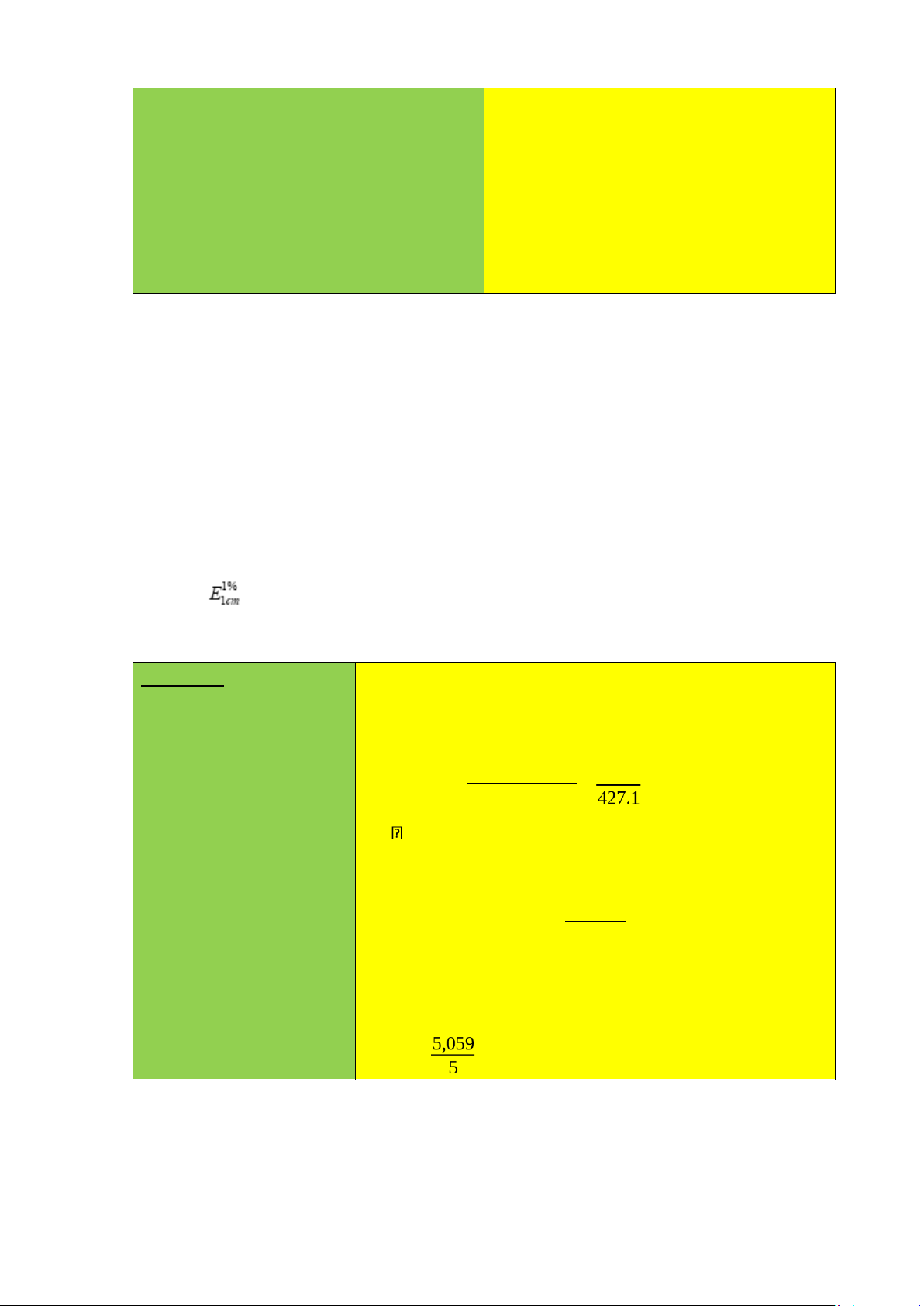
hàm lượng ghi trên nhãn? Biết hệ số hấp thụ riêng của trong dung dịch HCl 0,1 N ở 291nm là = 427.
b/. Trình bày công thức cơ bản của định luật Lambert – Beer trong quang phổ hấp thụ. Tóm tắt : Bài làm: P: 2ml → 200ml
Nồng độ dung dịch pyridoxin hydroclorid đem đi đo P: 2ml →100ml quang là: A = 0,432 A=A(1%,1cm).l.Cs A(1%,1cm) = 427 A 0,432 -3 Tính hàm lượmg (%)
Cs= A (1%,1cm) .l= =1,012.10
Nồng độ ban đầu của dung dịch Pyridoxin hydroclorid là: 200.100 . Cs = C%. K=1,012.10-3 2.2 = 5,059 (%)
hàm lượng của Pyridoxin hydroclorid, C8H11NO3. HCl ,
trong chế phẩm so với hàm lượng ghi trên nhãn là: H(5%)= = 1,012%
19. Tiến hành định lượng riboflavin trong nguyên liệu (có độ ẩm 6,95%) như sau: Hòa
tan 0,1025 g chế phẩm trong dung môi pha mẫu tới vừa đủ 1000,0 ml. Lấy 10,0 ml
dung dịch này pha loãng với cùng dung môi trên thành 50,0 ml. Độ hấp thụ của lOMoAR cPSD| 46342985
dung dịch thu được đo trong cuvet có bề dày 1 cm ở bước sóng cực đại 444 nm là 0,458.
a/. Tính hàm lượng phần trăm (kl/kl) của riboflavin - C17H20N4O6 - theo chế phẩm khô.
Biết E (1%, 1 cm) của riboflavin ở 444 nm là 328.
b/. Trình bày điều kiện áp dụng áp dụng định luật Lambert – Beer trong định lượng
bằng quang phổ hấp thụ UV – VIS. Tóm tắt: Bài làm: M= 0,1025g
Nồng độ dung dịch pyridoxin hydroclorid đem đi đo V = 1000ml quang là: P: 10 ml → 50 ml A=A(1%,1cm).l.Cs A= 0,458 A = A(1%,1cm) = 328 0,458=1,396.10-3 (%) Tính hàm lượng
Cs= A (1%,1cm) .l
Nồng độ ban đầu của dung dịch Pyridoxin hydroclorid là: 50
Cs = C%. K=1,396.10-3 .10 = 6,982.10-3 (%)
Khối lượng chất B có trong mẫu thử là: m
C%=V ⋅100 => m=C%.V: 100 = 6,982.10-3.1000: 10 = 0,07 (g)
hàm lượng phần trăm (kl/kl) của riboflavin - C17H20N4O6 - theo chế phẩm khô là: m %m = r .100 = 0,07 0,1025 .100=68,12% m KL:
20. Tiến hành định lượng diclofenac natri trong viên như sau: -
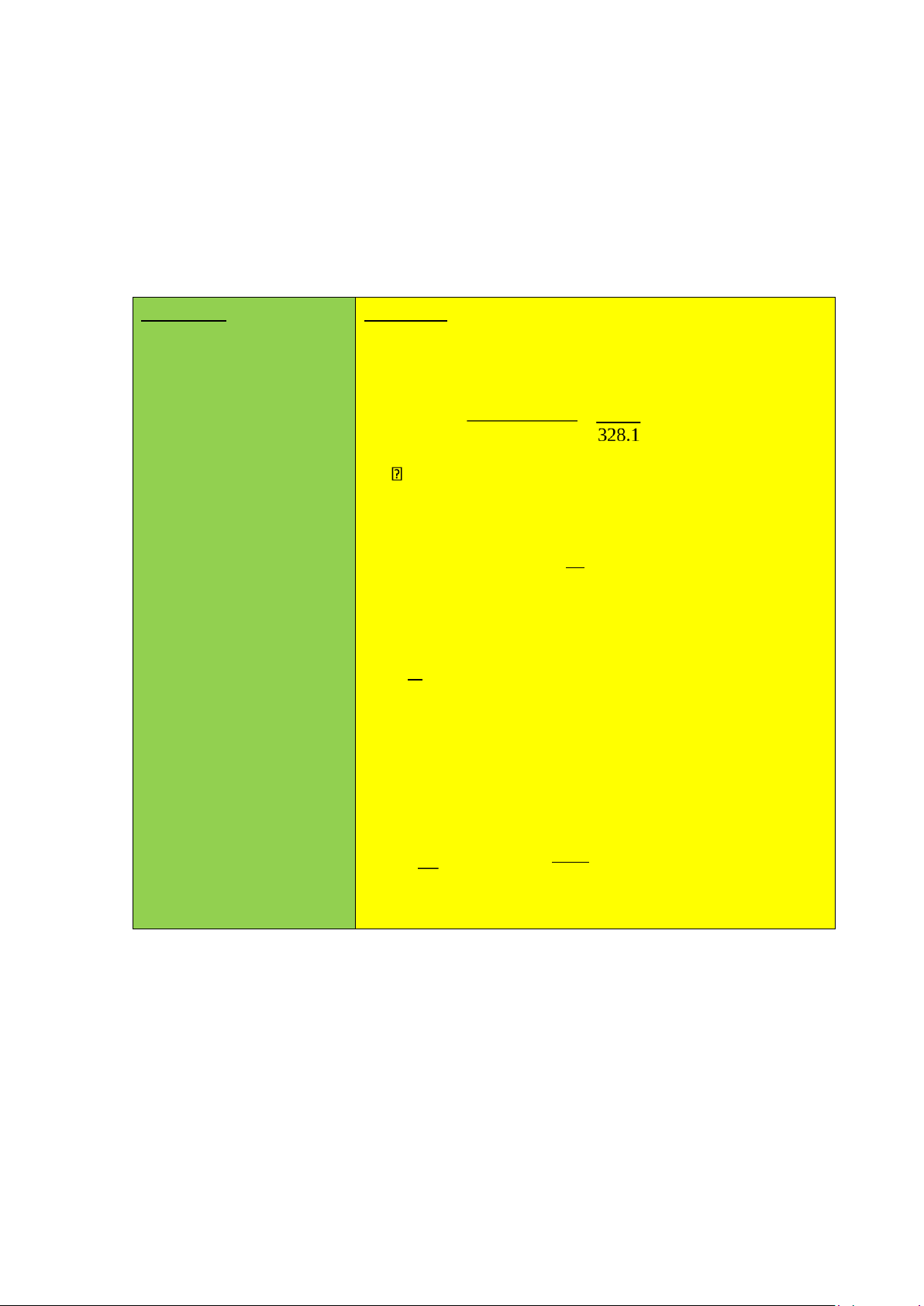
Dung dịch chuẩn: Cân 0,0502 g diclofenac natri chuẩn (hàm lượng 99,5% tính
theo nguyên trạng) vào bình định mức 100 ml, hòa tan vừa đủ thể tích bằng nước. Lấy
chính xác 2 ml dung dịch này vào bình định mức 100 ml, thêm ethanol 96% vừa đủ đến vạch, lắc đều. -
Dung dịch thử: hoà tan một lượng bột viên tương ứng với khối lượng của 1 viên
nén diclofenac natri trong nước và hoà loãng tới đủ 100,0 ml, sau đó pha loãng 2,00
ml dung dịch này tới vừa đủ 100,0 ml với ethanol 96%. Lọc. lOMoAR cPSD| 46342985
Độ hấp thụ của dung dịch thử và dung dịch chuẩn đo ở bước sóng 282 nm trong cốc
đo dày 1 cm, dùng ethanol 96% làm mẫu trắng lần lượt là 0,535 và 0,509. a/. Tính
hàm lượng (mg/viên) của diclofenac natri trong chế phẩm.
b/. Trình bày điều kiện áp dụng áp dụng định luật Lambert – Beer trong định lượng
bằng quang phổ hấp thụ UV – VIS. Tóm tắt: Bài làm: Chuẩn : Nồg độ ban đầu
m = 0,0502g → 0,0502. của dung dịch 99,5%=0,049949 chuẩn là: V= 100ml m P: 2ml→100ml C% = v = 100 = 0,049949% A= 0,509 Thử:
Nồng độ dung dịch mẫu thử ban đầu là: V= 100ml P: 2ml C →100ml T AT AT C A= 0,535
s As T=Cs⋅ As = ⇒C L=1cm ¿ = 0,0525% Hàm lượng
Hàm lượng (mg/viên) của diclofenac natri trong chế phẩm là HL(%)=0,0525: 0,04994=1,05(Mmg viên) KL:
21. Độ hấp thụ của một dung dịch có chứa hai chất A và B đo ở bước sóng 279 nm và
300 nm đều có giá trị là 0,510.
Tính nồng độ phần trăm của từng chất trong dung dịch?
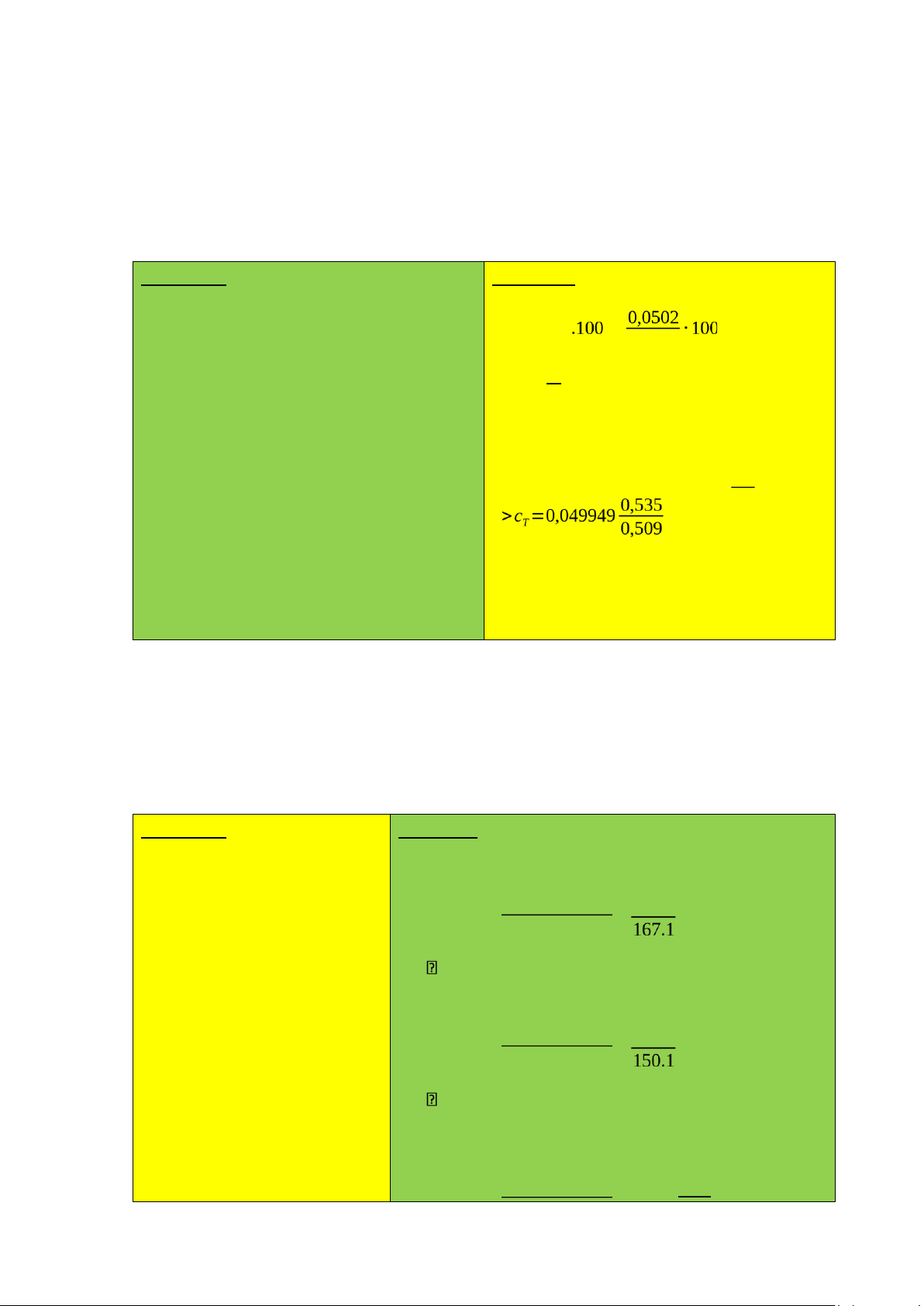
Biết hệ số hấp thụ riêng của A và B ở bước sóng 279 nm lần lượt là 955 và 150 ; ở 300
nm lần lượt là 167 và 736. Tóm tắt: Bài tập: Bs=279nm ở bước sóng 279nm A=0,510 A: A=A(1%,1cm).l.Cs A(1%,1cm)=955 (A) A(1%,1cm)=150 (B) A = Bs= 300 0,510=5,3403.10-4(%) A= 0,51
Cs= A (1% ,1cm) .l A(1%,1cm)=167 (A) B: A=A(1%,1cm).l.Cs A(1%,1cm)=736 (B) A = 0,510=3,4.10-3 (%)
Cs= A (1% ,1cm) .l Ở bước song 300nm A: A=A(1%,1cm).l.Cs A 0,51 lOMoAR cPSD| 46342985
Cs= A (1% ,1cm) .l= 167.1=3,0539.10-3 (%) B: A=A(1%,1cm).l.Cs A 0,51
Cs= A (1% ,1cm) .l= 736.1=6,9293.10-4 (%) KL: Bài tập thêm:
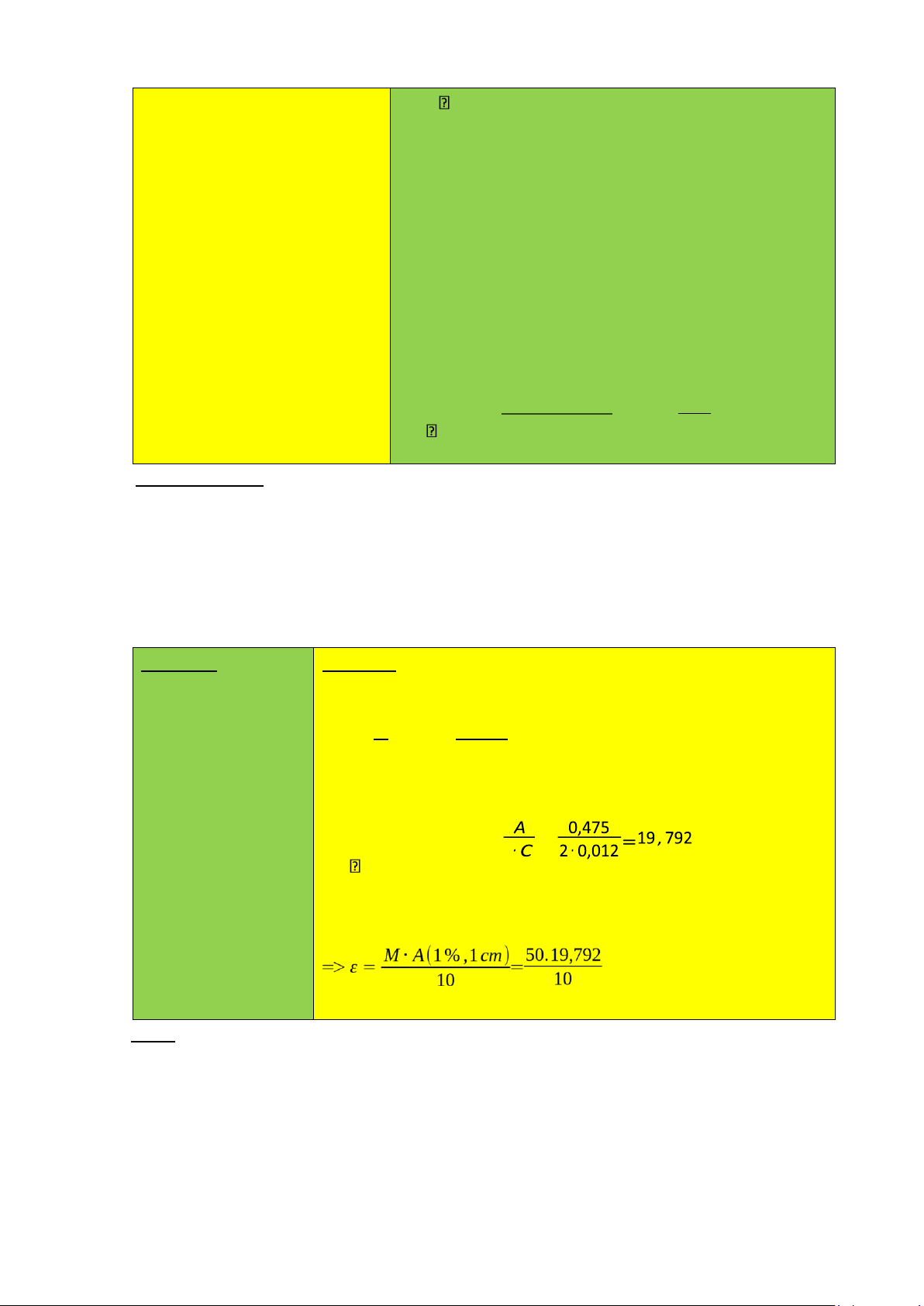
Bài 1: một dung dịch A có nồng độ 120 µg/ml, được đo mật độ quang trong cốc 2 cm, cho kết quả là 0,475
a. Xác định độ hấp thụ riêng của chất A tại điều kiện đo.
b. Xác định độ hấp thụ mol biết MW của A là 50 g/mol. Tóm tắt: Bài tập : C = 120 µg/ml
a. Nồng độ % của dung dịch A là L = 2cm A = 0,475
C% = mv .100 = 120.101 −6⋅100= 0,012% MW = 50 g/mol
Độ hấp thụ riêng của chất A tại điều kiện đo là: A = A(1%,1cm) . l.C% = A(1%,1cm) = l
b. Nồng độ mol của chất A là: M. A(1%,1cm) = 10 ε = 98,9585 KL:...
Bài 2: hòa tan 150mg chất A trong vừa đủ 200 ml dung môi. Pha loãng 10 ml dung
dịch vừa pha thành vừa đủ 100ml. Tiếp tục pha loãng 5 ml dung dịch này thành vừa đủ
50 ml .dung dịch thu được có độ hấp thụ là 0,536 ở bước sóng 257nm, trong cốc đo 1 cm.
a. Xác định độ hấp thụ riêng của chất A ở 257nm lOMoAR cPSD| 46342985
b. Nếu mẫu được đo ở 300nm thì cho A=0,421. Vậy nên chọn bước sóng nào để
phân tích chất A? Tại sao? Tóm tắt: m = 150 Bài làm: mg = 0,15 g V = a. Nồng độ ban đầu của chất 200ml A là: m P: 10ml → 100ml C% = = V .100 200 .100=0,075% P: 5ml → 50 ml A = 0,536
Nồng độ của chất A đem đi đo quang là: Bs = 257 nm C% 10 5 L = 1 cm
Cs = K = 0,075 .100 . 50 = 7,5.10-4 % a. A(1%,1cm) = ?
Độ hấp thụ riêng của chất A ở bước b. Bs = 300 nm
sóng 257nm là: A = A(1%,1cm). l.C A = 0,421 A(1%,1cm) = l.C =
Chọn bs nào để phân tích chất A?
1.70,536,5.10−4 A =714,67
b. Độ hấp thụ riêng của chất A ở bước sóng 300nm là: A = A(1%,1cm) . l .C A 0,421 A(1%,1cm) = l.C = 1.7,5.10 =516,33 A −4 257 > A300 => đo ở bs 257nm
Vì ở bs=257nm có độ nhạy cao hơn
Bài 3: 0,5 gam mẫu chứa chất B được hòa tan trong vừa đủ 200ml. Lấy 2 ml dung dịch
vừa pha vào bình định mức 50ml và thêm dung môi đến vừa đủ. Tiếp tục pha loãng
10ml dung dịch này thành 100ml. Độ hấp thụ của dung dịch đo trong cốc 1 cm là
0,450. Biết A(1%,1cm) là 510. Tính phần trăm khối lượng của B trong mẫu ban đầu. lOMoAR cPSD| 46342985 Tóm tắt: m Bài làm: =0,5 gam V= 200ml m P: 2ml → 50ml C%=V 200 = 0,25 % P: 10ml → 100ml
Nồng độ của dung dịch chất B đem đi đo L = 1 cm quang là: A = 0,45 A=A(1%,1cm).l.Cs A(1%,1cm)=510 A 0,45 %mB =?
Cs= A (1%,1cm) .l= 510.1= 8,8235.10-4 Nồng độ ban đầu của dung dịch chất B là Cs = C%.K = 0,2206%
Khối lượng chất B có trong mẫu thử là: m
C%=V ⋅100 => m=C%.V: 100 = 0,2206.200:100 = 0,4412 (g)
Phần trăm khối lượng của B trong mẫu ban đầu là: m 0,4412
%mB = mBm .100 = 0,5 .100=¿88,24% KL:... Bài 4:
• Dung dịch thử: lấy 0,05g mẫu thử chứa chất B hòa tan trong vd 100ml. Pha
loãng 50 lần để được dung dịch đem đo quang.
• Dụng dịch chuẩn: dung dịch chất B có nồng độ 8 µg/ml. Độ hấp thụ của dung
dịch chuẩn và dung dịch thử lần lượt là 0,480 và 0,525. Hãy tính % khối lượng của B trong mẫu thử. lOMoAR cPSD| 46342985 Bài 5:
• Pha loãng 1,0ml dung dịch chứa chất B thành vừa đủ 25ml. Tiếp tục pha loãng
5ml dung dịch này thành 50 ml. Đo quang được A =0,375
• Cân 0,0255 g chất B hòa tan trong 250ml. Lấy 10ml pha loãng thành 25ml
được dung dịch chuẩn có độ hấp thụ A=0,455.
• Xác dịnh nồng độ % của mẫu thử ban đầu? Tóm tắt: Bài làm: Mẫu thử:
Nồng độ ban đầu của dung dịch chuẩn là lOMoAR cPSD| 46342985 P: 1,0 ml → 25ml m 0,0255 P: 5ml →50ml
C%= .100= .100=0,0102% v 250 A= 0,375
Nồng độ dung dịch chuẩn đem đi đo Dung dịch chuẩn: quang là: M= 0,0255g Cs % V= 250ml P: 10 ml
Nồng độ dung dịch thử đem đi đo quang → 25 ml là : A= 0,455 %C =? CT AT AT
= ⇒CT=Cs⋅ As Cs AS CT %
Nồng độ dung dịch thử ban đầu là: cbd KL:...
Bài 6 viên nang Alverin được xác định hàm lượng bằng phương pháp HPLC.
• Dung dịch thử: cân một lượng bột viên tương ứng với khối lượng bột trong 5
viên alverin citrat vào bình định mức 250ml, thêm 100ml methanol, lắc siêu âm
1 giờ và thêm methanol đến định mức. Lắc kỹ pha loãng 10 phút và lọc (giấy
lọc Cellulose nitrat 0,45µm là thích hợp). Pha loãng 10,0 ml dịch lọc thu được thành 20,0 ml với nước.
• Dung dịch chuẩn: Pha dung dịch alverin citrat chuẩn 0,12 % trong methanol.
Pha loãng 10ml dung dịch này thành 20 ml với nước.
• Dung dịch thử và dung dịch chuẩn sau khi lọc được tiến hành sắc kí. Trên sắc
ký đồ thu được, diện tích pic thử và pic chuẩn lần lượt là 760352 và 752115
mAU.s. hãy tính hàm lượng của viên Alverin đã kiểm tra (mg/viên). Tóm tắt: Bài làm: Dung dịch thử:
Nồng độ dung dịch chuẩn đem đi V=250ml đo quang là: c P: 10ml→ 20ml
Cs= bd=0,12 10=0,06 % k A = 760352 mAU.s 20 Dung dịch chuẩn
Nồng độ dung dịch thử đem đi đo quang C= 0,12% là: P: 10ml → 20ml CT AT AT A= 572115
= ⇒CT=Cs⋅ As Cs A S Hàm hượng Alverin CT = 0,06. =0,0607% lOMoAR cPSD| 46342985
Nồng độ dung dịch thử ban đầu là: cbd = 0,1214%
Hàm lượng của Alverin có trong mẫu thử là: m c .V cbd=V ⋅100⇒m= 100bd m= = 0,3035 (g)
hàm lượng của viên Alverin đã kiểm tra là:
0,3035: 5= 0,0607 (g)= 60,7 (mg/viên) lOMoAR cPSD| 46342985 Phần sắc ký
30. Định lượng dexamethason phosphat (C22H30FO8P = 472,4) trong dung dịch thuốc
tiêm dexamethason phosphat 4 mg/ ml bằng HPLC. -
Dung dịch thử: Pha loãng 2,00 ml dung dịch chế phẩm bằng pha động vừa đủ 100,0 ml. -
Dung dịch chuẩn: Hòa tan và pha loãng 22,1 mg dexamethason natri phosphat
(C22H28FNa2O8P = 516,4) chuẩn (hàm lượng 100% tính theo nguyên trạng) trong pha động vừa đủ 250,0 ml.
Sắc ký dung dịch thử và dung dịch chuẩn, diện tích pic thu được trên sắc ký đồ ứng
với chất phân tích của các dung dịch này thu được lần lượt là 567325 (mAU.s) và 557930 (mAU.s).
Tính hàm lượng % của dexamethason phosphat so với lượng ghi trên nhãn. Tóm tắt: Bài làm: MW= 472,4
Nồng độ dung dịch chuẩn đem đi HPLC C= 4mg/ml là: Thử: m 22,1 P: 2ml 100ml At=
C%= .100= .100=8,84% (mg/ml) v 567325 mAU.s 250 Chuẩn:
Nồng độ dung dịch thử đem đi HPLC là: M= 22,1 mg CT AT AT MW= 516,4 = ⇒C V = 250 ml Cs AS
T=Cs⋅ As As = 557930 mAu.s Hàm lượng so với mẫu CT = 8,84. =8,99 % (mg/ml) Nồng độ dung dich thử ban đầu là: C%= Ct.K= 8,99.= 449,45% = 4,4945 (mg/ml)
hàm lượng % của dexamethason phosphat so với lượng ghi trên nhãn là: HL(%) = .100 =112,36125%
31. Tách 4 chất bằng HPLC với cột C8, pha động methanol – nước (60 : 40): lOMoAR cPSD| 46342985 A B C D
Giải thích vai trò và bản chất của pha tĩnh, vai trò của pha động và thứ tự rửa giải các
chất trong khi phân tích hỗn hợp các chất này. Trả lời:
• C8 pha tĩnh: không phân cực
• Pha động methanol – nước (60 : 40) : phân cực
• Pha tĩnh kém phân cực hơn pha động sắc ký pha đảo
• Trong sắc ký pha đảo, pha động phân cực hơn pha tĩnh nên chất nào phân cực
mạnh nhất sẽ phân bố tốt nhất trong pha động và sẽ được rửa giải trước nhất.
• Thức tự rửa giải sẽ ngược lại thứ tự phân cực
• Thứ tự phân cưc : hc thơm< dẫn chất thơm< dẫn chất nitro< cacid carboxylic
C < B • Chất A phân cực mạnh nhất rửa giải trước nhất
• Chất C phân cực kém nhất rửa giải cuối cùng
• Thứ tự rủa giải là: A D B C 32.
Xác định tạp chất liên quan của ceftriaxon natri bằng HPLC theo phương pháp
chuẩn hóa diện tích. Kết quả trên sắc ký đồ của dung dịch mẫu thử như sau: Tên chất Thời gian lưu Diện tích pic (phút) (mAU x phút) Tạp chất 1 1,9 21598 Ceftriaxon natri 7,0 8734387 lOMoAR cPSD| 46342985 Tạp chất 2 10,9 10504 Tạp chất 3 13,4 29401 Tạp chất 4 15,1 36213
a/. Chế phẩm có đạt chất lượng không? Biết rằng giới hạn cho phép của từng tạp là
không được quá 0,5% và tổng tạp không được quá 1,0%.
b/. Trình bày điều kiện áp dụng phương pháp chuẩn hóa diện tích trong định lượng bằng sắc ký. 33.
Dữ kiện sau thu được khi phân tích bằng sắc ký lỏng hiệu năng cao trên cột dài 25 cm. Tên chất
Thời gian lưu (phút)
Độ rộng pic ở nửa chiều cao pic W1/2 (phút) Chất không lưu giữ 1,01 - A 5,06 0,25 B 6,13 0,31 C 7,04 0,36
a/. Tính số đĩa lý thuyết trung bình của cột, chiều cao trung bình của đĩa lý thuyết và
độ phân giải giữa hai pic liền kề của các chất A, B và C. b/. Trình bày ý nghĩa của
các thông số trên trong sắc ký. lOMoAR cPSD| 46342985 Bài làm:
Số đĩa lý thuyết của chất A là: t
NA = 5,54. ( RA1/2¿2 = 5,54.(50,,0625)2 = 2269,50 w t N , 13
B = 5,54. ( RB/ ¿2 = 5,54.(60 , 31)2 = 2166,24 w1 2 t NC = 5,54. (
RB1/2¿2 = 5,54.(70,,0436)2 = 2118, 61 w
Tính số đĩa lý thuyết trung bình của cột là: N NTB =
A+NB+NC = 2269,5+2166,243+2118,61 =2184,78 3
chiều cao trung bình của đĩa lý thuyết là: L 25 = HTB NTB =
= 0,0114 độ phân giải giữa hai pic liền kề của các chất A, B là:
tRB−tRÂ 6,13−5,06 RS = 1 A
B = 12 .1,7.(0,25+0,31) = 2,2479 .(W +W )
2 độ phân giải giữa hai pic liền kề của các chất B, C là
tRC−tRB 7,04−6,13
RS = 1 .(WC+WB) = 1 .1,7.(0,36+0,31) = 1,5979 2 2 34.
Thời gian lưu tương đối của Aldrin , Carbophenothion, cis-Permethrin và
Cypermethrin là : 0,68; 1,00; 1,29 và 1,40.
a/. Tính thời gian lưu của các chất? Biết thời gian lưu của Carbophenothion là 10,0 phút.
b/. Tính hệ số dung lượng k’ của mỗi chất? Biết thời gian lưu của chất không bị lưu giữ là 1,25 phút. lOMoAR cPSD| 46342985 Bài làm:
Thời gian lưu của chất Aldrin là: t = . = 0,68 .10 = 6,8 phút RA tRRA tRB
Thời gian lưu của chất Carbophenothion là: t = . = 1 .10 = 10 phút RB tRRB tRB
Thời gian lưu của chất cis- Permethrin là: t =
. = 1,29 .10 = 12,9 phút Thời RC tRRC tRB
gian lưu của chất Cypermethrin là: t = . = 1,4 .10 = 14 phút RD tRRD tRB
c. Tính hệ số dung lượng k’ của mỗi chất là t t
K’A = RA−MtM = 6,81−,251,25 = 4,44 t
K’B = RB−tM = 101−,251,25 = 7 tM t K’C =
RC−MtM = 1,291,−251,25 = 9,32 t t t
K’D = RD−MtM = 141−,251,25 = 10,2 35.
a/ Trình bày khái niệm, cách tính, ý nghĩa của thông số số đĩa lý thuyết N và
chiều cao đĩa lý thuyết H trong sắc ký. Làm thế nào để tăng N và H của cột sắc ký?
b/. Hãy tính N của cột sắc kí khi phân tích chất A. Biết thời gian lưu của pic chất A là
6,25 phút; độ rộng đáy pic là 0,57 phút. Bài làm:
Số đĩa lý thuyết của cột sắc kí khi phân tích chất A là N = 16. t 6,25 ( R )2 = 16. ( )2 = 1923,67 W 0,57 36.
Dữ kiện sau thu được khi phân tích bằng sắc ký lỏng hiệu năng cao trên cột dài 15 cm. Tên chất
Thời gian lưu (phút)
Độ rộng pic W (phút) Chất không lưu giữ 1,01 - lOMoAR cPSD| 46342985 A 5,06 0,35 B 6,13 0,41 C 7,04 0,46
a/. Tính số đĩa lý thuyết trung bình của cột, chiều cao trung bình của đĩa lý thuyết và
độ phân giải giữa hai pic liền kề của các chất A, B và C. b/. Trình bày ý nghĩa của
các thông số trên trong sắc ký. Bài làm:
Số đĩa lý thuyết của chất A là: t N , 06
A = 16. ( RA ¿2 = 16.(50 , 35)2 = 3344,14 W t N , 13
B = 16. ( RB ¿2 = 16.(60 , 41)2 = 5376,62 W t N , 04
C = 16. ( RC ¿2 = 16.(70 , 46)2 = 3747,57 W
Tính số đĩa lý thuyết trung bình của cột là: N NTB =
A+NB+NC+ND = 3344,14+5376,623 +3747,57 = 3555,77 3
chiều cao trung bình của đĩa lý thuyết là: L 15 = HTB NTB = = 4,2 . 10-3
độ phân giải giữa hai pic liền kề của các chất A, B là: tRB−tRAA RS = 1 A
B = 12 ..(0,35+0,41) = 2,816 .(W +W )
2 độ phân giải giữa hai pic liền kề của các chất B, C là tRC−tRB 7,04−6,13
RS = 1 .(WC+WB) = 12 .(0,46+0,41) = 2,092



